一种诱导长茄游离小孢子愈伤组织的形成及植株再生方法与流程
本发明属于细胞工程领域的植物培养方法,具体涉及一种诱导长茄游离小孢子愈伤组织的形成及植株再生方法。
背景技术:
茄子属于茄科茄属,常异花作物,是世界各地广泛栽培的重要蔬菜之一。传统的育种需要先纯化亲本,而一个茄子育种材料的纯合需要自交5-6代,一个新品种的培育需7-8年时间,此育种方法既浪费时间,又浪费工力。目前,茄子遗传育种的研究热点是利用植物细胞的全能性快速获得纯合体,稳定植株性状,创制出新的育种材料,充分利用杂种优势。小孢子培养是快速获得纯合体最有效的方法之一。小孢子培养是在单细胞水平上利用小孢子培养诱导的单倍体经染色体加倍后获得高度纯合的纯合双单倍体的培养方法。近年来,一些研究者关于茄子游离小孢子和花粉培养做了大量工作,致力于优化(脱分化和再分化)小孢子成胚和胚状体成苗体系,但目前尚有许多基因型小孢子脱分化较难,二倍体栽培种小孢子愈伤组织再分化成苗率较低,限制了这一技术在实际育种工作中的应用范围。
技术实现要素:
本发明的目的在于提供一种诱导长茄游离小孢子愈伤组织的形成及植株再生方法,旨在提高长茄小孢子的愈伤组织的诱导能力、成活率、芽分化率以及植株生根率。
为实现上述目的,本发明采用如下技术方案:
本发明提供的高效诱导长茄游离小孢子愈伤组织的形成及植株再生方法,主要步骤如下:取合适的花蕾用吐温和次氯酸钠混合液振荡消毒15min,无菌水冲洗后用挤压的方法分离出小孢子,过滤离心收集小孢子,稀释到1.0×105 个/ml,35-36℃下进行热激处理3-5d,然后添加液体培养基2进行黑暗静止培养,培养4-7d时添加液体培养基3,15-20d后陆续出现肉眼可见的愈伤组织,当愈伤组织块径长到2cm左右时转移到分化培养基上,同时加入1-2ml液体培养基3与分化培养基形成固液共培养,培养60d后可分化出芽点,当芽点长到2-3cm时可将其从愈伤组织块上分离,转入过渡培养基上继续培养,过渡培养10-15d后转入1/2MS培养基中进行生根培养,15-20d可以分化出发达根系,形成完整植株。
具体方法包括如下:
(1)花蕾的选取与消毒:选取花萼微张、未裂开、花药绿白色或黄绿色的花蕾,取20-25朵花蕾在加入200μl吐温和50ml 8wt.%次氯酸钠的混合溶液中振荡消毒15min,在无菌条件下用无菌水冲洗3-4次,用无菌滤纸吸干水分备用;
(2)小孢子分离与收集: 将已消毒的花蕾剥取花药于研钵中,取20-25朵花蕾的花药集中在一个研钵中,加入2ml 91g/L甘露醇的洗液用研杵挤压花药,然后再加入8ml洗液,用200目无纺布过滤于带盖离心管,1000r/min离心3分钟,弃上清液,收集沉淀,加入10ml 91g/L甘露醇的洗液重悬,1000r/min离心3分钟,重复洗涤沉淀2次;
(3)小孢子的愈伤组织诱导及培养过程:用热激培养基1将分离的小孢子稀释到1.0×105 个/ml,吸取3-4ml于直径6cm培养皿中,封口,35-36℃黑暗静止培养;培养3-5天后培养皿加入等体积液体培养基2,然后均分成2皿,封口,在25℃下继续黑暗静止培养;培养4-7天后每皿再添加等体积液体培养基3,然后每皿均分成2皿,封口,继续在25℃黑暗静止培养,7-10天后形成肉眼可见的愈伤组织;
(4) 愈伤组织分化培养:当愈伤组织长到2mm,转移到分化培养基上,每瓶4-5个愈伤组织,采用固液共培,即每瓶加入1-2ml液体培养基3,然后在3000-5000Lx光照,12-14h·d-1条件下培养,20天继代一次,培养60天分化出芽;
(5)过渡培养:当芽长到2-3cm时即从愈伤组织上分离,转入过渡培养基上培养10-15天;
(6)生根培养:转入1/2 MS培养基中进行生根培养,15-20天分化出发达根系,形成完整植株。
所述的热激培养基1包含以下成分:1.5 NLN培养基中添加甘露醇80-100 g·L–1 、水解酪蛋白130-170mg·L–1、2, 4-D 0.1-1mg·L–1 、NAA 0.1-1 mg·L–1、6-BA 0.1-1 mg·L–1。
所述液体培养基2包含以下成分:1.5 NLN培养基、蔗糖50-70g· L–1 、水解酪蛋白130-170mg· L–1、2,4-D 0.1-1mg·L–1 、NAA 0.1-1 mg·L–1、6-BA 0.1-1 mg·L–1;液体培养基3包含以下成分:1.5 NLN培养基、蔗糖20-40g· L–1 、水解酪蛋白130-170mg·L–1、2,4-D 0.1-1mg·L–1 、NAA 0.1-0.5 mg·L–1、6-BA 0.1-0.5 mg·L–1。
所述分化培养基包含以下成分:MS培养基、蔗糖20-40 g·L–1 、琼脂5-8 g·L–1 、NAA 0.001-0.01mg·L–1、ZT 0.5-1.5mg·L–1。
所述过渡培养基包含以下成分:MS培养基、蔗糖20-40 g·L–1 、琼脂5-9 g·L–1 、活性炭0.5-1.5wt.%、NAA 3-7 mg·L–1、IAA 0.1-1mg·L–1。
本方法的优点是:
1.小孢子的游离与收集是采用挤压的方法,此方法可以使小孢子充分游离出来。
2.小孢子培养过程中,随着培养时间的延长所添加培养基的渗透压逐渐减小以利于小孢子分裂和生长。
3.分化培养时采用固液共培养的方法培养愈伤组织使其有一个液体到固体培养的过渡,提高愈伤组织成活率。
4.生根前经过渡培养可大大提高植株的生根率。
本方法小孢子成功诱导成愈伤组织的概率较大,获得再生植株的机率较高,高达85%以上,且经过渡培养基处理过的芽点生根较快,根系较发达,为茄子的遗传转化及功能基因组学研究奠定基础,大大加快了茄子的育种进程。
附图说明
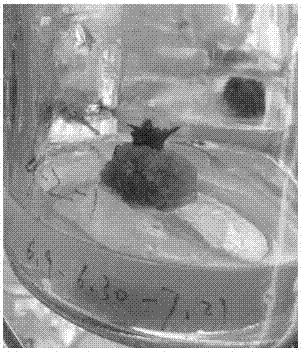
图1为液体培养基中形成的愈伤组织。
图2为愈伤组织上长出的芽点。
图3为转入过渡培养基中的芽点。
图4为生根培养基中的完整再生植株。
图5为再生植株移至保湿培养基。
具体实施方式
下述实施例所述方法如无特殊说明,均为常规方法。
实施例1
本发明提供的高效诱导长茄游离小孢子愈伤组织的形成及植株再生方法,具体步骤如下:
1.花蕾的选取与消毒:选取花萼微张、未裂开、花药绿白色或黄绿色的花蕾,取23朵花蕾在加入200μl吐温和50ml 8wt.%次氯酸钠的混合溶液中振荡消毒15min,在无菌条件下用无菌水冲洗4次,用无菌滤纸吸干水分备用。
2.小孢子分离与收集: 已消毒的花蕾中剥取花药于研钵中,取23朵花蕾的花药集中在一个研钵中,加入2ml 91g/L甘露醇的洗液用研杵挤压花药,然后再加入8ml 91g/L甘露醇的洗液,用200目无纺布过滤于10ml带盖离心管,在1000r/min离心3分钟,弃上清液,收集沉淀,加入10ml 91g/L甘露醇的洗液重悬,1000r/min离心3分钟,重新加入洗液重复洗涤沉淀2次。
3.小孢子的愈伤组织诱导及培养过程:用热激培养基1将分离的小孢子稀释到1.0×105 个/ml,吸取4ml于直径6cm培养皿中,Parafilm封口, 36℃黑暗静止培养。培养4天后每培养皿加入等体积液体培养基2,然后均分成2皿,Parafilm 封口,在25℃下继续黑暗静止培养。培养5天后每皿再添加等体积液体培养基3,然后每皿均分成2皿,Parafilm 封口,继续在25℃黑暗静止培养,8天后形成肉眼可见的愈伤组织。
其中所述培养基如下的:热激培养基1:1.5NLN培养基附加甘露醇90 g·L–1 、水解酪蛋白150mg·L–1、2, 4-D 0.5mg·L–1 、NAA 0.2 mg·L–1、6-BA 0.2 mg·L–1;
液体培养基2:1.5NLN培养基、蔗糖60g·L–1 、水解酪蛋白150mg·L–1、2,4-D 0.5mg·L–1 、NAA 0.2 mg·L–1、6-BA 0.2 mg·L–1;
液体培养基3:1.5NLN培养基、蔗糖30g·L–1 、水解酪蛋白150mg·L–1、2,4-D 0.5mg·L–1 、NAA 0.2 mg·L–1、6-BA 0.2 mg·L–1。
4. 愈伤组织分化培养:当愈伤组织长到2mm,转移到分化培养基上,每瓶5个愈伤组织,采用固液共培,即每瓶加入2ml液体培养基3,然后在4000Lx光照,13h·d-1条件下培养,20天继代一次,大约培养60天可以分化出芽。
其中所述分化培养基如下:MS培养基、蔗糖30 g·L–1 、琼脂7 g·L–1 、NAA 0.005 mg·L–1、ZT1.0mg·L–1。
5.过渡培养:当芽长到3cm时即可从愈伤组织上分离,转入过渡培养基上培养13天。
其中所述过渡培养基如下:MS培养基、蔗糖30 g·L–1 、琼脂7 g·L–1 、活性炭1wt.%、NAA 5 mg·L–1、IAA 0.5mg·L–1。
6.生根培养:转入1/2 MS培养基中进行生根培养,18天可以分化出发达根系,形成完整植株。
实施例2
(1)花蕾的选取与消毒:选取花萼微张,未裂开,花药绿白色或黄绿色的花蕾, 25朵花蕾在加入200μl吐温和50ml 8wt.%次氯酸钠的混合溶液中振荡消毒15min,在无菌条件下用无菌水冲洗3次,用无菌滤纸吸干水分备用;
(2)小孢子分离与收集: 已消毒的花蕾中剥取花药于研钵中,取25朵花蕾的花药集中在一个研钵中,加入2ml 91g/L甘露醇的洗液用研杵挤压花药,然后再加入8ml 91g/L甘露醇的洗液,用200目无纺布过滤于带盖离心管,1000r/min离心3分钟,弃上清液,收集沉淀,加入10ml 91g/L甘露醇的洗液重悬,1000r/min离心3分钟,重新加入洗液洗涤沉淀2次;
(3)小孢子的愈伤组织诱导及培养过程:用热激培养基1将分离的小孢子稀释到1.0×105 个/ml,吸取3ml于直径6cm培养皿中,封口,35℃黑暗静止培养;培养3天后培养皿加入等体积液体培养基2,然后均分成2皿,封口,在25℃下继续黑暗静止培养;培养4天后每皿再添加等体积液体培养基3,然后每皿均分成2皿,封口,继续在25℃黑暗静止培养,7天后形成肉眼可见的愈伤组织;
(4) 愈伤组织分化培养:当愈伤组织长到2mm,转移到分化培养基上,每瓶4个愈伤组织,采用固液共培,即每瓶加入1ml液体培养基3,然后在5000Lx光照,14h·d-1条件下培养,20天继代一次,培养60天分化出芽;
(5)过渡培养:当芽长到3cm时即从愈伤组织上分离,转入过渡培养基上培养15天;
(6)生根培养:转入1/2 MS培养基中进行生根培养, 20天分化出发达根系,形成完整植株。
所述的热激培养基1包含以下成分:1.5 NLN培养基中添加甘露醇100 g·L–1 、水解酪蛋白170mg·L–1、2, 4-D 1mg·L–1 、NAA 1 mg·L–1、6-BA 1 mg·L–1。
所述液体培养基2包含以下成分:1.5 NLN培养基、蔗糖70g· L–1 、水解酪蛋白170mg· L–1、2,4-D 1mg·L–1 、NAA 1 mg·L–1、6-BA 1 mg·L–1;
液体培养基3包含以下成分:1.5 NLN培养基、蔗糖40g· L–1 、水解酪蛋白170mg·L–1、2,4-D 1mg·L–1 、NAA 0.5 mg·L–1、6-BA 0.5 mg·L–1。
所述分化培养基包含以下成分:MS培养基、蔗糖40 g·L–1 、琼脂8 g·L–1 、NAA 0.01mg·L–1、ZT 1.5mg·L–1。
所述过渡培养基包含以下成分:MS培养基、蔗糖40 g·L–1 、琼脂9 g·L–1 、活性炭1.5wt.%、NAA 7 mg·L–1、IAA 1mg·L–1。
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的构思和范围进行限定,在不脱离本发明涉及方案的前提下,本领域技术人员对本发明的技术方案作出的各种显而易见的变型或改进,均应落入本发明的保护范围,本发明请求保护的技术内容,已经全部列入权利要求书中。
- 还没有人留言评论。精彩留言会获得点赞!