一种用于大豆遗传完整性分析的繁殖更新方法与流程
本发明属于作物种质资源学领域,涉及一种用于大豆遗传完整性分析的繁殖更新方法。
背景技术:
大豆(Glycine max(L.)Merr.)属于豆科(Leguminosae),蝶形花亚科(Papilionatae),大豆属(Glycine),Soja亚属,在我国人民日常生活和国民经济体系中具有举足轻重的地位,是人类重要的营养和保健食品。大豆籽粒的蛋白质含量为40%左右,约为其他植物的1~6倍,除蛋氨酸和胱氨酸含量较低外,其他人体必需的氨基酸含量都较高。因此,大豆蛋白对谷物蛋白有较好的增补效果,是仅次于动物蛋白的理想食品。大豆种质资源是大豆新品种选育和生物技术研究的重要物质基础,也是大豆生产持续发展的基本保证。我国是世界保存大豆种质资源数量最多的国家,约35000余份,这些材料是我国大豆遗传研究和作物育种的宝贵财富。
遗传完整性(genetic integrity)是指群体的遗传结构得到完全的保持,包括基因型频率分布和等位基因频率分布和其原始群体一样,保持不变。维持种质遗传完整性就是种质在贮藏及繁殖更新过程中保持子代与亲代具有最大程度的遗传相似性,这是种质保存工作的核心。影响种质遗传完整性的因素甚多,其中与繁殖更新相关的因素较多,例如,繁殖地点、繁殖群体量、授粉和收获方式等。因此,必须对作物的繁殖更新技术方法加以规范,以确保最大程度地维持其遗传完整性。
目前,国内外对于大豆种质遗传完整性研究报道较少,且其繁殖更新的程序方法也不规范。大豆种质在繁殖更新时因其生活力下降、繁殖地点、繁殖群体量、授粉和收获方式等不同,而使其遗传完整性丧失。因此,针对大豆在繁殖更新时容易发生遗传完整性变化的实际情况,制定出一套科学合理的用于大豆种质遗传完整性分析时的繁殖更新方法已迫在眉睫。
技术实现要素:
本发明针对现有技术的不足,提供一种用于大豆遗传完整性分析的繁殖更新方法,该方法完整可行且系统规范,可应用此方法对库存的高生活力大豆进行繁殖更新以维持其遗传完整性。
为此,本发明提供一种用于大豆遗传完整性分析的繁殖更新方法,包括亲代繁殖更新和子代繁殖更新。
所述亲代繁殖更新:将亲代种子经过人工老化处理后进行生活力检测,按照发芽率分组,选取不同发芽率梯度的亲代处理;各处理种子先进行育苗,然后移栽至大田中;单株收获。
所述子代繁殖更新:将各个子代处理,按照与亲代处理同样的步骤进行育苗、移栽、形态性状调查、单株收获。
所述子代单株与其亲代是一一对应关系,即子代的各个处理每个单株的编号与其亲代单株是一一对应的。
亲代和子代繁殖更新期间,进行形态标记分析及SSR分子标记分析以检测其遗传完整性。形态标记分析时,从亲代和子代的每个处理中按照编号选出30个单株,对其进行11个形态性状调查。进行性状调查的30个单株,亲代与子代的编号一一对应。同样,进行SSR标记分析时亲代及子代均取96个单株(包括形态性状调查的30个单株),子代采集叶片的单株与其亲代编号也是一一对应关系。
具体地,本发明用于大豆遗传完整性分析的繁殖更新方法,步骤如下:
(一)亲代繁殖更新
1、繁殖地点选择:
选择种质原产地或与原产地生态环境条件相似地区的地势平坦、地力均匀、形状规则、排灌方便且最少两年未种植大豆的田块;
2、种子老化及生活力检测
(1)种子人工老化:将播种、收获整齐度一致的同一份材料的大豆种子,放入人工气候箱中进行种子含水量平衡,平衡条件为45%RH,25℃,15天,使处理种子的含水量处于7.4%±0.1%;然后用铝箔袋真空密封分装,平均分成若干份,放置于人工老化箱内40℃恒温老化;放置顺序采用倒序法,即人工老化时间最长的处理先放入进行老化,人工老化时间最短的最后放入进行老化,试验结束时一起取出;人工老化结束后在25℃下,将所有处理密封平衡2天。以未经过人工老化的处理为对照。
(2)生活力检测:参考农作物种子检验规程GB/T3543.4中的标准条件,将对照与经过不同老化时间的处理进行发芽试验,并统计发芽势、发芽率、发芽指数和活力指数。
3、育苗及移栽:
按照遗传完整性分析的试验要求,选取包括对照在内的4~5个适合的发芽率梯度的大豆及野生大豆亲代处理进行育苗。
(1)制备育苗培养基质:将砂壤土、草炭土、蛭石和珍珠岩按照体积比为4:3:2:1比例混合,向混合基质中加入多菌灵,比例为每kg基质加入1g多菌灵;加入复合肥(N:P2O5:K2O=15:15:15),比例为每kg基质加入5g复合肥,加水搅拌混匀后,制得育苗培养基质。
(2)播种定盘:即将种子播种于育苗盘的过程。
(3)温室育苗:将步骤(2)中的育苗盘放入温室中,其上覆盖地膜保湿,温度控制在24.5~25.5℃,相对湿度为74.5~75.5%,种子出苗后将地膜掀掉。待幼苗长至三叶期后即可进行移栽。
(4)移栽大田:亩施农家肥1000~2000kg,磷酸二铵15kg。大豆每个处理田间定植200株,行距为50cm,株距为30cm,挖移栽穴,深10cm,将育苗盘中的幼苗移栽到大田中,及时填土浇水。
4、田间管理
(1)挂牌编号:待幼苗长至50cm高时,将定植于大田中每个处理的植株进行单株挂牌编号。
(2)栽培措施:常规管理即可。
5、形态性状调查及去杂
繁殖更新期间,从每个处理中按照编号选出30个单株,对其进行11个形态性状调查,这些性状包括:花色、粒色、粒形、脐色、茸毛色、荚色、结荚习性、株高、单株粒数、单株荚数和每荚粒数。并除去杂株。
6、收获、脱粒、干燥和保存
每个处理按照编号进行单株收获,脱粒,干燥至种子含水量8.0%以下,清选后保存。
(二)子代繁殖更新
1、繁殖地点选择:将大豆不同生活力的亲代各个处理繁殖更新所收获的种子次年原地进行繁殖更新。子代处理的繁殖的试验地及配套条件与其亲代一致。
2、生活力检测:子代处理繁殖更新时不需要经过种子老化。参考农作物种子检验规程GB/T3543.4中的标准条件,将各个子代处理进行发芽试验,并统计发芽势、发芽率、发芽指数和活力指数。
3、育苗及移栽:为保证与亲代各个处理的生长环境条件及种植密度一致,对子代处理进行育苗及移栽。培养基质、播种定盘、温室育苗和移栽大田过程与亲代一致。子代各个处理在育苗时,每格播种的种子是其亲代处理每个单株收获的种子,即育苗时每格长出的幼苗编号与其亲代单株是一一对应关系。每格播种2粒种子以保证成苗率。移栽时每格优选健壮的幼苗进行移栽。
4、田间管理:子代各个处理田间管理过程与其亲代一致。
5、形态性状调查及去杂:子代各个处理调查的形态性状与亲代完全一致。子代各个处理调查的每个单株与其亲代的每个单株也是一一对应关系,同样也是调查30个单株。去杂过程与亲代一致。
6、收获、脱粒、干燥和保存:子代处理的收获、脱粒、干燥和保存等程序与其亲代一致。
本发明提出了一整套完整可行且系统规范的用于大豆遗传完整性分析时的繁殖更新方法,特别是提出将不同生活力的亲代处理进行育苗移栽,对亲代处理的单株进行编号,并进行单株形态性状调查与收获,子代繁殖更新及形态性状调查时与其亲代处理是一一对应关系等技术创新。综合采用形态标记与SSR分子标记相结合的分析方法对提出的繁殖更新方法与常规的繁殖更新方法进行了遗传完整性对比分析,从而进一步验证了本发明提出的繁殖更新方法的可靠性和准确性。
本发明关键技术点及有益效果如下:
1、本发明提出的繁殖更新方法重点之一在于繁殖更新时子代单株与其亲代单株的一一对应关系,即子代育苗时的各个处理每个单株的编号与其亲代单株是一一对应的;进行形态性状调查时,子代各个处理调查的单株与其亲代单株也是一一对应关系,其目的是为了在进行大豆及野生大豆遗传完整性分析时明确子代与其亲代的遗传对应关系,使得出的试验数据具有更高的可靠性和准确性,得出的试验结论具有更强的说服力。
2、将不同生活力的亲代处理进行育苗移栽:由于大豆种子经过人工老化后,其种子活力较差,若是直播种子,田间出苗率很低,不能保证每个处理的种植密度一致,因此本发明采用先育苗,然后移栽的方法,每个处理定植200株,以保证种植密度一致,使得形态性状调查数据可靠准确,避免了因种植密度不一致而造成形态性状调查数据失真。
附图说明
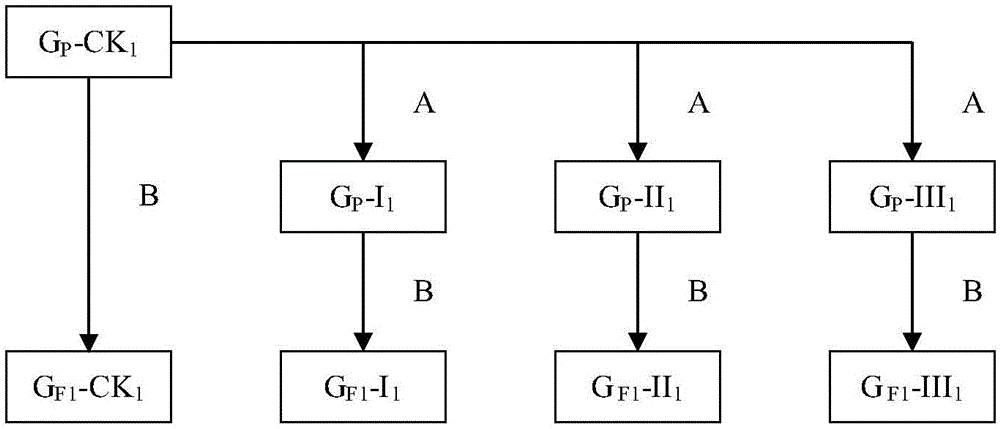
图1为本发明大豆亲代繁殖更新与子代繁殖更新时单株的一一对应关系示意图。
其中A表示进行人工老化;B表示田间繁殖过程(子代单株与亲代单株是一一对应关系)。
具体实施方式
下面结合具体试验方法和附图对本发明的技术方案及其所产生的技术效果进行进一步的阐述,下述说明仅是为了解释本发明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或替换,均属于本发明的保护范围。
本发明中所使用的方法如无特殊说明,均为本领域常规方法。下述实施例中所用的试验材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例一应用本发明方法和常规方法对大豆进行繁殖更新并进行遗传完整性分析
(一)试验材料:以大豆地方品种大黄豆种子为试验材料。
(二)试验方法:
1、方法一:利用本发明提供的方法对大豆地方品种大黄豆进行繁殖更新。步骤如下:
(1)大黄豆亲代处理繁殖更新
①繁殖地点选择:
a、繁殖地区:选择种质原产地。由于地方品种大黄豆原产地是山东省济宁市梁山县,因此在当地找到一农户,租赁其土地进行繁殖更新,能够满足繁殖更新材料的生长发育及其性状的表达。
b、试验地:地势平坦、地力均匀、形状规则、排灌方便且两年内未种植大豆;远离污染源、无人畜侵扰、附近无高大建筑;避开了病虫害多发区、重发区和检疫对象发生区。试验地块为每个小区宽1.5m,长30m,一个小区内进行一个处理的繁殖更新。
c、配套条件:具备了育苗、收获、晾晒、贮藏等试验条件和设施。
②种子老化及生活力检测
a、种子人工老化:将播种、收获整齐度一致的大豆地方品种大黄豆亲代种子10000粒,放入人工气候箱中进行种子含水量平衡,平衡条件为45%RH,25℃,15天,使处理种子的含水量处于7.4%±0.1%;然后用铝箔袋真空密封分装,平均分成若干份,每份1000粒,放置于人工老化箱内40℃恒温老化;放置顺序采用倒序法,即人工老化时间最长的处理先放入进行老化,人工老化时间最短的最后放入进行老化,试验结束时一起取出;人工老化结束后在25℃下,将所有处理密封平衡2天。以未经过人工老化的处理为对照。
b、生活力检测:参考农作物种子检验规程GB/T3543.4中的标准条件,将对照与经过不同老化时间的处理进行发芽试验,并统计发芽势、发芽率、发芽指数和活力指数(表1)。
③育苗及移栽:
按照遗传完整性分析的试验要求,选取包括对照在内的4个适合的发芽率梯度的亲代处理,即处理GP-CK1、GP-I1、GP-II1和GP-III1进行育苗。由于大豆种子经过人工老化后,其种子活力较差,若是直播种子,田间出苗率很低,不能保证每个处理的种植密度一致,因此需要预先进行育苗,然后移栽到大田中,每个处理定植200株,以保证种植密度一致,使得形态性状调查数据可靠准确,否则会因种植密度不一致而造成形态性状调查数据失真。育苗步骤如下:
a、制备育苗培养基质:将砂壤土、草炭土、蛭石和珍珠岩按照体积比为4:3:2:1比例混合,向混合基质中加入多菌灵,比例为每kg基质加入1g多菌灵;加入史丹利复合肥(N:P2O5:K2O=15:15:15),比例为每kg基质加入5g史丹利复合肥,加水混合后搅拌混匀后,制得育苗培养基质。
b、播种定盘:即将种子播种于育苗盘的过程。利用5×10格育苗盘育苗,将步骤a制备的培养基质填充于育苗盘中,填实抹平后,用喷壶均匀洒水,1~2小时后,用圆头小木棍或镊子等器具在每个育苗盘格子上打孔,直径1cm,深度2cm。将不同生活力处理的大豆亲代种子播种于小孔中。发芽率在80%以上的处理,每格播种1粒;发芽率在50~80%的处理,每格播种2粒;发芽率在30~50%的处理,每格播种3粒;发芽率在30%以下的处理,每格播种4粒。播种后用培养基质覆盖压实,再次洒水浇透即可。共育苗4盘。
c、温室育苗:将步骤b中的育苗盘放入温室中,其上覆盖地膜保湿,温度控制在24.5~25.5℃,相对湿度为74.5~75.5%,待种子出苗后将地膜掀掉。带幼苗长至三叶期后即可进行移栽。
d、移栽大田:幼苗移栽前,需造墒,精细整地,重施底肥,一般亩施农家肥1000~2000kg,磷酸二铵15kg。大豆每个处理田间定植200株。行距为50cm,株距为30cm,挖移栽穴,深10cm,将育苗盘中的幼苗移栽到大田中,及时填土浇水。移栽最好在下午进行,提高幼苗成活率。
④田间管理
a、挂牌编号:待幼苗长至50cm高时,将定植于大田中每个处理的植株进行单株挂牌编号。
b、栽培措施:封垄前及时进行中耕除草、培土;加强花荚期管理,争取多花多荚,防花荚脱落,花荚期施肥可根据长势酌情处理,如长势弱,花期可适当追肥,壮苗不追肥防止徒长,花荚期和鼓粒期可要适当浇水,防止受旱,以免影响百粒重及产量。需要注意地是每个处理的浇水施肥量必须相同,以免产生系统误差。适时除草,适期防病,科学治虫。播后芽前进行土壤封闭除草;盛花至结荚鼓粒期造桥虫、大豆卷叶螟等害虫容易发生,如田间有低龄幼虫啃食的网状和锯齿状叶片出现,要及时用药物防治。
⑤形态性状调查及去杂
a、性状调查:在地方品种大黄豆亲代处理繁殖更新期间,从每个处理中按照编号选出30个单株,对其进行11个形态性状调查,这些性状包括:花色、粒色、粒形、脐色、茸毛色、荚色、结荚习性、株高、单株粒数、单株荚数和每荚粒数。
b、去杂:在形态性状调查期间,核对每个单株的生育期、花色、茸毛色、叶形、生长习性、结荚习性和株高等主要性状与主体类型明显不一致的个体,当作杂株拔除。
⑥收获、脱粒、干燥和保存
a、收获:适时收获。对每个处理按照编号进行单株收获,每个单株的种子收获后进行编号,以便繁殖其子代。
b、脱粒:每个处理每个单株收获的种子在脱粒前,必须打扫干净脱粒场地、机械、用具等,严防混杂;将每个单株的种子单粒脱,单袋装;种子袋标签编号须与每个处理的每个单株编号一致,袋内外各附标签,避免写(挂)错标签。
c、干燥:脱粒装袋后及时晾晒,防止发热霉变。干燥至种子含水量8.0%以下,可停止干燥。
d、清选:去除破损粒、病虫粒和泥沙等杂质。
e、保存:将清选过的种子用铝箔袋密封包装后保存于-4℃中期库内。
(2)大黄豆子代处理繁殖更新
①繁殖地点选择:将大豆地方品种大黄豆的亲代各个处理繁殖更新所收获的种子次年原地进行繁殖更新。子代处理的繁殖的试验地及配套条件与其亲代一致。
②生活力检测:子代处理繁殖更新时不需要经过种子老化。子代处理的繁殖更新程序与其亲代大体一致,但不需要经过种子老化。参考农作物种子检验规程GB/T3543.4中的标准条件,将各个子代处理,即处理GF1-CK1、GF1-I1、GF1-II1和GF1-III1进行发芽试验,并统计发芽势、发芽率、发芽指数和活力指数(表1)。
表1大豆地方品种大黄豆发芽数据统计(方法一)
③育苗及移栽:为保证与亲代各个处理的生长环境条件及种植密度一致,对子代处理进行育苗及移栽。培养基质、播种定盘、温室育苗和移栽大田过程与亲代一致。子代各个处理在育苗时,每格播种的种子是其亲代处理每个单株收获的种子,即育苗时每格长出的幼苗编号与其亲代单株是一一对应关系。每格播种2粒种子以保证成苗率。移栽时每格优选健壮的幼苗进行移栽。
④田间管理:子代各个处理田间管理过程与其亲代一致。
⑤形态性状调查及去杂:子代各个处理调查的形态性状与亲代完全一致。子代各个处理调查的每个单株与其亲代的每个单株也是一一对应关系,同样也是调查30个单株。去杂过程与亲代一致。
⑥收获、脱粒、干燥和保存:子代处理的收获、脱粒、干燥和保存等程序与其亲代一致。
本发明中,子代繁殖更新时单株与其亲代是一一对应关系,即子代育苗时的各个处理每个单株的编号与其亲代单株是一一对应的,进行形态性状调查时,子代各个处理调查的单株与其亲代单株也是一一对应关系,其目的是为了在进行大豆地方品种大黄豆遗传完整性分析时明确子代与其亲代的遗传对应关系,使得出的试验数据具有更高的可靠性和准确性,得出的试验结论具有更强的说服力。亲代与子代各个处理关系如图1所示。
2、方法二:利用常规方法对大豆地方品种大黄豆进行繁殖更新。步骤如下:
(1)大黄豆亲代处理繁殖更新
①繁殖地点选择:为保证对比试验的准确性和可靠性,繁殖地区、试验地和配套条件与方法一相同。
②种子老化及生活力检测:种子人工老化的材料、程序、方法与方法一相同,即同一批亲代处理种子。生活力检测的数据,包括发芽势、发芽率、发芽指数和活力指数与方法一相同(表2)。
③播种:常规繁殖更新方法中没有育苗及移栽的步骤,而是将亲代处理种子直播。根据遗传完整性分析的试验要求,选取包括对照在内的4个适合的发芽率梯度的大豆,即处理GP-CK2、GP-I2、GP-II2和GP-III2进行直播。试验地块大小与方法一相同。每个小区根据发芽率播种,保证定苗200株。
④田间管理:播种前造墒,精细整地,重施底肥,一般亩施农家肥1000~2000kg,磷酸二铵15kg。出苗前后进行查苗,补苗,及时补种,但由于经过人工老化后,其活力较低,补苗后仍然出苗较差,因此不能保证种植密度一致。其余栽培措施与方法一相同。需要注意地是每个处理的浇水施肥量必须相同,以免产生系统误差。与方法一最大不同就是对单株不进行编号。
⑤形态性状调查及去杂:在地方品种大黄豆亲代处理繁殖更新期间,从每个处理中随机选出30个单株,对其进行11个形态性状调查,这些性状包括:花色、粒色、粒形、脐色、茸毛色、荚色、结荚习性、株高、单株粒数、单株荚数和每荚粒数。
⑥收获、脱粒、干燥和保存:收获方式为按照处理进行混合收获,即以处理为单位进行收获,以便繁殖其子代。脱粒方式为以处理为单位进行混合脱粒,纱网袋装,标签编号与处理编号一致,袋内外各附标签。干燥和清选方式与方法一相同。用纱网袋盛装后保存于-4℃中期库内。
(2)大黄豆子代处理繁殖更新
将亲代各个处理繁殖更新所收获的子代种子次年原地进行繁殖更新。子代处理的繁殖更新程序与其亲代大体一致,但不需要经过种子老化。参考农作物种子检验规程GB/T3543.4中的标准条件,将各个子代处理,即处理GF1-CK2、GF1-I2、GF1-II2和GF1-III2进行发芽试验,并统计发芽势、发芽率、发芽指数和活力指数(表2)。
表2大豆地方品种大黄豆发芽数据统计(方法二)
需要指出地是利用方法一与方法二进行繁殖更新的不同生活力亲代处理是同一批材料,因此生活力检测数据是一致的。
(3)利用形态标记对经过两种方法繁殖更新的地方品种大黄豆进行遗传完整性分析
本发明所统计形态标记性状如前所述共11个,包括:花色、粒色、粒形、脐色、茸毛色、荚色、结荚习性、株高、单株粒数、单株荚数和每荚粒数。按照方法一和方法二给出的程序进行形态性状调查,方法一和方法二每个处理的样本量均为30个单株;样本量为30在统计学中算作大样本,两组采用同样的样本量,可以有效地消除系统误差,使数据更加准确可靠。方法一是按照编号调查且亲代处理与其子代处理调查的单株是一一对应关系,方法二则是随机调查,亲代处理与其子代处理没有一一对应关系。
形态性状多样性的计算采用Shannon-Weaver信息指数,即H’=-∑PilnPi,Pi为某性状第i个代码值出现的概率。质量性状如花色、粒色和粒形等予以赋值(表3)。将数量性状如株高、单株粒数、单株荚数和每荚粒数进行10级分类,1级<X-2δ,10级≥X+2δ,中间每级间差0.5δ,X为平均值,δ为标准差。11个形态性状数据按不同的变异类型分别转换成AA、BB和CC等字母格式,利用生物统计软件Popgene等计算不同形态性状变异的Shannon-Weaver指数。然后利用SAS V9.1将两种方法繁殖更新的各个亲代处理的Shannon-Weaver指数与各自对照进行显著性t检验(表4)。
表3大豆地方品种大黄豆形态性状鉴定项目及标准
表4经过两种方法繁殖更新的地方品种大黄豆Shannon-Weaver指数t检验
注:*表示5%水平上显著差异;**表示1%水平上显著差异
结果显示,方法一繁殖更新的亲代处理中,发芽率为83.0%的处理GP-I1,其Shannon-Weaver指数与对照GP-CK1相比差异不显著,发芽率61.0%和30.0%的处理GP-II1和GP-III1,其Shannon-Weaver指数与对照GP-CK1相比差异显著或极显著。这表明,较高生活力的处理(发芽率≥83.0%)与对照相比,其遗传完整性得到了较好的保持,而较低生活力的处理(发芽率≤61.0%)与对照相比,其遗传完整性发生了显著变化。子代中各个处理(包括GF1-CK1、GF1-I1、GF1-II1和GF1-III1)的发芽率均为90.0%以上,其Shannon-Weaver指数与对照相比差异均不显著,特别是处理GF1-CK1与对照GP-CK1相比几乎没有任何差异,表明高生活力的子代群体,与对照相比其遗传完整性得到了较好的保持。这说明形态多样性与生活力密切相关,原因是形态多样性主要是数量性状造成的,而质量形状的差异很小,高生活力子代群体的数量性状与对照群体的差异较小,而低生活力子代群体的数量性状与对照群体的差异较大。
方法二繁殖更新的亲代处理中,发芽率同为83.0%的处理GP-I2,其Shannon-Weaver指数与对照GP-CK2相比差异显著,发芽率61.0%和30.0%的处理GP-II2和GP-III2,其Shannon-Weaver指数与对照GP-CK2相比差异极显著。这表明由于繁殖方法不当较高生活力的亲代处理(发芽率≥83.0%)与对照GP-CK2相比,其遗传完整性就发生了显著变化,而较低生活力的处理(发芽率≤61.0%)与对照GP-CK2相比,其遗传完整性发生了极显著变化。子代中处理GF2-CK2的发芽率为89.0%,与对照GP-CK2相比差异不显著,但t值和概率值显示,与方法一相比,经过方法二繁殖更新的子代处理,虽然其亲代生活力很高,为93.0%,但是其子代仍然发生了形态多样性变化;处理GF1-I2和GF1-II2的发芽率为88.0%和86.0%,与方法一相比,其发芽率有所下降,而Shannon-Weaver指数与对照GP-CK2相比差异虽不显著,但其概率值已接近0.05,其差异水平快要达到显著水平;处理GF1-III2的发芽率为85.0%,其Shannon-Weaver指数与对照GP-CK2相比差异显著,表明其遗传完整性就发生了显著变化。
以上数据表明,由于繁殖方法不当,较高生活力的子代处理(发芽率≥85.0%),其遗传完整性也发生了显著变化。推其原因:首先,亲代处理中由于种子活力下降而导致田间成苗率下降,造成种植密度不一致,一些单株长得过于高大,其形态性状,特别是数量性状发生较大变化;其次,由于活力较差,田间成苗率大幅下降,亲代传递给子代的遗传多样性降低,出现所谓的“奠基者效应”,导致子代的遗传完整性发生显著变化。
(4)利用SSR分子标记对经过两种方法繁殖更新的地方品种大黄豆进行遗传完整性分析
①分析样本:
a、方法一:不同生活力亲代处理及其子代处理在田间繁殖更新期间,选取96个单株(包括形态性状调查的30个单株),采集幼嫩叶片,-80℃下保存备用。子代采集叶片的单株与其亲代也是一一对应关系。
b、方法二:不同生活力亲代处理及其子代处理在田间繁殖更新期间,随机选取96个单株(不一定包括形态性状调查的30个单株),采集幼嫩叶片,-80℃下保存备用。子代采集叶片的单株与其亲代不存在一一对应关系。
②基因组DNA提取:采用SDS法单株提取上述两种方法繁殖更新的亲代及子代各个处理的基因组DNA。
③SSR引物扩增及聚丙烯酰氨凝胶检测:采用40对SSR核心引物(选取自王栋等,SSR标记分析种子老化及繁殖世代对大豆种质遗传完整性的影响,植物遗传资源学报2010,11(2):192-199。每个连锁群上分布两个位点,如表2所示),对上述两种方法繁殖更新的上述两种方法繁殖更新的亲代及其子代各个处理基因组DNA进行PCR扩增,采用6%聚丙烯酰氨凝胶电泳分离扩增产物,功率75W,时间为50min,电泳结束后采用常规银染法检测。
表5大豆地方品种大黄豆遗传完整性分析40对SSR核心引物
a、PCR扩增反应体系为:Premix TaqTM(TaKaRa TaqTM Version2.0)10.0μL,5.0μmol/L Primer pairs(1.0+1.0)μL,20.0ng/μL DNA 5.0μL,ddH2O 3.0μL,总体系为20.0μL。
b、PCR扩增反应程序为:94℃预变性4min;95℃变性45s,47℃退火45s,72℃延伸45s,35个循环;72℃延伸10min。温度降至4℃时取出,4℃冰箱内保存备用。
⑦结果统计及分析:根据检测结果,利用POPGENE version 1.31和Powermarker V3.25等软件对大豆地方品种大黄豆经过上述两种方法繁殖更新的亲代及其子代各个处理进行遗传结构分析,计算出各个处理的各位点等位基因频率、每位点等位基因数、遗传多样性指数和香农指数,并利用SAS 9.1对各处理群体与对照群体之间的各位点等位基因频率进行χ2检验,对每位点等位基因数、遗传多样性指数和香农指数进行显著性t检验。
a、等位基因频率差异分析
表6大豆地方品种大黄豆处理间等位基因频率差异分析(方法一)
从表6可以看出,方法一繁殖更新的亲代处理GP-I1、GP-II1和GP-III1与对照GP-CK1的等位基因频率显著差异和极显著差异的位点个数以及占总位点个数百分比,随着生活力的下降而增加,其中发芽率为30.0%的处理GP-III1的显著和极显著差异位点个数最多,分别为8个和4个,占总位点的个数的百分比分别为20.00%和10.00%,发芽率为61.0%的处理GP-II1次之,分别为5和2个,占总位点的个数的百分比分别为12.50%和5.00%,发芽率为83.0%的处理GP-I1最少,分别为1个和0个,占总位点的个数的百分比分别为2.50%和0,这表明生活力下降显著地影响了大豆种质材料处理内的等位基因频率分布。由对照GP-CK1繁殖的处理GF1-CK1与对照GP-CK1相比,无显著差异位点,由处理GP-1I繁殖的处理GF1-I1与对照GP-CK1相比,显著或极显著差异的位点个数与处理GP-I1持平,同为为1个和0个,占总位点的个数的百分比分别为2.50%和0,这表明发芽率为93.0%和83.0%的大豆经过方法一繁殖更新后,各位点的等位基因频率与对照相比几乎没有差异。由处理GP-II1和GP-III1繁殖的处理GF1-II1和GF1-III1,这2个处理与对照GP-CK1显著或极显著差异的位点个数较多,分别为6个和3个,9个和5个,占总位点的个数的百分比分别为15.00%和7.50%,22.50%和12.50%,且子代处理比相应亲代处理的显著或极显著差异位点数要高,表明发芽率为61.0%和30.0%的大豆种质材料子代处理各位点的等位基因频率与对照相比差异显著,且生活力水平愈低差异愈大。方法一结果表明,生活力下降对地方品种大黄豆的等位基因频率分布影响甚大。
表7大豆地方品种大黄豆处理间等位基因频率差异分析(方法二)
从表7可以看出,与方法一相比,方法二繁殖更新的各个处理与对照GP-CK2的等位基因频率显著差异和极显著差异的位点个数以及占总位点个数百分比普遍增加。亲代处理GP-I2、GP-II2和GP-III2与对照GP-CK2的显著和极显著差异位点个数,同样也随着生活力的下降而增加,与方法一不同的是,发芽率为83.0%的处理GP-I2的显著和极显著差异位点个数分别为4个和2个,占总位点的个数的百分比分别为10.00%和5.00%,而方法一相应的显著和极显著差异位点个数为1个和0个,占总位点的个数的百分比分别为2.50%和0,表明经过方法二繁殖更新的较高生活力群体内的等位基因频率分布发生了显著变化。发芽率为61.0%和30.0%的处理GP-II2和GP-III2与对照GP-CK2相比,其显著和极显著差异位点个数分别为7个和5个,12个和8个,占总位点的个数的百分比分别为17.50%和12.50%,30.00%和20.00%,都明显高于方法一相对应的数据。方法二繁殖更新的处理GF1-CK2与对照相比,其显著和极显著差异位点个数分别为4个和3个,占总位点的个数的百分比分别为10.00%和7.50%,而方法一相应的显著和极显著差异位点个数分别为0个,占总位点的个数的百分比也是0,这表明发芽率为93.0%的处理经过方法二繁殖更新后,其等位基因频率分布与对照相比也产生了显著差异。由处理GP-I2、GP-II2和GP-III2繁殖的处理GF1-I2、GF1-II2和GF1-III2,这3个处理与对照GP-CK1显著或极显著差异的位点个数较多,分别为6个和4个,9个和7个以及14个和10个,占总位点的个数的百分比分别为15.00%和10.00%,22.50%和17.50%以及35.00%和25.00%,与方法一的相应数据相比,都明显高出甚多。以上数据说明方法二繁殖更新的各个处理(包括高生活力处理)的等位基因频率分布与对照之间的差异明显高于方法一。
b、群体遗传结构分析
表8大豆地方品种大黄豆群体遗传结构(方法一)
注:*表示5%水平上显著差异;**表示1%水平上显著差异
从表8中可以看出,亲代处理GP-I1、GP-II1、GP-III1及其子代处理GF1-I1、GF1-II1和GF1-III1,其各项遗传多样性参数均低于对照GP-CK1,而且随老化时间的延长,生活力水平愈低,其各项遗传多样性参数也愈低。t检验结果显示,由对照GP-CK1繁殖的处理GF1-CK1,其各项遗传多样性参数与对照GP-CK1相比几乎没有差异,表明发芽率为93.0%的处理经过方法一繁殖更新后,其群体遗传结构得到了较好的保持。处理GP-I1的A、H和I等3项遗传多样性参数与对照相比无显著差异,而其子代处理GF1-I1的各项遗传多样性参数与对照相比虽有所下降但没有达到显著差异水平。处理GP-II1和GP-III1的A、H和I等3项遗传多样性参数与对照GP-CK1相比差异显著或极显著,其子代处理GF1-II和GF1-III的A、H和I等3个遗传多样性参数与对照相比差异极显著,表明更新发芽率分别为61.0%和30.0%的处理因生活力水平下降,其自身及子代群体内的遗传多样性低于对照处理遗传多样性。方法一结果表明,生活力下降对大豆地方品种大黄豆的群体遗传结构影响显著。
表9大豆地方品种大黄豆群体遗传结构(方法二)
注:*表示5%水平上显著差异;**表示1%水平上显著差异
从表9中可以看出,与方法一相比,方法二繁殖更新的各个处理包括对照的各项遗传多样性参数均有所下降。亲代处理GP-I2、GP-II2、GP-III2及子代处理GF1-CK2、GF1-I2、GF1-II2和GF1-III2,其各项遗传多样性参数均低于对照GP-CK2,而且生活力水平愈低,其各项遗传多样性参数也愈低。t检验结果显示,与方法一相比,由对照GP-CK2繁殖的处理GF1-CK2,其各项遗传多样性参数与对照GP-CK2相比差异虽未达到显著水平,但下降的较多,表明发芽率为93.0%的处理经过方法二繁殖更新后,其群体遗传结构有所改变,但未达到显著水平。处理GP-I2及其子代处理GF1-I2的A、H和I等3项遗传多样性参数与对照GP-CK2相比差异显著,这点与方法一不同,表明发芽率为83.0%的处理经过方法二繁殖更新后,其群体遗传结构发生了显著变化。处理GP-II2和GP-III2及其子代处理GF1-II2和GF1-III2的A、H和I等3项遗传多样性参数与对照GP-CK2相比差异极显著,表明更新发芽率分别为61.0%和30.0%的处理因生活力水平下降,其自身及子代群体内的遗传多样性低于对照的遗传多样性,这方面两种方法是一致的。以上结果表明,方法二繁殖更新的各个处理(包括高生活力处理)的群体遗传结构与对照之间的差异明显高于方法一,其群体内的遗传多样性降低较多。
综合大豆地方品种大黄豆形态标记分析和SSR标记分析的实验结果可得出以下结论:方法一繁殖更新的大豆种质材料,当更新发芽率高于83.0%时,亲代及其子代在形态性状水平及DNA分子水平上,其遗传完整性都得到了较好的保持;更新发芽率低于61.0%时,亲代及其子代在DNA分子水平上的遗传完整性明显改变。以此推荐其更新发芽率最低不得低于61.0%。方法二繁殖更新的大豆种质材料,即使更新发芽率为83.0%时,亲代及其子代在形态性状水平及DNA分子水平上,其遗传完整性都发生了显著变化,且得出的群体内遗传多样性低于方法一。因此,方法一较方法二更有利于大豆遗传完整性的保持,建议采用本发明提供方法对大豆种质遗传完整性分析时进行繁殖更新。
- 还没有人留言评论。精彩留言会获得点赞!