一种胃肠动力障碍动物模型的制备方法与流程
本发明涉及动物医学模型领域,具体是一种胃肠动力障碍动物模型的制备方法。
背景技术:
胃肠动力障碍性疾是一类多发的神经-肌肉等异常性疾病,其可发生于消化道的任何部位,以胃肠功能障碍、蠕动变缓、胃排空及小肠推进时间延长等为主要病机。通常将其分为运动性障碍和功能性障碍两大类,常见的DGIMD主要包括贲门失弛症、胃食管返流病、功能性消化不良、肠易激综合征、慢传输性便秘、胃轻瘫、假性肠梗阻等。
目前临床上用于促胃肠动力的药物主要以多巴胺受体拮抗剂、5-HT受体激动剂及胃动素受体激动剂等化学药物为主。甲氧氯普胺(又名胃复安)作为一种经典的多巴胺受体拮抗类药物,其应用于缓解糖尿病引起的胃轻瘫及手术或化疗引起的恶心、呕吐等症状已有数十年的历史,但该药物却因明显的锥体外系反应限制了其广泛使用,而其他同类药物也因锥体外系反应或高泌乳素血症等不良事件而受到质疑。西沙必利是第一代5-HT受体激动剂,其用于治疗功能性消化不良、胃轻瘫、假性肠梗阻等症状具有肯定的疗效,然而因其苯甲酰胺结构能够阻滞人类果蝇相关基因钾离子通道,可导致心律失常甚至猝死,故而逐渐退出药品市场。后续出现的同类药物如替加色罗、普芦卡必利等也因为上述不良反应或致癌性而被限制使用。以红霉素为代表的MTL受体激动剂在治疗胃肠动力障碍方面也具有一定的疗效,但其可降低进食后的胃体舒张的敏感性,同时还可能影响心肌细胞钠离子通道而诱发心律失常。其他可能用于胃肠动力障碍治疗的药物主要有胆囊收缩素受体拮抗剂、阿片肽受体拮抗剂等,但目前仍处于临床及临床前期研发阶段,具体疗效及安全性有待继续探讨。
当前用于DGIMD动物模型制备的方法主要有糖尿病模型、肝硬化模型、炎症性肠病模型、避水应激或加尾应激刺激模型、吗啡等诱导的慢传输性便秘模型、开腹刺激肠管模型等。以上几种动物模型都具有明确的针对性,如针对糖尿病或肝硬化等,因此不具有广泛的代表性,同时,他们导致胃肠动力障碍发生的共同机制主要都是影响了ICC细胞的功能或减少了肠道激素的分泌,并不能完全符合临床上DGIMD发病机制的多样性。
技术实现要素:
本发明要解决的技术问题是克服现有技术的缺陷,提供一种简易廉价且具有广泛代表性的胃肠动力障碍动物模型的制备方法。
为解决上述技术问题,本发明提供以下技术方案:一种胃肠动力障碍动物模型的制备方法,采用SPF级7周龄Sprague-Dawley(SD)大鼠,体重200g-240g,先饲养1周适应实验室环境,或待其质量达标后再进行实验,包括以下步骤:
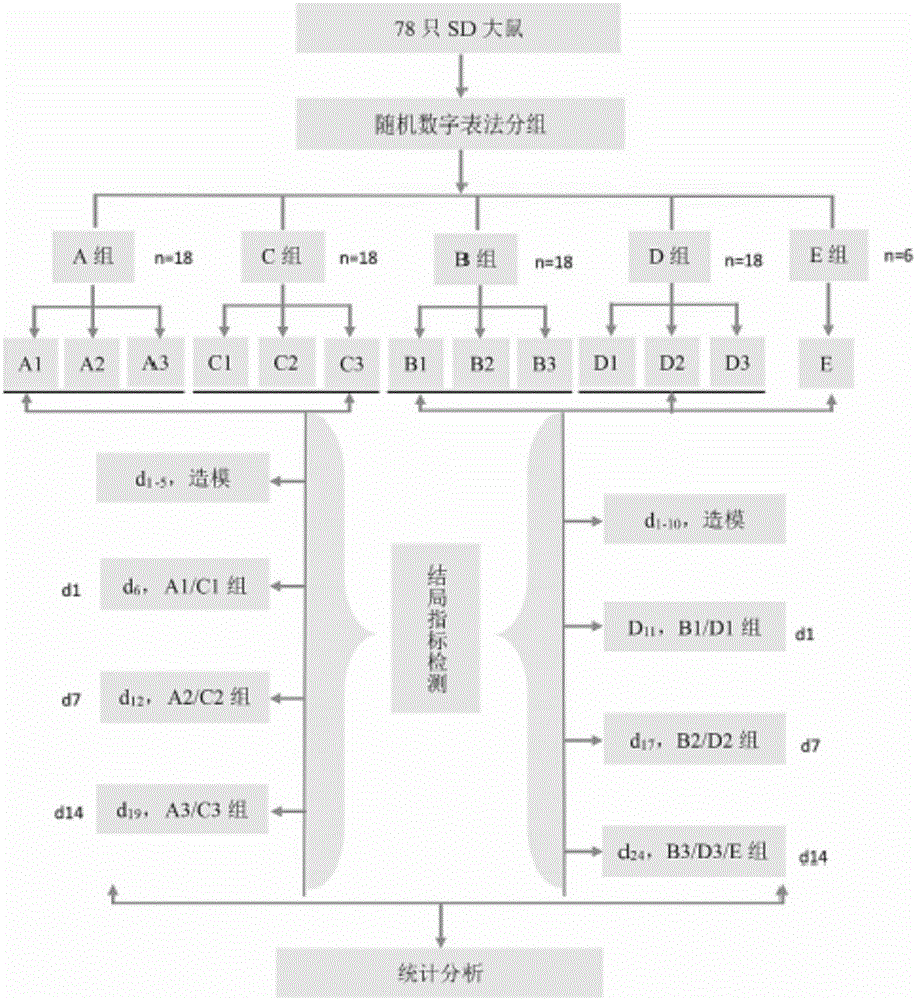
(1)饲养期间自由进食进水,采用周期为12小时的光照/黑暗交替,温、湿度适宜,将78只符合标准的SD大鼠从1号到78号进行标记,雌雄各半,每只大鼠对应固定的序号。然后采用随机数字表法将其均分为A(n=18)、B(n=18)、C(n=18)、D(n=18)和E(n=6)5个大组,其中前4个组根据不同的观察时间又分为3个小组,每个小组6只大鼠。
(2)A组:L-Arg干预短期组,第1天腹腔注射L-Arg 5.2g/kg(20%L-Arg,2.6ml/100g),第2-5天腹腔注射量减半,即L-Arg 2.6g/kg(20%L-Arg,1.3ml/100g)。
(3)B组:L-Arg干预长期组,第1天腹腔注射L-Arg 5.2g/kg(20%L-Arg,2.6ml/100g),第2-10天腹腔注射量减半,即L-Arg 2.6g/kg(20%L-Arg,1.3ml/100g)。
(4)C组:生理盐水干预短期组,在各时间段给予与A组L-Arg相同体积的生理盐水,干预周期为5天。
(5)D组:生理盐水干预长期组,在各时间段给予与B组L-Arg相同体积的生理盐水,干预周期为10天。
(6)E组:正常对照组,不予任何干预,所有实验大鼠均采用自由进食水。
(7)标本采样:前4个组分别在干预结束后的第1天、第7天及第14天进食24h后采集标本,E组则在干预结束后第14天采集标本。
(8)进行大鼠体重的变化、小肠推进率、胃肠激素、RAS系统成分、一氧化氮(NO)及环磷酸鸟苷(cGMP)的检测。
优选地,所述20%L-Arg溶液采用适量左旋精氨酸(L-Arg)粉末溶于生理盐水,配成20%(w/v)左旋精氨酸盐溶液(20g L-Arg溶于100ml生理盐水中),搅拌混勻后加入适量0.1mol/L HCI或0.1mol/L NaOH直至溶液变澄清,调节PH 7.35-7.45左右,常温保存。
优选地,所述2%BD-2000溶液采用2g葡聚糖蓝-2000溶于100ml的去离子水中,搅拌均匀,常温保存。
优选地,所述0.5%戊巴比妥钠溶液采用0.1g戊巴比妥钠粉末溶于20ml生理盐水中,避光常温保存。
优选地,所述4%多聚甲醛溶液采用40g多聚甲醛粉末溶于900ml蒸馏水中,逐渐调整PH至7.35-7.45,最后调整液体总量为1000ml,常温保存。
优选地,所述标本采集主要包括血样采集、胃组织采集和肠组织采集。
优选地,所述大鼠体重的变化采用电子称每天称量并记录大鼠体重的变化,所述小肠推进率根据量取幽门至BD-2000最前端的距离及小肠全长进行计算。
优选地,所述胃肠激素检测主要包括胃动素(MTL)、胃泌素(GAS)、血管活性肠肽(VIP)及生长抑素(SST)等。采用ELISA试剂盒法检测大鼠血浆中各类胃肠激素的表达水平。
优选地,所述RAS系统成分检测主要包括血浆肾素、血管紧张素II(AngII)、血管紧张素转换酶(ACE)、血管紧张素转换酶2(ACE2)及组织中血管紧张素II受体(AT2R),胃肠组织中AT2R的检测采用免疫组织化学法。
优选地,所述一氧化氮(NO)检测在组织中NO的含量采用格里斯试剂系统(Griess Reagent System)进行检测。
本发明与现有技术相比具有的有益效果是:
1.制备方法简单:本方案通过对比,最后确立了通过时长5天腹腔注射L-Arg盐溶液即可制备理想的胃肠动力障碍动物模型,和现有的糖尿病模型、肝硬化模型、夹尾刺激模型及外科手术模型相比,其制作方法简单,成模时间短,无需特殊的设备和技术;
2.质控指标明确:干预结束后小肠推进率、胃动素及血管活性肠肽等指标具有明显的变化规律,可作为重要的模型质控指标,具有很好的可重复性;
3.维持时间较长:该模型制备成功后,其胃肠动力障碍状态持续时间较长,能满足实验的基本需求;
4.制备成本低廉:该模型干预试剂为L-Arg和Nacl溶液,二者价格低廉,均为常见的实验试剂;
5.贴切疾病特征:糖尿病模型、肝硬化模型、夹尾刺激模型及外科手术模型等胃肠动力障碍模型仅仅代表具有某一特性的疾病模型,不具有广泛的代表性,更不符合胃肠动力障碍性疾病发病机理的复杂性。而L-Arg盐溶液模型成模机制较为复杂,更符合该类疾病发病的基本特征;
6.成模机制独特:除NO的参与外,RAS系统在该模型形成过程中发挥了重要的作用,而RAS系统与胃肠动力的相关性将成为今后该领域研究的热点之一,该模型也将为其进行深入的研究提供了基本保障。
附图说明
图1为本发明实验部分技术路线图;
图2为本发明造模干预期间各组大鼠体重的变化趋势;
图3为本发明造模干预结束后各组大鼠体重的变化趋势;
图4为本发明各组大鼠小肠推进率变化趋势对比图(其中,A组为理想模型制备方案);
图5为本发明各组大鼠血浆中胃动素表达水平变化趋势对比图(其中,A组为理想模型制备方案);
图6为本发明各组大鼠血浆中血管活性肠肽表达水平变化趋势对比图(其中,A组为理想模型制备方案)。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
1.实验动物
采用SPF级7周龄Sprague-Dawley(SD)大鼠,体重200g-240g。实验动物由兰州大学实验动物中心提供(许可证号:SCXK(甘)2009-0004)。购买大鼠后,先饲养1周适应实验室环境,或待其质量达标后再进行实验。饲养期间自由进食进水,采用周期为12小时的光照/黑暗交替,温、湿度适宜。本实验获得了兰州大学第二医院动物伦理委员会的审核批准(编号:B2015-004)。
2.使用药物
左旋精氨酸:Sigma公司生产。
戊巴比妥钠:上海索莱宝生物科技有限公司。
生理盐水:北京华兴科诺生物技术有限公司。
3.化学试剂
4.药物及试剂配制
20%L-Arg溶液:取适量左旋精氨酸(L-Arg)粉末溶于生理盐水,配成20%(w/v)盐酸左旋精氨酸溶液(20g L-Arg溶于100ml生理盐水中),搅拌混勻后加入适量0.1mol/L HCI或0.1mol/L NaOH直至溶液变澄清,调节PH 7.35-7.45左右,常温保存。
2%BD-2000溶液:去2g葡聚糖蓝-2000溶于100ml的去离子水中,搅拌均匀,常温保存。
0.5%戊巴比妥钠溶液:取0.1g戊巴比妥钠粉末溶于20ml生理盐水中,避光常温保存。
4%多聚甲醛溶液:取40g多聚甲醛粉末溶于900ml蒸馏水中,逐渐调整PH至7.35-7.45,最后调整液体总量为1000ml,常温保存。
5.主要器材
实施例1
一种胃肠动力障碍动物模型的制备方法,包括以下步骤:
1.动物分组
(1)将78只符合标准的SD大鼠从1号到78号进行标记,雌雄各半,每只大鼠对应固定的序号。然后采用随机数字表法将其均分为A(n=18)、B(n=18)、C(n=18)、D(n=18)和E(n=6)5个大组,其中前4个组根据不同的观察时间又分为3个小组,每个小组6只大鼠。
2.干预措施
(2)A组:L-Arg干预短期组,第1天腹腔注射L-Arg 5.2g/kg(20%L-Arg,2.6ml/100g),第2-5天腹腔注射量减半,即L-Arg 2.6g/kg(20%L-Arg,1.3ml/100g);
(3)B组:L-Arg干预长期组,第1天腹腔注射L-Arg 5.2g/kg(20%L-Arg,2.6ml/100g),第2-10天腹腔注射量减半,即L-Arg 2.6g/kg(20%L-Arg,1.3ml/100g);
(4)C组:生理盐水干预短期组,在各时间段给予与A组L-Arg相同体积的生理盐水,干预周期为5天;
(5)D组:生理盐水干预长期组,在各时间段给予与B组L-Arg相同体积的生理盐水,干预周期为10天;
(6)E组:正常对照组,不予任何干预。所有实验大鼠均采用自由进食水。
3.标本采集
前4个组分别在干预结束后的第1天、第7天及第14天进食24h后采集标本,E组则在干预结束后第14天采集标本,具体如下:
干预结束后,禁食24h,给予2%的葡聚糖蓝-2000 0.8ml/只灌胃,灌胃30min后,戊巴比妥钠(50mg/kg,1%v/v)经腹腔注射麻醉。
开腹,经下腔静脉采血2ml,置于事先加入EDTA-K2(10%,30ul=3mg,即1.5mg/ml血液)的抗凝采血管中,3500r/min,4℃离心15min,收集血浆并分装(100ul/管),保存于-80℃备用。
采血后,颈椎脱臼处死大鼠,立即完整解剖出全胃和肠管,测量并计算小肠推进率。
胃组织:解剖出胃体并将内容物溶于蒸馏水后,立即将胃体分为2部分,其中一部分立即置于0.1%DEPC水处理过的5ml离心管中,-80℃保存;另一部分浸入4%多聚甲醛(pH:7.35-7.45)固定液中固定24-48h,然后进行组织的修剪取材,石蜡包埋,常温下长期保持(HE染色/免疫组化染色等备用)。
肠组织:解剖出组织后,尽快分别离断十二指肠近端及距离回肠末端10cm处的肠组织各6cm,用蒸馏水清洗干净后分为2部分,一部分立即置于0.1%DEPC水处理过的5ml离心管中,-80℃保存;另一部分浸入4%多聚甲醛固定液中固定24-48h,最后取材并包埋,保存备用。
4.结局指标
1)大鼠体重的变化。每天用电子称称量并记录大鼠体重的变化。
2)小肠推进率:解剖出整个肠道后,量取幽门至BD-2000最前端的距离及小肠全长,按以下公式计算小肠推进率。
3)胃肠激素:主要包括胃动素(MTL)、胃泌素(GAS)、血管活性肠肽(VIP)及生长抑素(SST)等。采用ELISA试剂盒法检测大鼠血浆中各类胃肠激素的表达水平。具体步骤如下:
①先从冰箱取出96孔板,室温平衡20min,然后从铝箔袋中取出96孔板需要部分,若有剩余可密封后放回4℃保存;
②按需设置好标准品孔和样本孔,标准品孔分别加入各种不同浓度的标准品50μL;
③样本孔中先加待测样本10μL,再加样本稀释液40μL;空白孔不加;
④除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100μL,用封板膜封住反应孔,37℃恒温箱孵育60min;
⑤孵育结束后,甩去孔中的所有液体,吸水纸上垂直拍干,用排枪每孔加满洗涤液,静置1min后,甩去洗涤液,吸水纸上再次拍干,如此重复洗板5次;
⑥各孔加入终止液50μL,轻轻摇匀,15min内,在450nm波长处测定各孔的OD值;
⑦采用CurveExpert软件,以标准孔数据绘制标准曲线及曲线方程,以此计算各待测样本中胃动素的水平。
⑧统计分析
4)RAS系统成分:主要包括血浆肾素、血管紧张素II(AngII)、血管紧张素转换酶(ACE)、血管紧张素转换酶2(ACE2)及组织中血管紧张素II受体(AT2R)等。前几种成分的检查方法及流程与胃肠激素检查方法相同,胃肠组织中AT2R的检测采用免疫组织化学法。
5)一氧化氮(NO):组织中NO的含量采用格里斯试剂系统(Griess Reagent System)进行检测。具体步骤如下:
①将事先冻存的胃肠组织置于常温下解冻,然后称取0.2g组织,在1.8ml的生理盐水中进行充分研磨,然后在4℃,3000r/min离心15min,吸取离心管上层清亮的液体,分装(100ul/管)后于-80℃保存备用。
②实验前将试剂盒取出,在常温下平衡15-30min,取1ml的蒸馏水和1ul的NS溶液,充分混合;
③96孔板中留出前3列作为标准孔。在B-H的前三列孔中各加入50ul蒸馏水,在A的前三个孔中加入前面配好的标准液100ul;
④从A到H进行6系列2倍稀释,最终每孔中液体的体积为50ul;
⑤剩余孔中各加入50ul的待测样本,每个样本设置2-3个复孔;
⑥用排枪向每孔中加入50ul的SS液,常温避光孵育8min;
⑦每孔中加入50ul的NED液,常温避光再孵育8min;
⑧30min内,在540nm波长下测量各孔吸光度;
⑨绘制标准曲线,计算各样品NO浓度;
⑩统计分析。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种用于制备塑料桶的组合物的制作方法与工艺
- 功能生物材料在制备促进动物脊髓全横断损伤修复的材料中的应用的制作方法与工艺
- IGF2BP3和AFP联合标志物在制备肝癌诊疗评估试剂盒中的应用及试剂盒的制作方法与工艺
- 不同节理粗糙度隐节理岩体模型试样制备方法及制备模具与流程
- 一种中药组合物在制备预防和/或治疗肿瘤药物中的应用的制作方法与工艺
- 一种六小时高效保湿组合物及其制备和应用的制作方法与工艺
- 一种缓释复合型动物消毒剂的制备方法与流程
- 一种组合物以及用该组合物制备的环保标本保存液的制作方法与工艺
- 密封剂组合物、通过使其硬化制备的太阳能电池组件密封剂和使用其生产太阳能电池组件的方法与流程
- 4’‑GL高纯度组合物的制备方法与流程