诱发牛皮癣动物模型及其用途的制作方法
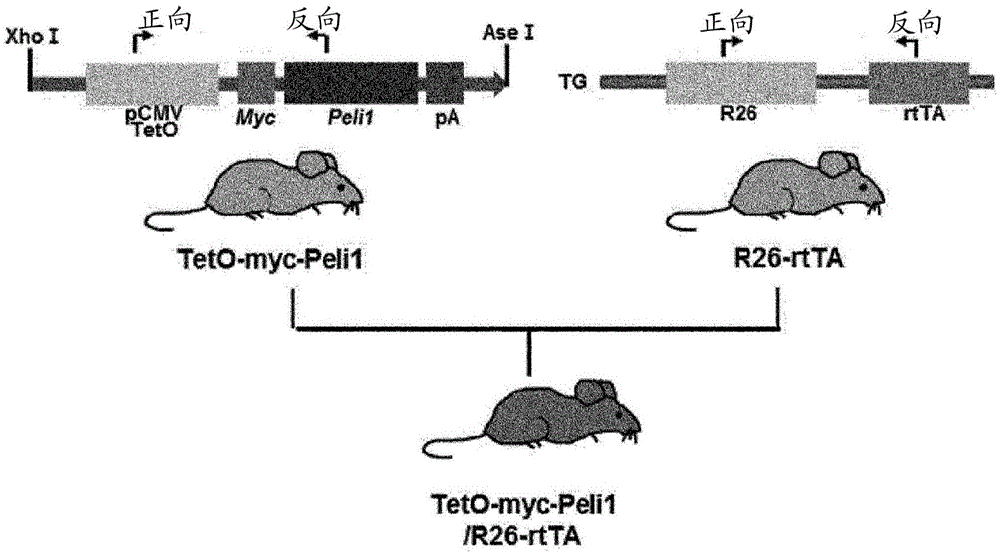
本发明涉及一种诱发牛皮癣动物模型及其用途。具体讲,就是涉及一种通过给药强力霉素(doxycycline)使peli1(pellino同系物1)基因过表达形成转基因的诱发牛皮癣动物模型及其用途。
背景技术:
:牛皮癣是一种比较具有代表性的慢性皮肤病,发病后大部分都会持续10-20年的时间,即使经过治疗会暂时好转,也必须终生冒着可能复发的风险生活。牛皮癣以边界分明的银白色鳞屑覆盖的红斑性皮肤病变为特征,主要在受到刺激较多部位的胳膊肘、膝盖、臀部、头皮等处发生。另外,牛皮癣通常会伴随多种并发症。其中,包括牛皮癣患者产生的特异性关节炎即牛皮癣关节炎。这种牛皮癣目前还没有能够直接预防发病的方法,预防其恶化就是最佳的方法。各种统计表明,接受牛皮癣诊断的患者数量在全球约占3%,国内约占1-2%。其中,约有三分之一的患者属于几乎不可能治愈的重症牛皮癣患者。特别是,据健康保险审查评估院的资料显示,2013年一年时间国内就有163936人因患牛皮癣而接受治疗。虽然目前尚未准确查明牛皮癣的病因,但是最近的研究表明,皮肤上的免疫细胞即t细胞的活性增加之后,其结果导致t细胞分泌的细胞因子(cytokine)刺激表皮細胞引起表皮細胞过度繁殖和炎症,因此免疫异常与基因变异成为现在主要的研究领域。此外,研究证明,环境因素、药物、持续性皮肤刺激、皮肤干燥、上呼吸道炎症、精神压力等也会引发牛皮癣或者使之恶化。目前,用于牛皮癣治疗的方法有很多,为了寻求更加有效的治疗方法,研究人员正在尝试各种方法,包括:将药物直接涂抹在皮肤上的局部治疗、利用光线的光疗、服用免疫抑制剂或者类固醇制剂药物的全身治疗、以及将这些治疗方法根据患者的情况综合运用而实施综合治疗等多种方法,一般根据牛皮癣的严重程度、活性度、病变的形态与状态、发生部位等因素确定治疗方法。同时,患者的年龄、治疗接近可能性(approachpossibility)与精神状态等也是非常重要的因素。在症状较轻的情况下,开始大多采用涂药的方式进行治疗。如果属于重症情况,一般就同时辅以光疗或者服药的方法进行治疗。另外,最近正在将通过多项研究开发的生物制剂用于临床测试验证其稳定性。实际上,也可以将生物制剂对患者使用。但是,现有治疗方法大部分都只能够缓解病情,而不能够从根本上进行彻底治疗。特别是,目前还没有针对牛皮癣患者的定制型疗法或靶向疗法。因此,有必要针对牛皮癣实施有效的诊断及治疗,为了开发用于牛皮癣的机理研究与治疗方法研究的生物样本,就需要合适的动物模型。虽然这方面的研究正在积极开展(韩国公开专利10-2010-0021561),但是目前尚处于不成熟的阶段。发明的详细说明技术问题本发明就是为解决上述问题而研发的,本发明人不仅确认能够将通过给药强力霉素使peli1基因过表达形成转基因的小鼠用作治疗重症牛皮癣的动物模型,而且确认peli1蛋白的过表达可以会诱发牛皮癣,因此peli1蛋白表达或活性抑制剂可用于牛皮癣的预防、改善、抑制或治疗,以基质蛋白的fha结合基序(motive)为靶标源于peli1fha结构域的肽会妨碍peli1蛋白的正常基质结合,由此确认可以将其用作新的治疗剂。在此基础上,完成了本发明。因此,本发明的一个目的在于,提供一种使peli1(pellino同系物1)基因过表达形成转基因的诱发牛皮癣动物模型及诱发所述牛皮癣动物模型的制作方法。本发明的另一个目的在于,提供一种利用所述动物模型筛选牛皮癣治疗剂的方法。本发明的另一个目的在于,由于利用最常用处方牛皮癣全身治疗剂即免疫抑制剂或者类固醇制剂可以有效治疗由peli1蛋白过表达诱发的牛皮癣,因此可以提供一种将peli1用于牛皮癣治疗剂开发治疗靶标的方法。本发明的另一个目的在于,提供一种由从序列号5至序列号11形成的组中选择的任意一个氨基酸序列构成的肽及以所述肽为有效成分的牛皮癣预防或治疗用药物组合物。本发明的另一个目的在于,提供一种以细胞渗透性肽与由从序列号5至序列号11形成的组中选择的任意一个氨基酸序列构成的肽连接为特征的peli1结合活性抑制肽和以所述peli1结合活性抑制肽为有效成分的牛皮癣预防或治疗用药物组合物。本发明的另一个目的在于,提供一种包含用于测定peli1蛋白表达水平的制剂的牛皮癣诊断用组合物。但是,本发明所要解决的技术问题并非仅限定于以上提供的课题,本领域的技术人员可以通过以下说明内容对尚未提到的其它课题有一个明确的了解。解决问题方法为了实现上述目的,本发明提供一种使peli1(pellino同系物1)基因过表达形成转基因的诱发牛皮癣动物模型。作为本发明的一个实现例,所述peli1基因会随着强力霉素的给药而进行过表达。作为本发明的另一实现例,所述peli1基因由序列号1的碱基序列构成。另外,本发明提供一种包括以下步骤的诱发牛皮癣动物模型制作方法:(a)将包含peli1(pellino同系物1)基因的表达载体引入宿主动物受精卵的步骤;(b)使所述引入的受精卵在代母的子宫内着床、分娩,获得第1代后代动物的步骤;(c)让所述获得的第1代后代动物与rtta(反向四环素反式激活因子)模型动物交配获得第2代后代动物的步骤。另外,本发明提供一种包括以下步骤的牛皮癣治疗剂筛选方法:a)将所述动物模型用候选物质处理的步骤;b)将用所述候选物质处理的动物模型进行饲养,并确认预后的步骤。另外,本发明提供一种以peli1(pellino同系物1)蛋白表达或活性抑制剂为有效成分的牛皮癣预防或治疗用药物组合物。作为本发明的一个实现例,所述peli1蛋白可以用由序列号1的碱基序列构成的多核苷酸编码。作为本发明的另一实现例,所述peli1蛋白由序列号2的氨基酸序列构成。作为本发明的另一实现例,所述peli1蛋白的表达抑制剂可以是从由与peli1基因的mrna互补结合的反义核苷酸、小干扰rna(shortinterferingrna)、短发夹rna(shorthairpinrna)及核酶(ribozyme)构成的组中选择的任意一种。作为本发明的另一实现例,所述peli1蛋白的活性抑制剂可以是从由与所述peli1蛋白互补结合的化合物、肽、肽模拟物、基质类似物、适体及抗体构成的组中选择的任意一种。另外,本发明提供一种由从序列号5至序列号11形成的组中选择的任意一个氨基酸序列构成的肽。作为本发明的一个实现例,所述肽能够抑制peli1蛋白与基质蛋白之间的结合。另外,本发明提供一种以细胞渗透性肽与由从序列号5至序列号11形成的组中选择的任意一个氨基酸序列构成的肽连接为特征的peli1结合活性抑制肽。作为本发明的另一实现例,所述peli1结合活性抑制肽通过gs连接子连接。作为本发明的另一实现例,所述细胞渗透性肽可以是从由聚精氨酸(polyarginines)、tat49-57、穿透素(penetratin)、pep-1、转运蛋白(transportan)、nls(核定位序列(nuclearlocalizationsequence))及hp4构成的组中选择的任意一种。另外,本发明提供一种以所述肽或peli1结合活性抑制肽为有效成分的牛皮癣预防或治疗用药物组合物。另外,本发明提供一种包括向个体给药所述药物组合物步骤的牛皮癣治疗方法。另外,本发明提供一种所述药物组合物的牛皮癣预防或治疗用途。另外,本发明提供一种对用于制造牛皮癣治疗用组合物的peli1(pellino同系物1)蛋白质进行编码的基因新用途。另外,本发明提供一种包含用于测定peli1蛋白表达水平的制剂的牛皮癣诊断用组合物。另外,为了提供诊断牛皮癣所需信息,本发明提供一种从个体样本中检测peli1蛋白的方法。另外,本发明提供一种所述peli1蛋白的牛皮癣诊断用途。发明的效果依据本发明的转基因动物模型,通过给药强力霉素使peli1(pellino同系物1)基因过表达,可以确认牛皮癣患者出现的表型与类似性表现。为了开发用于研究牛皮癣有效治疗方法的生物样本,可以对动物模型进行设计,并可以将其用于对治疗牛皮癣的候选药物进行筛选等临床研究中。另外,通过抑制peli1蛋白表达或活性,可以具体确认牛皮癣的预防、改善、抑制或治疗可能性。通过以干扰基质蛋白与peli1蛋白之间正常基质结合的fha结合基序为靶标源于peli1fha结构域的肽,可以有效应用于治疗牛皮癣相关疾病的新药研发。此外,通过确认所述peli1蛋白的表达水平,可以有效应用于对牛皮癣患者的疾病程度进行评估。附图简单说明图1a是是概略显示通过给药强力霉素使peli1过表达的诱导peli1表达小鼠(强力霉素诱导的peli1转基因小鼠)制作过程的模式图;图1b是通过pcr对给药强力霉素后peli1是否过表达形成转基因进行确认的结果示意图;图2是通过免疫印迹法对给药强力霉素诱导peli1表达小鼠各组织中peli1蛋白表达进行确认的结果示意图;图3a是通过肉眼观察对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后导致的自发性病变诱导效果进行比较的结果示意图;图3b是对出现所述图3a所示表型的小鼠比例进行计算的结果示意图;图3c是对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后导致的病变水平进行评分的结果示意图;图4a是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而通过h&e染色对皮肤层的结果进行比较的结果示意图;图4b是为了确认peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后导致诱导peli1过表达的细胞而利用peli1抗体与牛皮癣疾病标签蛋白即牛皮癣素(psoriasin)抗体进行免疫染色的结果示意图;图4c是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用基底层的标志物k14、棘细胞层的标志物k10、颗粒层的标志物兜甲蛋白(loricrin)的抗体进行免疫染色并对皮肤层发育变化进行比较的结果示意图;图4d是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用ki67与k14的抗体进行免疫染色并对基底层细胞的增殖能力进行比较的结果示意图;图4e是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用cd31抗体进行免疫染色并对血管生成变化进行比较的结果示意图;图4f是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用cd3抗体进行免疫染色并对t细胞的浸润变化进行比较的结果示意图;图4g及图4h是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而对皮肤病变周边的淋巴结变化进行比较的结果示意图;图4i是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用流式细胞分析法对淋巴结中免疫细胞的激活情况进行比较的结果示意图;图4j与图4k是以坐标图形式显示所述图4i结果的示意图;图4l是根据给药强力霉素情况对所述图4i结果中被激活的t细胞比例进行比较的示意图;图5a是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用淋巴结cd3+t细胞的cdna通过定量逆转录聚合酶链式反应对ifnγ、il-4、il-22、il-23等细胞因子的水平进行比较的结果示意图;图5b是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用il-17的抗体进行免疫染色的结果示意图;图5c是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药强力霉素后是否诱发牛皮癣而利用il-23的抗体进行免疫染色的结果示意图;图6a是通过肉眼观察对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药及清除强力霉素导致的自发性病变诱导效果进行比较的结果示意图;图6b是对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药及清除强力霉素导致的病变水平进行评分的结果示意图;图6c是为了验证peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药及清除强力霉素是否诱发牛皮癣而通过h&e染色对皮肤层的结构进行比较的结果示意图;图7a是为了确认peli1蛋白表达受到抑制时牛皮癣诱发是否被抑制而对正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)使用咪喹莫特(imiquimod)诱导牛皮癣模型的模式图;图7b是通过肉眼观察对正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)用咪喹莫特(imiquimod,toll-样受体7/9激动剂)处理后产生的牛皮癣病变进行比较的结果示意图;图7c是对正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)用咪喹莫特处理后导致的牛皮癣病变水平进行评分的结果示意图;图7d是对正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)用咪喹莫特处理后的皮肤厚度进行测定并以坐标图形式显示的结果示意图;图7e是为了验证正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)用咪喹莫特处理4次后的牛皮癣病变水平而通过h&e染色对皮肤层的结构进行比较的结果示意图;图8a是为了对用于评估peli1诱导表达小鼠(rtta-peli1)治疗药效果的临床前(preclinical)动物模型进行验证,对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药12周强力霉素后,再通过腹腔注射给药现有牛皮癣全身治疗剂即环孢霉素(cyclosporine,csa)与甲氨蝶呤(methotrexate,mtx)的模式图;图8b是对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药12周强力霉素后,再在一定期限内通过腹腔注射免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx),然后为了对牛皮癣病变水平进行比较,而通过h&e染色对皮肤层的结构进行比较的结果示意图;图8c是对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药12周强力霉素后,再在一定期限内通过腹腔注射免疫抑制剂即环孢霉素(csa)与甲氨蝶呤(mtx),然后对牛皮癣病变水平进行评分的结果示意图;图8d是对peli1诱导表达小鼠(rtta-peli1)与对照组小鼠(rtta)给药12周强力霉素后,再在一定期限内通过腹腔注射免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx),然后对皮肤厚度进行测定并以坐标图形式显示的结果示意图;图9a是概略显示为了抑制peli1mrna中蛋白质的合成而对靶标mrna序列进行确认后而据此制作shrna的过程示意图;图9b是将通过所述7a制作的shrna注入细胞内并通过免疫印迹法确认peli1蛋白表达是否被抑制的结果示意图;图10是概略显示抑制peli1结合活性的肽制作及所述肽抑制peli1结合活性过程的示意图;图11a是概略显示抑制peli1结合活性的肽制作过程的示意图;图11b是为了提高细胞渗透力而通过荧光染色对抑制结合有细胞穿膜肽的peli1结合活性的肽细胞渗透力进行确认的结果示意图;图11c是用peli1结合活性抑制肽处理后通过免疫印迹法对toll-likereceptor(tlr)信号传导激活效果进行比较的结果示意图。发明的最佳实施方式本发明人为了开发适合用于牛皮癣治疗剂研发的动物模型,经过了不懈的研究。最终,对通过给药强力霉素使peli1基因过表达形成转基因的小鼠牛皮癣患者出现的表型与类似性表现予以确认。在此基础上,完成了本发明。下面,将对本发明进行详细说明。本发明提供一种通过给药强力霉素使peli1(pellino同系物1)基因过表达形成转基因的诱发牛皮癣动物模型。另外,本发明提供一种包括以下步骤的诱发牛皮癣动物模型制作方法:(a)将包含peli1(pellino同系物1)基因的表达载体引入宿主动物受精卵的步骤;(b)使所述引入的受精卵在代母的子宫内着床、分娩,获得第1代后代动物的步骤;(c)让所述获得的第1代后代动物与rtta(反向四环素反式激活因子)模型动物交配获得第2代后代动物的步骤。本发明的术语“peli1(pellino同系物1)基因”,是指对因“e3泛素连接酶”这个名称而被大家广为熟知的pellino同系物1蛋白质进行编码的基因。如果是人,则存在于2号染色体内;如果是小鼠,则存在于11号染色体内。所述蛋白质或基因的具体碱基序列及蛋白质信息已由ncbi公布(ncbi参考序列:np_065702,nm_020651)。本发明中,peli1基因采用了序列号1的多核苷酸。在本发明中,所述动物的种类,包括:小鼠、大鼠、牛、马、猪、猴子、鸭子、狗、猫等,最好选用小鼠,但并非仅限定于此。在本发明的一个实施例中,先制作通过给药强力霉素使peli1基因过表达形成转基因的动物模型(参照实施例1),然后验证所述动物模型给药强力霉素后是否诱导自发性病变。结果表明,与对照组相比,当持续给药强力霉素时,就会自发地产生病变。特别是,观察到其皮毛的光泽消失,并出现脱毛现象。同时,皮肤还出现了非正常的变化(参照实施例4)。另外,在本发明的另一实施例中,利用制作的动物模型开展了诱发牛皮癣验证。结果表明,与对照组相比,当持续给药强力霉素时,表皮細胞层变厚,表皮层的血管生成增加,t细胞对皮肤层的浸润增强。同时,在皮肤病变周边的淋巴结内,免疫细胞出现了非正常激活及辅助t(helpert细胞)反应,由此确认与牛皮癣的表型(phenotype)非常类似(参照实施例5)。这种牛皮癣的表型在以下两种情况下会消失,一是停止给药强力霉素后peli1的表达降低到正常水平时;二是正常的peli1表达被抑制时(参照实施例6)。另外,当将现有用作牛皮癣全身治疗剂的免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)按一定周期通过腹腔给药时,牛皮癣的表型就会得到缓和。由此,利用临床前(preclinical)动物模型对诱发牛皮癣情况进行了验证(参照实施例7)。因此,依据本发明的动物模型可以有效应用于牛皮癣的治疗及研究。由此,作为本发明的另一形态,本发明提供一种利用通过上述方法制作的动物模型对牛皮癣治疗剂进行筛选的方法。所述筛选方法,包括:a)将所述动物模型用候选物质处理的步骤;b)将用所述候选物质处理的动物模型进行饲养,并确认预后的步骤。所述候选物质最好从由天然化合物、合成化合物、rna、dna、多肽、酶、蛋白质、配体、抗体、抗原、细菌或真菌的代谢产物及生物活性分子构成的组中选择任意一种,但并非仅限定于此。另外,通过制作诱发牛皮癣动物模型,对peli1蛋白过表达导致的牛皮癣诱发可能性进行了确认。peli1蛋白表达或活性抑制剂可以用作有助于对牛皮癣进行预防、改善、抑制或治疗的组合物有效成分。因此,作为本发明的另一形态,本发明提供一种以peli1(pellino同系物1)蛋白表达或活性抑制剂为有效成分的牛皮癣预防或治疗用药物组合物以及利用该组合物的牛皮癣治疗方法。在这种情况下,本发明中,peli1蛋白由序列号2的氨基酸序列构成。本发明中使用的术语,“预防”"是指通过给药本发明的药物组合物抑制牛皮癣或者延迟发病的所有行为。本发明使用的术语,“治疗”是指通过给药本发明的药物组合物使牛皮癣症状好转或者朝有利的方向发展的所有行为。在本发明中,peli1蛋白表达抑制剂可以从由与peli1基因的mrna互补结合的反义核苷酸、sirna、shrna及核酶(ribozyme)构成的组中选择,但并非仅限定于此。在本发明中,peli1蛋白活性抑制剂最好从由与所述peli1蛋白互补结合的化合物、肽、肽模拟物、基质类似物、适体及抗体构成的组中选择任意一种,但并非仅限定于此,抑制peli1蛋白活性的所有药物都可以使用。在本发明中,“肽模拟物(peptidemimetics)”作为通过抑制peli1蛋白结合结构域而抑制peli1蛋白活性的物质,所述肽模拟物可以是肽或非肽,也可以由通过psi结合等非肽结合方式结合的氨基酸构成。在本发明中,“适体(aptamer)”作为单链dna或rna分子,可以通过一种利用被称作“selex(指数富集的配体系统进化技术(systematicevolutionofligandsbyexponentialenrichment))”的寡核苷酸文库的调优法,将具有较高化合力和筛选力与特定化学分子或者生物分子结合的低聚物分离而获得。适体可以特定与靶标结合,从而对靶标的活性进行调整。例如:可以通过结合将靶标发挥功能的能力阻断。在本发明中,“抗体”可以特定与peli1蛋白直接结合,从而有效抑制peli1蛋白的活性。特定与所述peli1蛋白结合的抗体最好使用多克隆(polyclonal)抗体或单克隆(monoclonal)抗体。特定与所述peli1蛋白结合的抗体既可以采用本领域的技术人员都熟悉的方法制作,也可以采购商业领域广为人知的peli1蛋白抗体进行使用。另外,peli1蛋白具有ring-样(ring-like)结构域,因此可以发挥e3泛素连接酶的作用。即,peli1蛋白通过多种蛋白质翻译后修饰(posttranslationalmodificationofprotein)而被激活,从而发挥e3泛素连接酶的作用,并通过fha结构域与靶标蛋白质结合。因此,以基质蛋白的fha结合基序为靶标源于peli1fha结构域的肽会抑制peli1蛋白的正常基质结合,从而可以将其作为新型治疗剂使用。在本发明的另一实施例中,对通过fha结构域与靶标蛋白质之间的结合情况进行了确认。由此,为了抑制peli1蛋白与靶标蛋白质之间的结合,制作了源于peli1蛋白fha结构域的肽(参照实施例9)。因此,作为本发明的另一形态,本发明提供一种由从序列号5至11形成的组中选择的任意一个氨基酸序列构成的肽及包含所述肽的牛皮癣预防或治疗用药物组合物。在本发明中,所述肽心fha结合基序为靶标,可以抑制peli1蛋白与基质蛋白之间的结合。另外,所述肽也可以与容易渗透到细胞内的细胞穿膜肽(cell-penetratingpeptide)连接。在这种情况下,所述细胞穿膜肽可以使用从由聚精氨酸、tat49-57、穿透素、pep-1、转运蛋白、核定位序列及hp4构成的组中选择的任意一种。优选地,可以使用hp4,但并非仅限定于此。下面,为了有助于加深对本发明的理解,并列举理想的实施例。但是,列举下述实施例的目的在于,以便更容易对本发明进行理解,并不是为了通过下述实施例限定本发明的内容。[实施例]实施例1.实验准备及实验方法1-1.动物实验(animalexperiment)所有动物实验均利用经设立在成均馆大学医学院(sungkyunkwanuniversityschoolofmedicine;susm)的动物实验伦理委员会(theinstitutionalanimalcareandusecommittee;iacuc)批准的协议进行实验。成均馆大学医学院(susm)依据国际实验动物评估管理人认证协会(associationforassessmentandaccreditationoflaboratoryanimalcareinternational;aaalacinternational)与实验动物中心(theinstituteoflaboratoryanimalresources;ilar)的指导原则(guidelines)进行所有动物实验。1-2.基因型分析(genotyping)从通过给药强力霉素诱导peli1的peli1诱导表达小鼠(强力霉素诱导的peli1转基因小鼠)尾巴内提取基因组dna(gdna)后,为了确认是否形成转基因,而实施了聚合酶链式反应(pcr)。以gdna为模型使用引物,在teto&peli1的情况下,按照95℃30秒、55℃30秒、72℃1分钟的原则总共执行了4次操作之后,再按照95℃30秒、58℃1分钟、72℃1分钟的原则总共执行了34次rt-pcr。另外,在r26与rtta的情况下,按照95℃30秒、65℃1分钟、72℃1分钟的原则总共执行了34次pcr。在这种情况下,所用引物(primer)的具体序列如下:1)teto&peli1引物序列:正向引物(cmvteto-1)5'-aagtgaaagtcgagctcg-3'(序列号12)、逆向引物(peli11/3length)5'-tgatatcgtgtgctggtctttg-3'(序列号13)。2)r26&rtta引物序列:(1)正常小鼠(wt)-r26(f)与r26(r);正向引物5'-aaagtcgctctgagttgttat-3'(序列号14),逆向引物5'-ggagcgggagaaatggatatg-3'(序列号15);(2)转基因小鼠(tg)-r26(f)和rtta(r);正向引物5'-aaagtcgctctgagttgttat-3'(序列号16),逆向引物5'-gcgaagagtttgtcctcaacc-3'(序列号17)。从pcr反应的产物中取10μl,在溴化乙锭(etidiumbromide)存在的情况下,利用1%琼脂糖凝胶执行电泳,并对电泳条带进行了观察。1-3.免疫印迹法为了通过给药强力霉素确认myc-peli1表达的小鼠中peli1蛋白的表达,将对照组(-/rtta)小鼠与实验组(myc-peli1/rtta)小鼠以强力霉素(2mg/ml)饲养2周后进行了相关实验。分别向脏器碎片中加入裂解缓冲液(裂解缓冲液;150mmnacl,20mmhepes,5mmedta,0.5%诺乃洗涤剂(nonidet)p-40,1mm苯甲基磺酰氟,10mmnaf,1mmna3vo4,1mm二硫苏糖醇,以及蛋白酶抑制剂混合物),再利用组织粉碎器(homogenizer)进行均质化处理。然后,利用超高速离心分离机(14,000rpm,30min,4℃)进行分离。获得上清液的提取物之后,再采用bradford定量方法对蛋白质进行定量处理。将50μg脏器提取物利用8%sds-page执行电泳使其发生转移(利用硝化纤维素膜),利用混入有5%乳液的tbs-t缓冲液(100mmnacl,20mmtris-hclph7.4,0.05%tween-20)进行阻塞(blocking)之后,再利用3%bsa(包含tbs-t的溶液)将抗-myc(roche;1:2,000稀释),抗-peli1(santacruz;1:2,000稀释)或抗-β-肌动蛋白(sigma;1:4,000稀释)抗体在4℃条件下反应12小时以上,接着利用tbs-t缓冲液经过3次洗涤(洗涤;3次,10min,rt)之后,再将附着有hrp的2次抗体利用封闭液按照1:3,000的比例进行稀释,在常温条件下反应2小时。接着再利用tbs-t经过3次洗涤(洗涤;3次,10min,rt)之后,再利用ecl溶液诱导发光,从而通过x-线膜完成感光。1-4.流式细胞分析(flowcytometry)从小鼠的淋巴结(lymphnodes)中获得细胞,将红细胞(erythrocytes)去除之后,再利用以下抗体进行染色。具体讲,就是利用抗-cd3叶绿素蛋白cy5.5,抗-cd4pecy7,抗-cd8pe,抗-cd122apc,抗-cd44fitc,抗-cd62lapccy7对细胞进行染色后,再通过抗体的荧光,并利用流式细胞分析设备即cantoii流式细胞仪(bdbioscience)进行分析。1-5.组织病理(histopathology)小鼠的组织利用10%中性缓冲福尔马林进行固定(fixation),制作出石蜡块(paraffinblock)。从所述石蜡块中获得3μm厚的切片后,实施了苏木精&伊红(h&e)染色。在采用免疫组织化学法(immunohistochemistry)的情况下,利用抗-k14抗体,抗-ki67抗体,抗-cd31抗体,抗-cd3抗体实施了染色。接着,在完成染色之后,再利用含有dapi试剂的封固剂进行密封,利用显微镜[axiocam数码显微镜照相机及axiovision图像处理软件(carlzeiss)]获得了染色的组织样本经过染色后的图像。实施例2.制作peli1诱导表达转基因小鼠采用下述方法制作出了通过给药强力霉素使peli1(pellino同系物1)基因过表达的转基因动物模型,图1a中显示了制作方法的概略性模式图。具体讲,将克隆有标记了myc抗原表位的人peli1基因的载体(参照图1a)通过显微给药(microinjection)方式注入受精卵(1-细胞胚芽)内,制作出了转基因小鼠。完成显微给药后,再通过所述实施例1-2中记载的基因型分析(genotyping)方法对teto(四环素反应性原件(tetracycline-responsiveelement))myc-peli1转基因小鼠进行了筛选。筛选的小鼠与r26-rtta(反向四环素反式激活因子(reversetetracyclinetransactivator))小鼠交配后获得下一代转基因小鼠(强力霉素诱导的teto-myc-peli1转基因小鼠),然后通过所述实施例1-2中记载的聚合酶链式反应(polymerasechainreaction,pcr)确认是否形成转基因。其结果如图1b所示,确认获得了myc-peli1与rtta同时表达的转基因小鼠。实施例3.验证peli1诱导表达转基因小鼠的peli1表达水平对通过给药所述实施例2中制作的强力霉素使peli1过表达的peli1诱导表达小鼠组织中蛋白质水平的myc-peli1表达进行了确认。为此,给对照组(-/rtta)小鼠与实验组(myc-peli1/rtta)小鼠给药2周强力霉素(2mg/ml)后,获得了多种组织。具体讲,通过所述实施例1-3中记载的免疫印迹法(westernblotting)确认了对照组(-/rtta)小鼠与实验组(myc-peli1/rtta)小鼠的大脑(brain)、肺(lung)、心脏(heart)、胸腺(thymus)、胃(stomach)、小肠(smallintestine)、附睾(epididymis)、大肠(colon)、肾脏(kidney)、皮肤(skin)、睾丸(testis)、前列腺(prostate)、胰腺(pancreas)、肝脏(liver)、脾脏(spleen)、淋巴结(lymphnodes)、骨髓(bonemarrow)中myc-peli1的表达。其结果如图2所示,肺(lung)、胸腺(thymus)、胃(stomach)、附睾(epididymis)、大肠(colon)、肾脏(kidney)、前列腺(prostate)、胰腺(pancreas)、肝脏(liver)、脾脏(spleen)、淋巴结(lymphnodes)、骨髓(bonemarrow)等处的myc-peli1表达水平较高。相反,大脑(brain)、心脏(heart)、小肠(smallintestine)、皮肤(skin)、睾丸(testis)等处的myc-peli1表达水平较低或者几乎没有表达。实施例4.验证peli1诱导表达转基因小鼠给药强力霉素是否诱导自发性病变首先,给对照组(rtta)小鼠与实验组(rtta-peli1)小鼠通过饮水(drinkingwater)投喂24周强力霉素(2mg/ml)之后,再通过肉眼观察确认发生了病变,其结果如图3a所示,当持续给peli1诱导表达小鼠(rtta-peli1)投喂强力霉素时,就会自发性地产生病变。特别是,观察到其皮毛的光泽消失,并出现脱毛现象。同时,皮肤还出现了非正常的变化。然后,对出现上述表型的小鼠比例进行了测定,其结果如图3b所示,当所有小鼠的peli1因投喂强力霉素而过表达时,就会产生上述病变。然后,给对照组(rtta)小鼠与实验组(rtta-peli1)小鼠投喂24周强力霉素之后,对出现的表型变化进行了评分。在这种情况下,分数是根据下述表1中记载的标准进行评分的,其结果如图3c所示,随着强力霉素投喂时间的延长,其分数就会持续增加。[表1]从上述结果可以看出,上述病变是由于peli1的过表达而自发性地诱导产生的。实施例5.peli1诱导表达转基因小鼠的牛皮癣诱发验证为了确认所述实施例2中制作的peli1诱导表达转基因小鼠是否诱发牛皮癣,进行了以下实验。5-1.确认表皮細胞层变化首先,给对照组(rtta)小鼠与实验组(rtta-peli1)小鼠通过饮水(drinkingwater)投喂24周强力霉素(2mg/ml)之后,再通过所述实施例1-5中记载的苏木精&伊红(h&e)染色对皮肤层的结构进行了确认,其结果如图4a所示,对照组(rtta)小鼠形成了正常的皮肤层,相反,实验组(rtta-peli1)小鼠却观察到出现了非正常的病变。特别是,不仅表皮层细胞(epidermalcell)的层数大大增加,而且牛皮癣患者的皮肤层结构中还观察到了常见的角化不全(parakeratosis)、角化过度(hyperkeratosis)、表皮突(reteridge)、微脓疡(microabscess)等表型。通过上述结果可以确认,peli1诱导表达小鼠出现了牛皮癣的表型(phenotype)。另外,给对照组(rtta)小鼠与实验组(rtta-peli1)小鼠通过饮水(drinkingwater)投喂24周强力霉素(2mg/ml)之后,为了确认peli1蛋白是否在皮肤层过表达,利用peli1抗体进行了组织免疫染色,其结果如图4b所示,确认peli1蛋白在实验组(rtta-peli1)小鼠的皮肤层过表达。另外,利用牛皮癣疾病标签蛋白即牛皮癣素(psoriasin)抗体进行了组织免疫染色。结果观察到,投喂强力霉素的实验组(rtta-peli1)小鼠非常明显地诱导牛皮癣素表达。然后,确认了以下情况,即如果通过所述图4a所示方法给peli1诱导表达小鼠持续投喂强力霉素,则与对照组不同,其表皮細胞层出现非正常的增厚。按照所述实施例1-5中记载的方法,利用构成表皮层的基底层标志物k14、棘细胞层标志物k10、颗粒层标志物兜甲蛋白的抗体进行了免疫染色,并对染色的图像进行了确认,其结果如图4c所示,与对照组(rtta)小鼠相比,确认实验组(rtta-peli1)小鼠表皮层的基底层与棘细胞层增厚非常明显。然后,为了确认peli1诱导表达小鼠非正常增加的基底细胞的增殖能力,按照所述实施例1-5中记载的方法,将可以确认细胞增殖的标志物ki67一起进行染色,并对染色的图像进行了确认,其结果如图4d所示,与对照组(rtta)小鼠相比,确认实验组(rtta-peli1)小鼠增殖中的基底细胞数量增加了。通过所述结果,可以确认peli1诱导表达小鼠(rtta-peli1)增殖中的基底细胞数量非正常增加,由此导致表皮細胞层增厚。5-2.确认表皮层的血管生成变化在牛皮癣患者出现的表型中,出现了表皮层非正常增厚的特征,同时真皮层(dermallayer)非常显明地出现了血管非正常生成,而且还出现了血管扩张现象。为了对此进行确认,首先按照所述实施例1-5中记载的方法,利用毛细血管的标志物即cd31抗体实施了染色,其结果如图4e所示,可以确认,与对照组(rtta)小鼠相比,实验组(rtta-peli1)小鼠的血管生成非常明显,而且还出现了血管扩张现象。5-3.确认免疫细胞激活变化作为牛皮癣患者出现的表型之一,免疫细胞的浸润非常明显。而且,最近的研究表明,牛皮癣是由t细胞的非正常活性诱导的。因此,在皮肤层观察到了t细胞的浸润。为了对此进行确认,首先按照所述实施例1-5中记载的方法,利用t细胞的标志物即cd3抗体实施了染色,其结果如图4所示,可以确认,与对照组(rtta)小鼠相比,t细胞对实验组(rtta-peli1)小鼠皮肤层的浸润明显增加。然后,可以通过所述图4f中的结果对诱导发生非正常免疫反应的情况进行预测,由此对皮肤病变周边的淋巴结进行了确认。进一步讲,就是将存在于皮肤层附近的腹股沟(inguinal)、腋窝(axillary)、胳膊(brachial)、颈部(cervical)周边的淋巴结分离,并通过所述实施例1-5中记载的h&e染色对结构进行了确认,其结果如图4g及4h所示,与对照组(rtta)小鼠相比,存在于实验组(rtta-peli1)小鼠病变周边的淋巴结变大了。同时,淋巴结还变黑了。由此可知,免疫细胞的活性增加导致窦(sinus)的非正常形成增加。然后,通过所述图4g及4h中的结果确认皮肤病变周边的淋巴结变大了。这种淋巴结中免疫细胞的激活是采用所述实施例1-4中记载的流式细胞分析法进行确认的。进一步讲,将淋巴结中的免疫细胞分离,利用cd44、cd62l、cd122抗体对t细胞中cd4+t细胞的活性进行了确认,其结果如图4i所示,与对照组(rtta)小鼠相比,实验组(rtta-peli1)小鼠灭活(幼稚的)t细胞(cd62l+/cd44-)的比例减少了,激活(activated)t细胞(cd62l+/cd44高-低,cd62l-/cd44高,cd122+/cd44+)的比例增加了。另外,将所述图4i中的结果通过坐标图表现出来进行分析,其分析结果如图4j所示,虽然不能观察到构成淋巴结的t细胞比例存在差异,但是通过细胞数量进行比较,结果表明,不仅peli1诱导表达小鼠(rtta-peli1)总的免疫细胞数量增加了,而且cd3+、cd4+、cd8+t细胞数量大幅增加。另外,利用坐标图对激活的t细胞比例与数量进行分析,结果表明,如图4k及图4l所示,peli1诱导表达小鼠(rtta-peli1)淋巴结总的免疫细胞数量增加了。因此,灭活、激活t细胞数量增加了,但是对其比例进行确认的结果表明,激活细胞相对灭活细胞的比例增加了。由此可知,依据本发明的peli1诱导表达小鼠(rtta-peli1)的免疫细胞被非正常激活。5-4.t确认细胞的辅助性t反应变化根据现有报告,牛皮癣动物模型及患者被诱导产生非正常辅助性t反应。因此,利用淋巴结cd3+t细胞的cdna将ifnγ、il-4、il-22、il-23等细胞因子的水平通过定量逆转录聚合酶链式反应进行了比较,其结果如图5a所示,可以确认,1型辅助性t反应中分泌的细胞因子ifnγ与17型辅助性t反应中分泌的细胞因子il-22、il-23大幅增加了。另外,为了确认是否也在皮肤层诱导产生非正常辅助性t反应,通过实施例1-5中记载的免疫染色法利用il-17与il-23的抗体进行了实验,其结果如图5b和图5c所示,可以确认,与对照组小鼠(rtta)相比,peli1诱导表达小鼠(rtta-peli1)中被il-17或il-23的抗体染色的细胞数量大幅增加了。这与牛皮癣出现的表型非常类似。由此可以确认,不仅依据本发明的peli1诱导表达小鼠(rtta-peli1)的免疫细胞被非正常激活,而且还产生了非正常辅助性t反应。5-5.与牛皮癣患者出现的病变之间的类似性比较以通过所述实施例5-1至5-4对peli1诱导表达小鼠(rtta-peli1)出现的多种病变进行分析的结果为基础,与牛皮癣患者出现的表型进行了类似性比较,其结果如下述表2所示,可以确认,牛皮癣患者出现的表型与依据本发明的peli1诱导表达小鼠(rtta-peli1)出现的表型非常类似。[表2]实施例6.验证peli1作为新型牛皮癣治疗靶标的可行性以所述实施例4及实施例5中的结果为基础,对peli1蛋白过表达导致的诱发牛皮癣可能性进行了确认。为了确认通过抑制peli1蛋白表达对牛皮癣疾病实施治疗的可行性而进行了以下实验。6-1.确认通过强力霉素给药治疗牛皮癣的可行性在一定期限内,给对照组小鼠(rtta)与实验组小鼠(rtta-peli1)给药强力霉素,当出现牛皮癣的表型时,再清除给药的强力霉素,当peli1的表达降至正常水平时,对牛皮癣的表型进行了分析,其结果如图6a所示,可以确认,如果在5个月的时间内持续给药强力霉素,peli1诱导表达小鼠(rtta-peli1)就会出现牛皮癣的表型,相反,当给药3个月强力霉素之后就将强力霉素清除时,牛皮癣的表型就会消失,出现与对照组小鼠(rtta)非常类似的表型。接着,给对照组(rtta)小鼠与实验组(rtta-peli1)小鼠给药12周强力霉素。然后,重新执行强力霉素的给药及清除,并对出现的表型变化进行了评分,其结果如图6b所示,可以确认,在给药及清除强力霉素期间,分数继续增加及减少。为了根据所述图6a和图6b中的结果对皮肤层的结构进行确认,执行了所述实施例1-5中记载的苏木精&伊红(h&e)染色,其结果如图6c所示,给药强力霉素后,不仅peli1诱导表达小鼠(rtta-peli1)表皮细胞(epidermalcell)的层数增加非常明显,而且在牛皮癣患者的皮肤层结构中观察到了常的角化不全(parakeratosis)、角化过度(hyperkeratosis)、表皮突(reteridge)、微脓疡(microabscess)等表型。但是,在给药doxycyline之后清除的peli1诱导表达小鼠(rtta-peli1)皮肤层结构中观察到角化不全(parakeratosis)、角化过度(hyperkeratosis)、表皮突(reteridge)等表型消失,而且可以确认其与对照组小鼠(rtta)的皮肤层结构非常类似。由此确认,非正常增加的peli1表达可以诱导牛皮癣发病,当这种peli1的表达重新降至正常水平时,就会出现与正常情况非常类似的皮肤层表型,从而可以确认peli1作为新型牛皮癣治疗靶标的可行性。6-2.确认当peli1表达受到抑制时牛皮癣诱导决定的病变水平如所述实施例6-1所示,当非正常增加的peli1表达降至正常水平时,牛皮癣病变水平就会降至正常水平。为了确认正常水平下peli1表达受到抑制时牛皮癣诱导决定的病变水平,进行了以下实验。具体讲,对正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)利用给药tlr7与9的激动剂(agonist)即咪喹莫特(imq)的牛皮癣动物模型,进行了以下实验。即,每天使用62.5mg咪喹莫特对脱毛小鼠的背部进行处理(参照图7a)。其结果如图7b所示,可以确认,正常小鼠(wt)用咪喹莫特处理后,出现了红斑及角质等牛皮癣的表型,peli1表达抑制小鼠(peli1ko)虽然没有出现红斑,但是与正常小鼠(wt)相比,其角质的形成水平降低了。接着,将正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)用咪喹莫特处理之后,对牛皮癣表型变化进行了评分,其结果如图7c所示,可以确认,用咪喹莫特处理之后,正常小鼠(wt)的分数增加了,与之相比,peli1表达抑制小鼠(peli1ko)的分数比正常小鼠更低。为了根据所述图7b及图7c中的结果对皮肤层的结构进行确认,执行了所述实施例1-5中记载的苏木精&伊红(h&e)染色,其结果如图7d与图7e所示,可以确认,用咪喹莫特处理后,正常小鼠(wt)的皮肤厚度增加了,与正常小鼠相比,peli1表达抑制小鼠(peli1ko)的皮肤厚度却没怎么增加。另外,与正常小鼠(wt)相比,peli1表达抑制小鼠(peli1ko)表皮突(reteridge)的深度更浅,peli1表达抑制小鼠(peli1ko)角化过度(hyperkeratosis)也比正常小鼠(wt)更轻。由此,利用现有用咪喹莫特处理制作的牛皮癣动物模型,对正常小鼠(wt)与peli1表达抑制小鼠(peli1ko)牛皮癣病变的表型进行比较,结果表明,当peli1表达被抑制时,用咪喹莫特处理的牛皮癣病变水平比正常情况更低,从而可以再次确认,peli1能够作为牛皮癣治疗靶标。实施例7.验证peli1诱导表达小鼠的临床前牛皮癣动物模型用途以所述实施例4及实施例5中的结果为基础,对给peli1诱导表达小鼠给药强力霉素使peli1蛋白过表达导致的牛皮癣诱发可能性进行了确认,其目的在于,对peli1诱导表达小鼠作为用于牛皮癣治疗剂筛选及效果检验的临床前(preclinical)牛皮癣动物模型进行验证。为此,利用现有强效免疫抑制剂使牛皮癣疾病得到缓解,就用于牛皮癣患者的全身治疗剂即环胞霉素(csa)与甲氨蝶呤(mtx)的作用机理而言,在给药环胞霉素(csa)的情况下,通过抑制诱导t细胞活性的钙调磷酸酶(calcineurin)活性,抑制nfat的功能,并由此使特定细胞因子的分泌减少,从而抑制t细胞的活性。另外,在给药甲氨蝶呤(mtx)的情况下,抑制诱导上皮细胞的过度分裂、活性t细胞的细胞自杀及中性粒细胞的趋化性(chemotaxis)与特定细胞因子的分泌。上述实验的目的在于,对以下情况进行验证,给药环胞霉素(csa)与甲氨蝶呤(mtx)时,peli1诱导表达小鼠的牛皮癣表型是否得到缓解;是否可以将其用作临床前(preclinical)动物模型。为此,如图8a所示,给对照组小鼠(rtta)与实验组小鼠(rtta-peli1)给药一定期限(12周)强力霉素,当出现牛皮癣的表型时,环胞霉素(csa)每周给药6次,甲氨蝶呤(mtx)每周给药4次,均通过腹腔注射。然后,对牛皮癣的表型进行了分析。同时,为了确认皮肤层的结构,执行了所述实施例1-5中记载的苏木精&伊红(h&e)染色。其结果如图8b所示,可以确认,peli1诱导表达小鼠(rtta-peli1)的角化不全(parakeratosis)、角化过度(hyperkeratosis)、表皮突(reteridge)、微脓疡(microabscess)等表型在给药免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)之后,大部分都消失了。但是,即使给药免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)之后,仍然观察到表皮层细胞(epidermalcell)的增殖导致皮肤厚度增加。然后,给对照组小鼠(rtta)与实验组小鼠(rtta-peli1)给药一定期限(12周)强力霉素,当出现牛皮癣的表型时,将现有用于患者的治疗用免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)通过腹腔注射一定期限,然后对牛皮癣表型进行了评分。其结果如图8c所示,可以确认,当将免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)通过腹腔注射一定期限时,牛皮癣表型分数减少了。根据所述图8b中的结果,可以确认,当将免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)通过腹腔注射一定期限之后,大部分的牛皮癣表型都消失了,但是仍然观察到表皮层细胞(epidermalcell)的增殖导致的皮肤厚度增加,从而观察到了皮肤厚度的变化。其结果如图8d所示,可以确认,对因给药强力霉素而出现牛皮癣表型的peli1诱导表达小鼠通过腹腔注射一定期限的免疫抑制剂即环胞霉素(csa)与甲氨蝶呤(mtx)之后,皮肤的厚度减少了一半左右。由此,利用因给药强力霉素而出现牛皮癣表型的peli1诱导表达小鼠对牛皮癣治疗剂的效果进行验证,结果表明,牛皮癣疾病表型减少了,从而能够验证,peli1诱导表达小鼠可以作为用于新型牛皮癣治疗剂的筛选及效果检验的临床前(preclinical)动物模型。实施例8.制作peli1蛋白表达抑制剂以所述实施例6中的结果为基础,对通过抑制peli1蛋白表达治疗牛皮癣疾病的可行性进行了确认,为了抑制peli1mrna中的蛋白质合成,对靶标mrna序列进行了确认(参照图9a),以此为基础,制作了以下shrna及sirna。目标mrna序列#1:gggttcaacacactagcat(序列号3)目标mrna序列#2:gctcctttggatatgcaattt(序列号4)然后,将制作的shrna注入细胞内,通过所述实施例1-3中记载的免疫印迹法对peli1蛋白表达进行了确认,其结果如图9b所示,可以确认,将以peli1的mrna为靶标的shrna注入细胞内之后,有效抑制了peli1蛋白表达。实施例9.制作抑制peli1结合活性的肽9-1.制作peli1结合活性抑制肽peli1作为e3泛素连接酶,通过环(ring)-样结构域显示其作为连接酶的活性,通过fha结构域与靶标蛋白质进行结合。因此,为了抑制peli1与靶标蛋白质之间的结合,制作了源于peli1蛋白fha结构域的肽。[表3]源于fha结构域的肽序列95-114sntdmfqigrstespidfvv101-116qigrstespidfvvtd109-124pidfvvtdtvpgsqsn117-132tvpgsqsnsdtqsvqs125-140sdtqsvqstisrfacr133-149tisrfacriicernpp177-196dgqmdglttngvlvmhprng另外,为了使制作的肽容易渗透到细胞内,使其与细胞穿膜肽(cell-penetratingpeptide)连接。在这种情况下,所使用的细胞穿膜肽如下(参照图10):i)聚精氨酸(rrrrrrrrr)ii)tat49-57(rkkrrqrrr)iii)穿透素(rqikiwfqnrrmkwkk)iv)pep-1(ketwwetwwtewsqpkkkrkv)v)转运蛋白(gwtlnsagyllgkinlkalaalakkil)vi)核定位序列(vqrkrqklmp,skkkkikv,grkrkkrt)vii)hp4(rrrrprrrttrrrr)为了以图10为基础制作peli1的结合活性抑制肽,如图11a中的模式图所示,利用将细胞穿膜肽hp4与两种肽连接起来的gslinker序列制作出了peli1结合活性抑制肽。9-2.确认peli1结合活性抑制肽的细胞渗透力为了通过所述实施例9-1确认制作的peli1结合活性抑制肽的细胞渗透力,利用细胞培养液对peli1结合活性抑制肽处理后,通过荧光染色对其是否能够渗透细胞进行了确认。其结果如图11b所示,可以确认,如果与细胞穿膜肽即hp4结合,细胞渗透力就会大大增强。由此确认,结合有细胞穿膜肽的peli1结合活性抑制肽能够渗透到细胞内。9-3.确认peli1结合活性抑制肽的功能然后,为了对所述实施例9-2中确认的渗透到细胞内的peli1结合活性抑制肽的功能进行确认,进行了以下实验。具体讲,利用源于骨髓细胞的巨噬细胞对peli1传播的tlr3信号传输作用物质即poly(i:c)处理后,对tlr3信号传导的激活情况进行了比较。其结果如图11c所示,诱导peli1结合活性抑制肽向细胞渗透之后,当对tlr3信号传输作用物质即poly(i:c)进行处理时,可以明显观察到信号传输活性被抑制。以上,对本发明进行了举例说明。通过上述说明,具有本发明所属
技术领域:
一般知识的技术人员完全可以在不偏离本发明技术思想或者改变其必要特征的前提下,按照其它具体形态进行修改。因此,以上列举的实施例旨在从各个方面对本发明进行详细说明,它并不限定本发明的范围。产业上的可利用性依据本发明的转基因动物模型,可以有效应用于筛选治疗牛皮癣候选药物等临床研究。另外,通过以抑制基质蛋白与peli1蛋白正常基质结合的fha结合基序为靶标源于peli1fha结构域的肽,可以有效应用于治疗牛皮癣相关疾病的新药研发。<110>成均馆大学校产学协力团<120>诱发牛皮癣动物模型及其用途<130>mpct17-030<150>kr10-2017-0082620<151>2017-06-29<160>17<170>kopatentin3.0<210>1<211>1257<212>dna<213>pellino同系物1(pellinohomolog1)<400>1atgttttctcctgatcaagaaaatcatccatctaaagcaccagtaaaatatggtgaactc60attgtcttagggtataatgggtctctcccaaatggcgatagaggaaggaggaaaagtagg120tttgctttgtttaaaagacctaaggcaaatggggtgaagcccagcactgtgcatattgct180tgtactcctcaggctgcaaaggcaataagcaacaaagaccagcatagcatatcatatact240ttatctcgggcccagactgtggtggttgaatatactcatgacagcaacaccgatatgttt300cagattggccggtcgactgaaagccccattgattttgtagtaactgacacggttcctgga360agtcaaagtaattctgatacacagtcagtacaaagcactatatcaagatttgcctgcaga420atcatatgtgaacggaatcctccctttacagcacggatttatgctgcaggatttgactca480tcaaaaaacatctttcttggggagaaggctgccaaatggaagacatcagatggacagatg540gatggcttgaccactaatggtgttcttgtgatgcatccacgcaatgggttcacagaagac600tccaagcctggaatatggagagaaatatcggtgtgtggaaatgtatttagcctacgtgaa660accagatcggctcagcagagaggaaaaatggtggaaattgaaaccaatcagttacaagat720ggctcgttaattgacctctgtggtgcaacattgttatggcgtactgcagaaggcctttcc780cacactcctaccgtgaagcatttagaagctttaagacaggaaatcaatgcagcacgacct840cagtgccctgtagggttcaacacactagcatttcctagtatgaagaggaaagacgttgta900gatgaaaaacaaccatgggtatatctaaactgcggccatgtacatggctatcataactgg960ggaaacaaagaagaacgtgatggaaaagatcgtgaatgtcctatgtgtaggtctgttggt1020ccctatgttcctctgtggcttggatgtgaagctggattttatgtggacgccggccctcca1080acccatgcgtttagcccgtgtgggcatgtgtgttcagaaaagacaactgcctattggtcc1140cagatcccacttcctcatggtactcatacttttcatgcagcctgtcccttttgtgcacat1200cagttggctggtgaacaaggctacatcagacttatttttcaaggacctctagactaa1257<210>2<211>418<212>prt<213>pellino同系物1(pellinohomolog1)<400>2metpheserproaspglngluasnhisproserlysalaprovallys151015tyrglygluleuilevalleuglytyrasnglyserleuproasngly202530aspargglyargarglysserargphealaleuphelysargprolys354045alaasnglyvallysproserthrvalhisilealacysthrprogln505560alaalalysalaileserasnlysaspglnhisserilesertyrthr65707580leuserargalaglnthrvalvalvalglutyrthrhisaspserasn859095thraspmetpheglnileglyargserthrgluserproileaspphe100105110valvalthraspthrvalproglyserglnserasnseraspthrgln115120125servalglnserthrileserargphealacysargileilecysglu130135140argasnproprophethralaargiletyralaalaglypheaspser145150155160serlysasnilepheleuglyglulysalaalalystrplysthrser165170175aspglyglnmetaspglyleuthrthrasnglyvalleuvalmethis180185190proargasnglyphethrgluaspserlysproglyiletrpargglu195200205ileservalcysglyasnvalpheserleuarggluthrargserala210215220glnglnargglylysmetvalgluilegluthrasnglnleuglnasp225230235240glyserleuileaspleucysglyalathrleuleutrpargthrala245250255gluglyleuserhisthrprothrvallyshisleuglualaleuarg260265270glngluileasnalaalaargproglncysprovalglypheasnthr275280285leualapheprosermetlysarglysaspvalvalaspglulysgln290295300protrpvaltyrleuasncysglyhisvalhisglytyrhisasntrp305310315320glyasnlysglugluargaspglylysaspargglucysprometcys325330335argservalglyprotyrvalproleutrpleuglycysglualagly340345350phetyrvalaspalaglyproprothrhisalapheserprocysgly355360365hisvalcysserglulysthrthralatyrtrpserglnileproleu370375380prohisglythrhisthrphehisalaalacysprophecysalahis385390395400glnleualaglygluglnglytyrileargleuilepheglnglypro405410415leuasp<210>3<211>19<212>dna<213>peli1的shrna(shrnaofpeli1)<400>3gggttcaacacactagcat19<210>4<211>21<212>dna<213>peli1的sirna(sirnaofpeli1)<400>4gctcctttggatatgcaattt21<210>5<211>20<212>prt<213>fha结合肽1(fhabindingpeptide1)<400>5serasnthraspmetpheglnileglyargserthrgluserproile151015aspphevalval20<210>6<211>16<212>prt<213>fha结合肽2(fhabindingpeptide2)<400>6glnileglyargserthrgluserproileaspphevalvalthrasp151015<210>7<211>16<212>prt<213>fha结合肽3(fhabindingpeptide3)<400>7proileaspphevalvalthraspthrvalproglyserglnserasn151015<210>8<211>16<212>prt<213>fha结合肽4(fhabindingpeptide4)<400>8thrvalproglyserglnserasnseraspthrglnservalglnser151015<210>9<211>16<212>prt<213>fha结合肽5(fhabindingpeptide5)<400>9seraspthrglnservalglnserthrileserargphealacysarg151015<210>10<211>16<212>prt<213>fha结合肽6(fhabindingpeptide6)<400>10thrileserargphealacysargileilecysgluargasnpropro151015<210>11<211>20<212>prt<213>fha结合肽7(fhabindingpeptide7)<400>11aspglyglnmetaspglyleuthrthrasnglyvalleuvalmethis151015proargasngly20<210>12<211>18<212>dna<213>teto&peli1正向引物(teto&peli1forwardprimer)<400>12aagtgaaagtcgagctcg18<210>13<211>22<212>dna<213>teto&peli1反向引物(teto&peli1reverseprimer)<400>13tgatatcgtgtgctggtctttg22<210>14<211>21<212>dna<213>r26&rtta正向引物(r26&rttaforwardprimer)<400>14aaagtcgctctgagttgttat21<210>15<211>21<212>dna<213>r26&rtta反向引物(r26&rttareverseprimer)<400>15ggagcgggagaaatggatatg21<210>16<211>21<212>dna<213>r26&rtta正向引物2(r26&rttaforwardprimer2)<400>16aaagtcgctctgagttgttat21<210>17<211>21<212>dna<213>r26&rtta反向引物2(r26&rttareverseprimer2)<400>17gcgaagagtttgtcctcaacc21当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1