控制植物中的真菌感染的方法与流程
本发明在其一些实施方式中涉及控制植物中真菌感染的方法。
植物在其整个生命周期中与广泛的微生物有机体(包括病原体)相互作用。为了支持他们的健康状况并应对病原体挑战,植物产生大量化学化合物(scalschi等,2015)。包括灰葡萄孢(b.cinerea)的葡萄孢属某些种(botrytisspp.)是死体营养型病原体,导致地面上的器官腐烂,具有超过1400个植物种(plantspecies)的广泛宿主范围,包括许多茄科(solanaceae)家族成员(elad等,2016)。对葡萄孢属敏感的茄科成员包括重要的作物,如番茄(solanumlycopersicum)和马铃薯(solanumtuberosum)(fillinger和elad,2016)。碧冬茄(矮牵牛,petuniahybrida)是一种用于代谢组学和香料研究的茄科模式植物,对灰葡萄孢敏感(wang等,2013;elad等,2016)。
在果实、蔬菜和切花的生长和储存期间,灰葡萄孢(botrytiscinerea)造成作物的巨大损失(patel等,2015;fillinger和elad,2016)。灰葡萄孢宽泛的宿主范围是由于广泛的毒力因子,包括裂解酶和毒素(choquer等,2007),以及降低宿主防御和改变活性氧(ros)水平的因素(asselbergh等,2007;nakajima和akutsu,2014;patel等,2015)。
植物使用广泛的防御机制来避免病原体感染。这些包括局部诱导的防御反应、具有增加的ros产生的局部病变(lesions)的形成、抗微生物酚类化合物的形成、胼胝质和木质素的沉积、以及致病相关(pr)蛋白质合成的诱导(lattanzio等,2006)。生物胁迫后,酚类植物抗毒素和其他芳香族抗氧化化合物的增强是诱导合成芳香族氨基酸(aaas)的莽草酸途径(shikimatepathway)和诱导下游特异性多酚途径的结果(pandey等,2015;camanes等,2015)。
其他
背景技术:
包括:
美国专利号7,087,552
wo2012004795
ics,ferrari等,plantj.2003年7月;35(2):193-205)
tzin和galili,2010
tzin等,2012a;oliva等,2015
pennycooke等,2005;alon等,2013
kuc,1995;
bais等,2002;
petersen等,2009;
shekarchi等,2012;
song等,2013
vogt,2010;maeda和dudareva,2012年;tohge等,2013;
tzin等,2013;tzin等,manela等,201
技术实现要素:
根据本发明的一些实施方式的一个方面,提供了一种控制对其敏感的植物中的真菌感染的方法,该方法包括向植物施用有效量的苯丙氨酸或其类似物以控制植物中的真菌感染。
根据本发明的一些实施方式的一个方面,提供了一种控制对葡萄孢属感染敏感的植物中的葡萄孢属感染的方法,该方法包括向植物施用有效量的苯丙氨酸或其类似物以控制植物中的葡萄孢属感染。
根据本发明的一些实施方式,真菌选自子囊菌(ascomycota)门和卵菌(oomycota)门。
根据本发明的一些实施方式,真菌来自子囊菌门。
根据本发明的一些实施方式,真菌选自葡萄孢属(botrytis)、plenodomustracheiphilus,异名柠檬干枯病菌(plenodomustracheiphilussynphomatracheiphila)、核盘菌(sclerotiniasclerotiorum)和链格孢属(alternaria)。
根据本发明的一些实施方式,真菌来自卵菌门。
根据本发明的一些实施方式,真菌是瓜果腐霉(pythiumaphanidermatum)。
根据本发明的一些实施方式,葡萄孢属选自葡萄孢属的种,所述葡萄孢属的种选自灰葡萄孢(b.cinerea)、蚕豆葡萄孢(b.fabae)、葱腐葡萄孢(b.aclada)和假灰葡萄孢(b.pseudocinerea)。
根据本发明的一些实施方式,施用包括采前施用。
根据本发明的一些实施方式,施用包括采后施用。
根据本发明的一些实施方式,施用包括采前施用而非采后施用。
根据本发明的一些实施方式,施用包括采后施用而非采前施用。
根据本发明的一些实施方式,植物处于开花后阶段。
根据本发明的一些实施方式,植物处于开花阶段。
根据本发明的一些实施方式,植物处于开花前阶段。
根据本发明的一些实施方式,植物不是观赏植物(ornamentalplant)。
根据本发明的一些实施方式,植物包含果实。
根据本发明的一些实施方式,苯丙氨酸或类似物被配制在选自浸渍物(浸渍剂,dip)、喷洒物(喷剂,spray)或浓缩物(浓缩剂,concentrate)的组合物中。
根据本发明的一些实施方式,被配制的(theformulated)包含表面活性剂。
根据本发明的一些实施方式,在植物的根、茎、干、种子、果实或叶片的附近或其上进行施用。
根据本发明的一些实施方式,通过灌溉、浸透、浸渍、浸泡、注射、涂覆或喷洒进行施用。
根据本发明的一些实施方式,植物选自碧冬茄、番茄、甜罗勒、黄瓜、鳄梨和柠檬。
根据本发明的一些实施方式,对真菌或葡萄孢属感染敏感的植物是栽培的果实植物。
根据本发明的一些实施方式,栽培的果实植物选自草莓、葡萄、苹果、蓝莓、樱桃。
根据本发明的一些实施方式,对葡萄孢属感染敏感的植物选自豆、卷心菜、胡萝卜、洋葱和黄瓜。
根据本发明的一些实施方式,在开放田间(旷场,openfield)中进行施用。
根据本发明的一些实施方式,在温室中进行施用。
根据本发明的一些实施方式,在储存设施中进行施用。
根据本发明的一些实施方式,施用包括重复施用。
根据本发明的一些实施方式,重复施用包括在采前开花期间每周给予。
根据本发明的一些实施方式,施用是在出苗后。
根据本发明的一些实施方式,方法还包括分析真菌感染的存在或不存在或严重性。
根据本发明的一些实施方式,苯丙氨酸或类似物的浓度范围为0.01-50mm。
根据本发明的一些实施方式,类似物包括酪氨酸。
根据本发明的一些实施方式的一个方面,提供了一种农业组合物,其包含苯丙氨酸或其类似物和表面活性剂,用于控制植物中的真菌感染。
根据本发明的一些实施方式的一个方面,提供了一种农业组合物,其包含苯丙氨酸和酪氨酸,用于控制植物中的真菌感染。
根据本发明的一些实施方式,组合物还包含表面活性剂。
根据本发明的一些实施方式,表面活性剂是阳离子表面活性剂。
根据本发明的一些实施方式,表面活性剂是阴离子表面活性剂。
根据本发明的一些实施方式,表面活性剂是非离子表面活性剂。
除非另外定义,否则本文使用的所有技术和/或科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。虽然与本文描述的那些类似或等同的方法和材料可用于实践或测试本发明的实施方式,但下文描述了示例性方法和/或材料。以防冲突,将以专利说明书(包括定义)为主。另外,材料、方法和实例仅是说明性的,并非旨在必要地限制。
附图说明
仅通过举例的方式,本文参考附图描述了本发明的一些实施方式。现在详细地具体参考附图,要强调的是,所示的细节是通过举例的方式并且出于说明性讨论本发明的实施方式的目的。对此,与附图一起进行的描述使得本领域技术人员清楚如何可以实施本发明的实施方式。
在附图中:
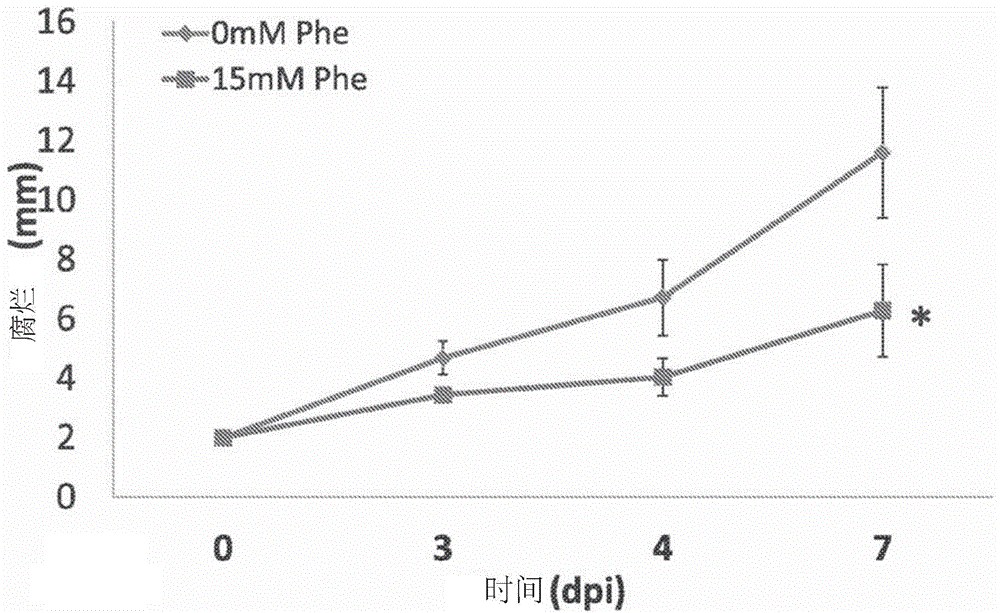
图1a-e展示了用phe处理的碧冬茄叶片显示出对灰葡萄孢更高的抗性。将离体叶片用灰葡萄孢分生孢子进行伤口接种。图1a-)测量用15mmphe处理或未用phe处理的碧冬茄离体叶片(n=25)的腐烂直径,直至7dpi。图1b-接种后4天(dpi),未处理的和用15mmphe处理的叶片。图1c-在用灰葡萄孢接种人工伤口后随着疾病的发展而发展出坏死或褪绿病的经处理和未经处理的叶片的百分比(n=45)。用商业碧冬茄植物('dreamheaven')重复该实验,由此在接种后3、4和7天(dpi)测量坏死面积,结果显示在图1d-e中。关于25片叶子的平均值±se结果表示为以mm2计的腐烂面积。星号(*)代表转基因系和对照之间的统计学显著差异——利用t-检验,p<0.05(图1d)。接种后第4天,用phe处理和未用phe处理的叶片的照片(图1e,上图(upperpanel))和11dpi接种区域的明视野成像(图1e,下图(lowerpanel))。
图2a-b显示了感染后0-8天通过浸透(图2a)或喷洒(图2b,其还显示离体叶片的图像)施用的0.5-4.1mm苯丙氨酸对番茄中灰霉病(灰葡萄孢)的严重性的影响。疾病严重性以百分比表示。0=对照。根据fisher's保护lsd检验(fisher'sprotectedlsdtest)对结果进行统计学分析。各评估日期处、后跟一个共同字母的值没有显著差异(<0.05)。
图2c-d显示了通过用6mm外源苯丙氨酸(phe)喷洒植物(添加0.1%silwettl-77表面活性剂)或浸透花盆处理整株碧冬茄植物('dreamheaven')对灰葡萄孢耐受性的影响,如腐烂面积(mm2)所示,结果表示为平均值±se。
图3a-b显示了较高phe浓度通过喷洒植物(添加0.1%silwettl-77表面活性剂)或浸透花盆提高碧冬茄植物对灰葡萄孢的耐受性。使用的phe浓度为6-50mm。腐烂面积(mm2)结果表示为平均值±se。
图3c-d显示了较高phe浓度通过喷洒植物(不含表面活性剂)提高番茄植物对灰葡萄孢的耐受性。使用的phe浓度为0.5-30mmphe(图3c)。结果通过用灰葡萄孢的分生孢子感染后11天的疾病严重性评分表示,其中0=无疾病,100=灰霉病腐烂的总覆盖率。图3d表示在以0.5mm级别(rate)施用phe的情况下不含表面活性剂和含有表面活性剂的phe的效果。表面活性剂的添加导致疾病控制的显著改善(图3d)。结果通过用灰葡萄孢的分生孢子感染后11天的疾病严重性评分表示,其中0=无疾病,100=灰霉病腐烂的总覆盖率。棒代表se。
图4a-b显示了在假叶树属的枝(ruscusbranches)被切割后用外源苯丙氨酸处理的假叶树属的枝的处理(图4b)导致对灰葡萄孢的耐受性提高(图4a)。使用的phe浓度为0.5-30mm。腐烂面积(mm2)结果表示为平均值±se。
图5a-b显示phe通过喷洒植物或浸透花盆提高甜罗勒植物对白腐病(核盘菌)的耐受性(图5a)。使用的phe浓度为4.1mm。结果通过audpc的疾病严重性评分(感染后6天期间疾病进展曲线下的面积)表示,其中严重性通过被乘以温育时间的腐烂直径(mm)的单位(units)来标记。
图6a-b显示通过用苯丙氨酸浸透或喷洒处理番茄导致对白腐病(核盘菌)的耐受性提高。使用的phe浓度为4mm。结果通过audpc的疾病严重性评分(感染后15天期间疾病进展曲线下的面积)表示,其中严重性通过被乘以温育时间的腐烂面积(mm2)的单位来标记。
图7a-b显示通过用苯丙氨酸浸透或喷洒处理柠檬导致对由puterodomustracheiphilus,异名柠檬干枯病菌真菌引起的柠檬枝枯病(malseccodisease)的耐受性提高。使用的phe浓度为4mm。结果通过因浸透处理(图7a下)和喷洒处理(图7a上)导致的感染部位疾病发病率的百分比来表示。
图8是栽培品种'ettinger'的鳄梨果实的图像,其浸渍在水或者1mm或4mm苯丙氨酸中30秒并在5℃下储存一天。然后通过在果实赤道(果实横径,fruitequatorial)处造成伤口,以7μl、浓度为105个分生孢子/ml的链格孢的孢子悬浮液在果实两侧接种鳄梨果实。在23℃下储存果实。在接种后6天期间监测腐烂面积。明显地,采后用phe溶液处理的果实采后显示对链格孢的耐受性提高。
图9a-b显示用苯丙氨酸处理黄瓜植物导致对瓜果腐霉的耐受性提高。使用的phe浓度为4mm。结果通过死亡植物发生率的百分比表示(图9a)。图9b:对照处理=下排,phe处理=上排。
图10a-b显示用phe、酪氨酸(tyr)或其组合处理番茄(图10a)和碧冬茄(图10b)植物导致对灰葡萄孢的耐受性提高,如通过疾病严重性评分(图10a)或以平均值±se表示的腐烂面积(图10b)所确定。
图11a-b显示栽培品种'shelly'的芒果果实,其浸渍在水或4mm苯丙氨酸中30秒并在12℃下储存一天。然后在果实茎端用20μl、浓度为105个分生孢子/ml的可可毛色二孢菌(lasiodiplodiatheobromae)的孢子悬浮液在果实两侧接种芒果果实。接种后6天后监测腐烂面积,同时在23℃下温育。
具体实施方式
本发明在其一些实施方式中涉及控制葡萄孢属感染的方法。
在详细解释本发明的至少一个实施方式之前,应理解本发明不一定限于其应用于以下描述中阐述的或通过实施例举例说明的细节。本发明能够具有其他实施方式或者以各种方式实践或实施。
灰葡萄孢是一种具有格外广泛的宿主范围的死体营养型病原真菌,包括至少1400种可能的宿主(elad等,2016)。由于其广泛的宿主范围,并且因为灰葡萄孢是许多商业种植作物中经济植物作物损失的主要参与者。在种植者中,真菌通常被称为葡萄孢属。
葡萄孢属主动杀死受感染的细胞,导致软腐病、枯萎病、叶斑病、猝倒病和茎癌(stemcancers)。受影响的叶片被分生孢子梗和分生孢子覆盖,随后塌陷和枯萎。真菌将从病叶生长到茎中,并产生几毫米到几厘米长的干燥、浅棕色病斑(lesions)。病斑还可在茎上的修剪疤痕处形成。茎病斑也可以用灰霉病覆盖。在严重的情况下,感染环绕茎并杀死植物。较老的衰老组织通常比较年轻组织更容易受到葡萄孢属的攻击。
为了防止温室种植植物中葡萄孢属的发展,必须严密调节温度和相对湿度。提供水而不润湿叶片更为重要。对于田间种植的植物,应采取良好的排水和杂草控制。此外,植物必须保持高营养水平。然而,这些预防措施不能完全避免在感染情况下发生相当大的产量损失。
杀真菌剂可用于控制温室和田间种植植物(例如番茄)中的葡萄孢属。然而,已知葡萄孢属已经对几种常用的杀真菌剂发展出了抗性。另外,从经济和环境的角度来看,杀真菌剂的使用是不期望的。
在将本发明简化(reducing)以用于实践的同时,本发明人已经研究了碧冬茄和拟南芥叶片中phe衍生的专门代谢物的积累增加对其对葡萄孢属的抗性的影响。直接施用phe减少了受影响植物中的葡萄孢属腐烂。此外,本发明人能够通过用phe进行浸透或喷洒处理来减少的葡萄孢属感染的番茄植物中的疾病症状。
这三种不相关的植物物种中的结果指出苯丙氨酸或其类似物在控制葡萄孢属感染的用途。
在进一步将本发明的实施方式简化以用于实践的同时,本发明人能够显示phe处理的效果是稳健的,并且当施用于不同植物(例如,碧冬茄、番茄、甜罗勒、黄瓜、鳄梨和柠檬)时,从多个层级(order)来影响真菌。
如下面的实施例1-11所示,phe处理控制来自子囊菌门(ascomycotadivision)(灰葡萄孢、plenodomustracheiphilus,异名柠檬干枯病菌、核盘菌和链格孢属)的4种真菌和来自卵菌门(oomycotadivision)的瓜果腐霉。有效的phe处理可以以多种方式进行,包括但不限于喷洒整株植物、浸透植物生长的土壤、整个切枝的浸渍、切枝的浸透和采后果实的浸渍。
在进一步将本发明的实施方式简化以用于实践时,本发明人能够显示phe的芳族类似物如酪氨酸具有phe的抗真菌性质(参见实施例11),从而能够使用phe类似物控制植物中的真菌感染。
根据本发明的一个方面,提供了一种控制对其敏感的植物中的真菌感染的方法,该方法包括向植物施用有效量的苯丙氨酸或其类似物,用于控制植物中的所述真菌感染。
根据本发明的一个方面,提供了一种控制对葡萄孢属感染敏感的植物中的葡萄孢属感染的方法,该方法包括向植物施用有效量的苯丙氨酸或其类似物,用于控制植物中的所述葡萄孢属感染。
如本文所用,术语“控制”是指预防或减少真菌感染或抑制此类感染的速率和程度。还考虑了治疗性处理。
根据具体实施方式,控制是预防葡萄孢属感染。
如本文所用,“真菌”是指植物真菌病原体。
根据具体实施方式,真菌属于子囊菌纲(ascomycetes)或担子菌纲(basidiomycetes)。
子囊菌纲的实例包括但不限于:
镰孢属某些种(fusariumspp.)(镰孢属枯萎病)
根串珠霉属某些种(thielaviopsisspp.)(溃疡腐烂病、黑根腐烂病、根串珠霉根腐烂病)
轮枝孢属某些种(verticilliumspp.)
稻瘟病菌(magnaporthegrisea)(稻瘟病)
核盘菌(棉状腐烂病)
担子菌纲的实例包括但不限于
黑粉菌属某些种(ustilagospp.)(黑粉病)
丝核菌属某些种(rhizoctoniaspp.)
豆薯层锈菌(大豆锈菌,phakosporapachyrhizi)(大豆锈病)
柄锈菌属某些种(pucciniaspp.)(谷物和草的严重锈病)
蜜环菌属某些种(armillariaspp.)(蜜环菌种(honeyfungusspecies),树木的烈性病原体
根据具体实施方式,真菌属于卵菌门(oomycetesdivision),也称为“类真菌生物”。它们包括一些最具破坏性的植物病原体,包括疫霉属(phytophthora)——其包括马铃薯晚疫病[3]和橡树猝死病(suddenoakdeath)的致病病原(causalagent)。卵菌(oomycetes)的特定种是造成根腐烂病的原因。
根据具体实施方式,卵菌植物病原体包括:
腐霉属某些种(pythiumspp.)
疫霉属某些种(phytophthoraspp.)
以下是真菌的进一步实例,所述真菌是根据本发明的一些实施方式预期控制的目标。
表1
根据具体实施方式,真菌选自子囊菌门和卵菌门。
根据具体实施方式,真菌来自子囊菌门。
根据具体实施方式,真菌选自葡萄孢属、plenodomustracheiphilus,异名柠檬干枯病菌、核盘菌和链格孢属。
根据具体实施方式,真菌来自卵菌门。
根据具体实施方式,真菌是瓜果腐霉。
如本文所用,术语“葡萄孢属”或“葡萄孢属某种(botrytissp.)”是指导致采前和采后多种霉菌的真菌病原体,霉菌攻击植物部分并在敏感植物中引起灰霉病。
根据一些实施方式,葡萄孢属的种(botrytisspecies)选自灰葡萄孢、葱腐葡萄孢(b.aclada)(b.allii(葱腐葡萄孢))、银莲花葡萄孢(b.anemone)、葱细丝葡萄孢(b.byssoidea)、驴蹄草葡萄孢(b.calthae)、卡罗来拉葡萄孢(b.caroliniana)、卷曲葡萄孢(b.convoluta)、藏红花葡萄孢(b.croci)、douglasii葡萄孢(b.douglasii)、椭圆葡萄孢(b.elliptica)、蚕豆葡萄孢(b.fabae)、拟蚕豆葡萄孢(b.fabiopsis)、ficariarum葡萄孢(b.ficariarum)、galanthina葡萄孢(b.galanthina)、唐菖蒲球腐葡萄孢(b.gladiolorum)、球形葡萄孢(b.globosa)、风信子葡萄孢(b.hyacinthi)、水仙葡萄孢(b.narcissicola)、牡丹葡萄孢(b.paeoniae)、天竺葵葡萄孢(b.pelargonii)、水仙葡萄孢(b.polyblastis)、大蒜盲种葡萄孢(b.porri)、毛茛葡萄孢(b.ranunculi)、中国葱葡萄孢(b.sinoallii)、葱鳞葡萄孢(b.squamosa)、球精葡萄孢(b.sphaerosperma)、郁金香葡萄孢(b.tulipae)。
还考虑了其他葡萄孢属的种。
根据具体实施方式,葡萄孢属的种是灰葡萄孢。
如本文所用,对葡萄孢属感染敏感的植物是指可以被葡萄孢属感染并且表现出所述感染产生的疾病症状的植物(例如霉菌病变、灰腐烂病、贵腐病、叶斑病(病变))。环境条件,例如生长条件或储存条件,如光、湿度和温度,与疾病传播密切相关。技术人员将认识到,在支持葡萄孢属感染的那些条件下,用苯丙氨酸或其类似物处理是有益的。有超过1400个受葡萄孢属影响的植物种(对感染敏感)。
在elad等,2016(见上文)中提供了综合列表,其通过引用以其整体并入本文。
下文列出了对葡萄孢属感染敏感的植物的非限制性实例。马铃薯、芥花、玉米、苜蓿、非洲雏菊、非洲紫罗兰、豌豆、小扁豆(lentil)、银莲花(anemone)、扁桃仁、苹果、杏、芦笋、鳄梨、杜鹃花、甜菜、风铃草(bellflower)、荷包牡丹(bleedingheart)、蝶粉花(butterflyflower)、小红莓(蔓越莓,cranberries)、胡萝卜、茶、烟草、番茄、马鞭草、甘薯、向日葵、草莓、蓝宝石花(sapphireflower)、红花、玫瑰、报春花(primula)、一品红、蒲包花植物(钱包花植物,pocketbookplant)、开心果(pistachio)、木豆、波斯紫罗兰、辣椒、梨、花生、桃、油桃、沟酸浆属(mimulus)、猴面花(monkey-flower)、芒果、生菜、伽蓝菜(kalanchoe)、冬珊瑚(jerusalemcherry)、凤仙花、酒花(hop)、大麻、葡萄、天竺葵、倒挂金钟(fuchsia)、仙客来、葫芦、十字花科植物、柑橘、瓜叶菊、鹰嘴豆、卡特兰(cattleya)、康乃馨、花旗松、大丽花、天南星科、爵床科、龙舌兰科、五加科、萝藦科(asclepiadaceae)、苦苣苔科、榕属(ficus)、水龙骨科(polypodiaceae)、葡萄科、杜鹃花、核果类(stonefruit)。
根据具体实施方式,植物不是观赏植物(例如,非洲雏菊、风铃草、蝶粉花、向日葵、蓝宝石花、红花、玫瑰、一品红、猴面花、天竺葵、倒挂金钟、康乃馨、大丽花、天南星科、爵床科、龙舌兰科、五加科、萝藦科、苦苣苔科、榕属、水龙骨科、葡萄科、杜鹃花)。
下文列出了对葡萄孢属感染敏感的植物的非限制性实例。马铃薯、芥花、玉米、苜蓿、非洲紫罗兰、豌豆、小扁豆、银莲花、扁桃仁、苹果、杏、芦笋、鳄梨、杜鹃花、甜菜、荷包牡丹、小红莓、胡萝卜、茶、烟草、番茄、马鞭草、甘薯、草莓、报春花、蒲包花植物、开心果、木豆、波斯紫罗兰、辣椒、梨、花生、桃、油桃、沟酸浆属、芒果、生菜、伽蓝菜、冬珊瑚、凤仙花、酒花、大麻、葡萄、仙客来、葫芦、十字花科、柑橘、瓜叶菊、鹰嘴豆、卡特兰、花旗松、核果类。
根据具体实施方式,对葡萄孢属感染敏感的所述植物是栽培的果实植物。
根据具体实施方式,栽培的果实植物是指果实具有经济价值的植物。
根据具体实施方式,经济价值是营养价值。
根据具体实施方式,栽培的果实植物是可食用植物(或具有可食用果实)。
根据具体实施方式,栽培的果实植物选自草莓、葡萄、苹果、蓝莓、樱桃。
根据具体实施方式,对葡萄孢属感染敏感的植物选自豆、卷心菜、胡萝卜、洋葱和黄瓜。
根据具体实施方式,植物不是金鱼草、碧冬茄或洋桔梗(lisianthus)。
根据具体实施方式,栽培的果实植物不是草莓、桃、苹果、橙子、柠檬、酸橙(lime)、李子、樱桃、覆盆子、黑莓、番茄、胡椒、甜瓜、黄瓜、南瓜(squash)、西瓜(当施用于谷物或果实时)。
根据具体实施方式,植物选自碧冬茄、番茄、甜罗勒、黄瓜、鳄梨和柠檬。
如本文所用,术语“苯丙氨酸”或“phe”是指具有式c9h11no2的α-氨基酸。可以将其视为取代丙氨酸的甲基的苄基、或代替丙氨酸的末端氢的苯基。由于苄基侧链的惰性和疏水性,该必需氨基酸被分类为中性和非极性。l-异构体用于以生物化学方式形成由dna编码的蛋白质。l-苯丙氨酸的密码子是uuu和uuc。苯丙氨酸是酪氨酸的前体;一元胺神经递质多巴胺、去甲肾上腺素(norepinephrine)(去甲肾上腺素(noradrenaline))和肾上腺素(epinephrine)(肾上腺素(adrenaline));和皮肤色素黑色素。
“苯丙氨酸的类似物”或“phe”是指phe的天然存在的组合物(composition)或合成类似物,其能够控制植物中的真菌(例如葡萄孢属)感染。不受理论束缚,表明phe或其类似物通过增加植物中的莽草酸途径(shikamatepathway)并且特别是苯丙素类(phenylpropanoids)的产生而起作用。
根据具体实施方式,phe类似物是天然存在的组合物。
根据具体实施方式,phe类似物是芳族的。
根据具体实施方式,phe类似物是酪氨酸或其合成类似物,其能够控制真菌(例如葡萄孢属)感染。
合成类似物可诸如从anaspec商购。
下文提供了非限制性实例列表。在施用于植物上之前,采取措施测试植物毒性。
根据具体实施方式,类似物是阿斯巴甜。
根据具体实施方式,类似物是酪氨酸。
如上所述,以控制真菌(例如葡萄孢属)感染的有效量施用苯丙氨酸。
根据具体实施方式,苯丙氨酸的给予量为0.01-50mm、0.1-50mm、0.5-50mm,例如0.5-30mm、1-50mm、5-50mm、10-50mm、10-30mm、5-30mm、1-30mm、10-20mm、0.5-20mm、5-20mm、1-20mm、1-15mm、15至30mm或上至50mm。
特别是当结合表面活性剂使用时或当使用phe和类似物的组合(例如,phe+tyr)时,使用低浓度(例如,0.01-10mm、0.01-5mm、0.01-1mm、0.1-10mm、0.1-5mm、0.1-1mm)的phe或其类似物是可能的。
如本文所用,“植物”是指整株植物、嫁接植物,包括种子、枝条、茎、根(包括块茎)、根茎(rootstock)、接穗以及植物细胞、组织和器官。植物可以是任何形式,包括插条(cuttings)和收获的材料(例如,果实)。
可以通过喷洒、撒粉、涂覆、浸泡、灌溉、浸透或以其他方式用活性成分处理它们或者可选地通过用活性成分处理植物种子、植物周围的土壤、或者播种种子的土壤、稻垫(ricepads)或用于水培的水,将phe(或类似物)施用于植物。施用可在植物感染真菌(例如葡萄孢属)之前或之后进行。
根据具体实施方式,将方案实施,从而诸如控制真菌——例如葡萄孢属。
根据具体实施方式,施用包括采前施用。
根据具体实施方式,所述施用包括采后施用。
根据具体实施方式,所述施用包括采前施用而非采后施用。
根据具体实施方式,所述施用包括采后施用而非采前施用。
根据具体实施方式,所述植物处于开花后阶段。
根据具体实施方式,所述植物处于开花阶段。
根据具体实施方式,所述植物处于开花前阶段。
当指示(indicated)具体阶段时,施用可以仅限于该阶段或仅限于所述阶段和更多阶段。例如,当指示在开花时施用时,施用可以在开花时或开花时+开花后(即果实)、或开花前+开花时或开花前+开花时+开花后进行。
根据具体实施方式,施用是在出苗后。
根据具体实施方式,所述苯丙氨酸或所述类似物被配制在选自浸渍物、喷洒物或浓缩物的组合物中。
根据具体实施方式,在植物的根、茎、干、种子、果实或叶片附近或其上进行所述施用。
根据具体实施方式,通过灌溉、浸透、浸渍、浸泡、注射、涂覆或喷洒进行所述施用。
根据具体实施方式,在开放田间中进行所述施用。
根据具体实施方式,在温室中进行所述施用。
根据具体实施方式,在储存设施(例如,暗室、冰箱)中进行所述施用。
根据具体实施方式,所述施用被进行一次。
根据具体实施方式,所述施用包括重复施用(例如,每周2次或更多次施用)。尤其设想了将重复施用用于田间/温室处理。
根据具体实施方式,所述重复施用包括在采前开花期间每周给予。
例如,建议的方案包括但不限于在开放田间和温室中喷洒植物、添加对在开放田间、温室和花盆中生长的植物的灌溉、在采后将整个叶枝浸入溶液中、在采后和装运前将切花添加到花瓶。
根据具体实施方式,将活性成分(phe和/或类似物)配制成组合物,其中活性成分与其他活性成分(例如杀真菌剂)和/或农业上可接受的载体混合”。
根据具体实施方式,本发明的这种组合物是货架稳定的。术语“货架稳定的”是指本发明的组合物在推荐条件(例如温度)下在整个给定的储存期内保持其活性,并且任选地不分离成单独的相或发展任何令人不快的气味。
如本文所用,术语“农业上可接受的载体”是指有助于将本发明的组合物施用于预期对象的材料或有助于储存、运输或处理的材料,所述对象可以是例如植物、植物材料或设备。用于向植物和植物材料施用的组合物中的载体优选是非植物毒性的或仅有轻微的植物毒性的。适合的载体可以是固体、液体或气体——取决于期望的配制物。在一个实施方式中,载体包括极性液体载体,如水、矿物油和植物油。
液体载体的实例包括但不限于水;醇,特别是丁醇或乙二醇,以及它们的醚或酯,特别是乙二醇甲醚乙酸酯(methylglycolacetate);酮,特别是丙酮、环己酮、甲乙酮、甲基异丁基酮、或异佛尔酮;石油馏分如链烷烃或芳香烃,特别是二甲苯或烷基萘;矿物油或植物油;脂族氯化烃,特别是三氯乙烷或二氯甲烷;芳香族氯化烃,特别是氯苯;水溶性或强极性溶剂,如二甲基甲酰胺、二甲亚砜或n-甲基吡咯烷酮;液化气体;或类似物或其混合物。
固体载体的实例包括但不限于填料,如高岭土、膨润土、白云石、碳酸钙、滑石、粉状氧化镁、漂白土(fuller'searth)、石膏、硅藻土和陶土。
为本发明的化合物(phe或类似物)提供缓慢释放或延迟释放的载体也可包括在本发明的组合物中(尤其是因为葡萄孢属的短生命周期)。
在另一个实施方式中,本发明的组合物(或其活性成分-phe或类似物)以能够抑制真菌孢子萌发的量施用。
根据具体实施方式,本发明的组合物(或其活性成分-phe或类似物)以能够降低管理机构(例如fda)建议的常用杀真菌剂的标准浓度的量施用。
根据具体实施方式,本发明的组合物(或其活性成分-phe或类似物)以能够减少坏死或褪绿病的量施用。
如本文所用,“增加”或“减少”或“降低”是指在相同测定条件下与不存在所述phe或类似物的情况下的对照植物相比较约+/-至少10%、20%、30%、40%、50%、60%、70%、80%、90%或更多。
可以直接施用于植物或施用于足够邻近植物的表面以控制植物的葡萄孢属感染。
因此,可以对可施用本发明的化合物或组合物的任何目标表面进行施用,例如植物、植物材料,包括根、鳞茎、块茎、球茎、叶片、花、种子、茎、愈伤组织、坚果、谷物、果实、插条、根茎、接穗、收获的作物,包括根、鳞茎、块茎、球茎、叶片、花、种子、茎、愈伤组织、坚果、谷物、果实、插条、根茎、接穗或任何可与收获的作物接触的表面,包括收获设备、包装设备和包装材料。
对于诸如收获设备、包装设备和包装材料的表面,在使用收获设备、包装设备或包装材料之前施用本发明的化合物或组合物。
根据具体实施方式,将本发明的化合物或组合物配制成浸渍物、粉末、喷洒物或浓缩物。
根据具体实施方式,配制物包含表面活性剂,其例如可以用于喷洒。
根据具体实施方式,表面活性剂是阳离子表面活性剂,例如苯扎氯铵、氯化十六烷基吡啶(cetylpyridiniumchloride)。
根据具体实施方式,表面活性剂是阴离子表面活性剂,例如烷基硫酸盐、乙氧基化烷基硫酸盐(alkylethoxylatesulphates)。
根据具体实施方式,表面活性剂是非离子表面活性剂,例如烷基多糖苷、tritonx-100、聚氧乙烯(20)失水山梨糖醇单油酸酯(tween-80)、silwettl-77。
根据具体实施方式,表面活性剂是tween-80或silwettl-77。
根据具体实施方式,表面活性剂的浓度为约0.1%。在一个实施方式中,本发明的组合物可进一步包含至少一种另外的农业剂。在可选实施方式中,本发明的组合物可以与至少一种另外的农业剂分开地、同时地或相继地递送。
在一个实施方式中,本发明的组合物可进一步包含至少一种另外的杀真菌剂。在一个可选实施方式中,本发明的组合物可以与至少一种另外的杀真菌剂分开地、同时地或相继地递送。
当配制含有另外的农业剂(如另外的杀真菌剂)的本发明的组合物或计划与另外的农业剂(如另外的杀真菌剂)分开地、同时地或相继地递送本发明的组合物时,可能期望评估随着时间的推移将组合物施用于植物材料所导致的植物毒性程度。这可以根据本领域公知的方法评估。
本发明的组合物或包含另外的农业剂(如另外的杀真菌剂)或与另外的农业剂(如另外的杀真菌剂)一起递送的本发明的组合物的评估可包括评估:(1)在不刺激不期望的非目标微生物的生长或损害有益生物的情况下控制葡萄孢属的程度。(2)控制耐久性。(3)在贯穿部分或整个生长季节重复使用时植物毒性的程度和对植物发育的影响。(4)与工业中使用的其他控制产品的兼容性。
如上所述,本发明的组合物可以单独使用或与一种或多种其他农业剂组合使用,其他农业剂包括农药、杀虫剂、杀螨剂(acaracides)、杀真菌剂、杀细菌剂、除草剂、抗生素、抗微生物剂、杀线虫剂(nematocides)、灭鼠剂、昆虫病原体、信息素、引诱剂、植物生长调节剂、植物激素、昆虫生长调节剂、化学不育剂、微生物防虫剂、驱虫剂(repellents)、病毒、诱食剂、植物营养物、植物肥料和生物防治剂(biologicalcontrolagents)。当与其他农业剂组合使用时,两种剂的施用可以是分开的、同时的或顺序的。这些农业剂的具体实例是本领域技术人员已知的,并且许多是容易商购的。
植物营养物的实例包括但不限于氮、镁、钙、硼、钾、铜、铁、磷、锰、钼、钴、硼、铜、硅、硒、镍、铝、铬和锌。
抗生素的实例包括但不限于土霉素和链霉素。
杀真菌剂的实例包括但不限于以下类别的杀真菌剂:甲酰胺(carboxamides)、苯并咪唑、三唑、羟基吡啶、二甲酰胺(dicarboxamides)、苯基酰胺、噻二唑(thiadiazoles)、氨基甲酸酯、氰基肟、肉桂酸衍生物、吗啉、咪唑、β-甲氧基丙烯酸酯和吡啶/嘧啶。
杀真菌剂的进一步实例包括但不限于天然杀真菌剂、有机杀真菌剂、硫基杀真菌剂、铜/钙杀真菌剂和植物宿主防御的诱导子。
天然杀真菌剂的实例包括但不限于全脂乳、乳清、脂肪酸或酯化脂肪酸。
有机杀菌剂的实例包括但不限于通过有机认证标准的任何杀真菌剂,如生物控制剂、天然产物、诱导子(其中的一些也可以归类为天然产物)以及硫和铜杀真菌剂(限于限制使用)。
硫基杀真菌剂的实例是kumulustmdf(basf,德国)。
铜杀真菌剂的实例是kocide.rtm.2000df(griffincorporation,美国)。
诱导子的实例包括但不限于壳聚糖、biontm、baba(dl-3-氨基-正丁酸,β-氨基丁酸)和milsanatm(westernfarmservice,inc.,美国)。
在一些实施方式中,可以使用非有机杀真菌剂。非有机杀真菌剂的实例包括但不限于bravotm(用于控制葫芦上的白粉病(pm));supershieldtm(yates,nz)(用于控制玫瑰上的葡萄孢属和pm);topas.rtm.200ew(用于控制葡萄和葫芦的pm);flinttm(用于控制苹果和葫芦上的pm);amistar.rtm.wg(用于控制谷物上的锈病和pm);和captantm、dithanetm、euparentm、rovraltm、scalatm、shirlantm、switchtm和teldortm(用于控制葡萄上的葡萄孢属)。
农药的实例包括但不限于嘧菌酯(azoxystrobin)、联苯三唑醇(bitertanol)、萎锈灵(carboxin)、cu.sub.2o、霜脲氰(cymoxanil)、环丙唑醇(cyproconazole)、嘧菌环胺(cyprodinil)、抑菌灵(dichlofluamid)、苯醚甲环唑(difenoconazole)、烯唑醇(diniconazole)、氟环唑(epoxiconazole)、拌种咯(fenpiclonil)、咯菌腈(fludioxonil)、氟喹唑(fluquiconazole)、氟硅唑(flusilazole)、粉唑醇(flutriafol)、呋霜灵(furalaxyl)、双胍盐(guazatin)、己唑醇(hexaconazole)、恶霉灵(hymexazol)、抑霉唑(imazalil)、酰胺唑(imibenconazole)、种菌唑(ipconazole)、醚菌酯(kresoxim-methyl)、代森锰锌(mancozeb)、甲霜灵(metalaxyl)、r-甲霜灵(r-metalaxyl)、叶菌唑(metconazole)、
生物防治的实例是包含奥德曼细基格孢(ulocladiumoudemansii)的botryzentm生物防治剂。
使用田间试验测定系统(fieldtrialassaysystems)也可以确认本发明组合物的功效。例如,本发明组合物防止真菌生长的能力的确认可以通过将本发明的化合物或组合物施用于植物材料然后用目标生物接种来获得。通过与未处理的对照相比,目标生物没有生长或生长减少来确认功效。
根据具体实施方式,农业组合物可包含苯丙氨酸或其类似物和表面活性剂(如本文所述),用于控制植物中的真菌感染。
根据具体实施方式,农业组合物可包含苯丙氨酸和酪氨酸,用于控制植物中的真菌感染。
本发明组合物处理真菌生长的能力的确认可以通过用目标生物接种植物材料然后施用本发明的组合物来获得。通过与未处理的对照相比,目标生物生长程度的降低或其消失来确认功效。
如本文所用,术语“约”是指±10%。
术语“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”、“具有”及其同根词意指“包括但不限于”。
术语“由……组成”意指“包括但不限于”。
术语“基本上由……组成”意指组合物、方法或结构可包括另外的成分、步骤和/或部分,但只有在另外的成分、步骤和/或部分实质上不改变所要求保护的组合物、方法或结构的基本和新颖特征的情况下。
如本文所用,单数形式“一”、“一个”和“该”包括复数的提及,除非上下文另有明确指示。例如,术语“化合物”或“至少一种化合物”可包括多种化合物,包括其混合物。
在整个该申请中,本发明的各种实施方式可以以范围格式表示。应当理解,范围格式的描述仅仅是为了方便和简洁,不应该被解释为对本发明范围的硬性限制。因此,应该认为对范围的描述已经具体公开了所有可能的子范围以及该范围内的各个数值。例如,应当认为对诸如1至6的范围的描述已经具体公开了子范围,如1至3、1至4、1至5、2至4、2至6、3至6等,以及在该范围内的各个数字,例如,1、2、3、4、5和6。无论范围的广度如何,这都适用。
无论何时在本文中指示数值范围,其意图包括所指示范围内的任何引用的数字(分数或整数)。短语“在第一指示数字和第二指示数字的范围之间”和“在第一指示数字“至”第二指示数字的范围之间”在本文中可互换使用,并且意图包括第一和第二指示数字以及它们之间的所有分数和整数。
如本文所用,术语“方法”是指用于完成给定任务的方式、手段、技术和程序,包括但不限于已知的方式、手段,技术和程序,或者由化学、药理学、生物学、生物化学和医学领域的从业者从已知方式、手段、技术和程序容易开发的那些方式、手段,技术和程序。
如本文所用,术语“处理”包括消除、基本上抑制、减缓或逆转状况的进展、基本上改善状况的临床或美学症状或基本上防止状况的临床或美学症状出现。
应当理解,为了清楚起见,在单独的实施方式的上下文中描述的本发明的某些特征也可以在单个实施方式中组合提供。相反,为简洁起见,在单个实施方式的上下文中描述的本发明的各种特征也可以单独地或以任何适合的子组合或者适于本发明任何其他描述的实施方式的方式来提供。在各种实施方式的上下文中描述的某些特征不被认为是那些实施方式的基本特征,除非该实施方式在没有那些元件的情况下不起作用。
在上文所描绘和在下面的权利要求部分所要求保护的本发明的各种实施方式和方面在以下实施例中找到实验支持。
实施例
现在参考以下实施例,其与以上描述一起以非限制性方式示例本发明的一些实施方式。
总体上,本文使用的命名法和本发明中使用的实验室程序包括分子技术、生物化学技术、微生物学技术和重组dna技术。这些技术在文献中被彻底解释。参见,例如,“molecularcloning:alaboratorymanual”sambrook等,(1989);“currentprotocolsinmolecularbiology”volumesi-iiiausubel,r.m.,ed.(1994);ausubel等,“currentprotocolsinmolecularbiology”,johnwileyandsons,baltimore,maryland(1989);perbal,“apracticalguidetomolecularcloning”,johnwiley&sons,newyork(1988);watson等,“recombinantdna”,scientificamericanbooks,newyork;birren等(eds)“genomeanalysis:alaboratorymanualseries”,vols.1-4,coldspringharborlaboratorypress,newyork(1998);如在美国专利号4,666,828;4,683,202;4,801,531;5,192,659和5,272,057中阐述的方法学;“cellbiology:alaboratoryhandbook”,volumesi-iiicellis,j.e.,ed.(1994);“currentprotocolsinimmunology”volumesi-iiicoliganj.e.,ed.(1994);stites等(eds),“basicandclinicalimmunology”(8thedition),appleton&lange,norwalk,ct(1994);mishellandshiigi(eds),“selectedmethodsincellularimmunology”,w.h.freemanandco.,newyork(1980);可获得的免疫测定广泛地描述于专利和科学文献中,参见,例如,美国专利号3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;“oligonucleotidesynthesis”gait,m.j.,ed.(1984);“nucleicacidhybridization”hames,b.d.,和higginss.j.,eds.(1985);“transcriptionandtranslation”hames,b.d.,和higginss.j.,eds.(1984);“animalcellculture”freshney,r.i.,ed.(1986);“immobilizedcellsandenzymes”irlpress,(1986);“apracticalguidetomolecularcloning”perbal,b.,(1984)和“methodsinenzymology”vol.1-317,academicpress;“pcrprotocols:aguidetomethodsandapplications”,academicpress,sandiego,ca(1990);marshak等,“strategiesforproteinpurificationandcharacterization-alaboratorycoursemanual”cshlpress(1996);所有这些都通过引用并入本文,如同在此完整阐述一样。其他一般性参考文献贯穿本文件提供。其中的程序被认为是本领域公知的,并且是为了方便读者而提供的。其中包含的所有信息都通过引用并入本文。
实施例1-2的材料和方法
植物材料和生长条件:
使用碧冬茄(petuniaxhybrida)v26品种和商业白花栽培品种(dreamwhite)栽培品种。如在oliva等,(2015)中描述的,种植碧冬茄植物。如tzin等,(2012)中描述的,种植拟南芥植物。
真菌材料和感染方法
灰葡萄孢菌株bo-05的分生孢子在pda培养基上生长10天。在无菌水中从平板上轻轻收集分生孢子并稀释至106个分生孢子/ml。将碧冬茄或拟南芥的相似年龄和大小的新鲜叶片从植物上分离,用水洗涤并置于22℃的人造光下的潮湿室中。将叶片的上侧造成伤口(1-2mm),并将5μl浓度为106个分生孢子/ml的分生孢子悬浮液置于人造伤口上。如结果中详述的,在接种后的特定天数(dpi)进行的接种之后测量腐烂直径。
dcf染色
将叶片在室温下在黑暗中浸入10μmpbs中的2',7'-二氯二氢荧光素二乙酸酯(dcfh-da)(thermofischer)中15分钟,然后用pbs漂洗叶片两次。在具有gfp3过滤器的荧光双目镜(fluorescencebinocular)(leicamzfliii)下对叶片成像,并用1.44版本的imagej(nih)定量绿色荧光。
用苯丙氨酸处理叶片
将碧冬茄叶片在含有0.02%silwettl-77表面活性剂、补充有15mm或0mm苯丙氨酸的双蒸水中浸渍10分钟。然后将叶片置于潮湿盒子中,并且接种有灰葡萄孢的伤口如上所述进行。
统计
通过t-检验或通过使用jmp软件的单向anova来计算统计学显著性分析。
实施例1
用苯丙氨酸处理的植物对病原体表现出更高的抗性
由于增加的苯丙素类,用phe外部处理碧冬茄叶片是否提高对灰葡萄孢病原体的抗性的问题得到了解决。用phe处理碧冬茄离体叶片并进行人工灰葡萄孢接种。与未处理的对照相比,phe处理的对照叶片中的腐烂直径在接种后7天明显更小(图1a-b)。确实,响应于phe的施用,坏死的严重症状和褪绿病的较轻微症状均被减少(图1c)。
对叶进行的外部phe处理提高了其对灰葡萄孢的抗性。这是提出phe供给(饲喂,feeding)作为植物抗真菌处理的首次报道。
在独立实验中,用15mmphe或用h2o2处理的野生型碧冬茄(v26栽培品种)的离体叶片的腐烂直径。通过以下方式用phe处理叶片:在含有0.02%silwettl-77表面活性剂、补充有15mm或0mm苯丙氨酸(对照)的双蒸水中将其浸渍10分钟。就在用灰葡萄孢(菌株bo-05)感染之前,用phe溶液进行处理。通过使叶片具有轻微的伤口(1-2mm)并以106个孢子/ml(灰葡萄孢菌株bo-05的分生孢子)(在pda培养基上生长10天)的浓度添加约5μl的葡萄孢属溶液来进行接种。使用无菌水从平板上轻轻收集分生孢子并稀释至106个分生孢子/ml)。将接种的离体叶片置于22℃的人造光下的潮湿盒子中。
在接种后3、4和7天(dpi)测量坏死面积。关于25片叶子的平均值±se结果表示为以mm*2计的腐烂面积。星号(*)代表转基因系和对照之间的统计学显著差异——利用t-检验,p<0.05(图1d)。接种后第4天,用phe处理和未用phe处理的叶片的照片(图1e,上图)和11dpi接种区域的明视野成像(图1e,下图)。
实施例2
番茄植物的疾病控制
材料和方法
植物
番茄植物(番茄栽培品种-brigate)在苗圃中从种子生长,并在未加热的温室中播种后40至50天移植到1升花盆中。使用5:3:8的npk肥料(计划使灌溉水具有浓度分别为120、30和150mg/l的总n、p和k;ec2.2ds/m),每天用滴水器按比例施肥2-3次,允许25-50%的排水。植物在生长期内在无害虫和无疾病的温室中在自然光下保持在20-30℃和50-90%的相对湿度,然后转移到如下所述在完整的叶片上进行病原体感染后允许疾病发展的区域。
病原体:生长、收获、感染和评估所赋予的疾病的严重性
诱导灰霉病的病原体
将灰葡萄孢[pers.:fr.[teleomorph:botryotiniafuckeliana(debary)whetzel](isolatebci16;[swartzbergd.etal.,eur.j.plantpathol.,2008,120:289-297])]在直径90mm、各自含有15mlpda的培养皿(petriplates)中的马铃薯葡萄糖琼脂(pda,difco,detroit,mi)上进行培养,并在20℃温育。将接种物保持在pda上并每两周转移一次。通过在具有自来水的玻璃管中搅拌1cm2、含有菌丝体和分生孢子的琼脂,从10至14日龄的培养物中收获灰霉病分生孢子。然后通过粗棉布(cheesecloth)过滤悬浮液。使用血细胞计数器和光学显微镜确定分生孢子的浓度,并将其调节至5×105个分生孢子/ml。由于灰葡萄孢分生孢子需要碳和磷酸盐用于萌发和渗透,因此将0.1%葡萄糖与0.1%kh2po4一起添加到最终的分生孢子悬浮液中。已经显示这些补充物促进灰葡萄孢分生孢子的萌发和随后叶片感染。
检查植物附着的(plantattached)番茄叶片。将整株植物保持在22±1℃、97±3%rh和1020勒克斯光强度的湿度室中。通过在两片成熟叶上放置10μl液滴的5×105个分生孢子/ml的悬浮液、5滴/叶(每片小叶上一滴)来感染植物。
使用图匙(图示键、图钥,pictorialkey)评估每株植物的疾病严重性;0=无感染(感染部位无症状),100=所有感染部位完全被灰霉病症状覆盖。对所述植物进行分析。
在实验过程中,将生长室的温度保持在20±1℃和75-90%rh。
苯丙氨酸处理
苯丙氨酸处理由在用灰葡萄孢感染前3天和0天进行施用浓度为0.5-4.1mm的喷洒或浸透组成。对照植物用水处理并保持在与上述相同的条件下。
统计分析
实验中的处理重复5次。各处理的重复被随机排列。在进一步分析之前,将以百分比计的疾病严重性数据进行反正弦转换。使用anova和fisher's保护lsd测试分析疾病严重性数据,并且在单向方差分析之后以统计学方式将疾病水平分开(<0.05)。
结果
通过苯丙氨酸控制灰霉病
当苯丙氨酸以0.5至4.1mm的浓度向根部区域浸透施用时(图2a)和当苯丙氨酸以1.0至4.1mm的浓度喷洒在植物上时(图2b),疾病严重性显著降低。
实施例3
通过用外源苯丙氨酸喷洒植物或浸透花盆处理整株碧冬茄植物提高对灰葡萄孢的耐受性
在phe处理之后3天进行灰葡萄孢接种。在这种情况下,仅进行了一次phe处理,然而可以采用多次处理,例如,接种前三天进行第一次和接种当天进行第二次(数据未显示但结果类似)。如上所述,用灰葡萄孢接种18片叶子。用尼龙袋覆盖植物并保持在光照下和22℃下(如上所述)。腐烂面积(mm*2)结果表示为平均值±se并显示在图2c-2d中。
值得注意的是,将4.1mm的phe与6mm的phe进行比较,并且抗性程度稍低,支持如下文进一步确认的剂量响应。
实施例4
植物对灰葡萄孢的耐受性随着通过喷洒植物或浸透花盆、以剂量响应方式进行phe处理而提高
如以上实施例3中所述,通过喷洒植物(图3a)或浸透花盆(图3b)来处理商业碧冬茄植物('dreamheaven'),这次用提高浓度的phe(6-50mm)。
在两种情况下,如图3a-b所示,较高phe浓度导致植物对灰葡萄孢的抗性提高,并且抗性持续更长时间。用phe溶液喷洒后7天和浸透花盆后10天,用较高phe浓度(35和50mm)处理的植物显示腐烂面积没有增加。图3c-d中显示了对于各种处理的植物的静止图像(stillimages)。
番茄植物获得了类似的结果(图3c)。具体地,用提高浓度的phe溶液(0.5-30mmphe水溶液,无去污剂)喷洒番茄植物,并在处理后11天测定疾病严重性百分比。另外,较高的浓度,如20和30mm,导致抗性提高持续较长时间段(结果未显示)。
向phe溶液中添加表面活性剂(0.01%tween80)改善了对灰葡萄孢的抗性提高的效果(图3d)。
实施例5
用外源苯丙氨酸处理切割的假叶树属的枝提高对灰葡萄孢的耐受性
假叶树属的枝充当观赏性装饰。这些植物对葡萄孢属非常敏感。通过在phe溶液中浸透切割的枝的尖端(图4b),或者将整个切割的枝浸渍在phe溶液中一小时,然后将其浸渍在水中并用葡萄孢属接种。在两种处理中,使用的浓度是6mm苯丙氨酸,而对于浸透处理,添加另外的浓度20mm(图4a)。对于浸渍实验,将50ppm的t.o.g-6添加到phe溶液中以防止在实验的日子中细菌生长。将对照枝浸透在水中和浸渍于含50ppm的t.o.g-6的水中。如上述实施例中所述,将假叶树属叶片造成伤口并用灰葡萄孢接种。腐烂面积(mm*2)结果表示为10次重复的平均值±se,每次重复是来自10个枝中的一个的一片叶子。
如从图4a中可以看出,在6mm的phe中浸渍整个枝一小时,显著提高了植物对葡萄孢属的抗性。
实施例6
用外源苯丙氨酸处理甜罗勒提高对白腐病(核盘菌)的耐受性
如关于番茄所述,用4.1mm的phe处理花盆中的甜罗勒植物,并用来自4天马铃薯葡萄糖琼脂培养(白腐病)的核盘菌菌丝体盘接种,其与葡萄孢属有关,均来自子囊菌门。
处理显示由腐烂面积确定的疾病症状显著减少(如上所述)。参见图5a-b。图5b显示了由核盘菌感染引起白霉病的甜罗勒植物。
实施例7
用外源苯丙氨酸处理番茄提高对白腐病(核盘菌)的耐受性
如以上实施例中所示,除了提高甜罗勒对白腐病的抗性之外,苯丙氨酸喷洒和浸透处理(与实施例6中关于甜罗勒描述的那些相同)也提高番茄叶对这种与葡萄孢属有关的真菌的抗性(图6a-b)。
图6b显示了由核盘菌感染导致白霉病的番茄小叶。
实施例8
用外源苯丙氨酸处理柠檬提高对由plenodomustracheiphilus,异名柠檬干枯病菌真菌引起的柠檬枝枯病的耐受性
如关于番茄所述,通过每花盆浸透10ml溶液或喷洒,用4mm的phe水溶液处理花盆中的柠檬植物。在用针将叶片造成伤口后,通过plenodomustracheiphilus的分生孢子悬浮液实施感染。两种处理都提高了植物叶片对真菌的抗性,如图7a所示。疾病发病率根据受感染叶片上成功感染部位的量来评估,并表示为受感染叶片的百分比。
图7b显示了柠檬叶,其显示由plenodomustracheiphilus引起的典型的柠檬枝枯病。
实施例9
用外源苯丙氨酸处理采后的鳄梨果实提高对链格孢的耐受性
将栽培品种'ettinger'的鳄梨果实浸渍在水中或1mm或4mm的苯丙氨酸中30秒,并在5℃下储存一天。然后将鳄梨果实在果实赤道处用浓度为105个分生孢子/ml的链格孢在果实两侧接种。在接种后6天期间监测腐烂面积,同时在23℃下温育。显著地,在接种后6天,以1-4mm的苯丙氨酸浸渍使由链格孢引起的褐斑的面积减少了4倍(参见图8)。
实施例10
用外源苯丙氨酸处理黄瓜植物提高对瓜果腐霉的耐受性
黄瓜小植株品种(cv.)betalpha,并生长在泥炭基生长培养基中,通过每盆10ml、4mm苯丙氨酸溶液浸透来处理,每个花盆含有4株植物。并且在各处理中测定存活的小植株百分比。图9a显示了在phe处理和phe未处理的花盆中由于猝倒病(瓜果腐霉)导致的死亡植物的百分比。图9b表示各处理的两个花盆;下排的花盆未被处理,上排的花盆用4mm的phe处理。
实施例11
用酪氨酸喷洒番茄和碧冬茄植物导致对灰葡萄孢的抗性提高,类似于phe。
如上所述,用葡萄孢属感染番茄植物(图10a)和碧冬茄植物(图10b)。通过单独和组合喷洒施用浓度为0.5mm的tyr、phe减少了灰葡萄孢感染。如上所述评估疾病。用通过单独和组合喷洒施用4mm的tyr或phe获得了类似的结果(结果未表示)。
尽管已经结合本发明的具体实施方式描述了本发明,但显然许多替代、修改和变化对于本领域技术人员而言将是显而易见的。因此,旨在涵盖落入所附权利要求的精神和广泛范围内的所有这些替代、修改和变化。
本说明书中提及的所有出版物、专利和专利申请均通过引用以其整体并入本说明书中,其程度如同每个单独的出版物、专利或专利申请被具体和单独地被指出通过引用并入本文。另外,本申请中任何参考文献的引用或标识不应被解释为承认这样的参考文献可用作本发明的现有技术。就使用章节标题来说,它们不应被解释为必然限制。
参考文献
1.alonm,malkao,eakteimang,elbazm,moyalbenzvim,vainsteina,morins.2013.activationofthephenylpropanoidpathwayinnicotianatabacumimprovestheperformanceofthewhiteflybemisiatabaciviareducedjasmonatesignaling.plosone8,e76619.
2.aranega-boup,delaoleyvam,finitii,garcía-agustínp,gonzález-boschc.2014.primingofplantresistancebynaturalcompounds.hexanoicacidasamodel.plantphysiology5,488.
3.asselberghb,curversk,francasc,audenaertk,vuylstekem,vanbreusegemf,
4.bahadura,singhdp,sarmabk,singhup.2012.foliarapplicationofl-phenylalanineandferulicacidstopeaplants:inducedphenylalanineammonialyaseactivityandresistanceagainsterysiphepisi.archivesofphytopathologyandplantprotection45,398–403.
5.baishp,walkerts,schweizerhp,vivancojm.2002.rootspecificelicitationandantimicrobialactivityofrosmarinicacidinhairyrootculturesofocimumbasilicum.plantphysiologyandbiochemistry40,983–995.
6.
7.chenm,chengb,zhangq,dingy,yangz,liup.2005.[effectsofapplyingl-methionine,l-phenylalanineandl-tryptophanonzeamaysgrowthanditsnutrientuptake].yingyongshengtaixuebao=thejournalofappliedecology/zhongguoshengtaixuexuehui,zhongguokexueyuanshenyangyingyongshengtaiyanjiusuozhuban16,1033–1037.
8.chenz,zhengz,huangj,laiz,fanb.2009.biosynthesisofsalicylicacidinplants.plantsignaling&behavior4,493–496.
9.choquerm,fourniere,kunzc,levisc,pradierj-m,simona,viaudm.2007.botrytiscinereavirulencefactors:newinsightsintoanecrotrophicandpolyphageouspathogen.femsmicrobiologyletters277,1–10.
10.dickmanmb,fluhrr.2013.centralityofhostcelldeathinplant-microbeinteractions.annualreviewofphytopathology,51,543-570.
11.elady.1992.theuseofantioxidants(freeradicalscavengers)tocontrolgreymould(botrytiscinerea)andwhitemould(sclerotiniasclerotiomm)invariouscrops.plantpathology41,417–426.
12.elady,pertoti,cotespradoam,stewarta.2016.planthostsofbotrytisspp.in:fillingers,in:fillingersandelady,eds.botrytis–thefungus,thepathogenanditsmanagementinagriculturalsystems.springerinternationalpublishing,pp413–486.
13.fillingers,elady(eds).2016.botrytis–thefungus,thepathogenanditsmanagementinagriculturalsystems.springer.
14.greycb,cowandp,langtonsd,watkinsrw.1997.systemicapplicationofl-phenylalanineincreasesplantresistancetovertebrateherbivory.journalofchemicalecology23,1463–1470.
15.hiratah,ohnishit,ishidah,tomidak,sakaim,haram,watanaben.2012.functionalcharacterizationofaromaticaminoacidaminotransferaseinvolvedin2-phenylethanolbiosynthesisinisolatedrosepetalprotoplasts.journalofplantphysiology169,444–451.
16.kucj.1995.phytoalexins,stressmetabolism,anddiseaseresistanceinplants.annualreviewofphytopathology33,275–297.
17.lattanziov,lattanziovm,cardinalia.2006.roleofphenolicsintheresistancemechanismsofplantsagainstfungalpathogensandinsects.phytochemistry:advancesinresearch661,23–67.
18.maedah,dudarevan.2012.theshikimatepathwayandaromaticaminoacidbiosynthesisinplants.annualreviewofplantbiology63,73–105.
19.manelan,olivam,ovadiar,sikron-persin,ayenewb,faita,galilig,perla,weissd,oren-shamirm.2015.phenylalanineandtyrosinelevelsarerate-limitingfactorsinproductionofhealthpromotingmetabolitesinvitisviniferacv.gamayredcellsuspension.frontiersinplantscience6.
20.nakabayashir,yonekura-sakakibarak,uranok,etal.2014.enhancementofoxidativeanddroughttoleranceinarabidopsisbyoveraccumulationofantioxidantflavonoids.theplantjournal77,367–379.
21.nakajimam,akutsuk.2014.virulencefactorsofbotrytiscinerea.journalofgeneralplantpathology80,15–23.
22.olivam,ovadiar,perla,bare,lewinsohne,galilig,oren-shamirm.2015a.enhancedformationofaromaticaminoacidsincreasesfragrancewithoutaffectingflowerlongevityorpigmentationinpetunia×hybrida.plantbiotechnologyjournal13,125–136.
23.olivam,ovadiar,perla,bare,lewinsohne,galilig,oren-shamirm.2015b.enhancedformationofaromaticaminoacidsincreasesfragrancewithoutaffectingflowerlongevityorpigmentationinpetunia×hybrida.plantbiotechnologyjournal13,125–136.
24.pandeyp,ramegowdav,senthil-kumarm.2015.sharedanduniqueresponsesofplantstomultipleindividualstressesandstresscombinations:physiologicalandmolecularmechanisms.plantphysiology,723.
25.pateltk,krasnyanskisf,allengc,louwsfj,pantheedr,williamsonjd.2015.tomatoplantsoverexpressingacelerymannitoldehydrogenase(mtd)havedecreasedsusceptibilityto&;lt;i&;gt;botrytiscinerea&;lt;/i&;gt;americanjournalofplantsciences06,1116–1125.
26.pennycookejc,coxs,stushnoffc.2005.relationshipofcoldacclimation,totalphenoliccontentandantioxidantcapacitywithchillingtoleranceinpetunia(petunia×hybrida).environmentalandexperimentalbotany53,225–232.
27.petersenm,abdullahy,bennerj,etal.2009.evolutionofrosmarinicacidbiosynthesis.phytochemistry70,1663–1679.
28.scalschil,sanmartínm,
29.shekarchim,hajimehdipoorh,saeidnias,gohariar,hamedanimp.2012.comparativestudyofrosmarinicacidcontentinsomeplantsoflabiataefamily.pharmacognosymagazine8,37–41.
30.siegmundu,viefhuesa.2016.reactiveoxygenspeciesinthebotrytis–hostinteraction.in:fillingers,in:elady,eds.botrytis–thefungus,thepathogenanditsmanagementinagriculturalsystems.springerinternationalpublishing,269–289.
31.songgc,choihk,ryuc-m.2013.thefolateprecursorpara-aminobenzoicacidelicitsinducedresistanceagainstcucumbermosaicvirusandxanthomonasaxonopodis.annalsofbotany,mct049.
32.szarkaa,tomasskovicsb,bánhegyig.2012.theascorbate-glutathione-α-tocopheroltriadinabioticstressresponse.internationaljournalofmolecularsciences13,4458–4483.
33.tohget,watanabem,hoefgenr,ferniear.2013.shikimateandphenylalaninebiosynthesisinthegreenlineage.frontiersinplantscience4.
34.tzinv,galilig.2010.thebiosyntheticpathwaysforshikimateandaromaticaminoacidsinarabidopsisthaliana.thearabidopsisbook/americansocietyofplantbiologists8,e0132.
35.tzinv,malitskys,benzvimm,bedairm,sumnerl,aharonia,galilig.2012a.expressionofabacterialfeedback-insensitive3-deoxy-d-arabino-heptulosonate7-phosphatesynthaseoftheshikimatepathwayinarabidopsiselucidatespotentialmetabolicbottlenecksbetweenprimaryandsecondarymetabolism.thenewphytologist194,430–439.
36.tzinv,rogachevi,meirs,zvimmb,mascit,vainsteina,aharonia,galilig.2013.tomatofruitsexpressingabacterialfeedback-insensitive3-deoxy-d-arabino-heptulosonate7-phosphatesynthaseoftheshikimatepathwaypossessenhancedlevelsofmultiplespecializedmetabolitesandupgradedaroma.journalofexperimentalbotany64,4441–4452.
37.vogtt.2010.phenylpropanoidbiosynthesis.molecularplant3,2–20.
38.wangh,liug,lic,powellalt,reidms,zhangz,jiangc-z.2013.defenceresponsesregulatedbyjasmonateanddelayedsenescencecausedbyethylenereceptormutationcontributetothetoleranceofpetuniatobotrytiscinerea.molecularplantpathology14,453–469.
39.zhangy,destefanor,robinem,butellie,bullingk,hilll,rejzekm,martinc,schoonbeekh-j.2015.differentreactiveoxygenspeciesscavengingpropertiesofflavonoidsdeterminetheirabilitiestoextendtheshelflifeoftomato.plantphysiology169,1568–1583.
- 还没有人留言评论。精彩留言会获得点赞!