一种白及愈伤组织的诱导培养方法与流程
本发明涉及中药材药物研究技术领域,涉及一种愈伤组织培养方法,具体涉及一种白及愈伤组织的诱导培养方法。
背景技术:
白及(bletillastriata(thunb.)rchb.f.)为兰科白及属的多年生草本药用植物,在我国主产于长江流域、甘肃、陕西等地。白及是我国传统的名贵中药材,药用价值广泛。历代药典记录其具有收敛止血、消肿生肌的功效,可用于治疗咯血、吐血、外伤出血、疮疡肿毒、皮肤皲裂等疾病。现代药理学研究表明,白及具有抗菌、抗氧化、抗肿瘤、抗消化性溃疡、免疫调节等作用。除了在药用方面的应用,白及还被用作工业、园艺等的原材料,其用途还在不断拓展,人们对白及的需求量正在急速增加。由于生态环境的破坏和过度采挖,野生白及的种群类型和数量急剧下降,濒临灭绝,急需开展种质资源保护和拓展、新品种选育、种苗快繁等方面的研究,而愈伤组织的诱导和繁育是这些研究的良好基础。因此,建立和优化出白及愈伤诱导和增殖培养的培养基配方和技术体系具有十分重要的基础研究和应用实践的价值。
发明人对白及的愈伤组织诱导和繁育进行了大量研究,在学术论文(不同激素配比对白及愈伤组织诱导、增殖和分化的影响,徐德林等,北方园艺,2016)中公布了一种白及愈伤组织诱导、增殖和分化的方法。其中,白及愈伤组织诱导采用的培养基为含6-苄氨基嘌呤(6-ba)或2,4-二氯苯氧乙酸(2,4-d)的ms固体培养基,增殖培养采用的培养基为含6-苄氨基嘌呤(6-ba)或2,4-二氯苯氧乙酸(2,4-d)的ms固体培养基。在完成白及愈伤组织诱导后,需要将愈伤组织从诱导培养基中取出,对愈伤组织进行清洗等各种处理,再放入继代培养基中进行增殖(继代)培养。上述操作非常繁琐,从固体的诱导培养基取出愈伤组织以及后续处理的过程易损伤愈伤组织,因愈伤组织生长时有一个生长核心,一旦破坏,愈伤组织就难以恢复分裂和生长。并且选择固体的增殖培养基不利于愈伤组织形成分散性好的游离小细胞团,难以为后续的诱导分化培养提供性质均一的愈伤组织。另外,采用固体的诱导培养基和继代培养基,不利于调节控制培养基中各营养物质和激素等的水平,不利于对诱导培养方法和过程进行优化和完善。
技术实现要素:
本发明主要解决的技术问题是提供一种白及愈伤组织的诱导培养方法,该诱导培养方法采取悬浮培养的方法对白及愈伤组织进行诱导和继代培养,并提供了一种愈伤组织诱导培养和继代培养的培养基。该方法可以易化对白及愈伤组织生长分化最佳条件进行研究的过程,减小毒性次生代谢产物对白及愈伤组织的影响,提供一个相对一致的白及愈伤组织细胞群体等。
为达到上述目的,本发明提出了以下技术方案:
一种白及愈伤组织的诱导培养方法,包括对白及种子的愈伤组织诱导培养和对愈伤组织的继代培养,所述愈伤组织诱导培养和所述继代培养均采用悬浮培养的方式,且均使用含有植物生长调节剂的ms液体培养基。
采用上述技术方案,技术原理为:使用含有植物生长调节剂的ms液体培养基对白及种子进行悬浮培养以诱导愈伤组织的产生;使用含有植物生长调节剂的ms液体培养基对白及愈伤组织进行悬浮培养以促进白及愈伤组织的增殖。
愈伤组织是在离体培养条件下,经植物细胞脱分化和不断增殖所形成的无特定结构的组织。植物外植体(白及种子)在培养基的作用下,经过一个复杂的过程形成愈伤组织。外植体组织受外界条件刺激后,开始改变原来的分裂方向和代谢方式,合成代谢活动加强,大量合成蛋白质和核酸物质,为细胞分裂做准备。
ms培养基为含盐量较大的培养基,比较适合愈伤组织诱导和愈伤组织的继代培养,高盐浓度的培养基对培养过程中愈伤组织数量及鲜重的增加有利。植物生长调节剂可以促进白及种子中的细胞脱分化,刺激白及细胞改变原有的遗传程式,刺激白及细胞分裂,最终形成愈伤组织,并刺激愈伤组织继续分裂生长。悬浮培养指的是一种在受到不断搅动或摇动的液体培养基里,培养单细胞及小细胞团的组织培养系统,是非贴壁依赖性细胞的一种培养方式。
本技术方案的有益效果具体如下:
本技术方案在愈伤组织诱导培养和继代培养中,均采用悬浮培养的方式。而现有技术中,愈伤组织诱导培养和继代培养均采用固体培养基对外植体进行愈伤组织诱导和继代培养。现有技术的方案存在较多缺陷。缺陷1:固体培养基配制完成后,较难对培养基成分和培养基含氧量等因素进行调控,不利于对白及愈伤组织生长分化最佳条件进行研究。缺陷2:愈伤组织在固体培养基中产生的次生代谢产物聚集在愈伤组织周围,不能或较难扩散到培养基的其他部位,从而导致待培养愈伤组织周围次生代谢产物聚集过多,其中一些毒性产物对愈伤组织的分裂以及生长造成了负面影响,使得愈伤组织出现大量褐化现象。缺点3:愈伤组织吸收利用完周边固体培养基的营养物质或植物生长调节剂后,难以利用较远位置的培养基中的物质,使得固体培养基物质利用率低。缺点4:在固体培养基中,愈伤组织细胞大量聚集,分散度很低,导致具有不同分化潜能的愈伤组织细胞团聚集,不能提供相对一致的细胞群体,不利于后期的诱导分化的进行,也不利于对植物的生理生化、胚胎发生、基因表达等方面的研究。缺点5:固体培养基不利于调节培养基中含氧量,从而不利于通过调节氧气含量来控制愈伤组织的生长状态,而在悬浮培养体系中,可以通过多种方式实现对培养基中含氧量的调节。
采用悬浮培养的方法可克服上述缺陷,可以易化对白及愈伤组织生长分化最佳条件进行研究的过程,减小毒性次生代谢产物对白及愈伤组织的影响,提供相对一致的白及愈伤组织细胞群体等。现有技术中,白及的愈伤组织诱导和继代培养通常采用固体培养基进行。特别是对于愈伤组织诱导,人们通常认为植物细胞脱分化的过程需要将外植体的细胞生长和分裂水平维持在一个较低的水平,将外植体置于固体培养集中静置培养,可使得培养基中化学物质作用于已有的植物细胞,从而促进细胞脱分化。通常认为,过高的外植体细胞生长和分裂水平,不利于培养基环境对细胞脱分化的促进。通过研究发现,悬浮培养可以使得外植体细胞和植物生长调节剂以及其他物质充分混合,虽然悬浮培养使得外植体细胞生长和分裂的水平增加,但悬浮培养仍然可以较为高效的促进外植体愈伤组织的形成。本方案克服了技术偏见,采用了悬浮培养的方法诱导白及种子愈伤组织的产生,以及促进愈伤组织的继代培养。
愈伤组织诱导培养和继代培养采用相同的培养基,可简化培养步骤。通常在愈伤组织诱导培养之后转培养基时,需要对愈伤组织进行清洗处理,以消除愈伤组织诱导培养基中的化学物质对后续采用的继代培养基的影响。愈伤组织诱导培养和继代培养采用相同的培养基,可以省略上述步骤,并且操作方便,简单实用,特别适合于进行大量对照实验或工业化生产愈伤组织(利用愈伤组织制造某天然物质)等的情况。
综上所述,本技术方案的有益效果为:
(1)提供相对一致的细胞群体,利于后期的诱导分化的进行;
(2)防止毒性次生代谢产物积累,从而促进愈伤组织形成和生长;
(3)可通过调节氧气含量来控制愈伤组织的生长状态;
(4)提供相对一致的白及愈伤组织细胞群体;
(5)易化对白及愈伤组织生长分化最佳条件进行研究的过程;
(6)愈伤组织诱导培养和继代培养采用相同的培养基,可简化培养步骤。
进一步,所述植物生长调节剂包括了6-苄氨基嘌呤、2,4-二氯苯氧乙酸和萘乙酸三种物质组成的混合物。
采用上述技术方案,6-苄氨基嘌呤(6-ba)是一种人工合成的细胞分裂素。2,4-二氯苯氧乙酸(2,4-d)是一种生长素类似物。萘乙酸(naa)是一种广谱型植物生长调节剂,能促进细胞分裂与扩大,诱导形成不定根增加座果,防止落果,改变雌、雄花比率等。
现有技术公布了含6-苄氨基嘌呤(6-ba)和2,4-二氯苯氧乙酸(2,4-d)的ms固体培养基能诱导出高质量的优质愈伤组织且诱导率、黄绿色愈伤组织所占的比率相对较高,愈伤组织较为疏松。并且6-ba和2,4-d的组合可以促进继代培养中愈伤组织的增殖。但同时认为,萘乙酸(naa)对白及愈伤组织的分化具有积极的作用,而愈伤组织的形成需要细胞脱分化。但发明人研究发现,采用6-ba、2,4-d和naa的组合,可以更好地促进白及种子愈伤组织的形成和愈伤组织在继代培养中的增殖,本技术方案克服了之前的技术偏见。
进一步,6-苄氨基嘌呤在ms液体培养基中的含量为:0.300-1.000mg/l;2,4-二氯苯氧乙酸在ms液体培养基中的含量为:1.270-2.000mg/l;萘乙酸在ms液体培养基中的含量为:0.262-1.000mg/l。
采用上述技术方案,按照上述植物生长调节剂的含量范围进行ms液体培养基的配制,使用含植物生长调节剂的ms液体培养基对白及愈伤组织进行诱导培养和继代培养,可获得颜色黄绿色、质疏松、增殖较快和生长旺盛的白及愈伤组织,并明显减少白及愈伤组织的褐化率。
进一步,所述ms液体培养基含有20-30g/l的蔗糖。
采用上述技术方案,培养的植物愈伤组织时,愈伤组织中不含叶绿体或叶绿体含量少,愈伤组织不能进行光合作用或者光合作用很弱。或者在对愈伤组织进行暗培养时,没有光源提供,导致光合作用不能进行。光合作用不能进行或者光合作用弱,会导致白及愈伤组织缺乏碳水化合物,从而阻碍白及愈伤组织正常分裂和生长。因此,需要在培养基中附加一些碳水化合物以供需要。培养基中的碳水化合物通常是蔗糖。蔗糖除作为培养基内的碳源和能源外,对维持培养基的渗透压也起重要作用。20-30g/l的蔗糖可以以被动扩散的形式进入植物细胞内而被植物利用。同时白及愈伤组织细胞内有蔗糖转化酶,可以吸收和利用蔗糖。
进一步,在所述愈伤组织诱导培养和所述继代培养中,ms液体培养基的ph为5.8-6.0。
采用上述技术方案,培养基ph值影响愈伤组织对营养元素的吸收、呼吸代谢、多胺代谢和dna合成,以及影响植物生长调节剂对愈伤组织细胞的作用,从而影响愈伤组织的形成及形态建成。ms液体培养基的酸碱度为ph5.8-6.0,为愈伤组织的分裂生长提供了适宜的酸碱度环境。
进一步,在所述愈伤组织诱导培养和所述继代培养中,培养条件均为暗培养,23-27℃的培养温度,100-120r/min的转速。
采用上述技术方案,23-27℃的培养温度为适宜白及愈伤组织大量生长分裂的温度。愈伤组织形成过程为植物细胞脱分化的过程,光会阻碍组织的脱分化,使得愈伤组织生长速度变慢。并且在形成愈伤组织时,光容易导致细胞再分化,不能达到形成大量愈伤组织的目的。因此,本技术方案优选暗培养的培养条件对白及愈伤组织进行诱导培养和继代培养。100-120r/min的转速保证了氧气可持续溶解于液体培养基中,为愈伤组织的分裂和生长提供足够的氧气。
进一步,在愈伤组织诱导培养之前设有前处理步骤,所述前处理步骤为:获取白及种子,并对白及种子进行消毒处理。
采用上述技术方案,对白及种子进行消毒处理可以防止细菌、霉菌以及其他的微生物污染培养基,提高白及愈伤组织诱导以及继代培养的成功率,并提高白及愈伤组织质量。
进一步,所述消毒处理为对白及种子按如下顺序进行消毒操作:酒精消毒,无菌水冲洗,用氯化汞溶液进行消毒,无菌水冲洗,用无菌吸水纸吸干白及种子表面水分。
采用上述技术方案,使用消毒剂反复消毒处理,并在使用消毒剂后用无菌水冲洗,可以防止消毒剂对植物细胞产生毒性作用,从而防止由于该毒性作用致使的白及愈伤组织培养效果较差的现象。
进一步,所述愈伤组织诱导培养的培养时间为30-50天。
采用上述技术方案,经过观察,使用含植物生长调节剂的ms液体培养基可在30-50天诱导出白及种子愈伤组织。
进一步,在所述继代培养中,每隔15-35天将原ms液体培养基更换为新鲜的ms液体培养基。
采用上述技术方案,续愈伤组织细胞在继代培养基中大量生长,消耗培养基中的营养物质,并产生大量次生代谢产物,需要定期更换新鲜培养基以维持白及愈伤组织的正常生长,防止褐化的产生。
附图说明
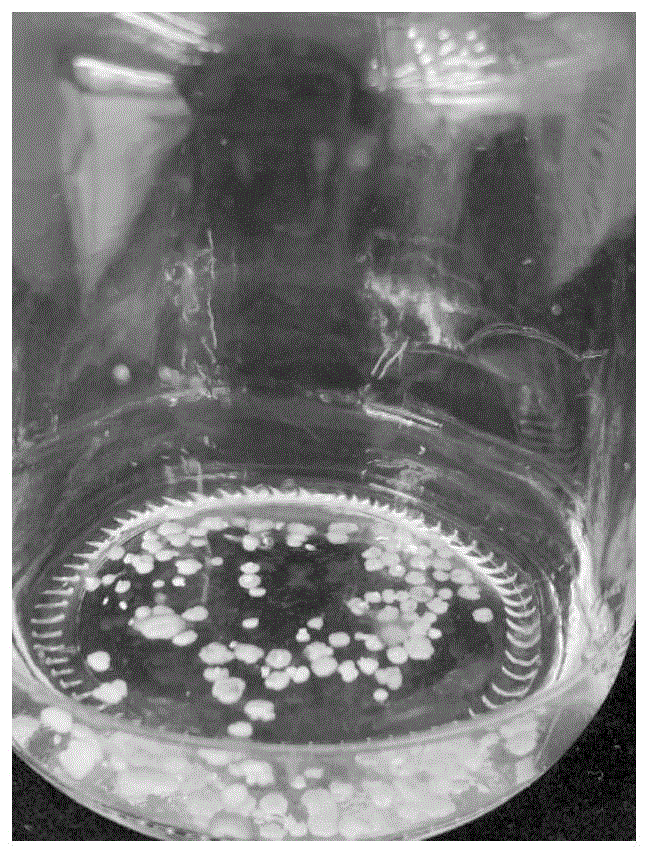
图1为生长有白及愈伤组织的培养基的照片,展示了实施例1中继代培养20天后白及愈伤组织形态、褐化情况和培养基清亮程度。
图2为生长有白及愈伤组织的培养基的照片,展示了实施例2中继代培养20天后白及愈伤组织形态、褐化情况和培养基清亮程度。
图3为生长有白及愈伤组织的培养基的照片,展示了对比例1中继代培养20天后白及愈伤组织形态、褐化情况和培养基清亮程度。
图4为生长有白及愈伤组织的培养基的照片,展示了对比例2中继代培养20天后白及愈伤组织形态、褐化情况和培养基清亮程度。
图5为生长有白及愈伤组织的培养基的照片,展示了对比例3中继代培养20天后白及愈伤组织形态、褐化情况和培养基清亮程度。
图6为生长有白及愈伤组织的培养基的照片,展示了对比例4中继代培养20天后白及愈伤组织形态、褐化情况和培养基清亮程度。
具体实施方式
实施例1
步骤一、取尚未开裂的白及成熟蒴果,流水下冲洗20min,剥开白及蒴果,将白及种子倒入已灭菌的10ml的ep管中。将ep管置与超净工作台中并打开,用75%酒精浸泡30s,并不断轻摇,然后用无菌水冲洗种子3次,之后再在ep管中加入含有两滴tween-80的0.1%氯化汞溶液,浸泡种子20s,浸泡过程中不断轻摇,最后用无菌水冲洗种子5次,用吸水纸吸干种子表面的水分,备用;
步骤二、将所得到的无菌白及种子转入诱导培养基中,诱导培养基ph值为6.0,诱导培养温度为25℃,采用暗培养的方式,转速为120r/min。诱导培养基由如下成分组成:ms液体培养基、0.480mg/l6-ba、1.685mg/l2,4-d、0.346mg/lnaa、25g/l蔗糖。在培养过程中定期观察愈伤组织的发生情况,诱导培养35天后诱导培养基中出现大量愈伤组织。计算愈伤组织诱导率:愈伤诱导率=愈伤组织数/接入外植体数×100%,在本实施例中愈伤组织的诱导率为94.23%。
步骤三:将步骤二中诱导培养基上挑选出疏松、嫩黄色的愈伤组织接种到继代培养基上。继代培养基由如下成分组成:ms液体培养基、0.480mg/l6-ba、1.685mg/l2,4-d、0.346mg/lnaa、25g/l蔗糖。培养基ph值为6.0,诱导培养温度为25℃,采用暗培养的方式,转速为120r/min。20天后统计愈伤织增殖率,并随时观察愈伤组织的生长状况。愈伤组织增殖率=增殖后愈伤组织鲜重/增殖前愈伤组织鲜重×100%。
继代培养20天之后(见图1),观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织明显膨大,结构更加疏松,愈伤组织很少褐化,培养基清亮,计算的愈伤组织增殖率为6.21%。
实施例2
本实施例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、0.760mg/l6-ba、1.635mg/l2,4-d、0.631mg/lnaa、30g/l蔗糖。
本实施例中,诱导培养32天后诱导培养基中出现大量愈伤组织,在本实施例中愈伤组织的诱导率为91.69%。继代培养20天之后(见图2),观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织明显膨大,结构更加疏松,愈伤组织很少褐化,培养基清亮,计算的愈伤组织增殖率为6.28%。
实施例3
本实施例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、1.000mg/l6-ba、2.000mg/l2,4-d、1.000mg/lnaa、20g/l蔗糖。
本实施例中,诱导培养36天后诱导培养基中出现大量愈伤组织,在本实施例中愈伤组织的诱导率为90.90%。继代培养20天之后,观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织明显膨大,结构更加疏松,愈伤组织很少褐化,培养基清亮,计算的愈伤组织增殖率为6.17%。
实施例4
本实施例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、0.300mg/l6-ba、1.270mg/l2,4-d、0.262mg/lnaa、25g/l蔗糖。
本实施例中,诱导培养30天后诱导培养基中出现大量愈伤组织,在本实施例中愈伤组织的诱导率为91.41%。继代培养20天之后,观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织明显膨大,结构更加疏松,愈伤组织很少褐化,培养基清亮,计算的愈伤组织增殖率为6.07%。
对比例1
本对比例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、2.0mg/l6-ba、3.0mg/l2,4-d、1.5mg/lnaa、20g/l蔗糖。
本对比中,诱导培养46天后诱导培养基中出现大量愈伤组织,继代培养20天之后,观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织出现了较多的褐化现象,培养基较为浑浊,计算的愈伤组织增殖率为4.21%。
对比例2
本对比例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、2.0mg/l6-ba、4.0mg/l2,4-d、2.0mg/lnaa、25g/l蔗糖。
本对比中,诱导培养42天后诱导培养基中出现大量愈伤组织,继代培养20天之后,观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织出现了较多的褐化现象,培养基较为浑浊,计算的愈伤组织增殖率为3.84%。
对比例3
本对比例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、0.1mg/l6-ba、1.0mg/l2,4-d、0.1mg/lnaa、15g/l蔗糖。
本对比中,诱导培养47天后诱导培养基中出现大量愈伤组织,继代培养20天之后,观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织出现了较多的褐化现象,培养基较为浑浊,计算的愈伤组织增殖率为4.68%。
对比例4
本对比例操作方法基本同实施例1,不同点在于在步骤二和步骤三中,使用的诱导培养基和继代培养基由如下成分组成:ms液体培养基、0.05mg/l6-ba、0.5mg/l2,4-d、0.05mg/lnaa、10g/l蔗糖。
本对比中,诱导培养50天后诱导培养基中出现大量愈伤组织,继代培养20天之后,观察愈伤组织在悬浮培养继代之后比20天前的愈伤组织出现了较多的褐化现象,培养基较为浑浊,计算的愈伤组织增殖率为4.32%。
对比例5
本对比例采用固体培养基对白及愈伤组织进行诱导,具体操作过程如下:
步骤一、取尚未开裂的白及成熟蒴果,流水下冲洗20min,剥开白及蒴果,将白及种子倒入已灭菌的10ml的ep管中。将ep管置与超净工作台中并打开,用75%酒精浸泡30s,并不断轻摇,然后用无菌水冲洗种子3次,之后再在ep管中加入含有两滴tween-80的0.1%氯化汞溶液,浸泡种子20s,浸泡过程中不断轻摇,最后用无菌水冲洗种子5次,用吸水纸吸干种子表面的水分,备用;
步骤二、用镊子夹起种子并均匀播撒入固体诱导培养基中,进行固体培养基诱导培养,诱导培养时间设置为60天。固体诱导培养基由如下成分组成:ms固体培养基、0.480mg/l6-ba、1.685mg/l2,4-d、0.346mg/lnaa、25g/l蔗糖。诱导培养结束后计算诱导率:愈伤诱导率=愈伤组织数/接入外植体数×100%,在本对比例中愈伤组织的诱导率为84.06%。
表1为对实施例1-4和对比例1-4的总结,由实验结果可知:采用含如下成分的ms液体培养基:0.300-1.000mg/l6-苄氨基嘌呤、1.270-2.000mg/l2,4-二氯苯氧乙酸、0.262-1.000mg/l萘乙酸,20-30g/l蔗糖,可在继代培养中得到获得颜色黄绿色、质疏松、增殖较快和生长旺盛的白及愈伤组织,并且白及愈伤组织的褐化率得到了明显的下降。
表1:对实施例1-4和对比例1-4的总结
表2为对实施例1-4和对比例5的总结,由实验结果可知:液体悬浮培养可以缩短愈伤组织诱导时间并且提到愈伤组织诱导率。
表2:对实施例1-4和对比例5的总结
以上所述的仅是本发明的实施例,方案中公知的具体结构及特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明结构的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本申请要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
- 还没有人留言评论。精彩留言会获得点赞!