用于治疗癌症的材料和方法与流程
发明背景
i.技术领域
该文档涉及治疗癌症的方法和材料。例如,该文档提供了在过继细胞疗法(例如,嵌合抗原受体t细胞疗法)中使用具有降低的表达水平的一种或多种细胞因子(例如,gm-csf)的嵌合抗原受体t细胞治疗患有癌症的哺乳动物(例如,人)的方法和材料。
2.
背景技术:
评价cd19导向的嵌合抗原受体t细胞(cart19)的安全性和有效性的重要试验的空前结果已经导致fda最近批准了cart19(tisagenlecleucel)用于复发性难治性急性淋巴细胞性白血病(all)以及cart19(axi-cel)用于治疗弥漫性大b细胞淋巴瘤(dlbcl)。cart细胞疗法的应用与导致细胞因子释放综合征(crs)和神经毒性的毒性有关。此外,cart细胞疗法的疗效仅限于淋巴瘤的40%可持久性缓解和急性白血病的50%-60%可持久缓解。
技术实现要素:
该文档提供了产生具有降低的表达水平的一种或多种细胞因子(例如,gm-csf)多肽的t细胞(例如,嵌合抗原受体(car)t细胞(cart))的方法和材料。例如,t细胞(例如,cart)可以进行工程改造(工程化,工程改变,engineered)而具有降低表达的gm-csf多肽(例如,用于过继细胞疗法)。在一些情况下,t细胞(例如cart)可以进行工程改造而敲除(ko)编码一种或多种细胞因子多肽(例如,gm-csf多肽)的核酸,从而降低细胞因子多肽(例如,gm-csf多肽)在该t细胞中的表达。该文档还提供了使用降低的表达水平的一种或多种细胞因子(例如,gm-csf多肽)的t细胞(例如,cart)的方法和材料。例如,可以将gm-csf多肽水平降低的t细胞(例如,cart)给予(例如,在过继细胞疗法中)患有癌症的哺乳动物以治疗该哺乳动物。
在一个方面中,本发明提供了一种增强受试者免疫疗法的抗肿瘤功效的方法,该方法包括向受试者给予具有gm-csf基因失活、gm-csf基因敲落(敲低,knock-down)或基因敲除(knockout)的car-t细胞(gm-csfk/ocar-t细胞),其中给予car-t细胞会减少或预防免疫治疗相关的毒性。
在另一方面中,本发明提供了一种用于降低用免疫疗法治疗的受试者中非gm-csf细胞因子水平的方法,该方法包括向受试者给予具有gm-csf基因失活、gm-csf基因敲落或基因敲除的car-t细胞(gm-csfk/ocar-t细胞)。
在一个方面中,本发明提供了一种在细胞中进行gm-csf基因失活、gm-csf基因敲落或gm-csf基因敲除(ko)的方法,其包括靶向性基因组编辑或gm-csf基因沉默。
在一个方面中,本发明提供了一种用于制备具有降低的水平的粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽的嵌合抗原受体t细胞的方法,所述方法包括:将核酸构建体引入离体t细胞中,其中所述核酸构建体包含:a)编码向导rna的核酸,其中所述向导rna与gm-csf信使rna互补;b)编码cas核酸酶的核酸,和c)编码所述嵌合抗原受体的核酸。
在另一方面中,本发明提供了一种制备具有降低的水平的粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽的嵌合抗原受体t细胞的方法,所述方法包括:将复合物引入离体t细胞内,其中所述复合物包含:a)向导rna,其中所述向导rna与gm-csf信使rna互补;和b)cas核酸酶;将编码所述嵌合抗原受体的核酸引入所述离体t细胞中。
在一个方面中,本发明提供了一种制备具有降低的水平的细胞因子多肽的嵌合抗原受体t细胞的方法,所述方法包括:将核酸构建体引入离体t细胞中,其中所述核酸构建体包括:a)编码向导rna的核酸,其中所述向导rna与细胞因子信使rna互补;b)编码cas核酸酶的核酸;和c)编码所述嵌合抗原受体的核酸。
在另一方面中,本发明提供了一种制备具有降低的水平的细胞因子多肽的嵌合抗原受体t细胞的方法,所述方法包括:将复合物引入离体t细胞中,其中所述复合物包括:a)向导rna,其中所述向导rna与细胞因子信使rna互补。b)cas核酸酶;并且将编码所述嵌合抗原受体的核酸引入所述离体t细胞中。
在另一方面中,本发明提供了一种改善嵌合抗原受体t细胞的t细胞效应子功能的方法,所述方法包括:将核酸构建体引入离体t细胞,其中所述核酸构建体包括:a)编码向导rna的核酸,其中所述向导rna与gm-csf信使rna互补;b)编码cas核酸酶的核酸,和c)编码所述嵌合抗原受体的核酸。
在一个方面中,本发明提供了一种用于改善嵌合抗原受体t细胞的t细胞效应子功能的方法,该方法包括:将复合物引入离体t细胞中,其中所述复合物包括:a)向导rna,其中所述向导rna与gm-csf信使rna互补;b)cas核酸酶;并将编码所述嵌合抗原受体的核酸引入所述离体t细胞中。
正如本文验证,gm-csfkocart会生产降低的水平的gm-csf,并在体外和体内模型中继续发挥正常功能。同样正如本文证明,gm-csfkocart可以具有增强的cart细胞功能和抗肿瘤活性。例如,在gm-csf耗尽后,可以观察到增强的cart细胞增殖和抗肿瘤活性。gm-csf耗竭后,在单核细胞存在下,可以提高cart19抗原特异性增殖。在all患者源异种移植物中,当与lenzilumab组合使用时,cart19细胞可以导致更持久的疾病控制,而gm-csfk/ocart细胞可以更有效地控制nalm6异种移植物中的白血病。在某些情况下,gm-csfkocart可以引入过继性t细胞疗法(例如,cart细胞疗法),以治疗例如患有癌症的哺乳动物,而不会导致crs和/或神经毒性。例如,gm-csfkocart可以引入过继性t细胞疗法(例如,cart细胞疗法)中以增强cart细胞疗法后的治疗窗口。在某些情况下,单个构建体可以用于将car引入细胞(例如,t细胞)中并降低或敲除同一细胞中一种或多种细胞因子多肽的表达。
在另一方面中,本发明提供了一种治疗患有癌症的哺乳动物的方法,其中所述方法包括向所述哺乳动物给予具有降低的水平的粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽的嵌合抗原受体t细胞。
在另一方面中,本发明提供了一种治疗患有癌症的哺乳动物的方法,其中所述方法包括向所述哺乳动物给予细胞因子多肽水平降低的嵌合抗原受体t细胞。
通常而言,该文档的一个方面的特征在于用于制备具有降低的水平的细胞因子多肽的cart细胞的方法。该方法可以包括将核酸构建体引入离体t细胞中,或基本上由其组成,其中所述核酸构建体包括:a)编码与细胞因子信使rna(mrna)互补的向导rna(grna)的核酸;b)编码cas核酸酶的核酸,和c)编码嵌合抗原受体的核酸。该细胞因子多肽可以包括粒细胞巨噬细胞集落刺激因子(gm-csf)多肽、白介素6(il-6)多肽、il-1多肽、m-csf多肽和/或mip-1b多肽。该细胞因子多肽可以是gm-csf多肽,并且该grna可以包括seqidno:1所示的核酸序列。该cas核酸酶可以是cas9核酸酶。编码car的核酸可以包括seqidno:2所示的核酸序列。该核酸构建体可以是病毒载体(例如,慢病毒载体)。该car可以靶向肿瘤相关抗原(例如,cd19)。该引入步骤可以包括转导。
在另一方面中,该文档的特征在于用于制备具有降低的水平的细胞因子多肽的cart细胞的方法。该方法可以包括将复合物引入离体t细胞中,或基本上由其组成,其中该复合物包括:a)与细胞因子mrna互补的grna;b)cas核酸酶;将编码car的核酸引入离体t细胞中。该细胞因子多肽可以包括gm-csf多肽和/或il-6多肽。该细胞因子多肽可以是gm-csf多肽,并且该grna可以包括seqidno:1所示的核酸序列。cas核酸酶可以是cas9核酸酶。编码car的核酸可以包括seqidno:2所示的核酸序列。该复合物可以是核糖核蛋白(rnp)。该car可以靶向肿瘤相关抗原(例如,cd19)。该引入步骤可以包括电穿孔。
在另一方面中,该文档的特征在于用于制备具有降低的水平的gm-csf多肽的cart细胞的方法。该方法可以包括将核酸构建体引入离体t细胞中,或基本上由其组成,其中该核酸构建体包括:a)编码与gm-csfmrna互补的grna的核酸;b)编码cas核酸酶的核酸;和c)编码car的核酸。grna可以包括seqidno:1所示的核酸序列。cas核酸酶可以是cas9核酸酶。编码car的核酸可以包括seqidno:2所示的核酸序列。该核酸构建体可以是病毒载体(例如,慢病毒载体)。该car可以靶向肿瘤相关的抗原(例如,cd19)。该引入步骤可以包括转导。
在另一方面中,该文档的特征在于用于制备具有降低的水平的gm-csf多肽的cart细胞的方法。该方法可以包括将复合物引入离体t细胞中,或基本上由其组成,其中该复合物包括:a)与gm-csfmrna互补的grna;b)cas核酸酶;和将编码car的核酸引入离体t细胞。grna可以包括seqidno:1所示的核酸序列。cas核酸酶可以是cas9核酸酶。该编码car的核酸可以包括seqidno:2所示的核酸序列。该复合体可以是rnp。该car可以靶向肿瘤相关抗原(例如,cd19)。该引入步骤可以包括电穿孔。
在另一方面中,该文档的特征在于治疗患有癌症的哺乳动物的方法。该方法可以包括向患有癌症的哺乳动物给予具有降低的水平的细胞因子多肽的cart细胞,或基本上由其组成。该细胞因子多肽可以包括gm-csf多肽和/或il-6多肽。细胞因子多肽可以是gm-csf多肽,并且该grna可以包括seqidno:1所示的核酸序列。该哺乳动物可以是人类。癌症可以是淋巴瘤(例如,dlbcl)。该癌症可以是白血病(例如,all)。该car可以靶向肿瘤相关的抗原(例如,cd19)。
在另一方面中,该文档的特征在于用于治疗患有癌症的哺乳动物的方法。该方法可以包括向患有癌症的哺乳动物给予具有降低的水平的gm-csf多肽的cart细胞,或基本上由其组成。该哺乳动物可以是人类。该癌症可以是淋巴瘤(例如,dlbcl)。该癌症可以是白血病(例如,all)。该car可以靶向肿瘤相关的抗原(例如,cd19)。
除非另有定义,否则本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义。尽管与本文描述的那些类似或等同的方法和材料可以用于实施本发明,但合适的方法和材料将在下面进行描述。本文提及的所有出版物、专利申请、专利和其他参考文献通过引用以其整体结合于本文中。在有冲突的情况下,以包括定义的本说明书为准。另外,材料、方法和实施例仅是举例说明性的,并非意图是限制性的。
在附图和以下描述中阐述了本发明的一个或多个实施方式的细节。根据该描述和附图以及权利要求书,本发明的其他特征、目的和优点将是显而易见的。
附图说明
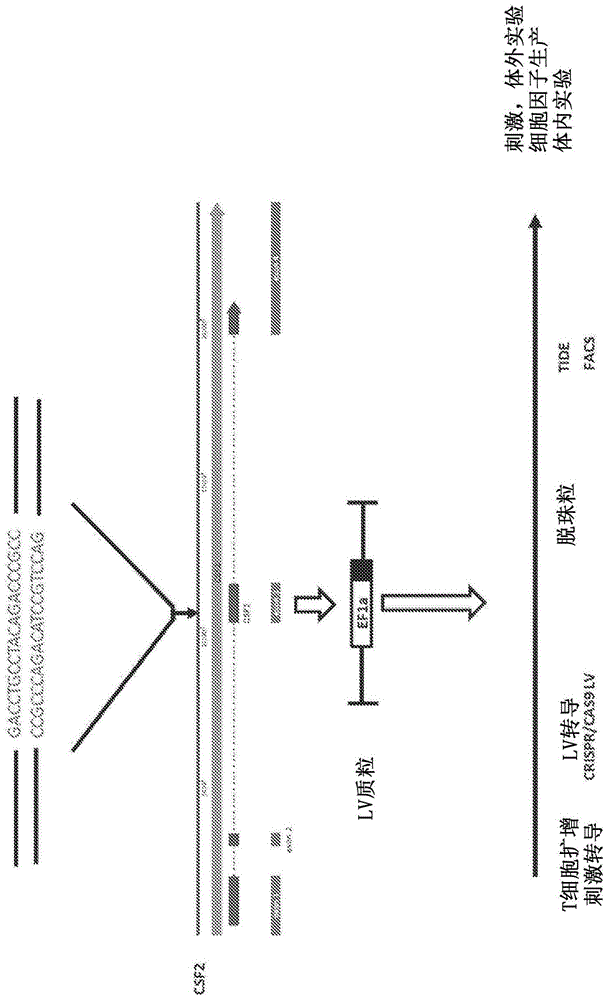
图1包含使用crispr工程改造gm-csf敲除(ko)细胞的示例性方法的示意图。靶向gm-csf的外显子3(也称为集落刺激因子2(csf2))的向导rna(gacctgcctacagacccgcc;seqidno:1)经过合成,并克隆到慢病毒(lv)质粒中。该lv质粒用于转导293t细胞,并在24小时和48小时之时收集慢病毒颗粒并浓缩。为了生成gm-csf敲除cart细胞,在第0天用cd3/cd28珠粒刺激t细胞。在第1天,用car19慢病毒颗粒转导t细胞,并同时用gmcsf敲除crispr/cas9慢病毒颗粒转导t细胞。将t细胞扩增8天,然后收获。
图2a-2b显示了car转导和gm-csf敲除效率。图2a包含显示具有针对gm-csf外显子3的向导rna的crispr/cas9慢病毒产生24.1%的敲除效率的曲线图。扩增结束时,收集cart细胞,分离dna并送去测序,以与对照序列进行比较。这产生了24.1%敲除效率。图2b包含显示慢病毒转导后的car转导效率为73%的流式细胞术分析。慢病毒转导后第6天进行流式细胞术分析。
图3表明显示了与cart细胞相比,gm-csfkocart19细胞会产生较少的gm-csf,而与对照未转导t细胞(utd)相比,gm-csf敲除对照t细胞会产生较少的gm-csf。cart19、gm-csfkocart19、utd或gm-csfkoutd与cd19阳性细胞系nalm6以1:5的比率进行共培养。4小时后,收获该细胞,透化并固定;并进行细胞因子的细胞内染色。
图4显示了与cart19相比,gm-csfkocart19细胞具有更强的扩增能力。用该病毒转导t细胞后,遵循其扩增动力学。与单独的cart19相比,gm-csfko扩增更强。
图5显示了编码car靶向cd19(car19)的示例性核酸序列(seqidno:2)。
图6a-6d显示了在单核细胞存在下,体外gm-csf中和作用会增强car-t细胞增殖,并且不会损害car-t细胞的效应子功能。图6a包含的曲线图显示了与同种型对照治疗相比,lenzilumab会体外中和由car-t细胞产生的gm-csf,这通过在单独的培养基中与cart19一起培养3天或与nalm6共培养的cart19一起培养3天后进行多重分析后得出,n=2个实验,每个实验2次重复,描绘了代表性实验,lenzilumab和同种型对照治疗之间的***p<0.001,t-检验,平均值±sem。图6b包含的曲线图显示了gm-csf中和抗体治疗并未抑制car-t细胞增殖的能力,这通过活cd3细胞的csfe流式细胞术增殖分析测试进行分析得出,n=2个实验,每个实验重复2次,描绘了所示3天时间点的代表性实验,lenzilumab和同种型对照治疗之间的nsp>0.05,t-检验,平均值±sem。单独:培养基中仅有cart19,molm13:cart19+molm13,pma/ion:cart19+5ng/mlpma/0.1μg/mlion,nalm6:cart19+nalm6。图6c包含的曲线图显示了当与单核细胞共培养时,与用cart19治疗的同种型对照相比,lenzilumab增强了cart19的增殖,n=3个在3天时间点的生物复制体,每个生物复制体2次复制,****p<0.0001,平均值±sem。图6d包含的曲线图显示了当用nalm6培养时,lenzilumab治疗并未抑制cart19或未转导t细胞(utd)的细胞毒性,n=2次复制/生物复制体,每个实验重复2次,描绘了48小时时间点的代表性实验,lenzilumab和同型对照治疗之间的nsp>0.05,t-检验,平均值±sem。
图7a-7e显示了在异种移植模型中体内gm-csf中和作用会增强car-t细胞的抗肿瘤活性。图7a包含的实验方案显示了向nsg小鼠注射cd19+荧光素酶+细胞系nalm6(每只小鼠i.v1×106个细胞)。4-6天后,对小鼠进行成像,随机分组,并在第二天与lenzilumab或对照igg(10mg/kg,每天ip进行10天,从car-t注射当天开始)一起接受1-1.5×106个car-t19或同等数量的对照utd细胞的总细胞。对小鼠进行系列生物发光成像,以评价注射car-t细胞后第7天开始的疾病负担,并跟踪其总存活率。注射car-t细胞后7-8天进行尾静脉放血。图7b包含的曲线图显示了与同型对照治疗相比,lenzilumab在体内中和了car-t产生的血清gm-csf,这通过gm-csf单重分析测试得出,n=2个实验,每组7-8只小鼠,代表性实验,car-t细胞/utd注射后第8天的血清,lenzilumab和同种型对照治疗之间***p<0.001,t-检验,平均值±sem。图7c包含的曲线图显示了在all的高肿瘤负荷复发异种移植模型中,在注射car-t后第7天,与同种型对照治疗的car-t相比,lenzilumab体内治疗的car-t在控制肿瘤负荷方面同样有效,n=2个实验,每组7-8只小鼠,描绘的是代表性实验,***p<0.001,*p<0.05,nsp>0.05,t-检验,平均值±sem。图7d包含显示了向nsg小鼠注射源自all患者的胚细胞(每只小鼠i.v1×106个细胞)的实验方案。小鼠挨个抽血,并且当cd19+细胞≥l/ul时,小鼠随机接受5×106cart19(转导效率为约50%)或具有lenzilumab或对照igg(10mg/kg,每天ip长达10天,开始于car-t注射当天)的utd细胞。在小鼠注射car-t细胞后的第14天开始挨个进行尾静脉放血以评价疾病负担,并跟踪其总存活率。图7e包含的曲线图显示了在原发性急性淋巴细胞性白血病(all)异种移植模型中,与采用car-t疗法的同种型对照治疗相比,采用car-t疗法的lenzilumab治疗会导致肿瘤负荷随着时间的更持久控制,每组6只小鼠,**p<0.01,*p<0.05,nsp>0.05,t-检验,平均值±sem。
图8包含的曲线图显示了在all的高肿瘤负荷复发异种移植模型中,与同种型对照+car-t细胞治疗的小鼠相比,lenzilumab+car-t细胞治疗的小鼠具有相当的存活率。n=2个实验,每组7-8只小鼠,描绘的是代表性实验,****p<0.0001,***p<0.001,*p<0.05,对数秩。
图9包含显示了验证gm-csfcrisprcas9敲除car-t细胞中的基因组改变的代表性tide序列的曲线图,n=2个实验,描绘的是代表性实验。
图10a-10e显示了gm-csfcrispr基因敲除car-t细胞表现出gm-csf表达降低,关键细胞因子水平相似,以及抗肿瘤活性增强。图10a包含的曲线图显示了与野生型cart19相比,crisprcas9gmcsfk/ocar-t表现出gmcsf产量降低,但其他细胞因子的生产和脱粒不受gm-csf基因破坏的抑制,n=3个实验,每个实验重复2次,相比于gm-csfk/ocar-t和car-t,***p<0.001,*p<0.05,nsp>0.05,t-检验,平均值±sem。图10b包含的曲线图显示了与car-t治疗相比,gm-csfk/ocar-t在体内具有降低的血清人gm-csf,这通过多重分析测试得到,每组5-6只小鼠(放血时为4-6只,cart注射后8天),gm-csfk/ocar-t细胞和野生型car-t细胞之间的****p<0.0001,***p<0.001,t-检验,平均值±sem。图10c包含的曲线图显示了在all的高肿瘤负荷复发异种移植模型中,与野生型cart19相比,体内gm-csfk/ocart19提高了总存活率,每组5-6只小鼠,**p<0.01,对数秩。图10d和10e包含显示除了人gm-csf以外来自多重血清的人(图10d)和小鼠(图10e)细胞因子的热分布图,表明gm-csfk/ocar-t细胞和野生型car-t细胞之间无统计学差异,进一步间接表明通过降低gm-csf的表达并没有不利地消除关键t细胞的细胞因子,每组5-6只小鼠(放血时为4-6只),****p<0.0001,t-检验。
图11包含的曲线图显示了在all的高肿瘤负荷复发异种移植模型中,与car-tin相比,体内gm-csf敲除car-t细胞显示出对肿瘤负荷的控制略有增强。在x轴上列出car-t注射后的天数,每组5-6只小鼠(第13天,在utd组中仅剩2只),描绘的是代表性实验,****p<0.0001,*p<0.05,双因素方差分析(2wayanova),平均值+sem。
图12a-12d显示了患者源的神经毒性和细胞因子释放综合征的异种移植模型。图12a包含的实验方案显示了小鼠接受了来自患有原发性all的患者的外周血的1-3×106个原发性胚细胞。通过尾静脉放血,监测小鼠约10-13周的移入。如所示,当血清cd19+细胞是2:10细胞/ul时,小鼠接受了cart19(2-5×106个细胞)并开始抗体疗法,共10天。每天对小鼠称重,以衡量其健康状况。cart19注射后5-6天进行小鼠脑mri,cart19注射后4-11天进行尾静脉放血以进行细胞因子和t细胞分析,这是两个独立实验。图12b包含的曲线图显示了gm-csf中和作用与cart19的组合与同型对照抗体与cart19的组合在控制all细胞的cd19+负荷方面具有同等效力,代表性实验,每组3只小鼠,注射cart19后11天,gm-csf中和作用+cart19和同种型对照+cart19之间的*p<0.05,t-检验,平均值±sem。图12c包含显示使用cart19疗法的脑mri表现出t1增强的图像,间接表明大脑血-脑屏障破坏和可能的水肿。每组3只小鼠,cart19注射后5-6天,代表性图像。图12d包含显示与未治疗的pdx对照相比,用cart19治疗的高肿瘤负荷原代all异种移植物显示出人cd3细胞对脑的浸润。每组3只小鼠,代表性图像。
图13a-13d显示了在异种移植模型中,cart19治疗后,体内gm-csf中和作用改善了细胞因子释放综合征。图13a包含的曲线图显示了与用cart19和同种型对照抗体治疗的小鼠相比,lenzilumab和抗小鼠gm-csf抗体会防止crs所致的体重减轻,每组3只小鼠,双因素方差分析,平均值±sem。图13b包含了显示在用lenzilumab和小鼠gm-csf中和抗体治疗的患者源异种移植物中人gm-csf被中和的曲线图,每组3只小鼠,***p<0.001,*p<0.05,t-检验,平均值±sem。图13c包含显示人细胞因子(注射cart19后11天收集的血清)在cart19治疗处理后表现出典型crs的细胞因子增加的热分布图。与用cart19和同种型对照抗体治疗的小鼠相比,gm-csf中和作用导致几种细胞因子显著减少,包括几种髓相关细胞因子,正如插图中所示,每组3只小鼠,注射cart19后第11天的血清,***p<0.001,**p<0.01,*p<0.05,比较了接受car-t细胞疗法的gm-csf中和抗体治疗的小鼠和同种型对照治疗小鼠,t-检验。图13d包含了显示小鼠细胞因子(注射cart19后11天收集的血清)在cart19治疗处理后表现出典型crs的小鼠细胞因子的增加的热分布图。gm-csf中和作用与使用对照抗体的cart19治疗处理相比,导致几种细胞因子,包括几种髓分化细胞因子,显著减少,如插图中所示,每组3只小鼠,注射cart19后第11天的血清,*p<0.05,比较了接受car-t细胞疗法的gm-csf中和抗体治疗小鼠和同种型对照治疗小鼠,t检验。
图14a-14d显示了在异种移植模型中,cart19治疗后,体内gm-csf中和改善了神经毒性。图14a和14b显示了表明与同型对照相比gm-csf中和有助于降低脑炎、血脑屏障破坏和可能水肿的增强tl-超强度(立方毫米)mri,(a)代表性图像,(b)每组3只小鼠,**p<0.01,*p<0.05,单因素方差分析,平均值±sd。图14c包含显示在用cart19疗法治疗后脑中存在人cd3t细胞的曲线图。gm-csf中和作用导致脑中cd3浸润减少的趋势,这通过脑半球中流式细胞术进行分析测定,每组3只小鼠,平均值±sem。图14d包含显示在car-t治疗期间接受gm-csf中和的小鼠大脑中,与在car-t治疗期间的同种型对照相比,cd11b+亮巨噬细胞(brightmacrophage)降低,这通过脑半球中的流式细胞术进行分析测定,每组3只小鼠,平均值±sem。
图15显示了gm-csfk/ocart19细胞的示例性生成。实验方案描述了用于产生gm-csfk/ocart19的方案(图15a)、grna序列(图15b)和引物序列(图15b)。为了产生gm-csfk/ocart19细胞,grna在u6启动子的控制下克隆到cas9慢病毒载体中,并用于慢病毒生产。24小时后,用cd3/cd28珠粒刺激正常供体源t细胞,并用car19病毒和crispr/cas9病毒双重转导。在第+6天去除cd3/cd28磁珠,并在第8天冷冻保存gm-csfk/ocart19细胞或对照cart19细胞。
图16显示了rna测序中所用的方案的流程图。使用illuminabcl2fastq软件将二进制基本调用数据转换为fastq。使用trimmomatic除去适配子序列,并使用fastqc检查质量。最新的人(grch38)和鼠(grcm38)参考基因组从ncbi下载。使用star30生成基因组索引文件,并对每种条件将配对末端读数映射到基因组。htseq用于生成每个基因的表达计数,而deseq2用于计算差异表达。基因本体论使用enrichr进行评价。
图17a-17b分别显示了在具有3级或更高等级神经毒性的人类患者中cd14+细胞是更大比例的cns细胞群(图17a),以及抗-hgm-cf抗体lenzilumab引起了用于nt实验的原生all小鼠模型中的由cd14+细胞和由cd11b+细胞所致的cns浸润减少(图17b),这正如实施例4中的详述。
具体实施方式
该文档提供了产生具有降低的表达水平的一种或多种细胞因子多肽(例如gm-csf多肽)的t细胞(例如,嵌合抗原受体(car)t细胞(cart))的方法和材料。在一些情况下,t细胞(例如,cart)可以进行工程改造以敲除(ko)编码gm-csf多肽的核酸,以降低gm-csf多肽在该t细胞中的表达(例如,与未进行工程改造为ko编码gm-csf多肽的核酸的t细胞相比)。经工程改造为ko编码gm-csf多肽的核酸的t细胞在本文中也可以称为gm-csfkot细胞。在某些情况下,本文提供的方法和材料可以用于调节髓细胞。在某些情况下,本文提供的方法和材料可以用于消耗髓细胞。在某些情况下,本文提供的方法和材料可以用于增强t细胞(例如,cart)效能。
本文提供的t细胞(例如,cart)可以设计成具有降低的表达水平的任何合适的细胞因子多肽或细胞因子多肽的组合。例如,本文提供的t细胞(例如,cart)可以设计成具有降低的表达水平的gm-csf多肽、白介素6(il-6)多肽、g-csf、干扰素γ(ifn-g)多肽、il-1b多肽、il-10多肽、单核细胞趋化蛋白1(mcp-1)多肽、γ(mig)多肽诱导的单因子、巨噬细胞炎性蛋白(mip)多肽(例如,mip-1β多肽)、肿瘤坏死因子α(tnf-a)多肽、il-2多肽、穿孔素多肽或其任意组合。例如,t细胞可以设计成同时具有降低的表达水平的gm-csf和il-6多肽。
在一个方面中,本发明提供了一种增强受试者中免疫疗法的抗肿瘤功效的方法,该方法包括向受试者给予具有gm-csf基因失活、gm-csf基因敲落或基因敲除的car-t细胞(gm-csfk/ocar-t细胞),其中给予car-t细胞可以降低或预防免疫疗法相关的毒性。在本文提供的方法的一个实施方式中,该方法还包括向受试者给予抗hgm-csf抗体,其中该抗hgm-csf抗体是结合并中和人gm-csf的重组抗hgm-csf抗体。在一个具体实施方式中,该方法包括向受试者给予抗hgm-csf抗体。在另一个实施方式中,免疫疗法有关的毒性car-t包括细胞因子释放综合征(crs)、神经毒性(nt)、神经炎症或其组合。
在本文提供的方法的某些实施方式中,给予(i)具有gm-csf基因失活、gm-csf基因敲落或基因敲除的car-t细胞(gm-csfk/ocar-t细胞)或(ii)car-t细胞和抗hgm-csf抗体会降低或阻止cd14+髓细胞向受试者中枢神经系统(cns)的转运。在一个实施方式中,受试者中枢神经系统(cns)中的高水平cd14+髓细胞是神经毒性的指示。cns中cd14+髓细胞水平通过实施腰穿刺、取出脑脊髓液(csf)样品并测量csf中的cd14+细胞,例如,通过流式细胞分析(流式细胞术)、elisa、抗cd14-fitc单克隆抗体或其他合适的测量技术进行测定。
在本文提供的方法的实施方式中,与未给予抗hgm-csf抗体的受试者相比,给予抗hgm-csf抗体的受试者的客观响应率(objectiveresponserate)得到改善。在具体实施方式中,该客观响应率是完全响应率或部分响应率。在另一个实施方式中,与未给予抗hgm-csf抗体和/或具有gm-csf基因失活、gm-csf基因敲落或基因敲除的car-t细胞(gm-csfk/ocar-t细胞)的受试者相比,该受试者的无进展响应和/或存活得到改善。在其它实施方式中,存活率是受试者的总存活率。在另一个实施方式中,在给予具有gm-csf基因失活、gm-csf基因敲落或gm-csfk/ocar-t细胞的car-t细胞之前、期间或之后,将抗hgm-csf抗体给予受试者。
在本文中提供的方法的具体实施方式中,该免疫疗法包括给予表达嵌合抗原受体表达t细胞(cart细胞)。在一个实施方式中,其中所述cart细胞是cart19细胞。在权利要求1的本文提供的方法的另一个实施方式中,该免疫疗法包括过继性细胞转移,该过继细胞转移选自由给予t细胞受体(tcr)改性(改变,修饰,modified)的t细胞、肿瘤浸润淋巴细胞(til)、嵌合抗原受体(car)-改性的天然杀伤细胞、或树突状细胞、或其任何组合组成的组。在一些实施方式中,该免疫疗法包括给予单克隆抗体、细胞因子、癌症疫苗、t细胞导向双特异性抗体(tcellengagingbispecificantibody)或其任何组合。在一个具体实施方式中,受试者患有癌症。在某些实施方式中,该癌症是淋巴瘤或白血病。在另一个实施方式中,该淋巴瘤是弥漫性大b细胞淋巴瘤(dlbcl)。在还有的另一个实施方式中,该白血病是急性淋巴细胞性白血病(all)。
在另一方面中,本发明提供了一种用于降低采用免疫疗法治疗的受试者中非gm-csf细胞因子水平的方法,该方法包括向受试者给予具有gm-csf基因失活、gm-csf基因敲落或基因敲除的car-t细胞(gm-csfk/ocar-t细胞)。在本文提供的方法的一个具体实施方式中,该方法还包括向受试者给予抗hgm-csf抗体。在另一个实施方式中,该非gm-csf细胞因子是ip-10、il-1a、il-1b、il-2、il-3、il-4、il-5、il-6、il-1ra、il-9、il-10、vegf、tnf-α、fgf-2、ifn-γ、il-12p40、il-12p70、scd40l、kc、mdc、mcp-1、mip-1a、mip-1b或其组合。在本文提供的方法的另一个实施方式中,与免疫疗法有关的毒性car-t包括crs、nt、神经炎症或其组合。
在一个方面中,本发明提供了一种用于在细胞中进行gm-csf基因失活、gm-csf基因敲落或gm-csf基因敲除(ko)的方法,其包括靶向性基因组编辑或gm-csf基因沉默。在本文提供的方法的一个实施方式中,该方法还包含核酸内切酶作为核酸切割酶。在一些实施方式中,该核酸内切酶是fok1限制酶或皮瓣核酸内切酶1(fen-1)。在某些实施方式中,该核酸内切酶是cas9crispr相关蛋白9(cas9)。在一个具体实施方式中,通过crispr/cas9的gm-csf基因失活会靶向并编辑外显子1、外显子2、外显子3或外显子4处的gm-csf基因。在一个实施方式中,包含crispr/cas9的gm-csf基因失活会靶向并编辑外显子3处的gm-csf基因。在另一个实施方式中,包含crispr/cas9的gm-csf基因失活会靶向并编辑外显子1处的gm-csf基因。
在还有的另一个实施方式中,gm-csf基因失活包括多种crispr/cas9酶,其中每种cas9酶会靶向并编辑外显子1、外显子2、外显子3或外显子4处的不同gm-csf基因序列。在另一个实施方式中,该gm-csf基因失活包括双等位基因crispr/cas9靶向和gm-csf基因的敲除/失活。
在本文提供的方法的具体实施方式中,该方法还包括用丙戊酸处理原代t细胞以增强双等位基因基因敲除/失活。在另一个实施方式中,靶向性基因组编辑包含锌指(znf)蛋白。在某些实施方式中,靶向性基因组编辑包含转录激活子样效应子核酸酶(talens)。在具体实施方式中,靶向性基因组编辑包含归巢核酸内切酶,其中该归巢核酸内切酶是arc核酸酶(arcus)或兆核酸酶(meganuclease)。在本文提供的方法的一个实施方式中,靶向性基因组编辑包括皮瓣核酸内切酶(fen-1)。在一个具体的实施方式中,该细胞是cart细胞。在一个具体实施方式中,该cart细胞是cd19car-t细胞。在另一个实施方式中,该cart细胞是bcmacar-t细胞。在另一个实施方式中,该gm-csf基因沉默选自由rna干扰(rnai)、短干扰rns(sirna)和dna导向rna干扰(ddrnai)组成的组。
在一个方面中,本发明提供了一种制备具有降低的水平的粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽的嵌合抗原受体t细胞的方法,所述方法包括:将核酸构建体引入离体t细胞中,其中所述核酸构建体包含:a)编码向导rna的核酸,其中所述向导rna与gm-csf信使rna互补;b)编码cas核酸酶的核酸,和c)编码所述嵌合抗原受体的核酸。在本文提供的所述方法的一个实施方式中,所述向导rna包含seqidno:1所示的核酸序列。在另一个实施方式中,所述cas核酸酶是cas9核酸酶。在其它实施方式中,编码所述嵌合抗原受体的所述核酸包含seqidno:2所示的核酸序列。在另一个实施方式中,所述核酸构建体是病毒载体。在一个具体实施方式中,所述病毒载体是慢病毒载体。在其它实施方式中,所述嵌合抗原受体靶向肿瘤相关的抗原。在另一个实施方式中,所述肿瘤相关抗原是cd19。在其它实施方式中,所述引入步骤包括转导。
在另一方面中,本发明提供了一种制备具有降低的水平的粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽的嵌合抗原受体t细胞的方法,所述方法包括:将复合物引入离体t细胞中,其中所述复合物包含:a)向导rna,其中所述向导rna与gm-csf信使rna互补;b)cas核酸酶;将编码所述嵌合抗原受体的核酸引入所述离体t细胞中。在本文提供的方法的一个实施方式中,所述向导rna包含seqidno:1所示的核酸序列。在另一个实施方式中,所述cas核酸酶是cas9核酸酶。在一个具体实施方式中,编码所述嵌合抗原受体的所述核酸包含seqidno:2所示的核酸序列。在另一个实施方式中,所述复合物是核糖核蛋白。在其它实施方式中,所述嵌合抗原受体会靶向肿瘤相关的抗原。在一个具体实施方式中,所述肿瘤相关的抗原是cd19。在本文提供的方法的另一个实施方式中,所述引入步骤包括电穿孔。
在另一方面中,本发明提供了一种治疗患有癌症的哺乳动物的方法,其中所述方法包括向所述哺乳动物给予具有降低的水平的粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽的嵌合抗原受体t细胞。在一个具体实施方式中,所述哺乳动物是人。在另一个实施方式中,所述癌症是淋巴瘤。在其它实施方式中,所述淋巴瘤是弥漫性大b细胞淋巴瘤。在另一个实施方式中,所述癌症是白血病。在另一个实施方式中,所述白血病是急性淋巴细胞性白血病。在一个实施方式中,所述嵌合抗原受体会靶向肿瘤相关的抗原。在一个具体实施方式中,所述肿瘤相关抗原是cd19。
在一个方面中,本发明提供了一种制备具有降低的水平的细胞因子多肽的嵌合抗原受体t细胞的方法,所述方法包括:将核酸构建体引入离体t细胞中,其中所述核酸构建体包含:a)编码向导rna的核酸,其中所述向导rna与细胞因子信使rna互补;b)编码cas核酸酶的核酸;和c)编码所述嵌合抗原受体的核酸。在本文提供的所述方法的某些实施方式中,所述细胞因子多肽包括粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽和/或白介素6(il-6)多肽。在一个具体实施方式中,所述细胞因子多肽是gm-csf多肽,并且其中所述向导rna包含seqidno:1所示的核酸序列。在一个实施方式中,所述cas核酸酶是cas9核酸酶。在另一个实施方式中,编码所述嵌合抗原受体的所述核酸包含seqidno:2所示的核酸序列。在其它实施方式中,所述核酸构建体是病毒载体。在一个具体的实施方式中,所述病毒载体是慢病毒载体。在另一个实施方式中,所述嵌合抗原受体会靶向肿瘤相关的抗原。在各种实施方式中,所述肿瘤相关的抗原是cd19。在另一个实施方式中,所述引入步骤包括转导。
在另一方面中,本发明提供了一种制备具有降低的水平的细胞因子多肽的嵌合抗原受体t细胞的方法,所述方法包括:将复合物引入离体t细胞中,其中所述复合物包括:a)向导rna,其中所述向导rna与细胞因子信使rna互补;和b)cas核酸酶,和将编码所述嵌合抗原受体的核酸引入所述离体t细胞中。在本文提供的所述方法的一个实施方式中,所述细胞因子多肽包括粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽和/或白介素6(il-6)多肽。在一个具体实施方式中,所述细胞因子多肽是gm-csf多肽,并且其中所述向导rna包含seqidno:1所示的核酸序列。在另一个实施方式中,所述cas核酸酶是cas9核酸酶。在另一个实施方式中,编码所述嵌合抗原受体的所述核酸包含seqidno:2所示的核酸序列。在其它实施方式中,所述复合物是核糖核蛋白。在还另外的实施方式中,所述嵌合抗原受体会靶向肿瘤相关的抗原。在一个具体的实施方式中,所述肿瘤相关的抗原是cd19。在另一个实施方式中,所述引入步骤包括电穿孔。
在又一方面中,本发明提供了一种用于治疗患有癌症的哺乳动物的方法,其中所述方法包括向所述哺乳动物给予具有降低的水平的细胞因子多肽的嵌合抗原受体t细胞。在所述提供的方法的一个实施方式中,所述细胞因子多肽包括粒细胞-巨噬细胞集落刺激因子(gm-csf)多肽和/或白介素6(il-6)多肽。在另一个实施方式中,所述细胞因子多肽是gm-csf多肽,并且其中所述向导rna包含seqidno:1所示的核酸序列。在其它实施方式中,所述哺乳动物是人。在另一个实施方式中,所述癌症是淋巴瘤。在又一个实施方式中,所述淋巴瘤是弥漫性大b细胞淋巴瘤。在另一个实施方式中,所述癌症是白血病。在其它实施方式中,所述白血病是急性淋巴细胞性白血病。在一个实施方式中,所述嵌合抗原受体会靶向肿瘤相关的抗原。在一个具体实施方式中,所述肿瘤相关的抗原是cd19。
在一个方面中,本发明提供了一种改善嵌合抗原受体t细胞的t细胞效应子功能的方法,所述方法包括:将核酸构建体引入离体t细胞中,其中所述核酸构建体包括:a)编码向导rna的核酸,其中所述向导rna与gm-csf信使rna互补;b)编码cas核酸酶的核酸;和c)编码所述嵌合抗原受体的核酸。
在另一方面中,本发明提供了一种改善嵌合抗原受体t细胞的t细胞效应子功能的方法,所述方法包括:将复合物引入离体t细胞中,其中所述复合物包括:a)向导rna,其中所述向导rna与gm-csf信使rna互补,和b)cas核酸酶;和将编码所述嵌合抗原受体的核酸引入所述离体t细胞中。
正如本文关于细胞因子(例如,gm-csf)的表达水平所用的术语“水平降低的”是指低于该细胞因子(例如,gm-csf)的参考表达水平的任何水平。正如本文关于细胞因子(例如,gm-csf)所用的术语“参考水平”是指通常在来自一个或多个哺乳动物(例如,人)的未进行工程改造至具有如本文所述的该细胞因子(例如,gm-csf多肽)的降低表达水平的样品(例如,对照样品)中观察到的该细胞因子(例如,gm-csf)的水平。对照样品可以包括但不限于野生型t细胞的t细胞(例如,不是gm-scfkot细胞的t细胞)。在某些情况下,细胞因子多肽(例如,gm-csf多肽)降低的表达水平是该细胞因子(例如,gm-csf)的不可检出水平。在某些情况下,gm-csf多肽降低的表达水平可以是gm-csf的消除水平。
在一些情况下,具有降低的表达水平的一种或多种细胞因子多肽如gm-csfkot细胞的t细胞可以维持正常的t细胞功能,如t细胞脱粒和细胞因子的释放(例如,与未工程改造成本文所述的具有降低的表达水平的该细胞因子(例如,gm-csf多肽)的cart相比)。
在一些情况下,具有(例如,经工程改造成具有)降低的水平的gm-csf多肽的t细胞(例如,gm-csfkot细胞)可以具有增强的cart功能,如抗肿瘤活性、增殖、细胞杀伤、细胞因子产生、疲劳敏感性(exhaustionsusceptibility)、抗原特异性效应子功能、持久性和分化(例如,与未工程改造成具有降低的水平的gm-csf多肽的cart相比)。
在一些情况下,具有(例如,经工程改造成具有)降低的水平的gm-csf多肽的t细胞(例如,gm-csfkot细胞)可以具有增强的t细胞扩增(例如,与未经过工程改造成如本文所述的具有降低的水平的gm-csf多肽的cart)。
具有(例如,经工程改造成具有)降低的水平的一种或多种细胞因子(例如,gm-csf多肽)的t细胞如gm-csfkot细胞可以是任何合适的t细胞。t细胞可以是初始t细胞。t细胞可以设计成如本文所述的具有降低的表达水平的一种或多种细胞因子的t细胞的实例包括但不限于细胞毒性t细胞(例如,cd4+ctl和/或cd8+ctl)。例如,可以工程改造成如本文所述的具有降低的水平的gm-csf多肽的t细胞可以是cart。在某些情况下,一种或多种t细胞可以获自哺乳动物(例如,患有癌症的哺乳动物)。例如,t细胞可以获自采用本文所述的材料和方法进行治疗的哺乳动物。
使用任何合适的方法都可以产生具有(例如,经工程改造成具有)降低的表达水平的一种或多种细胞因子多肽(例如,gm-csf多肽)的t细胞如gm-csfkot细胞。在某些情况下,t细胞(例如,cart)可以经过工程改造为ko编码gm-csf多肽的核酸,以减少该t细胞中的gm-csf多肽的表达。
在某些情况下,当t细胞(例如,cart)进行工程改造为ko编码细胞因子(例如,gm-csf多肽)的核酸以减少该细胞因子多肽在该t细胞中的表达时,可以采用任何合适的方法ko编码该细胞因子的核酸。可用于敲除编码细胞因子多肽(例如,gm-csf多肽)的核酸序列的技术的实例包括但不限于基因编辑、同源重组、非同源末端连接和微同源末端连接。例如,基因编辑(例如,采用工程核酸酶)可以用于ko编码编码gm-csf多肽的核酸。用于基因组编辑的核酸酶包括但不限于crispr-相关(cas)核酸酶、锌指核酸酶(zfns)、转录激活因子样效应子(tale)核酸酶和归巢核酸内切酶(he;也称为兆核酸酶(meganucleases))。
在一些情况下,可以使用成簇规则间隔的短回文重复序列(crispr)/cas系统(例如,可以引入到一种或多种t细胞中)以ko编码细胞因子多肽(例如,gm-csf多肽)的核酸(参见,例如,图1和实施例1)。用于ko编码细胞因子多肽(例如,gm-csf多肽)的核酸的crispr/cas系统可以包括任何合适的向导rna(grna)。在某些情况下,grna可以与编码gm-csf多肽的核酸(例如,gm-csfmrna)互补。对编码gm-csf多肽的核酸具有特异性的grna实例包括但不限于gacctgcctacagacccgcc(seqidno:1)、gcagtgctgcttgtagtggc,tcaggagacgccgggcctcc(seqidno:3)、cagcagcagtgtctctactc(seqidno:4)、ctcagaaatgtttgacctcc(seqidno:5)和ggccggtctcactcctggac(seqidno:6)。在一些情况下,设计成ko编码gm-csf多肽的核酸的crispr/cas系统的grna组分可以包括seqidno:1所示的核酸序列。
用于ko编码细胞因子多肽(例如,gm-csf多肽)的核酸的crispr/cas系统可以包括任何合适的cas核酸酶。cas核酸酶的实例包括但不限于cas1、cas2、cas3、cas9、cas10和cpf1。在一些情况下,设计成ko编码细胞因子多肽(例如,gm-csf多肽)的核酸的crispr/cas系统的cas组分可以是cas9核酸酶。例如,本文描述的crispr/cas9系统的cas9核酸酶可以是lenticrisprv2(例如,参见shalemetal.,2014science343:84-87;和sanjanaetal.,2014naturemethods11:783-784,每篇文献都通过引用以其整体结合于本文中)。
用于ko编码细胞因子多肽(例如,gm-csf多肽)的核酸的crispr/cas系统的组分(例如,grna和cas核酸酶)可以以任何合适的形式(format)引入一种或多种t细胞(例如,cart)中。在一些情况下,crispr/cas系统的组分可以作为编码grna的核酸和/或编码cas核酸酶的核酸引入到一种或多种t细胞中。例如,编码至少一种grna的核酸(例如,对编码gm-csf多肽的核酸具有特异性的grna序列)和至少一种cas核酸酶(例如,cas9核酸酶)的核酸可以引入到一种或多种t细胞中。在某些情况下,crispr/cas系统的组分可以作为grna和/或cas核酸酶引入到一种或多种t细胞中。例如,至少一种grna(例如,对编码gm-csf多肽的核酸具有特异性的grna序列)和至少一种cas核酸酶(例如,cas9核酸酶)可以引入到一种或多种t细胞中。
在某些情况下,当crispr/cas系统的组分(例如,grna和cas核酸酶)作为编码各组分的核酸(例如,编码grna的核酸和编码cas核酸酶的核酸)引入一种或多种t细胞中时,该核酸可以是任何合适的形式。例如,核酸可以是构建体(例如,表达构建体)。编码至少一种grna的核酸和编码至少一种cas核酸酶的核酸可以处于单独的核酸构建体上或同一核酸构建体上。在一些情况下,编码至少一种grna的核酸和编码至少一种cas核酸酶的核酸可以处于单个核酸构建体上。核酸构建体可以是任何合适类型的核酸构建体。可以用于表达至少一种grna和/或至少一种cas核酸酶的核酸构建体实例包括但不限于表达质粒和病毒载体(例如,慢病毒载体)。在编码至少一种grna的核酸和编码至少一种cas核酸酶的核酸处于单独的核酸构建体上的情况下,该核酸构建体可以是相同类型的构建体或不同类型的构建体。在一些情况下,编码至少一种对编码细胞因子多肽(例如,gm-csf多肽)的核酸具有特异性的grna序列的核酸和编码至少一种cas核酸酶的核酸可以处于单个慢病毒载体上。例如,编码至少一种对编码细胞因子多肽(例如gm-csf多肽)的核酸具有特异性的grna序列、编码至少一种包括seqidno:1所示序列的grna和编码至少一种cas9核酸酶的慢病毒载体可以用于t细胞的离体工程改造,以具有降低的表达水平的该细胞因子(例如,gm-csf多肽)。
在一些情况下,crispr/cas系统的组分(例如,grna和cas核酸酶)可以(例如,作为grna和/或作为cas核酸酶)直接引入一种或多种t细胞中。grna和cas核酸酶可以分开或一起引入一种或多种t细胞中。在grna和cas核酸酶一起引入一种或多种t细胞中的情况下,grna和cas核酸酶可以是复合物的形式。当grna和cas核酸酶为复合物的形式时,grna和cas核酸酶可以共价或非共价连接。在某些情况下,包含grna和cas核酸酶的复合物也可以包含一种或多种其他组分。可以包括crispr/cas系统的组分(例如,grna和cas核酸酶)的复合物实例包括但不限于核糖核蛋白(rnp)和效应子复合物(例如,包含crisprrna(crrna)的cas核酸酶)。例如,至少一种grna和至少一种cas核酸酶可以包括在rnp中。在一些情况下,rnp可以包括以约1:1-约10:1的比率(例如,约1:1-约10:1、约2:1-约10:1、约3:1-约10:1、约5:1-约10:1、约8:1-约10:1、约1:1-约9:1、约1:1-约7:1、约1:1-约5:1、约1:1-约4:1、约1:1-约3:1、约1:1-约2:1、约2:1-约8:1、约3:1-约6:1、约4:1-约5:1、或约5:1-约7:1)的grna和cas核酸酶。例如,rnp可以包括约1:1的比率的grna和cas核酸酶。例如,rnp可以包括约2:1的比例的grna和cas核酸酶。在一些情况下,包括至少一种对编码gm-csf多肽的核酸具有特异性的grna序列(例如,编码至少一种包括seqidno:1所示序列的grna)和至少一种cas9核酸酶的rnp可以用于t细胞的离体工程改造以具有降低的水平的gm-csf多肽。
crispr/cas系统用于ko编码细胞因子多肽(例如,gm-csf多肽)的核酸的组分(例如,grna和cas核酸酶)可以引入到一种或多种t-细胞(例如,cart)中。crispr/cas系统的组分引入到t细胞中的方法可以是物理方法。crispr/cas系统的组分引入到t细胞中的方法可以是化学方法。crispr/cas系统的组分引入到t细胞中的方法可以是基于颗粒的方法。可以用于将crispr/cas系统的组分引入到一种或多种t细胞中的方法的实例包括但不限于电穿孔、转染(例如,脂质转染)、转导(例如,病毒载体介导的转导)、显微注射和核转染。在一些情况下,当将crispr/cas系统的组分作为编码组分的核酸引入一种或多种t细胞中时,编码组分的核酸可以转导至一种或多种t细胞中。例如,编码至少一种对编码gm-csf多肽的核酸具有特异性的grna序列(例如,编码至少一种包括seqidno:1所示序列的grna)和至少一种cas9核酸酶的慢病毒载体可以转导到t细胞(例如,离体t细胞)中。在某些情况下,当crispr/cas系统的组分直接引入一种或多种t细胞时,这些组分可以电穿孔到一种或多种t细胞中。例如,可以包括至少一种对编码gm-csf多肽的核酸具有特异性的grna序列(例如,编码至少一种包括seqidno:1所示序列的grna)和至少一种cas9核酸酶的rnp可以电穿孔到t细胞(例如,离体t细胞)中。在某些情况下,crispr/cas系统的组分可以离体引入一种或多种t细胞中。例如,具有降低的水平的gm-csf多肽的t细胞的离体工程改造可以包括用编码crispr/cas系统的组分的慢病毒载体转导经分离的t细胞。例如,具有降低的水平的gm-csf多肽的t细胞的离体工程改造可以包括用包括crispr/cas系统的组分的复合物电穿孔经分离的t细胞。在将t细胞离体工程改造成具有降低的水平的gm-csf多肽的情况下,该t细胞可以获自任何合适的来源(例如,哺乳动物,如要进行治疗的哺乳动物或供体哺乳动物,或细胞系)。
在某些情况下,t细胞(例如,cart)可以用一种或多种gm-csf多肽表达或gm-csf多肽活性的抑制剂进行处理,以降低该t细胞中gm-csf多肽的表达(例如,与未用一种或多种gm-csf多肽表达或gm-csf多肽活性的抑制剂进行处理的t细胞相比)。gm-csf多肽表达或gm-csf多肽活性的抑制剂可以是任何合适的抑制剂。gm-csf多肽表达或gm-csf多肽活性的抑制剂的实例包括但不限于设计成诱导rna干扰的核酸分子(例如,sirna分子或shrna分子)、反义分子、mirna、受体阻滞剂和抗体(例如,拮抗抗体和中和抗体)。
具有降低的表达水平的一种或多种细胞因子的t细胞(例如,gm-csfkot细胞)可以表达(例如,可以进行工程改造以表达)任何合适的抗原受体。在某些情况下,抗原受体可以是异源抗原受体。在某些情况下,抗原受体可以是car。在某些情况下,抗原受体可以是肿瘤抗原(例如,肿瘤特异性抗原)受体。例如,t细胞可以进行工程改造以表达靶向患有癌症的哺乳动物中可以由癌细胞表达的肿瘤特异性抗原(例如,细胞表面肿瘤特异性抗原)的肿瘤特异性抗原受体。由在如本文所述的具有降低的表达的细胞因子多肽(例如,gm-csf多肽)的t细胞中表达的抗原受体可以识别的抗原的实例包括但不限于分化簇19(cd19)、粘蛋白1(muc-1)、人类表皮生长因子受体2(her-2)、雌激素受体(er)、表皮生长因子受体(egfr)、甲胎蛋白(afp)、癌胚抗原(cea)、ca-125、上皮肿瘤抗原(eta)、黑素瘤相关的抗原(mage)、cd33、cd123、cll-1、e-钙黏蛋白、叶酸受体α、叶酸受体β、il13r、egfrviii、cd22、cd20、κ-轻链、λ-轻链、去氨加压素(desmopressin)、cd44v、cd45、cd30、cd5、cd7、cd2、cd38、bcma、cd138、fap、cs-1和c-met。例如,具有降低的水平的gm-csf多肽的t细胞可以设计成表达抗原受体靶向cd19。图5中显示了编码car靶向cd19(car19)的示例性核酸序列。
任何合适的方法可以用于在具有(例如,经工程改造以具有)降低的表达水平的一种或多种细胞因子多肽的t细胞(例如,gm-csfkot细胞)上表达抗原受体。例如,编码抗原受体的核酸可以引入到一种或多种t细胞中。在某些情况下,病毒转导可以用于将编码抗原受体的核酸引入非分裂细胞中。编码抗原受体的核酸可以使用任何合适的方法引入到t细胞中。在某些情况下,编码抗原受体的核酸可以通过转导(例如,使用逆转录病毒载体如慢病毒载体的病毒转导)或转染而引入t细胞中。在一些情况下,编码抗原受体的核酸可以离体引入一种或多种t细胞中。例如,表达抗原受体的t细胞的离体工程改造可以包括用编码抗原受体的慢病毒载体转导经分离的t细胞。在将t细胞离体工程改造成表达抗原受体的情况下,t细胞可以获自任何合适的来源(例如,哺乳动物,如待治疗的哺乳动物或供体哺乳动物,或细胞系)。
在一些情况下,当具有(例如,经工程改造以具有)降低的表达水平的一种或多种细胞因子多肽的t细胞(例如,gm-csfkot细胞)也会表达(例如,进行工程改造以表达)抗原受体时,该t细胞可以进行工程改造以具有降低的表达水平的该细胞因子,并且可以使用任何适当的方法进行工程改造以表达抗原受体。在某些情况下,t细胞可以首先工程改造成具有降低的表达水平的细胞因子多肽(例如,gm-csf多肽),然后工程改造成表达抗原受体,反之亦然。在某些情况下,t细胞可以同时进行工程改造以具有降低的表达水平的一种或多种细胞因子多肽(例如gm-csf多肽)以及表达抗原受体。例如,一种或多种用于降低细胞因子多肽(例如,gm-csf多肽)表达的核酸(例如,慢病毒载体,其编码至少一种对编码该细胞因子和至少一种cas9核酸酶的核酸或者对编码至少一种与该细胞因子的mrna互补的寡核苷酸的核酸具有特异性的grna序列)和一种或多种编码抗原受体(例如,car)的核酸可以同时引入到一种或多种t细胞中。一种或多种用于降低细胞因子多肽(例如,gm-csf多肽)表达的核酸和一种或多种编码抗原受体的核酸可以引入到单独的核酸构建体中或单个核酸构建体中。在一些情况下,用于降低细胞因子多肽(例如,gm-csf多肽)表达的一种或多种核酸和编码抗原受体的一种或多种核酸可以在单个核酸构建体上引入到一种或多种t细胞中。在某些情况下,用于降低细胞因子多肽(例如,gm-csf多肽)表达的一种或多种核酸和编码抗原受体的一种或多种核酸可以离体引入一种或多种t细胞中。在t细胞进行离体工程改造以具有降低的表达水平的一种或多种细胞因子多肽(例如,gm-csf多肽)并表达抗原受体的情况下,该t细胞可以获自任何合适的来源(例如,哺乳动物,如待治疗的哺乳动物或供体哺乳动物,或细胞系)。
在一些情况下,具有(例如,经工程改造以具有)降低的表达水平的一种或多种细胞因子多肽的t细胞(例如,gm-csfkot细胞)可以对其进行刺激。t细胞可以在进行工程改造以具有降低的水平的一种或多种细胞因子多肽的同时对其进行刺激,或独立于工程改造以具有降低的表达水平的一种或多种细胞因子多肽而进行刺激。例如,可以首先刺激过继细胞疗法中使用的一种或多种具有降低的水平的gm-csf多肽的t细胞,然后可以对其进行工程改造以具有降低的表达水平的gm-csf多肽,反之亦然。在一些情况下,可以首先刺激过继细胞疗法中使用的一种或多种具有降低的表达水平的细胞因子多肽(例如,gm-csf多肽)的t细胞,然后可以对其进行工程改造以具有降低的水平的该细胞因子多肽。t细胞可以使用任何适当的方法进行刺激。例如,t细胞可以通过使t细胞与一种或多种cd多肽接触进行刺激。可以用于刺激t细胞的cd多肽实例包括但不限于cd3、cd28、诱导型t细胞共刺激物(icos)、cd137、cd2、ox40和cd27。在某些情况下,在将crispr/cas系统的组分(例如,grna和/或cas核酸酶)引入t细胞中以ko编码一种或多种细胞因子多肽(例如,gm-csf多肽)的核酸之前,该t细胞可以用cd3和cd28进行刺激。
该文档还提供了涉及癌症治疗的方法和材料。例如,一种或多种具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)可以(例如,在过继细胞疗法如cart疗法中)给予患有癌症的哺乳动物(例如,人),以治疗该哺乳动物。在某些情况下,如本文所述的治疗患有癌症的哺乳动物的方法可以降低哺乳动物内的癌细胞(例如,表达肿瘤抗原的癌细胞)的数量。在某些情况下,如本文所述的治疗患有癌症的哺乳动物的方法可以降低哺乳动物内的一种或多种肿瘤(例如,表达肿瘤抗原的肿瘤)的尺寸。
在某些情况下,向哺乳动物给予具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)并不会导致crs。例如,向哺乳动物给予具有降低的水平的gm-csf多肽的t细胞不会导致与crs相关的细胞因子(例如,crs关键细胞因子)的释放。与crs相关的细胞因子的实例包括但不限于il-6、g-csf、ifn-g、il-1b、il-10、mcp-1、mig、mip、mip1b、tnf-a、il-2和穿孔素。
在某些情况下,向哺乳动物给予具有降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)不会导致神经毒性。例如,向哺乳动物给予具有降低的水平的gm-csf多肽的t细胞并未导致白细胞的分化和/或活化,白细胞的分化和/或活化与神经毒性有关。其分化和/或活化与神经毒性相关的白细胞实例包括但不限于单核细胞、巨噬细胞、t细胞、树突状细胞、小胶质细胞、星形细胞和嗜中性粒细胞。
如本文所述,患有癌症的任何合适的哺乳动物(例如,人)都可以进行治疗。如本文所述可以进行治疗的哺乳动物的实例包括但不限于人、灵长类动物(例如,猴子)、狗、猫、马、牛、猪、绵羊、小鼠和大鼠。例如,患有癌症的人可以使用本文所述的方法和材料,例如,在过继性t细胞疗法中,如cart细胞疗法中用一种或多种具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽(例如,gm-csf多肽)的t细胞进行治疗。
当如本文所述治疗患有癌症的哺乳动物(例如,人)时,该癌症可以是任何合适的癌症。在某些情况下,如本文所述治疗的癌症可以是实体瘤。在某些情况下,如本文所述治疗的癌症可以是血液癌症。在某些情况下,如本文所述治疗的癌症可以是原发性癌症。在某些情况下,如本文所述治疗的癌症可以是转移性癌症。在某些情况下,如本文所述治疗的癌症可以是难治性癌症。在某些情况下,如本文所述治疗的癌症可以是复发性癌症。在某些情况下,如本文所述治疗的癌症可以表达肿瘤相关的抗原(例如,由癌细胞产生的抗原性物质)。如本文所述可以治疗的癌症的实例包括但不限于b细胞癌(例如,弥漫性大b细胞淋巴瘤(dlbcl)和b细胞白血病)、急性淋巴细胞性白血病(all)、慢性淋巴细胞性白血病(cll)、滤泡性淋巴瘤(follicularlymphoma)、套细胞淋巴瘤(mantlecelllymphoma)、非霍奇金淋巴瘤、霍奇金(hodgkin)淋巴瘤、急性髓细胞性白血病(aml)、多发性骨髓瘤、头颈癌、肉瘤、乳腺癌、胃肠道恶性肿瘤、膀胱癌、尿路上皮癌、肾癌、肺癌、前列腺癌、卵巢癌、子宫颈癌、生殖器癌(例如,男性生殖器癌和女性生殖器癌)和骨癌。例如,一种或多种具有(例如,经工程改造以具有)降低的水平的gm-csf多肽的t细胞(例如,gm-csfkot细胞)可以用于治疗患有dlbcl的哺乳动物。例如,一种或多种具有(例如,经工程改造以具有)降低的水平的gm-csf多肽的t细胞(例如,gm-csfkot细胞)可以用于治疗患有all的哺乳动物。
任何合适的方法都可以用于鉴定患有癌症的哺乳动物。例如,成像技术和活检技术都可以用于鉴定患癌症的哺乳动物(例如,人)。
一旦鉴定为患癌症(例如,dlbcl或all),哺乳动物就可以给予一种或多种如本文所述的具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)。
例如,一种或多种具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)可以用于过继性t细胞疗法(例如,cart细胞疗法)以治疗患有癌症的哺乳动物。例如,一种或多种具有降低的水平的gm-csf多肽的t细胞可以用于靶向哺乳动物(例如,患有癌症的哺乳动物)中的任何合适抗原的过继性t细胞疗法(例如,cart细胞疗法)中。在某些情况下,抗原可以是肿瘤相关的抗原(例如,由癌细胞生产的抗原性物质)。本文提供的过继t细胞疗法靶向的肿瘤相关抗原的实例包括但不限于cd19(与dlbcl、all和cll相关)、afp(与生殖细胞肿瘤和/或肝细胞癌相关)、cea(与肠癌、肺癌和/或乳腺癌相关)、ca-125(与卵巢癌相关)、muc-1(与乳腺癌相关)、eta(与乳腺癌相关)、mage(与恶性肿瘤相关)、cd33(与aml相关)、cd123(与aml相关)、cll-1(与aml相关)、e-钙黏蛋白(与上皮肿瘤相关)、叶酸受体α(与卵巢癌相关)、叶酸受体β(与卵巢癌和aml相关)、il13r(与脑癌相关)、egfrviii(与脑癌相关)、cd22(与b细胞癌相关)、cd20(与b细胞癌相关)、κ轻链(与b细胞癌有关)、λ轻链(与b细胞癌相关)、cd44v(与aml相关)、cd45(与血液癌症相关)、cd30(与霍奇金淋巴瘤和t细胞淋巴瘤相关),cd5(与t细胞淋巴瘤相关)、cd7(与t细胞淋巴瘤相关)、cd2(与t细胞淋巴瘤相关)、cd38(与多发性骨髓瘤和aml相关)、bcma(与多发性骨髓瘤相关)、cd138(与多发性骨髓瘤和aml相关)、fap(与实体瘤相关)、cs-1(与多发性骨髓瘤相关)、以及c-met(与乳腺癌有关)。例如,一种或多种具有降低的水平的gm-csf多肽的t细胞可以用于靶向cd19的cart细胞疗法(例如,cart19细胞疗法)以治疗本文所述的癌症。
在一些情况下,一种或多种具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)可以用于过继t细胞疗法(例如,cart细胞疗法)以治疗患有癌症以外的疾病或病症的哺乳动物。例如,一种或多种具有降低的水平的gm-csf多肽的t细胞可以用于靶向哺乳动物中任何合适疾病相关的抗原(例如,由患有特定疾病的细胞产生的抗原性物质)的过继性t细胞疗法(例如,cart细胞疗法)。本文提供的过继性t细胞疗法可以靶向的疾病相关抗原的实例包括但不限于去氨加压素(与自身免疫性皮肤病相关)。在另一个实施方式中,本文提供的过继性t细胞疗法可以靶向的疾病相关抗原包括但不限于dsg3抗原,寻常型天疱疮(pemphigusvulgaris)中与dsg3结合的b细胞受体(bcr)或抗原musk。在其它实施方式中,本文提供的过继性t细胞疗法可以靶向的疾病相关抗原包括但不限于musk重症肌无力(myastheniagravis)中musk的bcr。
在一些情况下,用于过继性t细胞疗法(例如,cart细胞疗法)的一种或多种具有(例如,经工程改造以具有)降低的表达水平的细胞因子多肽的t细胞(例如,gm-csfkot细胞)可以作为与一种或多种用于治疗癌症的其他药物的联合疗法而给予患有癌症的哺乳动物。例如,过继性细胞疗法中使用的一种或多种具有降低的水平的gm-csf多肽的t细胞可以与一种或多种抗癌疗法(例如,手术、放射疗法、化学疗法(例如,烷基化剂,如白消安(busulfan))、靶向疗法(例如,gm-csf抑制剂,如lenzilumab)、激素疗法、血管生成抑制剂、免疫抑制剂(例如,白介素6抑制剂,如托珠单抗(tocilizumab))和/或一种或多种crs疗法(例如,鲁索替尼(ruxolitinib)和依鲁替尼(ibrutinib))组合而给予哺乳动物。在过继细胞疗法中使用的一种或多种具有降低的水平的gm-csf多肽的t细胞与其他药物一起治疗癌症的情况下,一种或多种其他药物可以同时或独立进行给予。在某些情况下,可以首先给予一种或多种用于过继细胞疗法的具有降低的水平的gm-csf多肽的t细胞,并随后再给予一种或多种其他药物,反之亦然。
根据本文所述的实施方式以及如美国专利号8,168,183和9,017,674(其每一专利均通过引用以其整体结合于本文中)中所述的lenzilumab(humanigen,burlingame,ca),即一种hgm-csf中和抗体,是中和人gm-csf的新型首类
本发明将在以下实施例中进行进一步描述,这些实施例并非限制权利要求书中描述的本发明的范围。
实施例
实施例1
向缺陷cart细胞产生细胞因子以提高cart细胞疗法的治疗指数
该实施例描述了gm-csf敲除(gm-csfko)cart19细胞的发育,并表明所得的gm-csfkocart19细胞功能正常并具有增强的扩增能力。
实验设计:
使用了b细胞白血病异种移植物中的car19。如本文所述,这些质粒用于包装和慢病毒生产。作为小鼠模型,采用了两种模型:
1.异种移植模型:nsg小鼠皮下移植cd19阳性的荧光素酶阳性的细胞系nalm6。通过生物发光成像证实植入成功。小鼠用人pbmc静脉内注射,并在肿瘤内注射慢病毒颗粒进行处理。通过流式细胞术测量cart细胞的产生。评价cart向肿瘤部位的转运,并通过生物发光成像测量抗肿瘤响应,以衡量疾病负担。
2.来自jacksonlaboratory的人源化免疫系统(his)小鼠:向这些小鼠注射作为新生细胞的胎儿cd34+细胞,并因此培育出人造血功能。如先前所用,我们将这些小鼠植入cd19+细胞系nalm6。同样,我们将通过肿瘤内注射慢病毒颗粒在体内产生cart19。然后,将测量cart19细胞消除nalm6的活性,并将其与离体产生的慢病毒转导cart19细胞(目前已用于临床中)进行比较。
材料和方法:
car质粒的产生:
使用41bb和cd3将抗cd19克隆fmc63新合成到car骨架中,然后克隆到第三代慢病毒骨架中。
为了产生对照cart19细胞,使用pant细胞试剂盒对正常供体t细胞进行阴性选择,并使用抗cd3/cd28免疫磁珠(dynabeads)(invitrogen,在培养的第一天添加)进行离体扩增。刺激后一天,用慢病毒上清液以3的感染复数(moi)转导t细胞。在第6天去除抗cd3/cd28免疫磁珠,并在t细胞培养基(x-vivo15培养基,人血清5%,青霉素,链霉素和谷氨酰胺)中生长t细胞长达15天,并随后冷冻保存以备将来实验。在所有实验之前,t细胞解冻并在37℃下静置过夜。
gm-csf敲除cart细胞的生成:
gm-csf敲除cart细胞使用两种方法采用crisr-cas9系统产生:
1.生成grna,并将其克隆到编码cas9和grna的慢病毒载体中。在t细胞扩增期间,在第1天,也就是同一天,t细胞用该慢病毒转导,并同时用car19慢病毒颗粒转导。细胞扩增一段8天的时间,然后收获t细胞,分离dna并测序以评价敲除效率。这些细胞冷冻保存,并用于将来的体外或体内实验。核酸序列编码如图5中所示。
2.由grna产生mrna,并用于敲除gm-csf。为此,grna与rnp以1:1的比率混合,然后在用cd3/cd28珠粒刺激后的第3天对t细胞进行电穿孔。细胞扩增一段8天的时间,然后收获t细胞,分离dna并测序以评价敲除效率。这些细胞冷冻保存并用于将来的体外或体内实验。
细胞
该nalm6细胞系获自atcc,并维持于r10培养基(rpmi培养基,10%胎牛血清,青霉素和链霉素)中。正如所示,在某些实验中使用了在eflα启动子的控制下用萤光素酶-gfp细胞转导的nalm6-细胞。去标识(de-identified)的原生人all样品从mayoclinicbiobank获得。所有样品均在知情、书面同意后获得。对于所有功能研究,在分析前至少12小时对细胞解冻,并在37℃下静置过夜。
流式细胞术分析
抗人抗体购自biolegend、ebioscience或bdbiosciences。细胞从体外培养物或动物中进行分离,在补充有2%胎牛血清的pbs中洗涤一次,并在阻断fc受体后于4℃下染色。对于细胞数定量,countbright珠粒(invitrogen)根据厂商的说明书(invitrogen)进行使用。在所有分析中,根据正向散射特征相对于侧向散射的特征对所关注的种群进行门控,然后进行单重态门控(singletgating),并使用livedeadaqua(invitrogen)对活细胞进行门控。抗cd19car的表面表达通过用来自jacksonimmunoresearch的alexafluor647缀合的山羊抗小鼠f(ab′)2抗体染色而进行检测。
t细胞功能分析测试:
t细胞脱粒和细胞内细胞因子分析测试:
简而言之,t细胞与靶细胞以1:5的比率培养。为car表达进行染色之后,在培养时加入cd107a、cd28、cd49d和莫能菌素(monensin)。4小时后,收获细胞并对car表达,cd3和livedead染色(invitrogen)进行染色。固定细胞并使其透化(fix&
增殖分析测试:
t细胞经过洗涤并以1×107个/ml再悬浮于100μlpbs中,并在37℃下用100μlcfse2.5μm(lifetechnologies)标记5分钟。然后将反应用冷r10冷激,并将细胞洗涤3次。以100gy的剂量对靶进行辐照。将t细胞与经辐照的靶细胞以1:1的比率一起培养120小时。然后收获细胞,对cd3、car和livedeadaqua(invitrogen)进行染色,并在进行流式细胞术分析之前加入countbright珠粒(invitrogen)。
细胞毒性分析测试:
将nalm6-luc细胞或cfse(invitrogen)标记的原代all样品用于细胞毒性分析测试。简而言之,将靶标以指定的比率与效应子t细胞一起培养4、16、24、48和/或72小时。杀伤力通过在xenogenivis-200spectrum相机上进行生物发光成像或通过流式细胞术进行计算。对于后者,收获细胞;在分析之前,先加入countbright珠粒和7-aad(invitrogen)。
剩余活靶细胞为cfse+7-aad-。
分泌型细胞因子测定:
如所示,将效应子和靶细胞在t细胞培养基中以1:1的比率培养24或72小时。收集上清液,并按照厂商的规程(invitrogen)通过30重luminex阵列进行分析。
结果
gm-csfkocart细胞用crisr-cas9系统产生。在t细胞扩增期间,t细胞用编码grna和cas9的慢病毒和编码cari9的慢病毒进行转导(第1天)。细胞扩增8天。8天后,收获t细胞,分离dna,并对所分离的dna进行测序以评价敲除效率。例如,参见图1。t细胞表现出24.1%的敲除效率(图2a),并且car转导效率为73%(图2b)。
为评价gm-csfkocart细胞的细胞效应子功能,将cart19、gm-csfkocart19、utd或gm-csfkoutd与cd19阳性细胞系nalm6按照1:5的比率共培养。4小时后,收获细胞,透化,固定并对细胞因子染色(图3)。
为了评价gm-csfkocart细胞的增殖,在转导t细胞之后追踪扩增动力学。gm-csfkocart细胞比单独用cart19转导的细胞具有更强的扩增能力(图4)。
这些结果证实,gm-csf敲除cart可以增强cart细胞功能和抗肿瘤活性。这些结果还证实,与cart19组合的gmcsf阻断并未影响cart细胞效应子功能。
实施例2
cart疗法期间的gm-csf耗竭会降低细胞因子释放综合征和神经毒性,并可以增强cart细胞功能
该实施例研究了耗尽粒细胞巨噬细胞集落刺激因子(gm-csf)和髓细胞作为管理cart细胞相关毒性的潜在策略。据发现,用中和抗体阻断gm-csf,在体外或体内均不会抑制cart功能。体外cart细胞增殖得到增强,并且gm-csf耗竭后,cart细胞导致患者源的异种移植物中的白血病更控制更有效。此外,在crs和nt的原发性急性淋巴细胞性白血病异种移植模型中,gm-csf阻断导致大脑中髓细胞和t细胞浸润减少,并改善了crs和nt的发展。最后,在cart细胞制备期间,gm-csf敲除cart细胞通过crispr/cas9破坏gm-csf而产生。gm-csfk/ocart细胞继续正常发挥功能,并导致体内抗肿瘤活性增强。这些证明了gm-csf中和可以消除神经毒性和crs,并且还可以增强cart细胞功能。
材料和方法
细胞系和原代细胞
nalm6和molm13购自atcc,manassas,va,usa,用萤光素酶-zsgreen慢病毒(addgene)转导并分拣至100%纯度。细胞系培养于rio(rpmi,10%fcsv/v,1%penstrepv/v)中。根据机构审查委员会批准的方案,从mayoclinic生物库获得急性白血病患者的原代细胞。由institutionalbiosafetycommittee(ibc)批准重组dna的实验室使用。
原代t细胞和cart细胞
外周血单核细胞(pbmc)使用ficoll方案从去识别的供体血液单采锥(donorbloodapheresiscone)进行分离(例如,参见dietzetal.,2006transfusion46:2083-2089,其通过引用以其整体结合于本文中)。t细胞用阴性选择磁珠(stemcelltechnologies)分离,并使用cd14+磁珠(stemcelltechnologies)阳性选择出单核细胞。原代细胞与5%人血清、青霉素、链霉素和glutamax一起培养于x-vivo15培养基中。如下所述,cd19导向cart细胞通过正常供体t细胞的慢病毒转导而生成。第二代cari9构建体进行新合成(idt),并在ef-1a启动子的控制下克隆到第三代慢病毒中。cd19导向单链可变片段源自克隆fmc63。第二代41bb共刺激(fmc63-41bbz)car构建体经合成并用于这些实验。在lipofectamine3000、vsv-g和包装质粒的存在下,慢病毒颗粒通过质粒瞬时转染到293t病毒生产细胞中而产生。以1:3的比率使用cd3/cd28刺激珠粒(stemcell)刺激从正常供体中分离的t细胞,并随后在刺激后24小时以3.0的感染复数进行转染。在第6天去除磁珠,并在第8天收获cart细胞并冷冻保存,以备将来实验之用。在将cart细胞用于实验之前,要将其解冻并在t细胞培养基中静置12小时。
gm-csfk/ocart细胞的生成:
通过筛选先前报道对人gm-csf.25具有高效率的grna选择出靶向人gm-csf外显子3的向导rna(grna)。该grna在cas9第三代慢病毒构建体(lenticrisprv2)中定序(ordered),由u6启动子(genscript,township,nj,usa)控制。编码该构建体的慢病毒颗粒如上所述进行生产。t细胞在用cd3/cd28珠粒刺激后24小时,用car19和gm-csfgrna-lenticrisprv2慢病毒进行双重转导。然后如上所述,继续进行car-t细胞的扩增。为了分析靶向gm-csf的效率,使用purelinkgenomicdna微试剂盒(invitrogen,carlsbad,ca,usa)从gm-csfk/ocart19细胞中提取基因组dna。使用choicetaqbluemastermix(thomasscientific,minneapolis,mn,usa)对所关注的dna进行pcr扩增,并使用qiaquick凝胶提取试剂盒(qiagen,germantown,md,usa)进行凝胶提取,以测定编辑。发送pcr扩增子进行eurofins测序(louisville,ky,usa),并使用tide.nki.nl处可获得的tide(trackingoflndelsbydecomposition)软件计算等位基因改变频率。图15描述了grna序列、引物序列和用于生成gm-csfk/ocart19方案的方案。
gm-csf中和抗体和同种型对照
lenzilumab(humanigen,brisbane,ca)是中和人gm-csf的人源化抗体,正如美国专利号8,168,183和9,017,674中所述,该每一专利均通过引用以其整体结合于本文中。对于体外实验,使用了lenzilumab或同种型对照10ug/ml。对于体内实验,注射了10mg/kglenzilumab或同种型对照,并且在各个实验方案中指明了时间表、途径和频率。在某些实验中,还使用了抗小鼠gm-csf中和抗体(10mg/kg),正如实验方案中所示。
t细胞功能实验
正如所示,在cart细胞与其靶标以1:1的比率共培养后24或72小时进行细胞因子测定。如所示,对从这些实验中收集的上清液实施人gm-csf单重体(millipore)、30重体人多重体(millipore)或30重小鼠多重体(millipore)。这使用流式细胞仪珠粒测定法或luminex,细胞内细胞因子分析进行分析,并在莫能菌素(monensin)、hcd49d和hcd28存在下,将cart细胞与靶标以1:5的比率在37℃下培养4小时后,进行t细胞脱粒分析测试。4小时后,收集细胞并在表面染色后进行细胞内染色,然后进行固定和透化(fix&permcellfixation&cellpermeabilizationkit,lifetechnologies)。为了进行增殖分析测试,将cfse(lifetechnologies)标记的效应子细胞(cart19)和辐照靶细胞以1:1进行共培养。在某些实验中,将cd14+单核细胞以1:1:1的比率添加到共培养物中,如所示。正如具体实验中所示,细胞共培养3-5天,然后收获细胞,并用抗hcd3和live/deadaqua进行表面染色。pma/离子霉素用作t细胞的阳性非特异性刺激物,其浓度如具体实验中所示。为了进行杀伤性分析测试,正如具体实验中所列,cd19+荧光素酶+all细胞系nalm6或cd19-荧光素酶+对照molm13细胞以指定的比率与效应t细胞一起培养24或48小时。通过在xenogenivis-200spectrum相机(perkinelmer,hopkinton,ma,usa)上进行的生物发光成像,计算出杀伤率(killing),作为残留活细胞的量度。样品在成像前10分钟,每100μl样品体积用1μld-荧光素(30ug/ml)进行处理。
多参数流式细胞术
抗人抗体购自biolegend、ebioscience或bdbiosciences。从体外培养物或动物外周血中分离出细胞(ack溶胞后),在补充有2%胎牛血清的磷酸盐缓冲盐水中洗涤两次,并于4℃下进行染色。为了进行细胞数定量,根据厂商的说明书(invitrogen)使用countbright珠粒(invitrogen)。在所有分析中,根据正向散射相对于侧向散射的特征对所关注的种群进行门控,然后进行单重门控,并使用livedeadaqua(invitrogen)对活细胞进行门控。通过用山羊抗小鼠f(ab')2抗体染色,检测car的表面表达。流式细胞术在四激光cantoii分析仪(bdbiosciences)上进行。所有分析均使用flowjox10.0.7r2进行。
异种小鼠模型
根据institutionalanimalcareandusecommittee(iacuc)批准的培育方案,在mayoclinic的departmentofcomparativemedicine内对雄性和雌性8-12周龄nod-scid-il2ry-/-(nsg)小鼠进行饲养和护理。小鼠维持于已获得institutionalbiosafetycommittee批准用于bsl2+级实验的动物安全屏障空间中。
nalm6细胞系异种移植
cd19+、荧光素酶+allnalm6细胞系用于建立all异种移植物。这些异种移植实验已通过不同的iacuc协议获得批准。在此,通过尾静脉注射向静脉内注射1×106个细胞。注射后,6天后,使用xenogenivis-200spectrum相机对小鼠进行生物发光成像,以确认植入。腹膜内注射10μl/gd荧光素(15mg/ml)后进行成像。然后根据小鼠的生物发光成像将其随机分组,以接受特定实验中概述的不同处理。通常而言,注射1-2×106个cart细胞或utd细胞,并且确切的剂量列于特定的实验细节中。每周进行成像以评价和跟踪疾病负担。注射cart细胞后7-10天进行尾静脉放血以评价t细胞扩增,然后根据需要对此进行跟踪。使用ack裂解缓冲液(thermofisher)溶解小鼠外周血,然后用于流式细胞术研究。使用xenogenivis-200spectrum相机(perkinelmer,hopkinton,ma,usa)采集生物发光图像,并使用livingimage版本4.4(caliperlifesciences,perkinelmer)进行分析。对于经抗体治疗处理的小鼠,ip开始抗体治疗(10mg/kglenzilumab或同种型对照),共10天。
原发性患者源all异种移植物
为了建立原代all异种移植,nsg小鼠首先接受30mg/kg的白消安ip。第二天,向小鼠注射源自患有难治性all的患者外周血的2×106个原代细胞。监测小鼠的植入4-6周,并且当在血液中持续观察到cd19+细胞(>l个细胞/μl)时,将其随机分为接受或不接受采用抗体疗法的不同cart19或utd(1×106个细胞)治疗处理(从接受cart细胞疗法之日开始,总共10天的10mg/kglenzilumab或同种型对照ip)。通过尾静脉放血定期监测小鼠的白血病负担。
原发性患者源的crs/nt的all异种移植
类似于以上实验,对小鼠腹ip注射30mg/kg白消安。第二天,它们接受了1-2×106个原代胚细胞,这些胚细胞来自复发难治性all患者的外周血。监测小鼠移植4-6周,当cd19+细胞水平高(≥10个细胞/μl)时,它们接受cart19(2-5×106个细胞)并开始抗体疗法,共10天,正如具体实验的细节。每天对小鼠称重,以衡量其健康状况。在cart注射后5-6天进行小鼠的脑mri,并在cart注射后4-11天进行尾静脉放血。使用azalyze分析了脑mri图像。
mri采集
使用brukeravanceii7tesla垂直孔小动物mri系统(brukerbiospin)进行图像采集,以评价中枢神经系统(cns)的血管透化性。通过3-4%异氟烷诱导和维持吸入麻醉。在采集过程期间,使用mri相容性生命体征监测系统(model1030;sainstruments,stonybrook,ny)监测呼吸频率。使用100mg/kg体重-基剂量向小鼠ip注射钆,并在标准延迟15分钟后,使用体积采集t1加权的自旋回波序列(重复时间=150ms,回波时间=8ms,视野:32mm×19.2mm×19.2mm,矩阵:160×96×96;平均数=1)以获得t1加权图像。钆增强mri变化指示血脑屏障破坏。使用由mayoclinic的biomedicalimagingresource开发的analyze软件包进行容量分析。
小鼠脑组织上的rna-seq
使用mirneasymicro试剂盒(qiagen,gaithersburg,md,usa)分离rna,并用rnase-freednaseset(qiagen,gaithersburg,md,usa)处理。rna-seq由mayoclinic的genomeanalysiscore在illuminahtseq4000(illumina,sandiego,ca,usa)上进行。使用illuminabcl2fastq软件将二进制基本调用数据转换为fastq。使用trimmomatic去除适配子序列,并使用fastqc检查质量。最新人(grch38)和小鼠(grcm38)参考基因组从ncbi下载。使用star生成基因组索引文件,并对每种条件将配对末端读数映射到基因组。htseq31用于生成每个基因的表达计数,并且deseq2用于计算差异表达。基因本体论使用enrichr进行评价。图16总结了上面详述的步骤。rna测序数据可以获自geneexpressionomnibus,登录号为gse121591。
统计学研究
prismgraphpad和microsoftexcel常常用于数据分析。通过prism将热分布图中的高细胞因子浓度归一化为“1”,并将低浓度归一化为“o”。图例中描述了统计测试。
结果
在存在单核细胞的情况下,体外gm-csf中和作用会增强car-t细胞增殖,并且不会损害car-t细胞的效应子功能。
如果将car-t细胞疗法后的gm-csf中和作用用作预防crs和nt的策略,则它不得抑制car-t细胞的功效。因此,我们的初始实验旨在研究gm-csf中和作用对car-t细胞效应子功能的影响。在此,在lenzilumab(gm-csf中和抗体)或同种型对照(igg)存在下,cart19细胞与或不与cd19+all细胞系nalm6一起共培养。我们认为,lenzilumab而非igg对照抗体确实可以完全中和gm-csf(图6a),但不抑制car-t细胞抗原特异性增殖(图6b)。当cart19细胞与cd19+细胞系nalm6在单核细胞存在下共培养时,与cart19+同种型对照igg相比,lenzilumab与cart19组合证实抗原特异性cart19增殖呈指数增加(p<0.0001,图6c)。为了研究car-t特异性细胞毒性,cart19或对照utdt细胞与萤光素酶+cd19+nalm6细胞系一起培养,并用同型对照抗体或gm-csf中和抗体进行治疗处理(图1d)。gm-csf中和抗体治疗处理不会抑制car-t细胞杀死nalm6靶细胞的能力(图6d)。总体而言,这些结果表明,lenzilumab不能在体外抑制car-t细胞的功能,并且在单核细胞存在下会增强cart19细胞的增殖,表明gm-csf中和作用可以改善car-t细胞介导的功效。
gm-csf中和作用会体内增强异种移植模型中的car-t细胞抗肿瘤活性。
为了证实gm-csf耗竭不会抑制cart19的效应子功能,我们研究了用lenzilumab中和gm-csf对异种移植模型中cart19抗肿瘤活性的作用。首先,使用复发模型,旨在大力研究cart19细胞的抗肿瘤活性是否受gm-csf中和作用影响。向nsg小鼠注射1×106个荧光素酶+nalm6细胞,然后在6天后成像,容许为小鼠留出足够的时间以达到非常高的肿瘤负担。小鼠随机接受cart19或utd细胞的单次注射,以及同种型对照抗体或lenzilumab的10天注射(图7a)。注射cart19后8天收集的血清的gm-csf分析表明,lenzilumab在cart19疗法的情况下成功中和了gm-csf(图7b)。注射cart19一周后的生物发光成像表明,在这种高肿瘤负荷复发模型中,cart19与lenzilumab的组合有效控制了白血病,并显著优于对照utd细胞(图7c)。cart19与lenzilumab联合治疗处理导致强效抗肿瘤活性,并改善了总生存率,无论gm-csf中和作用水平如何,与用对照抗体的cart19相似,表明gm-csf不会损害体内car-t细胞的活性(图8)。其次,在人pbmc存在下,在原发性all患者源的异种移植模型中进行了这些实验,因为这代表了更为相关的异质模型。用白消安对化疗进行调理化疗后,向小鼠注射源自复发性all患者的胚细胞。通过连续尾静脉放血监测小鼠移植数周,并且当血液中的cd19+胚细胞≥lμl时,小鼠随机接受联合采用lenzilumab+抗鼠gm-csf中和抗体或同种型对照igg抗体的pbmc的cart19或utd治疗,从cart19注射当天开始进行10天(图7d)。在这种原生all异种移植模型中,与cart19+同种型对照相比,gm-csf中和作用联合cart19疗法导致在cart19给予后持续超过35天的时间内白血病疾病控制显著改善(图7e)。这表明,gm-csf中和作用可以在降低cart19细胞治疗后的复发和增加可持久的完全响应方面发挥作用。
gm-csfcrispr敲除car-t细胞表现出gm-csf表达降低,关键细胞因子水平相似,并增强了抗肿瘤活性。
为了确信排除在car-t细胞功能中至关重要的gm-csf的任何作用,我们在car-t细胞制备期间使用据报道会产生高效率的grna破坏gm-csf基因,将其克隆到crispr慢病毒骨架中。使用这种grna,我们在cart19细胞中获得了约60%的敲除效率(图9)。当用cd19+细胞系nalm6刺激car-t细胞时,与具有野生型gm-csf基因座的cart19(“野生型cart19细胞”)相比,gm-csfk/ocar-t细胞产生了统计学显著更少的gm-csf。在car-t细胞中的gm-csf敲除不会损害其他关键t细胞细胞因子,包括ifn-y、il-2或car-t细胞抗原特异性脱粒(cd107a)的生产(图10a),但确实表现出gm-csf表达降低(图10b)。为了确证gm-csfk/ocar-t细胞继续表现出正常功能,我们在all高肿瘤负荷复发异种移植模型中测试了它们的体内功效(如图7a中所述)。在该异种移植模型中,在cart19治疗处理后7天,利用gm-csfk/ocart19代替野生型cart19显著降低了人gm-csf的血清水平(图10b)。生物发光成像数据表明,与该模型中的cart19相比,gm-csfk/ocart19细胞显示出增强的白血病控制(图11)。重要的是,与野生型cart19细胞相比,gm-csfk/ocart19细胞证实了总存活率的显著提高(图10c)。除了gm-csf,在人(图10d)或小鼠(图10e)细胞因子中均未检测到统计学上的显著改变。总之,这些结果证实了图6和7,表明gm-csf耗竭不会损害car-t功效功能至关重要的细胞因子。此外,图10中的结果表明gm-csfk/ocart可以代表“内建(builtin)”gm-csf控制的治疗选项,作为car-t细胞生产期间的改善。
神经毒性和细胞因子释放综合征的患者异种移植模型
在该模型中,调理的nsg小鼠移植原代all胚细胞,并监测移植数周,直到它们发展为高疾病负担(图12a)。当外周血中cd19+胚细胞的水平≥10/μl时,小鼠随机接受所示的不同治疗处理(图12a)。用cart19(用对照igg抗体或gm-csf中和抗体)的治疗处理成功根除了这种疾病(图12b)。在用cart19治疗处理后4-6天内,小鼠开始出现运动无力,身体驼背和进行性体重减轻。症状与crs和nt一致。这与注射cart19后4-11天的关键血清细胞因子升高有关,类似于在car-t细胞疗法后的人crs(包括人gm-csf、tnf-a、ifn-y、il-10、il-12、il-13、il-2、il-3、ip-10、mdc、mcp-1、mip-1a、mip-1,以及小鼠il-6、gm-csf、il-4、il-9、ip-10、mcp-1和mig)。这些采用cart19治疗处理的小鼠还发展了nt,如脑mri分析所示,显示出异常t1增强,间接表明血脑屏障破坏和可能脑水肿(图12d),以及对所收获的脑的流式细胞术分析,显示出人cart19细胞的浸润(图12e)。此外,从出现nt征兆的小鼠大脑切片的rna-seq分析表明,调节t细胞受体、细胞因子受体、t细胞免疫激活、t细胞转运以及t细胞和髓细胞分化的基因显著上调(表1)。
表1.用cart19细胞治疗处理后,患者源异种移植物的大脑中改变的经典途径之表。
体内gm-csf中和作用能改善异种移植模型中cart19疗法后的细胞因子释放综合征和神经毒性。
使用图4a所示的针对nt和crs的异种移植患者源模型,我们研究了gm-csf中和对cart19毒性的影响。为了排除小鼠gm-csf的混杂效应(cofoundingeffect),小鼠接受了与10天gm-csf抗体疗法或同种型对照抗体组合的cart19细胞(10mg/kglenzilumab和10mg/kg抗小鼠gm-csf中和抗体)。gm-csf中和抗体疗法阻止了cart19疗法后crs诱导的体重减轻(图13a)。cart19细胞治疗后11天的细胞因子分析表明,人gm-csf被抗体中和(图13b)。另外,gm-csf中和导致几种人(ip-10、il-3、il-2、il-1ra、il-12p40、vegf、gm-csf)(图5c)和小鼠(mig、mcp-1、kc、ip-10)(图13d)细胞因子的显著降低。干扰素γ诱导的蛋白(ip-10,cxcl1o)由其他细胞类型中的单核细胞产生,并充当许多细胞类型(包括单核细胞、巨噬细胞和t细胞)的趋化因子。il-3在骨髓祖细胞分化中发挥作用。il-2是关键t细胞细胞因子。白介素-1受体拮抗剂(il-1ra)抑制il-1。(il-1由巨噬细胞产生,并是关键炎性细胞因子家族。)il-12p40是il-12的亚基,由其他细胞类型中的巨噬细胞产生并可以促进th1分化。血管内皮生长因子(vegf)促进血管形成。γ干扰素(mig,cxcl9)诱导的单因子是t细胞趋化因子。单核细胞趋化因子蛋白1(mcp-1,ccl2)吸引单核细胞、t细胞和树突状细胞。kc(cxcl1)由其他细胞类型中的巨噬细胞产生,并吸引骨髓细胞如嗜中性粒细胞。gm-csf中和后,还有几种其它人类和小鼠细胞因子降低的趋势。这表明,gm-csf在几种导致crs和nt的级联反应中发挥重要作用的细胞因子的下游活性中发挥作用。
car19治疗后5天的脑mri表明,与cart19+对照抗体相比,gm-csf中和降低了t1增强作用,这作为脑炎、血脑屏障破坏和可能水肿的量度。(使用lenzilumab和抗小鼠gm-csf抗体的)gm-csf中和后的mri图像与基线治疗前扫描相似,表明gm-csf中和有效消除了与cart19疗法相关的nt(图14a,14b)。在此患者源异种移植模型中使用人all胚细胞和人cart19,与cart19+同种型对照相比,cart19后的gm-csf中和可以将神经炎症降低59%(图14b)。这是一个重大发现,并且首次在体内证明了可以有效消除由cart19引起的nt。通过流式细胞术分析,在经过cart19疗法后,人cd3t细胞存在于大脑中,并且随着gm-csf中和,脑cd3t细胞有降低的趋势(图14c)。最后,与car-t疗法期间的同种型对照相比,在car-t细胞疗法期间接受gm-csf中和的小鼠大脑中观察到cd11b+明亮巨噬细胞(brightmacrophage)的降低趋势(图14d),间接表明gm-csf中和有助于降低大脑中的巨噬细胞。
实施例3-a
用于car19t源gm-csf的gm-csf基因kocart19细胞(gm-csfk/ocart19)和hgm-csf中和抗体(lenzilumab)联合疗法
lenzilumab(例如,10mg/kg或至多30mg/kg或1,800mg平剂量(flatdosing))与gm-csfk/ocart19细胞组合给予受试者。gm-csfk/ocar-t细胞在car-t细胞与肿瘤细胞接触/结合时有助于控制gm-csf释放。肿瘤部位gm-csf分泌的减少会导致全身测量中的炎性髓细胞活化和转运减少,mcp-1、il-6、ip10、kc、mip-1a、mip-1b、mig、vegf、il-1ra和il-12p40的水平降低。降低的细胞因子水平可以阻止或降低crs和nt的发生或严重度。lenzilumab的添加会确保从所有来源中和gm-csf,并有助于从肿瘤微环境中耗尽mdsc。lenzilumab的剂量可以以每两周的间隔重复,以确保mdsc的持续耗竭。gm-csfk/ocar-t细胞与lenzilumab的组合会导致联合疗法相对于对照组治疗处理的患者中响应率、无进展生存期和总生存期改善。联合疗法还会导致与car-t细胞疗法相关的毒性(包括crs和nt)的降低(或消除)。
实施例3-b
用于car19t源gm-csf的gm-csf基因kocart19细胞(gm-csfk/ocart19)和hgm-csf中和抗体(lenzilumab)联合疗法
lenzilumab(/600-1800mg)与gm-csfk/ocart19细胞组合给予受试者。
非霍奇金淋巴瘤癌症患者在疗法之前要进行预处理。他们i.v.注射抗hgm-csf抗体(600-1800mg),然后i.v.注射2×106个转导自体cd19cart细胞(gm-csfko)。在治疗后的特定时间,评价效果,例如,安全性、血液化学、神经学评价、疾病状态。该治疗处理可以每月重复,直到没有进一步的可检测癌症或癌症负荷显著减少为止。
实施例4
重组抗hgm-csf抗体lenzilumab降低中枢神经系统中的髓细胞浸润
如图17a中所示,在具有3级或更高等级神经毒性的人类患者中,cd14+细胞包含cns细胞群体的更大比例。与未采用的小鼠和仅采用cart19疗法治疗处理的小鼠相比,向用cart19疗法治疗处理的小鼠给予结合并中和人gm-csf的重组抗hgm-csf抗体(lenzilumab)证实cd14+细胞和cd11b+细胞所致的cns浸润降低,如图17b所示。使用了原生all小鼠模型,这如以下用于nt实验的详述。
crs/nt的原发性患者源all异种移植
类似于上述实验,小鼠ip注射30mg/kg白消安。第二天,它们接受了1-2×106个原发性胚细胞,这些胚细胞源自复发性难治性all患者的外周血。监测小鼠的移植4-6周,并且当cd19+细胞水平高(≥10个细胞/μl)时,它们接受cart19(2-5×106个细胞)并开始抗体疗法,共10天,这正如具体实验的细节中所示(如实施例2中所述)。每天对小鼠称重,以衡量其健康状况。在cart注射后5-6天进行小鼠的脑mri,并且在cart注射后4-11天进行尾静脉放血。使用azalyze分析脑mri图像。
实施例5
敲除t细胞中的gm-csf基因的基因编辑技术
各个小组正在寻求几种策略,以将基因编辑纳入用于治疗各种癌症的下一代嵌合抗原受体(car)t细胞的开发中。严重毒性(细胞因子释放综合征和神经毒性)与cart细胞疗法有关,并可能导致患者预后不良。毒性过程中的关键引发剂似乎是cart细胞源gm-csf。
基因编辑(例如,工程改造的核酸酶)可以用于t细胞中的kogm-csf基因和/或编码gm-csf基因表达必需蛋白的基因。适用于此类基因组编辑的核酸酶包括但不限于crispr相关(cas)核酸酶、锌指核酸酶(zfns)、转录激活子样效应子(tale)核酸酶和归巢核酸内切酶(hes),也称为兆核酸酶。
gm-csf的锌指核酸酶使用
使用锌指核酸酶(zfn)技术可以使cart细胞中的gm-csf基因失活。dna序列特异性核酸酶会切割gm-csf基因,而dna双链断裂修复会导致该基因失活。序列特异性核酸酶通过将序列特异性dna结合结构域(锌指)与fok1核酸内切酶结构域组合而产生。靶标核酸酶充当二聚体,并且使用两个不同的dna识别域提供位点特异性切割。fok1核酸内切酶的工程改造会确保形成异二聚体而不是同二聚体。因此,专一性异二聚体fok1-el变体会提供更高水平的特异性。
迄今为止,使用zfn技术的基因ko方法的临床经验是有限的。然而,在一项使用zfn技术敲除ccr5受体并将t细胞重新引入hiv病人中的小型安全性研究中,抗逆转录病毒药物治疗停止时,与未改变的t细胞相比,所经改变的t细胞具有明显的生存优势。
当达到双等位基因破坏时,观察到最佳效果。这表明达到最大%基因破坏率的ko技术可能是最有效的(singh2017,tebas2014)。在某些人细胞类型中,rad51的过度表达和丙戊酸治疗处理提高了双等位基因的靶向效率(takayama2017)。
人gm-csf基因的外显子1-4可以采用在所选靶区域内成对的zfn靶向。靶向接近dna序列内翻译起始密码子的潜在优势在于,这会确保基因敲除不会产生仍在合成的大蛋白片段。这种蛋白片段可能具有有害的生物学活性。
各种工具都可以用于识别特异性靶序列中潜在的锌指核酸酶(zfn)位点。这种工具的一个实例可以查阅以下网址:http://bindr.gdcb.iastate.edu/zifit/。在表达gm-csf的人细胞中测试了以此方式识别的用于zfn对表达的载体(适用于gm-csf基因ko),并通过细胞池内gm-csf生产的变化测量每对的基因破坏的有效性。选择出验证gm-csf水平最高降低的zfn对进行人类cart细胞内的测试。
例如,采用编码gm-csf特异性zfn对的复制缺陷型重组ad5病毒载体离体转导自体t细胞,导致gm-csf基因的改变。载体仅支持载体编码的基因的瞬时表达。这两个zfn结合到特异性发现于为gm-csf基因诱变所选的区域中(外显子1、2、3或4内)的复合bp序列。gm-csf特异性zfn的表达会诱导细胞dna中的双链断裂,该断裂会被细胞机制修复,导致所转导的细胞中随机序列插入或缺失。这些插入和缺失破坏了gm-csf编码序列,导致移码突变和蛋白表达终止。
t细胞生产/患者特异性样品
研究受试者经历10升白细胞去除术以收集>109个白细胞。两次采用一次性使用的封闭系统一次性装置,通过经由逆流离心淘析的单核细胞消耗和通过cd8+t细胞磁消耗,富集cd4+细胞的白细胞分离术产品。所得的富集cd4+t细胞采用抗cd3/抗cd28mab包被顺磁珠进行激活,并用编码cart的载体和编码zfn的载体进行转导。然后将细胞扩增并在封闭系统中培养。在转移到wave生物反应器中进行灌注条件下的额外扩增后,t细胞扩增继续进行。在培养期结束时,细胞耗尽磁珠,洗涤,浓缩并冷冻保存。
原代t细胞也可以用其他试剂,例如,丙戊酸进行处理以便提高zfn的双等位基因靶向效率。
公认的靶向序列
外显子1
外显子2
设计外显子3
外显子4
talens
使用活化子样效应子核酸酶(talens)还可以使t细胞中的gm-csf基因失活。talens与zfn类似,是因为它们包含与序列特异性dna结合结构域融合的fok1核酸酶结构域。然后,靶标核酸酶在该dna中会制造双链断裂,易错性修复会产生突变靶基因。采用使用结合位点中对于各碱基的dna结合tale(转录激活因子样效应子)重复结构域的简单蛋白-dna代码可以轻松设计出talens。talen的强大功能意味着基因组编辑是一个可靠而容易的过程(reyond.,etal.,2012natbiotechnol.2012may;30(5):460-5.doi:10.1038/nbt.2170,其通过引用以其整体结合于本文中)。
举例而言,人gm-csf基因外显子1内的一些tale靶序列为:
人gm-csf基因外显子4中的tale靶序列的实例:
原代t细胞中crisprcas-9介导的gm-csf基因ko
crispr(成簇规则间隔的短回文重复)、cas-9系统由cas9、rna导向核酸酶和短向导rna(grna)组成,有助于位点特异性dna断裂的产生,这种位点特异性dna断裂由细胞内源性机制进行修复。cas9/grnarnp向原代人t细胞的递送会导致高效靶基因改变。gm-csf基因敲除的crispr/cas9介导方法由详细规程进行描述,参见oh,s.a.,seki,a.,&rutz,s.(2018)currentprotocolsinimmunology,124,e69.doi:l0.1002/cpim.69,和sekiandrutz,jexp.med.2018vol.215no.3985-997,其每一个均通过引用以其整体结合于本文中。
据报道基因ko致gm-csf失活可以降低细胞因子释放综合征和神经毒性,并改善cart治疗的肿瘤异种移植小鼠的抗肿瘤活性(正如sternerrmetal.,2018blood20l8:blood-20l8-10-88l722;doi:https://doi.org/10.1182/blood-2018-10-881722所述),其通过引用以其整体结合于本文中。
靶向外显子1或2或3或4的crispr方法致gm-csf基因失活
多个、例如3个靶向gm-csf基因内3个不同序列的cas9构建体可以使用,以确保所有样品中的有效基因失活。(与其他基因编辑方法相比,这使用crispr轻松完成。)
使用cas9报道了双等位基因ko的高频率(正如zhang,y.,etal.,methods.2014年9月;69(2):171-178.doi:10.1016/j.ymeth.2014.05.003中所述,其通过引用以其整体结合于本文中。这种双频等位基因ko高频率会提供可能的优势。
cart细胞中gm-csfko的其他基因沉默技术
其它可以用于基因沉默的方法对于本领域普通技术人员而言是众所周知的,并可以包括但不限于也称为兆核酸酶的归巢核酸内切酶(he),rna干扰(rnai),短干扰rns(sirna),dna导向的rna干扰(ddrnai)。
car-t细胞中gm-csf基因ko与非cart源gm-csf的中和抗体的组合。
患者中所有gm-csf的去除/中和需要与cart细胞中的gm-csf基因ko组合使用的抗gm-csf抗体、抗受体抗体或可溶性受体-fc融合物。所给予的cart细胞包括但不限于gm-csfk/ocart细胞。在一个实施方式中,所给予的gm-csfk/ocart细胞是gm-csfk/ocart19。
抗gm-csf中和抗体在该联合疗法中给予包括但不限于lenzilumab。lenzilumab是一种新型高亲和重组人中和抗hgm-csf抗体。在非人灵长类动物中的研究表明,当甚至以高达>100mg/kg/wk反复剂量给予长达6个星期,该抗体也是安全的。当重复剂量给予(7剂400mg/剂,严重哮喘患者24周)时,该抗体对人也是安全的。该抗体可以与gm-csfkocart细胞疗法联组合用于癌症患者中以提供对人gm-csf的完全中和。癌症患者i.v.剂量给予抗hgm-csf抗体(600-1800mg),然后是2×106个cart细胞(gm-csfko)。在治疗处理后的特定时间评价效果,例如,安全性,血液化学,神经学评价,疾病状态。该治疗处理可以每月或每月3次重复,并可以导致疾病缓解和无进展生存期改善。
gm-csf也可以使用抗人gm-csf受体α(rα)抗体进行中和(正如minter,rr,etal.2012doi:10.1111/j.1476-5381.2012.02173.x中所述)。癌症患者i.v.剂量给予抗hgm-csf受体抗体(70-700mg),接着2×106个cart细胞(gm-csfko)。在治疗处理后的特定时间评价效果,例如,安全性、血液化学、神经学评价、疾病状态。治疗处理导致疾病缓解和无进展生存期改善。该治疗处理可以每月重复,直到没有进一步的可检测的癌症或癌症负荷显著减少为止。
其他实施方式
应当理解的是,尽管已经结合本发明的详细描述描述了本发明,但前述描述旨在举例说明而非限制本发明的范围,本发明的范围由所附权利要求的范围进行限定。其他方面、优点和修改都处于所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!