用于扩增人或动物循环肿瘤细胞的动物模型
本发明涉及能够扩增人或动物循环肿瘤细胞(ctc)的禽模型。
背景技术:
ctc是从肿瘤中分离的细胞,在加入血管系统后,其能够被置换进入血液。因此,这些细胞可以迁移到其他器官并参与转移的发展。因此,这些细胞代表了一个非常有吸引力的靶标,用于监测癌症的演变和治疗,甚至发现新的疗法。
然而,ctc的分离并不是一件容易的事情,因为这些细胞数量很少。因此,有必要在能够研究它们之前使其扩增。目前,可以在鼠模型中使用体外或体内培养物扩增ctc(kowalika等人,2017;drapkinb.j.等人,2018)。已经生成了来自多种癌症(肺癌、前列腺癌、乳腺癌、泌尿道癌、头癌或颈癌等)的ctc体外培养物,使得能够进行治疗方案的高速临床前测试,但是收效有限,因为这些培养物的时间太长,无法与临床实践相容,并且使ctc暴露于表型修饰(pantelk,alix-panabièresc.,2016)。
此外,在鼠模型中建立了来自ctc的短期体内培养,并且在ctc的量过低时在体外扩增的第一步骤后进行(giulianom等人,2015;williamses等人,2015;torphyrj等人,2014;rossie等人,2013)。也考虑了在免疫缺陷小鼠中直接接种ctc作为扩增分离的ctc的方法。在高度转移性小细胞肺癌(cppc)中,从具有高水平ctc(每7.5ml血液>400ctc)的患者中分离的ctc在小鼠体内形成肿瘤,该肿瘤对铂和依托泊苷化疗的反应对应于临床观察(hodgkinson,c.l.等人,2014)。这些研究为使用免疫缺陷小鼠作为ctc的“孵育器”开辟了道路,能够生成适应患者个体肿瘤的临床前模型。
然而,这些模型太昂贵而无法设想系统地使用它们。它们通常需要进行具有上述缺点的体外扩增的预先步骤。最后,这些模型的建立需要时间,这并不总是与预期效果的观察相一致。
因此,需要找到一种更便宜的体内模型,这样的模型还可以更快地给出结果,特别是不需要预先的体外扩增阶段,以研究这些最接近患者体内存在的ctc。
技术实现要素:
本发明涉及一种用于研究循环肿瘤细胞的动物模型,其由含胚鸟卵构成,优选由含胚鸡卵构成,所述动物模型包含从患有癌症的患者或动物的样本中分离的人或动物循环肿瘤细胞(ctc),所述ctc被移植在含胚卵的绒毛尿囊膜(cam)水平,在移植时所述含胚卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段。
该含胚卵是用于扩增ctc的动物模型,更具体地是禽模型。其还使得可以研究不同试剂对肿瘤发生的作用,以选择具有抗癌活性并因此可代表有效疗法的那些试剂,特别是用于治疗患者或动物,在含胚卵中移植的ctc源自所述患者或动物。然后这使得可以向患者施用预先在他或她自己的肿瘤细胞上测试过的治疗剂;从而导致个体化治疗。
本发明还涉及一种制备这种含胚鸟卵模型的方法,使得能够扩增源自患有癌症的患者或动物的样本的人或动物循环肿瘤细胞(ctc),所述方法包括在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从所述样本中分离的ctc,所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段。
本发明的主旨还涉及一种扩增从患有癌症的患者或动物的样本中分离的人或动物循环肿瘤细胞(ctc)的方法,所述方法包括以下步骤:
a)通过在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从患有癌症的患者或动物的样本中分离的ctc,制备根据本发明的含胚卵模型,所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
b)收集从扩增的ctc发展而成的肿瘤,和任选地
c)从步骤b)收集的肿瘤中回收ctc。
优选地,可以在该方法的范围内进行几轮移植,有利地进行两轮移植,以进一步优化ctc的扩增。因此,其包括在第二含胚卵的cam上进行肿瘤的第二次移植,所述肿瘤源自在第一含胚卵的cam上进行的ctc的第一次移植。
本发明还涉及一种用于确定患有癌症的患者或动物对一种或多种治疗剂的敏感性的方法,其特征在于所述方法包括:
-通过在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从患有癌症的患者或动物的样本中分离的ctc,扩增根据本发明的源自所述患有癌症的患者或动物的样本的循环肿瘤细胞(ctc),所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
-在新的含胚鸟卵的绒毛尿囊膜(cam)水平上移植在胚胎中发展而成的肿瘤,所述新的含胚鸟卵预先孵育到与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
-在移植后至少12小时在含胚卵中施用治疗剂,
-研究由此施用的治疗剂对在新的移植的含胚卵中发展而成的肿瘤的肿瘤发生的作用。
优选地,用于确定患有癌症的患者或动物对一种或多种治疗剂的敏感性的该方法进一步包括,在施用所述试剂之后,孵育移植的含胚卵至少1小时,以及任选地在所述新的移植的含胚卵孵育结束时收集从移植的ctc发展而成的肿瘤的步骤。
本发明的主旨还包括一种监测患有癌症的患者或动物的方法,所述方法包括:
-如上所述使用ctc制备第一含胚鸟卵,所述ctc是从所述患者或动物在时间t1的样本中分离的,以及研究在该第一含胚卵中发展而成的肿瘤的肿瘤发生,
-如上所述使用ctc制备第二含胚鸟卵,所述ctc是从相同患者或动物在时间t2的样本中分离的,以及研究在该第二含胚卵中发展而成的肿瘤的肿瘤发生,
-比较在第一和第二含胚卵中发展而成的肿瘤的肿瘤发生。
最后,本发明的主旨涉及一种筛选旨在用于体内治疗癌症的治疗剂的方法,所述方法包括:
-根据如上所述的方法,通过在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从患有癌症的患者或动物的样本中分离的ctc,制备含胚卵模型,所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
-在移植后至少12小时在含胚卵中施用一种或多种候选试剂,
-研究由此施用的治疗剂对移植的含胚卵中发展而成的肿瘤的肿瘤发生的作用。
附图说明
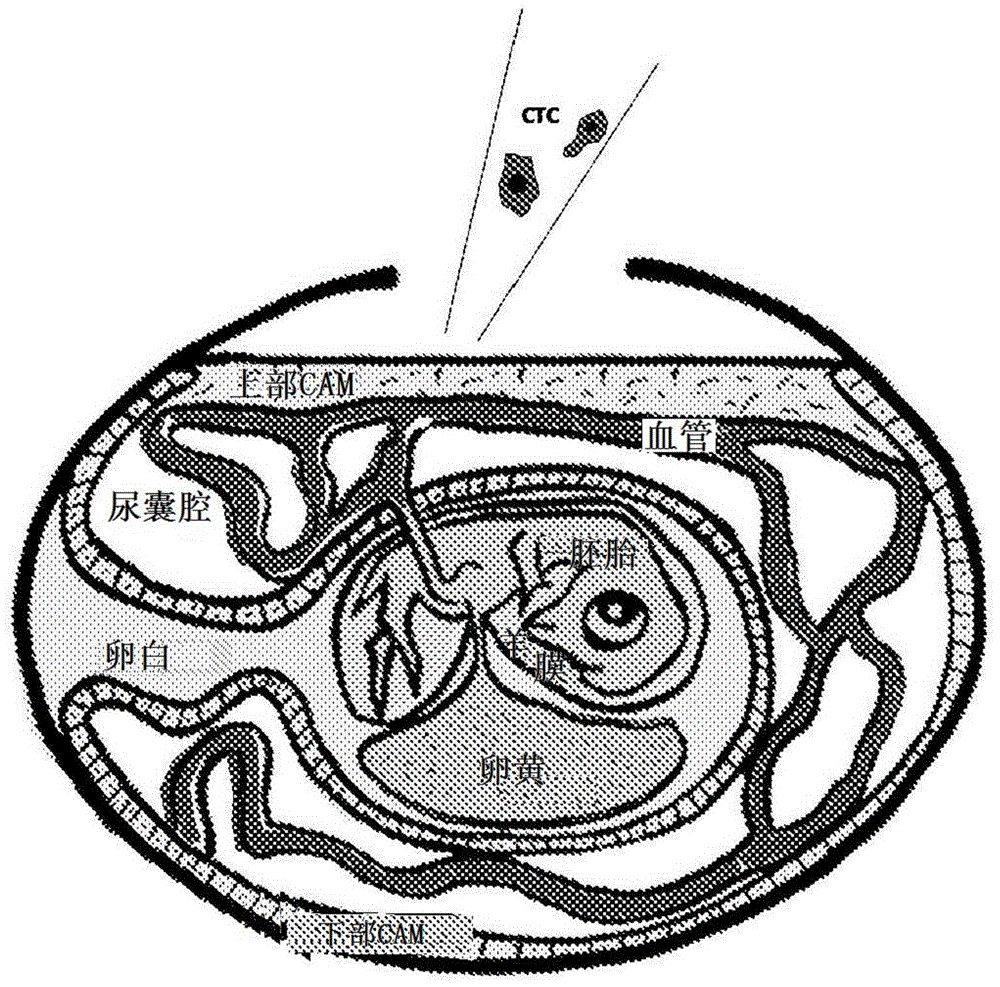
图1表示含胚卵模型的示意图,其中ctc移植位点在上部cam。
图2表示用于实施本发明的可能的实验方案:
第一轮移植(第一组卵):从患者收集的样本中分离的ctc按照一位患者一个卵被移植到卵中。第二轮移植(第二组卵):第二次移植使得能够重新扩增移植后卵中收集的肿瘤。
图3表示在第一轮ctc扩增时,通过在cam上的异种移植获得的肿瘤生长的卵内图像,所述ctc从患有肺癌、乳腺癌或前列腺癌的患者的血液中分离。
图4表示源自第一轮扩增时cam上移植的ctc的肿瘤的组织学切片,所述ctc分离自患有乳腺癌的患者的血液。
图5表示源自在第一轮扩增时cam上移植的ctc的肿瘤上人肿瘤标记物tp53(a)和kras(b)的遗传分析结果,所述ctc为患有肺癌的患者的ctc(#sh103和#cm105)。
图6表示源自在第二轮扩增时(第二次移植)cam上移植的ctc的肿瘤生长的卵内图像,所述ctc分离自患有肺癌的患者的血液。
图7表示在第一次(a)和第二次(b)移植后,从ctc获得的肿瘤的卵内图像,所述ctc从患有前列腺癌的患者的血液中分离,以及肿瘤切片的组织学分析(c),证明了第二次移植后卵内移植的ctc的扩增。
具体实施方式
本发明涉及一种用于研究循环肿瘤细胞的动物模型,特别是禽模型,其由含胚鸟卵构成,其包含从患有癌症的患者或动物的样本中分离的人或动物循环肿瘤细胞(ctc),所述ctc被移植在含胚卵的绒毛尿囊膜(cam)水平,在移植时所述含胚卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段。
优选地,根据本发明的含胚卵是鸡形目(galliformes)或鸵形目(struthioniformes)的鸟卵。特别地,特别优选地卵是鸡类(gallinacés)的卵,特别是鸡、鹌鹑、火鸡、雉鸡、孔雀、珍珠鸡或其他农场鸟的卵。它也可能是鸵鸟卵。有利地,根据本发明的含胚卵是鸡(gallusgallus)卵。
在本发明的范围内,术语“含胚卵”是指受精的鸟卵,其中胚胎可以在合适的条件下发育,特别是在温度为37℃至38℃的孵育器中发育。在这些条件下,鸡卵孵化结束所需的孵育时间为21天。
本文教导的发育阶段被定义为受精后卵的孵育时间的函数,特别是在如上文所定义的合适条件下的孵育时间。“cam水平上的移植”是指通过在cam上附着或注射施用,无论是在上部cam还是在下部cam上。
根据本发明的含胚卵模型具有源自两种不同生物体或异种移植物的细胞:“宿主”或“接受者”鸟的细胞,以及移植到卵中的ctc,所述ctc源自与“接受者”鸟不同物种的人或动物生物体。在特别优选的方式中,移植到含胚鸟卵中的ctc是人细胞。然后这些移植的ctc将在胚胎中发育,同时形成一个或多个实体瘤和/或在卵中移位。
根据定义,“在cam水平上的移植”发生在cam形成后,并且处于相当于鸡在正常和标准生长条件下至少发育8天的阶段。如果使用的鸟是鸡,这个阶段对应于至少发育8天。不同物种之间的发育天数会有所不同,移植可在不同的发育天数之后进行。例如,鸡的至少8天的发育阶段对应于鹌鹑的至少6.5天的发育阶段。
“患有癌症的患者或动物的样本”应理解为意指任何源自患有癌症的人或动物并含有ctc的样本。优选地,所述样本选自能够含有ctc的全血或生物流体,例如胸腔积液、腹水和脑脊液(lcr),优选全血。因此,移植到含胚卵中的ctc可能来自血液或此类流体中产生ctc的任何类型癌症(尤其是转移性癌症)。根据本发明的一个优选实施方案,移植到含胚卵中的ctc从患者或动物分离,所述患者或动物患有至少一种选自肺癌、前列腺癌、乳腺癌、结直肠癌的癌症。
有利地,根据本发明的含胚卵模型是鸡卵,其中在cam水平上并且在至少发育8天之后移植了人ctc。
应当理解,根据本发明的移植胚胎不具有孵化的任务,因此并不旨在产生成体生物体。正是由于这个原因,根据本发明的移植胚胎是一种旨在在其扩增期间接受ctc的模型,而不扩展到孵化,孵化对应于鸡发育的21天。无论如何,根据本发明的鸟胚胎在孵化之前以及移植的ctc将导致卵中发展成一个或多个肿瘤之后,将根据现行的伦理规则被处死。
这种模型使得能够在同一时间扩增ctc,特别是通过从这些ctc发展成肿瘤,在其上可以测试不同试剂的抗癌活性,这些试剂或者已知具有这样的活性,或者是候选,以确定其是否有这样的活性。还可以测试几种治疗剂的比较功效,以确定用于治疗移植的ctc所来源的患者的最有前景的疗法。
根据第二方面,本发明涉及一种制备上述含胚鸟卵模型的方法,使得能够扩增分离自患有癌症的患者或动物的样本的人或动物循环肿瘤细胞(ctc),所述方法包括在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从所述样本中分离的ctc,所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段。
本领域技术人员将知道如何确定进行ctc移植的时间,该时间取决于所用的鸟物种,即含胚卵孵育到或发育到cam形成并且处于相当于鸡中至少发育8天的发育阶段的最少天数。例如,在鸡中,可从发育8天后进行移植,而在鹌鹑中,则可从发育6.5天后进行移植。
根据一个优选的实施方案,在移植之前,含胚卵已经孵育到与cam形成相对应并且相当于鸡中至少发育9天或甚至更优选地至少发育9.5天的发育阶段。
在合适的条件下进行孵育,即在能够使含胚卵正常发育的条件下进行孵育,特别是在37℃至39℃之间的温度下,优选在38℃下,或甚至更优选在38.5℃下。
可以在cam的任何位置进行ctc的移植,在上部或下部,优选在上部cam的水平上进行移植。本领域技术人员熟知的任何方法都可以用于这种移植,特别是可以使用crespop.&casarb,2016引用的移植技术。
根据一个具体的实施方案,移植的ctc的量从大约5到大约5000ctc,在优选的方式中,从大约5到大约2500ctc,并且在甚至更优选的方式中,从大约5到大约1000ctc。
根据一个优选的实施方案,在从患有癌症的患者或动物的样本中分离所使用的ctc之后,并且在移植到含胚卵中之前,冷冻所使用的ctc。
对于在cam水平上的移植,通过本领域技术人员熟知的任何一种方法从患有癌症的患者或动物的样本中分离ctc。因此,通过从样本中存在的其他细胞中纯化来分离ctc,所述样本源自患有癌症的患者或动物,特别是通过从样本中存在的免疫细胞中分离来分离ctc。
分离ctc的方法可能基于不同的原理,这些原理可以将它们与样本的其他组分分离,从而进行ctc富集。zheyushen等人,2017特别描述了许多不同的方法。当目标是捕获非靶向细胞并洗脱ctc时,其可能以所谓的“阴性”富集的形式结束,或者当目标是捕获样本中的ctc并洗脱非靶向细胞时,其为所谓的“阳性”富集。
在这些方法中,可以列举通过过滤的分离方法,特别是通过垂直过滤的分离方法,例如由rarecellssas公司出售并特别地由hanweihou等人,2013描述的iset(根据肿瘤细胞大小的分离)技术。
某些方法可依赖于标记步骤,例如cellsearch方法(kaganm等人,2002年),该方法基于使用铁磁流体纳米粒子与靶向特定上皮细胞粘附标记物(epcam)的抗体对ctc进行免疫选择。因此,从其他血细胞的主要部分中磁性分离ctc。
也可以使用基于使用微流体系统的其他方法,这些方法依赖于取决于不同参数(例如细胞的大小、形状、密度、变形能力)的分离。其中可以特别引用vtx-1方法(例如sollier-christen等人,2018所描述的);基于使用包被抗epcam抗体的微点捕获表达epcam分子的肿瘤细胞的微流体方法(ctc-芯片)(其特别地在nagraths等人,2007中描述了);stemcells公司的rosettesep技术,其使用与磁珠偶联的抗体(cd45、cd66b和血型糖蛋白a)的混合物;由biolidics公司(前身为clearbridge)开发的靶向红细胞和白细胞或者替代的clearcellfx1方法,其特别地描述在lagets等人,2017中,其是特别有利的。
根据一个具体的实施方案,根据本发明的制备含胚鸟卵模型的方法进一步包括,孵育移植后的含胚卵至少12小时的步骤,优选孵育至少24小时,在甚至更优选的方式中,在移植后并且在使用前孵育至少48小时。优选地,参照鸡胚胎的发育阶段,移植后的含胚卵最多孵育20天,特别是最多孵育18天。
根据第三方面,本发明涉及一种扩增从患有癌症的患者或动物的样本中分离的人或动物循环肿瘤细胞(ctc)的方法,所述方法包括以下步骤:
a)如上所述,在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从患有癌症的患者或动物的样本中分离的ctc,所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
b)收集从扩增的ctc发展而成的肿瘤,以及任选地
c)从步骤b)收集的肿瘤中回收ctc。
发明人已经以令人惊讶的方式证明,ctc,特别是人来源的ctc可以在含胚鸟卵模型中扩增,这使得能够获得足够数量的这些ctc来研究它们,而且还可以使用它们来引导鉴定新的治疗或选择有望以个体化方式最有效的治疗。
根据上述用于扩增人或动物循环肿瘤细胞(ctc)的方法的优选实施方案,可以再次移植ctc,所述ctc将通过进行例如几轮移植和收集(术语第二次移植用于两轮移植)而被扩增,这样做是为了进一步提高ctc的扩增。因此,该方法可以包括以下步骤:
a)在含胚鸟卵的绒毛尿囊膜(cam)水平上移植从患有癌症的患者或动物的样本中分离的ctc,所述含胚鸟卵处于与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
b)收集从扩增的ctc发展而成的肿瘤,
b1)在第二含胚鸟卵的绒毛尿囊膜(cam)水平上移植在步骤b)中收集的肿瘤,所述第二含胚鸟卵预先孵育到与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
b2)任选地,孵育由此移植的该第二含胚卵至少12小时,
b3)收集从步骤b1)移植的肿瘤发展而成的肿瘤,和任选地,
c)从步骤b3)收集的肿瘤中回收ctc。
根据一个具体的实施方案,上述用于扩增人或动物循环肿瘤细胞(ctc)的方法进一步包括孵育移植后的含胚卵至少12小时的步骤,优选孵育至少24小时,在甚至更优选的方式中,在移植后并且在收集源自移植的ctc的肿瘤之前,孵育至少48小时。优选地,参照鸡胚胎的发育阶段,移植后的含胚卵最多孵育20天,特别是最多孵育18天。
本发明因此还涉及一种用于确定患有癌症的患者或动物对一种或多种治疗剂的敏感性的方法,其特征在于所述方法包括:
-如上所述,在含胚鸟卵中扩增从患有癌症的患者或动物的样本中分离的ctc,
-在新的含胚鸟卵的绒毛尿囊膜(cam)水平上移植由此收集的肿瘤,所述新的含胚鸟卵预先孵育到与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
-在移植后至少12小时在含胚卵中施用治疗剂,
-研究由此施用的治疗剂对在新的移植的含胚卵中发展而成的肿瘤的肿瘤发生的作用。
“治疗剂”是指具有抗肿瘤作用的任何化学或生物分子或化合物、纳米结构、物理方法或它们的组合,其特别对治疗从移植到含胚卵中的肿瘤性细胞发展而成的癌症类型具有潜在的疗效。
此类化合物可以是化学分子,如化疗剂;生物化合物,如抗体;治疗细胞,如cart;物理剂,如辐射;嵌入剂,如伊立替康;酪氨酸激酶的信号通路抑制剂,如舒尼替尼;抗激素剂,如他莫昔芬;免疫调节剂,如ketruda;膜受体抑制剂,如曲妥珠单抗等。
在本发明的范围内,术语肿瘤和癌症被无差别地使用,并且具有相同的含义,以定义恶性细胞的增殖。抗肿瘤和抗癌这两个术语的使用也是如此。
特别是,由于移植的ctc是从患有癌症的患者或动物的样本中分离,因此事实在于测试几种治疗剂使得能够选择最有希望治疗该患者的肿瘤的治疗剂。因此,根据本发明的优选实施方案,使用移植了ctc的含胚鸟卵来确定在所测试的不同试剂中具有最佳抗癌活性的试剂。
根据本发明,也可以使用移植有ctc的含胚鸟卵来测试与单独测试的每种试剂所获得的效果相比的治疗剂组合的抗癌功效。
在使用这种含胚卵的范围内,还可以确定、或甚至定量所测试的治疗剂的毒性,所述毒性是对移植的ctc发展而成的肿瘤的毒性,以及对整个胚胎的毒性。因此,本发明的另一个主旨涉及移植有ctc的含胚鸟卵在定量一种或多种治疗剂对肿瘤和/或对整个胚胎的毒性中的用途,所述ctc从患有癌症的患者或动物的样本中分离。
可以通过本领域技术人员熟知的技术以不同方式进行在含胚卵中施用治疗剂的步骤。尤其可以通过在cam水平上的附着或注射、通过肿瘤内注射、通过注射到卵的胚胎或胚胎外结构中来进行施用。
在ctc移植后至少12小时,优选至少24小时,或在甚至更优选的方式中,在移植后至少48小时,即移植后1至2天进行治疗剂的施用。还可以根据持续时间和施用次数方面的不同方案施用治疗剂,例如每两天、或每天、或一天两次、或单次注射,并且这最多到孵育卵的最后一天。这些选择将根据所施用的试剂来确定。
根据一个优选的实施方案,根据本发明用于确定患有癌症的患者或动物对一种或多种治疗剂的敏感性的方法,进一步包括,在将治疗剂施用到移植的含胚卵中之后,在研究对肿瘤发生的作用之前,孵育移植后的含胚卵至少1小时。有利地,在施用后进行孵育至少4天且至多12天,以对应于最多21天的胚胎发育阶段,有利地为18天的发育。根据一个具体的实施方案,根据本发明的用于确定患有癌症的患者或动物对一种或多种治疗剂的敏感性的方法进一步包括,在施用已经施用的治疗剂之后,在所述含胚卵的孵育结束时,收集从移植的ctc发展而成的肿瘤(特别是通过显微解剖)。可以采用几种互补的方法研究由此施用的治疗剂对肿瘤发生的作用,特别是在收集在移植的含胚卵中发展而成的肿瘤之后。它尤其可以包括对参数的分析,所述参数例如肿瘤生长、转移侵袭、血管生成、新生血管生成、炎症和/或肿瘤免疫浸润、对肿瘤和/或对整个胚胎的毒性。
因此,可以对肿瘤进行分析以测量和/或分析这些不同的参数,例如用于研究肿瘤生长的肿瘤重量和/或体积、用于研究转移侵袭的不同特异性标记物的表达,例如通过定量pcr对人转移的alu序列的扩增、用于血管生成和新生血管生成的肿瘤中的血管数量、用于炎症的白介素定量和/或标记物(例如,cd3、cd8、cd4、cd45和cd56)的定量(特别是通过rtqpcr),以评估肿瘤免疫浸润、重量和组织学分析,以评估对肿瘤的毒性。
转移侵袭的研究可以在下部cam上进行,其容易获得,但也可以在胚胎内的任何靶器官中进行,特别是根据癌症类型和相关转移现象的已知数据。
炎症和/或肿瘤免疫浸润尤其可以通过分析不同标记物的表达进行研究,所述标记物例如cd3(t淋巴细胞膜标记物)、cd4(调节性t淋巴细胞、单核细胞和巨噬细胞膜标记物)、cd8(细胞毒性t淋巴细胞标记物)、cd45(白细胞膜标记物)、cd56(nk细胞标记物)等。将能够开发这些标记物的特异性寡核苷酸对,以避免物种之间的交叉增殖。
通过扩展,还可以监测转移位点的炎症和免疫系统的细胞浸润。
本领域技术人员熟知的所有这些因素的组合分析使得能够确定患有癌症的患者或动物对胚胎中施用的治疗剂的敏感性,其中移植的ctc来自这些患有癌症的患者或动物。尤其是,这些参数形成了决策树的组成部分,临床医生使用所述决策树来决定对癌症患者采用的治疗管理。
在包括治疗剂对肿瘤发生的作用的根据本发明的所有方法的范围内,这些参数优先通过以下评估:比较在移植后的含胚卵中施用治疗剂后的参数、与根据相同方法预先移植相同ctc、但没有施用治疗剂的相同鸟的另一含胚卵中确定的那些参数。类似地,当研究几种治疗剂的作用时,优先通过以下评估所述作用:比较在移植后的含胚卵中施用治疗剂组合后的参数、与根据相同方法预先移植相同ctc、但在其中单独施用了治疗剂的相同鸟的一个或多个其他含胚卵中确定的那些参数。
根据另一方面,本发明还涉及一种用于监测患有癌症的患者或动物的方法,所述方法包括:
-如上所述使用ctc制备第一含胚鸟卵,所述ctc是从所述患者或动物在时间t1的样本中分离的,以及研究在该第一含胚卵中发展而成的肿瘤的肿瘤发生,
-如上所述使用ctc制备第二含胚鸟卵,所述ctc是从相同患者或动物在时间t2的样本中分离的,以及研究在该第二含胚卵中发展而成的肿瘤的肿瘤发生,
-比较在第一和第二含胚卵中发展而成的肿瘤的肿瘤发生。
本发明的主旨还涉及一种筛选旨在用于体内治疗癌症的治疗剂的方法,所述方法包括:
-在含胚鸟卵的cam水平上移植从患有癌症的患者或动物的样本中分离的循环肿瘤细胞,所述含胚鸟卵预先孵育到与cam形成相对应并且相当于鸡中至少发育8天的发育阶段,
-在移植后至少12小时在含胚卵中施用一种或多种候选试剂,
-研究由此施用的治疗剂对移植的含胚卵中发展而成的肿瘤的肿瘤发生的作用。
“候选治疗剂”是指如上文所定义的化学或生物治疗剂,并且能够具有抗癌活性,特别是对治疗从移植到含胚卵中的肿瘤性细胞发展而成的癌症类型具有潜在的疗效。根据本发明的筛选方法使得能够确定候选治疗剂是否具有抗癌活性,以及其是否具有抗转移活性。
上述在不同方法范围内的所有优选和精确的实施方案也适用于根据本发明的监测和筛选方法。
实施例
以下通过使用含胚鸡卵扩增人ctc来说明本发明。
ctc的制备
根据iset方法(hanweihou等人,2013)的细胞大小、或根据clearcell方法(lagets等人,2017)的微流体系统,通过过滤从处于转移阶段的患有肺癌、乳腺癌或前列腺癌患者的血液样本分离含胚卵中移植的ctc。将由此获得的ctc冷冻保存,并在移植前解冻。
诱导肿瘤δ
白来航(leghornblanche)母鸡的受精卵在37.5℃和40%的相对湿度下平放孵育9至10天。在这个孵育期(e9或e10)之后,卵就准备好接受移植了。打开卵,同时保持cam的完整性,该完整性将通过在外壳上打一个小孔来降低。然后在cam上方切割约1cm2的窗口。通过附着到cam上,移植ctc(5到2500个细胞),然后再次在37.5℃和40%湿度下孵育卵。移植后,在上部cam上发展成卵内肿瘤。最少每48小时观察一次卵以监测其发育。
图1显示了含胚卵的示意图,其中ctc移植位点在上部cam上。实验方案的一个例子如图2所示。
在发育的第18天(e18),cam的上部被移除,在磷酸盐缓冲液中洗涤,然后直接转移到多聚甲醛(pfa)中固定48小时。接下来从正常的cam组织中仔细提取肿瘤。
接下来分析收集的肿瘤,特别是:
-称重以研究肿瘤生长(图2,第一轮);
-用于组织学或遗传分析(例如转移)(图2,第一轮);
-用于在发育第9天的新一批含胚卵中进行第二次移植,以进行扩增(图2,第二轮)。该步骤可以根据需要重复多次(具有定期的表型对照)。
第二次移植
移植的ctc生长9天后,收集已发展成的肿瘤并准备进行第二次移植。将肿瘤切成小块,将每一块移植到新卵的cam中,以获得ctc的强扩增。
转移分析
转移的分析可以在下部cam的一部分(与移植位点相对)上或在收集的胚胎组织上进行,胚胎组织与肿瘤是同时收集的,并以合适的方式储存。提取总基因组dna后,可以通过qpcr、使用人alu序列(在人中具有良好保守性的多拷贝序列)特异性的引物来检测这些样本中的人细胞。
结果
上述实验设计应用于从患有肺癌的患者血液中分离的ctc(#da106、#da107、#pa108、#cb110、#pc111、#vm109、#sh103、#cm105)、从患有乳腺癌的患者血液中分离的ctc(#ps234、#ss226、#ur227、#lp229)、从患有前列腺癌的患者血液中分离的ctc(#pt319、#bg320)。
在cam上9天后(e18),成功将患者ctc的所有样本均移植到cam上,并出现了肿瘤的发展。在图3中显示组合在一起的第一轮扩增后肿瘤生长的卵内图像。
通过苏木精/曙红染色对第一轮扩增收集的肿瘤进行组织学分析,这些肿瘤源自从患有乳腺癌的患者血液中分离的、然后移植到上部cam上的ctc(#ps234)。
结果在图4中组合在一起,显示了恶性肿瘤增殖的存在。
最后,根据2017年yohes&thyagarajanb的综述中引用的“下一代测序”(ngs)方法,通过高速测序进行基因突变分析,其中基因组dna上的人肿瘤标记物tp53(mogia&kuwanoh2011)和kras(gouly等人,2015)从第一轮扩增时收集的肿瘤中提取,并源自从患有肺癌的患者血液中分离的ctc。根据thermofisher销售的genejetffpedna纯化试剂盒的方法进行dna的提取。
结果在图5中组合在一起,该图显示了在源自患有肺癌患者的第一次ctc移植的两种不同肿瘤中(#sh103和#cm105),存在人肿瘤标记物tp53(图5a)和kras(图5b)突变。
在e18时,收集第一次移植的肿瘤(其源自患有肺癌患者血液中分离的ctc),切碎,然后再次移植到第二组含胚卵的cam上。在第二轮扩增后在e18收集的肿瘤生长的卵内图像在图6中组合在一起(a和b对应于源自两个不同第二次移植的cam上的肿瘤的卵内图像)。
在e18时,收集第一次移植的肿瘤(其源自患有前列腺癌患者血液中分离的ctc)(clearcellfx1微流体方法),切碎,然后再次移植到第二组含胚卵的cam上。在图7中显示组合在一起的肿瘤生长的卵内图像。图像a代表在第一次移植后从ctc获得的卵内肿瘤。箭头显示了肿瘤发展的两个位点。图像b对应于源自第二次移植的cam上的卵内肿瘤,由a中所示的肿瘤产生。图像c对应于b中表示的肿瘤切片的组织学分析,一方面显示cam的组织,另一方面显示肿瘤组织。
结论
上述结果表明,与现有技术的鼠模型相比,使用禽含胚卵模型使得能够以更快和更便宜的方式对从患者样本中分离的ctc进行卵内扩增。因此,本发明使得能够快速构建ctc生物库,其接下来可用于抗癌疗法的功效测试,用于监测和筛选能够产生有效和个性化治疗的新试剂。
参考文献
kowalikaetal.currentapproachesforavoidingthelimitationsofcirculatingtumorcellsdetectionmethodsandtreatmentofpatientswithsolidtumors.translationalres.2017.areviewarticle,vol185:58-84;
drapkinb.j.etal.genomicandfunctionalfidelityofsmallcelllungcancerpatient-derivedxenografts.cancerdiscov.2018may;8(5):600-615.
pantelk,alix-panabièresc.functionalstudiesonviablecirculatingtumorcells,clinchem,2016feb;62(2):328-34,
giulianom,herreras,christinyp,shawc,creightoncj,mitchellt,bhatr,zhangx,maos,dobroleckile,al-rawia,chenf,venezianibm,zhangxh,hilsenbecksg,contrerasa,gutierrezc,jeselsohnrm,rimawimf,osborneck,lewismt,schiffr,trivedimv.circulatinganddisseminatedtumorcellsfrombreastcancerpatient-derivedxenograft-bearingmiceasanovelmodeltostudymetastasis,breastcancerres.2015jan9;17:3.
williamses,rodriquez-bravov,chippada-venkatau,delaiglesia-vicentej,gongy,galskym,ohw,cordon-cardoc,domingo-domenechj.generationofprostatecancerpatientderivedxenograftmodelsfromcirculatingtumorcells.jvisexp.2015oct20;(105):53182.
torphyrj,tignanellicj,kamandejw,moffittra,herreraloezasg,sopersa,yehjj.circulatingtumorcellsasabiomarkerofresponsetotreatmentinpatient-derivedxenograftmousemodelsofpancreaticadenocarcinoma,plosone,2014feb19;9(2)
rossie,ruggem,facchinettia,pizzim,nardog,barbieriv,maniconem,defaveris,chiarascainim,bassou,amadoria,zamarchir.retainingthelong-survivecapacityofcirculatingtumorcells(ctcs)followedbyxeno-transplantation:notonlyfrommetastaticcancerofthebreastbutalsoofprostatecancerpatients.oncoscience.2013dec31;1(1):49-56
hodgkinson,c.l.,morrow,c.j.,li,y.,metcalf,r.l.,rothwell,d.g.,trapani,f.,polanski,r.,burt,d.j.,simpson,k.l.,morris,k.,pepper,s.d.,nonaka,d.,greystoke,a.,kelly,p.,bola,b.,krebs,m.g.,antonello,j.,ayub,m.,faulkner,s.,priest,l.,carter,l.,tate,c.,miller,c.j.,blackhall,f.,brady,g.,anddive,c.(2014).tumorigenicityandgeneticprofilingofcirculatingtumorcellsinsmall-celllungcancer.natmed20,897-903.
crespop.&casarb.;bio-protocol,vol.6,lss20,oct20,2016;chickembryochorioallantoicmembraneasaninvivomodeltostudymetastasis
hanweihouetal.scientificreports3,articlenumber:1259(2013)
lagetsetal..plosone,2017jan6;12(1):e0169427.
yohesetthyagarajanb.archpathollabmed.2017nov;141(11):1544-1557.
reviewofclinicalnext-generationsequencing
mogiaandkuwanoh;jbiomedbiotechnol.2011;2011:583929.tp53mutationsinnonsmallcelllungcancer.
goulyetal.;cancer.2015sep1;121suppl17:3069-79.differencesindrivergenesbetweensmoking-relatedandnon-smoking-relatedlungcancerinthechinesepopulation.
zheyushenetal.,chemsocrev,2017apr18;46(8):2038-2056.currentdetectiontechnologiesofcirculatingtumorcells.
sollier-christenetal.,journalofquantitativecellscience,cytometryparta,2018,93a:1240-1245.
kaganm,howardd,bendelet,etalasamplepreparationandanalysissystemforidentificationofcirculatingtumorcells.jclinligandassay2002;25:104-10.
nagraths1,sequistlv,maheswarans,belldw,irimiad,uikusl,smithmr,kwakel,digumarthys,muzikanskya,ryanp,balisuj,tompkinsrg,haberda,tonerm;nature.2007dec20;450(7173):1235-9.
- 还没有人留言评论。精彩留言会获得点赞!
- 一种检测哺乳动物血液中微量循环肿瘤细胞的特异性方法与制造工艺
- 一种循环肿瘤细胞阴性富集方法与制造工艺
- 高通量测序检测人循环肿瘤DNA EGFR基因的捕获探针及试剂盒的制造方法与工艺
- 用于肿瘤早期筛查的肿瘤血小板RNA定量检测模型及方法与制造工艺
- 肿瘤循环DNA技术检测‑癌症早期易发风险评估数据法的制造方法与工艺
- 一种偶联抗体的仿生免疫磁球及其制备方法与制造工艺
- 一种循环肿瘤细胞快速检测试剂盒及其制备和应用方法与制造工艺
- 循环肿瘤细胞表面标志分子磷脂酰肌醇蛋白聚糖‑3的检测方法与制造工艺
- 使用组合的核酸酶、连接酶、聚合酶和测序反应识别和枚举核酸序列、表达、拷贝或DNA甲基化变化的方法与制造工艺
- 一种循环肿瘤细胞分析仪的制造方法与工艺