还原糖醇、呋喃衍生物的合成的制作方法
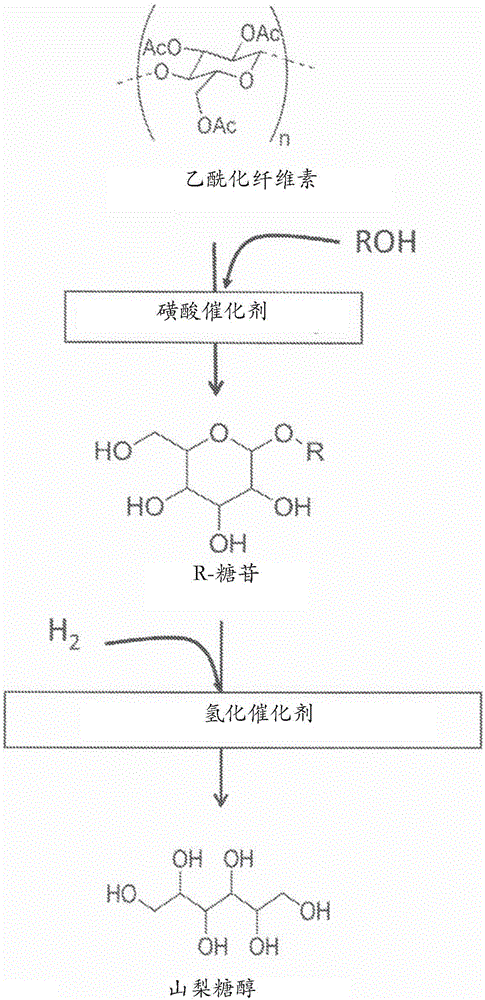
本发明涉及由C6糖醇或R-糖苷合成1,2,5,6-己四醇(HTO)、1,4,5己三醇、和1,2,6己三醇。
发明背景
已知R-糖苷是用于生产包括基于糖的表面活性剂的精细化学品的重要中间体。通常,R-糖苷通过R-醇与糖的Fischer苷化来制备,这涉及在糖的缩醛或缩酮碳与醇的羟基之间的糖苷键的酸催化形成。最常见的糖是葡萄糖。R-糖苷还可以通过在多糖例如淀粉或纤维素中的葡萄糖残基与醇的酸催化的Fischer苷化来制备,其经由醇部分的取代导致多糖中的糖苷键的裂解,形成游离葡萄糖苷。典型地需要强酸、高温、和高压。与较温和的条件相容的并且利用较不昂贵的起始材料(尤其是具有另外受限制的应用的起始材料)的机制将是经济上有利的,尤其在工业规模上。
纤维素是植物物质的主要成分,是非营养性的,并且在纸张和纺织工业之外没有被广泛使用。纤维素可以通过酸或酶水解转化为葡萄糖,然而,水解由于纤维素的稳健的晶体结构是困难的。已知的酸水解方法典型地需要浓硫酸以实现葡萄糖的良好产率。不幸的是,葡萄糖在浓硫酸存在下可降解形成羟甲基糠醛(“HMF”),其进而可以进一步聚合成被称为腐黑物的焦油状物质。HMF和焦油状腐黑物的形成负面地影响了葡萄糖的产率并且需要额外的分离步骤。由于低反应速率和费用,并且酶不使已经被化学改性的纤维素水解,本领域中已知的酶水解方法对于纤维素至葡萄糖的工业规模转化还是不切实际的。
最近,Deng等人报道了在酸催化剂存在下将纤维素和甲醇直接转化成甲基葡萄糖苷。Deng等人,在中等温度下在甲醇中纤维素至甲基葡萄糖苷的酸催化的直接转化(Acid-catalysed Direct Transformation of Cellulose into Methyl Glucosides in Methanol at Moderate Temperatures),46化学通讯(Chem.Comm.)2668-70(2010)。测试了不同的稀释的无机和有机酸,其中硫酸提供了48%的最佳甲基葡萄糖苷产率。还测试了Keggin类型的杂多酸,其中H3PW12O40产生53%的甲基葡萄糖苷。然而,在H3PW12O40的存在下在乙醇中纤维素的转化产生了42%的降低的乙基葡萄糖苷产率。测试了固体酸,其中带有SO3H基团的各种形式的碳给出61%的最好的甲基葡萄糖苷产率。
最近,Dora等人报道了在基于磺化碳的催化剂上将纤维素催化转化为甲基葡萄糖苷。Dora等人,在基于磺化碳的催化剂上纤维素至高产率的甲基葡萄糖苷的有效催化转化(Effective Catalytic Conversion of Cellulose into High Yields of Methyl Glucosides over Sulfonated Carbon Based Catalyst),120生物资源技术(Bioresource Technology)318-21(2012)。合成含有SO3H基团的基于碳的催化剂并且对甲醇中的纤维素转化进行评估。确切地,使微晶纤维素与甲醇和磺化的碳催化剂(该微晶纤维素的按重量计50%)在从175℃至275℃的温度下反应。在275℃下在15分钟的反应时间下获得最大92%的甲基葡萄糖苷产率。
转向糖醇,在此目前没有已知的用于通过氢化从烷基糖苷生产糖醇(即,己糖醇或戊糖醇例如山梨糖醇和木糖醇)的方法。典型地通过在高压下在氢化催化剂存在下加热未改性的糖来生产糖醇。
近来,Fukuoka等人报道了糖醇可以使用负载型铂或钌催化剂由纤维素来制备,这些催化剂显示出对于将纤维素转化为糖醇的高活性,其中载体材料的选择是重要的。Fukuoka等人,纤维素催化转化为糖醇(Catalytic Conversion of Cellulose into Sugar Alcohols),118德国应用化学(Agnew.Chem.)5285-87(2006年)。该机制涉及将纤维素水解为葡萄糖,然后将葡萄糖还原为山梨糖醇和甘露糖醇。然而,产率是最多约30%的至糖醇的转化率,并且这些反应在5MPa的高压下发生。
最近,Verendel等人综述了在各种条件下将多糖一锅法转化为小的有机分子。Verendel等人,由多糖一锅法催化生产小的有机物(Catalytic One-Pot Production of Small Organics from Polysaccharides),11合成(Synthesis),1649-77(2011)。纤维素在酸性条件和高压下的水解氢化被披露为产生最高达90%的山梨糖醇,尽管这些工艺被分类为“绝不简单的”。还披露了没有加入可溶性酸在氢气下通过负载金属将淀粉、菊粉和多糖水解产物直接水解氢化成糖醇。报道了沉积于氧化铝上的钌或铂、负载于活性碳上的各种金属、以及沸石作为合适的催化剂用于纤维素降解。还披露了在产生山梨糖醇的酸性条件下过渡金属纳米团簇对于纤维二糖的降解的作用。一项不同的研究着眼于在负载型钌催化剂下将具有不同结晶度的纤维素转化为多元醇,其中负载在碳纳米管上的钌给出73%的己糖醇的最好产率。
对于具有高选择性并且通过替代途径生产糖醇的成本有效的方法仍然存在需要。
在又另一个主题上,分子1,2,5,6-己四醇(“HTO”)是在较高价值的化学品的形成中有用的中间体。HTO以及具有比碳原子更少的氧原子的其他多元醇可以被认为是“还原多元醇”。Corma等人总体上披露了含有至少四个碳原子的较高分子量的多元醇可以用于制造聚酯、醇酸树脂、以及聚氨酯。Corma等人,用于将生物质转化为化学品的化学路径(ChemicalRoutes for the Transformation of Biomass into Chemicals),107化学综述(Chem.Rev.)2443(2007)。
已知山梨糖醇氢解产生HTO,尽管典型地这些反应条件是苛刻的并且不经济的。美国专利号4,820,880披露了HTO的生产,涉及在高温和高压下在亚铬酸铜催化剂存在下加热己糖醇在有机溶剂中的溶液与氢气。示例性起始己糖醇包括山梨糖醇和甘露糖醇。发现水不利地影响反应速度,需要该反应在水不存在下并且相反使用乙二醇单甲醚或乙二醇单乙醚作为唯一的溶剂进行,这对可以反应的山梨糖醇量设定了溶解度限制。在此类条件下,显示为有用的山梨糖醇的最大浓度在乙二醇单甲醚中是9.4%wt./wt.,这提供了约28%的HTO的摩尔产率。在其中山梨糖醇浓度被减小至在二醇单甲醚中约2%wt/wt的类似反应中,HTO的摩尔产率是38%,然而低浓度的反应物使得此种方法不经济。最近,美国专利号6,841,085披露了用于氢解6-碳糖醇(包括山梨糖醇)的方法,这些方法涉及使起始材料与氢气在至少120℃的温度下在含铼的多金属固体催化剂存在下反应。镍和钌催化剂作为用于山梨糖醇氢解的传统催化剂被披露,然而这些催化剂主要产生较低水平的多元醇(例如丙三醇和丙二醇)并且没有示出可检测地产生HTO或己三醇。
对于用于由糖醇生产HTO的改进的成本有效的催化剂仍然存在需要并且对于不同于糖醇的替代基底仍然存在需要。
在另一个背景主题上,分子2,5双(羟甲基)四氢呋喃(“2,5-HMTHF”)典型地通过HMF的催化还原来制备。由于HMF的费用、苛刻的反应条件和差的产率,这是不切实际的。例如,美国专利号4,820,880披露了在至少50大气压的压力下在亚铬酸铜催化剂的存在下、在180℃至230℃的范围内的温度下在乙二醇单甲醚中用氢气将HTO转化为2,5-HMTHF。
总体上,在本领域中存在需要来设计用于将纤维素转化为烷基糖苷、用于将烷基糖苷转化为糖醇、用于将糖醇转化为HTO和其他还原多元醇、并且用于制成此类还原多元醇的有用的衍生物如2,5-HMTHF的经济的方法。
发明概述
在一个方面,本披露提供了由乙酰纤维素纸浆合成R-糖苷的方法,基本上没有降解产物的形成。这些方法涉及在式ROH(其中R是C1-C4烷基)的醇和选自由膦酸和磺酸组成的组的酸催化剂的存在下,在足以由该乙酰纤维素纸浆形成R-糖苷部分的时间和温度下,加热乙酰纤维素纸浆。在优选的实践中,该乙酰纤维素纸浆是来自单子叶植物物种,例如选自下组的物种,该组由以下各项组成:禾草、玉米秆、竹子、小麦秸、大麦秸、粟秸、高粱秸、以及稻秸。在示例性实施例中,该酸催化剂是具有式R1SO3H的磺酸,其中R是烷基或环烷基。
在另一个方面,本披露提供由烷基糖苷合成糖醇的方法。这些方法包括使含有R-糖苷的溶液与氢化催化剂在足以将该R-糖苷转化为包含糖醇和ROH(其中R是C1-C4烷基)的混合物的时间和温度以及压力下接触。该氢化催化剂可以含有铜和/或钌。当该氢化催化剂包含铜时,并且该溶液应该含有小于2ppm的硫阴离子以及小于1ppm的氯阴离子。示例性钌催化剂选自下组,该组由以下各项组成:负载在碳上的钌、负载在沸石上的钌、负载在TiO2上的钌以及负载在Al2O3上的钌。
在另一方面,结合上述方法提供由乙酰化纤维素纸浆生产糖醇的方法,该方法包括由如以上描述的乙酰纤维素纸浆产生R-糖苷;并且如以上进一步描述的使该R-糖苷与氢化催化剂接触。
在另一个方面,本披露提供了制备还原糖醇的方法,该还原糖醇包括至少一个选自下组的成员,该组由1,4,5己三醇、,2,6-己四醇、和1,2,5,6己四醇组成。这些方法包括使包含水和至少20%wt/wt的起始化合物的溶液与氢气和雷尼铜催化剂、在足以产生含有具有至少50%mol/mol的组合选择性产率的这些还原糖醇中的一种或多种的混合物的时间和温度以及压力下接触,该起始化合物选自由C6糖醇和C6糖的R-糖苷组成的组,其中R是甲基或乙基。在这些方法的最有利的实施例中,该反应溶液包含20-30%wt/wt的水和45-55%的C2-C3二醇。在示例性实施例中,该溶液包含20-30%wt/wt的水和50-55%wt/wt的丙二醇。这些方法提供了至少70%mol/mol的对于还原糖醇的组合选择性产率。这些方法的一个具体的实施例是制备1,2,5,6-己四醇的方法。此具体实施例包括使包含20-30%wt/wt的水、45-55%的丙二醇以及至少20%wt/wt的起始化合物的溶液与氢气和雷尼铜催化剂、在足以产生含有具有至少35%wt/wt的选择性产率的1,2,5,6-己四醇的混合物的时间和温度以及压力下接触,该起始化合物选自由C6糖醇和C6糖的R-糖苷组成的组,其中R是甲基或乙基。在最有利的实施例中,对于1,2,5,6-己四醇的选择性产率是至少40%wt/wt。
在还另一个方面,提供了由还原糖醇制备四氢呋喃衍生物例如2,5-双(羟甲基)四氢呋喃的方法。在一个实施例中,这些方法包括使包含1,2,5,6-己四醇的混合物与酸催化剂、在足以将该1,2,5,6-己四醇转化为2,5双(羟甲基)四氢呋喃的时间和温度以及压力下接触,该酸催化剂选自由硫酸、膦酸、碳酸和耐水性非布朗斯特路易斯酸组成的组。在示例性实施例中,该非布朗斯特路易斯酸是三氟甲磺酸盐化合物,例如三氟甲磺酸铋和三氟甲磺酸钪。在其他示例性实施例中,该酸催化剂是硫酸。在优选的实施例中,该酸催化剂是膦酸。
在某些实施例中,该混合物进一步包含1,4,5己三醇并且与该酸催化剂的接触进一步将1,4,5己三醇转化为2-羟乙基四氢呋喃。在某些实施例中,该方法包括通过将包含1,4,5己三醇的混合物与同一类型的酸催化剂接触来制备2羟乙基四氢呋喃。另外的方法可以进一步包括将2-羟乙基四氢呋喃与该2,5-双(羟甲基)四氢呋喃分离。在具体的另外的实施例中,使该分离的2,5双(羟甲基)四氢呋喃与氧化铼催化剂在足以将该2,5双(羟甲基)四氢呋喃转化为1,6-己二醇的时间和温度下接触。
附图简要说明
图1示出了根据本发明的某些方面在酸催化剂下在R醇存在下由乙酰化纤维素合成R葡萄糖苷,以及在氢化催化剂下经由氢解由R-葡萄糖苷合成山梨糖醇。
图2示出了根据本发明的其他方面在雷尼镍催化剂下经由山梨糖醇和/或C6R-葡萄糖苷的氢解合成己三醇和1,2,5,6己四醇,以及根据本发明的还另一方面各自通过与非布朗斯特路易斯酸接触,由1,2,5,6己四醇合成2,5(羟甲基)四氢呋喃以及由1,4,5己三醇合成2-羟乙基四氢呋喃。
发明详细说明
由乙酰纤维素纸浆合成R-糖苷。在一个方面,本披露提供了在醇和酸催化剂存在下由乙酰纤维素纸浆合成R-糖苷的方法。如贯穿本披露在化学式中属类地使用的“R”代表烷基部分。糖苷属类地指含有糖苷键(即,将糖分子连接到另一个官能团上的共价键类型,在这种情况下该另一个官能团是烷基部分)的物质,而葡萄糖苷属类地指衍生自葡萄糖的糖苷。
最适合于在本披露的方法中使用的乙酰纤维素纸浆衍生自单子叶植物物种。优选地,该单子叶植物物种选自下组,该组由以下各项组成:禾草、玉米秆、竹子、小麦秸、大麦秸、粟秸、高粱秸、以及稻秸。更优选地,该单子叶植物物种是玉米秆。可以通过工业中已知的任何方法制备乙酰纤维素纸浆。在WIPO公开号WO 2013/044042中披露的乙酰化的纤维素纸浆的制备的一个非限制性实例涉及用C1-C2酸(即,含有1或2个碳原子的酸)处理木质纤维素生物质,随后用C1-C2酸可混溶的有机溶剂洗涤。
最适合于在本披露的方法中使用的醇是含有在1与4个之间的碳原子的那些:甲醇、乙醇、丙醇、丁醇、及其异构体。该醇优选地以至少5:1的醇与乙酰纤维素纸浆的重量比存在。
最适合于在本披露的方法中使用的酸催化剂是具有式RSO3H的磺酸或膦酸。磺酸的合适的但非排他性实例包括二壬基萘磺酸、6-氨基-间-甲苯磺酸(又称为2-氨基-5-甲基苯磺酸)、烷基苯磺酸(作为LAS-99销售,其是包含最少97%的苯磺酸的C10-C16烷基衍生物的直链烷基苯磺酸)、支链的十二烷基苯磺酸(作为EM-99销售)、以及烷基芳基磺酸(作为酸销售)。酸催化剂可以是均相的或多相的。酸催化剂优选以醇的按重量计至少0.5%的量、并且出于经济原因优选不超过醇的按重量计4%的量存在。
在典型的方法中,首先在所选择的醇中洗涤该乙酰纤维素纸浆,所选择的醇最典型地是甲醇或乙醇,尽管可以使用任何C1-C4醇。将洗涤的乙酰纤维素纸浆与该醇和酸催化剂在反应容器内组合,并且在足以由该乙酰纤维素纸浆形成R-糖苷部分的时间和温度下加热。然后将该反应容器冷却至室温。典型地,将内容物过滤以除去残余的未反应浆料。可以进一步使液体部分经受标准分离方法,例如液体萃取或蒸馏以产生纯化的R-糖苷部分。
在此处提供的用于合成R-糖苷的方法中,可以改变反应时间和温度。在高于250℃的温度下,降解产物负面地影响R-糖苷的产率。在低于150℃的温度下,乙酰纤维素纸浆基本上不溶解并且R-糖苷的产率也被负面地影响。因此,优选的反应温度是150℃-250℃。在此处提供的方法中的反应时间的范围典型地是在15分钟与45分钟之间。在这些温度和时间下加热乙酰纤维素纸浆使乙酰纤维素纸浆溶解,使疏水的磺酸催化剂溶解,并且允许R-糖苷部分的形成,同时避免显著量的降解产物例如HMF的形成。
典型地,来自这些方法的R-糖苷的产率是在该乙酰纤维素纸浆中的起始糖重量的20%与60%之间。这些方法的其他副产物可以包括左旋葡聚糖、乙酰丙酸酯、糠醛例如羟甲基糠醛(HMF)、以及一些可溶性游离糖例如右旋糖。
由R-糖苷合成糖醇。在另一个方面,本披露提供了如在图1中描绘的在氢气和氢化催化剂存在下由R-糖苷合成糖醇的方法。可以通过本发明的方法合成的糖醇包括但不限于山梨糖醇、甘露糖醇、艾杜糖醇、半乳糖醇、塔罗糖醇、以及1,4-脱水山梨糖醇。
该R-糖苷可以由商业来源获得或者来源于在工业中任何已知的方法。在某些实施例中,该R-糖苷根据前述方法衍生自乙酰纤维素纸浆,并且因此该R-糖苷的烷基部分优选含有在1与4之间的碳原子。其他催化剂例如各种铜催化剂也可以是有用的。当将该氢化催化剂选择为含有铜的催化剂时,该R-糖苷应该含有最低的阴离子,特别地小于2ppm的硫阴离子以及小于1ppm的氯阴离子。
该氢化催化剂优选是酸性的。包括但不限于负载在碳上的钌、负载在沸石上的钌、负载在TiO2上的钌、以及负载在Al2O3上的钌的含钌氢化催化剂特别地有利于糖醇的合成。该氢化催化剂优选地以该R-糖苷的0.5%-12.5%重量的量存在。在使用在碳上的钌的示例性实践中,该量是该R-糖苷的按重量计约5%。
这些方法包括将R-糖苷、氢化催化剂、和水在反应容器中组合。将空气从该反应容器中去除,并且在室温下将氢气装入到希望的压力。然后将反应器加热到一定温度持续足以将该R-糖苷转化为包含糖醇的混合物的时间。该温度应该是至少150℃并且该压力应该是至少600psi。较低的温度和压力导致实质性减少的糖醇产率。合适的温度是在160℃与220℃之间。最典型地,温度应该在170℃与190℃之间,其中约180℃的温度是最优选的。合适的压力是600-1000psi,其中示例性的压力是约850psi。反应时间典型地是2-4小时。
在优选的条件下,该R-糖苷转化率达到几乎100%,其中至少85%的至山梨糖醇的摩尔转化率。在使用纯化的R-糖苷的某些非限制性实例中,摩尔转化率达到97%或甚至100%。
1,2,5,6-己四醇和己三醇的合成。在另一个方面,本披露提供通过在雷尼铜催化剂存在下用氢气氢化由起始化合物合成希望的化合物的方法,该起始化合物是在包含水的溶液中以至少20%wt/wt存在的C6R-糖苷或C6糖醇,该希望的化合物包括至少一个选自下组的成员,该组由1,4,5己三醇、1,2,5,6己四醇、和1,2,6-己三醇组成。该雷尼铜催化剂可以从商业来源(例如,格雷斯公司(WR Grace&Co),美国)获得或者通过本领域普通技术人员已知的方法制备。典型地,制备雷尼铜催化剂的方法涉及铜铝合金的碱处理以便将铝从该合金的表面部分蚀刻掉。
优选地,雷尼铜催化剂在反应器内被部署为固定床,并且以该起始化合物的重量的5%-30%存在。与在US.4,820,080中描述的亚铬酸铜催化剂或其他铜催化剂例如海绵铜(参见实例6)相比,与雷尼铜的反应可以在水存在下以对于1,2,5,6己四醇、1,4,5己三醇和1,2,6己三醇的高摩尔选择性进行,当水是唯一溶剂时,这允许该起始材料溶解至该反应混合物的50%wt/wt或更多,其中对于希望的化合物的组合选择性是至少50%mol/mol。
尽管在一些实施例中,水可以是唯一溶剂,在特别有利的实施例中,溶剂是20%-30%wt/wt的水和45%-55%wt/wt的C2-C3二醇的混合物。在这种情况下,该起始材料可以是该反应混合物的从15%至35%wt/wt。在最有利的实施例中,该C2-C3二醇是丙二醇。在优选的实践中,该起始材料(C6糖醇或C6烷基糖苷)是该反应混合物的至少20%wt/wt。在示例性实施例中,该起始材料是该反应混合物的约25%wt/wt。虽然不受理论约束,但据信水和丙二醇的混合物达到具有充足的水以便溶解最高达35%的该起始材料的最佳平衡,而充足的C2-C3二醇的存在允许更多氢气溶解在该反应混合物中并且进一步延长该雷尼铜催化剂的寿命。当起始材料是C6R-糖苷或C6糖醇时,与雷尼铜在这些条件下的反应具有对于HTO和1,4,5己三醇的高选择性,其中这些组合的物种占该摩尔产率的超过60%并且在大部分情况中超过70%。典型地,该HTO自身占从起始材料的摩尔产率的至少35%并且更典型地至少40%。
这些方法的第一子集涉及在雷尼铜催化剂存在下由C6R-糖苷合成HTO。该R-糖苷可以由商业来源获得或者来源于在工业中任何已知的方法。在某些实施例中,该R-糖苷是由如之前在此描述的乙酰化纤维素纸浆获得的乙基葡萄糖苷。然而,该反应可以使用任何R-糖苷,其中该R基团是C1至C4烷基。最优选地,该R基团是甲基或乙基,其中最通常可获得的糖苷是甲基葡萄糖苷或乙基葡萄糖苷。
这些方法的第二子集涉及在相同催化剂存在下由C6糖醇合成HTO。这些糖醇可以由商业来源获得或者来源于在工业中任何已知的方法。在某些实施例中,这些糖醇可以通过C6糖或C6R-糖苷的氢化获得。例如,山梨糖醇典型地通过在雷尼镍催化剂下氢化葡萄糖获得。乙基葡萄糖苷可以根据之前在此描述的方法通过氢化乙酰纤维素纸浆获得。
在一个方面,这些方法包括将该R-糖苷或糖醇与水并且任选地并且更优选地与C2-C6二醇在优选含有雷尼铜的固定床的反应容器中组合。将空气从该反应容器中去除,并且在室温下将氢气装入到特定的压力。然后将该反应器加热到一定温度并且持续一定时间,该温度和时间足以将这些起始材料转化为含有希望的材料的混合物,在C6糖醇或C6R-糖苷的情况下该混合物将是HTO和1,4,5己三醇的混合物。在最佳反应条件下,超过98%的起始材料被转化,其中对于HTO和1,4,5己三醇的选择性当仅使用水作为溶剂时是至少50%wt/wt或者当使用水和C2或C3二醇例如丙二醇的组合作为溶剂时是大于60%并且甚至大于70%。在这些条件下,HTO是来自起始材料的mol/mol产率的至少35%并且更优选地至少40%。
在此处提供的用于合成HTO的方法中,可以改变压力、温度、和反应时间。优选地,温度是在175℃与250℃之间。在示例性实施例中,温度是190℃-215℃。压力优选是在500psi与2500psi之间。在更典型的实施例中,压力是在800与2000psi之间。在某些示例性实施例中,压力是约1800psi。在间歇反应器中,反应时间优选是在1小时与4小时之间,并且更优选地是3小时。在连续反应体系中,调节起始材料的输入流和氢气的流动速率以获得与雷尼铜催化剂接触的起始材料的最佳停留时间。在典型的实验室规模实例中,氢气流动速率是800-1000毫升/分钟,并且山梨糖醇溶液流动速率是0.25毫升/分钟,获得2小时的平均停留时间。
除了以上讨论的主要己三醇之外,氢解C6糖或R-葡萄糖苷的相同方法还产生其他多元醇,例如1,2,5己三醇、1,2丁二醇、1,2,3丁三醇、丙二醇、乙二醇和少量。在其中HTO合成是最佳的条件下,例如在丙二醇和水存在下,1,2丁二醇是在HTO和1,4,5己三醇之后制备的第三主要产物。
相似地,C5糖醇例如核糖醇、木糖醇和阿糖醇以及R-糖苷还可以在如在此提供的雷尼镍下经受氢解,导致产生作为主要产物的1,2,5戊三醇,连同1,2丁二醇、1,2,4丁三醇、丙三醇、乙二醇和丙二醇。丁四醇还可以在雷尼镍下通过氢解被还原以便形成作为主要产物的1,2丁二醇,连同1,2,4丁三醇、2,3丁二醇、丙二醇和乙二醇。
将多元醇分子内环化为四氢呋喃衍生物HTO和己三醇(特别地1,4,5己三醇)的重要用途是如在图2中示出的这些分子可以容易地在酸存在下经受分子间环化以形成有用的四氢呋喃(THF)衍生物。环化反应是从多元醇中释放水分子的脱水反应。来自C6糖醇的雷尼镍催化氢解的两种主要多元醇是HTO和1,4,5己三醇。HTO经受环化以形成2,5-双(羟甲基)四氢呋喃(2,5HMTHF),2,5-双(羟甲基)四氢呋喃是用于聚合物或1,6己二醇的制备的有用的起始材料。在相同的条件下,1,4,5己三醇经受环化以形成2-羟乙基四氢呋喃,2-羟乙基四氢呋喃是有价值的溶剂并且在药物领域中是有用的。有利地,将这些化合物酸催化分子内环化为其相应的THF衍生物允许将THF衍生物与彼此并且与可能仍未反应的起始糖醇和己烷多元醇容易分离。
如在优选实施例中提及的,该酸催化剂优选选自下组,该组由硫酸、膦酸、碳酸或耐水性非布朗斯特路易斯酸组成。出人意料地发现,作为均相催化剂存在的膦酸异常良好地起作用,而在大多数条件下磷酸根本不起作用。还可能是以下情况:例如用于形成糖苷的非均相膦酸催化剂也可以是有用的。
耐水性非布朗斯特路易斯酸是以氢接受布朗斯特酸中的电子的方式接受电子、但是使用不同于氢的受体物种、并且在水存在下耐受水解的分子物种。示例性耐水非布朗斯特路易斯酸是在此由三氟甲磺酸铋(III)和三氟甲磺酸钪(III)例示的三氟甲磺酸盐化合物。其他适合的三氟甲磺酸盐包括,但不限于,三氟甲磺酸银(I)、三氟甲磺酸锌(II)、三氟甲磺酸镓(III)、三氟甲磺酸钕(III)、三氟甲磺酸铝、三氟甲磺酸铟(III)、三氟甲磺酸锡(II)、三氟甲磺酸镧(III)、三氟甲磺酸铁(II)、三氟甲磺酸钇(III)、三氟甲磺酸铊(I)、三氟甲磺酸钆(III)、三氟甲磺酸钬(III)、三氟甲磺酸镨(III)、三氟甲磺酸铜(II)、三氟甲磺酸钐(III)、三氟甲磺酸镱(III)水合物、以及三氟甲磺酸镍(II)。其他合适的耐水性非布朗斯特路易斯酸包括,但不限于,氯化铋(III)、氯化铟四水合物、氯化锡(II)、氯化铝六水合物、乙酸银(I)、硫酸镉、氧化镧、氯化亚铜(I)、氯化铜(II)、溴化锂、和氯化钌(III)。优选地该酸催化剂存在于该反应混合物中的这些起始材料的0.05%至5%mol/mol的范围内。还另一种替代的酸催化剂是碳酸,其可以在压力下并且在二氧化碳的存在下进行在水中的反应中而产生。
这些方法包括将HTO、任何己三醇或者其与或没有任何残余的未反应糖醇或6C R-糖苷的混合物与酸催化剂组合。在一个实践中,HTO和己三醇可以首先例如通过蒸馏彼此分离。在其他实践中,可以使用在雷尼铜下由糖醇或6C R-糖苷的氢解产生的整体反应混合物,并且其后通过蒸部分离出随后的THF衍生物。在其中该酸催化剂是硫酸或非布朗斯特路易斯酸化合物的情况下,优选将该反应混合物置于小于0.4psi的真空下并且加热持续足以将这些己三醇和HTO转化为如以上描述的其对应的四氢呋喃衍生物的时间。当该反应在碳酸存在下完成时,它在典型地至少625psi的压力下进行。
在此处提供的方法中,可以改变温度、压力、和反应时间。当酸催化剂不是产生自CO2时,温度优选是在110℃与150℃之间。在使用硫酸或三氟甲磺酸盐催化剂的方法中,可以改变温度、压力、和反应时间。优选地,温度是在120℃与150℃之间。低于120℃的温度不能提供充足的热能以进行闭环。大于150℃的温度引发不想要的副产物形成。当使用三氟甲磺酸盐例如三氟甲磺酸铋或三氟甲磺酸钪作为酸催化剂时,温度更优选是约130℃。
此外,酸催化的环化优选在真空下发生以促进通过脱水形成的水的去除以及所希望的THF衍生物产物的随后回收。真空优选是在3.0至6.0psi的压力范围内。低于3.0psi的压力可能引起具有低沸点和高蒸气压的一些希望的THF衍生物蒸发。高于6.0psi的压力不能去除在反应期间形成的水。更低的压力例如小于0.4psi、或甚至0.1psi对于具有较低蒸气压和/或较高沸点的THF衍生物的随后的回收是有用的。
合适的反应时间是1至4小时。在一些实施例中,这些反应在更少的1-2小时并且在一些实施例中约1小时内完成。
在此有用的非布朗斯特路易斯酸催化剂全部是耐水的。优选地,非布朗斯特路易斯酸催化剂是金属三氟甲磺酸盐。优选地,非布朗斯特路易斯酸催化剂是均相的。在具体的实施例中,该非布朗斯特路易斯酸催化剂选自由三氟甲磺酸铋和三氟甲磺酸钪组成的组。三氟甲磺酸盐酸催化剂负载量优选是基于起始多元醇在0.5摩尔百分比与5摩尔百分比之间,并且更优选地以基于起始多元醇材料的1摩尔百分比的量存在。
除了以上化合物之外,通过C6糖醇或R-葡萄糖苷的雷尼镍催化氢化获得的其他多元醇包括1,2,6己三醇、1,2,5己三醇和1,2,4丁三醇。这些化合物的酸催化环化主要分别形成1-甲醇四氢吡喃醇、5-甲基四氢呋喃2-甲醇、和3-羟基四氢呋喃。
进一步地,还可以在雷尼镍下将C5糖醇还原为低级多元醇。当使用C5糖醇时,主要的还原多元醇是1,2,5戊三醇。这种化合物的酸催化环化主要形成四氢呋喃-2甲醇。
如在下表1中示出的,清楚地,多元醇完全转化为其环化的衍生物是有可能的。如在表1中并且通过某些非限制性实例证明的,当实现起始糖醇的几乎完全转化时,可以由其对应的起始多元醇化合物获得环化THF衍生物的最高达83%mol/mol的产率。如在此使用的,“几乎完全转化”是指在该反应中消耗了至少97%的这种起始化合物或这些化合物。
表1
至环状衍生物的转化率%
2,5-双(羟甲基)四氢呋喃以及由这些多元醇制备的其他THF(和吡喃)衍生物可以容易地通过蒸馏与彼此并且与未反应的多元醇分离。随后可以通过与氧化铼催化剂接触一定时间和温度经由呋喃环的氧化将2,5-双(羟甲基)四氢呋喃转化为1,6己二醇,该时间和温度足以将2,5-双(羟甲基)四氢呋喃转化为1,6己二醇。优选地,该氧化铼催化剂进一步包括氧化硅。
提供以下实例以便说明本发明的各个方面并且不旨在以任何方式限制本发明。本领域普通技术人员可以使用这些实例作为指导以用不同来源的乙酰纤维素纸浆、不同的醇、不同的酸催化剂、不同的氢化催化剂、不同的多元醇混合物、或不同的条件来实践本发明的各个方面,而不背离所披露的本发明的范围。
实例1:由乙酰化的玉米秆纸浆制备乙基糖苷
通过在PCT公开号WO 2013/044042中描述的方法获得的乙酰化的玉米秆纸浆用乙醇洗涤,过滤,烘箱干燥,并且研磨。将75毫升的高压釜式反应器装入2克的洗涤研磨纸浆、40克的变性乙醇、以及0.2克的甲磺酸。将该反应器系统加热到185℃。在达到设定温度后,将反应器内含物保持在185℃持续30分钟。使该反应器冷却至室温并且过滤内含物。将约0.84克的干燥的残余纸浆从44.14克的滤液中去除。在滤液中的乙基葡萄糖苷作为来自起始溶解纸浆的糖的重量百分比的产率是34%。
实例2:由乙酰化的玉米秆纸浆制备甲基糖苷
乙酰化的玉米秆纸浆用乙醇洗涤,过滤,烘箱干燥,并且研磨。将75毫升的高压釜式反应器装入2克的洗涤研磨纸浆、40克的甲醇、以及0.2克的甲磺酸。将该反应器系统加热到185℃。在达到设定温度后,将反应器内含物保持在185℃持续30分钟。使该反应器冷却至室温并且过滤内含物。将约0.93克的干燥的残余纸浆从44.72克的滤液中去除。在滤液中的单甲基葡萄糖苷作为纸浆中的起始糖的摩尔百分比的产率是45%。
实例3:由乙酰化的玉米秆纸浆制备甲基糖苷-各种酸
使用各种反应时间和温度和各种酸遵循在实例2中描述的程序,产生在表2中示出的单甲基葡萄糖苷的摩尔产率。EM-99是支链的十二烷基苯磺酸(作为EM-99出售),LAS-99是烷基苯磺酸(作为LAS-99出售),pTSA是对-甲苯磺酸,MSA是甲磺酸。
表2
实例4:由甲基葡萄糖苷制备山梨糖醇-低温
将80.1克的甲基葡萄糖苷、10.1克的Ru/C、和300毫升的水的混合物加入到装配有温度和压力控制器的高压釜式反应器内。通过氢气鼓泡穿过汲取管3次来去除空气。在室温下在850psi下装入氢气。将该混合物加热至140℃并在该温度下保持3小时。使该反应器冷却至室温并且释放剩余的氢气。将反应器内含物过滤以去除催化剂。在真空下蒸发滤液以获得小于5%产率的山梨糖醇以及大量的未反应的甲基葡萄糖苷。)
实例5:由甲基葡萄糖苷制备山梨糖醇-高温
将80.1克的甲基葡萄糖苷、10.1克的Ru/C、和300毫升的水的混合物加入到装配有温度和压力控制器的高压釜式反应器内。通过氢气鼓泡穿过汲取管3次来去除空气。在室温下在850psi下装入氢气。将该混合物加热至165℃并在该温度下保持3小时。使该反应器冷却至室温并且释放剩余的氢气。将反应器内含物过滤以去除催化剂。在真空下蒸发滤液以获得97%产率的山梨糖醇以及少量的未反应的甲基葡萄糖苷。
实例6:由甲基葡萄糖苷制备山梨糖醇
将80.1克的甲基葡萄糖苷、10.1克的Ru/C、和300毫升的水的混合物加入到装配有温度和压力控制器的高压釜式反应器内。通过氢气鼓泡穿过汲取管3次来去除空气。在室温下在850psi下装入氢气。将该混合物加热至180℃并在该温度下保持3小时。使该反应器冷却至室温并且释放剩余的氢气。将反应器内含物过滤以去除催化剂。在真空下蒸发滤液以获得100%产率的山梨糖醇。
实例7:在水中用海绵铜催化剂由甲基葡萄糖苷制备1,2,5,6己四醇-对比实例
将80.1克的甲基葡萄糖苷、24.8克的海绵铜、和300毫升的水的混合物加入到装配有温度和压力控制器的高压釜式反应器内。通过氢气鼓泡穿过汲取管3次来去除空气。在室温下在850psi下装入氢气。将该混合物加热至225℃并在该温度下保持3小时。使该反应器冷却至室温并且释放剩余的氢气。将反应器内含物过滤以去除催化剂。在真空下蒸发滤液以获得1,2,5,6-己四醇(15%wt/wt)和山梨糖醇(85%wt/wt)。
实例8:在水中用雷尼铜由山梨糖醇制备1,2,5,6己四醇低压
将雷尼铜催化剂装载到固定床反应器系统中。该反应器装入在600psi下的氢气,并且将氢气流动速率保持在1000毫升/分钟。将该反应器加热到225℃。以LHSV=0.5的速率通过该反应器系统进料50%wt/wt山梨糖醇和水的溶液。山梨糖醇的转化率是98.5%,具有5.8%的1,2,5,6-己四醇重量产率。
实例9:在水中用雷尼铜由山梨糖醇制备1,2,5,6己四醇-高压
如在实例7中的将雷尼铜催化剂装载到固定床反应器系统中。在1800psi下装入氢气,并且将氢气流动速率保持在1000毫升/分钟。将该反应器加热到205℃。再次,以LHSV=0.5的速率将50%wt/wt山梨糖醇和水的溶液进料穿过反应器系统。山梨糖醇的转化率是73%,具有28.8%的1,2,5,6-己四醇选择性重量产率。其他多元醇存在但没有被量化。
实例10在水/丙二醇中用雷尼铜由山梨糖醇制备1,2,5,6-己四醇
如在实例8和9中描述的,在210℃以及1800psi的压力下使如在表3中示出的含有25%wt/wt山梨糖醇、约25%wt/wt的水以及约50%重量的丙二醇的溶液穿过雷尼铜固定床反应器系统。对于丙二醇(PG)、乙二醇(EG)、1,2己二醇(1,2-HDO)、1,2丁二醇(1,2-BDO)、1,2,6己三醇(1,3,6-HTO)、1,4,5己三醇(1,4,5-HTO)和1,2,5,6己四醇(1,2,5,6-HTO)分析所产生的反应混合物,其中在表4中示出结果。
表3
表4
实例11:用硫酸将1,2,5,6己四醇转化为2,5-双(羟甲基)四氢呋喃
在真空(约20托)下在120℃使0.6克的浓硫酸和36克的1,2,5,6-己四醇的溶液反应1小时。将该溶液冷却至室温并且然后通过加入50毫升的水和2克的碳酸钙来中和。过滤该溶液并且然后在真空下浓缩以获得约96%的2,5-双(羟甲基)四氢呋喃产率。
实例12:用三氟甲磺酸铋将1,2,5,6己四醇转化为2,5-双(羟甲基)四氢呋喃
在真空(小于5托)下在130℃使110毫克的三氟甲磺酸铋以及151.41克的含有33%wt/wt的1,2,5,6-己四醇的山梨糖醇氢解混合物的溶液反应2小时。将该溶液冷却至室温。通过高效液相色谱法(HPLC)分析的样品示出了该1,2,5,6-己四醇的完全转化并且表明获得93.4%的2,5-双(羟甲基)四氢呋喃的理论产率。
实例13:用三氟甲磺酸钪将1,2,5,6己四醇转化为2,5双(羟甲基)四氢呋喃
在真空(小于5托)下在130℃使89毫克的三氟甲磺酸钪以及163.57克的含有33%wt/wt的1,2,5,6-己四醇的山梨糖醇氢解混合物的溶液反应2小时。将该溶液冷却至室温。通过HPLC分析的样品示出了该1,2,5,6-己四醇的完全转化并且表明获得91.3%的2,5-双(羟甲基)四氢呋喃的理论产率。
实例14:用三氟甲磺酸铋将1,2,5,6己四醇转化为2,5-双(羟甲基)四氢呋喃
在真空(200托)下在130℃使544毫克的1,2,5,6己四醇和24毫克的三氟甲磺酸铋的混合物反应2小时。将所产生的残余物冷却至室温。通过气相色谱法分析的样品表明该残余物含有1.24%(按重量计)的起始己-1,2,5,6-四醇和61.34%(按重量计)的希望的(四氢呋喃-2,5,-二基)二甲醇。
实例14:用膦酸将1,2,5,6己四醇转化为2,5-双(羟甲基)四氢呋喃
向配备有PTFE涂覆的磁力搅拌棒的三颈的500mL圆底烧瓶中装入300g的由~42wt.%的1,2,5,6-己四醇构成的中间相的灰白色油和3.44g的膦酸(H3PO3,相对于HTO为5mol%)。一个颈用磨口玻璃接头加盖,中间的颈用装配有热电偶的套设的热电偶套管适配器加盖,并且最后一个颈用附接到干冰冷却的250mL的梨形接收器上的短路径冷凝器加盖。在剧烈搅拌的同时,在真空(20托)下将该混合物加热至150℃持续4小时。在这段时间之后,破坏真空,并且将残余的浅色的油冷却并且称重,提供了3.06g。GC分析表明95mol%的HTO已经被转化并且对于2,5-双(羟甲基)四氢呋喃的选择性产率是88%mol/mol。
实例16:由1,2,5戊三醇制备四氢呋喃-2-甲醇
在真空(200托)下在130℃使1.05克的戊-1,2,5-三醇和57毫克的三氟甲磺酸铋的混合物反应2小时。将所产生的残余物冷却至室温。由气相色谱法分析的样品指示了该残余物含有36.24%(按重量计)的该起始戊烷-1,2,5-三醇和50.37%(按重量计)的所希望的(四氢呋喃-2-基)甲醇。
实例17:由1,2,4丁三醇制备3-四氢呋喃醇
在真空(200托)下在130℃使1.00克的1,2,4丁三醇和62毫克的三氟甲磺酸铋的混合物反应2小时。将所产生的残余物冷却至室温。通过气相色谱法分析的样品表明该残余物含有12.56%(按重量计)的起始丁-1,2,4-三醇和76.35%(按重量计)的希望的四氢呋喃-3-醇。
实例18:由1,2,5己三醇制备5-甲基四氢呋喃-2-甲醇
在真空(200托)下在130℃使817毫克的1,2,5己三醇和40毫克的三氟甲磺酸铋的混合物反应2小时。将所产生的残余物冷却至室温。通过气相色谱法分析的样品表明该起始己-1,2,5-三醇被完全转化并且该残余物含有75.47%(按重量计)的希望的甲基四氢呋喃-2-甲醇。还以7.42%的重量产率产生的是异构体2-甲基-4-四氢吡喃醇。
实例19对于环化的通用分析方案
在完成如在实例11-18中描述的反应物脱水环化时,取出反应混合物的样品并且用足够的水稀释以产生1-5mg/mL的溶液。然后使其等分部分经受使用安捷伦(Agilent)系列仪器并且使用以下方案的用于定量的高效液相色谱法(HPLC):将10μL样品注入到300mm×7.8mm 有机酸柱上,该柱用5mM硫酸流动相预平衡并且在0.800mL/min的速率下流动。维持流动等度并且分子目标物以通过折射率检测器(RID)确定的特征时间从该柱洗脱。对于每种分析物的定量方法在注射之前建立,施用具有至少0.995的相关系数的线性回归分析。
- 还没有人留言评论。精彩留言会获得点赞!