一种复配抗氧化物在保健食品中的应用的制作方法
本发明涉及食品应用技术领域,尤其涉及具有抗氧化功能的物质在保健食品中的应用。
背景技术:
沙棘原花青素是一种高效的天然抗氧化剂,维生素c的抗氧化能力也一直被人们认可,目前对它们各自抗氧化能力已进行了相关的研究,但关于它们之间的协同抗氧化能力的研究却未见公开。目前虽有一些利用其它来源的原花青素,如葡萄籽原花青素、紫叶李原花青素与维生素c复配,发现具有协同促进清除dpph等自由基的能力,但这只能说明,此类复配物可作为食品添加剂抗氧化剂,如果想将复配物用于抗氧化功效的保健食品,需要进行深入的生物实验研究。同时,不同来源的原花青素的结构差异较大,它们的生物活性也存在差异,因此在保健食品领域的应用不能以偏概全,必须选用特定的、针对性强的原花青素进行复配,否则难以达到预期的抗氧化功效。
技术实现要素:
本发明要解决的技术问题是针对现有技术的缺点,提供一种可在细胞水平上协同提高抗氧化能力的复配抗氧化物在保健食品中的应用,并提供了其相关功能的检测方法。
为解决上述技术问题,本发明采用如下技术方案:一种复配抗氧化物在保健食品中的应用,其特征在于:由沙棘原花青素与维生素c复配制成的具有抗氧化增效协同作用的抗氧化物在制备保健食品中的应用,在复配抗氧化物中,沙棘原花青素与维生素c的质量比例为8:2~2:8。
沙棘原花青素与维生素c复配的具体操作步骤为:
1)将沙棘原花青素和维生素c分别加纯净水溶解,分别配成1000μg/ml的溶液;
2)分别吸取同浓度的沙棘原花青素溶液与维生素c溶液,沙棘原花青素与维生素c分别以8:2、6:4、5:5、4:6、2:8的比例加纯净水稀释,使沙棘原花青素与维生素c复配溶液终浓度达25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml、800μg/ml、1000μg/ml,混合均匀后4℃保存,用于抗氧化活性测试。
其中,检测沙棘原花青素与维生素c复配物对细胞活力影响的步骤如下:
(1)细胞培养:采用cck-8法检测样品对raw264.7细胞活力的影响;收集对数生长期细胞,调整细胞悬液的浓度为5×104cell/ml,接种于96孔培养板,每孔100μl;将载有细胞的96孔板置于二氧化碳恒温培养箱中,37℃、5%co2条件下培养24h;
(2)样品处理:弃上清,pbs洗涤2次后,加入用rpmi1640培养液稀释的不同浓度的原花青素与vc配比为5:5的样品100μl,阴性对照组仅加入细胞培养基;阳性对照组加入终质量浓度为1μg/ml的lps,培养24h后,每孔加入10μlcck-8溶液,培养箱孵育1h;用酶标仪于450nm处测各孔的吸光度,按下述公式计算细胞活力:
cellviability%=(odsample-odblank)/(odcontrol-odblank)×100%。
其中,检测沙棘原花青素与维生素c复配物对过氧化氢诱导氧化损伤细胞保护作用的步骤如下:
(1)氧化损伤模型建立:取对数生长期的raw264.7细胞接种于96孔板中,每孔200ml,细胞浓度为2.0×105个/ml;在37℃、5%co2条件下培养24h至细胞贴壁,弃上清液,加入用rpmi-1640培养基配制的不同浓度的h2o2溶液,共设置8个浓度梯度组,h2o2终浓度分别为0、50、100、200、400、600、800、1000μmol/l,每个浓度梯度设置5个重复孔;细胞培养6h后,采用cck8法检测细胞的存活率;
(2)复配物对raw264.7细胞保护作用实验:取对数生长期的raw264.7细胞接种于96孔板中,每孔100μl,细胞浓度为2.0×105个/ml;在37℃、5%co2条件下培养24h至细胞贴壁,弃上清液,pbs洗涤2次后,加入用rpmi1640培养液配置的浓度为100μg/ml的不同混合比例的复配物样品100μl,培养4h后,除空白对照组外,其余各组加入过氧化氢使之终浓度为800μmol/l,培养4h后,采用cck8法检测细胞的存活率。
其中,检测沙棘原花青素与维生素c复配物对过氧化氢诱导氧化损伤细胞内抗氧化酶和抗氧化物影响的步骤如下:
(1)细胞培养:取对数生长期的raw264.7细胞接种于12孔板中,每个孔1ml,细胞浓度为2.0×105个/ml,在37℃、5%co2条件下培养24h至细胞贴壁;
(2)样品处理:弃上清液,pbs洗涤2次后,加入用rpmi1640培养液稀释的不同浓度的样品加入用rpmi1640培养液配置的浓度为100μg/ml的不同混合比例的复配物样品100μl,培养4h后,除空白对照组外,其余各组加入过氧化氢使之终浓度为800μmol/l,培养4h后,采用试剂盒测定酶活力;
(3)sod酶活力检测:采用sod检测试剂盒,培养结束后,弃去上清液,每皿加入200μl细胞裂解液,收集细胞裂解液,12,000rpm、4℃离心10min,吸取上清液为待测样品;采用bca蛋白浓度测定试剂盒定量蛋白,每种样品吸取20微克蛋白的细胞用于后续检测,将sod标准品稀释至如下系列浓度:60u/ml,40u/ml,20u/ml,10u/ml,5u/ml,各取20微升,用于制作标准曲线;按照说明书配制缓冲液及工作液,37℃孵育30分钟,在450nm测定吸光度;
样品中总sod活力的计算:
抑制百分率=(空白对照1-样品)/(空白对照1-空白对照2)×100%
待测样品中sod酶活力单位=抑制百分率/(1-抑制百分率)units
(4)gsh含量测定:采用总谷胱甘肽检测试剂盒,蛋白定量为1mg/ml,将gsh标准品配制成2、5、10、15、25、50μm,标准品及样品各吸收10μl,加入150微升总谷胱甘肽检测工作液和nadph溶液,25℃孵育25分钟,在412nm测定吸光度,根据标准曲线计算各组gsh含量。
本发明通过将沙棘原花青素与维生素c在一定比例下复配,可在细胞水平上协同提高抗氧化能力,如提高细胞活力、保护细胞氧化损伤、提高抗氧化酶(sod)的分泌、提高抗氧化物(gsh)的水平,从而使得该复配抗氧化物可用于具有抗氧化功效的保健食品。
附图说明
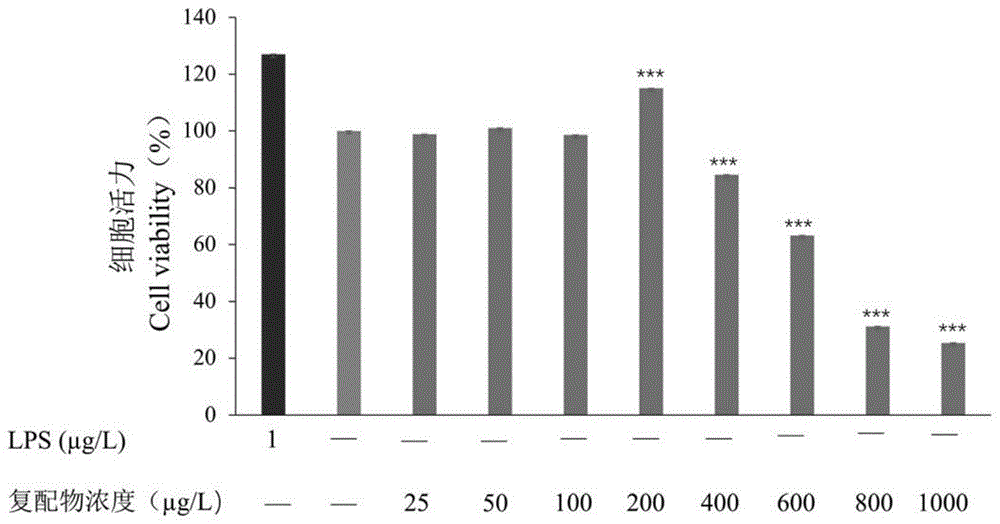
图1为沙棘原花青素对细胞活力的影响状态图;
图2为不同浓度过氧化氢对raw264.7细胞活力的影响状态图;
图3为过氧化氢浓度与raw264.7细胞活力的线性方程关系曲线图;
图4为样品对raw264.7细胞氧化损伤的保护作用状态图;
图5为样品对raw264.7细胞氧化损伤的保护作用的联合指数曲线图;
图6为样品对raw264.7细胞抗氧化酶活性的影响状态图;
图7为样品对raw264.7细胞抗氧化酶活性影响的联合指数曲线图;
图8为样品对raw264.7细胞抗氧化物含量的影响图;
图9为样品对raw264.7细胞抗氧化物含量影响的联合指数曲线图。
具体实施方式
下面结合附图通过具体实施方式对本发明做进一步说明:
本实施例中,
1、不同比例的沙棘原花青素和vc(维生素c)复配物的制备
配置浓度为25、50、100、200、400、800、1000μg/ml的沙棘原花青素与vc溶液,分别按照质量比8:2、6:4、5:5、4:6和2:8进行复配,得到一系列沙棘原花青素与vc的复配物。
2、沙棘原花青素与vc复配物对raw264.7细胞活力的影响
(1)细胞培养:采用cck-8法检测样品对raw264.7细胞活力的影响。收集对数生长期细胞,调整细胞悬液的浓度为5×104cell/ml,接种于96孔培养板,每孔100μl。将载有细胞的96孔板置于二氧化碳恒温培养箱中,37℃,5%co2条件下培养24h。
(2)样品处理:弃上清,pbs洗涤2次后,加入用rpmi1640培养液稀释的不同浓度的原花青素与vc配比为5:5的样品(25、50、100、200、400、800、1000μg/ml)100μl,阴性对照组仅加入细胞培养基;阳性对照组加入终质量浓度为1μg/ml的lps,培养24h后,每孔加入10μlcck-8溶液,培养箱孵育1h。用酶标仪于450nm处测各孔的吸光度。按下述公式计算细胞活力:
cellviability%=(odsample-odblank)/(odcontrol-odblank)×100%得到复配物浓度在100ug/ml以下对细胞活力无影响,如图1所示。
3、沙棘原花青素与vc复配物对过氧化氢诱导氧化损伤raw264.7细胞的保护作用
(1)氧化损伤模型建立:取对数生长期的raw264.7细胞接种于96孔板中,每孔200ml,细胞浓度为2.0×105个/ml。在37℃、5%co2条件下培养24h至细胞贴壁,弃上清液,加入用rpmi-1640培养基配制的不同浓度的h2o2溶液,共设置8个浓度梯度组,h2o2终浓度分别为0(h2o2空白组)、50、100、200、400、600、800、1000μmol/l,每个浓度梯度设置5个重复孔。细胞培养6h后,采用cck8法检测细胞的存活率。
如图2可知,h2o2浓度大于300μmol/l时细胞活力明显降低,经图3线性方程计算ic50值为785.2μmol/l,因此,后续实验选定800μmol/l的h2o2浓度作为制造氧化损伤模型的条件。
(2)复配物对raw264.7细胞保护作用实验:取对数生长期的raw264.7细胞接种于96孔板中,每孔100μl,细胞浓度为2.0×105个/ml。在37℃、5%co2条件下培养24h至细胞贴壁,弃上清液,pbs洗涤2次后,加入用rpmi1640培养液配置的浓度为100μg/ml的不同混合比例的复配物样品(原花青素:vc=8:2、6:4、5:5、4:6、2:8)100μl,培养4h后,除空白对照组外,其余各组加入过氧化氢使之终浓度为800μmol/l,培养4h后,采用cck8法检测细胞的存活率。
得到各个样品对过氧化氢诱导的细胞氧化损伤均有一定保护作用,且各个比例的沙棘原花青素与vc的复配物保护作用均明显大于两样品单独作用,且由图5的联合指数值可以得到,各个配比下的复配物均对细胞氧化损伤的保护具有协同作用。
4、沙棘原花青素与vc复配物对对过氧化氢诱导氧化损伤raw264.7细胞内抗氧化酶和抗氧化物的影响
(1)细胞培养:取对数生长期的raw264.7细胞接种于12孔板中,每孔1ml,细胞浓度为2.0×105个/ml。在37℃、5%co2条件下培养24h至细胞贴壁。
(2)样品处理:弃上清液,pbs洗涤2次后,加入用rpmi1640培养液稀释的不同浓度的样品加入用rpmi1640培养液配置的浓度为100μg/ml的不同混合比例的复配物样品(原花青素:vc=8:2、6:4、5:5、4:6、2:8)100μl,培养4h后,除空白对照组外,其余各组加入过氧化氢使之终浓度为800μmol/l,培养4h后,采用试剂盒测定酶活力。
(3)sod酶活力检测:采用sod检测试剂盒(碧云天公司,货号s0101s),培养结束后,弃去上清液,每皿加入200μl细胞裂解液,收集细胞裂解液,12,000rpm、4℃离心10min,吸取上清液为待测样品。采用bca蛋白浓度测定试剂盒(p0009)定量蛋白,每种样品吸取20微克蛋白的细胞用于后续检测,将sod标准品稀释至如下系列浓度:60u/ml,40u/ml,20u/ml,10u/ml,5u/ml,各取20微升,用于制作标准曲线。按照说明书配制缓冲液及工作液,37℃孵育30分钟,在450nm测定吸光度。
样品中总sod活力的计算:
抑制百分率=(空白对照1-样品)/(空白对照1-空白对照2)×100%
待测样品中sod酶活力单位=抑制百分率/(1-抑制百分率)units
得到各个样品对细胞内sod酶活力均有提高效果,且各个比例的沙棘原花青素与vc的复配物作用均明显大于两样品单独作用。且由7的联合指数值可以得到,各个配比下的复配物均对细胞抗氧化酶的活性提升具有协同作用。
(4)gsh含量测定:采用碧云天公司的总谷胱甘肽检测试剂盒(产品编号s0052)。蛋白定量为1mg/ml,将gsh标准品配制成2、5、10、15、25、50μm(即nmol/ml),标准品及样品各吸收10μl,加入150微升总谷胱甘肽检测工作液和nadph溶液,25℃孵育25分钟,在412nm测定吸光度。根据标准曲线计算各组gsh含量。
得到各个样品对细胞内gsh含量均有提高效果,且各个比例的沙棘原花青素与vc的复配物作用均明显大于两样品单独作用。且由图9的联合指数值可以得到,各个配比下的复配物均对细胞内抗氧化物的含量提升具有强协同作用。
以上已将本发明做一详细说明,以上所述,仅为本发明之较佳实施例而已,当不能限定本发明的实施范围,即凡依本申请范围所作均等变化与修饰,皆应仍属本发明涵盖范围内。
- 还没有人留言评论。精彩留言会获得点赞!