NBP158及其用途的制作方法
糖尿病的流行病学、病理生理学和治疗
糖尿病(Diabetic Mellitus,DM)是以由胰岛素之产生、胰岛素之作用或这二者的缺陷引起的高水平血糖为标志的一组疾病。DM可导致严重的并发症和过早死亡。2010年,DM在美国影响2580万各年龄的人,包括1880万人已被诊断且700万人尚未被诊断。基于空腹血糖水平或血红蛋白A1C水平,65岁以上成年人中的50%患有前驱糖尿病(prediabetes)。DM是肾衰、非创伤性下肢截肢和新发成人失明(blindness)病例的首要原因,是心脏病和卒中(stroke)的主要原因,并且是美国第七位的致死原因。
1型DM或胰岛素依赖型糖尿病(insulin-dependent diabetes mellitus,IDDM)在患者的免疫系统破坏胰腺细胞(产生胰岛素的唯一细胞)时发生。2型DM或非胰岛素依赖型糖尿病(non-insulin-dependent diabetes mellitus,IDDM)始于胰岛素抵抗(其中细胞不适当地使用胰岛素的疾病)。随着对胰岛素之需求的提高,胰腺逐渐丧失其产生胰岛素的能力。妊娠糖尿病是在妊娠期间诊断出的葡萄糖不耐受(glucose intolerance)形式。其他类型的DM由特定遗传病症、外科手术、用药、感染、胰腺疾病等疾病引起。
目前的针对DM的治疗和处理包括患者教育、自我护理练习、饮食、胰岛素和降低血糖水平的口服用药。患有1型DM的患者必须接受胰岛素注射。对于2型DM,通过血糖控制、血压控制、血脂控制预防并发症,以及对眼、足和肾的预防性护理是非常重要的。对于早期2型DM患者,健康的饮食计划和锻炼计划、降低过重体重和口服用药可使其血糖水平处于控制之下。但是对于晚期2型DM患者,口服用药和胰岛素二者是必需的。高剂量的胰岛素抑制胰腺产生内源性胰岛素,且这可能不降低血糖水平,因为在许多患有2型DM的患者中存在胰岛素抵抗。
病理生理学研究显示,提高的胰岛素抵抗和不充足的胰岛素分泌是2型糖尿中高血糖状态的主要基础原因。胰岛素抵抗在诊断前通常已经存在,表现为抑制的肝中响应于胰岛素的葡萄糖产生和降低的对葡萄糖转运到肌肉和脂肪组织中的刺激。然而,只要β细胞分泌较高量的胰岛素,正常血糖可以维持。最终,胰岛素水平由于降低的β细胞数量及其降低的分泌能力而降低。
血糖控制的总体目标是使长期并发症尽最小化,同时避免严重的低血糖事件。血糖控制的目标是保持糖化血红蛋白水平低于7.0%。目前可用的口服降糖药包括改善胰岛素敏感性的药剂,例如二甲双胍;噻唑烷二酮类(吡格列酮和罗格列酮);提高循环胰岛素水平的药剂,例如磺酰脲类(例如,格列吡嗪、格列本脲等);美格列奈类(例如,瑞格列奈、那格列奈);GLP-1受体激动剂(例如,艾塞那肽、利拉鲁肽),以及二肽基肽酶IV(Dipeptidyl peptidase IV,DPP-IV)抑制剂(例如,西格列汀、沙格列汀);其他药剂,例如α-葡糖苷酶抑制剂(例如,阿卡波糖、米格列醇)、胆汁酸螯合剂(例如,考来维仑)、多巴胺激动剂(例如,溴隐亭)、胰淀素(amylin)模拟物(例如,普兰林肽)。在临床上显著高血糖(血糖水平>300mg/dl或16.7mmol/l;糖化血红蛋白水平>10%)的患者中,应当开始胰岛素治疗。低血糖和体重增长是长期使用胰岛素的主要问题。
总之,患有2型DM的患者中的血糖控制至关重要,然而,目前的口服和注射用药远非最终的选择。需要通过独特机制起效的新降糖剂来更好地治疗或者甚至治愈2型DM。
FGFBP3的生理学和生物化学
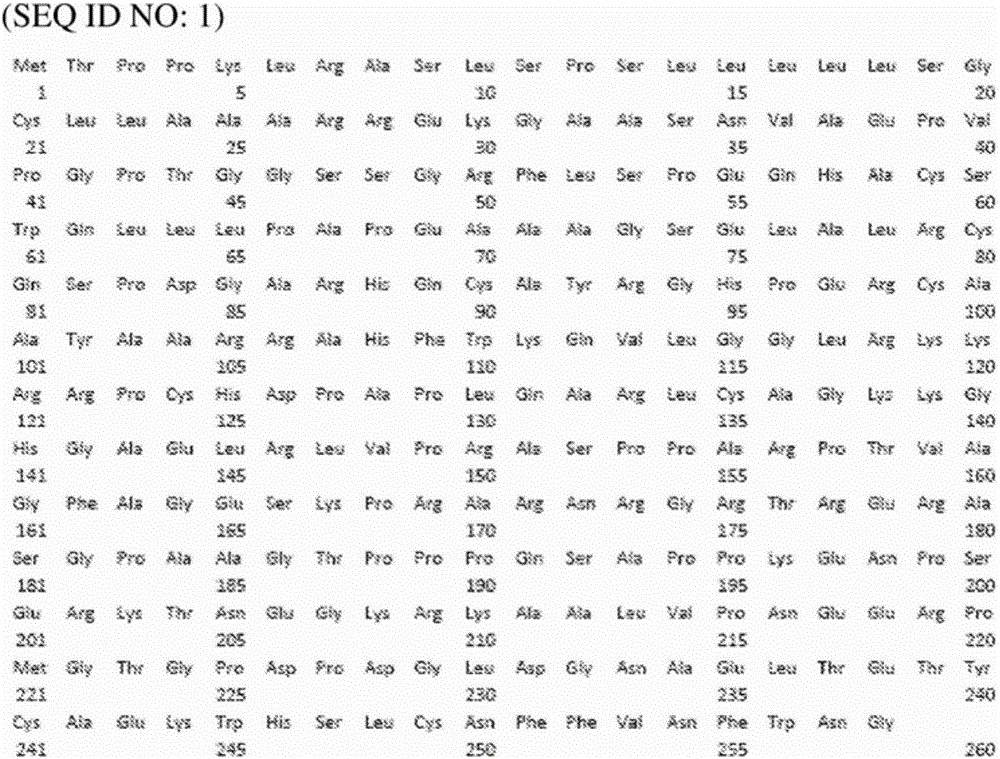
FGFBP3是FGF结合蛋白家族(FGFBP1、FGFBP2和FGFBP3)的成员。人FGFBP3前体(登录号NP_689642、RefSeq NM_152429.4、CCDS ID7418.1)由图1(SEQ ID NO:1)中的具有26个残基长度的信号肽(1-26位氨基酸)和232个残基长度的分泌肽(27-258位氨基酸)的258个氨基酸组成。编码人FGFBP3的DNA可获自从具有FGFBP3mRNA并以可检出的水平表达它的许多组织(例如脑、结肠、肝、肺等)制备的cDNA文库。
旁分泌/自分泌因子(例如FGF1和FGF2)由于高结合亲和力3通过硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)结合(sequester)至细胞外基质和细胞表面。由于低结合亲和力,内分泌因子(例如FGF19、FGF21和FGF23)可在循环中经过很长距离。如果在没有外源性FGF的情况下施用,FGFBP家族蛋白(FGFBP1、FGFBP2和FGFBP3)在体外或在体内并不活化FGF信号传送途径。在外源性FGF存在下,FGFBP蛋白显著增强FGF信号传送。FGFBP3与旁分泌/自分泌FGF(例如FGF1和FGF2)或内分泌FGF(例如FGF19、FGF21和FGF23)结合。由于FGF及其受体参与许多癌细胞系和原发肿瘤的增殖和进展,FGFBP3作为长期施用之药物的一个主要问题是促分裂可能性(mitogenic potential)。例如,FGFBP3以高亲和力与FGF19结合,所述FGF19在骨骼肌中表达人FGF19的转基因小鼠中诱导肝细胞癌(hepatocellular carcinoma,HCC)的发生。最近,FGF19中和抗体已被用于在FGF19转基因小鼠中预防部分地通过抑制β-联蛋白(β-catenin)信号传送介导的HCC发生,这进一步确证了FGF19在HCC进展中的作用。
成纤维细胞生长因子结合蛋白3(Fibroblast growth factor binding protein 3,FGFBP3)在体外还自身与肝素以高亲和力结合,但在FGF2存在下,以低亲和力结合。然而,FGFBP3与HSPG在体内的结合亲和力是未知的。最近的研究表明,FGFBP3可局部地和全身性地发挥功能作用。在鸡胚中,发现FGFBP3通过活化旁分泌/自分泌FGF信号传送来提高脑中的血管通透性;在基因敲除小鼠模型中,FGFBP3通过独特的信号传送途径在焦虑相关行为的调节中发挥关键作用。初步的表型数据还提供了在FGFBP3缺失(-/-)小鼠中瘦体重(lean body mass)降低的证据,这表明FGFBP3可以内分泌的方式参与能量代谢(fuel metabolism)的调节。
发明概述
本项发明提供了新的治疗性蛋白质和新的用于治疗代谢性疾病和病症(包括糖尿病和肥胖症)的方案。所述治疗性蛋白质包括分泌型(secreted)人成纤维细胞生长因子结合蛋白3(FGFBP3)和分泌型FGFBP3的N端158个氨基酸(NBP158)。
在一个实施方案中,本发明提供了合成的核酸分子,其包含编码人FGFBP3蛋白突变体(NBP158)的DNA。
在一方面中,所述合成的核酸分子包含与(a)编码具有1至约184或27至约184位氨基酸残基序列(包括图1(SEQ ID NO:1))的人FGFBP3多肽N端158个氨基酸(NBP158)的DNA分子或(b)(a)的DNA分子的互补物(complement)具有至少75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的DNA。
在另一方面中,本发明提供了包含编码NBP158或其变体的DNA的载体。所述载体可包含上文中定义的任何合成的核酸分子。还提供了包含这样的载体的宿主细胞。例如,所述宿主细胞可以是CHO细胞、大肠杆菌(E.coli)或者酵母。还提供了用于产生NBP158多肽的方法,包括在适于表达NBP158的条件下培养宿主细胞并从细胞培养物中回收NBP158。
在另一方面中,本发明提供了由上文中定义的任何合成的核酸序列编码的重组NBP158多肽。NBP158多肽由具有与(a)1至约184或(b)27至约184位氨基酸残基序列(包括图1(SEQ ID NO:1))具有至少75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列的肽组成。
在另一个实施方案中,本发明提供了组合物,其包含与可药用载体组合的人FGFBP3多肽或者上文中所定义的人FGFBP3突变体多肽(NBP158)。在一方面中,所述组合物包含治疗有效剂量的FGFBP3或NBP158。优选地,所述组合物是无菌的。
在另一个实施例中,本发明提供了在哺乳动物中治疗糖尿病的方法,其包括腹膜内、静脉内、皮下或肌内将上文中所定义的药物组合物全身性递送到哺乳动物中。
在另一个实施方案中,本发明提供了在哺乳动物中治疗肥胖症的方法,其包括腹膜内、静脉内、皮下或肌内将上文中所定义的药物组合物全身性递送到哺乳动物中。
在另一个实施方案中,本发明涉及用于治疗血脂异常和代谢性疾病并发症的方法,其包括腹膜内、静脉内、皮下或肌内将上文中所定义的药物组合物全身性递送到哺乳动物中。
附图简述
图1,人FGFBP3的氨基酸序列(SEQ ID NO:1)。
图2,人FGFBP3蛋白(未标记)在CHO细胞中的表达。A、B,来自转染有人FGFBP3表达载体(72小时)的CHO细胞的上清液中分泌型人FGFBP3(27-158位氨基酸)通过考马斯蓝(Coomassie Blue)染色示出(A)并且通过对FGFBP3的免疫印迹(immunoblotting,IB)检测(B)。C,加载CHO细胞裂解物并进行对FGFBP3的免疫印迹以检测FGFBP3前体和分泌型FGFBP3肽二者。D,图A中所指示的蛋白质样品通过质谱法进行分析,并且通过LC/MS鉴定分泌型人FGFBP3肽的100%序列(如下划线所示)。
图3,人BP3的合成的66个残基长度的C末端尾部(CBD66,SEQ ID NO:1的193-258位氨基酸)的氨基酸序列和二硫键桥。
图4,FGFBP3处理对葡萄糖代谢的治疗效果不依赖于FGF信号传送。A,单次FGFBP3处理后2小时后,空腹血糖水平下降,并且葡萄糖耐量在15、30、60和120分钟时示出显著的改善(n=5)。B,用CBD 66单次处理后2小时后,在ob/ob小鼠中葡萄糖代谢未改善(n=5)。C,选择性FGFR抑制剂PD173074无法阻断FGFBP3的治疗效果(n=5,p<0.001)。(**,p<0.01;***,p<0.001)。D,FGFBP3在HepG2细胞中未活化Erk1/2信号传送。符号(**和***)表示FGFBP3处理之前(基线)和之后血浆葡萄糖水平的显著差异。
图5,通过氢/氘交换进行的分泌型人FGFBP3构象分析。FGFBP3不依赖于FGF21信号传送地改善葡萄糖耐量。(A、B)分泌型FGFBP3和CBD66的氘摄取。Y轴对应于整合到肽中的氘的实际量;并且X轴代表FGFBP3肽片段的氨基酸序列(-25-0,信号肽序列;1-232分泌型FGFBP3蛋白序列;167-232,C端66个氨基酸,CBD66)。无FGF21时FGFBP3(A)或CBD66(B)的氘摄取(----)与有FGF21时的氘摄取(----)进行比较。最显著的区别由黑框图出。(C、D)在肝素不存在下的FGFBP3(C)或CBD66(D)的氘摄取(----)与肝素存在下的氘摄取(----)进行比较。最显著的区别以示出。
图6,人FGFBP3突变体蛋白(NBP158)在CHO细胞中的表达。A,在转染有突变体FGFBP3表达载体的CHO细胞的条件化培养基中的分泌型人FGFBP3的N端158个氨基酸(NBP158,SEQ ID NO:1的27-184位氨基酸)通过考马斯蓝染色显示(A)。B,图A中所指示的蛋白质级分(fraction)通过质谱分析进行分析,并且通过LC/MS鉴定NBP158的100%序列(如下划线所示)。
图7,单次NBP158处理对ob/ob小鼠中葡萄糖代谢的时间过程。A,单次NBP158注射后2小时,葡萄糖耐量在处理之前和之后在60和90分钟时明显改善(n=6)。B,单次NBP158处理后24小时,空腹血糖没有降低,但是在30和60分钟时示出显著差异(n=6)。C,单次NBP158处理之后48小时,在120分钟时示出显著差异(n=6)(*,p<0.05;**,p<0.01;***,p<0.001)。D,单次NBP158处理之后2小时(n=8)、24小时(n=6)和48小时(n=5)ob/ob小鼠中葡萄糖代谢的改善。(*,p<0.05;**,p<0.01;***,p<0.001)。符号(*、**和***)表明NBP158处理之前(基线)和之后血浆葡萄糖水平的显著差异。
图8,单次NBP158处理对ob/ob小鼠中葡萄糖代谢的剂量响应。A-C,空腹血糖水平降低,并且葡萄糖耐量在15、30、60和120分钟时示出显著改善(n=6)(A),并且更大的作用见于0.5mg/kg(n=6)(B)和1mg/kg(n=6)(C)。D,腹膜内注射0.1mg/kg(n=6)、0.5mg/kg(n=6)或1.0mg/kg(n=6)NBP158之后DIO小鼠中空腹血糖水平的降低和葡萄糖耐量的改善。(*,p<0.05;**,p<0.01;***,p<0.001)。
图9,单次NBP158处理对饮食诱导的肥胖症(DIO)小鼠中葡萄糖代谢的急性效应。A,NBP158单次处理后2小时,空腹血糖水平降低且葡萄糖耐量在15、30、60、120和180分钟时示出显著改善(n=6)。B,腹腔内注射NBP158后,DIO小鼠中葡萄糖代谢的改善(n=6)。(*,p<0.05;**,p<0.01;***,p<0.001)。
图10,用NBP-158单次处理后饮食诱导的肥胖症(DIO)小鼠的体重改变。A,DIO小鼠(15-20周龄)用NBP158(n=5)或CBD66(n=5)处理。单次处理1周后,将小鼠称重,并将体重的改变在这些组之间进行比较。在CBD66处理组中,体重提高了(1.9±0.6克/只动物);在NBP158处理组,体重降低了(2.1±0.7克/只动物)。(p<0.05)。
发明详述
本发明提供了用于治疗代谢性疾病和病症(例如糖尿病(DM)和肥胖症)的组合物和方法。在一个实施方案中,本发明使用FGFBP3蛋白或FGFBP3突变体蛋白(包括人FGFBP3和NBP158)以实现对DM的治疗益处。本发明提供了新的多肽、核酸分子、载体和宿主细胞。本发明提供了使用新的多肽来降低空腹血糖并且改善DM中葡萄糖糖耐量的方法。本发明还提供了治疗糖尿病和肥胖症的最佳剂量、持续时间和施用途径。1.定义
本文中使用的术语“NBP158多肽”、“NBP158蛋白”和“NBP158”包括与SEQ ID NO:1的27至184或者1至184位残基的氨基酸序列具有至少75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的多肽。所述NBP158可通过重组和/或合成的方法来制备。
“NBP158突变体”意指任何非天然序列NBP158多肽,其为有活性的NBP158,如以下所定义,与图1(SEQ ID NO:1)中所示具有推导出的氨基酸序列的FGFBP3多肽的27至184或者1至184位氨基酸序列具有至少约80%氨基酸序列同一性。这样的FGFBP3突变体包括例如NBP158多肽,其中在图1(SEQ ID NO:1)的27至184或者1至184位残基序列的N端或C端以及在一个或更多个内部结构域内添加或缺失一个或更多个氨基酸残基。
“天然序列FGFBP3”包含与从自然界得到的FGFBP3具有相同氨基酸序列的多肽。这样的天然序列FGFBP3可以从自然界分离或者通过重组和/或合成的方式产生。术语“天然序列FGFBP3”特别地包括FGFBP3的天然的截断或者分泌形式(例如,细胞外结构域序列)、天然变体形式(例如,选择性剪接形式)和天然等位基因变体。在本发明的一个实施方案中,天然序列FGFBP3是成熟的或全长的天然序列FGFBP3,其包含图1(SEQ ID NO:1)的27至258(或者1至258)位氨基酸。
术语“多肽”和“蛋白质”可互换使用,是指由通过肽键连接的单链氨基酸残基构成的化合物。多肽或蛋白质可以(但不需要)包含非天然氨基酸和氨基酸衍生物。可被插入到蛋白质或多肽(包括本文中公开的嵌合多肽)中的非天然氨基酸的非限制性实例列表包括:氨基酸、高氨基酸(homoamino acid)、环状氨基酸和具有衍生化侧链的氨基酸。实例包括(L型或D型;缩写在括号内):对乙酰基苯丙氨酸、对叠氮基苯丙氨酸、对溴代苯丙氨酸、对碘代苯丙氨酸和对乙炔基苯丙氨酸、瓜氨酸(Cit)、高瓜氨酸(hCit)、Na-甲基瓜氨酸(NMeCit)、Na-甲基高瓜氨酸(Na-MeHoCit)、鸟氨酸(Om)、Na-甲基鸟氨酸(Na-MeOrn或NMeOrn)、肌氨酸(Sar)、高赖氨酸(hLys或hK)、高精氨酸(hArg或hR)、高谷氨酰胺(hQ)、Na-甲基精氨酸(NMeR)、Na-甲基亮氨酸(Na-MeL或NMeL)、N-甲基高赖氨酸(NMeHoK)、Na-甲基谷氨酰胺(NMeQ)、正亮氨酸(Nle)、正缬氨酸(Nva)、1,2,3,4-四氢异喹啉(Tic)、八氢吲哚-2-羧酸(Oic)、3-(1-萘基)丙氨酸(1-Nai)、3-(2-萘基)丙氨酸(2-Nai)、1,2,3,4-四氢异喹啉(Tic)、2-茚满基甘氨酸(Igi)、对碘代苯丙氨酸(pi-Phe)、对氨基苯丙氨酸(4AmP或4-Amino-Phe)、4-胍基苯丙氨酸(Guf)、甘氨酰赖氨酸(缩写为″K(NE-glycyl)″或″K(glycyl)″或″K(gly)″)、硝基苯丙氨酸(nitrophe)、氨基苯丙氨酸(aminophe或Amino-Phe)、苄基苯丙氨酸(benzylphe)、γ-羧基谷氨酸(γ-carboxyglu)、羟脯氨酸(hydroxypro)、对羧基苯丙氨酸(Cpa)、a-氨基已二酸(Aad)、Na-甲基缬氨酸(NMeVal)、N-a-甲基亮氨酸(NMeLeu)、Na-甲基正亮氨酸(NMeNle)、环戊基甘氨酸(Cpg)、环己基甘氨酸(Chg)、乙酰基精氨酸(acetylarg)、α二氨基丙酸(Dpr)、α,γ-二氨基丁酸(Dab)、二氨基丙酸(Dap)、环己基丙氨酸(Cha)、4-甲基苯丙氨酸(MePhe)、二苯基丙氨酸(Bi-PhA)、氨基丁酸(Abu)、4-苯基苯丙氨酸(或联苯丙氨酸;4Bip)、α-氨基异丁酸(Aib)、β-丙氨酸、β-氨基丙酸、哌啶酸、氨基己酸、氨基庚酸、氨基庚二酸、锁链素(desmosine)、二氨基庚二酸、N-乙基甘氨酸、N-乙基天冬酰胺、羟基赖氨酸、异羟基赖氨酸、异锁链素、别异亮氨酸、N-甲基甘氨酸、N-甲基异亮氨酸、N-甲基缬氨酸、4-羟基脯氨酸(Hyp)、γ-羧基谷氨酸、e-N,N,N-三甲基赖氨酸、E-N-乙酰基赖氨酸、0-磷酸丝氨酸、N-乙酰基丝氨酸、N-甲酰基甲硫氨酸、3-甲基组氨酸、5-羟基赖氨酸、w-甲基精氨酸、4-氨基-0-邻苯二甲酸(4APA),以及其他相似的氨基酸,以及特别地列出的这些中任一种的衍生化形式。
与NBP158序列相关的“氨基酸序列同一性百分比(%)”在本文中定义为,在序列比对并引入空位(如果必需的话)以实现最大百分比序列同一性之后(并且不考虑任何保守替换作为序列同一性的一部分),候选序列中与NBP158序列中的氨基酸残基相同的氨基酸残基百分比。本文中使用的%同一性值通过获自[NCBI,http://blast.ncbi.nlm.nih.gov/Blast.cgi]的DELTA-BLAST生成。DELTA-BLAST使用数个搜索参数,大多数设定为缺省值。可调整的参数设定为以下值:重叠跨度=1,重叠分数=0.125,单词阈值(T)=11。HSP S和HSP S2参数为动态值,并且由程序本身根据特定序列的构成和搜索目标序列的特定数据库的组成来设定;然而,可对值进行调整以提高敏感性。%氨基酸序列同一性值通过匹配的相同残基数目除以比对区域中“较长”序列的残基总数来确定。所述“较长”序列是在比对区域中具有最多实际残基的序列(忽略通过DELTA-BLAST引入以使比对得分最大化的空位)。
以类似的方式,与本文中鉴定的NBP158多肽的编码序列相关的“百分比(%)核酸序列同一性”定义为候选序列中的核苷酸残基与NBP158编码序列中的核苷酸残基相同的核苷酸残基的百分比。本文中使用的同一性值通过设定为缺省参数的BLASTN生成,其中重叠跨度和重叠分数分别设定为1和0.125。
当用于描述本文中公开的多种多肽时,“分离的”意指已从其天然环境的组分中鉴定并分离和/或回收的多肽。天然环境的污染组分是通常会干扰所述多肽的诊断或治疗用途的物质,并且可包括酶、激素和其他蛋白质性或非蛋白质性溶质。在一些优选的实施方案中,所述多肽将被纯化至(1)通过使用转杯式测序仪(spinning cup sequenator)足以获得至少15个N端或中间的氨基酸序列的程度,或者(2)通过使用考马斯蓝(或优选银)染色的在非还原性或还原性条件下的SDS-PAGE的均一性。分离的多肽包括在重组细胞内的原位多肽,因为FGFBP3天然环境中的至少一种组分将不存在。然而,分离的多肽通常将通过至少一个纯化步骤制备。
编码FGFBP3多肽的“分离的”核酸分子是从在FGFBP3编码核酸的天然来源中通常与其相关的至少一种污染核酸分子鉴定和分离的核酸分子。分离的FGFBP3编码核酸分子与其见于自然界中的形式或背景不同。因此,分离的FGFBP3编码核酸分子与天然细胞中存在的FGFBP3编码核酸分子不同。然而,分离的编码FGFBP3多肽的核酸分子包括包含在通常表达FGFBP3的细胞(其中,例如,所述核酸分子处于与天然细胞不同的染色体位置)中的FGFBP3编码核酸分子。
本文中所用的术语“载体”用于指用于向宿主细胞传递编码信息的任何分子(例如,核酸、质粒或病毒)。
本文中所用的术语“载体”是指适用于转化宿主细胞的载体,并且含有指导和/或控制所插入的异源核酸序列之表达的核酸序列。表达包括但不限于例如转录、翻译和RNA剪接(如果存在内含子的话)的过程。
术语“控制序列”是指在特定的宿主生物中表达可操纵地连接的编码序列所必需的DNA序列。例如,适用于原核生物的控制序列包括启动子、任选地操纵子序列、以及核糖体结合位点。已知真核细胞使用启动子、多聚腺苷酸化信号和增强子。
当核酸与另一核酸序列产生功能关联时,核酸被“可操纵地连接”。例如,如果前序列(presequence)或分泌前导序列的DNA作为参与多肽分泌的前体蛋白(preprotein)表达,则所述前序列或分泌前导序列的DNA与所述多肽的DNA可操纵地连接;如果启动子或增强子影响序列的转录,则所述启动子或增强子与编码序列可操纵地连接;或者核糖体结合位点如果处在便于翻译的位置,则所述核糖体结合位点与编码序列可操纵地连接。一般而言,“可操纵地连接”意味着被连接的DNA序列是邻近的,并且在分泌前导序列的情况下,是邻近的且在同一阅读框(reading phase)内。然而,增强子不一定必须是邻近的序列。连接通过在方便的限制性酶切位点的连接来完成。如果这样的位点不存在,根据常规实践使用合成的寡核苷酸衔接子(adaptor)或接头(linker)。
当在本文中使用时,术语“表位标记的”是指嵌合多肽,其包含与“标记多肽(tag polypeptide)”融合的NBP158多肽。适合的标记多肽一般具有至少6个氨基酸残基,并且通常为约8至50个氨基酸残基(优选地,约10至20个氨基酸残基)。
本文中使用的术语“宿主细胞”用于指已经被转化的细胞,或者能够用核酸序列转化并且然后能够表达选定的目的基因。该术语包括亲代细胞的后代,不论所述后代与原亲代在形态上或在基因构成上是否相同,只要所述选定的基因存在即可。
“活性的”或“活性”对于本文中的目的而言是指保持重组或合成的NBP158的生物学和/或免疫学活性的NBP158形式。优选地,活性是指促进葡萄糖代谢或者降低体重的能力。
“生物学活性”在可通过动物研究鉴定的蛋白质或其他分子的情况下用于指这样的蛋白或者其他分子改变体内生理学参数(例如血糖、血压、体温、体重等)的能力。
“治疗”是为了防止疾病的发生或者改变疾病的病理学而进行的干预。因此,“治疗”是指治疗性治疗和预防性或防止性措施。需要治疗者包括已经患病者和需要预防疾病发生者。在糖尿病治疗中,治疗剂可以直接降低空腹血糖水平或者改善糖耐量。
在本文中使用的术语“有效剂量”和“治疗有效剂量”均指本文中公开的嵌合多肽的量,其用于支持NBP158或其突变体多肽的可观察水平的一种或更多种生物活性,例如在人或非人对象中降低血糖、胰岛素、甘油三酯或胆固醇水平,降体重,或改善葡萄糖耐量、能量消耗或胰岛素敏感性的能力。
用于治疗目的的“哺乳动物”是指归类为哺乳动物的任何动物,包括人、家养和农场动物、以及动物园饲养的动物、用于体育的动物或者宠物动物,例如狗、马、猫、牛等。优选地,所述哺乳动物是人。
本文中使用的“载体”包括可药用的载体、赋形剂或者稳定剂,其在所使用的剂量和浓度下对暴露于它的细胞或哺乳动物无毒。通常来说,生理学上可接受的载体是水性pH缓冲溶液。生理学上可接受的载体包括:缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或者免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖或其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,例如EDTA;糖醇,例如甘露糖醇或山梨糖醇;成盐抗衡离子,例如钠离子;和/或非离子表面活性剂,例如TWEENTM、聚乙二醇(PEG)和PLURONICSTM。
与一种或更多种另外的治疗剂“组合”施用包括同时和以任何顺序先后施用。
2.本发明的组合物
a.人FGFBP3分泌多肽之N端158个氨基酸残基(NBP158)
本发明提供了合成的核苷酸序列,其编码在本申请中称为NBP158的多肽。特别地,已合成并优化了编码全长FGFBP3多肽(SEQ ID NO:1)的1至184位氨基酸的cDNA,如在下文中的实施例中进一步详细公开的。这184个氨基酸的开放阅读框被亚克隆到市售可得的载体中。NBP158作为没有C端表位标记的重组蛋白产生。未标记的NBP158蛋白从经质粒转染的CHO细胞中分泌出来,其编码全长FGFBP3多肽(SEQ ID NO:1)的27至184位氨基酸。
b.NBP158突变体多肽
除了本文中描述的NBP158多肽的全长或分泌序列之外,还考虑可制备NBP158突变体。可以通过向NBP158的DNA中引入合适的核苷酸改变,和/或通过合成期望的NBP158突变体多肽来制备NBP158突变体,如下文实施例中所述。本领域技术人员将理解,氨基酸的改变可以改变NBP158的翻译后过程,例如改变糖基化位点的数目或位置或者改变磷酸化位点。
全长序列NBP158中或者本文中所述的NBP158的多个结构域中的变异可使用已提出的保守和非保守突变的技术和指导来完成。变异可以是一个或更多个编码NBP158的密码子的替换、缺失或插入,其导致与(SEQ ID NO:1)的1至约184或27至约184位氨基酸残基相比NBP158氨基酸序列的改变。任选地,变异可以是在NBP158的一个或更多个结构域中将至少一个氨基酸用任何其他氨基酸替换。在决定哪个氨基酸残基可以被插入、替换或缺失而不不利地影响期望的活性的指导可通过对NBP158的序列与同源的已知蛋白质分子进行比较并将高同源性区域中进行的氨基酸序列改变的数目最小化而找到。氨基酸替换可以是将一个氨基酸用具有相似结构和/或化学特性的另一个氨基酸替换的结果,例如用丝氨酸来替换亮氨酸,即保守型氨基酸替换。插入或缺失可任选地在1至5个氨基酸的范围内。允许的变异可通过在序列中系统地进行氨基酸的插入、缺失或替换并且测试所得变体在体外测定中的活性来确定。
突变可使用本领域中已知的方法进行,例如寡核苷酸介导的(位点定向)诱变、丙氨酸扫描和PCR诱变。可对克隆的DNA进行位点定向诱变、盒式诱变(cassette mutagenesis)、限制性选择诱变或其他已知技术来产生NBP158突变体。也可采用DNA扫描氨基酸分析以沿连续的序列鉴定一个或更多个氨基酸。在优选的扫描中,氨基酸相对较小,即中性氨基酸。这样的氨基酸包括丙氨酸、甘氨酸、丝氨酸和半胱氨酸。丙氨酸通常是该组中优选的扫描氨基酸,因为它去掉了除了β-碳之外的侧链,且不太可能改变突变体的主链构象。通常首选丙氨酸还因为它是最常见的氨基酸。此外,它经常存在于被包埋的和暴露的位置。如果丙氨酸替换不产生足够数量的变体,可使用电子等排氨基酸(isosteric amino acid)。
c.多肽的表达和检测
以下描述主要涉及通过培养用含有NBP158核酸的载体转化或转染的细胞来产生NBP158。当然,考虑可使用本领域中公知的替代方法来制备NBP158。例如,NBP158序列或其一部分可以通过使用固相技术的直接肽合成产生。体外蛋白质合成可使用手动技术或通过自动化来进行。自动合成可例如用Applied Biosystems肽合成仪(Foster City,Calif.)使用制造商的使用手册来完成。NBP158的各部分可分别化学合成并使用化学或酶学方法组合以产生全长的NBP158。
宿主细胞用本文中所述的表达或克隆载体转染或转化用于产生NBP158,并将其在经合适的修饰以用于诱导启动子、选择转化子或者扩增编码期望序列之基因的常规营养介质中培养。培养条件(例如介质、温度、pH等)可由有经验的技术人员无需过多实验而选择。一般来说,用于使细胞培养生产率最大化的原则、方法步骤和实际技术可见于Mammalian Cell Biotechnology:A Practical Approach,M.Butler,ed.(IRL Press,1991)和Sambrook et al.,(同上)。
转染的方法是普通技术人员已知的,例如,CaPO4和电穿孔。根据所使用的宿主细胞,使用适于这样的细胞的标准技术进行转化。采用氯化钙的钙处理(如Sambrook et al.,(同上)中所述)或电穿孔通常用于原核生物或包含坚固细胞壁屏障的其他细胞。以土壤农杆菌(Agrobacterium tumefaciens)感染用于转化某些植物细胞,如Shaw et al.,Gene,23:315,(1983)所述。对于没有这样的细胞壁的哺乳动物细胞,可使用Graham and Van Der Eb,Virology,52:456-457,(1978)的磷酸钙沉淀法。已描述哺乳动物细胞宿主系统转化的一般方面。向酵母中转化通常按照Van Solingen et al.,J.Bact.,130:946,(1977)和Hsiao et al.,Proc.Natl.Acad.Sci.(USA),76:3829,(1979)的方法进行。然而,也可使用用于将DNA引入到细胞中的其他方法,例如通过核显微注射、电穿孔、细菌原生质体与完整细胞融合、或聚阳离子(例如聚凝胺(polybrene)、聚鸟氨酸(polyornithine))。对于用于转化哺乳细胞的多种技术,参见Keown et al.,Methods in Enzymology,185:527-537(1990)和Mansour et al.,Nature,336:348-352(1988)。
本文中用于克隆或表达载体中的DNA的合适宿主细胞包括原核生物、酵母或高等真核细胞。合适的原核生物包括但不限于真细菌,例如革兰氏阴性或革兰氏阳性生物,例如肠杆菌科(Enterobacteriaceae),例如大肠杆菌。多种大肠杆菌菌株是可公开获得的,例如大肠杆菌K12菌株MM294(ATCC 31,446);大肠杆菌X1776(ATCC 31,537);大肠杆菌菌株W3110(ATCC 27,325)和K5772(ATCC 53,635)。除了原核生物,真核微生物(例如丝状真菌或酵母)也是FGFBP3编码载体的合适克隆或表达宿主。酿酒酵母(Saccharomyces cerevisiae)是常用的低等真核宿主微生物。
用于表达糖基化NBP158的合适宿主细胞来自于多细胞生物。无脊椎动物细胞的实例包括昆虫细胞(例如果蝇S2和夜蛾Sf9),以及植物细胞。可用的哺乳动物宿主细胞系的实例包括中国仓鼠卵巢(CHO)细胞和COS细胞。更具体的实例包括:以SV40转化的猴肾CVI系(COS-7,ATCC CRL 1651);人胚肾系(293或亚克隆用于在悬浮培养中生长的293细胞,Graham et al.,J.Gen Viral.,36:59(1977));中国仓鼠卵巢细胞/-DHFR;小鼠睾丸支持细胞(TM4);人肺细胞(W138,ATCC CCL 75);人肝细胞(Hep G2,HB 8065);以及小鼠乳腺肿瘤细胞(MMT060562,ATCC CCL51)。合适宿主细胞的选择被认为是本领域现有技术。
编码NBP158的核酸(例如,cDNA或基因组DNA)可以插入到用于克隆(DNA的扩增)或用于表达的可复制载体。多种载体是可公开获得的。所述载体可以是例如质粒、黏粒、病毒颗粒或噬菌体的形式。合适的核酸序列可以通过多种方法插入到载体中。一般来说,使用本领域中已知的技术将DNA插入到适当的限制性内切酶位点。载体构件通常包括但不限于:一个或更多个信号序列、复制起点、一个或更多个标记基因、增强子元件、启动子和转录终止序列。含有这些构件中的一种或更多种的合适载体的构建采用技术人员已知的标准连接技术。
NBP158不仅可以直接重组产生,也可作为与异源多肽的融合多肽重组产生,所述异源多肽可以是信号序列或者在成熟蛋白质或多肽的N端具有特异性切割位点的其他多肽。一般而言,信号序列可以是载体的构件,或者它可以是插入到载体中的NBP158编码DNA的一部分。所述信号序列可以是选定的原核信号序列,其例如选自碱性磷酸酶、青霉素酶、lpp或热稳定的肠毒素II前导序列。为了在酵母中分泌,所述信号序列可以是酵母转化酶前导序列、α因子前导序列(包括酵母属和克鲁维酵母属α-因子前导序列)、或酸性磷酸酶前导序列、白色念珠菌(C.albicans)葡萄糖淀粉酶前导序列(1990年4月4日公布的EP 362,179),或者在1990年11月15日公布的WO 90/13646中描述的信号。在哺乳动物细胞表达中,哺乳动物信号序列可以用于指导蛋白质的分泌,例如来自相同或相关物种的分泌型多肽的信号序列,以及病毒分泌前导序列。
表达载体和克隆载体都包含核酸序列,其使载体能够在一种或更多种选择的宿主细胞中复制。这样的序列对于多种细菌、酵母和病毒是公知的。来自质粒pBR322的复制起点适用于大多数革兰氏阴性细菌,2fA质粒起点适用于酵母,且多种病毒起点(SV40、多瘤病毒、腺病毒、VSV或BPV)可用于哺乳动物细胞中的克隆载体。
表达载体和克隆载体将通常包含选择基因,也称为选择标志。典型的选择基因编码这样的蛋白质,其(a)赋予对抗生素或其他毒素(例如氨苄青霉素、新霉素、甲氨蝶呤或四环素)的抗性;(b)补足营养缺陷型缺陷;或(c)供应不能从复合培养基中得到的关键营养物,例如,编码芽孢杆菌(Bacilli)D-丙氨酸消旋酶的基因。用于哺乳动物细胞的合适选择标记是能够鉴定细胞组分摄取FGFBP3编码核酸的那些,例如DHFR或胸苷激酶。在采用野生型DHFR时,合适的宿主细胞是如Urlaub et al.,Proc.Natl.Acad.Sci.USA,77:4216(1980)所述制备和繁殖的DHFR活性缺陷的CHO细胞系。用于酵母的合适选择基因是存在于酵母质粒YRp7中的trp1基因。trp1基因为缺乏在色氨酸中生长之能力的酵母突变株提供选择标志,例如,ATCC No.44076或PEP4-1[Jones,Genetics,85∶12(1977)]。
表达载体和克隆载体通常包含可操纵地与NBP158编码核酸序列连接的启动子以指导mRNA合成。被多种潜在宿主细胞识别的启动子是公知的。适用于原核宿主的启动子包括内酰胺酶和乳糖启动子系统,碱性磷酸酶、色氨酸(trp)启动子系统,以及杂合启动子(例如tac启动子)。用于细菌系统的启动子还将包含与编码NBP158的DNA可操纵地连接的Shine-Dalgarno(S.D.)序列。
适用于与酵母宿主一起使用的合适启动序列的实例包括用于以下的启动子:3-磷酸甘油酸激酶或其他糖酵解酶,例如烯醇酶、甘油醛-3-磷酸脱氢酶、己糖激酶、丙酮酸脱羧酶、磷酸果糖激酶、葡萄糖-6-磷酸异构酶、3-磷酸甘油变位酶、丙酮酸激酶、磷酸丙糖异构酶、磷酸葡萄糖异构酶和葡糖激酶。
其他酵母启动子(其为具有通过生长条件控制的转录的额外优势的诱导型启动子)为用于以下的启动子区域:醇脱氢酶2、异细胞色素C、酸性磷酸酶、与氮代谢相关的降解酶、金属硫蛋白、甘油醛-3-磷酸脱氢酶、以及负责利用麦芽糖和半乳糖的酶。用于酵母表达的合适的载体和启动子在EP 73,657中进一步描述。
哺乳动物宿主细胞中NBP158从载体的转录受到例如以下启动子的控制:从病毒基因组获得的启动子,所述病毒例如多瘤病毒、禽痘病毒(1989年7月5日公布的UK 2,211,504)、腺病毒(例如腺病毒2)、牛乳头状瘤病毒、禽肉瘤病毒、巨细胞病毒、逆转录病毒、乙肝病毒和猿猴病毒40(SV40);从异源哺乳动物启动子获得的启动子,例如肌动蛋白启动子或免疫球蛋白启动子;以及从热休克启动子获得的启动子;只要这样的启动子与宿主细胞系统相容即可。
编码NBP158的DNA通过高等真核生物的转录可通过在载体中插入增强子序列而提高。增强子是DNA的顺式作用元件(通常为约10至300bp),其作用于启动子以提高其转录。现在已知许多增强子序列来自哺乳动物基因(球蛋白、弹性蛋白酶、白蛋白、甲胎蛋白和胰岛素)。然而,人们通常会使用来自真核细胞病毒的增强子。实例包括在复制起点晚期侧(late side)的SV40增强子(bp 100-270)、巨细胞病毒早期启动子增强子、在复制起点的晚期侧的多瘤病毒增强子、以及腺病毒增强子。增强子可被剪接到载体中,位于FGFBP3编码序列5′或3′侧的位置,但优选位于启动子5′侧的位点。
在真核宿主细胞(酵母、真菌、昆虫、植物、动物、人或来自其他多细胞生物的有核细胞)中使用的表达载体将也可包含用于终止转录和用于稳定mRNA的必需序列。这样的序列通常可获自真核或者病毒DNA或cDNA的5′侧(以及偶尔3′端)非翻译区。这些区域包含在编码FGFBP3的mRNA的非翻译部分中作为聚腺苷酸化片段转录的核苷酸区段。
适用于适应在重组脊椎动物细胞培养中合成NBP158的另一些方法、载体和宿主细胞描述于Gething et al.,Nature,293:620-625(1981);Mantei et al.,Nature,281:40-46(1979);EP 117,060;以及EP 117,058。
基于本文中所提供的序列,基因扩增和/或表达可使用适当标记的探针在样品中直接测量,例如,通过常规的Southern印迹、定量mRNA转录的Northern印迹、斑点印迹(DNA分析)或原位杂交。或者,可使用识别特异性双链体(包括DNA双链体、RNA双链体和DNA-RNA杂合双链体或DNA-蛋白质双链体)的抗体。继而,抗体可被标记,并且可在双链体与表面结合时进行测定,使得可在表面上形成双链体后检测与所述双链体结合之抗体的存在。
或者,基因表达可通过免疫学方法(例如细胞或组织切片的免疫组织化学染色以及细胞培养物或体液的测定)进行测量以直接定量基因产物的表达。可用于免疫组化染色和/或样品体液测定的抗体可以是单克隆或多克隆的,并且可在任何哺乳动物中制备。为方便起见,所述抗体可针对全序列NBP158多肽或针对基于本文中提供的DNA序列的合成多肽或者针对与NBP158 DNA融合并且编码特定抗体表位的外源序列来制备。
d.多肽的纯化
NBP158的形式可从培养基或从宿主细胞裂解物中回收。如果是膜结合的,可使用合适的去污剂溶液(例如Triton-X100)或通过酶促切割从膜上释放。在NBP158表达中所采用的细胞可通过多种物理或化学手段来破坏,例如冻融循环、超声处理、机械破碎或细胞裂解剂。
可期望从重组细胞蛋白质或多肽中纯化NBP158。以下过程是示例性的合适纯化过程:通过在离子交换柱上分级分离;乙醇沉淀;反相HPLC;在硅胶上或在阳离子交换树脂(例如DEAE)上进行的色谱;色谱聚焦;SDS-PAGE;硫酸铵沉淀;使用例如Sephadex G-75的凝胶过滤;除去污染物(例如IgG)的蛋白A琼脂糖凝胶柱;以高结合亲和力纯化NBP158的肝素柱;以及结合NBP158的表位标记形式的金属螯合柱。可采用多种蛋白质纯化方法,且此类方法是本领域中已知的并且描述于例如Deutscher,Methods in Enzymology,182(1990);Scopes,Protein Purification:Principles and Practice,Springer-Verlag,New York(1982)。选择的纯化步骤将取决于例如所使用的产生方法的性质和所产生的特定NBP158。
3.NBP158和NBP158突变体的用途
a.药物组合物
可以药物组合物的形式施用NBP158多肽以及NBP158突变体用于治疗代谢性疾病和病症,包括DM和肥胖症。
通过将具有期望纯度的多肽与任选的本领域中通常采用的“可药用”或“生理学上可接受的”载体、赋形剂或稳定剂(其均称为“赋形剂”)混合制备多肽的治疗性制剂用于作为冻干制剂或水溶液保存。例如,缓冲剂、稳定剂、防腐剂、渗透压平衡剂(isotonifier)、非离子洗涤剂、抗氧化剂和其他杂项添加剂(miscellaneous additive)。(见Remington′s Pharmaceutical Sciences,16th edition(or later),A Osol,Ed.(1980))。这样的添加剂在所采用的剂量和浓度下对接受者必须是无毒的。
缓冲剂有助于维持近似生理条件范围内的pH。其优选以约2mM至约50mM的浓度存在。用于本发明中使用的合适的缓冲剂包括有机和无机酸及其盐。例如,柠檬酸盐缓冲剂(例如,柠檬酸一钠-柠檬酸二钠混合物、柠檬酸-柠檬酸三钠混合物、柠檬酸-柠檬酸一钠混合物等)、琥珀酸盐缓冲剂(例如,琥珀酸-琥珀酸一钠混合物、琥珀酸-氢氧化钠混合物、琥珀酸-琥珀酸二钠混合物等)、酒石酸盐缓冲剂(例如,酒石酸-酒石酸钠混合物、酒石酸-酒石酸钾混合物、酒石酸-氢氧化钠混合物等)、富马酸盐缓冲剂(例如,富马酸-富马酸一钠混合物等)、富马酸盐缓冲剂(例如,富马酸-富马酸一钠混合物、富马酸-富马酸二钠混合物、富马酸一钠-富马酸二钠混合物等)、葡糖酸盐缓冲剂(例如,葡糖酸-葡糖酸钠混合物、葡糖酸-氢氧化钠混合物、葡糖酸-葡糖酸钾混合物等)、草酸盐缓冲剂(例如草酸-草酸钠混合物、草酸-氢氧化钠混合物、草酸-草酸钾混合物等)、乳酸盐缓冲剂(例如,乳酸-乳酸钠混合物、乳酸-氢氧化钠混合物、乳酸-乳酸钾混合物等)和乙酸盐缓冲剂(例如,乙酸-乙酸钠混合物、乙酸-氢氧化钠混合物等)。另外,也可以采用磷酸盐缓冲剂、组氨酸缓冲剂和三甲胺盐(例如Tris)。
添加防腐剂以延迟微生物的生长,并且以0.2%-1%(w/v)的量添加。用于本发明中使用的合适的防腐剂包括酚、苯甲醇、间甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、十八烷基二甲基苄基氯化铵、苯扎卤铵(例如,苯扎氯铵、苯扎溴铵、苯扎碘铵)、六甲氯铵(hexamethonium chloride)、对羟基苯甲酸烷基酯(例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、儿茶酚、间苯二酚、环己醇和3-戊醇。
存在渗透压平衡剂(有时被称为“稳定剂”)以确保本发明液体组合物的等渗性,所述渗透压平衡剂包括多羟基糖醇,优选三羟基或更多羟基的糖醇,例如甘油、赤藓醇、阿糖醇、木糖醇、山梨醇和甘露糖醇。考虑到其他成分的相对量,多羟基醇可以按重量计0.1%至25%、优选1%至5%的量存在。
稳定剂是指功能范围可从填充剂(bulking agent)到使治疗剂增溶或有助于阻止变性或附着于容器壁的添加剂的一大类赋形剂。典型的稳定剂可以是多羟基糖醇(上文中列举);氨基酸,例如精氨酸、赖氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、丙氨酸、鸟氨酸、L-亮氨酸、2-苯基丙氨酸、谷氨酸、苏氨酸等;有机糖或糖醇,例如乳糖、海藻糖、水苏糖、甘露糖醇、山梨糖醇、木糖醇、核糖醇、肌肌醇(myoinisitol)、半乳糖醇、甘油等,包括环多醇(cyclitol),例如肌醇(inositol);聚乙二醇;氨基酸聚合物;含硫还原剂,例如尿素、谷胱甘肽、硫辛酸、巯基乙酸钠、硫代甘油、氨基硫代甘油和硫代硫酸钠;低分子量多肽(即<10个残基);蛋白质,例如人血清白蛋白、牛血清白蛋白、明胶或免疫球蛋白;亲水聚合物,例如聚乙烯吡咯烷酮;单糖,例如木糖、甘露糖、果糖、葡萄糖;二糖,例如乳糖、麦芽糖、蔗糖;以及三糖,例如棉子糖;多糖,例如葡聚糖。稳定剂可以活性蛋白质重量的0.1至10,000重量份存在。
存在非离子表面活性剂或去污剂(也称作“湿润剂”)以有助于使治疗剂增溶以及保护治疗性蛋白质免受搅动诱导的聚集,这也允许制剂暴露于受到应力的剪切表面而不引起蛋白质变性。合适的非离子表面活性剂包括聚山梨醇酯(20、80等)、泊洛沙姆(184、188等)、多元醇、聚氧乙烯失水山梨醇单醚(等)。非离子表面活性剂以约0.05mg/ml至约1.0mg/ml,优选约0.07mg/ml至约0.2mg/ml的范围存在。额外的杂项赋形剂包括填充剂(例如淀粉)、螯合剂(例如EDTA)、抗氧化剂(例如,抗坏血酸、甲硫氨酸、维生素E)和潜溶剂。
本文中的制剂也可含有多于一种对于被治疗的特定适应证所必需的活性化合物,优选具有不彼此不利地影响的互补活性的那些。例如,可希望进一步提供免疫抑制剂。这样的分子在组合中以有效用于期望目的的量合适地存在。
活性成分也可以包埋在微胶囊中,所述微胶囊例如通过凝聚技术或通过界面聚合(分别例如羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)在胶体药物递送系统(例如,脂质体、白蛋白微球、微乳剂、纳米颗粒和纳米胶囊)或在粗乳液中制备。这样的技术在Remington′s Pharmaceutical Sciences,第16th版(或更晚的版本),A Osal,Ed.(1980)中公开。
待用于体内施用的制剂必须是无菌的。这可很容易地例如通过无菌滤膜过滤来实现。
可制备缓释制剂。缓释制剂的合适实例包括含有FGFBP3多肽突变体的固体疏水性聚合物的半透性基质,所述基质为成型制品(例如薄膜或微胶囊)的形式。缓释基质的实例包括聚酯、水凝胶(例如,聚(甲基丙烯酸2-羟基乙基酯)或聚(乙烯醇))、聚交酯、L-谷氨酸与L谷氨酸乙酯的共聚物、不可降解的乙烯乙酸乙烯酯的共聚物、可降解的乳酸-乙醇酸共聚物(例如,(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林构成的可注射微球)),以及聚-D-(-)-3-羟基丁酸。虽然聚合物(例如乙烯-乙酸乙烯酯和乳酸-乙醇酸)使得能够释放分子超过100天,但是某些水凝胶释放蛋白质的时间较短。当包封的抗体在体内保持很长时间,它们可由于在37℃下暴露于潮湿而可变性或聚集,导致生物学活性的丧失和可能的免疫原性改变。根据所涉及的机制可设计用于稳定化的理性策略。例如,如果发现聚集机制是通过硫基-二硫化物互换的分子间S-S键形成,那么稳定化可通过修饰巯基残基、从酸性溶液中冻干、控制含水量、使用适宜添加剂和开发特定的聚合物基质组合物来实现。
通过本发明的筛选测定鉴定的非蛋白质化合物可以类似的方式使用本领域中公知的标准技术来配制。
b.治疗方法
本发明的试剂(例如NBP158蛋白或NBP158突变体)根据已知的方法(例如作为推注的静脉内施用或通过一段时间的连续输液,通过肌内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、经口、局部(topical)或吸入途径)向哺乳动物(优选人)施用。优选多肽的静脉内施用。为预防或治疗疾病,试剂(例如本文中的蛋白质)的适当剂量将取决于待治疗的疾病类型(如上文中所定义)、疾病的严重程度和病程、施用试剂是预防性或治疗性目的、先前的治疗、患者的临床病史和对试剂的响应、以及主治医师的判断。所述试剂一次性或在一系列治疗中向患者合适地施用。
将有效治疗特定疾病或病症的治疗性多肽或其片段的量将取决于疾病或病症的性质,并且可通过标准临床技术来确定。在可能的情况下,希望确定剂量-响应曲线,并且本发明的药物组合物先在体外测试,然后在于人中测试之前可用于动物模型系统。然而,基于本领域中的常识,有效地促进感觉神经元存活的药物组合物可提供约5至20ng/ml并且优选约10至20ng/ml的局部治疗剂浓度。
用于皮下施用的剂量方案可以从每月一次到每天一次,这取决于若干临床因,包括疾病的类型、疾病的严重程度、以及患者对治疗剂的敏感性。例如,根据疾病的类型和严重程度,约500ng/kg至100mg/kg(即0.0005-100mg/kg)的蛋白质为用于向患者施用的初始候选剂量,无论是例如通过一次或更多次分开施用,或者通过连续输液。典型的每日剂量范围可以是约1μg/kg至20mg/kg或更多,这取决于上述因素。对于数天或更长时间的重复施用,根据情况,持续治疗直至发生期望的疾病症状抑制。然而,其他剂量方案也是可用的。常规技术和测定很容易地监控该治疗进程。
在一个实施案例中,单独的NBP158对禁食的ob/ob小鼠的葡萄糖耐量产生即时效应。如图7A中所示,单独的单剂量FGFBP3在2小时处理之后显著降低在15、30、60、120和180分钟时的血清葡萄糖水平。最大药理学作用发生在单剂量的组合方案之后的2小时,持续至少24小时,并在2天后回到基线。
在另一个实施例中,NBP158改善了饮食诱导的肥胖症(DIO)小鼠(临床相关的糖尿病动物模型)的葡萄糖耐量。首先,用NBP158(0.5mg/kg)的单次处理显著降低空腹血糖水平并改善葡萄糖耐量,但单剂量的CBD66即使在高得多的剂量(1mg/kg至5mg/kg)下也没有作用。
如普通技术人员可以理解的,本发明药物组合物的最佳剂量和期望药物浓度可随所考虑的特定用途而改变。合适剂量或施用途径的确定完全在本领域普通技术人员能力范围内。动物实验提供了用于确定用于人治疗的有效剂量的可靠指导。物种之间有效剂量的缩放可以按照Mordenti,J.和Chappell,W.,″The use of interspecies scaling in toxicokinetics",Toxicokinetics and New Drug Development,Yacobi et al.,Eds,Pergamon Press,New York 1989,pp.42-96所制定的原则进行。
总之,NBP158多肽(人分泌型FGFBP3之N端的158个氨基酸)以剂量依赖性方式显著地降低了血浆葡萄糖水平,而且起效快(<2小时)且持续时间长(>24小时)。人分泌型FGFBP3蛋白不通过其C端FGF结合结构域CBD66改善葡萄糖代谢。FGFBP3的降糖作用独立于FGF信号传送。由于NBP158不与FGF结合,我们得出结论,NBP158治疗不太可能诱导癌症(例如,肝细胞癌(HCC))的发生。因此,NBP158对代谢性疾病(包括DM和肥胖症)而言是非常安全且有前途的治疗肽。
实施例
实施例1:人FGFBP3和分泌型人FGFBP3的N端158个氨基酸(NBP158)的氨基酸序列。
人成纤维细胞生长因子结合蛋白3前体(FGFBP3,登录号NP_689642、RefSeq NM_152429.4、CCDS ID7418.1)由258个氨基酸组成,其中具有图1(SEQ ID NO:1)中的26个残基长度(1-26位氨基酸)的信号肽和232个残基长度(27-258位氨基酸)的分泌肽。通过EMBOSS Water软件进行的人FGFBP3(NP_689642.3)BLAST搜索示出与小鼠FGFBP3(NP_114156)的57.6%同一性和67.6%相似性。疏/亲水性图(hydropathy plot)分析显示出在FGFBP3的N末端的一个强疏水性区域,并且使用SignalP 3.0 Server以位于26位氨基酸(A)与27位氨基酸(R)之间的切割位点预测到分泌信号序列。分泌型人FGFBP3的N端158个氨基酸片段(NBP-158)与肝素结合结构域(而非FGF结合结构域)重叠。NBP158的氨基酸序列是SEQ ID NO:1(图1)的27至184位。
实施例2:人FGFBP3蛋白(未标记)在CHO细胞中的表达。
在经含有无标记天然FGFBP3蛋白的表达载体转染的CHO细胞的上清液中仅发现分泌型人FGFBP3(图2,A、B)。在经转染的CHO细胞的裂解物中,发现人FGFBP3的前体和分泌肽分别以33kDa和27kDa的表观分子量迁移(图2,C)。为进一步分析FGFBP3蛋白,将表达外源性无标记人FGFBP3(图2A)的条件化培养基在4%-12%的NUPAGE凝胶上进行分离,并且用考马斯蓝对蛋白质进行染色。该级分中存在的主要蛋白质迁移的位置与免疫反应性FGFBP3相同(图2B)。在图A中的标出的蛋白质样品通过质谱法进行分析,并且通过LC/MS鉴定分泌型人FGFBP3肽的100%序列(以下划线示出)(图2D)。
实施例3:FGFBP3处理对葡萄糖代谢的治疗作用独立于FGF信号。
8周龄雄性ob/ob小鼠购自南京大学南京生物医学研究所(南京,中国)。动物在中山大学实验动物中心的GLP动物设施中饲养,并定期不限量地提供啮齿动物饲料(rodent chow)和水。动物实验经中山大学实验动物护理和使用委员会(Institutional Animal Care and Use Committee,IACUC)审查并批准。为确认FGFBP3的活性,我们用单剂量FGFBP注射ob/ob小鼠并且进行腹膜内葡萄糖耐量测试(intraperitoneal glucose tolerance test,IPGTT)。小鼠禁食过夜(16小时)。在开始实验之前,将动物称重以确定葡萄糖的注射量。IPGTT在安静的房间中进行,并将操作保持在最低限度以降低操作过程中的应激。推注葡萄糖(1g kg-1)到腹膜腔中(30%D-葡萄糖:H2O溶液),在0、15、30、60、120和180分钟时从尾尖取血样,并血糖水平用便携式葡萄糖计(S60,Yuwell)来测定。在未经任何处理时测量IPGTT基线,并将血浆葡萄糖水平与正常范围(空腹血糖<6.1mmol/L,2小时ipGTT血浆葡萄糖<7.8mmol/L)相比较。FGFBP3在早上(上午9:00)单次腹膜内(i.p.)注射施用。进行葡萄糖耐量测试并在测试后3-6周测量体重变化。
单次FGFBP3注射(0.5mg/kg)后2小时,葡萄糖耐量在处理之前和之后在60和90分钟时显著改善(n=5)(图4A)。为了评估内源性FGF在FGFBP3处理中的作用,我们向ob/ob小鼠中全身性递送了CBD66(FGFBP3的FGF结合结构域),然后在CBD66处理后2小时行ipGTT。空腹血糖没有下降,葡萄糖耐量也没有得到改善(图4B,n=5)。此外,给予ob/ob小鼠5mg/kg PD173074(p.o.)或20%的DMSO作为对照。PD173074没有阻断0.5mg/kg FGFBP3的降血糖效果(图4C,n=5,p<0.001),尽管它可以防止体内过表达FGFBP3而导致的脑血管通透性的提高。此外,没有外源性FGF时,FGFBP3处理无法活化HepG2细胞中的Erk1/2信号传送(图4D)。因为Erk1/2的磷酸化对所有的FGF信号传送途径都是必不可少的,所以这些结果表明,FGFBP3处理不通过FGF活化或内源性FGF信号传送改善葡萄糖稳态。
实施例4:通过氢/氘交换进行的分泌型人FGFBP3构象分析。
内分泌FGF的成员FGF21具有对代谢性疾病的治疗潜力3-7。FGF21模拟物的临床试验显示出强烈的降脂作用,但对葡萄糖稳态则显示出出人意料地适中的作用8。先前的研究表明,FGFBP3通过CBD66与内源性FGF缔合,并且在体内通过活化FGFR提高脑血管通透性1。为确认FGF21与FGFBP3的相互作用,我们通过氢-氘交换(H/D交换)质谱法(MS)分析了分泌型FGFBP3蛋白(-25-0,信号肽序列;1-232,分泌型FGFBP3蛋白质序列)和CBD66(167-232)的构象。
在此先简要描述氘标记和质谱分析。10mM磷酸钠、150mM NaCl(pH7.4)中的30μM蛋白质储备溶液(stock solution)用于实验。蛋白质的混合物FGFBP3-FGF21和CBD66-FGF21以1∶1的比例制备,并在4℃下温和搅拌孵育过夜。通过在25℃下用D2O缓冲液(10mM磷酸钠,pD 7.0)将储液稀释9倍(v/v)来起始H/D交换反应。对于零时间点,将样品用10mM磷酸钠缓冲液(pH 7.0)稀释。同位素交换反应在一小时后通过使用冰冷的100mM磷酸钠缓冲液(pH 2.3)进行1∶1稀释来猝灭,然后在线(online)进样到固定化胃蛋白酶柱(Applied Biosystem,Thermo,USA)中,随后使用具有用于超高效液相色谱仪(ultraperformance liquid chromatograph,UPLC)的HDX技术的Waters nanoACQUITY系统(Waters公司,美国)进行分离,并使用Waters Synapt-G2S HDMS质谱仪(Waters公司,美国)进行质量分析。蛋白质样品(70-80pmol)进样到填充有固定化胃蛋白酶的2.1mm/30mmL不锈钢柱中,其中流量为0.1%甲酸中1μl/分钟。在VanGuard Pre-Column(2.1mm*5mm,ACQUITY UPLC BEH C18,1.7μm)上捕获肽3分钟。然后将捕获物置于与ACQUITY UPLC BEH C18柱(1.7μm,1.0mm*100mm;Waters公司)连接,在0℃使用20%-80%梯度的乙腈在9分钟中以37μl/min的流量分离肽。向这两种流动相中添加甲酸(0.1%)以维持pH为2.5。在配备有离子迁移分离(ion mobility separation)的Waters Q-TOF质谱仪上使用电喷雾电离以正灵敏度离子模式在优化条件下获取肽的质谱。在12分钟内,在50-2,000的质荷比(m/z)范围内获取谱,碰撞能量阶梯为21-44V。质量准确度是使用亮氨酸脑啡肽标准物(Waters公司,美国)通过不断的锁质量修正(lock-mass correction)维持。一式两份的未氘化对照样品的胃蛋白肽(FGFBP3为一式三份样品)使用精确质量和碰撞诱导解离的组合以由Waters MassLynx 4.1软件辅助的与离子迁移分离偶联的数据非依赖性获取模式(MSE)鉴定。选取未氘化和氘化的肽在0小时和1小时时的质谱并在Waters DynamX v2.0中进行分析。
所有FGFBP3肽片段在60分钟时的氘摄取都提高,其表现出1-77、107-139和165-197位氨基酸残基的更松弛的构象。紧密的构象显示在具有较少氘摄取的78-106和198-232位氨基酸序列(图5A,----)。与FGF21孵育后,FGFBP3片段(158-205)(图5A,)和CBD66(167-232)(图5B,)的氘摄取均提高,这表明该FGF21结合结构域解折叠。FGFBP3的构象在4℃与肝素孵育过夜之后也发生变化。37-77位氨基酸的氘摄取在肝素存在下降低(图5C,----),但对于通过FGFBP3与FGFBP1的序列比对预测的肝素结合结构域(82-114位氨基酸),氘摄取却没有改变。CBD66的构象在肝素存在下没有改变(图5C、D----和----),这与先前的研究结果一致。
实施例5:人FGFBP3突变体蛋白NBP158在CHO细胞中的表达。
分泌型人FGFBP3的N端158个氨基酸(NBP158,SEQ ID NO:1的27-184位氨基酸)存在于经表达载体转染的CHO细胞的上清中,所述载体包含全长NBP158序列(SEQ ID NO:1的1-184位氨基酸)。发现分泌型NBP158以18kDa的表观分子量迁移(图6,A)。所指示的蛋白质样品通过质谱法进行分析,并且通过LC/MS鉴定NBP158的100%序列(以下划线示出)(图6B)。
实施例6:单次NBP158处理对ob/ob小鼠中葡萄糖代谢的时间过程。
为了确证NBP158的活性,我们用单剂量的NBP158注射ob/ob小鼠并进行IPGTT,如上文中所述。单次NBP158注射(0.5mg/kg)后2小时,空腹血糖、萄糖耐量在处理之前和之后在60和90分钟时显著改善(n=6)(图7A)。为确定单次NBP158处理的时间过程,在单次NBP158注射之后24小时进行GTT,并且空腹葡萄糖水平没有降低,但是发现30和60分钟时葡萄糖耐量的显著差异(n=6)(图7B)。单次NBP158处理之后48小时,未表现出显著差异(n=6)(图7C、D)。
实施例7:NBP158处理对ob/ob小鼠中葡萄糖代谢的剂量响应。
为了评估纯化的NBP158蛋白的全身性作用,我们用提高剂量的NBP158(0.1、0.5、1mg/kg)处理ob/ob小鼠。单次NBP158处理(0.1mg/kg)之后2小时,空腹血糖从基线10.6±0.7(mmol/L)降低至7.06±0.15(mmol/L)(p<0.01),并且葡萄糖耐量在30、60、120和180分钟时改善(图8A,0.1mg/kg,p<0.001)(n=6)。曲线下面积(AUC)降低了38.4%,从2694.54±125.46降至1659.17±95.83(mmol/l/分钟)(图8D,0.1mg/kg,p<0.01)。用0.5mg/kg NBP158处理之后,空腹血糖降至6.65±0.38(mmol/L)(p<0.01),并且显著降低的血浆葡萄糖水平还见于15、30、60、120和180分钟(图8B,0.5mg/kg,p<0.001)(n=6)。AUC降低了49.2%,降至1369±161(mmol/l/分钟)(FIG.8D,0.5mg/kg,p<0.01)。在更高的剂量下,NBP158处理将空腹血糖水平降至7.19±0.15(mmol/L)(p<0.01),并且显著降低的血浆葡萄糖水平还见于15、30、60、120和180分钟,AUC降低了56.8%,降至1164.67±35.33(mmol/l/分钟)(图8C、D,1.0mg/kg,p<0.001)(n=6)。
这些动物的正常运动在实验后观察三周。在进食的ob/ob小鼠中,NBP158处理(0.5mg/kg)并不改变注射后15分钟至24小时的随机血糖水平,这表明血浆葡萄糖水平可以通过食物摄入来维持。因此,我们的结论是:NBP158处理以剂量依赖的方式显著地降低血浆葡萄糖水平,而且起效快(<2小时)且持续时间长(>24小时)。
实施例8:NBP158处理对饮食诱导的肥胖症(DIO)小鼠中葡萄糖代谢的急性效应。
3周龄雄性C57BL6小鼠购自中山大学(广州,中国)。实验前3个月,动物不限量饲喂60%高脂饮食(目录号D12492,Research Diets,Inc.,NJ)和水。动物实验经中山大学动物护理和使用委员会(IACUC)审查并批准。NBP158多肽或CBD66多肽如上文中所述施用。NBP158单次处理(0.5mg/kg)之2后小时,空腹血糖水平降低,并且在15、30、60、120和180分钟时显示出葡萄糖耐量的显著改善(n=6)(图9A、B)。单次CBD66处理之后2小时,发现处理之前和之后没有显著差异(n=6)(图9C、D)。因此,用NBP158(而非CBD66)处理在DIO小鼠中降低空腹血糖并且改善葡萄糖耐量。
实施例9:用NBP158或CBD66单次处理之后DIO小鼠的体重变化。
用60%高脂饮食饲喂3周龄雄性B6小鼠12周,然后随机分配到NBP158或CBD66处理组。DIO小鼠(18周龄)用单次注射NBP158(n=6)或CBD66(n=6)处理。处理之后一周,将DIO小鼠称重并将体重的变化在这些组之间进行比较。在NBP158处理组,体重下降了(-2.4±0.46g/只动物)或(-5.545±1.08%/只动物);而在CBD66处理组,体重提高了(0.74±0.14g/只动物)或(1.66±0.42%/只动物),这与未处理的动物类似(图10A、B)。因此,NBP158(而非CBD66)显著降低体重,这表明在治疗肥胖症中的治疗作用(p<0.05,图10)。
所有的出版物(包括授权的专利和公布的专利申请)、通过url地址或登录号确定的所有数据库条目、以及所有美国专利申请(无论是否公布)均通过引用整体并入本文。
虽然本发明已针对其某些实施方案进行了描述,并且为了举例说明的目的已列举了许多细节,但对于本领域技术人员而言明显的是,本发明很容易被添加另外的一些实施方案,并且本文中所描述的某些细节可以被显著改变而不脱离本发明的基本原则。
- 还没有人留言评论。精彩留言会获得点赞!