肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制作方法
本发明涉及影像学诊断造影剂,尤其是一种肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备方法和在核磁共振成像和近红外荧光成像中的应用。
背景技术:
在癌症发生的早期,如果能迅速精确地检测出病变器官或组织的生理形态学变化,并给出相应的影像学信息,对癌症的早期诊断具有非常重大的意义。造影剂就是这样一类物质,通过注入到人体特定的组织或器官,使之与正常组织部位产生密度或其他差异,并将这些差异进行显影,从而提供关于疾病重要的临床信息。
核磁共振成像(Magnetic Resonance imaging,MRI)是利用体液或组织中水分子或富氢小分子的氢核在外加磁场及特定射频脉冲的作用下产生共振来成像的一种技术。临床上,对体内某一结构或器官内的异常病灶进行磁共振成像扫描检查时,为了增强异常病灶的显影效果,提高测试仪器的对病变组织的分辨率,往往通过静脉注射造影剂进行增强扫描成像。目前常用的磁共振造影剂-钆喷酸葡胺(Gd-DTPA)缺乏与肿瘤组织识别的特异性。因此,提高磁共振造影剂的肿瘤靶向能力,是增强核磁共振成像对比度的关键步骤。
近红外荧光成像(Near-infrared fluorescence imaging)以其成像灵敏、快速等优势广泛应用于医学和生物学领域。其方法是将具有由近红外波长的激发光照射能发出荧光的造影剂进行生物体成像,从而反应病变组织的生理学变化。近红外荧光造影剂的发射光位于近红外波段(600-900nm),有效避开了内体水、有氧及无氧血红蛋白等主要组织的吸收波长,具有良好的生物组织穿透能力,并且对组织无损伤。临床常用的近红外荧光造影剂为吲哚菁绿ICG,是目前唯一一个被FDA批准认证可用于人体的近红外荧光染料,应用于心输出量、肝功能、眼底造影等方面的检测。但吲哚菁绿体内代谢速度快,光及热稳定性差,且无肿瘤特异性检测,使其应用受到限制。
随着分子影像学方法的不断发展,结合多种成像方式的双模态或多模态分子探针受到人们的青睐,这类探针可同时用于不同影像设备的检测,实现多种显像模式的优势互补,对于复杂疾病可以提供更为全面的诊断学信息,其中基于核磁共振成像及近红外成像的MRI/NIR双模态探针同时具有MRI高空间分辨率、NIR高灵敏度且成像迅速的特点,在医学诊断中具有非常重要的意义。
2003年美国马萨诸塞州总医院和哈佛医学院分子成像中心研究人员首次将近红外染料Cy5.5共价接枝到葡聚糖包裹Fe2O3磁性中心得到MRI/NIR双模态探针Cy5.5-CLIO,并用于小鼠脑部胶质瘤的适时定位监测(Kircher.M.F.et al. CANCER RESEARCH.2003,63,8122–8125)。然而,该探针的水合粒径为32nm,易聚集,且探针缺乏肿瘤靶向性。随着MRI/NIR双模态探针的不断发展,具有MRI高弛豫率/荧光效率高、生物相容性好、安全低毒,可特异性靶向肿瘤的双模态探针越来越成为研究的热点之一。
技术实现要素:
本发明的目的是提供一种肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备方法和在核磁共振成像和近红外荧光成像中的应用,制备得到的造影剂具有较高的MRI弛豫率、NIR荧光效能以及肿瘤靶向识别能力,并且具有好的生物相容性和稳定性。
本发明的技术方案如下:
一种肿瘤靶向核磁共振/荧光双模态成像造影剂,该造影剂由核磁共振双亲分子,近红外荧光染料双亲分子及肿瘤靶向双亲分子通过自组装形成,具体为在水溶液中超声自组装形成的纳米结构。
所述造影剂为纳米粒,粒径范围为20-40nm,组装体的分子量范围为500-1000Da,适合的pH值范围为6-8。
所述的核磁共振成像双亲分子,结构式如下,
是由顺磁性物质与带有氨基或羧基的单链或双链分子进行反应所得的产物,所述核磁共振成像双亲分子的分子量范围500-1000Da。
所述的近红外荧光染料双亲分子,结构式如下,
是由近红外荧光染料与带有氨基或羧基的单链或双链分子进行反应所得的产物,分子量范围500-1000Da。
所述的肿瘤靶向双亲分子,结构式如下,
为肿瘤特异性亲和分子与带有氨基或羧基的单链或双链分子进行反应所得的产物,分子量范围500-1000Da。
核磁共振双亲分子:近红外荧光染料双亲分子:肿瘤靶向双亲分子之间的摩尔比范围为5:5:1-40:5:1,优选摩尔比范围为5:5:1-20:5:1,最佳摩尔比范围5:5:1-10:5:1。
所述的核磁共振双亲分子是由顺磁性物质与带有氨基或羧基的单链或双链分子进行反应所得的产物;所述的近红外荧光染料双亲分子是由近红外荧光染料与带有氨基或羧基的单链或双链分子进行反应所得的产物;所述的肿瘤靶向双亲分子是肿瘤特异性亲和分子与带有氨基或羧基的单链或双链分子进行反应所得的产物。
所述的顺磁性物质是含有钆的造影剂;所述的近红外荧光染料为菁染料(Cyanine)、含四吡咯基团的近红外荧光染料、咕吨类荧光染料、方酸衍生物、噻嗪类和嗯嗪类近红外荧光染料、二氟化硼-二吡咯甲烷荧光染料中的一种;所述的肿瘤特异性亲和分子是叶酸,多肽,单克隆抗体中的一种。
所述的带有氨基或羧基的单链或双链分子是十六胺、双十六胺、碳十八烷胺、磷脂、脑磷脂中的一种。
一种情况是:顺磁性物质为Gd-DOTA或Gd-DTPA;近红外荧光染料为菁染料Cy系列荧光染料Cy3、Cy5、Cy5.5或Cy7,肿瘤特异性亲和分子为叶酸。
本发明所述的顺磁性物质、近红外荧光染料、肿瘤特异性亲和分子可以选择市售购买,根据需要自行制备或者在其基础上进行改进,根据具体要求进行选择,以符合本发明所要制备造影剂的性能。
本发明所述造影剂的制备方法为:
步骤a)制备核磁共振双亲分子:顺磁性物质与带有氨基或羧基的单链或双链分子反应,得核磁共振双亲分子;
步骤b)制备近红外荧光染料双亲分子:取近红外荧光染料与带有氨基或羧基的单链或双链分子反应,产物通过柱层析纯化,真空干燥得近红外荧光染料双亲分子;
步骤c)制备肿瘤靶向双亲分子:肿瘤特异性亲和分子与带有氨基或羧基的单链或双链分子反应,真空干燥得肿瘤靶向双亲分子;
步骤d)制备肿瘤靶向核磁共振及近红外荧光双模态成像造影剂:将核磁共振双亲分子、近红外荧光染料双亲分子肿瘤靶向双亲分子在有机溶剂中混合后充分搅拌,旋蒸除去有机溶剂,加入超纯水,超声,既得肿瘤靶向核磁共振和近红外荧光双模态成像造影剂。
具体的制备方法为:
步骤a)制备核磁共振双亲分子:顺磁性物质与带有氨基或羧基的单链或双链分子,在室温碱性条件下反应,真空干燥得核磁共振双亲分子,所述碱为三乙胺或N,N-二异丙基乙胺(DIPEA),碱的加入量为顺磁性物质摩尔量的3-10倍;
步骤b)制备近红外荧光染料双亲分子:取近红外荧光染料与带有氨基或羧基的单链或双链分子溶于有机溶剂中,在碱性条件下,氮气保护60-90℃回流,反应产物通过柱层析纯化,真空干燥得近红外荧光染料双亲分子,所述有机溶剂为二甲基甲酰胺(DMF)或甲苯;所述碱为三乙胺或N,N-二异丙基乙胺(DIPEA),碱的加入量为近红外染料摩尔量的3-10倍;
步骤c)制备肿瘤靶向双亲分子:肿瘤特异性亲和分子中的羧基与N-羟基琥珀酰亚胺(NHS)在二环己基碳二亚胺(DCC)作用下生成N-羟基琥珀酰亚胺羧酸酯,将带有氨基或羧基的单链或双链分子加入到上述活性酯中,室温碱性条件下反应,乙醚或石油醚沉淀反应产物,真空干燥得肿瘤靶向双亲分子;所述碱为三乙胺或N,N-二异丙基乙胺(DIPEA),碱的加入量为肿瘤特异性亲和分子摩尔量的3-10倍;
步骤d)制备肿瘤靶向核磁共振及近红外荧光双模态成像造影剂:分别取核磁共振双亲分子与近红外荧光染料双亲分子溶于甲醇或丙酮中,取肿瘤靶向双亲分子溶于四氢呋喃(THF)或丙酮中,将三种溶液混合之后充分搅拌,旋蒸除去有机溶剂,然后加入超纯水,超声,既得肿瘤靶向核磁共振和近红外荧光双模态成像造影剂。
本发明提供一种制备方法,但并不限制于此方法的保护范围,具体为:
步骤a)制备核磁共振双亲分子:DOTA或DTPA溶于有机溶剂中,再加入N-羟基琥珀酰亚胺(NHS)和二环己基碳二亚胺(DCC),生成N-羟基琥珀酰亚胺羧酸酯,将带有氨基或羧基的单链或双链分子加入到上述活性酯中,同时加入三乙胺或N,N-二异丙基乙胺(DIPEA),室温条件下反应,抽滤,石油醚或乙醚洗涤反应产物,真空干燥得到沉淀;三氟乙酸(TFA)作用下脱去顺磁性物质中羧基保护基,水溶液中加热条件下,与水合醋酸钆或氯化钆螯合后,真空干燥得核磁共振双亲分子;
步骤b)制备近红外荧光染料双亲分子:取近红外荧光染料与带有氨基或羧基的单链或双链分子溶于二甲基甲酰胺(DMF)或甲苯溶剂中,同时加入三乙胺或N,N-二异丙基乙胺(DIPEA),氮气保护下60-90℃回流,反应产物通过柱层析纯化,真空干燥得近红外荧光染料双亲分子;
步骤c)制备肿瘤靶向双亲分子:肿瘤特异性亲和分子中的羧基与N-羟基琥珀酰亚胺(NHS)在二环己基碳二亚胺(DCC)作用下生成N-羟基琥珀酰亚胺羧酸酯,将带有氨基或羧基的单链或双链分子加入到上述活性酯中,同时加入三乙胺或N,N-二异丙基乙胺(DIPEA),室温条件下反应,乙醚或石油醚沉淀反应产物,真空干燥得肿瘤靶向双亲分子;
步骤d)制备肿瘤靶向核磁共振及近红外荧光双模态成像造影剂:分别取核 磁共振双亲分子与近红外荧光染料双亲分子溶于甲醇或丙酮中,取肿瘤靶向双亲分子溶于四氢呋喃(THF)或丙酮中,将三种溶液混合之后充分搅拌,旋蒸除去有机溶剂,然后加入超纯水,超声,既得肿瘤靶向核磁共振和近红外荧光双模态成像造影剂。
其中,步骤a)中室温条件下反应时间为8-12h,所述有机溶剂为二氯甲烷或乙腈;步骤b)中氮气保护下回流8-12h;步骤c)中室温条件下反应24-48h,步骤d)中,超声时间范围20-40min。
在本发明造影剂的制备过程中:顺磁性物质与带有氨基或羧基的单链或双链分子的摩尔比范围为1:1-1:5;红外荧光染料与带有氨基或羧基的单链或双链分子的摩尔比范围为1:5-1:10;肿瘤特异性亲和分子与带有氨基或羧基的单链或双链分子摩尔比范围为1:1-3:1。
本发明的优点和有益效果为:
本发明肿瘤靶向核磁共振和近红外荧光双模态成像造影剂,由核磁共振双亲分子、近红外荧光双亲分子和肿瘤靶向双亲分子在水溶液中超声自组装形成的囊泡形纳米结构,通过该方法得到的双模态探针粒径分布均一且有较好的稳定性。近红外荧光染料的应用大大提高了双模态探针的荧光性能,同时肿瘤靶向双亲分子与肿瘤细胞表面高表达的亲和力,可以有效实现靶向显影。
此外,肿瘤靶向核磁共振和近红外荧光双模态成像造影剂可用在肿瘤切除术中集术前磁共振诊断,术中荧光引导切除及术后核磁共振疗效评价等多重功能于一体,其能够在生理pH条件下稳定存在,并能特异性蓄积靶向肿瘤部位,显著增强肿瘤病灶部位的MRI信号强度和近红外荧光信号强度,提高核磁共振成像及近红外荧光成像扫描的特异性及敏感性,有望作为造影剂用于肿瘤切除手术术中荧光引导及术后核磁共振监测。
该肿瘤靶向核磁共振和近红外荧光双模态成像造影剂具有高的弛豫率、优良的热稳定性,较低的毒副作用,较高的量子产率以及较好的光稳定性等特点,可以有效应用于活细胞和活体的磁共振成像和荧光成像。
附图说明
图1为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的透射电镜结果图;
图2为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的粒径分布图;
图3为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的水合粒径及粒径稳定性结果图;
图4为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的核磁共振成像结果图;
图5为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的弛豫率结果图;
图6为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的吸收和发射光谱图;
图7为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂在异位胶质瘤裸 鼠模型体内核磁共振成像结果图;
图8为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂在异位胶质瘤裸鼠模型体内近红外荧光成像结果图。
具体实施方式
下述实施例用于说明本发明,其中的原料为实验室制备,但并不影响本发明对权利要求所要保护的范围。
实施例1
肿瘤靶向核磁共振及近红外荧光双模态成像造影剂制备:
(1)制备核磁共振双亲分子:取1.0026g三叔丁基1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)溶于二氯甲烷(DCM),与0.2448g N-羟基琥珀酰亚胺(NHS)在1.8087g二环己基碳二亚胺(DCC)作用下室温活化2h,然后加入0.5065g十六胺,室温条件下搅拌反应12h,抽滤后用大量乙醚沉淀反应产物,真空干燥得乳白色粉末;再加入到三氟乙酸(TFA)与DCM的混合液中,搅拌反应2h,旋蒸除去反应溶剂,用石油醚清洗反应产物,真空干燥得白色油状物;将白色油状物在水中复溶,同时加入0.3481g水合醋酸钆,调溶液pH至5-6,90℃反应2h,真空干燥得核磁共振双亲分子。
(2)制备近红外荧光染料双亲分子:取16.75g三氯氧磷与2.499g环己酮溶于N,N-二甲基甲酰胺(DMF)和DCM的混合液中,80℃氮气保护下回流3h,反应产物在水中重结晶,真空干燥得中间产物1;取2.225g 2,3,3-三甲基吲哚与1.875g碘丙酸溶于甲苯中,100℃氮气回流3h,乙醚、丙酮混合液萃取反应产物,真空干燥得中间产物2;取中间产物1(0.532g)和2(2.204g)溶于甲苯和DMF混合溶剂,160℃氮气保护下回流10h,反应产物在乙醚和水相中萃取,真空干燥得墨绿色固体近红外染料Cy7,取0.7011g Cy7与2.333g十六胺溶于DMF中,氮气保护下70℃回流10h,反应产物通过柱层析纯化,真空干燥得近红外荧光染料双亲分子。
(3)制备肿瘤靶向双亲分子:取1.0034g叶酸溶于二甲基亚砜(DMSO)中,叶酸与0.2970g N-羟基琥珀酰亚胺(NHS)在2.2343g二环己基碳二亚胺(DCC)作用下活化12h,向叶酸活性酯中加入含有0.5094g十六胺的乙酸乙酯溶液,室温下避光搅拌反应24h,乙醚沉淀反应产物,真空干燥得肿瘤靶向双亲分子。
(4)制备肿瘤靶向核磁共振和近红外荧光双模态成像造影剂:分别取核磁共振双亲分子与近红外荧光染料双亲分子溶于甲醇中,取肿瘤靶向双亲分子溶于四氢呋喃(THF)中,将三种溶液混合之后充分搅拌,旋蒸除去有机溶剂,然后加入超纯水,超声40min即得肿瘤靶向核磁共振和近红外荧光双模态成像造影剂。其中,所用三种基元摩尔比为核磁共振双亲分子:近红外荧光双亲分子:肿瘤靶向双亲分子=5:5:1。
实施例2
肿瘤靶向核磁共振及近红外荧光双模态成像造影剂制备:
(1)制备核磁共振双亲分子:取1.0026g三叔丁基1,4,7,10-四氮杂环十二 烷-1,4,7,10-四乙酸(DOTA)溶于二氯甲烷(DCM),与0.2448g N-羟基琥珀酰亚胺(NHS)在1.8087g二环己基碳二亚胺(DCC)作用下室温活化2h,然后加入0.5660g碳十八烷胺,室温条件下搅拌反应12h,抽滤后用大量乙醚沉淀反应产物,真空干燥;再加入到三氟乙酸(TFA)与DCM的混合液中,搅拌反应2h,旋蒸除去反应溶剂,用石油醚清洗反应产物,真空干燥得白色油状物;将白色油状物在水中复溶,同时加入水合醋酸钆,调溶液pH至5-6,90℃反应2h,真空干燥得核磁共振双亲分子。
(2)制备近红外荧光染料双亲分子:取实施例1中制备的Cy7 0.5g与1.886g碳十八烷胺溶于DMF中,氮气保护下70℃回流10h,反应产物通过柱层析纯化,真空干燥得近红外荧光染料双亲分子。
(3)制备肿瘤靶向双亲分子:取1g叶酸溶于二甲基亚砜DMSO中,叶酸与0.2970g N-羟基琥珀酰亚胺NHS在2.2343g二环己基碳二亚胺DCC作用下活化12h,向叶酸活性酯中加入含有0.5660g碳十八烷胺的乙酸乙酯溶液,室温下避光搅拌反应24h,乙醚沉淀反应产物,真空干燥得肿瘤靶向双亲分子。
(4)制备肿瘤靶向核磁共振和近红外荧光双模态成像造影剂:分别取核磁共振双亲分子与近红外荧光染料双亲分子溶于甲醇中,取肿瘤靶向双亲分子溶于四氢呋喃THF中,将三种溶液混合之后充分搅拌,旋蒸除去有机溶剂,然后加入超纯水,超声40min即得肿瘤靶向核磁共振和近红外荧光双模态成像造影剂。其中,所用三种基元摩尔比为核磁共振双亲分子:近红外荧光双亲分子:肿瘤靶向双亲分子=5:5:1。
实施例3
肿瘤靶向核磁共振及近红外荧光双模态成像造影剂制备:
(1)制备核磁共振双亲分子:取1.0026g三叔丁基1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)溶于二氯甲烷(DCM),与0.2448g N-羟基琥珀酰亚胺(NHS)在1.8087g二环己基碳二亚胺(DCC)作用下室温活化2h,然后加入1.571g磷脂,室温条件下搅拌反应12h,抽滤后用大量乙醚沉淀反应产物,真空干燥;再加入到三氟乙酸(TFA)与DCM的混合液中,搅拌反应2h,旋蒸除去反应溶剂,用石油醚清洗反应产物,真空干燥得白色油状物;将白色油状物在水中复溶,同时加入水合醋酸钆,调溶液pH至5-6,90℃反应2h,真空干燥得核磁共振双亲分子。
(2)制备近红外荧光染料双亲分子:取实施例1中制备的Cy7 0.5g与5.150g磷脂溶于DMF中,氮气保护下70℃回流10h,反应产物通过柱层析纯化,真空干燥得近红外荧光染料双亲分子。
(3)制备肿瘤靶向双亲分子:取1g叶酸溶于二甲基亚砜DMSO中,叶酸与0.2970g N-羟基琥珀酰亚胺NHS在2.2343g二环己基碳二亚胺DCC作用下活化12h,向叶酸活性酯中加入含有1.571g磷脂的乙酸乙酯溶液,室温下避光搅拌反应24h,乙醚沉淀反应产物,真空干燥得肿瘤靶向双亲分子。
(4)制备肿瘤靶向核磁共振和近红外荧光双模态成像造影剂:分别取核磁 共振双亲分子与近红外荧光染料双亲分子溶于甲醇中,取肿瘤靶向双亲分子溶于四氢呋喃THF中,将三种溶液混合之后充分搅拌,旋蒸除去有机溶剂,然后加入超纯水,超声40min即得肿瘤靶向核磁共振和近红外荧光双模态成像造影剂。其中,所用三种基元摩尔比为核磁共振双亲分子:近红外荧光双亲分子:肿瘤靶向双亲分子=5:5:1。
实施例4
非靶向核磁共振及近红外荧光双模态成像造影剂制备
分别取实施例1中制备的核磁共振双亲分子与近红外荧光染料双亲分子溶于甲醇中,将两种溶液混合之后充分搅拌,旋蒸除去有机溶剂,然后加入超纯水,超声40min既得核磁共振和近红外荧光双模态成像造影剂,用于对照组实验。其中,所用来那个中基元摩尔比为核磁共振双亲分子:近红外荧光双亲分子=1:1。
实施例5
造影剂的形貌与粒径分布表征:
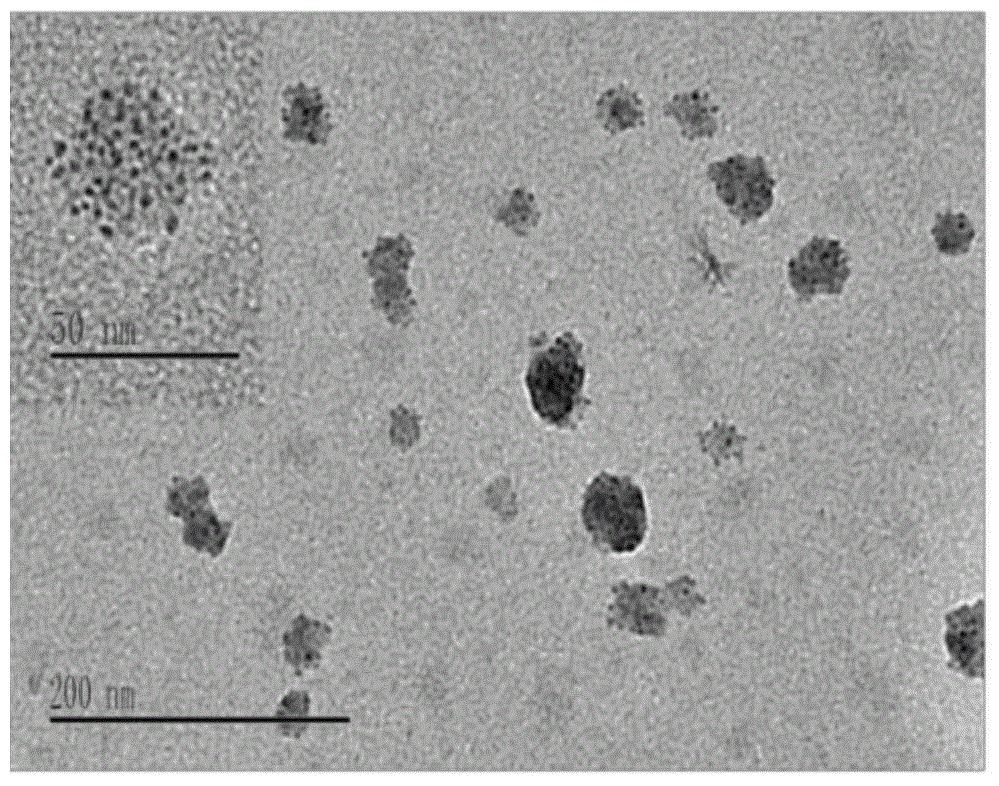
实施例1制备的造影剂利用透射电镜表征其形貌和粒径分布。将样品溶液滴加至铜网上,磷钨酸负染5-10min,在透射电子显微镜(JEM-2100日本电子株式会社)下观察,结果见图1和图2,显示本发明造影剂为球形,分散均一,粒径为25±5nm。
实施例6
造影剂的水合粒径测定:
将实施例1和实施例2制备的造影剂利用激光粒度仪对其水合粒径进行测定。将样品溶液稀释后于激光粒度仪(Beckman-CoulterLS-100Q,美国)下测定,结果见图3,显示本发明造影剂的水合粒径为80±10nm,用于对照的实施例2制备的造影剂水合粒径为80±5nm,粒径分布较窄。
实施例7
造影剂的稳定性测定:
将实施例1和实施例2制备的造影剂利用激光粒度仪对其稳定性进行测定。将样品溶液用生理盐水稀释后于室温下静置不同的时间,然后利用激光粒度仪(Beckman-CoulterLS-100Q,美国)测定其水合粒径来判断其稳定性。结果见图3,显示造影剂在生理盐水中稳定性良好,没有发生团聚现象。
实施例8
造影剂的核磁共振成像:
将实施例1和实施例2制备的造影剂利用核磁共振扫描仪对其核磁共振成像能力进行测定。将样品用水稀释成不同浓度,放入1.5ml EP管中,利用小动物核磁共振成像系统(MiniMR-Rat苏州)测定不同浓度造影剂的成像能力。结果见图4,图4为肿瘤靶向核磁共振和近红外荧光双模态成像造影剂的核磁共振成像结果图,途中第一排为实施例1制备的造影剂,第二排为实施例2制备的对照组造影剂,显示实验组及对照组造影剂均具有良好的核磁共振成像能力, 随着造影剂浓度增加,核磁共振信号显著增强;
显示两种造影剂均有良好的成像能力,随着造影剂浓度的增加,可以使核磁共振信号值显著增加。
实施例9
造影剂的弛豫率测定:
将实施例1和实施例2制备的造影剂利用核磁共振扫描仪对其弛豫率进行测定。将样品用水稀释成不同浓度,放入1.5mlEP管中,利用小动物核磁共振成像系统(MiniMR-Rat苏州)测定不同浓度造影剂T1弛豫时间,然后计算造影剂的弛豫率(r1)。结果见图5,图中直线1为实施例1制备的造影剂,直线2为实施例2制备的对照组造影剂,显示两种造影剂的弛豫率分别为11.87mM-1s-1和9.27mM-1s-1。
实施例10
造影剂的吸收谱与荧光发射光谱测定:
将实施例1制备的造影剂利用紫外-可见分光光度计(岛津2550,日本)测定其吸收光谱,利用小动物活体成像系统(MK50101-EX,CRI,USA)测定其发射光谱。结果见图6,图中曲线1为本造影剂的吸收光谱,曲线2为本造影剂的发射光谱,显示本造影剂的最大吸收及最大发射位置,该造影剂斯托克斯位移达到140nm,具有良好的近红外成像性能、荧光性能。
实施例11
造影剂在胶质瘤转移裸鼠模型体内磁共振成像能力测定:
将实施例1和实施例2制备的造影剂利用小动物核磁共振成像系统(MiniMR-Rat苏州)对其在异位胶质瘤裸鼠模型体内的核磁共振成像进行测定。所用裸鼠为雌性BALB/c-nu小鼠(大连医科大学提供,体重20-25g)。在裸鼠的右后背部皮下注入2×106个细胞,约10天后瘤直径达到5mm×5mm用于动物实验。裸鼠肿瘤模型8只,随机分为2组,一组为实验组,尾静脉注射经生理盐水稀释的本发明造影剂,按照0.05mmol[Gd]/kg体重注射;一组为对照组,尾静脉注射经生理盐水稀释的实施例2制备的造影剂,按照0.05mmol[Gd]/kg体重注射。分别在注射前和注射后3、10、24、48、72、96、120及144小时进行核磁共振扫描成像。结果见图7,其中,第一行为本造影剂注射异位胶质瘤裸鼠模型小鼠体内核磁共振成像结果图,显示注射前及注射后的1到6天时间内肿瘤区域核磁共振信号随时间变化明显;第二行为实施例2制备的对照组造影剂注射异位胶质瘤裸鼠模型小鼠体内核磁共振成像结果图显示注射前及注射后的1到6天时间内肿瘤区域核磁共振信号随时间有变化,但变化不如实验组明显。
实施例12
造影剂在胶质瘤转移裸鼠模型体内近红外荧光成像能力测定:
将实施例1和实施例2制备的造影剂利用小动物活体成像系统(MK50101-EX,CRI,USA)对其在异位胶质瘤裸鼠模型体内的荧光成像能力进行测定。实 验动物模型的建立与实验分组与实施例9中保持一致。结果见图8,其中,第一行为本造影剂注射异位胶质瘤裸鼠模型小鼠体内近红外荧光成像结果图,显示注射前及注射后的1到6天时间内肿瘤区域近红外荧光信号随时间变化明显,肿瘤边界清晰可见;第二行为实施例2制备的对照组造影剂注射异位胶质瘤裸鼠模型小鼠体内近红外荧光成像结果图,显示注射前及注射后的1到6天时间内肿瘤区域近红外荧光信号随时间有变化,但变化不如实验组明显。
以上所述实施例并不限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法