一种克林霉素磷酸酯冻干粉针试剂的制作方法
本发明属药物制剂领域,涉及一种抗菌用的粉针试剂,具体涉及一种用于抗菌的克林霉素磷酸酯粉针试剂,该粉针试剂可被广泛运用到治疗革兰式阳性细菌,厌氧细菌引起的各种感染。
背景技术:
:现有技术公开了克林霉素磷酸酯是克林霉素的衍生物,其化学名称为:(2s-反式-6-(1-甲基-4-丙基-2-吡咯烷碳酰氨基)-1-硫代-甲基-7-氯-6,7,8-三脱氧-L-苏式-α-D-半乳糖吡喃糖苷-2-二氢磷酸酯,在临床上被广泛用于治疗革兰式阳性细菌,厌氧细菌引起的各种感染。目前,治疗所述的感染的试剂主要以粉针试剂的形式存在,实践显示,制成粉针试剂可以解决试剂的稳定性,但是溶解性能相对变差。现有技术中,在制备一些难溶性药物,例如克林霉素磷酸酯药物,由注射液变更为粉针剂时,常使用增溶剂、采用pH值调节以及分割原剂型规格制成小规格粉针剂等是常用的方法,其中,难溶性药物制备为粉针剂时,增溶剂的使用是一种比较普遍的措施。目前,该
技术领域:
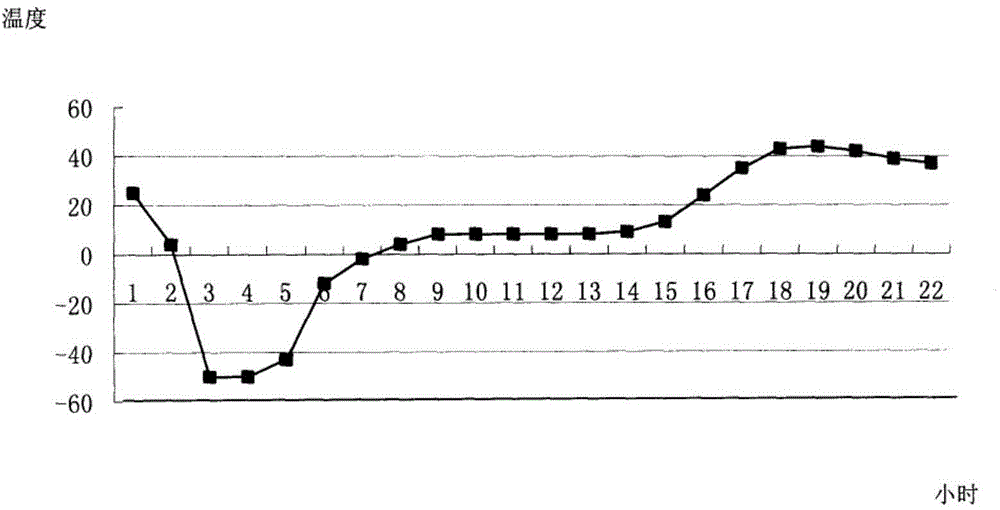
中使用较多的增溶剂主要有羟丙基-β-环糊精、PEG系列、聚山梨酯80(吐温80)和泊洛沙姆等;中国发明专利01133218.2和101569612A公开了一种克林霉素磷酸酯粉针试剂和制备方法,其中均含有吐温80为增溶剂,然而,实践显示,吐温80具有的溶血风险会显著影响药物的安全性。针对目前上述产品制剂形式在实践中存在的若干缺陷的现状,本申请的发明人拟提供一种更加安全的冻干试剂及生产工艺,更具体涉及一种更加安全有效的增容的方法,同时不影响克林霉素磷酸酯的性能,并且不影响药物的使用,即在使用过程中,不会因为溶解而出现混浊或结晶现象。技术实现要素:本发明目的在于克服现有技术的缺陷,提供一种新的克林霉素磷酸酯粉针试剂,该粉针试剂在冻干剂处方中添加适当比例的氯化钠或苯甲酸钠作为助溶剂, 在适当的pH条件下进行冻干,制得的克林霉素磷酸酯粉针试剂不具有溶血风险,显著增加用药的安全性,同时保证了药品的质量。本发明目的通过如下技术方案实现:本发明的一种克林霉素磷酸酯冻干粉针试剂,包括克林霉素磷酸醋和助溶剂,其特征在于,所述克林霉素磷酸酯为1重量份;氯化钠或苯甲酸钠为0.05-3重量份;采用注射用水作冻干溶剂,碳酸氢钠调节冻干溶液pH值为pH4-8。本发明的实施例中,优选克林霉素磷酸酯粉针试剂的组成为:克林霉素磷酸酯为为1重量份;苯甲酸钠为0.05重量份;注射用水用作冻干溶剂,用10%碳酸氢钠调节pH值为pH4-8;本发明的另一实施例中,优选克林霉素磷酸酯粉针试剂的组成为:克林霉素磷酸酯为1重量份;氯化钠为0.05重量份;溶于注射用水中,用10%碳酸氢钠调节pH值为pH6.0-6.5。本发明的另一实施例中,优选克林霉素磷酸酯粉针试剂的组成为:克林霉素磷酸酯为1重量份;氯化钠为3重量份;溶于注射用水中,用10%碳酸氢钠调节pH值为pH6.0-6.5。本发明目的进一步目的,还提供一种制备克林霉素磷酸酯粉针试剂的方法,其包括,先将氯化钠溶于注射用水中,再加入克林霉素磷酸酯,再用10%碳酸氢钠调节pH至6.0-6.5,无菌过滤,冷冻干燥;在本发明的一个实施例中优选:在过滤前,用0.1%-0.3%的活性炭对溶液进行处理,较优的,用活性炭对溶液进行处理的时间为30分钟,较优的,所用克林霉素磷酸酯和氯化钠质量份数比为20:1至1:3,更优的,调节pH为6.3和6.4。本发明的优点在于:本发明的粉针试剂在冻干剂处方中添加适当比例的氯化钠或苯甲酸钠作为助溶剂,在适当的pH条件下进行冻干,制得的克林霉素磷酸酯粉针试剂不含有具有溶血风险的增溶剂,因而不具有溶血风险,明显降低药物的安全风险,显著增加用药的安全性,同时保证药品的质量;同时,所述的制备的方法能大大简化生产过程,降低生产成本。为了便于理解,以下将通过具体的附图和实施例对本发明进行详细地描述。 需要特别指出的是,具体予试验实例和附图仅是为了说明,显然本领域的普通技术人员可以根据本文说明,在本发明的范围内对本发明做出各种各样的修正和改变,这些修正和改变也纳入本发明的范围内。附图说明图1是本发明的克林霉素磷酸酯冻干粉针试剂的冻干曲线。具体实施方式实施例11)冻干溶媒选择依据由于注射用水具有无毒、无生理活性、无生理刺激性、价廉易得等优点,因此选用注射用水作为本品冻干用溶媒;2)pH值确定取克林霉素磷酸酯,制成300毫克的克林霉素磷酸酯溶液,溶液的pH值为3.4,溶液呈混浊状态,经10%碳酸氢钠溶液调节pH值为5.5,6.0,6.5及7.0,考察其溶液的澄清度与颜色,结果表明,pH6.0时,主药未完全溶解,为兼顾本品生理适应性及冻干过程对pH的影响,确定注射用克林霉素磷酸酯配制溶液的pH范围为6.0-6.5(如表1所示);表1pH值的选择pH值5.56.06.57.0溶液的澄清度与颜色浑浊澄清无色澄清无色澄清无色3)助溶剂的选择虽然克林霉素磷酸酯在水中易溶,但为保证成品可见异物的合格,在所述配方中加入适量量的氯化钠,按不同配方量准确称取氯化钠,倒入总体积60%的注射用水中,不断搅拌至全部溶解;再加入16克林霉素磷酸酯,然后边搅拌边用10%碳酸氢钠溶液调节pH值至6.0-6.5,初滤、精滤、灌装后按冻干工艺冻干,观察成品的pH值和可见异物,结果表明:通过加不同浓度的氯化钠或苯甲酸钠, 配方2、3、4和5的可见异物符合规定(如表2所示);表2助溶剂对注射用克林霉素磷酸酯的影响试验4)灌装液稳定性实验按可见异物符合规定配方配制注射用克林霉素磷酸酯溶液,加入0.1%活性炭吸附脱色0.5小时,用微孔滤膜进行过滤,于0,1,2,3,4,5,6h时间点测定溶液浓度和可见异物,结果表明:注射用克林霉素磷酸酯灌装液在6小时内含t稳定,异物符合规定要求(如表3所示);表3灌装液的稳定性试验结果时间点(h)0123456RSD可见异物合格合格合格合格合格合格合格_含量(mg/ml)145.65149.10145.261467.81147.16149.18140.380.435)高温实验取注射用克林霉素磷酸酯,60℃温度下放置10天,于第5天和第10天取样,考察性状、酸度、有关物质、含量、可见异物,结果如表4所示;表4高温(60℃)对注射用克林霉素磷酸酯稳定性的影响6)高湿度试验将注射用克林霉素磷酸酯揭去铝塑组合盖和氮化药用丁基橡胶塞,按吸湿性试验方法,在相对湿度90%和75%条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,结果如表5所示;表5湿度对注射用克林霉素磷酸酯稳定性的影响7)光照试验取注射用克林霉素磷酸酯,放在光照装置内,于室温和光照度为4500Lx士500Lx的条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求进行检测,本品在60℃贮存条件下放置10天,各项指标均符合规定;结果显 示,所述试验品在25℃和90%相对湿度条件下贮存10天,冻干块收缩,呈粘性透明状物,吸湿增重明显,溶液颜色和澄清度不符合规定,含量及有关物质符合规定;所述试验品在25℃和75%相对湿度条件下放置10天,吸湿增重不明显,其他各项指标均符合规定;结果表明,所述试验品在强光照射条件下放置10天,各项指标均符合规定(如表6所示);表6光照(4500Lx±500Lx.)对注射用克林霉素磷酸酯稳定性的影响8)配伍试验鉴于试验产品将用于临床静脉滴注给药,本实验进一步考察试验样品与0.9%氯化钠注射液和5%葡萄糖注射液的配伍稳定性,取0611批样品2瓶,分别配制成6mg/ml的溶液,混匀,室温放置,分别于0,1,2,3,4,6,8h观察其溶液澄清度与颜色、pH值、含量、有关物质等变化,结果显示:本试验样品与0.9%氯化钠注射液,5%葡萄糖注射液配伍8小时稳定(如表7、表8所示);表7注射用克林霉素磷酸酯与0.9%氯化钠注射液的配伍稳定性考察结果表8注射用克林霉素磷酸酯与5%葡萄糖注射液的配伍稳定性考察结果9)制备方法称取配方量克林霉素磷酸酯和氯化钠,在60%总体积的注射用水中加入配方量氯化钠或苯甲酸钠,搅拌使充分溶解,再加入配方量的克林霉素磷酸酯,边搅拌边用10%碳酸氢钠调PH至6.0-6.5,再加注射用水至规定体积,加0.1%的针用活性炭,搅拌30分钟,除菌过滤,滤液经检验合格后,按每瓶约2.5mL分装于玻璃管制注射剂瓶中或粉液双室袋的粉腔中,冷冻干燥,压塞,轧盖,包装,即得;将制备的注射用克林霉素磷酸酯溶液定量分装入7m1玻璃管制注射剂瓶,用氯化药用丁基橡胶塞半加塞,放入冻干机箱内,开启冻干机,采用程序控制设定冻干曲线(如图1所示),冻干过程结束,自动压塞;考察按上述冻干曲线制备的三批注射用克林霉素磷酸酯的外观、水分、pH,结果表明:按设定的冻干曲线考察制备的三批产品,其外观、水分和pH值均符合质量标准要求(如表9所示);表9同一冻干曲线下三批样品考察结果批号外观水分(%)pH050791为白色疏松状物0.416.3050792为白色疏松状物0.586.3050793为白色疏松状物0.436.3本发明实验中,根据国家食品药品监督管理局制剂处方及工艺研究指导原则,进行了制剂处方和工艺的研究,结果表明,本发明的粉针试剂的配方可行,制备方法的工艺条件可以保证药品质量。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1