蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制作方法
本发明涉及生物医学领域中蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用。
背景技术:
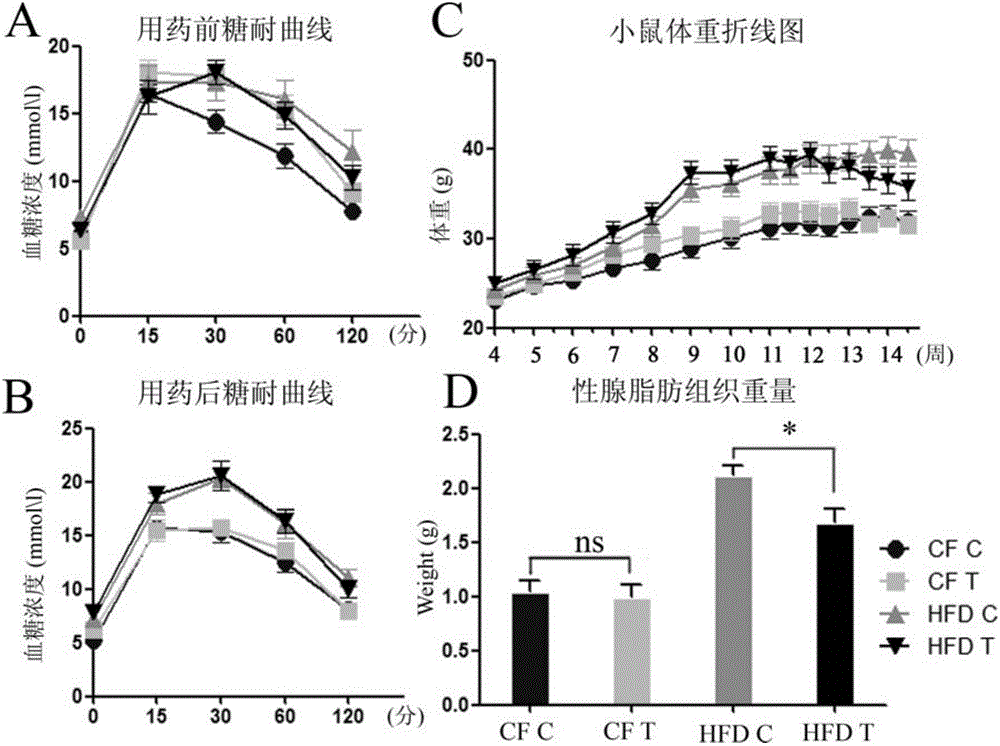
:在正常细胞中,蛋白酶体可以通过降解被泛素化标记的蛋白从而达到调控蛋白质的水平以及功能。除此之外蛋白酶体在清除细胞中的异常蛋白或者错误折叠蛋白同样发挥着重要的作用。蛋白酶体抑制剂可能通过抑制一些促进细胞凋亡的因子的降解,从而达到抑制癌细胞无限增殖的目的。Bortezomib(中文译为:硼替佐米),其化学式如式1:千禧制药(MillenniumPharmaceuticals)定硼替佐米商品名为Velcade。中国的正式商品名为万珂,硼替佐米是其主成分,是一种癌症治疗药物。硼替佐米是全球第一个用于治疗人类疾病的蛋白酶体抑制剂(proteasomeinhibitor),也是唯一一个被FDA批准的用于人类临床疾病的蛋白酶体抑制剂药物,可延缓、停止及治疗多发性骨髓瘤(multiplemyeloma)和被套细胞淋巴瘤(Mantlecelllymphoma),属于标靶治疗的新型抗癌药。硼替佐米于1995年由美国一家制药公司Myogenics公司(后来改名为ProScript)的科学家发现,药物代号为PS-341。该药物仅仅做了小规模的针对多发性骨髓瘤病人的一期临床试验。1999年10月Leukosite公司又被MillenniumPharmaceuticals收购,千禧制药公司并与美国强生公司合作继续发展PS-341。临床研究指出,一群对治疗没有效应或已经复发的骨髓瘤病患,接受万珂的治疗后,有35%对万珂有效应,而且其中有10%的患者属于完全或接近完全的缓解。如此的效应率具有高度意义,因为后期疾病的患者或对其他治疗无反应的多发性骨髓瘤患者,有完全缓解的很罕见。两个二期临床试验的证据显示,PS-341确实具备持续性的疗效反应,因此美国食品药品监督管理局(FDA)在2003年5月快速审查通过准 许其用于治疗已接受过至少两种处方而表现出疾病恶化的多发性骨髓瘤,之后于2008年同意应用于所有多发性骨髓瘤病人。脂滴是细胞内中性脂(neutrallipids)的主要贮存场所,广泛存在于细菌、酵母、植物、昆虫以及动物细胞中。研究表明,多种代谢性疾病,如肥胖、脂肪肝、心血管疾病及糖尿病、中性脂贮存性疾病和NiemannPickC疾病,往往都伴随着脂滴的大小和单位面积数目(密度)的异常。技术实现要素:本发明所要解决的技术问题是提供蛋白酶体抑制剂的降低生物体内脂的含量和脂储积能力的新功能。为解决上述技术问题,本发明首先提供了下述1-5中任一应用:1、蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用;2、蛋白酶体抑制剂在制备降低动物组织脂含量或脂储积能力产品中的应用;3、蛋白酶体抑制剂在制备降低动物细胞脂含量或脂储积能力产品中的应用;4、蛋白酶体抑制剂在制备治疗动物脂肪肝产品中的应用;5、蛋白酶体抑制剂在制备降低动物体重产品中的应用。本发明中,所述动物可为哺乳动物,如人或小鼠。所述哺乳动物具体可为小鼠(C57BL/6)。所述动物细胞具体可为人类宫颈癌HeLa细胞。所述动物组织可为脂肪组织或非脂肪组织。所述脂肪组织具体可为性腺脂肪组织。所述非脂肪组织具体可为肝脏组织。本发明中,所述蛋白酶体抑制剂可为硼替佐米(Bortezomib)、以所述硼替佐米为活性成分的药物、MG132或以所述MG132为活性成分的药物。所述硼替佐米具体可为SelleckChemicals公司产品,产品目录号为S1013。所述MG132具体可为SelleckChemicals公司产品,产品目录号位S2619。本发明中,所述动物脂含量是指动物中性脂含量,可体现在动物细胞和/或组织中脂滴的大小和单位面积数目(密度)上。所述动物组织脂含量是指动物组织中性脂含量,可体现在动物组织中脂滴的大小和单位面积数目(密度)上。所述动物细胞脂含量是指动物细胞中性脂含量,可体现在动物细胞中脂滴的大小和单位面积数目(密度)上。本发明中,所述脂肪肝为非酒精性脂肪性肝病(NAFLD),是指除酒精和其他明确的损肝因素外所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征。实验证明,蛋白酶体抑制剂可以降低动物脂含量,施用蛋白酶体抑制剂后动物的脂肪肝表型得到了明显的改善:HFDT组(高脂饮食小鼠蛋白酶体抑制剂处理组)小鼠肝脏组织中的脂滴直径高于HFDC组(高脂饮食小鼠空白处理组)小鼠肝脏组织 中的脂滴直径(p<0.001),CFT组(正常体重小鼠蛋白酶体抑制剂处理组)小鼠肝脏组织中的脂滴直径高于CFC组(正常体重小鼠空白处理组)小鼠肝脏组织中的脂滴直径(p<0.001);HFDC组(高脂饮食小鼠空白处理组)小鼠每3mm2肝脏组织中的脂滴个数高于HFDT组(高脂饮食小鼠蛋白酶体抑制剂处理组)小鼠每3mm2肝脏组织中的脂滴个数(p<0.001),CFC组(正常体重小鼠空白处理组)小鼠每3mm2肝脏组织中的脂滴个数高于CFT组(正常体重小鼠蛋白酶体抑制剂处理组)小鼠每3mm2肝脏组织中的脂滴个数(p<0.001)。HFDT组(高脂饮食小鼠蛋白酶体抑制剂处理组)小鼠的性腺脂肪组织重量显著高于HFDC组(高脂饮食小鼠空白处理组)小鼠的性腺脂肪组织重量,HFDT组(高脂饮食小鼠蛋白酶体抑制剂处理组)小鼠的性腺脂肪组织重量为HFDC组(高脂饮食小鼠空白处理组)小鼠的0.79倍。实验证明,蛋白酶体抑制剂可以降低动物细胞的脂储积能力:MG132可以减少人类宫颈癌HeLa细胞中的脂滴数量,并且人类宫颈癌HeLa细胞中的脂滴数量随MG132浓度的升高而降低。实验证明,蛋白酶体抑制剂可以降低肥胖动物的体重:硼替佐米对正常体重小鼠无影响,HFDT组(高脂饮食小鼠蛋白酶体抑制剂处理组)小鼠体重为HFDC组(高脂饮食小鼠空白处理组)小鼠的0.90倍。实验证明,蛋白酶体抑制剂可以用来制备降低动物、动物细胞与动物组织的脂含量和脂储积能力以及动物体重的产品。附图说明图1为硼替佐米处理对小鼠体重和性腺脂肪组织的影响。其中,A为硼替佐米处理前各组小鼠的糖耐受情况;B为硼替佐米处理后各组小鼠的糖耐受情况;C为不同时期各组小鼠体重的变化情况;D为在处理28天各组小鼠性腺脂肪组织的重量,ns表示T-test中无显著差异,*表示P<0.05。图2为各组小鼠肝脏组织和性腺脂肪组织中的脂滴。其中,A为各组小鼠肝脏组织和性腺脂肪组织中的脂滴照片;B为各组小鼠肝脏组织中的脂滴直径;C为各组小鼠肝脏组织中的脂滴密度。ns表示T-test中无显著差异,***表示P<0.001。图3为不同培养基中人类宫颈癌HeLa细胞中的脂滴。其中,20uM、60uM和100uM分别表示20μM、60μM和100μM。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的小鼠(C57BL/6)为北京维通利华实验动物技术有限公司产品,专业名称为C57BL/6NCrlBR,品系代码为213。下述实施例中的人类宫颈癌HeLa细胞系为ACTT(AmericanTypeCultureCollection)产品,商品名为HeLa(CCL-2TM)。下述实施例中的脂肪含量为10%(脂肪提供热量百分比)的鼠粮为ResearchDiets,Inc产品,产品目录号为D12450H。下述实施例中的脂肪含量为45%(脂肪提供热量百分比)的鼠粮为ResearchDiets,Inc产品,产品目录号为D12451。下述实施例中的硼替佐米为SelleckChemicals产品,产品目录号为S1013。下述实施例中的MG132为SelleckChemicals产品,产品目录号位S2619。下述实施例中的OA培养基的制备方法为:向无水乙醇中加入OA得到OA浓度为100mM的OA母液,向DMEM完全培养基中加入OA母液得到OA浓度为100μM的OA培养基。下述实施例中的OA-20μMMG132培养基的制备方法为:向DMSO中加入MG132得到MG132浓度为20mM的MG132母液,向上述OA培养基中加入MG132母液得到MG132浓度为20μM的OA-20μMMG132培养基。下述实施例中的OA-60μMMG132培养基的制备方法为:向DMSO中加入MG132得到MG132浓度为20mM的MG132母液,向上述OA培养基中加入MG132母液得到MG132浓度为60μM的OA-60μMMG132培养基。下述实施例中的OA-100μMMG132培养基的制备方法为:向DMSO中加入MG132得到MG132浓度为20mM的MG132母液,向上述OA培养基中加入MG132母液得到MG132浓度为100μM的OA-100μMMG132培养基。下述实施例中的OA培养基、OA-20μMMG132培养基、OA-60μMMG132培养基和OA-100μMMG132培养基中的油酸(Oleicacid,O.A.)可使在这些培养基中培养的细胞产生大量大小均一的脂滴。下述实施例中的动物体内脂含量是指动物体内中性脂含量;细胞中的脂含量是指细胞中的中性脂含量。实施例1、蛋白酶体抑制剂可以降低动物体内脂含量本实施例中用到的蛋白酶体抑制剂为硼替佐米。一、肥胖小鼠模型的建立通过不同脂肪含量的配方鼠粮对小鼠(C57BL/6)进行不同肥胖程度的诱导,具体方法如下:选取32只4周龄小鼠(C57BL/6),随机分为两组,每组16只:一组饲喂脂肪含量为10%(脂肪提供热量百分比)的鼠粮7周,得到16只11周龄的正常体重小鼠;另一组饲喂脂肪含量为45%(脂肪提供热量百分比)的鼠粮7周,得到16只11周龄的高脂饮食(highfatdiet,HFD)小鼠,这16只高脂饮食小鼠具有与人类肥胖人群相似的II型糖尿病症状,如胰岛素抵抗。从小鼠4周龄至11周龄,每周测量体重一次,上述小鼠的体重如图1中C所示。二、硼替佐米可以降低动物体内脂含量将硼替佐米溶于DMSO中,得到硼替佐米溶液。称量正常体重小鼠体重后,按照1μg硼替佐米/g体重的标准分别对8只正常体重小鼠灌胃上述硼替佐米溶液,将灌胃当天记为处理第0天(小鼠11周龄),分别在处理第3天、处理第7天(小鼠12周龄)、处理第10天、处理第14天(小鼠13周龄)、处理第17天、处理第21天(小鼠14周龄)和处理第24天各灌胃一次,每次灌胃硼替佐米溶液的体积均和第一次灌胃硼替佐米溶液的体积相同,分别在处理第3天、处理第7天、处理第10天、处理第14天、处理第17天、处理第21天、处理第24天和处理第28天(小鼠15周龄)称量小鼠体重(表1和图1中C),硼替佐米处理结束后得到8只15周龄正常体重硼替佐米处理小鼠(CFT组小鼠),硼替佐米处理过程中,这8只小鼠均用脂肪含量为10%(脂肪提供热量百分比)的鼠粮饲喂。按照上述方法,将硼替佐米溶液替换为等体积的DMSO,其他均不变,得到8只15周龄正常体重空白处理小鼠(CFC组小鼠),DMSO处理过程中小鼠体重如表1和图1中C所示。称量高脂饮食小鼠体重后,按照1μg硼替佐米/g体重的标准分别对8只高脂饮食小鼠灌胃上述硼替佐米溶液,将灌胃当天记为处理第0天(小鼠11周龄),分别在处理第3天、处理第7天(小鼠12周龄)、处理第10天、处理第14天(小鼠13周龄)、处理第17天、处理第21天(小鼠14周龄)和处理第24天各灌胃一次,每次灌胃硼替佐米溶液的体积均和第一次灌胃硼替佐米溶液的体积相同,分别在处理第3天、处理第7天、处理第10天、处理第14天、处理第17天、处理第21天、处理第24天和处理第28天(小鼠15周龄)称量小鼠体重(表1和图1中C),硼替佐米处理结束后得到8只15周龄高脂饮食硼替佐米处理小鼠(HFDT组小鼠),硼替佐米处理过程中,这8只小鼠均用脂肪含量为45%(脂肪提供热量百分比)的鼠粮饲喂。按照上述方法,将硼替佐米溶液替换为等体积的DMSO,其他均不变,得到8只15周龄高脂饮食空白处理小鼠(HFDC组小鼠),DMSO处理过程中小鼠体重如表1 和图1中C所示。在处理第0天各组小鼠灌胃前和处理第28天各组小鼠体重称量后检测小鼠的糖耐受情况,具体方法如下:对各组已空腹12小时的小鼠,分别依照体重按10μl/g体重的剂量腹腔注射浓度为0.2g/ml的葡萄糖溶液,在注射葡萄糖前和注射葡萄糖后15分钟、30分钟、60分钟和120分钟分别测定每只小鼠的血糖含量(图1中A和B)。在处理第28天,分别取出以上各组小鼠的性腺脂肪组织(gWAT,性腺脂肪组织是和小鼠性腺紧密相连的一堆脂肪块,可以直接从小鼠体内取出)并称取重量(图1中D),然后用苏木素/伊红(HE)染色后观察性腺脂肪组织中的脂滴(图2中A)。在处理第28天,分别取出以上各组小鼠的肝脏组织,用苏木素/伊红(HE)染色后观察肝脏组织中的脂滴并统计脂滴的直径和分布密度(图2和表2)。表1、每次灌胃前各组小鼠的体重(g)处理时间HFDT组HFDC组CFT组CFC组处理第0天37.43±3.8036.20±3.8231.13±3.4630.11±3.21处理第3天38.98±3.8737.68±4.2732.87±3.2131.17±3.13处理第7天38.60±3.8137.76±4.4532.96±3.0331.82±3.44处理第10天39.43±3.7038.92±4.4532.97±3.3031.70±3.42处理第14天37.77±4.0438.88±4.4832.77±2.9431.31±2.99处理第17天38.17±3.8939.11±4.1633.28±3.0531.98±3.47处理第21天36.83±3.6839.41±4.3131.62±1.8732.41±3.46处理第24天36.63±4.1439.92±4.3632.31±2.2532.52±3.50处理第28天35.82±4.1439.60±4.3031.58±2.4731.98±3.22结果显示,糖耐受实验表明硼替佐米小鼠的糖耐受没有影响。在处理第0天,用于硼替佐米处理的8只正常体重小鼠和用于DMSO处理的8只正常体重小鼠体重基本无差异,用于硼替佐米处理的8只高脂饮食小鼠和用于DMSO处理的8只高脂饮食小鼠体重基本无差异,用于硼替佐米处理的8只高脂饮食小鼠的体重为用于硼替佐米处理的8只正常体重小鼠的1.2倍;在处理第28天,正常体重空白处理小鼠(CFC组小鼠)与正常体重硼替佐米处理小鼠(CFT组小鼠)体重基本无差异,而高脂饮食硼替佐米处理小鼠(HFDT组小鼠)体重为高脂饮食空白处理小鼠(HFDC组小鼠)的0.9倍,表明,硼替佐米对正常体重小鼠无影响,但可以降低高脂饮 食小鼠(即肥胖小鼠)的体重。在处理第28天,正常体重空白处理小鼠(CFC组小鼠)、正常体重硼替佐米处理小鼠(CFT组小鼠)、高脂饮食空白处理小鼠(HFDC组小鼠)和高脂饮食硼替佐米处理小鼠(HFDT组小鼠)的性腺脂肪组织重量分别为1.04±0.27g、0.99±0.26g、2.12±0.24g和1.68±0.36g。正常体重空白处理小鼠(CFC组小鼠)与正常体重硼替佐米处理小鼠(CFT组小鼠)的性腺脂肪组织重量基本无差异,而高脂饮食硼替佐米处理小鼠(HFDT组小鼠)的性腺脂肪组织重量显著高于高脂饮食空白处理小鼠(HFDC组小鼠)的性腺脂肪组织重量,高脂饮食硼替佐米处理小鼠(HFDT组小鼠)的性腺脂肪组织重量为高脂饮食空白处理小鼠(HFDC组小鼠)的0.79倍。表明,硼替佐米对正常体重小鼠无影响,但可以降低高脂饮食小鼠(即肥胖小鼠)的性腺脂肪组织重量。表2、各组小鼠的肝脏组织中的脂滴直径和分布密度组别脂滴直径(μm)脂滴密度(每3mm2脂滴个数)CFC组22.57±8.507264.3±95.37CFT组6.843±2.46312.38±8.749HFDC组21.72±6.245459.0±72.23HFDT组7.076±2.825233.3±84.53结果显示,CFC组小鼠与HFDC组小鼠肝脏组织中的脂滴直径基本无差异,HFDT组小鼠与CFT组小鼠肝脏组织中的脂滴直径基本无差异,HFDT组小鼠肝脏组织中的脂滴直径高于HFDC组小鼠肝脏组织中的脂滴直径(p<0.001),CFT组小鼠肝脏组织中的脂滴直径高于CFC组小鼠肝脏组织中的脂滴直径(p<0.001)。HFDC组小鼠每3mm2肝脏组织中的脂滴个数高于CFC组小鼠每3mm2肝脏组织中的脂滴个数(p<0.001),HFDT组小鼠每3mm2肝脏组织中的脂滴个数高于CFT组小鼠每3mm2肝脏组织中的脂滴个数(p<0.001),HFDC组小鼠每3mm2肝脏组织中的脂滴个数高于HFDT组小鼠每3mm2肝脏组织中的脂滴个数(p<0.001),CFC组小鼠每3mm2肝脏组织中的脂滴个数高于CFT组小鼠每3mm2肝脏组织中的脂滴个数(p<0.001)。表明,硼替佐米可以降低小鼠肝脏组织中的脂滴直径与脂滴密度,小鼠的脂肪肝表型得到了明显的改善(图2中A)。实施例2、蛋白酶体抑制剂可以降低细胞中的脂含量本实施例中用到的蛋白酶体抑制剂为MG132。分别向OA培养基、OA-20μMMG132培养基、OA-60μMMG132培养基和OA-100μMMG132培养基中加入人类宫颈癌HeLa细胞系,每种培养基中人类宫颈癌HeLa细胞的密度相同,然后分别在37℃下培养24小时,经过4%PFA固定后,用BODIPY标记各培养基的人类宫颈癌HeLa细胞的脂滴后,观察各培养基中细胞中的脂滴,结果如图3所示。结果显示,MG132可以减少人类宫颈癌HeLa细胞中的脂滴数量,并且人类宫颈癌HeLa细胞中的脂滴数量随MG132浓度的升高而降低,表明MG132可以降低细胞的脂储积能力,而且具备剂量效应。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种制备自噬小体型瘤苗的培养基添加剂及其制备方法与制造工艺
- N-萘烷基取代的含氮杂环衍生物、制备方法及其抗肿瘤用途与制造工艺
- 作为BET蛋白抑制剂的1H‑吡咯并[2,3‑c]吡啶‑7(6H)‑酮和吡唑并[3,4‑c]吡啶‑7(6H)‑酮的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- 一种人肿瘤抑制蛋白变体及其应用的制造方法与工艺
- G蛋白信号调节因子6及其抑制剂在治疗脂肪肝和Ⅱ型糖尿病中的功能和应用的制造方法与工艺
- 蛋白酶体抑制剂在制备降低动物脂含量或脂储积能力产品中的应用的制造方法与工艺
- GINS2基因或蛋白的抑制剂在制备抗肿瘤药物中的应用的制造方法与工艺
- ZNF383蛋白在制备抑制p53蛋白活性的产品中的应用的制造方法与工艺
- 蛋白酶体抑制剂MLN9708的合成方法与制造工艺