儿茶酚胺产生促进剂,起因于儿茶酚胺的缺乏的疾病的治疗药/预防药及治疗用/预防用食品组合物的制作方法
本发明涉及儿茶酚胺产生促进剂、起因于缺乏儿茶酚胺的疾病的治疗药/预防药、起因于缺乏儿茶酚胺的疾病的治疗用/预防用食品组合物。
背景技术:
儿茶酚胺是具有儿茶酚与胺的化合物,在生物体内作为一部分的神经递质存在。在生物体内最丰富地含有的儿茶酚胺是肾上腺素、去甲肾上腺素及多巴胺,它们由酪氨酸转化而来。酪氨酸转化成L-DOPA(L-3,4-二羟基苯丙氨酸),进而,L-DOPA转化成多巴胺。另外,去甲肾上腺素由多巴胺转化而来,肾上腺素由去甲肾上腺素转化而来。
阿尔兹海默病或帕金森氏病等神经退行性疾病中,确认了儿茶酚胺的缺乏,实用化或研究基于儿茶酚胺的产生促进的预防或治疗。例如作为抗帕金森氏病药,给予作为肾上腺素、去甲肾上腺素及多巴胺的前体的苯丙氨酸、酪氨酸或L-DOPA。另外,为了防止起因于利用单胺氧化酶进行的氨基氧化去除的代谢,作为抗帕金森氏病药使用单胺氧化酶抑制药。关于阿尔兹海默病,近年来逐渐变成主要进行药物治疗,目前未发现根本的治疗药。然而,研究了去甲肾上腺素、多巴胺的重要性,并且对于阿尔兹海默病模型小鼠,也报道了去甲肾上腺素的组织内浓度的减少(非专利文献1~4),因此期待开发基于儿茶酚胺的产生促进的阿尔兹海默病的预防或治疗方法。
另一方面,蚯蚓萃取物或蚯蚓干燥粉末自古以来在东方国家主要作为各种疾病的预防剂、治疗剂使用,至今为止已知作为膀胱内结石缩小剂及排出促进剂、黄疸治疗剂、分娩促进剂、强壮剂、育毛剂、强精剂、解热剂、痉 挛治疗剂、血液循环促进剂、半身不遂治疗剂、间接镇痛剂、排尿剂、支气管哮喘剂、高血压症治疗剂的用途。
但是,至今为止没有将蚯蚓作为有效成份的在儿茶酚胺产生促进剂、阿尔兹海默病或帕金森氏病的预防/治疗中利用蚯蚓的报道例。
现有技术文献
非专利文献
非专利文献1:Francis BM et al.,Neuropsychopharmacology(2012)37:1934-1944
非专利文献2:Szot P,Epilepsia(2012)53(Suppl.1):61-66
非专利文献3:Xu Y et al.,Progress in Neurobiology(2012)97:1-13
非专利文献4:Robertson IH,Neurobiology of Aging(2013)34:298-308
技术实现要素:
发明要解决的问题
考虑在阿尔兹海默病或帕金森氏病等的神经退行性疾病的治疗中伴随长期的药剂给予,因此特别需要安全且副作用少的药剂,需求来自天然物的儿茶酚胺产生促进剂以及阿尔兹海默病及帕金森氏病的预防/治疗药。
于是,本发明的目的在于提供将天然物作为有效成分含有的儿茶酚胺产生促进剂、起因于缺乏儿茶酚胺的疾病的预防/治疗剂,起因于缺乏儿茶酚胺的疾病症状的改善用食品组合物及改善用医药用组合物。
用于解决问题的方案
即,本发明的儿茶酚胺产生促进剂,其特征在于,含有蚯蚓的干燥粉末、磨碎物及/或萃取物作为有效成分。
本发明的起因于缺乏儿茶酚胺的疾病的治疗药或预防药,其特征在于,含有前述儿茶酚胺产生促进剂。
本发明的起因于缺乏儿茶酚胺的疾病的治疗用或预防用的食品组合物,其特征在于,含有前述儿茶酚胺产生促进剂。
本发明的起因于缺乏儿茶酚胺的疾病的治疗药或预防药,其中,前述起因于缺乏儿茶酚胺的疾病优选选自由阿尔兹海默病及帕金森氏病组成的组。
本发明的起因于缺乏儿茶酚胺的疾病的治疗用或预防用的食品组合物,其中,起因于前述缺乏儿茶酚胺的疾病优选选自由阿尔兹海默病及帕金森氏病组成的组。
本发明的儿茶酚胺产生促进剂的制造方法,其特征在于,使用蚯蚓的干燥粉末、磨碎物或萃取物。
本发明的起因于缺乏儿茶酚胺的疾病的治疗药或预防药的制造方法,其特征在于,使用蚯蚓的干燥粉末、磨碎物或萃取物。
本发明的起因于缺乏儿茶酚胺的疾病的治疗用或预防用食品组合物的制造方法,其特征在于,使用蚯蚓的干燥粉末、磨碎物或萃取物。
本发明的儿茶酚胺的产生促进方法,其特征在于,使用蚯蚓的干燥粉末、磨碎物及/或萃取物。
本发明的蚯蚓的干燥粉末、磨碎物或萃取物,其用于因缺乏儿茶酚胺的疾病的治疗。
本发明的起因于缺乏儿茶酚胺的疾病的治疗方法或预防方法,其特征在于,将蚯蚓的干燥粉末、磨碎物及/或萃取物以有效量给予对象。
发明的效果
根据本发明,可提供将天然物作为有效成分含有的儿茶酚胺产生促进剂,起因于缺乏儿茶酚胺的疾病的预防剂/治疗剂、起因于缺乏儿茶酚胺的疾病的症状的改善用食品组合物及改善用医药用组合物。
附图说明
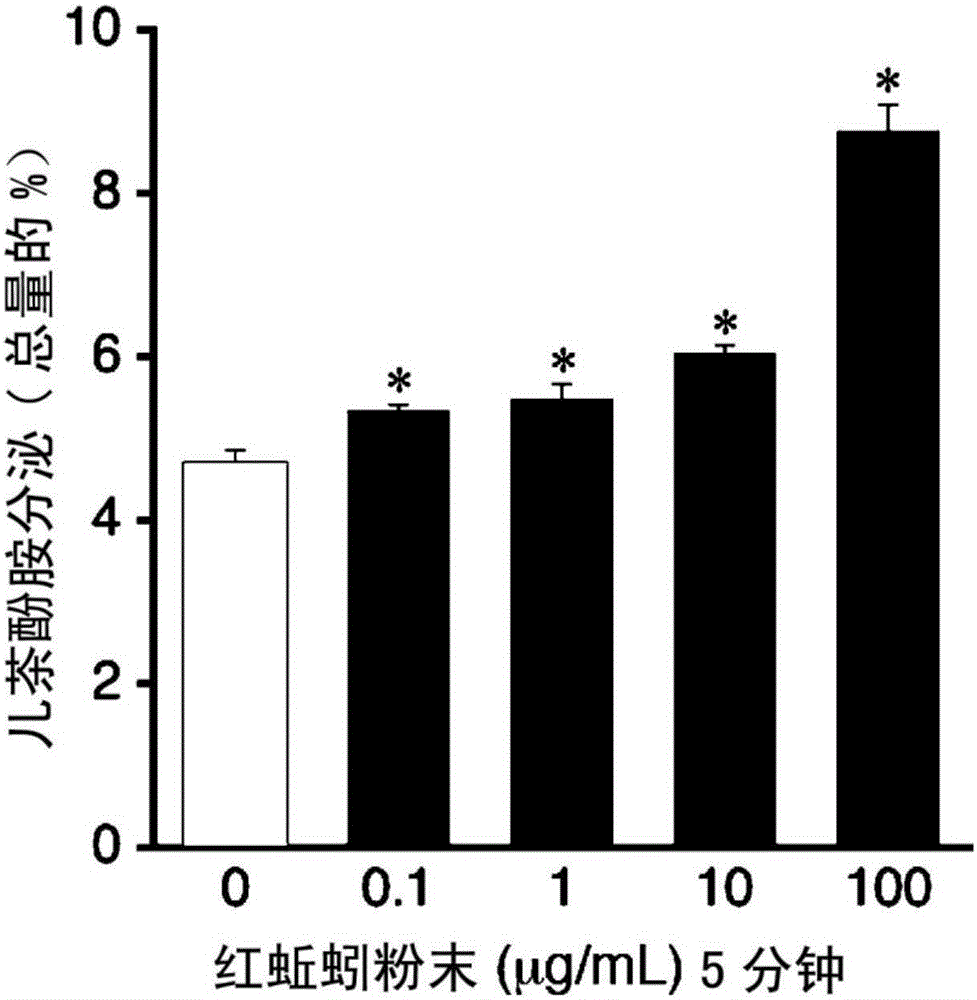
图1为表示介由含有蚯蚓干燥粉末的牛肾上腺髓质嗜铬细胞的儿茶酚胺的分泌量变化的图表。横轴表示蚯蚓干燥粉末的浓度。纵轴表示儿茶酚胺的分泌量。将蚯蚓干燥粉末0μg/mL、5分钟时的细胞内儿茶酚胺量设为100%。
图2为表示介由含有蚯蚓干燥粉末的牛肾上腺髓质嗜铬细胞的细胞内钙浓度变化的照片图。
图3为表示介由含有蚯蚓干燥粉末的牛肾上腺髓质嗜铬细胞的细胞内钙的荧光强度变化的图表。横轴表示蚯蚓干燥粉末的浓度。纵轴表示荧光强度。将蚯蚓干燥粉末0μg/mL群组的荧光强度设为100%。
图4为表示介由调查含有蚯蚓干燥粉末的牛肾上腺髓质嗜铬细胞的酪胺酸羟化酶的磷酸化变化的免疫印迹法的结果的照片图。
具体实施方式
本发明中,使用于原料的蚯蚓没有特别限制,例如可使用红蚯蚓(Lumbricus rubellus)、LT蚯蚓(Lumbricus terrestris)、赤子爱胜蚓(Eisenia foetida)、缟蚯蚓(Allolobophora caliginosa)、八毛枝蚓(Dendrobaena octaedra)、樱蚯蚓(Allolobophora japonica Michaelsen)、八田蚯蚓(Drawida hattamimizu Hatai)、背黑蚯蚓(Pheretima divergens Michaelsen)、普通蚯蚓(Pheretima communissima)、田地蚯蚓(Pheretima agrestis)、西宝环毛蚓(Pheretima sieboldi Horst)、黑氏环毛蚓(Pheretima hilgendorfi)、湖滨蚯蚓(Pontodrilus matsushimensis Iizuka)、丝蚯蚓(Tubifex hattai Nomura)、[Limnodrilus gotoi Hatai=L.Socialis Stephenson]等。
本发明中蚯蚓的干燥粉末意指,将未处理或经过前处理的蚯蚓的磨碎物或萃取物干燥而得到的粉末。另外,蚯蚓的磨碎物意指,将未处理或经过前处理的蚯蚓磨碎而得到的液态或糊状的物质。蚯蚓的萃取物意指,将未处理或经过前处理的蚯蚓或其磨碎物溶解于水、水溶液或有机溶剂、不溶性馏分 去除或分离而得到的提取物。前述前处理没有特别限制,可列举后述的污物等的去除处理等。另外,蚯蚓的干燥粉末、磨碎物及萃取物也可以进行后处理,作为后处理可列举造粒、过滤、精制、浓缩、稀释及pH调节等。
用于得到蚯蚓的磨碎物的磨碎方法没有特别限制,例如可以使用均质机、混合器、均相搅拌机、擂溃机、加压型细胞破坏装置等磨碎。
用于得到蚯蚓的萃取物的萃取方法没有特别限制,例如将蚯蚓的干燥粉末或磨碎物溶解于萃取溶剂,去除或分离不溶性馏分而可萃取。作为萃取溶剂可列举水、水溶液、以及乙醇、丙酮及乙酸乙酯等有机溶剂,可单独1种或组合2种以上。其中,优选水、乙醇或乙醇水溶液。
用于得到蚯蚓的干燥物的干燥方法没有特别限制,介由冷冻干燥、加热干燥及喷雾干燥等干燥方法可进行干燥。其中,根据后述的理由,优选冷冻干燥。
本发明中蚯蚓的干燥粉末、磨碎物或萃取物根据目的配混有效量即可。虽然适当的配混量依赖于目的、给药途径及形态、蚯蚓的干燥粉末等制造方法等的各种因素,但去除后述的残留在蚯蚓消化管内的消化物、附着在表皮的污物等后,将蚯蚓磨碎,换算成将磨碎物冷冻干燥而得到的蚯蚓的干燥粉末重量,将起因于缺乏儿茶酚胺的疾病的预防或轻度的疾病治疗作为目的时,优选为每一天1~15000mg,更优选为每一天12~1800mg,进一步优选为每一天120~180mg。另外,起因于缺乏儿茶酚胺的重度的疾病治疗作为目的时,优选为每1天1~15000mg,更优选为每1天18~3600mg,进一步优选为每一天180~360mg。
本发明的儿茶酚胺产生促进剂、治疗药、预防药及食品组合物的形状没有特别限制,可以为固态、粉末、半固态及液态的任一者均可。
本发明中可直接使用蚯蚓的干燥粉末、磨碎物或萃取物。另外,特别是本发明的儿茶酚胺产生促进剂、治疗药及预防药,也可包含药学上可接受的 载体,例如作为片剂、颗粒剂、散剂、胶囊剂、软胶囊剂、溶液剂、注射剂、栓剂、缓释剂等,可经口地或非经口地(例如静脉给予、直接给予于患部等)给予。作为药学上可接受的载体,可使用赋形剂、粘合剂、崩解剂、流化剂、润滑剂、涂布剂、悬浊剂、着色剂、甜味剂或表面活性剂等,依照公知的方法可制成一般的医药制剂形态。另外,也可包含其他治疗/预防成分或药学上可接受的添加剂。
另外,本发明特别是本发明的儿茶酚胺产生促进剂及食品组合物中也可包含通常使用于食品的添加剂。可使用例如赋形剂、粘合剂、崩解剂、流化剂、润滑剂、涂布剂、悬浊剂、着色剂、甜味剂或表面活性剂等,依据公知的方法可制成一般的食品组合物的形态。另外,也可包含其他食品或来自食品的成分。
本发明中蚯蚓的干燥粉末、磨碎物及萃取物中,就制造工序的保存稳定性的观点而言,优选使用蚯蚓的干燥粉末。也可以使蚯蚓的干燥粉末预先溶解及/或分散于水等液体后,与药学上及/或使用于食品的通常的载体、添加剂等其他成分混合。
本发明中没有特别限制起因于缺乏儿茶酚胺的疾病,但优选选自由阿尔兹海默病和帕金森氏病组成的组。
为了将蚯蚓作为原料进行经口给予,优选去除残留在蚯蚓消化管内的消化物、附着在表皮的污物等。本发明中没有特别限制去除方法,也可使用公知的方法去除。可使用例如将蚯蚓生物体浸渍在如钠盐或钾盐那样的碱盐水溶液中,使消化管内的黄土排泄的方法(记载在日本特开平1-47718号公报、日本特开平1-47719号公报、日本特开平1-47720号公报及特开平1-268639号公报中的方法),将蚯蚓生物体放置维持于6~26℃的酸水溶液中0.1~5小时而去除消化管内的粪土的方法(记载在日本特开平3-72427号公报中的方法)等。
作为本发明的去除方法,优选使下述的金属的氯化物及/或羟基羧酸与 蚯蚓接触的方法。
上述金属的氯化物是选自由钾、钠、镁及钙组成的组中的至少1种金属的氯化物。即,是选自由氯化钾、氯化钠、氯化镁及氯化钙组成的组中的至少1种。另外,也可以为上述物质的混合物,上述物质与能够添加于食品中的其他无害成分的混合物。作为这样的混合物可列举例如食盐、岩盐、天日盐。上述金属的氯化物可以通过将粉末状的物质撒在活蚯蚓上来使用,由此引起蚯蚓与金属的氯化物的接触。
使上述金属的氯化物接触活蚯蚓后,优选使活蚯蚓如下所述与羟基羧酸接触。另外,也可以不接触上述金属的氯化物,如下述进行羟基羧酸与蚯蚓的接触。
关于与上述羟基羧酸的接触,也可通过将粉末状羟基羧酸撒在活蚯蚓上进行。另外,也可浸渍在pH2~5的羟基羧酸水溶液中。经由与金属的氯化物的接触后进行与羟基羧酸的接触时,优选与上述金属的氯化物的接触后迅速地进行与羟基羧酸的接触。另外,活蚯蚓与羟基羧酸的接触之前,优选水洗蚯蚓。通过水洗去除上述金属的氯化物后使蚯蚓与羟基羧酸接触时可得到酶活性高的蚯蚓干燥粉末。与羟基羧酸接触前进行水洗时,在开始与金属的氯化物接触后,优选30分钟以内、更优选20分钟以内进行水洗。没有特别限制水洗方法,可采用公知的方法。
使活蚯蚓长时间与羟基羧酸接触时会死亡,因为生活功能消失、消化管内的消化物无法排泄,所以尽可能迅速地优选30秒以内、更优选以20秒以内,用水稀释羟基羧酸,调节成pH2~5的范围。
因羟基羧酸形成对蚯蚓不舒服的生活环境,所以活蚯蚓是通过自我保存本能放出体液、排泄物而改善生活环境。另外,因为羟基羧酸具有杀菌性,所以发挥如前述地促进消化器内残留的消化物等的排泄的作用,并且可以期待对蚯蚓上附着的杂菌进行杀菌的效果。
上述方法中使用的结晶状羟基羧酸在使用条件下呈现结晶状体即可,可与其羟基数或者羧基数无关地使用。即,单羟基单羧酸、单羟基多羧酸、多羟基单羧酸、多羟基多羧酸中的任一者均可。
作为本发明中使用的羟基羧酸,可列举例如乙醇酸、乳酸、乙酸、β‐羟基丙酸、α‐羟基正丁酸、β‐羟基正丁酸、α‐羟基正戊酸、β‐羟基正戊酸、苹果酸、α‐甲基苹果酸、α‐羟基戊二酸、β‐羟基戊二酸、柠檬酸、丙二酸及琥珀酸等。其中从对于食品可使用且容易获取的角度考虑,优选为乳酸、乙酸、苹果酸、柠檬酸、丙二酸及琥珀酸。羟基羧酸可单独一种使用,也可混合2种以上使用。
活蚯蚓组织的65%为水份。作为活蚯蚓的保命功能运作的时间,有某程度富余,但若活蚯蚓死亡,酶将工作,所以放置于不舒服生活环境下的时间的控制必须慎重进行。此时间依条件而被左右,但通常为3~180分钟的范围。
以羟基羧酸处理的蚯蚓生物体优选如下进行:利用水清洗后,磨碎成液状或糊状的磨碎物。清洗优选用纯水进行。清洗方法并无特别限制,可采用已知的水洗方法。另外,磨碎前的处理工序的合计时间、即自将金属氯化物撒于活蚯蚓至以水清洗羟基羧酸结束的时间优选总计为240分钟以内。
前述的磨碎方法并无特别限制,例如使用均化器、混合机、均质机、擂溃机、加压型细胞破坏装置,通常于1~25℃进行。从抑制蚯蚓构成成份分解的观点出发,优选于低温下进行,优选以2~15℃的温度。
由磨碎蚯蚓所得的磨碎物是收纳于例如不锈钢制托盘,施以冷冻干燥。此时蚯蚓生物体所含的酶虽不作用于活细胞,但因为对死细胞瞬间作用,有产生腐败性气体的担心,为防止此,优选以急速冷却、冷冻成-18℃~-35℃,抑制酶作用后,进行冷冻干燥。
为了如此地不损害蚯蚓原本的药理作用而粉末化,优选迅速地冷冻,但另一方面,使以过短时间冷冻时,与作为蚯蚓糊主要成份的蛋白质一同存在 的杂质形成点状不结冻部分,有时不能分离,所以不优选过度急速的冷冻。因此,冷冻优选在-18℃至-35℃的低温必要进行20~240小时、更优选进行50~170小时。
冷冻干燥时,选择能够去除水分和杂质而不残留的条件是重要的。因此,优选于压力50Pa以下,-60℃至+90℃的温度,边阶段地提高温度,边控制于10~60小时的范围进行。
作为冷冻干燥的方法,例如如前述将磨碎物以-18℃至-35℃的温度必要冷冻20~240小时后,于-60℃至+90℃的温度,分多个阶段进行升温,边于压力25~40Pa分多个阶段减压,边冷冻真空干燥10~60小时,由此可得到无菌状态的淡黄色蚯蚓干燥粉末。
进而,优选具备下述工序:将经冷冻干燥的前述磨碎物溶解于水或乙醇水溶液,去除或分离不溶性馏分。去除或分离不溶性馏分的工序可与上述同样地进行经由放置的沈淀、离心、过滤等。优选边搅拌或振动边进行溶解于水或乙醇水溶液的步骤。溶解于水所需的时间优选为1~120分钟,更优选为5~80分钟。虽乙醇水溶液的乙醇浓度没有特别限制,但优选为10~70%(v/v),更优选为30~60%。
对于本发明的儿茶酚产生促进剂、治疗药、预防药与食品组合物,可以如上述将溶解于水或乙醇水溶液的上清液直接使用以水溶液的状态使用,也可以去除水分作为浓缩液使用,也可以使其干燥以粉末状使用。也可以将上清液干燥并制成粉末状后溶解于水中使用。另外,也可以直接使用蚯蚓糊状物经冻结干燥后的粉末,而不溶解于水或乙醇水溶液。
另外,本发明中作为去除方法,优选如下进行:将活蚯蚓放置于不舒服环境下处理之前,即,使上述活蚯蚓与金属的氯化物或羟基羧酸接触之前,将活蚯蚓移动到如面包箱那样的扁箱中,放置于明亮处10~50小时,去除附着于表皮的污物。于明亮处的放置时间更优选为12~24小时。作为此时的收 纳量优选为蚯蚓堆栈为30~60mm、优选40~50mm的厚度的程度的量。此平箱内,使如砂、泥那样的异物不存在,另外,蚯蚓为夜行性且于黑暗处的生活活动变得活跃,有消耗体力的担心,所以夜晚优选通过电照培养方式等保持明亮。通过此操作,活蚯蚓发挥其自我防御本能,将消化管内残留的消化物排泄,此排泄物会覆盖全身,防止水分蒸发,以维持其生活环境,所以若该覆盖的污物即排泄物用适当的手段反复进行剥离,则最后可去除其消化管内的消化物以及附着于表皮的污物。
附着于蚯蚓表皮的污物的剥离,例如可使用无纺布覆盖活蚯蚓,使污物吸附在无纺布上来进行。通过将在明亮处的放置及去除附着于表皮的污物以及与上述金属氯化物及/或羟基羧酸相接触进行组合,可期待蚯蚓体内有毒物的进一步排出、去除。
本发明中作为得到蚯蚓的干燥粉末的方法,特别是就干燥粉末的保存稳定性的观点而言,优选下述方法。
(A-1)一种蚯蚓的干燥粉末的制造方法,其具备如下工序:
使活蚯蚓与选自由钾、钠、镁及钙组成的组中的至少1种金属的氯化物接触,
之后,使粉末状羟基羧酸与活蚯蚓接触,用水稀释调节成pH2~5,保持3~180分钟后,水洗活蚯蚓并磨碎,将得到的磨碎物进行冷冻干燥。
(A-2)一种蚯蚓的干燥粉末的制造方法,其具备如下工序:
使活蚯蚓与选自由钾、钠、镁及钙组成的组中的金属的氯化物接触,
之后,将活蚯蚓浸渍在调节成pH2~5的羟基羧酸水溶液中,保持3~180分钟后,水洗活蚯蚓并磨碎,将得到的磨碎物进行冷冻干燥。
(A-3)一种蚯蚓的干燥粉末的制造方法,在前述(A-1)或(A-2)中,进一步具备如下工序:使经冷冻干燥的前述磨碎物溶解于水或乙醇水溶液,去除或分离不溶性馏分后,进一步进行冷冻干燥。
另外,将磨碎活蚯蚓而成的磨碎物进行冷冻干燥后,从干燥物的杀菌的观点出发,优选将得到的干燥物以110℃以上且低于130℃进行加热处理。加热温度低于110℃时,有干燥物的杀菌不充分的情形,130℃以上时包含在蚯蚓干燥物中的酶失活而活性降低,故不优选。更优选为115~125℃。加热方法没有特别限定,可列举吹热风的方法、使用加热夹套的方法、放置于托盘等而用加热器加热的方法、使用定温恒温器的方法等。加热时间优选为30秒~130分钟,更优选为30分钟~90分钟,进一步优选为60分钟~90分钟。加热时间过短时,有会出现杀菌不充分的情况,加热时间过长时,会失去酶活性,故不优选。需要说明的是,由于对液体中的酶进行上述加热处理则会失去酶活性,所以本发明中优选使用蚯蚓的干燥粉末。
本发明中作为得到蚯蚓的磨碎物的方法,优选下述方法。
(B-1)一种蚯蚓的磨碎物的制造方法,其具备如下工序:
使活蚯蚓与选自由钾、钠、镁及钙组成的组中的至少1种金属的氯化物接触,
之后,使粉末状羟基羧酸与活蚯蚓接触,用水稀释调节成pH2~5,保持3~180分钟后,水洗活蚯蚓并磨碎。
(B-2)一种蚯蚓的磨碎物的制造方法,其具备如下工序:
使活蚯蚓与选自由钾、钠、镁及钙组成的组中的金属的氯化物接触,
之后,将活蚯蚓浸渍在调节成pH2~5的羟基羧酸水溶液中,保持3~180分钟后,水洗活蚯蚓并进行磨碎。
本发明中作为得到蚯蚓的萃取物的方法优选下述方法。
(C-1)一种蚯蚓的萃取物的制造方法,其具备如下工序:
使活蚯蚓与选自由钾、钠、镁及钙组成的组中的至少1种金属的氯化物接触,
之后,使粉末状羟基羧酸与活蚯蚓接触,用水稀释调节成pH2~5,保持 3~180分钟后,水洗活蚯蚓并磨碎,将得到的磨碎物经冷冻干燥后溶解于水或乙醇水溶液,去除或分离不溶性馏分。
(C-2)一种蚯蚓的萃取物的制造方法,其具备如下工序:
使活蚯蚓与选自由钾、钠、镁及钙组成的组中的金属的氯化物接触,
之后,将活蚯蚓浸渍在调节成pH2~5的羟基羧酸水溶液中,保持3~180分钟,然后水洗活蚯蚓并磨碎,将得到的磨碎物冷冻干燥后溶解于水或乙醇水溶液,去除或分离不溶性馏分。
实施例
以下通过实施例进一步详细地说明本发明,本发明不受以下实施例的任何限制。需要说明的是,以下,在没有特别说明的情况下,“%”为全部质量基准。
[蚯蚓干燥粉末的制备]
将放置在明亮场所24小时后已剥离表皮上附着的污物的活红蚯蚓30kg,在平盘上展开并使厚度约为5cm,在其上均匀地撒上250g氯化钠。20分钟后将蚯蚓进行水洗。然后,同样地撒上250g柠檬酸之后以15秒钟加入30L纯水进行稀释。此时在刚加水之后的pH为2.25,完全稀释时的pH为2.74。撒上柠檬酸粉末时,蚯蚓一口气释放出黄色的体液。以水稀释后,在该状态下保持20分钟。接着,从污浊的柠檬酸水溶液中取出活蚯蚓,经水洗后,用均质机在10℃的条件下进行磨碎,从而制备蚯蚓糊。接着,抽吸脱气对该蚯蚓糊进行抽吸脱气,去除其中含有的气体后,将其转移到不锈钢制的托盘上,并瞬间骤冷至-35℃,并在该温度下维持50小时进行缓慢冷冻。将经冷冻的蚯蚓糊以-35℃将压力0Pa保持2小时之后,升温至25℃的温度,在40Pa下干燥10小时,接着在40℃、压力35Pa下干燥14小时,接着在65℃、压力35Pa下干燥12小时,最后将温度设为80℃、压力25Pa的条件下保持6小时,由此进行真空冷冻干燥。通过该处理得到了含水量8质量%的淡黄色蚯蚓干燥粉末。
使用RM-50D型加热装置(大河原制作所股份有限公司制)将在上述得到的蚯蚓干燥粉末进行加热处理。加热条件是花费90分钟加热至120℃之后,在120℃加热20分钟,花费240分钟冷却至40℃之后,取出蚯蚓干燥粉末。
以乙醇:冷冻干燥粉末成为20:1(v/w)的方式将经加热处理的蚯蚓干燥粉末溶解于50%乙醇水溶液,在室温(25℃)下以1500rpm振动1小时。之后,以4℃、10000×g离心15分钟,分离上清,在75℃减压浓缩15分钟。将得到的上清移至不锈钢制的托盘上,并瞬间骤冷至-35℃,在此温度维持50小时进行缓慢冷冻。将经冷冻的蚯蚓糊在-35℃将压力0Pa保持2小时之后,升温至温度25℃,在40Pa下以10小时,之后在40℃、压力35Pa下以14小时,之后在65℃、压力35Pa下以12小时进行干燥,最后将温度设为80℃,压力25Pa下保持6小时,由此进行真空冷冻干燥,得到蚯蚓干燥粉末A-1。
[牛肾上腺髓质嗜铬细胞培养]
将由牛肾上腺髓质分离的牛肾上腺髓质嗜铬细胞在培养液中(37℃)培养48小时。需要说明的是,由于肾上腺髓质嗜铬细胞是胚胎学上来自神经嵴的细胞,所以是有时作为神经细胞模型被利用的细胞。
[儿茶酚胺分泌测定]
将在上述已培养的牛肾上腺髓质嗜铬细胞(4×106个:35mm培养皿)的培养液置换为以上述得到的蚯蚓干燥粉末A-1分别成为0.01、1、10及100μg/mL的方式溶解的KRP溶液(克雷布斯林格氏磷酸盐缓冲溶液:Krebs-Ringer phosphate buffer)1mL,并且在37℃培养5分钟。仅将溶液从溶解有用于培养的蚯蚓干燥粉末的KRP溶液采集0.1ml,添加0.1mL的0.2N高氯酸与0.2mL的3,4-二羟基苯胺(DHBA),使用HPLC(高效液相色谱)及ESA公司制CoulochemⅡ(电化学检测机),求出儿茶酚胺的分泌量。另外,将上述蚯蚓干燥粉末A-1以0μg/mL在37℃培养了5分钟的牛肾上腺髓质嗜铬细胞的细胞(4×106个)内儿茶酚胺量作为100%换算的结果示于图1。
[细胞内钙浓度测定]
将在上述进行了培养的牛肾上腺髓质嗜铬细胞(4×106个:35mm培养皿)的培养液置换为以5μmol/mL的最终浓度含有同人化学股份有限公司制Fluo-4-AM的KRP溶液1mL,在37℃培养30分钟。然后,将培养皿固定在荧光显微镜下回流装置,用在上述得到的蚯蚓干燥粉末A-1分别成为0.1、10及100μg/mL的方式溶解的KRP溶液进行回流,从回流开始以5秒间隔进行照片记录,测定照片整体的荧光(488nm)强度峰时的荧光强度。将荧光强度峰时的照片示于图2,另外,将蚯蚓干燥粉末A-1为0μg/mL时的荧光强度峰时的荧光强度作为100%进行比较的结果示于图3。
需要说明的是,已知肾上腺嗜铬细胞与神经细胞中细胞内钙浓度的上升促进含儿茶酚胺的分泌囊泡的启动(分泌囊泡的细胞膜融合),引起儿茶酚胺的分泌。
[酪胺酸羟化酶的磷酸化]
将在上述已培养的牛肾上腺髓质嗜铬细胞(4×106个:35mm培养皿)的培养液置换为以上述得到的蚯蚓干燥粉末A-1分别成为0及100μg/mL的方式溶解的KRP溶液(克雷布斯格氏磷酸盐缓冲溶液:Krebs-Ringer phosphate buffer)1mL,并且在37℃培养5分钟。然后,以PBS(-)溶液(4℃)清洗细胞后迅速地仅采集细胞(4×106个),通过免疫印迹法检测酪胺酸羟化酶(Tyrosine Hydroxylase:TH)的磷酸化。将结果示于图4。
需要说明的是,酪胺酸羟化酶是儿茶酚胺的生物合成的限速酶,由于细胞内钙浓度的上升而被磷酸化、被活性化。
从图1很明显地得知,蚯蚓干燥粉末与对照溶液(未含有蚯蚓干燥粉末的KRP溶液)相比,显著地增加儿茶酚胺的分泌量,100μg/mL时也增加85%。如从图2、图3明显地得知,蚯蚓干燥粉末与对照溶液相比也增加细胞内钙。从图4很明显地得知,蚯蚓干燥粉末使儿茶酚胺的生物合成的限速酶即酪胺 酸羟化酶的丝氨酸残基(第19、31、40个)的磷酸化(pSer-TH)增加,表示活性上升。
- 还没有人留言评论。精彩留言会获得点赞!
- 微波碱水解5-甲基-5-(3,4-二甲氧基苄基)乙内酰脲制备甲基多巴的方法
- 酸直接水解5-甲基-5-(3,4-二甲氧基苄基)乙内酰脲制备甲基多巴的方法
- 可用于治疗帕金森症的儿茶酚胺衍生物的制作方法
- 类固醇类的孕烯醇酮及其同分异构体在制备治疗高血压药物中的应用的制作方法
- 用作皮质儿茶酚胺能神经传递调节剂的3-苯基-3-甲氧基-吡咯烷衍生物的制作方法
- 用作皮质儿茶酚胺能神经传递调节剂的新3-苯基-氮杂环丁烷衍生物的制作方法
- 调节儿茶酚胺合成、释放并增强免疫机能的药物组合物的制作方法
- 作为儿茶酚胺前体药物的苯乙胺和稠环变体及其用途的制作方法
- 一种提高蚕豆花左旋多巴含量的方法
- 作为儿茶酚胺前体药物的苯乙胺和稠环变体及其用途的制作方法