用C1抑制剂治疗遗传性血管性水肿的制作方法
根据35USC 119(e),本申请要求2014年2月28提交的美国临时专利申请第61/946,677号(出于所有目的其通过引用整体并入本文)的权益。
背景技术:
人C1抑制剂(C1INH),也称为C1酯酶抑制剂,是丝氨酸蛋白酶抑制剂超级家族的一种物质。美国专利号7,067,713公开了在转基因非人哺乳动物的奶中制备重组C1抑制剂(rhC1INH)。该专利还指出,C1抑制剂(或其重组制剂)可用于治疗患有HAE的患者或需要免疫抑制的患者。
HAE是罕见的潜在威胁生命的疾病,被认为是常染色体显性遗传疾病。C1酯酶抑制剂缺乏的遗传性血管性水肿的特征在于组织肿胀反复发作。例如,HAE发作可以表现为面部、外周、咽/喉、胃肠(GI)道/腹部或泌尿生殖系统肿胀的反复发作。患有HAE发作的患者也患有严重的疼痛、残疾、腹胀、恶心等,可能需要住院或经历学校、工作和社交以及睡眠中断。急性发作不可预料,经常在没有明显触发时发生。本领域需要缓解患有急性HAE发作的患者的症状的方法。
发明简述
本发明部分基于发现用于治疗人类患者的HAE急性发作的新方法。本文所述的方法和给药方案对于患有HAE的患者的存活是有利的,在一些情况下是关键的。可以从该给药方案受益的患者群包括但不限于:患有威胁生命的HAE症状的个体、重组C1抑制剂第一剂量后4小时HAE发作症状没有缓解的患者、和重组C1抑制剂第一剂量后仅经历有限缓解(VAS得分降低少于20mm)的患者。
本文所述的一个方面是用于治疗患者中遗传性血管性水肿(HAE)的急性发作的方法。该方法包括以50IU/kg患者体重向患者静脉施用第一剂量的重组C1酯酶抑制剂,然后在施用第一剂量后,以50IU/kg患者体重向患者静脉施用第二剂量的重组C1酯酶抑制剂,从而治疗患者的HAE的急性发作。
在一些实施方案中,第一剂量在患者的HAE发作开始后5小时内施用。在进一步的实施方案中,第二剂量在第一剂量后至少4小时施用。还在进一步的实施方案中,第一剂量和第二剂量在24小时期间内施用。还在进一步的实施方案中,24小时期间内施用不超过两次剂量。
在一些实施方案中,在具有多个HAE发作部位的患者中施行该方法。发作部位可以是外周、腹部、面部、咽部和/或喉部。在进一步实施方案中,HAE发作在患者中表现为威胁生命的症状的形式。还在进一步实施方案中,发作的严重度在100mm的视觉模拟量表(VAS)上为至少50mm。
在一些实施方案中,在从第一剂量起4小时内症状开始缓解,且在第二剂量前的缓解程度为VAS得分的降低少于20mm的患者中施行该方法。在一些情况下,VAS得分的降低可以基于两个连续时间点测量。
在一些实施方案中,在第一剂量后且在施用第二剂量前HAE发作症状持续的患者中施行该方法。
在一些实施方案中,本文所述的重组C1抑制剂的氨基酸序列与源自人血浆的C1酯酶抑制剂的氨基酸序列相同,且具有与源自人血浆的C1酯酶抑制剂相比修饰的碳水化合物结构。在进一步实施方案中,重组C1抑制剂从转基因哺乳动物的奶纯化。还在进一步的实施方案中,重组C1抑制剂是rhC1INH。
在本文所述的任何实施方案中,重组C1酯酶抑制剂的第一和第二剂量可以由患者自己施用。
本文提供的另一个方面是用于治疗HAE的方法,其中所述方法涉及施用含有C1抑制剂的组合物,其中在4小时或更短时间内实现症状的明显缓解。本文所述的另一个方面是用于治疗患有急性HAE发作的患者的方法,包括向患者施用含有C1抑制剂的组合物,其中在12小时内,或优选24小时内,或更优选48小时内,或进一步优选72小时内,该治疗明显缓解患者的急性HAE发作的症状并且症状没有复发。此外,优选在12小时内,更优选24小时内,或更优选48小时内,或进一步优选72小时内没有新的急性HAE发作。
本文所述的另一个方面是用于治疗患有HAE的患者的方法,包括向患者施用含有C1抑制剂的组合物,其中该治疗提供HAE症状的明显缓解,但患者的D-二聚体水平没有明显升高。更优选地,D-二聚体水平从施用C1抑制剂组合物起至少7天的时期内没有明显升高。
进一步的实施方案是用于治疗患有HAE的患者的方法,包括向患者施用含有C1抑制剂的组合物,其中该治疗提供HAE症状的明显缓解,但血栓栓塞事件的风险没有明显增加。该治疗优选不明显增加深静脉血栓形成的风险。
对于以上各实施方案,可以在一个或多个粘膜下或皮下的发作部位向患者施用C1抑制剂组合物。在优选的实施方案中,C1抑制剂是重组C1抑制剂,例如rhC1INH。在以上各方面,组合物以单次剂量或多次剂量,优选以单次剂量施用。组合物以25-100IU/kg,更优选以约50IU/kg,且最优选以约50IU/kg的剂量施用。
在以上实施方案中,优选施用C1抑制剂组合物以提供HAE症状的缓解。在优选的实施方案中,那些症状之一是由HAE引起的组织肿胀。可以向患有HAE或急性HAE发作的患者施用C1抑制剂组合物。以下描述其他方面和实施方案。
附图描述
图1是饼图,显示根据向实施例1研究募集的患者施用的rhC1INH剂量次数(单次剂量vs两次剂量)的HAE发作的分解。向93%的发作施用rhC1INH单次剂量,向7%的发作施用rhC1INH两次剂量。
图2是描述实施例1所述的研究中用rhC1INH治疗的患者的反应和再发率的图表。对于这些研究,反应定义为4小时内持续的症状开始缓解。持续是指缓解程度,其中获得VAS得分的降低大于或等于20mm。
图3是描述实施例1所述的rhC1INH治疗后3天内发作症状复发或出现新的发作症状的数量的图表。
图4是描述基线中值D-二聚体浓度(其对于实施例2所述的HAE患者从正常水平升高)的图表。
图5是描述与正常D-二聚体浓度水平相比,安慰剂vs rhC1INH的患者(实施例2)随时间的中值D-二聚体浓度变化的图表。
图6是描述与正常D-二聚体浓度水平相比,具有粘膜下或皮下发作部位的安慰剂患者(实施例2)的中值D-二聚体浓度的图表。
图7是描述与正常D-二聚体浓度水平相比,具有粘膜下或皮下发作部位的rhC1INH患者(实施例2)的中值D-二聚体浓度的图表。
图8是描述与正常D-二聚体浓度水平相比,具有多个vs单个发作部位(实施例2)的患者的D-二聚体浓度的图表。
图9是描述施用了rhC1INH vs安慰剂的患者(实施例2)的D-二聚体浓度的图表。
发明详述
C1酯酶抑制剂(C1INH)缺乏的遗传性血管性水肿的特征在于组织肿胀反复发作。重组人C1INH(rhC1INH)能有效改善HAE患者的血管性水肿症状。该治疗在至少12小时内、24小时内、48小时内或72小时内导致高反应率且无再发。该治疗在4小时内提供明显缓解或开始缓解。在进一步的实施方案中,单次剂量的rhC1INH在治疗急性HAE发作中提供持续和持久的反应。在另一个实施方案中,该方法包括向患者施用第一剂量,且在第一剂量后施用第二剂量的重组C1抑制剂,每次剂量为50IU/kg患者体重。在本文所述的方法中,用本文所述的重组C1抑制剂治疗不会造成副作用或出现副作用的风险,例如升高的D-二聚体水平、血栓栓塞事件或深静脉血栓形成。
本文所述的一个方面是用于治疗患有遗传性血管性水肿(HAE)的患者,包括向患者施用含有C1抑制剂的组合物,其中在4小时或更短时间内实现症状的明显缓解。本文所述的另一个方面是用于治疗患有急性HAE发作的患者的方法,包括向患者施用含有C1抑制剂的组合物,其中在12小时内、24小时内、48小时内或72小时内,该治疗明显缓解患者的急性HAE发作的症状并且症状基本上没有复发。此外,优选在24小时内、24小时内、48小时内或72小时内没有新的急性HAE发作。
本文所述的另一个方面是用于治疗患有HAE的患者的方法,包括向患者施用含有C1抑制剂的组合物,其中该治疗提供HAE症状的明显缓解,但患者的D-二聚体水平没有明显升高。在一个实施方案中,D-二聚体水平从施用C1抑制剂组合物起至少7天的时期内没有明显升高。在另一个实施方案中,患者的D-二聚体水平从治疗时间开始至治疗后至少7天保持低于4000ug/L、低于3000ug/L、低于2500ug/L。
本文所述的进一步方面是用于治疗患有HAE的患者的方法,包括向患者施用含有C1抑制剂的组合物,其中该治疗提供HAE症状的明显缓解,但血栓栓塞事件的风险没有明显增加。该治疗进一步不明显增加深静脉血栓形成的风险。
对于以上各实施方案,可以在一个或多个粘膜下或皮下的发作部位向患者施用C1抑制剂组合物。在一个实施方案中,C1抑制剂是rhC1INH。在本文所述的以上各方面,组合物以单次剂量或多次剂量,优选以单次剂量施用。组合物以25-100IU/kg,更优选以约50IU/kg,或以50IU/kg的剂量施用。剂量优选静脉施用。
在以上实施方案中,优选施用C1抑制剂组合物以提供HAE发作症状的缓解,例如诱导由HAE造成的组织肿胀明显减少。
C1抑制剂基因
表明C1抑制剂的cDNA序列编码500个氨基酸的蛋白质,其包括22个氨基酸信号序列(Bock等1986,Biochem.25:4292-4301)。C1抑制剂的整个人基因组序列是已知的,表明该基因包含7个内含子(Carter P.等1988,Eur.J.Biochem.173:163)。本发明包括表达本文所述的任何原型序列的等位、同源和诱导变体的转基因哺乳动物。这种变体通常在氨基酸水平与已知的C1抑制剂基因显示大量的序列同一性。这种变体通常在严格条件下与已知基因杂交,或与有已知基因之一编码的抗体或多肽交叉反应。基因组和cDNA序列的其他实例可从GenBank获得。如果需要C1抑制剂基因的其他克隆序列,可以用已知的C1抑制剂序列从基因组或cDNA文库(优选人)获得。
转基因设计
设计转基因以在携带该转基因的转基因非人哺乳动物的乳腺靶向表达重组C1抑制剂。基本方法需要将编码蛋白的外源DNA片段与信号序列和有效促进该外源DNA片段表达的调控序列可操作连接。通常,该调控序列包括启动子或增强子。DNA片段可以是基因组、小基因(删除一个或多个内含子的基因组)、cDNA、YAC片段、两个不同C1抑制剂基因的嵌合、或任何这些的杂合体。包括基因组序列一般导致更高的表达水平。
在基因组构建体中,不需要保留所有的内含子序列。例如,可以去除一些内含子序列以获得更小的转基因,促进DNA操作和随后的微注射。参见Archibald等,WO 90/05188(出于所有目的其全文通过引用并入本文)。去除某些内含子在一些情况下也有助于增强表达水平。去除一个或多个内含子以降低表达水平从而确保翻译后修饰基本上完整也是需要的。还可能删除一些或全部非编码的外显子。在一些转基因中,突变C1抑制剂编码序列中的选择核苷酸以去除蛋白水解的切割位点。因为通过转基因哺乳动物产生的C1抑制剂通常意欲用于向人施用,获得编码C1抑制剂序列的DNA片段的物种优选人类。类似的,如果意欲用途是兽医治疗(例如对马、狗或猫),优选DNA片段来自相同物种。调控序列例如启动子和增强子来自唯一或至少优选在乳腺中表达的基因(即乳腺特异性基因)。作为启动子和增强子来源的优选基因包括β-酪蛋白、κ-酪蛋白、αS1-酪蛋白、αS2-酪蛋白、β-乳球蛋白、乳清酸蛋白和α-乳清蛋白。启动子和增强子一般但不总是来自相同的乳腺特异性基因。优选该基因来自与待表达转基因的哺乳动物相同的哺乳动物物种。也可以使用来自其他物种的表达调控序列,例如来自人基因的那些。信号序列必须能够导向C1抑制剂从乳腺的分泌。合适的信号序列可以来自编码分泌蛋白的哺乳动物基因。C1抑制剂的天然信号序列是合适的。除这些信号序列之外,信号序列的优选来源是来自与获得启动子和增强子相同基因的信号序列。任选地,在转基因中包括其他调控序列以优化表达水平。这种序列包括5’侧翼区、5’转录但非翻译区、内含子序列、3’转录但非翻译区、多聚腺苷酸化位点和3’侧翼区。通常从获得启动子和增强子的乳腺特异性基因或从表达C1抑制剂基因获得这种序列。包括这种序列产生模拟真实乳腺特异性基因和/或真实C1抑制剂基因的遗传环境。在一些情况下(例如牛αS1-酪蛋白),这种遗传环境导致转录基因的更高表达。或者,从其他异源基因,例如β-珠蛋白或病毒基因获得3’侧翼区和非翻译区。包括来自C1抑制剂基因的3’和5’非翻译区或其他异源基因也可以增加转录物的稳定性。
在一些实施方案中,来自乳腺特异性基因的约0.5、1、5、10、15、20或30kb的5’侧翼区与来自表达的C1抑制剂基因的约1、5、10、15、20或30kb的3’侧翼区组合。如果从cDNA序列表达蛋白,在启动子和编码序列之间包括内含子序列是有利的。内含子序列优选是由以下形成的杂合序列:获得启动子的乳腺特异性区的第一个内含子的插入序列的5’部分和IgG插入序列或C1抑制剂基因的插入序列的3’部分。参见DeBoer等,WO 91/08216(出于所有目的其全文通过引用并入本文)。用于表达C1抑制剂cDNA的另一个优选转基因基于可从Invitrogen(Carlsbad,CA)商购的pBC1表达载体试剂盒。pBC1载体包含山羊β-酪蛋白启动子和包括几个外显子和内含子的一部分山羊β-酪蛋白基因,以及3’非翻译序列。将C1抑制剂cDNA插入pBC1特有的Xho插入位点将产生包含C1抑制剂cDNA序列的嵌合RNA,其两侧是山羊β-酪蛋白外显子和内含子序列。然而,一旦适当剪切该嵌合RNA分子,只有C1抑制剂cDNA序列被翻译。
用于从基因组序列表达C1抑制剂蛋白的优选转基因包含编码完整编码序列和信号肽的基因组C1抑制剂序列、3’UTR和3’侧翼序列,任选连接至包含足以导向C1抑制剂蛋白表达的调控序列的5’αSI酪蛋白片段。
在至少一种,经常几种生物中的以上列出的所有乳腺特异性基因的DNA序列信息是可获得的。参见例如Richards等,J.Biol.Chem.256,526-532(1981)(大鼠α-乳清蛋白);Campbell等,Nucleic AC1ds Res.12,8685-8697(1984)(大鼠WAP);Jones等,J.Biol.Chem.260,7042-7050(1985))(大鼠β-酪蛋白);Yu-Lee&Rosen,J.Biol.Chem.258,10794-10804(1983)(大鼠γ-酪蛋白));Hall,Biochem.J.242,735-742(1987)(人α-乳清蛋白);Stewart,Nucleic AC1ds Res.12,389(1984)(牛as1和K酪蛋白cDNA);Gorodetsky等,Gene 66,87-96(1988)(牛β-酪蛋白);Alexander等,Eur.J.Biochem.178,395-401(1988)(牛K酪蛋白);Brignon等,FEBS Lett.188,48-55(1977)(牛αS2酪蛋白);Jamieson等,Gene 61,85-90(1987),Ivanov等,Biol.Chem.Hoppe-Seyler 369,425-429(1988),Alexander等,Nucleic AC1ds Res.17,6739(1989)(牛β乳球蛋白);Vilotte等,Biochimie 69,609-620(1987)(牛α-乳清蛋白)(出于所有目的其全文通过引用并入本文)。
MerC1er&Vilotte,J.Dairy SC1.76,3079-3098(1993)(出于所有目的其全文通过引用并入本文)综述了各种奶蛋白基因的结构和功能。如果需要其他序列数据,使用已有序列作为探针可以容易地克隆已经获得的区域的侧翼序列。同样地,使用已知的同源核苷酸序列或抗体或同源蛋白作为探针从生物筛选文库获得不同生物的乳腺特异性调控序列。
采用αS1酪蛋白调控序列将重组蛋白的表达靶向至乳腺的一般策略和示范性转基因更详细地描述于DeBoer等,WO 91/08216和WO 93/25567(出于所有目的其全文通过引用并入本文)。还描述了采用来自其他乳腺特异性基因的调控序列的转基因的实例。参见例如Simon等,Bio/Technology 6,179-183(1988)和WO 88/00239(1988)(用于在绵羊中表达的β乳球蛋白调控序列);Rosen,EP 279,582和Lee等,Nucleic AC1ds Res.16,1027-1041(1988)(用于在小鼠中表达的β-酪蛋白调控序列);Gordon,Biotechnology 5,1183(1987)(用于在小鼠中表达的WAP调控序列);WO 88/01648(1988)和Eur.J.Biochem.186,43-48(1989)(用于在小鼠中表达的α-乳清蛋白调控序列)(出于所有目的其全文通过引用并入本文)。
将以上所述的转基因引入非人哺乳动物。大多数非人哺乳动物,包括啮齿类动物例如小鼠和大鼠、兔,绵羊类(ovine)例如绵羊(sheep),山羊类(caprine)例如山羊(goat),猪类(procine)例如猪(pig),和牛科例如黄牛和水牛是合适的。牛科的优势是奶产量大,而小鼠的优势是转基因和育种容易。兔提供良好平衡的这些优势。兔每天可以产生100ml蛋白含量为约14%的奶(参见Buhler等,Bio/Technology 8,140(1990))(出于所有目的其全文通过引用并入本文),还可以用与小鼠相同的原理和相似的设施操作和育种。一般不采用非胎生哺乳动物例如针鼹或鸭嘴兽。
在一些转基因方法中,将转基因引入受精卵的原核。对于某些动物例如小鼠和兔,在体内进行受精并手术移除受精卵。在其他的动物中尤其是牛,优选从活的或屠宰动物移除卵并在体外使卵受精。参见DeBoer等,WO 91/08216。体外受精允许将转基因引入对于整合处于细胞周期的最佳阶段的基本上同步的细胞(不晚于S阶段)。一般通过微注射引入转基因。参见US 4,873,292。然后体外培养受精卵直到获得包含约16-150个细胞的植入前胚胎。胚胎的16-32个细胞阶段称为桑椹胚。包含超过32个细胞的植入前胚胎称为囊胚。这些胚胎显示囊胚腔的发育,一般在64个细胞阶段。用于培养受精卵至植入前阶段的方法描述于Gordon等,Methods Enzymol.101,414(1984);Hogan等,Manipulation of the Mouse Embryo:A Laboratory Manual,C.S.H.L.N.Y.(1986)(小鼠胚胎);Hammer等,Nature 315,680(1985)(兔和猪胚胎);Gandolfi等J.Reprod.Fert.81,23-28(1987);Rexroad等,J.Anim.SC1.66,947-953(1988)(绵羊胚胎)和Eyestone等J.Reprod.Fert.85,715-720(1989);Camous等,J.Reprod.Fert.72,779-785(1984);和Heyman等Theriogenology 27,5968(1987)(牛胚胎)(出于所有目的其全文通过引用并入本文)。有时,植入前胚胎在植入前冷冻储存一段时间。取决于转基因整合时的发育阶段,将植入前胚胎转移至假怀孕雌性的输卵管,导致转基因或嵌合动物出生。可以育种嵌合哺乳动物以形成真正的种系转基因动物。
或者,可以将转基因引入胚胎干细胞(ES)。这些细胞从体外培养的植入前胚胎获得。Bradley等,Nature 309,255-258(1984)(出于所有目的其全文通过引用并入本文)。可以通过电穿孔或微注射将转基因引入这种细胞。ES细胞适合于通过同源重组将转基因引入特定的染色体位点。例如,可以将编码C1抑制剂的转基因引入遗传位点,使得其与乳腺中能够导向编码序列表达的内源调控序列可操作连接。将转化的ES细胞与来自非人动物的囊胚组合。ES细胞在胚胎定植,在一些胚胎中形成或促成所得嵌合动物的种系。参见Jaenisch,Science,240,1468-1474(1988)(出于所有目的其全文通过引用并入本文)。或者,可以将ES细胞用作移植入去核受精卵的细胞核来源,产生转基因哺乳动物。在进一步的实施方案中,通过涉及细胞核转移的方法产生包含能够表达C1抑制剂的转基因的转基因动物,优选非人哺乳动物。可以采用各种类型的细胞作为待转移至卵母细胞的细胞核供体。在各种分化阶段的(从未分化至完全分化)、在各种细胞周期阶段的(例如休眠或增殖细胞)供体细胞(例如成人、胎儿或胚胎细胞)可以从包含C1抑制剂转基因的转基因动物的所有组织获得,且可以从体细胞或种系组织获得(参见WO 97/07669,WO 98/30683和WO 98/39416,其全文出于所有目的通过引用并入本文)。
或者,使用传统方法例如Ca-磷转染、微注射或脂质体转染从其中引入了C1抑制剂转基因且随后选择或筛选存在转基因或转基因的特殊整合的体外培养的细胞获得供体细胞核(参见WO 98/37183和WO 98/39416,其全文出于所有目的通过引用并入本文)。通过电诱导或化学诱导的融合方式(参见WO 97/07669、WO 98/30683和WO98/39416任意之一),或通过微注射(参见WO99/37143,其全文出于所有目的通过引用并入本文)将供体细胞核引入卵母细胞。随后培养移植的卵母细胞以发育成胚胎,然后将胚胎植入假怀孕雌性动物的输卵管,导致转基因后代出生(参见WO 97/07669、WO 98/30683和WO 98/39416任意之一)。
另一种转基因方法使用基于逆转录病毒的载体来引入期望转基因。这种载体的实例包括Yee等(1994,Meth.Cell.Biol.43:99-112,全文出于所有目的通过引用并入本文)所述的源自水泡性口炎病毒G糖蛋白(VSG-G)MoMLV的逆转录病毒载体(VSV-G假型)。如Chan等(1998,Proc.Natl.Acad.SC1.USA 95:14028-14033,全文出于所有目的通过引用并入本文)所述,用这种VSV-G假型载体感染受精前在第二次减数分裂中期II停滞的卵母细胞以产生转基因后代。或者,不产生遗传修饰的动物,而是出于制备药物蛋白的目的,通过逆转录病毒感染来转化受限的器官,优选乳腺。在融合的逆转录病毒载体中,将编码C1抑制剂的序列带入非人乳腺以感染乳腺上皮细胞允许在这些动物的奶中产生C1抑制蛋白(Archer等,1994,Proc.Natl.Acad.SC1.USA 91:6840-6844,全文出于所有目的通过引用并入本文)。
为了产生包含两个或多个转基因的转基因动物,可以使用与单个转基因相同的方法同时引入多个转基因。或者,开始可以将转基因引入单独的动物,然后通过育种动物组合进相同基因组。或者,产生包含转基因之一的第一转基因动物。然后将第二个转基因引入那个动物的受精卵或胚胎干细胞。在一些实施方案中,将长度超过约50kb的转基因构建为重叠片段。将这种重叠片段同时引入受精卵或胚胎干细胞,并在体内进行同源重组。参见Kay等,WO 92/03917(全文出于所有目的通过引用并入本文)。
如上所述,本文所述的转基因哺乳动物在其基因组整合至少一个转基因。在一个细胞阶段引入转基因一般导致转基因动物及其后代基本上所有的种系和体细胞(可能已经经历体细胞突变的少数细胞除外)在其基因组中包含转基因。在较后阶段引入转基因导致嵌合体或嵌合动物。然而,可以育种已经在其种系中整合进转基因的一些这种动物来产生其中基本上所有体细胞和种系细胞包含转基因的转基因体。乳腺细胞的病毒转基因通常产生其中转基因仅在乳腺细胞中存在的转基因哺乳动物。这种哺乳动物不会将其种系传递至后代。
转基因至少主要在乳腺靶向编码C1抑制剂蛋白的DNA片段的表达。C1抑制剂可以至少100、500、1000、2000、5000或10,000、20,000或50,000μg/ml的高水平分泌。本文所述的转基因哺乳动物呈现基本上正常的健康。在乳腺之外的组织中C1抑制剂蛋白的次级表达出现的程度不足以引起不良反应。此外,外源C1抑制剂蛋白以足够功效从乳腺分泌,堵塞分泌器官的沉淀物不存在问题。
转基因哺乳动物可以开始产生奶的年龄当然随动物的性质而变。对于转基因牛,年龄为约天然的2岁半,或激素刺激6个月,而对转基因鼠,年龄为约9-11周。当然,仅物种的雌性成员用于产生奶。然而,转基因雄性对于育种雌性后代也是有价值的。可以将来自转基因雄性的精子冷冻储存以用于随后的体外受精并产生雌性后代。F.从奶或其他来源回收蛋白转基因的成年雌性哺乳动物产生含有高浓度的外源C1抑制剂蛋白的奶。
可通过以下方式从奶纯化C1抑制剂:通过离心和去除脂肪使转基因奶脱脂,然后通过高速离心继之以死端过滤(例如通过使用连续下降的过滤器尺寸的死端过滤)或交叉流过滤去除酪蛋白,或直接通过交叉过滤去除酪蛋白。如果需要,可以根据其特有的物理和化学性质从奶纯化蛋白质(参见Scopes,Protein Purification(Springer-Verlag,N.Y.,1982))Prograis等,(1985)J.MediC1ne 16(1-3):303-350;Pilatte等,(1989)J.Immunol.Methods 120:37-43,Reboul等,.(1977)Febs Lett.79:45-50,Alsenz等,(1987)J.Immunol.Methods 96:107-1 14,Ishizaki等,(1977)J.Biochem.82:1155-1 160。纯化条件应当优选分离人C1抑制剂和非人转基因哺乳动物的内源C1抑制剂。
阳离子、阴离子和金属亲和层析全部可以用于从奶或其他来源(例如重组细胞培养物或天然来源)纯化人C1抑制剂蛋白。一些方法使用超过一个的这些步骤,一些方法使用全部三个步骤。尽管可以以任何顺序进行这些步骤,优选的顺序是进行阳离子层析,然后阴离子层析,然后金属离子亲和层析。
阳离子层析例如可以使用Sepharose(TM)大珠或羧甲基纤维素进行。使用低盐的上样缓冲液(例如20mM柠檬酸钠,0.02M氯化钠)。可以在较高盐浓度(例如20mM柠檬酸钠,0.2M氯化钠)洗脱人C1抑制剂。然后将含有人C1抑制剂的洗脱液进行阴离子层析。阴离子柱的基质可以是例如纤维素、葡聚糖、琼脂糖或聚苯乙烯的材料。配体例如可以是二乙基氨乙基(DEAE)、聚乙烯亚胺(PEI)或季铵官能团。阴离子交换柱的强度是指配体的电离状态。强离子交换柱(例如具有季铵配体的那些)永远带有正电荷。在弱阴离子交换柱(例如DEAE和PEI)中,正电荷的存在取决于柱的pH。一般用pH高于人C1抑制剂的pi的低盐缓冲液上样阴离子交换柱。在低盐缓冲液中洗涤柱几次以洗脱未结合的蛋白。然后用盐浓度增加的缓冲液洗脱结合蛋白。
Q Sepharose FF是优选的阴离子交换柱,因为该材料与其他阴离子交换柱相比相对便宜且具有适合大规模纯化的相对较大的珠子尺寸。在特定条件下,可以从Q Sepharose FF洗脱人C1抑制剂,而不洗脱兔奶中发现的兔C1抑制剂或其他蛋白。为获得人酸性α-葡萄糖苷酶与Q Sepharose FF的良好结合,将柱在低盐(例如少于50mM,如磷酸钠缓冲液)中预平衡。缓冲液的pH应当为约7.0+/-1.0以获得人C1抑制剂与柱的良好结合。然后以增加的盐浓度通过逐步洗脱或梯度洗脱人C1抑制剂。逐步洗脱对于大规模纯化更易于控制。大多数加载的人C1抑制剂可以以相对高的纯度在一个步骤(约0.25M盐)中从Q FF柱上洗脱。
金属亲和层析用基质例如Sepharose和结合的金属离子例如铜、锌、镍、钴或钙来进行。也可以使用有机螯合基团例如亚氨基二乙酸。用相对高浓度(例如高于0.2M)的非螯合盐(例如氯化钠)将柱平衡至约6-8的pH。在这些条件下,残留污染蛋白与柱结合,而人C1抑制剂不结合,从而可以容易洗脱。
示例性的纯化方法在实施例部分描述。该方法提供C1抑制剂制剂,其相对于所有污染物纯度为至少98%或99%(w/w)且包含少于0.5%、0.1%或0.05%的兔C1抑制剂(w/w)。额外的纯化优选用于获得纯度为至少99%,优选为至少99.5%,更优选99.8%,最优选99.9%的C1抑制剂制剂。
药物组合物
在一些方法中,将从奶或其他来源纯化的C1抑制剂以纯化形式与药物载体一起作为药物组合物施用。优选的形式取决于意欲的施用模式和治疗应用。药物载体可以是适合将多肽递送至患者的任何相容的无毒物质。无菌水、醇、脂肪、蜡和惰性固体可用作载体。药物组合物也可以包含药学上可接受的佐剂、缓冲剂、分散剂等。药物组合物中抑制剂的浓度可以差异很大,例如从少于约0.1%重量,一般为至少约1%重量至高达20%重量或更高。
药物组合物优选通过胃肠外施用,例如通过静脉、动脉内、皮下、腹腔内或肌肉内注射或输注;或通过鞘内或颅内施用。在优选的实施方案中,通过静脉输注施用。用于胃肠外施用的合适制剂是本领域已知的,且一般为液体制剂。
具体实施方式
应理解,下述的实施例和实施方案仅为说明的目的,基于其的各种修饰或变化将向本领域技术人员建议,并包含在本发明的精神和权限以及所附权利要求书的范围内。
实施例1
从两个随机对照试验及其开放标签延伸研究汇集来自用静脉rhC1INH(50IU/kg)治疗的患有实验室确认诊断HAE的患者(13岁或更大)的数据。观察患者在呈现前少于5小时的症状发作以及大于或等于50mm(严重)的基线视觉模拟量表(VAS;Reidl MA,Ann Allergy Asthma Immunol 2013,110(4):295-9,其通过引用并入本文)得分。在一个随机对照试验中,患者接受第二rhC1INH剂量作为威胁生命的症状的抢救药物或在第一剂量后4小时没有发生缓解。在另一个随机对照试验中,患者没有接受第二剂量。在开放标签延伸研究中,允许rhC1INH的第二剂量基于临床反应由研究者决定。
在4个临床试验的过程中,由于一次或多次发作,127位患者接受50IU/kg的rhC1INH。121位患者适合接受rhC1INH的第二剂量。对于所有解剖部位的所有发作,结合反应、再发(relapse)和复发(recurrence)数据。反应定义为治疗4小时内的持续4小时的缓解(两个连续时间点的VAS得分的降低大于或等于20mm)且在持续前没有额外剂量或抢救药物。测定所有患者在24小时随访数据中的再发,并测定所有患者在3天随访数据中的复发或新的发作症状。
图1显示对于急性HAE发作施用的rhC1INH剂量的次数。93%的发作用单次剂量的rhC1INH治疗。7%的发作用两次剂量的rhC1INH治疗。
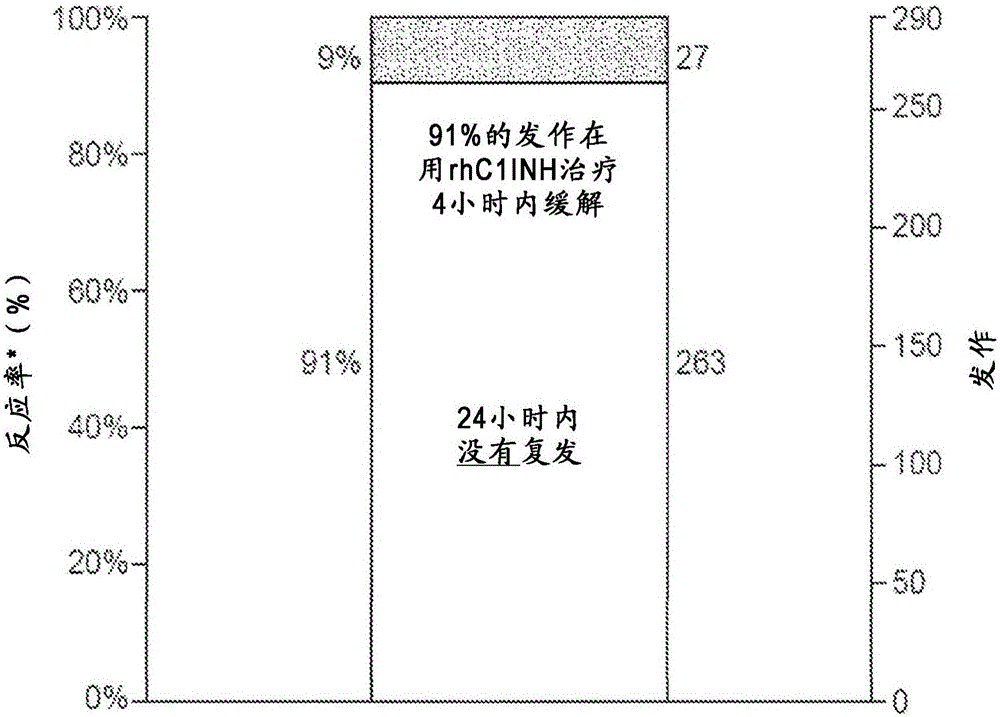
图2显示在用rhC1INH治疗的患者中的反应和再发率。反应定义为4小时内持续的症状开始缓解。对于两个随机对照试验和两个开放标签延伸研究中的患者,用rhC1INH治疗后没有血栓或血栓栓塞事件,没有过敏反应,且没有诱导中和抗体。
图3显示rhC1INH治疗后3天内发作症状复发或新的发作症状的次数。在93%患者中,没有复发或新的发作症状。
基于该研究,以4小时内开始缓解的发作的次数评估,发现用rhC1INH治疗导致高反应率。大多数在4小时内开始缓解的发作用单次rhC1INH剂量有效治疗。一些发作需要第二次rhC1INH剂量。对于4小时内缓解的发作,24小时内没有发生明显的再发。rhC1INH治疗3天内再发或新的发作症状的发生率较低。此外,在治疗急性HAE发作中,单次剂量的rhC1INH提供持续和持久的反应。
实施例2
已经报道血栓栓塞事件(TEE)具有一些源自血浆的C1INH,但不具有重组的人C1INH(rhC1INH,超过1000次施用)。该研究评估对于急性HAE发作rhC1INH的安全性和功效,包括监测TEE并分析D-二聚体纤维蛋白降解产物(D-二聚体水平)和深静脉血栓形成(DVT)风险。
74位患有急性HAE发作的患者随机分为3:2,并接受50IU/kg rhC1INH或安慰剂。在输注期间,在研究之前、之后2小时和第7天分析D-二聚体水平(以平均25th-75th四分位表示)。使用威尔斯预测规则分析DVT风险。Wells PS,等Thromb.Haemost.2000:83:416-20。在静脉注射研究药物后2小时和第7天(发作消除后),通过在基线收集的血液样品(即,从发作起少于5小时并在研究用药之前)评估D-二聚体水平。认为小于或等于250μg/L的值正常(即参考标准)。
患者和研究设计:这是随机、双盲、安慰剂(盐水)对照、多中心、多国研究,用来评估对于治疗患有HAE的患者的急性血管性水肿发作,rhC1INH与盐水相比的功效和安全性。患有实验室确认诊断HAE的75位患者(年龄≥13岁;美国和加拿大之外的≥18岁)随机集中(3:2)以接受用于治疗适合的血管性水肿发作的rhC1INH(对于<84kg的患者50IU/kg,或对于≥84kg的患者4200IU)或盐水的双盲静脉注射。如果(i)他们的发作部位是外周(四肢)、腹部、面部和/或咽部-喉部;(ii)这些发作的发生在去诊所之前少于5小时;和(iii)患者评分的发作总体严重度在100mm的视觉模拟量表(VAS)上为至少50mm,患者适合治疗(Reidl MA,Ann Allergy Asthma Immunol2013,110(4):295-9),其通过引用并入本文)。对于患有多个适合发作部位的患者,主要发作部位被定义为在基线具有最高VAS得分的部位。
血栓风险评估:临床监测所有随机患者的血栓事件。通过使用威尔斯预测规则(Wells PS,等Thromb.Haemost.2000:83:416-20)评估深静脉血栓形成(DVT)风险。要求给药后得分升高的患者进行下肢超声检查以排除DVT。对于血栓事件的可能发展,评估患者输注后D-二聚体水平的升高(包括超声检查,如果临床指示)。
血浆样品收集:为了测定D-二聚体水平,在静脉注射研究药物后2小时和第7天(发作消除后),在基线收集柠檬酸血液样品(即,从发作起少于5小时并在静脉注射研究药物之前)。对于所有分析,对于接受抢救药物后的任何评估,将接受rhC1INH作为抢救药物的随机化以接受盐水溶液的患者从盐水溶液处理组换成rhC1INH治疗组。
D-二聚体测量:在中心实验室测量血浆中的D-二聚体水平(正常范围<540μg/L)。
患者人口特征:募集显示患有合适急性HAE发作的75位患者接受研究药物:44位随机接受50IU/kg rhC1INH,31位随机接受盐水;1位随机化以接受rhC1INH治疗的患者没有被治疗且不包括在分析中。
表1的治疗组总结了患者的安排、关键人口特征和HAE发作频率以及合适发作的严重度。治疗组之间的患者人口特征和基线特征总体上相似。两个组中患者用100mm VAS量表评分的基线的发作严重度相似(rhC1INH组平均为73.5mm vs盐水组平均为77.3mm)。rhC1INH组和盐水组中的主要发作部位也相似(外周部位为rhC1INH组44%vs盐水组45%,腹部部位为rhC1INH组37%vs盐水组39%)。
深静脉血栓形成风险:基于威尔斯预测规则评分,没有患者被鉴定为具有增加的DVT风险。在rhC1INH组的39位患者和盐水组的30位患者中记录的所有得分较低,从-2至0,表明患者患DVT的可能性非常低。对威尔斯得分为0的2位患者(1位rhC1INH和1位盐水)进行的超声检查在腹部和下肢均正常,没有证据表明DVT。
D-二聚体水平:在三个时间点(基线,rhC1INH输注后2小时,和用rhC1INH治疗后7天)评估D-二聚体水平(以平均25th-75th四分位表示)。通过评估主要发作部位类型(粘膜下:腹部和咽部-喉部vs皮下:面部和外周)、严重度(对于主要发作部位,中度:VAS为50-75mm;严重为≥76mm)和单个vs多个影响部位进行进一步分类。
患者在基线的总体中值D-二聚体水平升高(2149[480-5105]μg/L,正常范围<540μg/L)(表2)。用rhC1INH或盐水治疗后2小时,所有患者的D-二聚体水平持续升高至中值水平2469(643-5827)μg/L。治疗后第7天,两个治疗组的D-二聚体水平均恢复至正常附近的水平。应当注意的是,用rhC1INH或盐水治疗后2小时和第7天,组之间的平均D-二聚体水平没有统计学差异。在两个治疗组的第2小时(rhClINH:145μg/L;盐水:192μg/L)和第7天(rhClINH:-2401μg/L;盐水:-1923μg/L),两个治疗组从基线起的平均变化也相似,表明rhC1INH治疗不影响HAE患者的D-二聚体产生。
发生在粘膜下或皮下水肿的HAE发作影响皮肤、肠和上呼吸道。基于粘膜下和皮下主要发作部位评估患者群的D-二聚体水平(表3)。与具有皮下发作的患者相比,具有粘膜下发作的患者的中值D-二聚体水平至少比基线(p=0.0274)和治疗后2小时(p=0.0126)高三倍。在总体群中,用rhC1INH治疗在两个给药后的时间点对D-二聚体水平没有明显影响。没有进一步评估个体主要发作部位(例如面部、外周、腹部、咽部-喉部)的D-二聚体水平之间的比较。
在基线将主要发作部位的严重度分类为中度(VAS≥50mm且<75mm)或严重(VAS≥75mm)。总体上,患有中度(1674[593-5241]μg/L)和严重(2320[260-5550]μg/L)发作的患者的中值基线D-二聚体水平相似(表4)。用rhC1INH治疗的严重发作在第7天的D-二聚体水平(280[109-925]μg/L)确实倾向于比用盐水治疗的那些(560[273-4056μg/L)低。
尽管大多数HAE发作表现分为单个部位的症状,一些发作可能表现为同时受影响的多个解剖部位。鉴于此,还测定D-二聚体水平是否被多个受影响部位的存在所影响。64位患者表明单个部位发作,10位表明多个部位发作。在基线,具有多个受影响部位的患者(9555[4315-13300)μg/L)的中值D-二聚体水平高于具有单个部位的患者(4568[2065-24634]μg/L)。治疗后2小时,多个发作部位的D-二聚体水平仍然更高(5040[812-11045]μg/L vs.单个部位的2294[615-5065]μg/L)。至第7天,两个组的D-二聚体水平恢复至正常。
表1:患者的人口特征和基线特征
表2:所有患者随时间的D-二聚体水平*
*正常范围<540μg/L
表3:具有粘膜下vs皮下部位的合适发作的有症状HAE患者的D-二聚体水平
数值以中值(四分位范围)表示。
*解剖部位表示主要发作部位(参见方法)。
a粘膜下=咽部-喉部、腹部、没有报道泌尿生殖系统发作。
b皮下=外周,面部。
表4:在主要发作部位的D-二聚体水平严重度
a严重度是基于主要发作部位在每次访问时的总体VAS得分。
图4-9进一步总结了结果。与缓解时间相比,在HAE发作期间的D-二聚体水平升高。然而,D-二聚体水平的升高与rhC1INH治疗无关。用rhC1INH没有观察到血栓栓塞事件。
在本申请中引用的所有文献、专利、专利申请和公告专利的内容通过引用明确并入本文。除非另有说明,本文所用的技术术语基于本领域技术人员理解的常规用法。在标准教科书中可以找到分子生物学中常用术语的定义(例如Oxford University Press出版的Benjamin Lewin,Genes V,1994(ISBN 0-19854287-9);Kendrew等(eds.),The Encyclopedia of Molecular Biology,published by Blackwell Science Ltd,1994(ISBN 0-632-02182-9);和VCH出版社出版的Robert A.Meyers(ed.),Molecular Biology and Biotechnology:a Comprehensive Desk Reference,Inc.,1995(ISBN 1-56081-569-8))。
- 还没有人留言评论。精彩留言会获得点赞!