烯醇酶1(ENO1)组合物及其用途的制作方法
本申请要求2014年1月13日提交的美国临时专利申请No.61/926,913,2014年6月9日提交的美国临时专利申请No.62/009,783和2015年1月7日提交的美国临时专利申请No.62/100,881的优先权,将其每篇的内容全部按引用并入本文中。
序列表的提交
通过EFS-Web以电子形式提交了与本申请相关的序列表并由此将其全部按引用并入说明书中。含有序列表的文本文件名为119992_10619_Sequence_Listing。该文本文件的大小为33KB,并且该文本文件于2015年1月13日生成。
背景技术:
随着血糖水平在餐后升高,胰岛素分泌并刺激外周组织(骨骼肌和脂肪)的细胞主动地从血液吸收葡萄糖作为能量源。作为胰岛素分泌或机能失调的结果而丧失葡萄糖稳态通常导致代谢障碍,如糖尿病,其可能由肥胖共同引发或由肥胖进一步加剧。因为这些病症可能降低生活质量或甚至是致命的,因此需要恢复从血流中适当清除葡萄糖的策略。
尽管糖尿病可能由于引起胰腺大范围损伤的任何病症(例如,胰腺炎、肿瘤、特定药物(如皮质类固醇或喷他脒)的施用、铁超负荷(即,血色素沉着)、获得性或遗传性内分泌病和外科手术切除)而继发产生,但最常见形式的糖尿病通常由胰岛素信号传导系统的原发性失调产生。存在两种主要类型的糖尿病,即1型糖尿病(也称为胰岛素依赖性糖尿病(IDDM))和2型糖尿病(也称为胰岛素无关性或非胰岛素依赖性糖尿病(NIDDM)),尽管它们的发病机理不同,但都有共同的长期并发症。
1型糖尿病,其占到所有原发性糖尿病病例的大约10%,是特征在于胰腺的胰岛素产生β细胞的大范围破坏的器官特异性自身免疫疾病。随之发生的胰岛素产生的降低不可避免地导致葡萄糖代谢的失调。尽管胰岛素的施用给患有这种病症的患者提供了相当大的益处,但胰岛素的短血清半衰期是维持正常血糖的主要障碍。可替代的治疗是胰岛移植,但这种策略只获得了有限的成功。
2型糖尿病,其影响较大比例的人群,特征在于胰岛素分泌的失调和/或外周组织对胰岛素的应答降低,即,胰岛素抵抗。尽管2型糖尿病的发病机理仍然不清楚,但流行病学研究表明这种形式的糖尿病由多重遗传缺陷的集合或多态性产生,其各自引起其自身的易感风险并由环境因素改变,包括超重、饮食、不活动、药物和过量饮酒。尽管各种治疗性处理可以用于控制2型糖尿病,但它们与各种使人衰弱的副作用相关。因此,常常建议诊断为患有2型糖尿病或处于患2型糖尿病风险中的患者采用更健康的生活方式,包括减轻体重、改变饮食、锻炼和适当的饮酒。然后,这样的生活方式改变不足以逆转由糖尿病引起的血管和器官损伤。
技术实现要素:
在一个方面中,本发明提供了用于递送至肌肉的包含烯醇酶1(Eno1)或其片段的组合物。在一个方面中,本发明提供了用于在血糖升高的受试者中使血糖正常化的方法,所述方法包括将包含Eno1或其片段的组合物施用于受试者,由此使受试者中的血糖正常化。在一个方面中,本发明提供了治疗受试者的一种或多种病症的方法,所述病症包括受损的葡萄糖耐量、胰岛素抵抗、前驱糖尿病和糖尿病,尤其是2型糖尿病,所述方法包括将包含Eno1或其片段的组合物施用于受试者,由此治疗受试者的病症。在本发明的特定方法中,将Eno1递送至肌肉。
本发明提供了用于递送至肌细胞的包含Eno1或其片段的药物组合物。
在特定实施方案中,Eno1包括Eno1多肽或其片段。在特定实施方案中,Eno1包括Eno1核酸或其片段。在特定实施方案中,Eno1包括人Eno1,例如,人Eno1多肽或人Eno1核酸,或其片段。
在特定实施方案中,组合物进一步包括微粒。在特定实施方案中,组合物进一步包括纳米颗粒。在特定实施方案中,Eno1或其片段是生物活性的。在特定实施方案中,Eno1或其片段具有纯化内源性人Eno1多肽的至少90%的活性。
在特定实施方案中,组合物进一步包括原位形成的组合物。在特定实施方案中,组合物进一步包括脂质体。在特定实施方案中,组合物包括树状聚合物。在特定实施方案中,组合物进一步包括表达载体,例如,编码Eno1或其片段。在特定实施方案中,表达载体包括病毒载体。
在特定实施方案中,组合物包括含有Eno1或其片段(例如,Eno1多肽,例如,人Eno1多肽)和肌肉靶向部分的复合物。在特定实施方案中,肌肉靶向部分包括骨骼肌和/或平滑肌靶向肽(MTP)。在特定实施方案中,MTP包含选自ASSLNIA;WDANGKT;GETRAPL;CGHHPVYAC和HAIYPRH的氨基酸序列。在特定实施方案中,复合物包含连接物,例如,连接Eno1和SMTP。在特定实施方案中,连接物选自共价连接物、非共价连接和可逆连接物。在特定实施方案中,复合物包括药物学上可接受的树状聚合物。在特定实施方案中,树状聚合物是PAMAN树状聚合物。在特定实施方案中,树状聚合物是G5树状聚合物。在特定实施方案中,树状聚合物是不带电的树状聚合物。在特定实施方案中,树状聚合物是酰化树状聚合物。在特定实施方案中,树状聚合物是PEG化树状聚合物或乙酰化树状聚合物。在特定实施方案中,复合物包括脂质体。在特定实施方案中,复合物包括微粒或纳米颗粒。在特定实施方案中,组合物包括原位形成的组合物。
在特定实施方案中,Eno1在递送至肌细胞时从复合物释放。
在特定实施方案中,Eno1或其片段和靶向部分以约1:1至约1:30的比率存在于复合物中。
在特定实施方案中,组合物配制成通过注射或输注来施用。在特定实施方案中,组合物配制成用于口服施用。在特定实施方案中,组合物配制成用于肠胃外施用。在特定实施方案中,组合物配制成用于肌肉内施用、静脉内施用或皮下施用。
本发明提供了降低血糖升高的受试者的血糖的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,药物组合物包括本文中提供的任一药物组合物。
本发明提供了提高葡萄糖耐量降低的受试者的葡萄糖耐量的方法,该方法包括将包含Eno1的药物组合物施用于受试者。在特定实施方案中,药物组合物包括本文中提供的任一药物组合物。
本发明提供了提高胰岛素敏感性降低和/或具有胰岛素抵抗的受试者的胰岛素反应的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,药物组合物包括本文中提供的任一药物组合物。
本发明提供了治疗受试者糖尿病的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,糖尿病是2型糖尿病。在特定实施方案中,糖尿病是前驱糖尿病。在特定实施方案中,糖尿病是1型糖尿病。在特定实施方案中,糖尿病是妊娠糖尿病。在特定实施方案中,药物组合物包括本文中提供的任一药物组合物。
本发明提供了降低Hb1Ac水平升高的受试者的Hb1Ac水平的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,药物组合物包括本文中提供的任一药物组合物。
本发明提供了改善血糖水平控制异常的受试者的血糖水平控制的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,药物组合物包括本文中提供的任一药物组合物。
在特定实施方案中,通过注射或输注来施用Eno1或其片段。在特定实施方案中,肠胃外施用Eno1或其片段。在特定实施方案中,口服施用Eno1或其片段。在特定实施方案中,通过选自肌肉内、静脉内和皮下的途径来施用Eno1或其片段。
本发明提供了用于诊断受试者的血糖水平升高的方法,包括:(a)检测受试者的生物样品中的Eno1水平,和(b)将生物样品中的Eno1水平与预定的阈值进行比较,其中低于预定阈值的Eno1水平指示受试者中升高的血糖的存在。在特定实施方案中,该方法进一步包括检测血糖升高的一种或多种诊断指标的水平。在特定实施方案中,血糖升高的一种或多种其他诊断指标选自HbA1c、空腹血糖、餐后血糖和葡萄糖耐量。在特定实施方案中,生物样品是血液或血清。在特定实施方案中,通过免疫分析或ELISA测定Eno1的水平。在特定实施方案中,步骤(a)包括(i)将生物样品接触选择性地结合Eno1以形成生物标志物复合物的试剂,和(ii)检测生物标志物复合物。在特定实施方案中,试剂是选择性地结合Eno1的至少一个表位的抗-Eno1抗体。
在特定实施方案中,步骤(a)包括测定生物样品中Eno1 mRNA的量。在特定实施方案中,扩增反应用于测定生物样品中Eno1 mRNA的量。在特定实施方案中,扩增反应是(a)聚合酶链式反应(PCR);(b)基于核酸序列的扩增试验(NASBA);(c)转录介导的扩增(TMA);(d)连接酶链式反应(LCR);或(e)链置换扩增(SDA)。在特定实施方案中,将杂交试验用于测定生物样品中Eno1 mRNA的量。在特定实施方案中,将与Eno1 mRNA的一部分互补的寡核苷酸用于杂交试验中来检测Eno1 mRNA。
在本发明的特定实施方案中,升高血糖的诊断是选自2型糖尿病、前驱糖尿病、妊娠糖尿病和1型糖尿病的疾病或病症的诊断。
本发明提供了用于诊断受试者中升高血糖的存在的方法,包括:
(a)将生物样品接触选择性地结合Eno1的试剂;
(b)允许试剂与Eno1之间形成复合物;
(c)检测复合物的水平,和
(d)将复合物的水平与预定的阈值进行比较,其中高于预定阈值的复合物水平指示患者正遭受升高的血糖。在特定实施方案中,试剂是抗-Eno1抗体。在特定实施方案中,抗体包含可检测标记。在特定实施方案中,检测复合物水平的步骤进一步包括将复合物接触可检测的二抗并测量二抗的水平。在特定实施方案中,该方法进一步包括检测一种或多种其他的升高血糖的指标的水平。在特定实施方案中,一种或多种其他的血糖指标选自HbA1c水平、空腹血糖、餐后血糖和葡萄糖耐量。在特定实施方案中,生物样品是血液或血清。
在本发明的特定实施方案中,通过免疫分析或ELISA测定复合物的水平。在特定实施方案中,升高的血糖指示前驱糖尿病、2型糖尿病、1型糖尿病或妊娠糖尿病。在特定实施方案中,该方法进一步包括施用其中诊断表明受试者存在升高的血糖的治疗方案,其中治疗方案选自药物治疗和行为治疗,或其组合。在特定实施方案中,药物治疗包括用选自(a)美格列奈,(b)磺酰脲,(c)二肽基肽酶-4(DPP-4)抑制剂,(d)双胍,(e)噻唑烷二酮类,(f)α-葡糖苷酶抑制剂,(g)胰淀素(amylin)模拟物;(h)肠促胰岛素模拟物;(i)胰岛素;和(j)其任意组合的药剂的治疗。
在特定实施方案中,之前的任一方法进一步包括选择怀疑具有升高的血糖或处于具有升高的血糖的风险中的受试者。
在特定实施方案中,之前的任一方法进一步包括从怀疑具有升高的血糖或处于具有升高的血糖的风险中的受试者获得生物样品。
在特定实施方案中,之前的任一方法进一步包括将生物样品中一种或多种血糖升高相关的指标的水平与对照样品中一种或多种血糖升高相关的指标的水平进行比较,所述对照样品选自:在比该生物样品早的时间点从同一受试者获得的样品,来自具有正常血糖的受试者的样品,来自前驱糖尿病受试者的样品,来自2型糖尿病受试者的样品,来自妊娠糖尿病受试者的样品和来自1型糖尿病受试者的样品。
本发明提供了用于监控受试者的血糖升高的方法,该方法包括:
(1)测定在第一时间从血糖升高的受试者获得的第一生物样品中的Eno1水平;
(2)测定在第二时间从该受试者获得的第二生物样品中的Eno1水平,其中第二时间晚于第一时间;和
(3)将第二样品中的Eno1水平与第一样品中的Eno1水平进行比较,其中Enol水平的改变指示受试者中血糖升高状态的改变。
在特定实施方案中,测定步骤(1)和(2)进一步包括测定选自HbA1c水平、空腹血糖、餐后血糖和葡萄糖耐量的一种或多种其他血糖指标的水平。
在特定实施方案中,在获得第二样品之前,受试者用针对血糖升高的药物进行治疗。在特定实施方案中,与第一生物样品相比第二生物样品中降低的Eno1水平指示受试者中血糖的升高。在特定实施方案中,与第一生物样品相比第二生物样品中提高或相等的Eno1水平指示受试者中血糖的正常化。在特定实施方案中,该方法进一步包括基于受试者的血糖水平选择和/或施用用于该受试者的不同治疗方案。在特定实施方案中,治疗方案选自药物治疗和行为矫正治疗。在特定实施方案中,药物治疗包括用选自(a)美格列奈,(b)磺酰脲,(c)二肽基肽酶-4(DPP-4)抑制剂,(d)双胍,(e)噻唑烷二酮类,(f)α-葡糖苷酶抑制剂,(g)胰淀素模拟物;(h)肠促胰岛素模拟物;(i)胰岛素;和(j)其任意组合的药剂的治疗。
本发明提供了治疗受试者的升高的血糖的方法,包括:(a)从怀疑具有血糖升高的受试者获得生物样品,(b)提交生物样品以获得关于Eno1水平的诊断信息,(c)如果Eno1水平高于阈值水平,施用治疗有效量的抗糖尿病治疗。
本发明提供了治疗受试者的升高的血糖的方法,包括:(a)获得生物样品中关于Eno1水平的诊断信息,和(b)如果Eno1水平高于阈值水平,施用治疗有效量的抗糖尿病治疗。
本发明提供了治疗受试者的升高的血糖的方法,包括:
(a)从怀疑血糖升高的受试者获得生物样品用于鉴定关于Eno1水平的诊断信息,
(b)测量生物样品中的Eno1水平,
(c)如果Eno1水平低于阈值水平,给健康护理提供者推荐施用血糖降低治疗。
在特定实施方案中,该方法进一步包括获得关于血糖升高的一种或多种其他指标水平的诊断信息。
在特定实施方案中,该方法进一步包括测量血糖升高的一种或多种其他指标的水平。
在特定实施方案中,血糖升高的一种或多种其他指标选自HbA1c水平、空腹血糖水平、餐后血糖水平和葡萄糖耐量。
在特定实施方案中,如果Eno1的水平低并检测了血糖升高的至少一种其他指标,步骤(c)进一步包括施用治疗有效量的葡萄糖降低治疗。在特定实施方案中,如果Eno1的水平低于阈值水平并且存在血糖升高的至少一种其他指标,步骤(c)进一步包括向健康护理提供者推荐施用葡萄糖降低治疗。
在特定实施方案中,生物样品是血液或血清。在特定实施方案中,通过免疫分析或ELISA来测定Eno1的水平。在特定实施方案中,通过(i)将生物样品接触选择性地结合Eno1以形成生物标志物复合物的试剂,和(ii)检测生物标志物复合物来测定Eno1的水平。在特定实施方案中,试剂是选择性地结合Eno1的至少一个表位的抗-Eno1抗体。
在特定实施方案中,通过测量生物样品中Enol mRNA的量来测定Enol的水平。在特定实施方案中,将扩增反应用于测量生物样品中Enol mRNA的量。在特定实施方案中,扩增反应是(a)聚合酶链式反应(PCR);(b)基于核酸序列的扩增试验(NASBA);(c)转录介导的扩增(TMA);(d)连接酶链式反应(LCR);或(e)链置换扩增(SDA)。在特定实施方案中,将杂交试验用于测量生物样品中Eno1 mRNA的量。在特定实施方案中,将与Eno1 mRNA的一部分互补的寡核苷酸用于杂交试验中来检测Eno1 mRNA。
本发明提供了用于检测生物样品中的Eno1的试剂盒,其包括至少一种用于测量生物样品中的Eno1水平的试剂,和一套用于测量Eno1水平的说明。在特定实施方案中,试剂是抗-Eno1抗体。在特定实施方案中,试剂盒进一步包括检测抗Eno1抗体的工具。在特定实施方案中,检测抗Eno1抗体的工具是可检测的二抗。在特定实施方案中,试剂是与Eno1 mRNA互补的寡核苷酸。在特定实施方案中,说明列出了用于检测生物样品中的Eno1水平的免疫分析或ELISA。在特定实施方案中,说明列出了用于分析生物样品中的Eno1 mRNA水平的扩增反应。在特定实施方案中,将扩增反应用于测量生物样品中Enol mRNA的含量。在特定实施方案中,扩增反应是(a)聚合酶链式反应(PCR);(b)基于核酸序列的扩增试验(NASBA);(c)转录介导的扩增(TMA);(d)连接酶链式反应(LCR);或(e)链置换扩增(SDA)。在特定实施方案中,说明列出了用于测定生物样品中Enol mRNA的量的杂交试验。在特定实施方案中,试剂盒进一步包括至少一种与Enol mRNA的一部分互补的寡核苷酸。在特定实施方案中,试剂盒进一步包括至少一种用于测量生物样品中的HbA1c和/或血糖水平的试剂。在特定实施方案中,试剂盒进一步包括用于测量从其获得生物样品的受试者中选自HbA1c水平、餐后血糖水平、空腹血糖水平和葡萄糖耐量的至少一种水平的说明。
本发明提供了用于检测血糖升高的方法中的试剂组,该试剂组包括用于Eno1和HbA1c的检测试剂。
本发明提供了用于治疗血糖升高的方法中的试剂组,该试剂组包括用于Eno1和HbA1c的检测试剂。
本发明提供了用于监控血糖升高的治疗的方法中的试剂组,该试剂组包括用于Eno1和HbA1c的检测试剂。
本发明提供了含有本文中提供的试剂组和一套用于获得关于一种或多种血糖升高指标的水平的诊断信息的说明的试剂盒。
本发明提供了试剂组的用途,所述试剂组包括多种对于在用于诊断和/或治疗血糖升高的方法中检测血糖升高的标志物特异性的检测试剂,其中所述试剂组的至少一种检测试剂对于检测Eno1是特异性的,和其中其余的一种或多种检测试剂对于检测选自HbA1c和葡萄糖的血糖升高标志物指示剂是特异性的。
在上述方法的特定实施方案中,受试者骨骼肌细胞中的葡萄糖流量增加。
在另一个方面中,本发明提供了提高受试者的葡萄糖流量的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是上述任一种药物组合物。在另一个方面中,本发明提供了提高受试者骨骼肌细胞中的糖酵解活性或能力的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是上述任一种药物组合物。
在另一个方面中,本发明提供了提高受试者骨骼肌细胞中线粒体游离脂肪酸氧化的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是上述任一种药物组合物。
在特定实施方案中,受试者具有血糖升高、葡萄糖耐量降低、胰岛素敏感性降低和/或胰岛素抵抗、糖尿病、Hb1Ac水平升高和异常血糖水平控制中的任何一种或多种。
在上述任一种方法的特定实施方案中,受试者是人。
在特定方面中,本发明涉及包含治疗有效量的Eno1或其片段的药物组合物。在特定实施方案中,药物组合物是用于递送至肌细胞。在特定方面中,本发明涉及包含Eno1或其片段和肌肉靶向肽的药物组合物。在特定实施方案中,药物组合物是用于递送至肌细胞。在特定实施方案中,Eno1包括Eno1多肽或其片段。在特定实施方案中,Eno1包括Eno1核酸或其片段。在特定实施方案中,组合物进一步包括编码Eno1或其片段的表达载体。在特定实施方案中,Eno1或其片段是生物活性的。在特定实施方案中,Eno1或其片段具有纯化内源人Eno1多肽的至少90%的活性。在特定实施方案中,Eno1是人Eno1。在特定实施方案中,组合物进一步包括微粒。在特定实施方案中,组合物进一步包括纳米颗粒。在特定实施方案中,组合物进一步包括原位形成组合物。在特定实施方案中,组合物进一步包括脂质体。在特定实施方案中,组合物进一步包括树状聚合物。在特定实施方案中,组合物包括含有Eno1多肽和肌肉靶向肽的复合物。在特定实施方案中,Eno1多肽是人Eno1多肽。在特定实施方案中,肌肉靶向肽包含选自ASSLNIA;WDANGKT;GETRAPL;CGHHPVYAC和HAIYPRH的氨基酸序列。在特定实施方案中,复合物进一步包含连接物。在特定实施方案中,连接物选自共价连接物、非共价连接和可逆连接物。在特定实施方案中,复合物进一步包括药物学上可接受的树状聚合物。在特定实施方案中,药物学上可接受的树状聚合物是PAMAN树状聚合物。在特定实施方案中,药物学上可接受的树状聚合物是G5树状聚合物。在特定实施方案中,药物学上可接受的树状聚合物是不带电的树状聚合物。在特定实施方案中,药物学上可接受的树状聚合物是酰化树状聚合物。在特定实施方案中,药物学上可接受的树状聚合物是PEG化树状聚合物或乙酰化树状聚合物。
在前述的组合物的特定实施方案中,复合物进一步包括脂质体。在特定实施方案中,复合物进一步包括微粒。在特定实施方案中,复合物进一步包括原位形成的组合物。在特定实施方案中,Eno1在递送至肌细胞时从复合物释放。在特定实施方案中,树状聚合物和ENO1以约1:1至约10:1的比率存在于复合物中。在特定实施方案中,树状聚合物和ENO1以约3:1至约5:1的比率存在于复合物中。在特定实施方案中,肌肉靶向部分和树状聚合物以约0.1:1至约10:1的比率存在于复合物中。在特定实施方案中,肌肉靶向部分和树状聚合物以约1:1至约3:1的比率存在于复合物中。在特定实施方案中,Eno1和肌肉靶向部分以约1:1至约1:30的比率存在于复合物中。
在前述的组合物的特定实施方案中,组合物配制用于肠胃外施用。在特定实施方案中,组合物配制用于口服施用。在特定实施方案中,组合物配制用于肌肉内施用、静脉内施用或皮下施用。
在特定方面中,本发明涉及降低血糖升高的受试者的血糖的方法,该方法包括将上述任一组合物施用于受试者,由此降低受试者的血糖。
在特定方面中,本发明涉及提高葡萄糖耐量降低的受试者的葡萄糖耐量的方法,该方法包括将上述任一组合物施用于受试者,由此提高受试者的葡萄糖耐量。
在特定方面中,本发明涉及提高具有胰岛素敏感性降低和/或胰岛素抵性的受试者的胰岛素反应的方法,该方法包括将上述任一组合物施用于受试者,由此提高受试者的胰岛素反应。
在特定方面中,本发明涉及治疗受试者的糖尿病的方法,该方法包括将上述任一组合物施用于受试者,由此治疗受试者的糖尿病。在特定实施方案中,糖尿病是2型糖尿病或1型糖尿病。在特定实施方案中,糖尿病是前驱糖尿病。
在特定方面中,本发明涉及降低Hb1Ac水平升高的受试者中的Hb1Ac水平的方法,该方法包括将上述任一组合物施用于受试者,由此降低受试者的Hb1Ac水平。
在特定方面中,本发明涉及改善具有异常血糖水平控制的受试者的血糖水平控制的方法,该方法包括将上述任一组合物施用于受试者,由此改善受试者的血糖水平控制。在上述方法的特定实施方案中,受试者的骨骼肌细胞中的葡萄糖流量增加。
在特定方面中,本发明涉及提高受试者的葡萄糖流量的方法,该方法包括将上述任一组合物施用于受试者,由此提高受试者的葡萄糖流量。
在特定方面中,本发明涉及提高受试者骨骼肌细胞中的糖酵解活性或能力的方法,该方法包括将上述任一组合物施用于受试者,由此提高受试者骨骼肌细胞中的糖酵解活性或能力。
在特定方法中,本发明涉及提高受试者骨骼肌细胞中的线粒体游离脂肪酸氧化的方法,该方法包括将上述任一组合物施用于受试者,由此提高受试者骨骼肌细胞中的线粒体游离脂肪酸氧化。
在上述方法的特定实施方案中,通过肠胃外施用Eno1。在上述方法的特定实施方案中,口服施用Eno1。在特定实施方案中,通过选自肌肉内、静脉内和皮下的途径施用Eno1。在上述方法的特定实施方案中,受试者具有血糖升高、葡萄糖耐量降低、胰岛素敏感性降低和/或胰岛素抵抗、糖尿病、Hb1Ac水平升高和异常血糖水平控制中的任何一种或多种。
在特定实施方案中,上述方法进一步包括选择具有血糖升高、葡萄糖耐量降低、胰岛素敏感性降低和/或胰岛素抵抗、糖尿病、Hb1Ac水平升高和异常血糖水平控制中的任何一种或多种的受试者。
在前述方法的特定实施方案中,受试者是人。
下文中提供了其他实施方案。
附图说明
图1A是显示了用或未用Eno1和胰岛素处理的平滑肌成肌细胞中的葡萄糖摄取的图。图1B显示了用0、500或1000ug/ml Eno1处理但未用胰岛素处理的平滑肌成肌细胞中的葡萄糖摄取。
图2A和2B显示了用0、500或1000μg/ml Eno1处理的人骨骼肌肌管中的Eno1蛋白质水平。图2C显示了用0、500或1000μg/ml Eno1处理的人骨骼肌肌管中的Eno1活性。
图3A显示了原始和热灭活的Eno1的Eno1活性。图3B显示了活性和热灭活的Eno1的葡萄糖摄取的诱导。
图4A和4B显示了用或未用Eno1蛋白处理后,膳食诱导的肥胖症(DIO)小鼠模型中葡萄糖耐量测试的葡萄糖清除的(A)时间过程和(B)曲线下面积(AUC)。
图5显示了通过SDS-PAGE分析的含有各种浓度的Eno1的聚丙烯酰胺凝胶的考马斯蓝染色。L1:Precision Plus Protein Standard Dual Color,L2:Eno1(10.0μg),L3:Eno1(1.0μg),L4:Eno1(0.1μg)。
图6显示了通过SDS-PAGE分析的含有各种浓度的Eno1的聚丙烯酰胺凝胶的银染。L1:Precision Plus Protein Standard Dual Color,L2:Eno1(10.0μg),L3:Eno1(1.0μg),L4:Eno1(0.1μg)。
图7显示了Eno1的Western印迹分析。L1:Precision Plus Protein Standard Dual Color,L2:Eno1(10.0μg),L3:Eno1(1.0μg),L4:Eno1(0.1μg)。
图8显示了用2:1比例的Eno1与树状聚合物SMTP制得的Eno1/G5-树状聚合物/SMTP的Zeta(ζ)电位测量。
图9显示了在各种温度下储存后,单独的Eno1(单独烯醇酶)和Eno1/G5-树状聚合物/SMTP(烯醇酶/G5-SMC)溶液的标准化活性。
图10A和10B是(A)荧光标记的Eno1-G5-PAMAN树状聚合物复合物和(B)荧光标记的肌肉靶向的Eno-1-G5-PAMAM树状聚合物复合物在小鼠中的组织分布的代表性荧光图像。
图11是用溶媒、G5-PAMAM树状聚合物、G5-PAMAM树状聚合物+SMTP、G5-PAMAM树状聚合物+Enol、G5-PAMAM树状聚合物+Eno1+SMTP中的一种处理的瘦小鼠或DIO小鼠的体重的图。
图12是显示了注射盐水或G5-PAMAM树状聚合物+Eno1+SMTP(50ug/kg)后,在注射后1、4和24小时具有膳食诱导的肥胖症的小鼠中血糖水平的图。
图13A显示了用G5-PAMAM树状聚合物+SMTP(DIO NP+SMTP)或G5-PAMAM树状聚合物+Enol+SMTP(DIO烯醇酶-1+NP+SMTP)处理1周后,瘦小鼠和膳食诱导肥胖症(DIO)的糖尿病小鼠模型中葡萄糖耐量测试的结果。图13B显示了图13A中每个处理组的曲线下面积(AUC)。图13C和13D显示了用溶媒、G5-PAMAM树状聚合物(G5)、G5-PAMAM树状聚合物+SMTP、G5-PAMAM树状聚合物+Enol、G5-PAMAM树状聚合物+Eno1+SMTP中的一种处理两周后,瘦小鼠或DIO小鼠的葡萄糖耐量测试中的葡萄糖清除的(C)时间过程和(D)曲线下面积(AUC)。
图14A和14B显示了用溶媒、G5-PAMAM树状聚合物、G5-PAMAM树状聚合物+SMTP、G5-PAMAM树状聚合物+Enol、G5-PAMAM树状聚合物+Eno1+SMTP中的一种处理四周后,瘦小鼠或DIO小鼠的葡萄糖耐量测试中葡萄糖清除的(A)时间过程和(B)曲线下面积(AUC)。
图15显示了8周治疗后,瘦小鼠、膳食诱导的肥胖症(DIO)小鼠、用G5-树状聚合物处理的DIO小鼠(DIO+NP)和用Eno1/G5-树状聚合物/SMTP复合物处理疗的DIO小鼠(DIO+Eno-1+NP+SMTP)中的血清乳酸盐水平。
图16A和16B显示了用溶媒、G5-PAMAM树状聚合物(G5)+SMTP和G5-PAMAM树状聚合物+Eno1+SMTP(25ug/kg或50ug/kg)中的一种处理一周后,db/db小鼠(BKS.Cg-m+/+Leprdb/J)的腹膜内葡萄糖耐量测试中葡萄糖清除的(A)时间过程和(B)曲线下面积(AUC)。
图17A和17B显示了注射溶媒、所示剂量的G5-PAMAM树状聚合物+SMTP和G5-PAMAM树状聚合物+Eno1+SMTP后立即开始的时间过程中获得的用溶媒、G5-PAMAM树状聚合物(G5)+SMTP和G5-PAMAM树状聚合物+Eno1+SMTP(25ug/kg或50ug/kg)中的一种处理两周后db/db小鼠(BKS.Cg-m+/+Leprdb/J)的葡萄糖水平的时间过程。图17A显示了来自全部四个给药方案的结果。图17B显示了来自G5-PAMAM树状聚合物+SMTP(G5+SMTP)和G5-PAMAM树状聚合物+Eno1+SMTP(Eno1+G5+SMTP)50ug/kg的结果,以显示30分钟时间点时葡萄糖水平的显著差异。
图18显示了处理两周后,每日一次皮下注射25μg/kg体重或50μg/kg体重的Eno1/G5-树状聚合物/SMTP复合物对db/db糖尿病小鼠模型的餐后血糖水平的作用。Eno1注射后24小时在没有禁食的情况下测量餐后葡萄糖。“NP”是G5-树状聚合物。
图19显示了每日两次(早晨和晚上)皮下注射100μg/kg体重或200μg/kg体重的Eno1/G5-树状聚合物/SMTP复合物对db/db糖尿病小鼠模型的餐后血糖水平的作用。
图20显示了用G5-PAMAM树状聚合物(G5)、G5-PAMAM树状聚合物+SMTP(G5-SMC)和酰化G5-PAMAM树状聚合物+SMTP(G5-SMC-Ac)处理后检测的肌酸激酶和半胱天冬酶3活性。
图21显示了用或未用Eno1和胰岛素处理的人骨骼肌肌管中的p-Akt蛋白水平。
图22A显示了用或未用纯化的Eno1处理的人骨骼肌肌管中的Glut1、Glut4、HK2和成肌素mRNA水平。图22B显示了用或未用纯化的Eno1处理的人骨骼肌肌管中的Glut1蛋白水平。Glut1蛋白水平是通过核糖体蛋白中值标准化的相对单位。
图23显示了用或未用纯化的Eno1处理的葡萄糖饥饿(上图)和葡萄糖刺激(下图)的人骨骼肌肌管中的葡萄糖-6-磷酸(G6P)水平。
图24显示了用或未用纯化的Eno1处理的葡萄糖饥饿(上图)和葡萄糖刺激(下图)的人骨骼肌肌管中的磷酸烯醇丙酮酸(PEP)水平。
图25显示了用或未用纯化的Eno1处理的,顺序地用棕榈酸盐、CCCP和乙莫克舍(etomoxir)处理的人骨骼肌肌管(HSMM)培养物中的氧消耗率(OCR)。
图26显示了用或未用纯化的Eno1处理的,顺序地用葡萄糖、寡霉素(oligomycin)和2-DG处理的人骨骼肌肌管(HSMM)培养物中的细胞外酸化率(ECAR)。
图27A显示了用500μg/ml或1000μg/ml Eno1处理的人骨骼肌肌管中相对于未处理的对照人骨骼肌肌管的线粒体含量。线粒体含量通过在Eno1处理48小时后将Mitotracker Green(一种绿色荧光线粒体染料)加入细胞中来测定。
图27B显示了用500μg/ml或1000μg/ml Eno1处理的人骨骼肌肌管中相对于未处理的对照人骨骼肌肌管(Eno1 0ug/ml)的线粒体活性氧物质(Mito-ROS)产生。通过用二氢若丹明123处理细胞来测定Mito-ROS,二氢若丹明123是一种不带电的和非荧光的活性氧物质(ROS)指示剂,其可以被动跨膜扩散,在此处其氧化成阳离子若丹明123(其定位于线粒体中并且呈现绿色荧光)。二氢若丹明123处理后,将肌管胰蛋白酶化、洗涤并接受流式细胞分析以测定Mito-ROS水平。
图28A显示了用0、500或1000μg/ml Eno1处理的骨骼肌肌管中的5’AMP激活蛋白激酶(AMPK)和磷酸化AMPK(pAMPK)水平。将核纤层蛋白A/C用作加样对照。
图28B显示了用0、500或1000μg/ml Eno1处理的基础或血清饥饿的骨骼肌肌管中的pAMPK(p-AMPK)与AMPK的比例。
图29显示了描述Nampt在Eno1作用模式中的潜在作用的工作模型的示意图。
图30显示了相对于未处理的对照人骨骼肌肌管(Eno1 0ug/ml),在4天分化后在分化培养基中用500ug/ml或1000μg/ml Eno1处理48小时的人骨骼肌肌管中的Nampt活性。
图31显示了用重组细胞外Nampt(eNampt)处理的血清饥饿人骨骼肌肌管中的2-DG摄取。
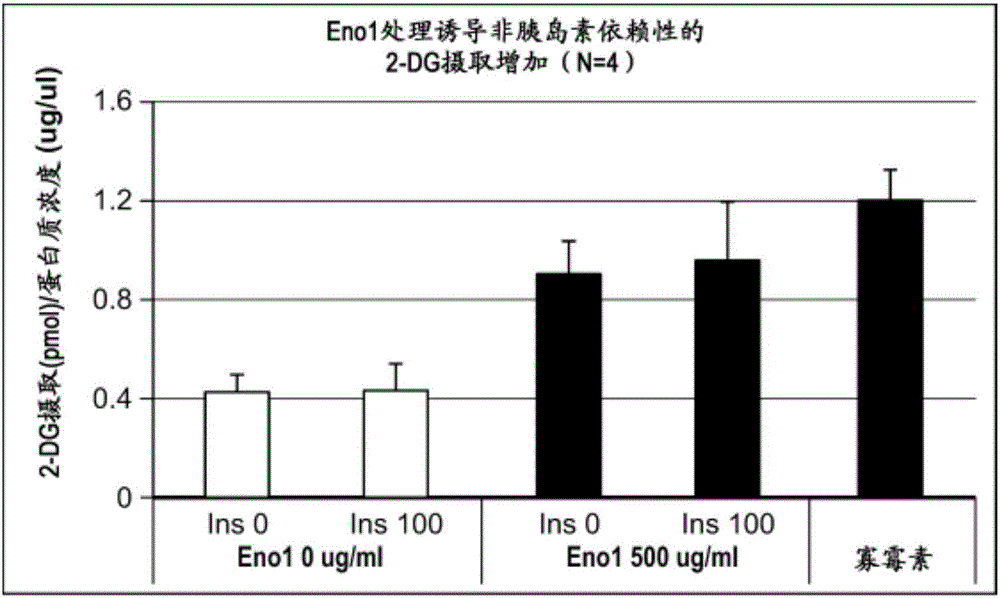
图32显示了在存在或不存在Nampt抑制剂FK866的情况下,在4天分化后在分化培养基中用0、500或1000μg/ml Eno1处理48小时的人骨骼肌肌管中的葡萄糖摄取。在开始Eno1处理后24小时加入FK866,并且用FK866处理肌管24小时。在3小时血清饥饿后测量2-DG摄取。FK866的Nampt抑制消除了Eno1诱导的葡萄糖摄取。
图33显示了糖酵解途径的示意图。
图34A和34B显示了人Eno1,变体1(NCBI登录号NM_001428.3)的(A)氨基酸序列(SEQ ID NO:2)和(B)核酸编码序列(SEQ ID NO:1)。
图35A和35B显示了人Eno1,变体2(NCBI登录号NM_001201483.1)的(A)氨基酸序列(SEQ ID NO:4)和(B)核酸编码序列(SEQ ID NO:3)。人Eno1,变体2蛋白也称为MBP-1。
图36A显示了ENO2mRNA的核酸序列(SEQ ID NO:5)。图36B显示了Eno2的氨基酸序列(SEQ ID NO:6)。
图37A和37B分别显示了ENO3mRNA的变体1(SEQ ID NO:7)和变体2(SEQ ID NO:8)的核酸序列。图37C显示了Eno3蛋白的异形体1(SEQ ID NO:9),其由变体1和变体2两者编码。图37D显示了ENO3mRNA的变体3的核酸序列(SEQ ID NO:10)。图37E显示了Eno3的异形体2的氨基酸序列(SEQ ID NO:11),其由变体3编码。与变体1相比,ENO3mRNA的变体3在5’UTR中不同并且在5’编码区缺少两个外显子。Eno3蛋白的异形体2比异形体1短,但具有相同的N-和C-末端。
具体实施方式
使用发现平台技术来描绘驱动糖尿病的病理生理的明显不同的分子印记。通过这种发现平台技术将Eno1鉴别为在人原发性体外糖尿病模型中被显著调节的关键节点。本文中随后讨论的体外和体内研究证实了Eno1在胰岛素依赖性和非胰岛素依赖性葡萄糖摄取、葡萄糖耐受性、胰岛素敏感性和/或糖尿病中的作用,所述糖尿病例如为1型糖尿病、2型糖尿病、前驱糖尿病和妊娠糖尿病。更具体地,用Eno1蛋白处理人肌管证明了提高肌管中非胰岛素依赖性和胰岛素依赖性葡萄糖摄取两者,表明Eno1在1型和2型糖尿病两者的治疗中以及在存在和不存在胰岛素和/或胰岛素反应的两种情况中的葡萄糖摄取中的作用。此外,Eno1蛋白的施用(单独地或在骨骼肌靶向树状聚合物的环境中)改善了小鼠膳食诱导的肥胖症模型中的葡萄糖耐受性,并且预期在1型和2型糖尿病的遗传模型中具有相似结果。这些结果证明了Eno1在使葡萄糖和胰岛素反应正常化中是有效的,并且因此表明Eno1可用于改善葡萄糖耐受性和提高胰岛素敏感性/降低胰岛素抵抗,因此可用于治疗糖尿病。
I.定义
烯醇酶1,(α),也称为ENO1L、α-烯醇酶、烯醇酶-α、tau-晶体蛋白、非神经烯醇酶(NNE)、α烯醇酶样1、磷酸丙酮酸水合酶(PPH)、纤溶酶原结合蛋白、MYC启动子结合蛋白1(MPB1)和2-磷酸-D-甘油酸水解酶,是哺乳动物中发现的三种烯醇酶同工酶中的一种。本文在图34和35中提供了人Eno1异形体的蛋白质和核酸序列。本申请提供了用于人疾病治疗的人氨基酸和核酸序列。然而,将理解本发明的组合物和方法可以通过选择待处理物种的Eno1容易地适应于非人动物的治疗。非人物种的Eno1的氨基酸和核酸序列是本领域已知的并且可以在例如ncbi.nlm.nih.gov/genbank/中找到。在一些实施方案中,本发明的组合物和方法中使用的Eno1是哺乳动物Eno1。在优选实施方案中,Eno1是人Eno1。
如本文中使用的,“Eno1的施用”,除非另外指出,理解为Eno1蛋白或用于Eno1蛋白表达的核酸构建体的施用。在特定实施方案中,Eno1蛋白可以包括Eno1蛋白片段或用于编码Eno1蛋白片段的核酸。在特定实施方案中,Eno1的施用是Eno1蛋白的施用。在特定实施方案中,Eno1的施用是Eno1多核苷酸的施用。本文中提供了人Eno1的蛋白质和核酸序列。在特定实施方案中,Eno1的施用包括人Eno1的第一变体或第二变体的施用。在特定实施方案中,Eno1的施用包括人Eno1的第一变体和第二变体的施用。在特定实施方案中,Eno1的施用包括人Eno1的第一变体的施用。在特定实施方案中,Eno1的施用包括人Eno1的第二变体的施用。在特定实施方案中,Eno1的施用包括仅人Eno1的第一变体的施用。在特定实施方案中,Eno1的施用包括仅人Eno1的第二变体的施用。
如本文中使用的,“生物活性的”是指具有内源性Eno1蛋白的至少一种活性的Eno1分子或其片段。例如,在一些实施方案中,生物活性Eno1分子或其片段催化2-磷酸-D-甘油酸(PGA)脱水成磷酸烯醇丙酮酸(PEP)。在一些实施方案中,生物活性Eno1分子或其片段催化PEP水合成PGA。在一些实施方案中,生物活性Eno1分子或其片段提高细胞的葡萄糖摄取,所述细胞例如为肌细胞,优选骨骼肌细胞。在一些实施方案中,生物活性Eno1分子或其片段降低血糖水平,例如,餐后血糖水平或葡萄糖耐量测试中的血糖水平。在一些实施方案中,生物活性Eno1分子或其片段结合Nampt,例如,细胞外Nampt(eNampt)。
如本文中使用的,“施用于肌肉”、“递送至肌肉”或“递送至肌细胞”包括骨骼肌细胞、平滑肌细胞等理解为将有效剂量的Eno1提供给肌肉,例如,肌细胞的制剂、方法或其组合,以提供所需的全身性效应,例如,血糖异常受试者中血糖的正常化,例如,通过提高葡萄糖耐量和/或胰岛素敏感性,或治疗糖尿病。在特定实施方案中,将Eno1配制用于直接施用于肌肉,并且优选停留在肌肉中。在特定实施方案中,用于直接施用于肌肉(即,肌肉内施用)的Eno1制剂,优选是持续释放制剂允许相对低的施用频率(例如,每周一次或更少,每隔一周或更少,每月一次或更少,每隔一月一次或更少,每三个月一次或更少,每四个月一次或更少,每五个月一次或更少,每六个月一次或更少)。在特定实施方案中,Eno1连接于靶向部分以提高Eno1至肌肉的递送,使得不是必需将Eno1直接递送至肌肉(例如,皮下或静脉内递送)。将理解施用于肌肉不需要将整个剂量的Eno1递送至肌肉或肌细胞中。在特定实施方案中,至少5%,至少10%,至少15%,至少20%,至少25%,至少30%,至少35%的Eno1递送至肌肉,优选骨骼肌和/或平滑肌。在特定实施方案中,递送至肌细胞的非肌肉内施用肌肉靶向Eno1的量比递送至肌肉的非靶向Eno1的量高约1.5倍或更高倍,2倍或更高倍,3倍或更高倍,4倍或更高倍,5倍或更高倍,或者6倍或更高倍。在特定实施方案中,将Eno1递送至骨骼肌。在特定实施方案中,将Eno1递送至平滑肌。在特定实施方案中,将Eno1递送至骨骼肌和平滑肌。在特定实施方案中,与平滑肌相比,Eno1优先或以更高量递送至骨骼肌。在特定实施方案中,递送至肌肉的至少50%,60%,70%,75%,80%,85%,90%,95%或更多Eno1递送至骨骼肌。在特定实施方案中,Eno1不递送至平滑肌。测定通过靶向部分的有效载荷的相对靶向的试验是本领域已知的,并且例如在Samoylova等,1999,Muscle Nerve,22:460-466中提供,其按引用并入本文中。
如本文中使用的,“肌肉靶向部分”包括至少肌肉靶向肽(MTP),例如,骨骼肌和/或平滑肌靶向肽(SMTP)。在特定实施方案中,靶向部分包括结合整联蛋白αvβ5或αvβ3整联蛋白的配体。在特定实施方案中,靶向部分包括CD-46配体。在特定实施方案中,靶向部分包括腺病毒peton蛋白,任选地结合腺病毒35纤维蛋白。在特定实施方案中,肌肉靶向Eno1的至少5%,至少10%,至少15%,至少20%,至少25%,至少30%,至少35%通过肌肉靶向部分递送至肌肉,在一些实施方案中,优选骨骼肌和/或平滑肌。在特定实施方案中,递送至肌细胞的非肌肉内施用肌肉靶向Eno1的量比递送至肌肉的非靶向Eno1的量高约1.5倍或更高倍,2倍或更高倍,3倍或更高倍,4倍或更高倍,5倍或更高倍,或者6倍或更高倍。
如本文中使用的,“肌肉靶向肽”或“MTP”理解为提高其有效载荷(例如,Eno1)递送至肌细胞(优选骨骼肌和/或平滑肌细胞)的肽序列。MTP是本领域已知的并且例如在美国专利No.6329501;美国专利公开No.20110130346和Samoylova等,1999,Muscle and Nerve 22:460-466中提供,将其每一篇全部按引用并入本文中。在特定实施方案中,MTP是骨骼肌靶向肽。“骨骼肌靶向肽”是提高其有效载荷(例如,Eno1)递送至骨骼肌细胞的肽序列。在特定实施方案中,MTP是平滑肌靶向肽。“平滑肌靶向肽”是提高其有效载荷(例如,Eno1)递送至平滑肌细胞的肽序列。在特定实施方案中,MTP提高其有效载荷(例如,Eno1)递送至骨骼细胞和平滑肌细胞。在特定实施方案中,MTP,例如,骨骼肌靶向肽和/或平滑肌靶向肽,没有提高其有效载荷递送至心肌细胞。MTP,例如,骨骼肌靶向肽包括,但不限于,包含以下序列的肽:ASSLNIA;WDANGKT;GETRAPL;CGHHPVYAC和HAIYPRH。在优选实施方案中,MTP包含氨基酸序列ASSLNIA。
如本文中使用的,“有效载荷”理解为用于通过靶向部分递送至靶细胞的部分。在特定实施方案中,有效载荷是肽,例如,Eno1肽。在特定实施方案中,有效载荷是核酸,例如,编码Eno1肽的核酸。在特定实施方案中,有效载荷进一步包括与Enol有效载荷一起递送至靶细胞的其他组分(例如,树状聚合物、脂质体、微粒)或药剂(例如,治疗剂)。
如本文中使用的,“连接物”理解为将靶向部分和有效载荷足够接近地并置以使得有效载荷通过靶向部分递送至所需的位点的部分。在特定实施方案中,连接物是共价连接物,例如,交联剂,包括可逆交联剂;肽键,例如,其中有效载荷是与靶向部分共翻译的蛋白质。在特定实施方案中,连接物共价连接于有效载荷或靶向部分之一,并与另一个非共价连接。在特定实施方案中,连接物包括树状聚合物。在特定实施方案中,树状聚合物共价连接于靶向部分并且非共价连接于有效载荷,例如,Eno1。在特定实施方案中,连接物是脂质体或微粒,并且靶向部分暴露于脂质体的表面上,并且有效载荷(例如,Eno1)包封在脂质体或微粒中。在特定实施方案中,连接物和Eno1存在于微粒连接物的表面上。在特定实施方案中,靶向部分存在于病毒颗粒的表面上并且有效载荷包括编码Eno1的核酸。
如本文中使用的,“连接的”、“可操作地连接的”、“接合的”等是指其中所描述的组分存在于允许它们以预定的方式起作用的复合物中的并置。组分可以共价连接(例如,肽键、二硫键、非天然化学键)、通过氢键连接(例如,蛋白质的钮-扣(knob-into-holes)配对,参见,例如,美国专利5,582,996;Watson-Crick核苷酸配对),或者直接或通过连接物(例如,肽序列,通常为短肽序列;核酸序列;或化学连接物,包括使用用于连接于高阶或较大结构(包括微粒、珠子或树状聚合物)的连接物)的离子结合(例如,螯合剂和金属)。如本文中使用的,复合物的组分可以通过包装在脂质体和/或树状聚合物之中和/或之上而彼此连接,其中复合物的一些组分可以共价连接,而一些非共价连接。连接物可以用于提供活性分子之间的分离,使得通过将第一分子连接于第二分子而分子的活性基本上没有受到抑制(低于10%,低于20%,低于30%,低于40%,低于50%)。连接物可以用于例如将Eno1连接于靶向部分。如本文中使用的,在其中使用本发明试剂的情况(即,通常是生理条件)下,连接的(但非共价接合的)分子具有低于10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10、10-11或10-12,或那些值包括的任何范围的彼此结合亲和性(Kd)。
在特定实施方案中,有效负荷和靶向部分以约1:1摩尔比存在于复合物中。在特定实施方案中,靶向部分以相对于有效负荷的摩尔过量存在于复合物中。在特定实施方案中,有效负荷与靶向部分的比例为约0.1:1,约0.2:1,约0.3:1,约0.4:1,约0.5:1,约0.6:1,约0.7:1,约0.8:1,约0.9:1,约1:1,约2:1,约3:1,约4:1,约5:1,约6:1,约7:1,约8:1,约9:1,约10:1,约11:1,约12:1,约13:1,约14:1,约15:1,约16:1,约17:1,约18:1,约19:1或约20:1。
“树状聚合物”是由多个从中央核心径向发射的分支单体组成的聚合分子。由于用于产生树状聚合物的结构和合成方法,来自树状聚合物合成的产物理论上是单分散性的。当除去树状聚合物的核心时,保留多个称为树突(dendron)的相同片段,树突的数量取决于中央核心的多重性。从核心向外缘移向外缘时遇到的分支点的数量限定了其代数(generation),例如,G-1、G2、G-3等,较高代的树状聚合物与较低代数的树状聚合物相比更大、分支更多并且具有更多的末端基团。如本文中使用的,树状聚合物优选是药物学上可接受的树状聚合物。
如本文中使用的,“血糖升高的受试者”或“提高的血糖”理解为具有认为是病理状态的足够持续时间和频率的血糖升高的受试者,即没有产生足够的胰岛素或对胰岛素不够敏感的受试者而使得受试者的葡萄糖水平在进食后的延长时间段内保持升高,例如,进食后持续超过两小时,和/或具有升高的空腹血糖的受试者。在特定实施方案中,血糖升高的受试者理解为具有至少100mg/dl的空腹血糖和在75-g口服葡萄糖耐量测试中至少140mg/dl的2-小时血糖之一或两者的受试者。在特定实施方案中,血糖升高的受试者理解为具有至少126mg/dl的空腹血糖;在75-g口服葡萄糖耐量测试中至少200mg/dl的2-小时血糖;或至少200mg/dl的随机血糖中的一种或多种的受试者。在特定实施方案中,血糖升高的受试者理解为具有至少92mg/dl的空腹血糖;在75-g口服葡萄糖耐量测试中至少180mg/dl的1-小时血糖;和在75-g口服葡萄糖耐量测试中至少153mg/dl的2-小时血糖中的一种或多种的妊娠受试者。在如本文中使用的特定实施方案中,血糖升高的受试者不包括患有1型糖尿病或导致绝对胰岛素缺陷的胰腺疾病的受试者。在如本文中使用的特定实施方案中,血糖升高的受试者包括患有1型糖尿病或导致绝对胰岛素缺陷的胰腺疾病的受试者。
如本文中使用的,“HbA1c升高的受试者”或“A1c升高的受试者”理解为具有至少5.7%的HbA1c水平的受试者。在特定实施方案中,受试者具有至少6.5%的HbA1c水平。
如本文中使用的,“糖尿病”旨在指1型糖尿病或2型糖尿病,或1型和2型糖尿病两者,任选地结合妊娠糖尿病。在特定实施方案中,糖尿病包括2型糖尿病。在特定实施方案中,糖尿病不包括1型糖尿病。在特定实施方案中,糖尿病包括妊娠糖尿病。在特定实施方案中,糖尿病不包括妊娠糖尿病。在特定实施方案中,糖尿病包括前驱糖尿病。在特定实施方案中,糖尿病包括前驱糖尿病、1型糖尿病和2型糖尿病。在特定实施方案中,糖尿病包括前驱糖尿病和2型糖尿病。
如本文中使用的,“胰岛素抵抗”和“胰岛素不敏感性”可以互换使用并指其中胰岛素的量在降低血糖中的有效性比正常受试者低而导致血糖提高高于正常范围(其不是由于胰岛素的缺乏)的状况,尤其是病理状况。不希望受到机理的束缚,所述状况通常与通过胰岛素受体的信号传导降低相关。通常,肌肉和脂肪细胞中的胰岛素抵抗分别降低葡萄糖摄取以及作为糖原和甘油三酯的储存。肝细胞中的胰岛素抵抗导致降低的糖原合成并且不能抑制葡萄糖产生和释放至血液中。
胰岛素抵抗常常与“胰岛素不足”一起存在于同一受试者中,其也导致非由于胰岛素的缺乏引起的高于正常范围的血糖提高,尤其是血糖的病理性提高。胰岛素不足是与缺乏胰岛素作用相关的状况,其中胰岛素存在并由身体产生。这与其中由于缺乏胰岛细胞而不产生胰岛素的1型糖尿病明显不同。
对于本发明方法的目的,不需要区分受试者是否患有胰岛素抵抗/不敏感性、胰岛素不足或两者。
术语“受损的葡萄糖耐量”(IGT)或“前驱糖尿病”用于描述在给予葡萄糖耐量测试时具有落入正常和高血糖之间的血糖水平的人员,即,具有异常的葡萄糖耐量,例如,病理上异常的葡萄糖耐量。这样的人员处于产生糖尿病的较高风险中,尽管他们在临床上没有表征为患有糖尿病。例如,受损的葡萄糖耐量是指其中患者高于110mg/dl并低于126mg/dl(7.00mmol/L)的空腹血糖浓度或空腹血清葡萄糖浓度,或高于140mg/dl(7.78mmol/L)并低于200mg/dl(11.11mmol/L)的2小时餐后血糖或血清葡萄糖浓度的状况。前驱糖尿病,也称为受损的葡萄糖耐量或受损的空腹血糖是产生2型糖尿病、心血管疾病和死亡的主要风险因素。许多焦点已经放在研发通过有效治疗前驱糖尿病来防止2型糖尿病发生的治疗干预上(Pharmacotherapy,24:362-71,2004)。
如本文中使用的,“病理”状况达到疾病或病症的临床上可接受的阈值。如果病理状况没有解决,例如,血糖和/或HbA1c没有正常化,病理状况可以导致对受试者的显著的不良作用,特别是长期的。病理状况可以通过治疗剂、外科手术和/或生活方式改变来逆转。病理状况可以是或不是慢性的。病理状况可以是或不是可逆的。病理状况可以是或不是终末的。
“高胰岛素血症”定义为其中受试者具有胰岛素抵抗而具有或不具有正常血糖的病症,其中空腹或餐后血清或血浆胰岛素浓度升高高于不具有胰岛素抵抗的正常瘦个体的血清或血浆胰岛素浓度(即,空腹血糖测试中>100mg/dl,或在口服葡萄糖耐量测试中>140mg/dl)。
“高血糖症”(高血糖)的病症是其中血糖水平太高的状况。通常,在血糖水平升高高于180mg/dl时产生高血糖症。高血糖症的症状包括尿频、烦渴以及在较长时间跨度内的体重减轻。
“低血糖症”(低血糖)的病症是其中血糖水平太低的状况。通常,在血糖水平下降低于70mg/dl时产生低血糖症。低血糖症的症状包括情绪化、四肢麻木(尤其是手和臂中)、混乱、颤抖和头昏。由于这种状况在存在超过可利用葡萄糖量的过量胰岛素时产生,因此其有时候也称为胰岛素反应。
如本文中使用的,“HbA1c水平”或“A1c水平”理解为从HbA1c测试测定的血红蛋白A1c(HbA1c)水平,其评价了之前两个和三个月期间的平均血糖水平。没有糖尿病的人员通常具有4%至6%范围中的HbA1c值。前驱糖尿病特征在于5.7%至6.5%的病理性HbA1c水平,其中高于6.5%的HbA1c水平指示糖尿病。HbA1c的每1%的提高反映出血糖水平提高大约30mg/dL,并且由于持久的血糖升高导致的提高的并发症风险。优选地,根据本发明待治疗的患者的HbA1c值降低至低于9%,低于7%,低于6%,并且最优选至约5%。因此,待治疗患者的过量HbA1c水平(即,超过5.7%的HbA1c水平)相对于治疗前的该水平优选降低至少10%,20%,30%,40%,50%,60%,70%,80%,90%或更多(即,治疗前水平-治疗后水平/治疗前水平)。
如本文中使用的,术语“受试者”是指人和非人动物,包括兽医学受试者。术语“非人动物”包括全部脊椎动物,例如,哺乳动物和非哺乳动物,如非人灵长类、小鼠、兔、绵羊、狗、猫、马、奶牛、鸡、两栖动物和爬行动物。在优选实施方案中,受试者是人并且可以称为患者。
如本文中使用的,术语“治疗(treat)”、“处理(treating)”或“疗法(treatment)”优选是指获得有益或所需临床结果的活动,所述临床结果包括但不限于,疾病或病症的一个或多个体征或症状的缓解或改善、减弱疾病的程度、疾病的稳定状态(即,没有恶化)、疾病状态的改善或缓和。如本文中使用的,治疗可以包括胰岛素抵抗的减轻、提高胰岛素敏感性、降低胰岛素缺陷、提高或正常化HbAc1水平、改善或正常化HbAc1水平、改善或正常化血糖水平(例如,餐后血糖水平、空腹血糖水平、葡萄糖耐量)和改善糖尿病的至少一种体征或症状中的一种或多种。糖尿病(包括2型糖尿病)治疗中的治疗目标包括<6.5%的HbAc1水平;餐前血糖80-120mg/dl;和餐后2小时血糖<140mg/dl。前驱糖尿病治疗的治疗目标包括将HbA1c、血糖水平和葡萄糖反应降低至正常水平。治疗不需要是治愈性的,或达到治疗的理想治疗目标。治疗结果不需要定量地测定。然而,在特定实施方案中,治疗结果可以通过考虑朝向范围末端的正常值的百分改善来定量。例如,代谢症状特征在于一些测量值(例如,血糖水平、HbA1c水平)的过量和其他测量值(例如,胰岛素反应)的不足。具有150mg/dl空腹血糖水平的受试者将具有50mg/dl(150mg/dl-100mg/dl,最大正常血糖水平)的过量空腹血糖。过量血糖降低20%将是过量血糖的10mg/dl降低。对其他值可以进行相似的计算。
如本文中使用的,“降低血糖水平”表示将过量的血糖降低至少10%,20%,30%,40%,50%,60%,70%,80%,90%,95%或更高,以获得正常化的血糖水平,即,不高于150mg/dl的血糖水平。理想地,餐前的血糖水平降低至正常血糖水平,即,150至60mg/dL,140至70mg/dL,130至70mg/dL,125至80mg/dL,并优选120至80mg/dL。可以通过提高与血液的葡萄糖清除相关的任一种生物活性来获得这样的血糖水平降低。因此,具有降低血糖水平能力的药剂可以提高胰岛素产生、分泌或作用。例如,可以通过提高外周组织的葡萄糖摄取和/或通过降低肝葡萄糖产生来提高胰岛素作用。或者,药剂可以降低肠的碳水化合物吸收,改变葡萄糖转运蛋白活性(例如,通过提高GLUT4表达、固有活性或易位),增加胰岛素敏感性组织的量(例如,通过提高肌细胞或脂肪细胞分化)或改变脂肪细胞或肌细胞的基因转录(例如,改变从代谢途径基因的脂肪细胞表达的因子分泌)。理想地,药剂提高与葡萄糖清除相关的超过一种活性。
“改变胰岛素信号传导途径使得血糖水平降低”表示改变(通过提高或降低)涉及胰岛素信号传导的任一种活性,使得整体结果是血浆的葡萄糖清除的提高和使血糖正常化。例如,改变胰岛素信号传导途径,由此引起胰岛素产生、分泌或作用的提高,提高外周组织的葡萄糖摄取,降低肝葡萄糖产生或降低肠的碳水化合物吸收。
“治疗有效量”是足以治疗受试者的疾病的量。可以在一次或多次施用中施用治疗有效量。
用于2型糖尿病的多种治疗是本领域已知的,包括药物干预和行为干预两者。用于2型糖尿病治疗的药物包括,但不限于,美格列奈类(瑞格列奈(Prandin)和那格列奈(Starlix));磺酰脲类(格列甲嗪(Glucotrol)、格列美脲(Amaryl)和格列本脲(DiaBeta,Glynase));二肽基肽酶-4(DPP-4)抑制剂(沙格列汀(Onglyza)、西格列汀(Januvia)和利拉利汀(Tradjenta));双胍类(二甲双胍(Fortamet,Glucophage));噻唑烷二酮类(罗格列酮(Avandia)和匹格列酮(Actos));和α-葡糖苷酶抑制剂(阿卡波糖(Precose)和米格列醇(Glyset))。胰岛素通常只用于晚期2型糖尿病的治疗中,并且包括速效胰岛素(门冬胰岛素(NovoLog),谷赖胰岛素(Apidra)和赖脯胰岛素(Humalog);短效胰岛素(普通胰岛素(Humulin R,Novolin R));中效胰岛素(人胰岛素NPH(Humulin N,Novolin N))和长效胰岛素(甘精胰岛素(Lantus)和地特胰岛素(Levemir))。用于糖尿病的治疗还可以包括行为矫正,包括锻炼和体重减轻,其可以通过使用药物或外科手术来促进。针对升高的血糖和糖尿病的治疗可以结合。例如,药物治疗可以与行为矫正治疗结合。
如本文中使用的“诊断”等是指基于观察、检验或情况对患者状况的临床或其他评价而用于基于至少一种指征的存在,如疾病、失调或病症的体征或症状,鉴别受试者为患有疾病、失调或病症。通常,使用本发明方法的诊断包括与本文中提供的方法结合的针对疾病、失调或病症的多个指征对受试者的观察。诊断方法提供疾病存在或不存在的指示。单一诊断测试通常不提供关于所测试受试者疾病状况的确切结论。
如本文中使用的,“监控”理解为在第一时间点和在之后的第二时间点评价受试者中疾病的至少一个体征或症状,比较病症的体重或症状的严重程度,并确定病症随着时间加重或是减轻。
术语“用药(administer)”、“给药(administering)”或“施用(administration)”包括将药物组合物或药剂递送至受试者系统中或者至受试者体内或之上的特定区域的任何方法。在特定实施方案中,药剂经肠或肠胃外施用。在本发明的特定实施方案中,药剂通过静脉内、肌肉内、皮下、皮内、鼻内、经口、经皮或经粘膜施用。在特定的优选实施方案中,通过注射或输注施用药剂,例如,静脉内、肌肉内、皮下。在特定实施方案中,施用包括使用泵。在特定实施方案中,局部或全身性地施用药剂。可以通过协同工作的多名人员来进行药剂施用。施用药剂包括,例如,对受试者开出待施用的药剂和/或提供直接地或通过另一种手段服用特定的药剂(通过自身递送,例如,通过口服递送、皮下递送、通过中心线的静脉内递送等;或用于通过受训人员的递送,例如,静脉内递送、肌肉内递送等)的说明。
如本文中使用的,术语“共同施用”是指在用于糖尿病、前驱糖尿病、葡萄糖不耐性或胰岛素抵抗治疗的药剂施用前、同时或基本上同时、之后或与其间断地施用Eno1。本文中提供的Eno1制剂可以用于与至少一种用于糖尿病、前驱糖尿病、葡萄糖不耐性或胰岛素抵抗治疗的其他治疗剂的联合疗法中。Eno1和/或其药物制剂及其他治疗剂可以叠加地或更优选地协同地发挥作用。在一个实施方案中,Eno1和/或其制剂与用于糖尿病、前驱糖尿病、葡萄糖不耐性或胰岛素抵抗治疗的另一治疗剂的施用同时施用。在另一个实施方案中,在用于糖尿病、前驱糖尿病、葡萄糖不耐性或胰岛素抵抗治疗的另一治疗剂的施用之前或之后施用Eno1和/或其制剂。
如本文中使用的术语“样品”是指从受试者分离的相似流体、细胞或组织的集合。术语“样品”包括来自受试者的任何体液(例如,尿液、血清、血液、淋巴、妇科流体、囊液、腹水液、眼内液和通过支气管灌洗和/或腹腔冲洗收集的流体)、腹水、组织样品或细胞。其他受试者样品包括泪滴、血清、脑脊液、粪便、痰液和细胞提取物。在特定的实施方案中,样品是尿液或血清。在特定实施方案中,样品包括细胞。在其他实施方案中,样品不包括细胞。
如本文中使用的,术语“对照样品”,是指任何临床上相关的比较样品,包括,例如,来自未患受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、糖尿病或前驱糖尿病中任何一种的健康受试者的样品;或在受试者的较早时间点(例如,在治疗前,在治疗的较早阶段)来自受试者的样品。对照样品可以是用试剂盒提供的纯化样品、蛋白质和/或核酸。这样的对照样品可以例如在系列稀释中稀释以允许测试样品中分析物的定量测量。对照样品可以包括源自一名或多名受试者的样品。对照样品还可以是在较早时间点从待评价的受试者制得的样品。例如,对照样品可以是在异常血糖水平或A1c水平发作之前、在疾病的较早阶段或者在施用治疗或部分治疗之前从待评价的受试者获取的样品。对照样品还可以是来自动物模型或来自源自动物模型的组织或细胞系的样品,所述动物模型是受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、糖尿病或前驱糖尿病的动物模型。可以测定由一组测量组成的对照样品中Eno1活性或表达的水平,例如,基于任何合适的统计测量,如,例如,包括平均值、中值或众数值的集中趋势的测量。
术语“对照水平”是指受试者或受试者样品中受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、糖尿病或前驱糖尿病的体征的公认或预定的水平。以下水平认为是正常水平:
--低于或等于100mg/dl的空腹血糖。
--低于或等于5.7%的HbA1c。
--低于或等于140mg/dl的口服葡萄糖耐量测试。
高于这些水平的水平理解为病理水平。
如本文中使用的,生物标志物的“预定阈值”是指获自正常或健康受试者(例如,不具有异常血糖的受试者)的相应对照/正常样品或对照/正常样品组中升高血糖的生物标志物(例如,生物样品中的表达水平或量(例如,ng/ml))或其他指示剂的水平。预定阈值可以在生物样品中标志物水平的测量之前或同时测定。对照样品可以在之前时间来自同一受试者或者来自不同受试者。
如本文中使用的,在“较早时间点”获得的样品是在过去足够的时间获得的样品,使得与较后时间点相比在来自较早时间点的样品中可以获得临床上相关的信息。在特定实施方案中,较早时间点早至少四周。在特定实施方案中,较早时间点早至少六周。在特定实施方案中,较早时间点早至少两个月。在特定实施方案中,较早时间点早至少三个月。在特定实施方案中,较早时间点早至少六个月。在特定实施方案中,较早时间点早至少九个月。在特定实施方案中,较早时间点早至少一年。可以随着时间以规律或不规律的间隔获得多个受试者样品(例如,3、4、5、6、7或更多个),并分析标志物水平变化的趋势。用于测试特定受试者的合适间隔可以由本领域技术人员基于常规考虑来确定。
如本文中使用的,术语“获得”理解为是指制造、购买或以另外的方式拥有。
如本文中使用的,“检测(detecting)”、“探测(detection)”等理解为是指为了鉴定样品中的特定分析物进行的试验,例如,样品中的Eno1表达或活性水平。样品中检测的分析物或活性的量可以为零或低于试验或方法的检测水平。检测或探测还可以包括葡萄糖和/或HbAc1水平的测量。
术语“调节(modulate)”或“调控(modulation)”是指水平的上调(即,激活或刺激)、下调(即,抑制或遏制)或者两者(结合或单独)。“调节剂”是执行调控的化合物或分子,并且可以是例如激动剂、拮抗剂、激活剂、刺激剂、阻遏剂或抑制剂。
术语“表达”在本文中用来表示多肽通过其从DNA产生的过程。该过程包括基因转录成mRNA并且将这种mRNA翻译成多肽。根据其中使用的上下文,“表达”可以指RNA、蛋白质或两者的产生。
术语“基因的表达水平”或“基因表达水平”是指由细胞中的基因编码的mRNA以及前-mRNA新生转录产物、转录产物加工中间体、成熟mRNA和降解产物的水平,或者蛋白质的水平。
如本文中使用的,术语“扩增”是指用于获得靶核酸序列的多个拷贝(“扩增子”)或其互补序列或片段的任何已知的体外过程。体外扩增是指产生可能含有少于完整靶标区域序列或其互补序列的扩增核酸。已知的体外扩增方法包括,例如,转录介导的扩增、复制酶介导的扩增、聚合酶链式反应(PCR)扩增、连接酶链式反应(LCR)扩增和链置换扩增(SDA,包括多链置换扩增方法(MSDA))。复制酶介导的扩增使用自身复制RNA分子和复制酶,如Q-β-复制酶(例如,Kramer等,美国专利No.4,786,600)。PCR扩增是公知的并且使用DNA聚合酶、引物和热循环以合成DNA或cDNA的两条互补链的多个拷贝(例如,Mullis等,美国专利No.4,683,195、4,683,202和4,800,159)。LCR扩增通过使用杂交、连接和变性的多个循环而使用至少四个单独的寡核苷酸来扩增靶标及其互补链(例如,欧洲专利申请公开No.0 320 308)。SDA是其中引物含有用于限制性核酸内切酶的识别位点的方法,该识别位点允许核苷酸内切酶切割包括靶序列的半修饰(hemimodified)DNA双链体的一条链,接着以一系列的引物延伸和链置换步骤来扩增(例如,Walker等,美国专利No.5,422,252)。两种其他的已知链置换扩增方法不需要核酸内切酶切割(Dattagupta等,美国专利No.6,087,133和美国专利No.6,124,120(MSDA))。本领域技术人员将理解本发明的寡核苷酸引物序列可以容易地用于任一种基于通过聚合酶的引物延伸的体外扩增方法中(一般参见Kwoh等,1990,Am.Biotechnol.Lab.8:14-25和Kwoh等,1989,Proc.Natl.Acad.Sci.USA 86,1173-1177;Lizardi等,1988,BioTechnology 6:1197-1202;Malek等,1994,Methods Mol.Biol.,28:253-260和Sambrook等,2000,Molecular Cloning--A Laboratory Manual(分子克隆--实验室手册),第三版,CSH Laboratories)。如本领域公知的,设计寡聚物以在选定的条件下结合互补序列。
如本文中使用的,术语“抗原”是指引发受试者中的抗体反应或被抗体识别并结合的分子,例如,肽、多肽、蛋白质、片段或其他生物学部分。
如本文中使用的,术语“互补”是指两个核酸链的区域之间或相同核酸链的两个区域之间的序列互补的宽泛概念。已知第一核酸区域的腺嘌呤残基能够与第二核酸区域(其与第一个区域反平行)的残基(如果该残基是胸腺嘧啶或尿嘧啶)形成特异性的氢键(“碱基配对”)。相似地,已知第一核酸链的胞嘧啶残基能够与第二核酸链(其与第一链反平行)的残基(如果该残基是鸟嘌呤)碱基配对。如果在两个区域以反平行方式排列时第一区域的至少一个核苷酸残基能够与第二区域的残基碱基配对,则核酸的第一区域与相同或不同核酸的第二区域互补。优选地,第一区域包括第一部分和第二区域包括第二部分,由此当第一和第二部分以反平行方式排列时,第一部分的至少约50%,并且优选至少约75%,至少约90%,或至少约95%的核苷酸残基能够与第二部分中的核苷酸残基碱基配对。更优选地,第一部分的全部核苷酸残基能够与第二部分中的核苷酸残基碱基配对。
如本文中使用的,短语“特异性结合”或“特异性地结合”在结合抗体与蛋白质或肽的相互作用使用时表示该相互作用取决于蛋白质上特定结构(即,抗原决定簇或表位)的存在;换句话说,抗体识别并结合特定的蛋白质结构而不是总体的蛋白质。例如,如果抗体对于表位“A”是特异性的,则在含有标记的“A”和抗体的反应中存在含有表位A(或游离的,未标记的A)的蛋白质将降低标记的A结合于抗体的量。
短语“特异性鉴别”理解为以足够低的分析背景和所用试剂的交叉反应性检测目标标志物,以使得检测方法在诊断上是有用的。在特定实施方案中,用于标志物的特异性鉴别的试剂只结合标志物的一种异形体。在特定实施方案中,用于标志物的特异性鉴别的试剂结合标志物的超过一种异形体。在特定实施方案中,用于标志物的特异性鉴别的试剂结合标志物的全部已知的异形体。
如本文中使用的,短语“怀疑血糖升高的受试者”是指存在指示血糖升高或与血糖升高相关的一个或多个体征或症状或者正针对血糖升高进行筛选(例如,在常规体检中)的受试者。怀疑血糖升高的受试者还可以具有一个或多个风险因子。怀疑血糖升高的受试者通常尚未测试过异常葡萄糖水平、代谢或反应。然而,“怀疑血糖升高的受试者”包括已经接受了初步诊断(例如,升高血糖的单次出现,但未确认)但其血糖升高的程度未知的个体。该术语进一步包括曾经血糖升高的人(例如,针对血糖升高治疗的在延长时间段内维持正常血糖和/或HbA1c水平的个体,例如,至少3个月,至少6个月等)。
冠词“一个(a)”、“一种(an)”和“该(the)”在本文中用于指该冠词的一个或超过一个(即,至少一个)语法对象,除非另外清楚地指明相反的情况。例如,“一个要素”表示一个要素或超过一个要素。
术语“包括”在本文中用于表示短语“包括但不限于”,并且可以与其互换使用。
术语“或”在本文中用于表示术语“和/或”并且可以与其互换使用,除非文中清楚地表示另外的情况。
术语“如”在本文中用于表示短语“如但不限于”,并且可以与其互换使用。
除非特意声明或从上下文中明显看出,如本文中使用的,术语“约”理解为在本领域的正常容许范围内,例如,在平均值的2倍标准偏差内。约可以理解为在所陈述值的10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%,0.1%,0.05%或0.01%内。除非另外从上下文中清楚看出,否则本文中提供的所有数值由术语约来修饰。
本文中变量的任何定义中的化学基团列表的列举包括该变量作为任何单一基团或所列基团的组合的定义。针对本文中的变量或方面的实施方案的列举包括作为任何单一实施方案或与任何其他实施方案或其部分组合的实施方案。
本文中提供的任何组合物或方法可以与本文中提供的任何其他组合物和方法的一种或多种结合。
本文中提供的范围理解为涵盖范围内所有值。例如,1至50的范围理解为包括来自由1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,15,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50组成的组的任何数字、数字的组合或子范围。
现在将详细描述本发明的优选实施方案。尽管本发明将结合优选实施方案来描述,但将理解其不是打算将本发明限于那些优选的实施方案。相反,意图是的涵盖替换方案、改变和等同方案,如可以包括在通过所附权利要求限定的本发明的精神和范围内。
IIA.烯醇酶1
烯醇酶1,(α),也称为ENO1L、α-烯醇酶、烯醇酶-α、tau-晶体蛋白、非神经烯醇酶(NNE)、α烯醇酶样1、磷酸丙酮酸水合酶(PPH)、纤溶酶原结合蛋白、MYC启动子结合蛋白1(MPB1)和2-磷酸-D-甘油水解酶,是哺乳动物中发现的三种烯醇酶同工酶中的一种。每种同工酶是由2个α、2个γ或2个β亚基构成的同型二聚体,并且作为糖酶解酶发挥作用。此外,α烯醇酶以单体形式作为结构晶体状蛋白(tau-晶体蛋白)发挥作用。这种基因的可变剪接获得较短的异形体,其已经证明结合c-myc启动子并且作为肿瘤遏制剂发挥作用。已经鉴别了几种假基因,包括染色体1长臂上的一种。α-烯醇酶还已经鉴别为桥本脑病中的自身抗原。关于人Eno1的更多信息可以例如依据Gene ID No.2023在NCBI基因数据库中找到(参见,www.ncbi.nlm.nih.gov/gene/2023,以本申请提交日可获得的版本按引用并入本文中)。
Eno1变体
人Eno1的两种异形体是已知的。人烯醇酶1,(α)(ENO1),转录物变体1,mRNA的蛋白质和mRNA序列可以在GenBank登录号No.NM_001428找到(参见www.ncbi.nlm.nih.gov/nuccore/NM_001428.3,其以本申请提交日可获得的版本按引用并入本文中)。这个变体编码较长的异形体,其定位于细胞溶质,并且具有α-烯醇酶活性。已经报道了这种异形体的单体形式作为结构晶体状蛋白(tau-晶体蛋白)发挥作用,而二聚形式作为烯醇酶发挥作用。在本发明的优选实施方案中,Eno1是Eno1的转录物变体。
人烯醇酶1,(α)(ENO1),转录物变体2,mRNA的蛋白质和mRNA序列可以在GenBank登录号No.NM_001201483找到(参见www.ncbi.nlm.nih.gov/nuccore/NM_00001201483.1,其以本申请提交日可获得的版本按引用并入本文中)。这个变体与变体1相比5’端不同,并且从框内下游起始密码子启动翻译,从而产生较短的异形体(MBP-1)。这种异形体定位于细胞核,并且通过结合其启动子作为c-myc原癌基因的转录阻遏子发挥作用。在本发明的特定实施方案中,Eno1是Eno1的转录物变体2。
例如,UniProtKB/Swiss-Prot数据库中登录号No.P06733描述了Eno1蛋白的几种其他变体。Eno1蛋白变体的实例显示于以下的表1中。
表1.Eno1变体
在本发明的特定实施方案中,Eno1是表1中所列变体中的一种。
Eno1活性
Eno1是在糖酵解途径的最后步骤中催化2-磷酸-D-甘油酸(PGA)脱水成磷酸烯醇丙酮酸(PEP)的关键糖酵解酶。Diaz-Ramos等,2012,J Biomed Biotechnol.2012:156795和图33。烯醇酶在Emden Mayerhoff-Parnas糖酵解途径(分解代谢方向)中催化PGA脱水成PEP。在糖异生过程中的合成代谢途径(逆向反应)中,Eno1催化PEP水合成PGA。因此,Eno1也称为磷酸丙酮酸水合酶。金属离子是损害烯醇酶活性提高的辅因子;因此Eno1也称为金属激活的金属酶。镁是引起最高活性的天然辅因子,并且是酶具有催化活性所需要的。酶活性中涉及的其他金属离子的相对活化强度谱显示出以下顺序:Mg2+>Zn2+>Mn2+>Fe(II)2+>Cd2+>Co2+、Ni2+、Sm3+、Tb3+和大部分的其他二价金属离子。在由烯醇酶催化的反应中,来自与PGA的羧酸基团邻近的碳的α-质子被抽取,并且PGA转化成烯醇化物阴离子中间体。这种中间体在各种化学反应中被进一步加工,包括外消旋、环异构化以及水或氨的β-消除。参见Atlas of Genetics and Cytogenetics in Oncology and Haematology database,atlasgeneticsoncology.org/Genes/GC_ENO1.Html。
酶活性的烯醇酶以二聚形式(同型-或异二聚体)存在,并且由两个以反平行方式彼此面对的亚基组成。已经测定了来自酵母和人的烯醇酶的晶体结构并且提出了催化机理。Diaz-Ramos等,以上引用的。参与这种酶的催化活性的五个残基在整个进化中是高度保守的。体外研究揭示了在位置Glu168、Glu211、Lys345、Lys396或His159处不同的突变烯醇酶显示出显著降低的活性水平。烯醇酶的组成和保守部分是参与烯醇酶活性位点的构象变化的两个Mg2+离子,并且使得能够结合底物或其类似物。Atlas of Genetics and Cytogenetics in Oncology database,以上引用的。在特定实施方案中,本发明的组合物包含金属离子辅因子。金属离子辅因子可以提供Eno1在组合物中提高的稳定性和/或提高的体内Eno1活性。在一个实施方案中,金属离子辅因子是二价的。在一个实施方案中,二价金属离子辅因子是Mg2+、Zn2+、Mn2+、Fe(II)2+、Cd2+、Co2+或Ni2+。在一个实施方案中,金属离子辅因子是三价的,例如,Sm3+或Tb3+。
例如,可以使用丙酮酸激酶(PK)/乳酸脱氢酶(LDH)实验测定Eno1活性。以下显示了用于这种烯醇酶试验的反应。
2-磷酸-D-甘油酸(DPG)
可以通过例如使用来自Photon Technology International,Inc.(pti-nj.com)的PTI Quantamaster 40分光光度计测量NADH荧光的降低来测定NADH至NAD+转化的反应速率。用于通过比色丙酮酸激酶/乳酸脱氢酶试验测量Eno1活性的试剂盒也是商业上可购得的,例如,从ABCAM(Cambridge,MA;目录编号ab117994)。ABCAM Eno1活性试验进一步描述于以下的实施例5中。
还如实施例2中所述的,通过测量Eno1对人骨骼肌肌管(HSMM)中的葡萄糖摄取的作用来测定Enol活性。
在特定实施方案中,Eno1或其片段具有纯化内源性人Eno1多肽的至少10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,110%,120%,130%,140%,150%,160%,170%,180%,190%,200%,300%,400%或500%的活性。在特定实施方案中,通过上述的丙酮酸激酶/乳酸脱氢酶试验或HSMM葡萄糖摄取试验测定Eno1、其片段和纯化的内源性人Eno1多肽的活性。
在特定实施方案中,如本文中所述的与树状聚合物复合的Eno1多肽具有未与树状聚合物复合的纯化内源性Eno1多肽的至少10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,110%,120%,130%,140%,150%,160%,170%,180%,190%,200%,300%,400%或500%的活性。在特定实施方案中,通过上述的丙酮酸激酶/乳酸脱氢酶试验或HSMM葡萄糖摄取试验测定与树状聚合物复合的Eno1多肽的活性和未与树状聚合物复合的纯化内源性Eno1多肽的活性。
在特定实施方案中,如本文中所述的与树状聚合物和靶向肽复合的Eno1具有未与树状聚合物和靶向肽复合的纯化内源性人Eno1多肽的至少10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,110%,120%,130%,140%,150%,160%,170%,180%,190%,200%,300%,400%或500%的活性。在特定实施方案中,通过上述的丙酮酸激酶/乳酸脱氢酶试验或HSMM葡萄糖摄取试验测定与树状聚合物和靶向肽复合的Eno1多肽的活性和未与树状聚合物和靶向肽复合的纯化的内源性人Eno1多肽的活性。
在一个实施方案中,本发明组合物中的Eno1或其片段(其中该组合物包含金属离子辅因子(例如,二价金属离子辅因子,如Mg2+、Zn2+、Mn2+、Fe(II)2+、Cd2+、Co2+或Ni2+,或者三价金属离子辅因子,如Sm3+或Tb3+))具有纯化的内源性人Eno1多肽的至少10%,20%,30%,40%,50%,60%,70%,80%,90%,100%,110%,120%,130%,140%,150%,160%,170%,180%,190%,200%,300%,400%或500%的活性。在特定实施方案中,通过上述的丙酮酸激酶/乳酸脱氢酶试验或HSMM葡萄糖摄取试验测定如上所述在金属离子辅因子的组合物中的Eno1或其片段的活性和纯化的内源性人Eno1多肽的活性。
葡萄糖流量
肌肉葡萄糖摄取的调节涉及三步骤的过程,其由以下组成:(1)葡萄糖至肌肉的输送,(2)葡萄糖通过葡萄糖转运子GLUT4转运至肌肉中和(3)肌肉内葡萄糖通过己糖激酶(HK)的磷酸化。肌肉葡萄糖摄取的生理调节需要葡萄糖从血液移动至间质并移动至胞内空间,并且随后磷酸化成G6P。血糖浓度、肌肉血流和毛细管至肌肉的募集决定了葡萄糖从血液至间质的移动。质膜GLUT4含量控制葡萄糖转运至细胞中。肌肉己糖激酶(HK)活性、细胞HK区室化和HK抑制剂(G6P)的浓度决定了葡萄糖磷酸化的能力。这三个步骤-葡萄糖的输送、转运和磷酸化-包括葡萄糖流,并且所有三个步骤对于葡萄糖流量控制都是重要的。然而,葡萄糖磷酸化下游的步骤也可以影响葡萄糖摄取。例如,糖酵解或糖原合成的加速可以减少G6P,提高HK活性,提高葡萄糖磷酸化的能力,并潜在刺激肌肉葡萄糖摄取。Wasserman等,2010,J Experimental Biology,Vol.214,pp.254-262。
本发明至少部分地基于以下发现:Eno1影响葡萄糖流途径的几个组成部分,包括提高葡萄糖转运子GLUT1和GLUT4以及己糖激酶HK2的表达,和提高糖酵解途径中间体G6P和PEP的水平,因此表明Eno1处理起到提高葡萄糖流量的作用。
本发明还至少部分地基于以下发现:在来自正常受试者的肌细胞和来自患有2型糖尿病的受试者的肌细胞中Eno1被差异地调节。本发明进一步基于以下令人惊讶的发现:用Eno1处理肌细胞提高葡萄糖摄取至细胞中并且将Eno1施用于膳食诱导肥胖症的小鼠将葡萄糖耐量和胰岛素反应正常化。
因此,本发明提供了通过将Eno1施用于受试者来治疗通常与糖尿病(包括至少1型糖尿病、前驱糖尿病、2型糖尿病和妊娠糖尿病)相关的血糖升高的方法。此外,本发明提供了用于在哺乳动物中诊断和/或监控(例如,监控疾病进展或治疗)和/或预后升高血糖状态(例如,糖尿病)的方法。本发明还提供了基于关于血糖升高的受试者的血液或血清中的Eno1水平的诊断信息来治疗或调节治疗方案的方法。本发明进一步提供用于实施本发明方法的试剂组和试剂盒。
本发明还提供了用于提高受试者的葡萄糖流量的方法,包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是本文中所述的任一种药物组合物。本发明还提供了提高受试者的骨骼肌细胞中的葡萄糖流量的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是本文中所述的任一种药物组合物。
本发明还提供了提高受试者骨骼肌细胞中的糖酵解活性的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是本文中所述的任一种药物组合物。
本发明还提供了提高受试者骨骼肌细胞中的线粒体游离脂肪酸氧化的方法,该方法包括将包含Eno1或其片段的药物组合物施用于受试者。在特定实施方案中,施用于受试者的药物组合物是本文中所述的任一种药物组合物。
如本文中使用的“提高葡萄糖流量”理解为提高(1)葡萄糖至肌肉的输送,(2)葡萄糖至肌肉中的转运和(3)肌肉内葡萄糖的磷酸化中的至少一种或多种。在特定实施方案中,提高葡萄糖流量包括提高肌细胞中的糖酵解活性或线粒体游离脂肪酸氧化。
IIA.烯醇酶2和烯醇酶3
烯醇酶2(Eno2)也称为γ烯醇酶、神经元烯醇酶、神经元特异性烯醇酶(NSE)或HEL-S-279并且由ENO2基因编码。Eno2是磷酸丙酮酸磷酸酶,糖酵解酶。Eno2是同型二聚体并且在中枢神经系统(CNS)的成熟神经元和神经元起源的细胞中找到。神经元在各种类型应激下将Eno2释放至系统循环中。Yee等,2012,Invest.Ophthalmol.Vis.Sci.Vol.53,No.10,pp.6389-6392。ENO2mRNA的核酸序列和Eno2的氨基酸序列分别显示于图36A和36B中。
烯醇酶3(Eno3)也称为β烯醇酶、肌肉烯醇酶、肌肉特异性烯醇酶(MSE)或GSD13并且由ENO3基因编码。Eno3催化2-磷酸甘油酸和磷酸烯醇丙酮酸的互变。Eno3在成人骨骼肌细胞中发现,它在此处在肌肉发育和再生中起着作用。在成人肌肉中,超过90%的烯醇酶活性由Eno3引起。编码Eno3的基因中的突变与糖原贮积病有关。Comi等,2001,Ann Neurol.Vol.50,No.2,pp.202-207。已经鉴定了ENO3mRNA的三个变体,变体1、2和3。变体1和2编码Eno3蛋白的异形体1,而变体3编码Eno3蛋白的异形体2。与变体1相比,ENO3mRNA的变体3在5’UTR不同并且在5’编码区中缺少两个外显子。Eno3蛋白的异形体2比异形体1短,但具有相同的N-和C-末端。Eno3的变体1、2和3的核酸序列以及异形体1和2的氨基酸序列显示于图37A-37E中。
Eno2和/或Eno3也可以替代Eno1用于本文中所述的方法、药物组合物、试剂组和试剂盒中。例如,Eno2和/或Eno3可以用于通过将包含Eno2和/或Eno3的药物组合物施用于受试者而治疗通常与糖尿病(包括至少1型糖尿病、前驱糖尿病、2型糖尿病和妊娠糖尿病)相关的血糖升高的方法中。此外,Eno2和/或Eno3可以用于在哺乳动物中诊断和/或监控(例如,监控疾病进展或治疗)和/或预后升高的血糖状态(例如,糖尿病)的方法中。Eno2和/或Eno3还可以用于基于关于血糖升高的受试者的血液或血清中的Eno2或Eno3水平的诊断信息来治疗或调节治疗方案的方法中,以及用于实施本发明的试剂组和试剂盒中。本发明还涉及包含Eno2和/或Eno3的药物组合物,例如,用于递送至肌细胞。
III.糖尿病诊断和分类
糖尿病(diabetes mellitus)(DM),常常简称为糖尿病(diabetes),是其中个人具有高血糖的一组代谢疾病,不管是因为身体没有产生足够的胰岛素或是因为细胞不能对产生的胰岛素作出反应。这种高血糖产生了多尿(频繁排尿)、烦渴(增加的口渴)和多食(增加的饥饿)的经典症状。
2型糖尿病由胰岛素抵抗引起,这是其中细胞不能适当地使用胰岛素的一种病症,有时合并绝对的胰岛素缺乏。身体组织对胰岛素反应性的缺陷据信至少部分地涉及胰岛素受体。然而,具体的缺陷是未知的。
在2型糖尿病的早期阶段,主要的异常是降低的胰岛素敏感性。在这个阶段,可以通过提高胰岛素敏感性或降低肝脏的葡萄糖产生的多种措施和药物来逆转高血糖。前驱糖尿病表示个体的血糖水平高于正常但还不足够高至进行2型糖尿病的诊断时发生的病症。
2型糖尿病是由于在胰岛素抵抗的情况中β细胞的胰岛素产生不足。胰岛素抵抗(这是细胞不能适当地对正常水平的胰岛素作出反应)主要发生在肌肉、肝脏和脂肪组织内。在肝脏中,胰岛素通常抑制葡萄糖释放。然而,在胰岛素抵抗的情况中,肝脏不适当地将葡萄糖释放至血液中。胰岛素抵抗相对β细胞功能障碍的比例在个体之间是不同的,一些个体主要具有胰岛素抵抗并且只具有胰岛素分泌的很小缺陷,而其他个体具有轻微的胰岛素抵抗且主要是缺乏胰岛素分泌。
其他与2型糖尿病和胰岛素抵抗相关的潜在重要机制包括:脂肪细胞内提高的脂质分解、对肠促胰岛素的抗性和肠促胰岛素的缺乏、血液中的高胰高血糖素水平、肾脏的盐和水保留提高和中枢神经系统对代谢的不当调节。然而,不是所有具有胰岛素抵抗的人员都发生糖尿病,因为还需要胰腺β细胞胰岛素分泌的损害。
1型糖尿病由于身体不能产生胰岛素而引起,并且目前需要用注射胰岛素来治疗。1型糖尿病的特征在于胰腺中郎罕氏胰岛的产胰岛素β细胞的损失,导致胰岛素缺乏。大部分受影响的人在开始发作时其他方面是健康的并且具有健康体重。对胰岛素的敏感性和反应性通常是正常的,尤其是在早期阶段。然而,特别是在后期阶段,可能发生胰岛素抵抗,包括由于免疫系统清除施用的胰岛素引起的胰岛素抵抗。
A.诊断标准
美国糖尿病协会在Diabetes Care,36:S67-74,2013中公开了糖尿病的诊断和分类标准,将其按引用并入文本中,其提供了更详细的各种类型糖尿病的定义。以下进一步讨论糖尿病的诊断标准。参考文献如下分类1型糖尿病或2型糖尿病:
I.1型糖尿病(β-细胞破坏,通常导致绝对的胰岛素缺陷)
A.免疫介导的
B.特发性的
II.2型糖尿病(范围可以从具有相对胰岛素缺陷的主要胰岛素抵抗至具有胰岛素抵抗的主要分泌缺陷)
III.其他特定类型
IV.妊娠糖尿病
本文中提供了用于进行诊断或评价方法的方法。本文中提供的糖尿病的诊断标准如下:
用于糖尿病诊断的标准
*在不存在明确的高血糖的情况下,标准1-3应当通过重复测试来证实。
本文中提供的糖尿病/前驱糖尿病的提高风险的诊断标准如下:
用于糖尿病(前驱糖尿病)的提高风险的标准*
*对于所有三个测试,风险是连续的,延伸低于范围的下限并且在范围的高端变得不成比例地高。
本文中提供的妊娠糖尿病的诊断标准如下:
妊娠糖尿病(GDM)的筛选和诊断
由于相对于进食的特定时间需求(例如,空腹血糖)或进行测试需要的时间量(例如,与口服葡萄糖耐量测试),用于血糖升高或糖尿病的诊断和/或监控的血糖测量可能是麻烦的。此外,诊断标准明确要求在不存在明确的高血糖的情况下,应当通过重复测试来确认标准1-3。使用HbA1c水平作为诊断指标可能是有利的,因为其提供随着时间的血糖水平的指示,即,约之前1-2个月,并且不需要特殊的时间表来进行测试。相似地,可以测定Eno1水平而没有特别的时间表需求或者食物消耗限制或需求。
因此,在一些方面中,本发明涉及用于诊断受试者中血糖升高的存在的方法,包括:(a)将生物样品接触选择性结合Eno1的试剂;(b)允许试剂和Eno1之间形成复合物;(c)检测复合物的水平,和(d)将复合物的水平与预定的阈值进行比较,其中样品中复合物的水平低于预定阈值表明患者正遭受升高的血糖。在特定实施方案中,选择性结合Eno1的试剂是抗Eno1抗体。在特定实施方案中,抗体包含可检测的标记。
在上述方法的一些实施方案中,检测复合物水平的步骤进一步包括将复合物接触可检测的二抗并且测量二抗的水平。该方法还可以进一步包括检测血糖升高的一个或多个其他指标的水平。血糖的一个或多个其他指标可以选自HbA1c水平、空腹葡萄糖水平、餐后葡萄糖水平和葡萄糖耐量。
在上述方法的一些实施方案中,生物样品是血液或血清。在一些实施方案中,通过免疫分析或ELIS检测复合物的水平。在一些实施方案中,受试者中升高血糖的存在指示选自前驱糖尿病、2型糖尿病、1型糖尿病和妊娠糖尿病的疾病或病症。
B.糖尿病、胰岛素抵抗和胰岛素不足的继发病理
由糖尿病(1型和2型两者)、胰岛素抵抗和胰岛素不足引起的异常血糖调控与继发病理相关,其中许多由差的循环引起。这样的继发病理包括黄斑变性、周围神经病、溃疡和降低的伤口愈合以及降低的肾功能。已经表明将葡萄糖水平和/或HbAc1水平维持在正常范围内降低这些继发病理的发生。应理解血糖、胰岛素和HbAc1水平的正常化将通过限制原发性病理(例如,受损的葡萄糖耐量、提高的血糖)降低继发病理的发生。在特定实施方案中,Eno1不用于治疗与受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、胰岛素不足、糖尿病或前驱糖尿病相关的继发病理。在特定实施方案中,Eno1用于治疗与受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、胰岛素不足、糖尿病或前驱糖尿病相关的继发病理。
IV.剂量和施用方式
施用的技术和剂量根据化合物的类型而改变(例如,蛋白质和/或核酸,单独的或与微粒、脂质体或树状聚合物复合),并且是本领域技术人员公知的或容易确定的。
本发明的治疗化合物可以与药物学上可接受的稀释剂、载体或赋形剂一起,以单位剂量形式来施用。施用可以是肠胃外、静脉内、皮下、口服、外部(topical)或局部(local)。在特定实施方案中,施用不是口服的。在特定实施方案中,施用不是外部的。在特定的优选实施方案中,施用是全身性的。可以通过协同工作的多个人员来进行药剂施用。施用药剂包括,例如,开出施用于受试者的药剂的处方和/或直接地或通过另一人提供服用特定的药剂的说明,其或者通过自我递送,例如,作为口服递送、皮下递送、通过中心线的静脉内递送等,或者通过受过训练的专业人士来递送,例如,静脉内递送、肌肉内递送、皮下递送等。
组合物可以是用于口服施用的丸剂、片剂、胶囊、液体或持续释放片剂的形式;或用于静脉内、皮下或肠胃外施用的液体;或用于全身性施用的聚合物或其他持续释放溶媒。
本领域公知的用于制备制剂的方法可以在例如“Remington:The Science and Practice of Pharmacy”(第20版,编辑A.R.Gennaro,2000,Lippincott Williams&Wilkins,Philadelphia,Pa)中找到。用于肠胃外施用的制剂可以例如含有赋形剂、无菌水、盐水、聚烷撑二醇(如聚乙二醇)、植物来源的油或氢化萘。生物相容的、生物可降解的丙交酯聚合物、丙交酯/乙交酯共聚物或聚氧乙烯-聚氧丙烯共聚物可以用于控制化合物的释放。纳米颗粒制剂(例如,生物可降解的纳米颗粒、固体脂质纳米颗粒、脂质体)可以用于控制化合物的生物分布。其他潜在有用的肠胃外递送系统包括乙烯-乙酸乙烯酯共聚物颗粒、渗透泵、可植入输注系统和脂质体。制剂中化合物的浓度根据多种因素而改变,包括待施用药物的剂量和施用途径。
化合物可以任选地作为药物学上可接受的盐来施用,如制药业中通常使用的非毒性酸式加成盐或金属络合物。酸式加成盐的实例包括有机酸,如乙酸、乳酸、扑酸、马来酸、柠檬酸、苹果酸、抗坏血酸、琥珀酸、苯甲酸、棕榈酸、辛二酸、水杨酸、酒石酸、甲磺酸、甲苯磺酸或三氟乙酸等;聚合酸,如单宁酸、羧甲基纤维素等;和无机酸,如盐酸、氢溴酸、硫酸、磷酸等。金属复合物包括锌、铁等。金属络合物包括锌、铁等。
用于口服使用的制剂包括含有在与无毒的药物学上可接受的赋形剂的混合物中的活性成分的片剂。这些赋形剂可以是,例如,惰性稀释剂或填充剂(例如,蔗糖和山梨糖醇)、润滑剂、助流剂和抗粘剂(例如,硬脂酸镁、硬脂酸锌、硬脂酸、硅石、氢化植物油或滑石)。用于口服使用的制剂也可以作为咀嚼片,或作为硬明胶胶囊(其中将活性成分与惰性固体稀释剂混合),或作为软明胶胶囊(其中将活性成分与水或油介质混合)来提供。
施用化合物的剂量和时机根据各种临床因素而改变,包括受试者的整体健康和疾病(例如,糖尿病、前驱糖尿病)的症状的严重性。
A.用于长效注射药物的制剂
经受高首过清除率的生物制剂和其他药剂可能不适用于口服施用而需要通过肠胃外途径来施用。然而,用于注射药物的治疗方案的依从性可能是低的,因为受试者常常抵触通过注射来自身施用药剂,例如,皮下注射,特别是当疾病没有使受试者感到不舒服时。通过注射的其他施用途径,例如,静脉内、肌肉内,通常需要通过经训练的专业人士来施用,使得频繁的药剂施用是不方便的并且常常是疼痛的。
已经制备了提供注射药剂的持续递送的制剂,包括,但不限于,油基注射液、注射药物悬浮液、注射微球和原位注射系统。与相同化合物的常规制剂相比,长效注射制剂给予了许多优势。这些优势包括至少以下:每次注射后限定时间段内可预测的药物释放特性;更好的患者依从性;易于施用;通过避免首过代谢提高全身利用度;降低的给药频率(即,较少注射)而不损害治疗的有效性;降低的副作用发生率;和医疗护理的总体成本降低。
1.油基注射液和注射药物悬浮液。
常规长效注射由水性溶剂中的亲脂性药物组成(作为悬浮液)或由溶解于植物油中的亲脂性药物组成。商业上可购得的用于肌肉内施用的油基注射药物包括,但不限于,癸酸氟哌啶醇、癸酸氟非那嗪、庚酸睾酮和戊酸雌二醇。这些长效制剂的施用频率大约为每几周。在悬浮液制剂中,药物吸收的速率限制步骤是药物颗粒在制剂或药物制剂周围的组织流体中的溶解。形成水溶性差的盐可以用于控制药物颗粒的溶解速率以延长吸收。然而,几种其他因素,如注射部位、注射体积、药物存库(depot)在注射部位的扩散程度以及油溶媒本身的吸收和分布可能影响药物的总体药代动力学特性。调节这些因素以提供所需药物释放特性在本领域技术人员的能力范围内。
2.基于聚合物的微球体和原位成型。
基于聚合物的长效注射剂的开发是用于大分子(如肽和蛋白质药物)的最适合策略之一。商业上可购得的微球制剂包括,但不限于,醋酸亮丙瑞林、双羟萘酸曲普瑞林、醋酸奥曲肽、醋酸兰瑞肽、利培酮和纳曲酮。商业上可购得的原位形成植入物包括醋酸亮丙瑞林,并且含有紫杉醇和丁哌卡因的原位形成植入物正在临床试验中。这些制剂用于肌肉内施用。用于大分子的基于聚合物的制剂的优势包括:大分子的体外和体内稳定、全身利用度的提高、生物半衰期的延长、患者方便性和依从性的增强和给药频率的降低。
可注射微球和原位形成制剂的设计中的最关键因素是合适的生物可降解聚合物的选择。药物分子从生物可降解微球的释放受到通过聚合物基质的扩散和聚合物降解的控制。聚合物的性质,如共聚物组成比例、聚合物结晶度、玻璃态转化温度和亲水性在释放过程中起着关键作用。尽管结构、固有聚合物特性、核心溶解度、聚合物亲水性和聚合物分子量影响药物释放动力学,药物从微球释放的可能机制如下:初始从表面释放、通过孔隙释放、通过完整的聚合物屏障的扩散、通过水溶胀屏障的扩散、聚合物侵蚀和本体降解。所有这些机制一起在释放过程中起作用。用于微球和原位形成制剂的聚合物包括,但不限于,过去数十年中广泛研究的用于受控药物递送的多种生物可降解聚合物,包括聚丙交酯(PLA)、聚乙交酯(PGA)、聚(丙交酯-共-乙交酯)(PLGA)、聚(ε-己内酯)(PCL)、聚葡糖酸酯、聚酸酐、聚原酸酯、聚(二噁烷酮)和聚烷基氰基丙烯酸酯。原位形成制剂中使用的热诱导胶凝系统显示出热可逆溶胶/凝胶转变,并且通过低临界溶解温度表征。它们在室温下是液体并且在低临界溶解温度和更高温度下产生凝胶。原位固化有机凝胶由水不溶性两性液体组成,其在水中溶胀并形成各种类型的溶致液晶。
B.靶向药物递送
药物至其作用位点的递送可以通过降低提供所需全身性作用所需要的药物量来提高治疗指数。可以通过使用将限制全身性暴露的方法或制剂,例如,肌肉内注射、滑膜内(intrasinovial)注射、鞘内注射、眼内注射,将药物施用于靶组织而将药物递送至作用位点。以上讨论的多种持续递送制剂是用于肌肉内施用的并且提供至肌肉组织的局部递送。或者,靶向部分可以与用于施用于靶位点的治疗性有效载荷缔合或连接。靶向部分可以包括结合特定细胞类型的多种部分中的任何一种。
1.靶向部分
本发明的特定实施方案包括使用靶向部分,包括如上讨论的相对小的肽(例如,25个氨基酸或更少,20个氨基酸或更少,15个氨基酸或更少,10个氨基酸或更少)、肌肉靶向肽(MTP)包括平滑肌和/或骨骼肌靶向肽、αvβ3整联蛋白配体(例如,RGD肽和肽类似物)、αvβ5整联蛋白配体或CD46配体。将理解这样的肽可以包括一个或多个化学修饰以允许与Eno1形成复合物,从而改变肽的药代动力学和/或药效学特性。在特定实施方案中,靶向部分可以是小分子,例如RGD肽模拟物。在特定实施方案中,靶向部分可以包括蛋白质和任选地来自腺病毒35的纤维蛋白。在特定实施方案中,病毒蛋白质存在于病毒颗粒上。在特定实施方案中,病毒蛋白质不存在于病毒颗粒上。在特定实施方案中,靶向部分可以是抗体、抗体片段、抗体模拟物或T-细胞受体。
2.靶向复合物
可以通过肌肉内注射以外的其他途径(例如,皮下注射、静脉内注射)来施用靶向Eno1复合物,同时提供Eno1至肌肉的递送。靶向复合物可以包括一个或多个直接或间接连接于Eno1的靶向部分。靶向复合物的形成没有实质性地或不可逆地抑制Eno1的活性及其对正常化血糖水平和胰岛素反应的作用。在特定实施方案中,使用靶向复合物可以降低提供有效剂量需要的Eno1的总量。以下讨论靶向复合物的一些示例性的、非限制性的实施方案。
在特定实施方案中,有效载荷和靶向部分以约1:1摩尔比存在于复合物中。在特定实施方案中,靶向部分相对于有效载荷以摩尔过量(例如,2:1,3:1,4:1,5:1,6:1,7:1,8:1,9:1,10:1,11:1,12:1,13:1,14:1,15:1,16:1,17:1,18:1,19:1,20:1,21:1,22:1,23:1,24:1,25:1,26:1,27:1,28:1,29:1,30:1或更高;或任何两个值包括的任何范围)存在于复合物中。在特定实施方案中,有效载荷与靶向部分为约1:5-1:15;约1:7-1:13,约1:8-1:12。
将理解本发明的组合物和方法包括超过一种靶向部分-有效载荷复合物(即,靶向部分-有效载荷复合物群体)的施用。因此,将理解每个有效载荷的靶向部分数量可以表示复合物群体中每个有效载荷的平均靶向部分数。在特定实施方案中,至少70%的复合物具有选定的靶向部分与有效载荷的摩尔比。在特定实施方案中,至少75%的复合物具有选定的靶向部分与有效载荷的摩尔比。在特定实施方案中,至少80%的复合物具有选定的靶向部分与有效载荷的摩尔比。在特定实施方案中,至少85%的复合物具有选定的靶向部分与有效载荷的摩尔比。在特定实施方案中,至少90%的复合物具有选定的靶向部分与有效载荷的摩尔比。
a.连接物
多种化学连接物是本领域已知的并且可从商业来源(例如,Pierce Thermo Fisher Scientific Inc.,参见,例如,www.piercenet.com/cat/crosslinking-reagents)获得。这样的试剂可以用于将一个或多个靶向部分可逆或不可逆地化学连接于Enol。连接物还可以用于将靶向部分和Eno1附接于某结构,例如,微粒、树状聚合物,而不是将靶向部分直接连接于Eno1。在特定实施方案中,将Eno1与靶向复合物连接的连接物是可逆的,使得施用后Eno1从复合物释放,优选基本上是在肌肉处释放。
b.肽键
如本文中使用的,靶向复合物可以包括Eno1用肽靶向部分的转化。产生包括用于靶向Eno1的氨基酸序列的表达构建体的方法完全在本领域技术人员的能力范围内。
c.脂质体
脂质体递送系统是本领域已知的,包括限制全身性暴露的制剂,由此降低全身性暴露和脱靶效应。例如,是其中阿霉素包裹在长循环PEG化脂质体中的用于治疗特定类型癌症的组合物,所述脂质体进一步包含胆固醇。两性霉素B的各种脂质体制剂(包括和)配制成用于在脂质体或含有各种磷脂、胆固醇和硫酸胆甾醇酯的脂质复合物中静脉内施用。是在卵磷脂酰甘油和DMPC中配制为脂质体的维替泊芬(verteporfin),用于静脉内施用。脂质体制剂也已知用于肌肉内注射。是灭活的甲肝病毒,而是灭活的流感病毒A株和B株的血细胞凝集素(hemaglutinine)。两种病毒制剂都在DOPC和DOPE的组合中配制。这样的脂质体,或其他生理上可接受的脂质体,可以用于Eno1的包装并且随后用靶向部分表面修饰以将Eno1递送至肌肉。还可以包括调节脂质体的细胞内运输的其他部分。脂质体摄取至细胞中时,脂质体释放Eno1,由此允许其具有其治疗效果。
d.树状聚合物
树状聚合物可以用作用于将多个靶向部分与一个或多个Eno1分子连接的支架。在特定实施方案中,树状聚合物在与Eno1偶联之前用靶向部分修饰。
e.微粒
微粒可以用作用于将多个靶向部分与一个或多个Eno1分子连接的支架,Eno1分子与微粒连接或包封在微粒中。在特定实施方案中,微粒在与Eno1偶联之前用靶向部分修饰。
f.病毒载体
已经长期研究病毒嗜性,并用于指引病毒至目标细胞类型。Parker等,2013(Gene Therapy,20:1158-64)已经研发了具有血清型35的纤维和peton的腺病毒血清型5帽位点(capsite),以增强至骨骼肌和/或平滑肌的递送。这样的病毒载体和其他病毒载体可以用于将Eno1表达构建体递送至肌细胞。
C.树状聚合物
树状聚合物在本发明的情况中可以用作用于靶向复合物的骨架,而用于将非肌肉内施用的Eno1递送至肌肉。或者,树状聚合物可以用于调节肌肉内施用的Eno1的药代动力学和药效学特性。在本发明的组合物和方法中,树状聚合物理解为药物学上可接受的树状聚合物。
基于树状聚合物的平台已经获得了对用于药物应用中的关注。与其他聚合物载体相似,树状聚合物可以合成以避免结构毒性和免疫原性。树状聚合物模拟人蛋白质的大小、溶解性和形状的能力使得该技术成为用于许多治疗和诊断应用的理想选择。1-10纳米的大小使得树状聚合物能够有效地穿过血管内皮扩散,内化至细胞中,并且通过肾脏快速清除。这有助于避免长期毒性并且降低对快速降解平台的需求。多个反应性表面基团的可利用性使得树状聚合物能够携带功能性分子的较高有效载荷,从而增强至作用位点的靶向递送,由此提高功效。
已经生产或正在商业研发针对几种生物医学应用的树状聚合物。局部的、基于聚赖氨酸树状聚合物的杀菌剂,VivaGelTM,已经由Starpharma研发。是用于基因转染的基于树状聚合物的材料。基于树状聚合物的诊断工具包括Gadomer-17,一种含有用钆螯合物功能化的聚赖氨酸树状聚合物的磁共振成像(MRI)造影剂,以及CS,一种用于心脏标志物以快速诊断心脏病发作的生物传感剂。
树状聚合物通过其芯-壳结构来限定,其中树状聚合物利用添加至芯的各个另外的壳(或代)使功能性表面基团的大小和数量大约翻倍。外壳通过本领域公知的方式通过交替的单体反应合成。可以通过改变单体单元来合成专门的树状聚合物骨架。树状聚合物的生物学特性很大程度上受到化学骨架和表面终止(surface termination)的影响。对于成为用于体内药物递送的合适载体的树状聚合物,它们必须是无毒的、非免疫原性的和能够通过穿过合适的屏障而靶向和到达特定的位置,同时足够稳定以保留在循环中。文献中合成和公开的绝大部分树状聚合物在生理条件下是不溶的或不能够在添加功能性分子后保持可溶并且不适用于生物学应用。然而,几类树状聚合物已经显示出对于生物医学应用是有用的支架;实例包括聚酯、聚赖氨酸和聚丙烯亚胺(PPI或DAB)树状聚合物。
生物医学应用中最广泛使用的树状聚合物是聚(酰胺胺)(PAMAM)树状聚合物。从丙烯酸甲酯和乙烯-二胺的重复反应合成的聚酰胺骨架帮助大分子保持水溶性并最小化免疫原性。不同代的PAMAM树状聚合物还能够模拟身体中容易发现的球状蛋白的大小和特性。全代PAMAM树状聚合物的胺封端表面允许容易的表面修饰,使得平台能够在生理条件下携带和溶解疏水性治疗分子,如氨甲喋呤。如果表面胺被中和或适当修饰(例如,酰基化),PAMAM树状聚合物呈现出很少的非特异性毒性。
主动靶向使用分子(如靶向部分)以通过结合于细胞特异性分子来介导其有效载荷(药物或其他)递送至细胞。靶向部分,如本文中提供的那些,常常通过靶细胞上高度表达的受体来结合。靶向配体和细胞表面受体之间的相互作用允许治疗剂或有效载荷选择性地到达肌细胞并且甚至通过受体介导的过程引导到细胞内。
与单一配体相比,与在树状聚合物表面上呈现多个结合配体相关的多价效应增强树状支架的摄取。由多个配体的同时结合引起的多价相互作用允许树状聚合物提高平台的结合亲合力,甚至在单个配体对靶向的受体具有低亲和性时。PAMAM平台已经成功地用作用于连接多价靶向分子(包括抗体、肽、T-抗原和叶酸)的支架。靶向配体将树状聚合物锚定至其中特定受体在细胞表面上表达的位置。靶向的树状聚合物-药物偶联物特异性地递送更高剂量至靶向的细胞而同时避开正常细胞,因此避免潜在的全身性毒性。
用乙酰基中和PAMAM树状聚合物的表面胺最小化毒性和非特异性的树状聚合物摄取。树状聚合物的乙酰基加帽还允许提高从身体的清除,最小化长期治疗的影响。氨基封端的PAMAM树状聚合物的PEG化降低免疫原性和提高溶解性。与阳离子母体材料相比,PEG封端的树状聚合物具有提高的血流半衰期。羟基和甲氧基封端的聚酯树状聚合物已经显示出在高达40mg/kg的浓度下在体内是无毒的。已经在体内证实了阳离子和阴离子树状聚合物之间的毒性差异。使用斑马鱼胚模型,羧基封端的树状聚合物的毒性显著低于G4胺封端的树状聚合物。在相同研究中,用RGD的表面修饰也降低了毒性。
将理解以上和本文中描述的所有树状聚合物可以用于本发明的Eno1组合物及其使用方法中。
在特定实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为约1:1至约10:1,例如,约1:1,约2:1,约3:1,约4:1,约5:1,约6:1,约7:1,约8:1,约9:1或约10:1。在一个实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为约3:1至7:1,例如,3:1,4:1,5:1,6:1或7:1。在一个实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为4:1至6:1,例如,3:1,4:1或5:1。在一个实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为3:1至5:1,例如,3:1,4:1或5:1。在再另一个实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为4:1至5:1。在另一个实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为3:1至4:1。在进一步优选的实施方案中,包含树状聚合物和Eno1的复合物中树状聚合物分子数与Eno1分子数的比率为约5:1。
可以通过使用本领域已知的任何常规方法,如,例如,丙酮酸激酶(PK)/乳酸脱氢酶(LDH)试验或本文中描述的任何其他试验,通过测定树状聚合物/Eno1复合物的Eno1活性(例如,与未复合的Eno1相比)来测试和选择复合物中树状聚合物与Eno1的最佳比率。还可以通过在体外试验中评价树状聚合物/Eno1复合物对葡萄糖摄取的作用,例如,按照本文中实施例2所述的通过测量人骨骼肌微管(HSMM)中的葡萄糖摄取或本领域已知的任何相似试验,来测试和选择树状聚合物与Eno1的最佳比率。还可以通过在体内测量树状聚合物/Enol复合物对血糖水平的作用,例如,按照本文中实施例7和8中所述的通过测量糖尿病小鼠模型中树状聚合物/Eno1复合物对血糖的作用,或本领域已知的任何相似模型或试验,来测试和选择树状聚合物与Eno1的最佳比率。复合物中树状聚合物与Eno1的最佳比率将优选保留体外和/或体内的Eno1活性,和/或提供Eno1至细胞的递送。
将理解本发明的组合物和方法包括超过一种树状聚合物-Eno1-靶向肽复合物(即树状聚合物-Eno1-靶向肽复合物群体)的施用。因此,将理解每个Eno1分子的树状聚合物数可以表示复合物群体中每个Eno1的平均树状聚合物数。在特定实施方案中,至少70%的复合物具有选定的树状聚合物与Eno1的摩尔比。在特定实施方案中,至少75%的复合物具有选定的树状聚合物与Eno1的摩尔比。在特定实施方案中,至少80%的复合物具有选定的树状聚合物与Eno1的摩尔比。在特定实施方案中,至少85%的复合物具有选定的树状聚合物与Eno1的摩尔比。在特定实施方案中,至少90%的复合物具有选定的树状聚合物与Eno1的摩尔比。
在特定实施方案中,树状聚合物/Eno1/靶向肽复合物中树状聚合物分子数与靶向肽数的比率为1:0.1至1:10,1:1至1:10,1:1至1:5,或1:1至1:3。在特定实施方案中,树状聚合物分子数与靶向肽数的比率为约1:1,1:2,1:3,1:4,1:5,1:6,1:7,1:8,1:9或1:10。在优选实施方案中,树状聚合物/Eno1/靶向肽复合物中树状聚合物分子数与靶向肽数的比率为约1:1。在优选实施方案中,树状聚合物/Eno1/靶向肽复合物中树状聚合物分子数与靶向肽数的比率为约1:2。在优选实施方案中,树状聚合物/Eno1/靶向肽复合物中树状聚合物分子数与靶向肽数的比率为约1:3。
在特定实施方案中,树状聚合物/Eno1/靶向肽复合物中靶向肽数与树状聚合物分子数的比率为至少1:1,至少2:1,至少3:1,至少4:1,至少5:1,至少6:1,至少7:1,至少8:1,至少9:1或至少10:1。在一个实施方案中,树状聚合物/Eno1/靶向肽复合物中靶向肽数与树状聚合物分子数的比率为至少3:1。
将理解本发明的组合物和方法包括超过一个靶向肽-Eno1-树状聚合物复合物(即靶向肽-Eno1-树状聚合物复合物群体)的施用。因此,将理解每个树状聚合物的靶向肽数表示复合物群中每个树状聚合物的平均靶向肽数。在特定实施方案中,至少70%的复合物具有选定的靶向肽与树状聚合物的摩尔比。在特定实施方案中,至少75%的复合物具有选定的靶向肽与树状聚合物的摩尔比。在特定实施方案中,至少80%的复合物具有选定的靶向肽与树状聚合物的摩尔比。在特定实施方案中,至少85%的复合物具有选定的靶向肽与树状聚合物的摩尔比。在特定实施方案中,至少90%的复合物具有选定的靶向肽与树状聚合物的摩尔比。
可以通过测量树状聚合物/Eno1/靶向肽在体内对特定组织的靶向,例如,如本文中实施例6中所述的,通过测量可检测地标记的树状聚合物/Eno1/靶向肽复合物在体内的靶向,来选择树状聚合物与靶向肽的最佳比率。
V.血糖水平的指标的检测和测量及控制
用于检测和测量血糖升高的指标和血糖控制的方法可以根据待测量指标的性质而改变。可以直接(例如,通过测定血液中葡萄糖的量)或间接(例如,通过检测糖化血红蛋白(HbA1c)的量)测量升高的血糖,且由此测量血糖水平控制的丧失和糖尿病的严重性,糖化血红蛋白是血红蛋白和葡萄糖的反应产物。本发明进一步提供用于使用Eno1检测血糖控制的方法。
本发明考虑任何合适的手段、技术和/或程序用于检测和/或测量本发明的血糖水平指标。本领域技术人员将理解用于测量本发明指标的方法将至少取决于所检测或测量的指标(例如,葡萄糖、酮类、mRNA或多肽,包括糖化多肽)和生物样品(例如,全血、血清)的类型。特定的生物样品在测量本发明的生物标志物之前还可能需要特定的专门处理,例如,在待测量mRNA生物标志物(例如,Eno1mRNA)的情况中mRNA的制备。
A.使用确定的指标直接或间接测量血糖和血糖控制
血糖监控是在单个时间点直接测试血液中的葡萄糖浓度(血糖)的方式。在糖尿病的护理中特别重要的,血糖测试通过刺穿皮肤(通常,在手指上)以抽血,然后将血液施加于化学活性的一次性“测试条”上来进行。不同的制造商使用不同的技术,但大部分系统测量电特征,并且使用这种电特征来测定血液中的葡萄糖水平。该测试通常称作毛细血管血糖。用于周期性或连续使用的商业可购得的血糖监测器是本领域已知的。用于周期性检测血糖水平的葡萄糖监测器包括,但不限于,TRUEResult血糖计(TRUE)、ACCU-CHEK血糖计(ACCU-CHEK)、OneTouch血糖计(ONETOUCH)和FreeStyle Lite Blood Glucose(FREESTYLE LITE)。将理解,直接测量的正常血糖水平将根据最后食用食物后的时间量而不同,正常的空腹血糖水平低于正常的餐后血糖水平。直接血糖监控也用于葡萄糖耐量测试中以监控对服用高剂量葡萄糖的反应和葡萄糖从血液清除的速率。
糖化血红蛋白(血红蛋白A1c、HbA1c、A1C、Hb1C、HbA1c)是主要测量来鉴定延长时间段上平均血糖浓度的血红蛋白形式,即血糖的间接测量。HbA1c通过血红蛋白暴露于血糖而在非酶促糖化途径中形成。当存在正常血糖水平时,产生正常量的糖化血红蛋白,其作为总血红蛋白的百分比或特定的血液浓度测量。当血糖水平高时,产生升高的糖化血红蛋白水平。糖化是不可逆的反应。因此,红细胞内糖化血红蛋白的量反映出细胞已经暴露于其中的葡萄糖的平均水平。测量糖化血红蛋白通过监控长期血清葡萄糖调控而非通过葡萄糖监控提供的快照图像来评价治疗的有效性。HbA1c水平与之前四周至三个月内的平均血糖浓度成比例。例如,可以使用高性能液相色谱(HPLC)或免疫分析来测量HbA1c水平。以下详细讨论用于检测和测量蛋白质分析物的方法。
B.核酸指示剂的检测
在特定实施方案中,本发明涉及核酸生物标志物(例如,Eno1 mRNA生物标志物)的检测,任选地结合血糖的其他指示剂,来监控受试者中的糖尿病和/或血糖控制,例如,血糖、酮类和/或HbA1c的直接测量。
在各种不同的实施方案中,本发明的诊断/预后方法通常涉及血样中Eno1表达水平的测定。本发明方法实施中基因表达水平的测定可以通过任何合适的方法来进行。例如,可以通过检测从目标基因表达的mRNA的表达和/或检测由基因编码的多肽的表达来进行基因表达水平的测定。
对于检测编码Eno1的核酸,可以使用任何合适的方法,包括但不限于,Southern印迹分析、northern印迹分析、聚合酶链式反应(PCR)(参见,例如,美国专利No.4,683,195;4,683,202和6,040,166;"PCR Protocols:A Guide to Methods and Applications(PCR实验方案:方法和应用指导)",Innis等(编辑);1990,Academic Press:New York)、逆转录酶PCR(RT-PCR)、锚定PCR、竞争性PCR(参见,例如,美国专利No.5,747,251)、cDNA末端快速扩增(RACE)(参见,例如,"Gene Cloning and Analysis:Current Innovations(基因克隆和分析:目前的创新),1997,pp.99-115);连接酶链式反应(LCR)(参见,例如,EP 01 320 308);单边PCR(Ohara等,Proc.Natl.Acad.Sci.,1989,86:5673-5677)、原位杂交、基于Taqman的分析(Holland等,Proc.Natl.Acad.Sci.,1991,88:7276-7280)、差异显示(参见,例如,Liang等,Nucl.Acid.Res.,1993,21:3269-3275)和其他RNA指纹技术、基于核酸序列的扩增(NASBA)和其他基于转录的扩增系统(参见,例如,美国专利No.5,409,818和5,554,527)、Qbeta复制酶、链置换扩增(SDA)、修复链反应(RCR)、核酸酶保护分析、基于减法的方法(subtraction-based method)、等。
在其他实施方案中,可以通过扩增从mRNA产生的互补DNA(cDNA)或互补RNA(cRNA)并使用微阵列对其进行分析来测定Eno1的基因表达水平。多种不同的阵列构造及其生产方法是本领域技术人员已知的(参见,例如,美国专利No.5,445,934;5,532,128;5,556,752;5,242,974;5,384,261;5,405,783;5,412,087;5,424,186;5,429,807;5,436,327;5,472,672;5,527,681;5,529,756;5,545,531;5,554,501;5,561,071;5,571,639;5,593,839;5,599,695;5,624,711;5,658,734和5,700,637。微阵列技术允许同时测量大量基因的稳态mRNA水平。目前广泛使用的微阵列包括cDNA阵列和寡核苷酸阵列。使用微阵列的分析通常是基于从标记探针接收的信号强度的测量,所述标记探针用于检测来自样品的与固定于微阵列上已知位置的核酸探针杂交的cDNA序列(参见,例如,美国专利No.6,004,755;6,218,114;6,218,122和6,271,002)。基于阵列的基因表达方法是本领域已知的并且在许多科学出版物以及专利中描述(参见,例如,M.Schena等,Science,1995,270:467-470;M.Schena等,Proc.Natl.Acad.Sci.USA 1996,93:10614-10619;J.J.Chen等,Genomics,1998,51:313-324;美国专利No.5,143,854;5,445,934;5,807,522;5,837,832;6,040,138;6,045,996;6,284,460和6,607,885)。
在一个特定的实施方案中,本发明包括通过扩增和检测对应于Eno1的核酸,任选结合血糖升高的一种或多种其他指示剂,来鉴别遭受异常血糖的受试者的方法。
用作扩增模板的核酸可以根据标准方法(Sambrook等,1989)从生物样品中所含的细胞分离。核酸可以是基因组DNA或者片段化或全细胞RNA。在使用RNA的情况中,将RNA转化成互补cDNA可能是需要的。在一个实施方案中,RNA是全细胞RNA,并且直接用作扩增模板。
将与对应于本文中鉴定的任一Eno1核苷酸序列的核酸选择性杂交的引物对在允许选择性杂交的条件下接触分离的核酸。一旦杂交,将核酸:引物复合物接触一种或多种促进模板依赖性核酸合成的酶。进行多轮扩增,也称为“循环”,直至产生足够量的扩增产物。接着,检测扩增产物。在特定应用中,可以通过视觉方式进行检测。或者,检测可以涉及通过化学发光、掺入的放射性标记或荧光标记的放射性闪烁扫描法或甚至通过使用电或热脉冲信号的系统(AFFYMAX技术;Bellus,1994)的间接产物鉴定。检测后,可以将给定患者中看到的结果与正常患者和血糖升高患者(例如,前驱糖尿病、2型糖尿病、妊娠糖尿病或1型糖尿病患者)的统计学显著参照组进行比较。以这种方式,有可能将检测的核酸量与各种临床状态相关联。
如本文中限定的,术语引物表示包括能够在模板依赖性方法中启动新生核酸的合成的任何核酸。通常,引物是长度十至二十个,优选十五至二十个核苷酸的寡核苷酸,但也可以使用更长的序列。引物以双链或单链形式来提供,尽管优选单链形式。
多种模板依赖性方法可用于扩增给定模板样品中存在的核酸序列。最佳的已知扩增方法之一是聚合酶链式反应(称为PCR),其详细描述于美国专利No.4,683,195,4,683,202和4,800,159以及Innis等,1990中,将其每篇全部按引用并入本文中。
在PCR中,制备两个引物序列,其与靶核酸序列的相对互补链上的区域互补。将过量的三磷酸脱氧核苷酸连同DNA聚合酶(例如,Taq聚合酶)一起加入反应混合物中。如果样品中存在靶核酸序列,引物将结合靶核酸并且聚合酶将通过添加核苷酸引起引物沿着靶核酸序列延伸。通过升高和降低反应混合物的温度,延伸的引物将与靶核酸解离以形成反应产物,过量引物将结合靶核酸和反应产物,并且重复该过程。
可以进行逆转录酶PCR扩增程序以定量扩增的mRNA的量。将RNA逆转录成cDNA的方法是公知的并且描述于Sambrook等,1989中。逆转录的替代方法利用热稳定的DNA聚合酶。这些方法描述于1990年12月21日提交的WO 90/07641中。聚合酶链式反应方法是本领域公知的。
用于扩增的另一种方法是连接酶链式反应(“LCR”),公开于欧洲申请No.320 308中,将其全部按引用并入本文中。在LCR中,制备两个互补探针对,并且在靶序列存在下,每个对结合靶标的相对互补链,使得它们邻接。在连接酶的存在下,两个探针对连接以形成单个单元。通过温度循环,如PCR中那样,结合的连接单元从靶标解离,并且随后用作用于过量探针对连接的“靶序列”。美国专利No.4,883,750描述了一种与LCR类似的用于将探针对结合靶序列的方法。
Qbeta复制酶,描述于PCT申请No.PCT/US87/00880中,也可以用作本发明中的再另一种扩增方法。在这种方法中,在RNA聚合酶存在下,将具有与靶标的区域互补的区域的RNA的重复序列加入样品中。聚合酶将复制该重复序列,其随后可以被检测到。
等温扩增方法可以用于本发明的核酸扩增中,其中使用限制性核酸内切酶和连接酶来获得在限制性位点的一条链中含有核苷酸5’-[α-硫代]-三磷酸的靶分子的扩增。Walker等(1992),将其全部按引用并入本文中。
链置换扩增(SDA)是进行核酸的等温扩增的另一种方法,其涉及多轮链置换和合成,即,缺口平移。相似的方法,称为修复链反应(PCR),涉及在靶向用于扩增的整个区域中使几个探针退火,接着进行修复反应,其中只存在四种碱基中的两种。为了易于检测,其他两种碱基可以作为生物素化的衍生物加入。相似的方法用于SDA中。也可以使用循环探针反应(CPR)检测靶特异性的序列。在CPR中,具有非特异性DNA的3’和5’序列以及特异性RNA的中间序列的探针与样品中存在的DNA杂交。杂交时,用RNase H处理反应,并且将探针的产物鉴别为截然不同的产物,其在消化后释放。将原始模板与另一个循环探针退火并重复该反应。
根据本发明可以使用GB申请No.2 202 328和PCT申请No.PCT/US89/01025中描述的再另外的扩增方法,每篇都以其全部按引用并入。在前一申请中,将“修饰的”引物用于PCR样的、模板和酶依赖性合成中。可以通过用捕获部分(例如,生物素)和/或检测部分(例如,酶)标记来修饰引物。在后一申请中,将过量的标记引物加入样品中。在靶序列存在的情况下,探针结合并通过催化切割。切割后,靶序列完整释放以被过量的探针结合。标记探针的切割给出靶序列存在的信号。
其他考虑的核酸扩增程序包括基于转录的扩增系统(TAS),包括基于核酸序列的扩增(NASBA)和3SR。Kwoh等(1989);Gingeras等,PCT申请WO 88/10315,将其全部按引用并入本文中。在NASBA中,核酸可以通过标准苯酚/氯仿萃取、临床样品的热变性、用裂解缓冲液和用于DNA和RNA分离的minispin柱处理或者RNA的盐酸胍提取来制备用于扩增。这些扩增技术涉及使具有靶特异性序列的引物退火。聚合后,用RNase H消化DNA/RNA杂合体,同时将双链DNA分子再次热变性。在任一种情况中,通过添加第二靶特异性引物,接着聚合将单链DNA制成完全双链的。然后通过聚合酶如T7或SP6多重转录双链DNA分子。在等温循环反应中,将RNA逆转录成双链DNA,并用聚合酶如T7或SP6再转录一次。将所得到的产物(不管是截短的或完整的)表明靶特异性的序列。
Davey等,欧洲申请No.329 822(将其全部按引用并入本文中)公开了涉及循环合成的单链RNA(“ssRNA”)、ssDNA和双链DNA(dsDNA)的核酸扩增方法,其可以根据本发明来使用。ssRNA是用于第一引物寡核苷酸的第一模板,其通过逆转录酶(RNA依赖性DNA聚合酶)来延伸。RNA然后通过核糖核酸酶H(RNase H,对于DNA或RNA双链体中的RNA特异性的RNA酶)的作用从所得到的DNA:RNA双链体除去。所得到的ssDNA是用于第二引物的第二模板,其也包括5’侧与模板同源性的RNA聚合酶启动子的序列(通过T7RNA聚合酶举例说明)。然后这个引物通过DNA聚合酶(通过大肠杆菌DNA聚合酶1的大“Klenow”片段来举例说明)延伸,从而形成双链DNA(“dsDNA”)分子,具有与引物之间的原始RNA序列相同的序列,并且在一端另外具有启动子序列。这种启动子序列可以被合适的RNA聚合酶利用来制备DNA的许多RNA拷贝。这些拷贝随后可以重新进入循环,导致非常迅速的扩增。通过酶的适当选择,可以等温地进行这种扩增而不需要在每个循环添加酶。由于这种方法的循环性质,可以选择DNA或RNA形式的起始序列。
Miller等,PCT申请WO 89/06700(将其全部按引用并入本文中)公开了基于启动子/引物序列与单链靶DNA(“ssDNA”)杂交接着转录该序列的许多RNA拷贝的核酸序列扩增方案。这种方案不是循环的,即,新模板不是从所得到的RNA转录物产生。其他扩增方法包括“race”和“单侧PCR.TM.”。Frohman(1990)和Ohara等(1989),将每篇都以其全部按引用并入本文中。
基于在具有所得到的“二-寡核苷酸”的序列的核酸存在下连接两个(或更多个)寡核苷酸而由此扩增二-寡核苷酸的方法也可以用于本发明的扩增步骤中。Wu等(1989),将其全部按引用并入本文中。
根据特定的分析形式和特定的需求以及使用的靶向序列,本发明的寡核苷酸探针或引物可以是任何合适长度的。在优选实施方案中,寡核苷酸探针或引物长度为至少10个核苷酸(优选地,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32…),优选长度至少15个核苷酸(15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32…),并且它们可以适应地改变以尤其适合于选定的核酸扩增系统和/或使用的杂交系统。较长的探针和引物也在本发明的范围内,如本领域公知的。具有超过30,超过40,超过50个核苷酸的引物和具有超过100,超过200,超过300,超过500,超过800和超过1000个核苷酸长度的探针也被本发明涵盖。当然,较长的引物具有更昂贵的缺陷,并且因此,本领域中通常设计和使用具有15至30个核苷酸长度的引物。如本领域公知的,在本发明的方法中可以使用长度范围为10至超过2000个核苷酸的探针。对于上述%同一性,非特意描述的探针和引物的大小(例如,16,17,31,24,39,350,450,550,900,1240个核苷酸…)也在本发明的范围内。在一个实施方案中,本发明的寡核苷酸探针或引物与Eno1RNA(或其互补序列)或Eno1 mRNA特异性地杂交。更优选,选择Eno1引物和探针来检测与血糖升高或异常血糖调控相关的Eno1RNA,该血糖升高或异常血糖调控与例如前驱糖尿病、2型糖尿病、1型糖尿病或妊娠糖尿病相关。
在其他实施方案中,检测手段可以利用杂交技术,例如,其中选择特异性的引物或探针与目标靶生物标志物(例如,Eno1)退火,并且此后进行选择性杂交的检测。如本领域通常所知的,可以通过考虑其杂交的熔点及其靶向的序列来设计寡核苷酸探针和引物(参见下文和Sambrook等,1989,Molecular Cloning--A Laboratory Manual(分子克隆--实验室手册),第2版,CSH Laboratories;Ausubel等,1994,见Current Protocols in Molecular Biology(分子生物学通用实验方案),John Wiley&Sons Inc.,N.Y.)。
为了使得能够在本发明的测试条件下发生杂交,寡核苷酸引物和探针应当包含与Eno1多核苷酸的一部分具有至少70%(至少71%,72%,73%,74%或更高),优选至少75%(75%,76%,77%,78%,79%,80%,81%,82%,83%,84%,85%,86%,87%,88%,89%或更高)和更优选至少90%(90%,91%,92%,93%,94%,95%,96%,97%,98%,99%,100%)同一性的寡核苷酸序列。本发明的探针和引物是在严格杂交条件下杂交的那些和在至少中等严格条件下与Eno1同源物杂交的那些。在特定实施方案中,本发明的探针和引物具有与Eno1基因序列(例如,cDNA或mRNA)的完全序列同一性。应当理解,通过使用本领域已知的计算机比对和序列分析的方法(参考Molecular Cloning:A Laboratory Manual(分子克隆:实验室手册),第三版,由Cold Spring Harbor Laboratory编辑,2000),可以基于本文中公开的Eno1序列容易地设计其他探针和引物并用于本发明中。
C.血糖控制的血糖多肽指示剂的检测
本发明考虑用于检测血糖的多肽指示剂(包括Eno1或HbA1c)的任何合适方法。在特定实施方案中,检测方法是涉及特异性地结合Eno1和血红蛋白中的一种或多种的抗体的免疫检测方法,尤其是特异性地结合糖化血红蛋白。各种有用的免疫检测方法的步骤已经描述于科学文献中,如,例如,Nakamura等(1987),将其按引用并入本文中。
通常,免疫检测方法包括获得怀疑含有血糖升高的蛋白质或肽指示剂的样品,并且根据具体情况,在有效地允许免疫复合物形成的条件下将样品接触根据本发明的抗体。
免疫结合方法包括用于检测或定量样品中的反应性组分的量,该方法需要检测或定量在结合过程中形成的任何免疫复合物。在此,将获得怀疑含有血糖升高的蛋白质或肽指示剂的样品,并将样品接触抗体,然后检测或定量在特定条件下形成的免疫复合物的量。
就血糖指标的检测而言,分析的生物样品可以是怀疑含有血糖的蛋白质或肽指示剂(如Eno1或HbA1c)的任何样品。在HbA1c的情况中,生物样品可以是例如血液,或在Eno1的情况中,可以是血液或血清。
在有效地允许免疫复合物(初级免疫复合物)形成的条件下并持续足够的时间将选定的生物样品接触抗体(例如,作为结合生物样品中的Eno1、HbA1c或血红蛋白的检测剂)。通常,复合物形成是将组合物简单地加入生物样品中并将混合物孵育对于抗体与存在的任何抗原形成复合物(即,结合存在的任何抗原)足够长的时间的问题。在这个时间后,通常洗涤样品-抗体组合物,如组织切片、ELISA平板、点印迹或western印迹,以除去任何非特异性结合的抗体物质,从而只允许在初级免疫复合物内特异性结合的那些抗体被检测到。
通常,免疫复合物形成的检测是本领域公知的并可以通过应用多种途径来实现。这些方法通常基于标记或标志物的检测,如本领域标准用途的任何放射性、荧光、生物或酶标签或标记。关于此类标记使用的美国专利包括美国专利No.3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149和4,366,241,将每篇都按引用并入本文中。当然,如本领域已知的,可以通过使用第二结合配体如第二抗体或生物素/抗生物素蛋白配体结合设置发现另外的优势。
检测中使用的抗体(例如,抗Eno1抗体、抗血红蛋白或抗糖化血红蛋白抗体)可以自身连接于可检测标记,其中随后可以简单地检测这种标记,由此允许测定组合物中初级免疫复合物的量。
或者,可以通过对于结合的抗体具有结合亲和性的第二结合配体来检测成为结合在初级免疫复合物内的第一添加组分。在这些情况中,第二结合配体可以连接于可检测标记。第二结合配体自身常常是抗体,其因此可以被称为“第二”抗体。将初级免疫复合物在有效地允许次级免疫复合物形成的条件下接触标记的第二结合配体或抗体持续足够的时间。然后通常洗涤次级免疫复合物以除去任何非特异性结合的标记的第二抗体或配体,并且随后检测次级免疫复合物中保留的标记。
更多的方法包括通过两步法检测初级免疫复合物。如上所述,将对编码的蛋白质、肽或相应的抗体具有结合亲和性的第二结合配体(如抗体)用于形成次级免疫复合物。洗涤后,将次级免疫复合物再次在有效地允许免疫复合物(三级免疫复合物)形成的条件下接触对于第二抗体具有结合亲和性的第三结合配体或抗体持续足够的时间。第三配体或抗体连接于可检测标记,从而允许检测由此形成的三级免疫复合物。该系统可以提供信号扩大,如果这是希望的。
本发明的免疫检测方法在病症的诊断中具有明显的实用性,所述病症如升高的血糖、血糖控制的丧失和糖尿病。在此,使用怀疑含有编码的蛋白质或糖化肽的生物或临床样品。然而,这些实施方案对非临床样品也具有用途,如在抗原或抗体样品的滴定中、在杂交瘤的选择中等等。
本发明特别考虑了将ELISA用作一种免疫检测分析类型的用途。考虑了本发明的生物标志物蛋白或肽将发现在诊断和预后监控异常血糖和糖尿病的ELISA试验中作为免疫原的用途。免疫分析,以其最简单和直接的意义,是结合测试。特定的优选免疫分析是本领域已知的各种类型的酶联免疫吸附试验(ELISA)和放射免疫试验(RIA)。使用组织切片的免疫组织化学检测可能是有用的。然而,将容易地认识到检测不限于这样的技术,并且western印迹、点印迹等也可以使用。
在一个示例性的ELISA中,将与本发明的蛋白指示剂结合的抗体固定于呈现蛋白亲和性的选定表面上,如聚苯乙烯微滴定平板的孔。然后,将怀疑含有血糖水平指示剂的测试组合物,如血液或血清样品,加入孔中。在结合并洗涤除去非特异性结合的免疫复合物后,可以检测结合的抗原。通常通过添加与可检测标记连接的对于指示剂蛋白特异性的第二抗体来实现检测。这种类型的ELISA是简单的“夹心ELISA”。还可以通过添加第二抗体,接着添加对第二抗体具有结合亲和性的第三抗体来实现检测,所述第三抗体连接于可检测标记。
在另一个示例性的ELISA中,将怀疑含有血糖指示剂蛋白的样品固定于孔表面上,并随后接触用于结合指示剂的特异性抗体。在结合并洗涤以除去非特异性结合的免疫复合物后,检测结合的抗原。在初始抗体连接于可检测标记的情况中,可以直接检测免疫复合物。再次,可以使用对第一抗体具有结合亲和性的第二抗体来检测免疫复合物,所述第二抗体连接于可检测标记。
与使用的形式无关,ELISA具有特定的共同特征,如涂覆、孵育或结合,洗涤以除去非特异性结合的物质,并检测结合的免疫复合物。这些如下所述。
在用抗原或抗体涂覆平板中,通常将用抗原或抗体的溶液孵育平板的孔,孵育过夜或持续指定的时间段。然后洗涤平板的孔以除去未完全吸附的材料。然后用对于测试抗血清在抗原上是中性的非特异性蛋白“涂覆”任何剩余的可用孔表面。这些包括牛血清白蛋白(BSA)、酪蛋白和奶粉溶液。涂覆允许封闭固定表面上的非特异性吸附位点并由此降低由抗血清非特异性结合在表面上引起的背景。
在ELISA中,习惯上使用次级或三级检测方式而不是直接程序。因此,蛋白质或抗体与孔结合后,用非反应性物质涂覆来降低背景,并洗涤以除去未结合的物质,固定表面与对照生物样品接触,例如来自具有正常血糖的受试者和/或足够血糖控制的受试者的血液或血清,以在有效地允许免疫复合物(抗原/抗体)形成的条件下测试。然后免疫复合物的检测需要标记的第二结合配体或抗体,或第二结合配体或抗体与标记的第三抗体或第三结合配体结合。
短语“在有效地允许免疫复合物(抗原/抗体)形成的条件下”表示所述条件优选包括用溶液如BSA、牛γ球蛋白(BGG)和磷酸盐缓冲盐水(PBS)/Tween稀释抗原和抗体。这些添加的试剂也倾向于有助于非特异性背景的降低。
“合适的”条件也表示孵育是在足以允许有效结合的温度下并持续足够的时间段。孵育步骤通常为约1至约4小时,优选在大约25至27℃的温度下,或在约4℃下过夜等等。
在ELISA中的所有孵育步骤后,洗涤接触的表面以除去非复合的物质。优选的洗涤程序包括用溶液洗涤,所述溶液如PBS/Tween或硼酸盐缓冲液。测试样品和初始结合的物质之间形成特异性免疫复合物并随后洗涤后,可以测定甚至极少量的免疫复合物的出现。
为了提供检测手段,第二或第三抗体具有连接的标记以允许检测。优选地,标记是在用合适的发色底物孵育时导致生色的酶。因此,例如,初级或次级免疫复合物在有利于发生更多免疫复合物的形成的条件下用脲酶、葡萄糖氧化酶、碱性磷酸酶或过氧化氢酶偶联的抗体接触和孵育一段时间(例如,在含有PBS的溶液如PBS-Tween中在室温下孵育2h)。
用标记的抗体孵育并随后洗涤除去未结合的物质后,将标记的量定量,例如,通过用发色底物(如脲和溴甲酚紫)孵育来定量。然后通过测量颜色产生的程度来定量,例如,使用可见光谱分光光度计来定量。
也可以使用蛋白质质谱方法和仪器来测量、定量、检测和另外分析本发明的蛋白质生物标志物/指示剂(例如,Eno1、HbA1c)。蛋白质质谱是指将质谱应用于研究蛋白质。尽管不意图受到限制,两种途径通常使用质谱来表征蛋白质。在第一种中,将完整的蛋白质电离,然后引入质谱仪中。将这种途径称为蛋白质分析的“自上而下”策略。用于完整蛋白质电离的两种主要方法是电喷雾电离(ESI)和基质辅助激光解吸/电离(MALDI)。在第二种途径中,使用蛋白酶如胰蛋白酶将蛋白质酶促消化成较小的肽。随后将这些肽引入质谱仪中,并通过肽质量指纹谱或串联质谱法来鉴定。因此,这后一种途径(也称为“自下而上”蛋白质组学)使用肽水平的鉴定来推断蛋白质的存在。
可以使用飞行时间(TOF)MS或傅立叶变换离子回旋共振(FT-ICR)来进行本发明的生物标志物的全蛋白质质量分析。因为它们的宽质量范围,并且在FT-ICR的情况中,由于其高质量准确性,这两种类型的仪器是有用的。用于肽质量分析的最广泛使用的仪器是MALDI飞行时间仪器,因为它们允许以高步幅获取肽质量指纹(PMF)(1PMF可以在大约10秒内分析)。本申请中还可以使用多阶段四极飞行时间和四极离子阱。
还可以在共同存在于生物介质或样品中的蛋白质和分子的复杂混合物中测量蛋白质指示剂,然而,本文中可能需要在考虑样品的分级。将理解,蛋白质的复杂混合物的电离可能导致其中更丰富的蛋白质具有“淹没”或遏制来自同一样品中较不丰富的蛋白质的信号的趋势。此外,由于混合物组分的巨大数量,来自复杂混合物的质谱可能难以解释。在质谱分析前,可以使用分级来首先分离蛋白质的任何复杂混合物。有两种方法广泛用于将蛋白质或其来自酶消化的肽产物分级。第一种方法将完整蛋白质分级并且称为二维凝胶电泳。第二种方法,高效液相色谱(LC或HPLC),用于将酶消化后的肽分级。在一些情况中,结合这两种技术可能是理想的。本文中也考虑了本领域已知的用于将蛋白质混合物分级的任何其他合适的方法。
2D凝胶上确定的凝胶斑点通常可归属于一种蛋白质。如果蛋白质的身份是所需要的,通常应用凝胶内消化的方法,其中切除目标蛋白质斑点,并通过蛋白水解消化。可以使用肽质量指纹谱通过质谱测定从消化获得的肽质量。如果这种信息不允许蛋白质的明确鉴定,则可以将其肽进行串联质谱法用于从头测序。
使用HPLC/MS表征蛋白质混合物在本领域中也可以称为“鸟枪法蛋白质组学”和MuDPIT(多维蛋白质鉴定技术)。通过一个或两个液相色谱(LC)步骤将从蛋白质混合物的消化得到的肽混合物分级。来自色谱阶段的洗脱液可以通过电喷雾电离直接引入质谱仪,或设置在一系列斑点上用于之后使用MALDI的质量分析。
可以利用各种技术使用MS来鉴定蛋白质指示剂(例如,Eno1或Hb1Ac),本文中考虑了全部这些技术。肽质量指纹谱使用蛋白水解肽的质量作为检索数据库的预测质量的输入,其从一系列已知蛋白质的消化产生。如果参照列表中的蛋白质序列产生了相当大数量的匹配实验值的预测质量,存在这种蛋白质存在于原始样品中的一些证据。将进一步理解,用于自动化的、数据依赖性电喷雾电离(ESI)串联质谱法(MS/MS)结合微毛细管液相色谱(LC)和数据库检索的方法和仪器的开发已经显著提高了凝胶分离蛋白质的鉴定灵敏度和速度。微毛细管LC-MS/MS已经成功用于直接来自混合物的单个蛋白质的大规模鉴定而没有凝胶电泳分离(Link等,1999;Opitek等,1997)。
几种最近的方法允许通过质谱来定量蛋白质。例如,碳(13C)或氮(15N)的稳定的(例如,非放射性的)重同位素可以加入一个样品中,同时另一个可以用相应的轻同位素(例如,12C和14N)标记。在分析前,将两个样品混合。由于其质量差异,可以区分源自不同样品的肽。其峰强度的比例对应于肽(和蛋白质)的相对丰度比率。用于同位素标记的最常用方法是SILAC(细胞培养物中通过氨基酸的稳定同位素标记)、胰蛋白酶催化的18O标记、ICAT(同位素编码的亲和性标签)、iTRAQ(用于相对和绝对定量的同重同位素标记)。可以进行“半定量”质谱而不需要样品的标记。通常,这使用MALDI分析来进行(以线性模式)。来自单个分子(通常是蛋白质)的峰强度或峰面积在此与样品中的蛋白质量相关联。然而,单个信号取决于蛋白质的初级结构、样品的复杂性和仪器的设置。其他类型的“无标记”定量质谱使用消化蛋白质的谱计数(或肽计数)作为用于测定相对蛋白质量的手段。
在一个实施方案中,可以根据以下示例性方法,使用质谱从复杂生物样品鉴别和定量任何一种或多种蛋白质指示剂(例如,Enol,HbA1c),所述示例性方法不是意图限制本发明或其他基于质谱的方法的使用。
在这个实施方案的第一个步骤中,(A)将包含蛋白质的复杂混合物(包括至少一种目标指示剂)的生物样品,例如,怀疑血糖提高的生物样品分级,并用稳定的同位素X标记。(B)接着,将已知量的内标加入生物样品中,其中通过将与该至少一种目标靶生物标志物相同的标准蛋白质分级并用稳定的同位素Y标记来制备内标。(C)然后将获得的这种样品引入LC-MS/MS设备中,并且使用针对内标选择的多反应监测(MRM)过渡进行MRM分析以获得MRM色谱图。(D)然后观察MRM色谱图以鉴定源自生物样品的显示出与源自内标的肽(内标肽)相同的保留时间的靶肽生物标志物,并通过将内标肽的峰面积与靶肽指示剂的峰面积进行比较来定量测试样品中的靶蛋白指示剂。
任何合适的生物样品可以用作LC-MS/MS/MRM分析的起始点,包括源自血液、尿液、唾液、毛发、细胞、细胞组织、活检材料及其处理产物的生物样品;以及通过基因重组技术制备的含蛋白质样品。本发明的优选实施方案包括使用血液或血清样品。
以下进一步描述以上步骤(A)至(D)中的每一个。
步骤(A)(分级和标记)。在步骤(A)中,将靶蛋白指示剂分级成肽的集合,其随后用稳定的同位素X来标记。为了将靶蛋白分级,例如,可以使用用蛋白水解酶(蛋白酶)(如胰蛋白酶)和化学切割方法(如使用溴化氰的方法)消化靶蛋白的方法。优选通过蛋白酶的消化。如果允许蛋白水解消化进行完全,则已知给定摩尔量的蛋白质对于每种胰蛋白酶肽切割产物产生相同的摩尔量。因此,测定给定蛋白质的胰蛋白酶肽的摩尔量允许测定样品中原始蛋白质的摩尔量。可以通过测定蛋白酶消化中含有的靶蛋白衍生的肽(肽集合)的绝对量来完成靶蛋白的绝对定量。因此,为了允许蛋白水解消化进行完全,优选在用胰蛋白酶进行蛋白酶消化前进行还原和烷基化处理以还原并烷基化靶蛋白中所含的二硫键。
随后,将获得的消化产物(肽集合,包含生物样品中靶生物标志物的肽)进行用稳定的同位素X的标记。稳定的同位素X的实例包括氢原子的1H和2H、碳原子的12C和13C以及氮原子的14N和15N。可以从其合适地选择任何同位素。可以通过将消化产物(肽集合)与含有稳定同位素的试剂反应来进行稳定同位素X的标记。商业上可购得的此类试剂的优选实例包括(由Applied Biosystems生产),其是胺特异性的稳定同位素试剂盒。由2种或3种作为同位素标记结果在其间具有恒定质量差异并且结合肽的N-端或赖氨酸残基的伯胺的试剂(-轻和-重;或-D0、-D4和-D8)组成。
步骤(B)(内标的添加)。在步骤(B)中,将已知量的内标加入步骤(A)获得的样品中。本文中使用的内标是通过将由与待测量的靶蛋白(靶生物标志物)相同的氨基酸序列组成的蛋白质(标准蛋白质)分级并用稳定的同位素Y标记获得的消化产物(肽集合)而获得的消化产物(肽集合)。分级处理可以与以上针对靶蛋白的相同方式来进行。用稳定的同位素Y标记也可以与以上针对靶蛋白的相同方式来进行。然而,本文中使用的稳定同位素Y必须具有与用于标记靶蛋白消化产物的稳定同位素X不同的质量。例如,在使用上述mTRAQ(注册商标)(由Applied Biosystems生产)的情况中,在将mTRAQ-轻用于标记靶蛋白消化产物时,应当使用mTRAQ-重来标记标准蛋白消化产物。
步骤(C)(LC-MS/MS和MRM分析)。在步骤(C)中,首先将步骤(B)中获得的样品放置在LC-MS/MS设备中,然后使用针对内标选定的MRM过渡来进行多反应监测(MRM)分析。通过使用LC-MS/MS设备的LC(液相色谱),首先通过一维或多维高效液相色谱来分离步骤(B)中获得的样品(用稳定同位素标记的肽集合)。这样的液相色谱的特定实例包括阳离子交换色谱,其中通过利用肽之间的电荷差异来进行分离;和反相色谱,其中通过利用肽之间的疏水性差异来进行分离。这两种方法可以结合使用。
随后,将每种分离的肽通过使用包括两台串联连接的质谱仪的串联质谱仪(MS/MS质谱仪)进行串联质谱分析。使用这样的质谱仪使得能够检测几飞摩尔(fmol)水平的靶蛋白。此外,MS/MS分析使得能够分析肽上的内部序列信息,因此能够实现无假阳性的鉴别。其他类型的MS分析仪也可以使用,包括扇形磁场质谱仪(Sector MS)、四极质谱仪(QMS)、飞行时间质谱仪(TOFMS)和傅立叶变换离子回旋共振质谱仪(FT-ICRMS),以及这些分析仪的组合。
随后,将获得的数据通过搜索引擎来进行谱比对和列出针对每个蛋白质实验检测的肽。优选将检测的肽针对每个蛋白质分组,并且优选至少三个具有大于前体离子的m/z值的片段和至少三个具有优选500或更大的m/z值的三个片段在谱上以信号强度递减的顺序选自各个MS/MS谱。以强度的递减顺序从这些选择两个或更多个片段,并且将强度的平均值限定为MRR过渡的预期灵敏度。当从一个蛋白质检测到多个肽时,使用预期灵敏度作为指数选择至少两个具有最高灵敏度的肽作为标准肽。
步骤(D)(测试样品中靶蛋白的定量)。步骤(D)包括在步骤(C)中检测的MRM色谱图中鉴别显示出与源自内标的肽(内标肽)相同的保留时间的源自靶蛋白(目标靶生物标志物)的肽,并通过将内标肽的峰面积与靶肽的峰面积进行比较来定量测试样品中的靶蛋白。可以通过利用之前制备的标准蛋白的校准曲线来定量靶蛋白。
可以通过以下方法来制备校准曲线。首先,如上所述,用蛋白酶(如胰蛋白酶)消化由与靶生物标志物蛋白相同的氨基酸序列组成的重组蛋白。随后,用两种不同类型的稳定同位素单独地标记已知浓度的前体片段过渡选择标准(PFTS)(即,一种用用于标记内标肽的稳定异构体标记(用IS标记),而另一种用用于标记靶肽的稳定异构体标记(用T标记))。通过将特定量的IS标记的PTFS与各种浓度的T标记的PTFS混合来产生多个样品。将这些样品置于上述LC-MS/MS设备中以进行MRM分析。将获得的MRM色谱图上的T-标记的PTFS与IS-标记的PTFS的面积比(T-标记的PTFS/IS-标记的PTFS)相对于T-标记的PTFS的量进行作图以制备校准曲线。可以通过参照校准曲线来计算测试样品中所含的靶蛋白的绝对量。
D.抗体和标记(例如,荧光部分和染料)
在一些实施方案中,本发明提供了包括用于本发明生物分子(例如,单独或结合血糖和血糖控制的至少一种其他指示剂(例如,HbA1c、酮类)的Eno1)的高灵敏度检测和定量或用于血糖的直接测量的标记的方法和组合物。本领域技术人员将认识到许多策略可以用于标记靶分子以使得其能够在颗粒混合物中检测或区分(例如,标记的抗Eno1抗体或标记的二抗,或与Eno1 mRNA特异性地杂交的标记的寡核苷酸探针)。标记可以通过任何已知方式来连接,包括利用标记和靶标的非特异性或特异性相互作用的方法。标记可以提供可检测的信号或影响颗粒在电场中的移动性。此外,标记可以直接地或通过结合伴体来完成。
在一些实施方案中,标记包括结合目标指示剂的结合伴体,其中结合伴体连接于荧光部分。本发明的组合物和方法可以利用高荧光部分,例如,在通过所述部分激发波长下的激光发射光刺激时能够发射至少约200个光子的部分,其中激光聚焦于含有所述部分的不小于约5微米直径的点上,并且其中在所述点处由激光指引的总能量不超过约3微焦耳。以下更详细地描述适用于本发明的组合物和方法的部分。
在一些实施方案中,本发明提供了用于检测生物分子的标记,包括连接于荧光部分的生物分子的结合伴体,其中当通过所述部分激发波长下的激光发射光刺激时,所述荧光部分能够发射至少约200个光子,其中激光聚焦于含有所述部分的不小于约5微米直径的点上,并且其中在所述点处由激光指引的总能量不超过约3微焦耳。在一些实施方案中,所述部分包含多个荧光实体,例如,约2至4,2至5,2至6,2至7,2至8,2至9,2至10,或约3至5,3至6,3至7,3至8,3至9,或3至10个荧光实体。在一些实施方案中,所述部分包括约2至4个荧光实体。在一些实施方案中,生物分子是蛋白质或小分子。在一些实施方案中,生物分子是蛋白质。荧光实体可以是荧光染料分子。在一些实施方案中,荧光染料分子包含至少一个取代的吲哚环系统,其中吲哚环的3-碳上的取代基含有化学反应性基团或偶联物质。在一些实施方案中,染料分子是选自Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 647、Alexa Fluor 680或Alexa Fluor 700的Alexa Fluor分子。在一些实施方案中,染料分子是选自Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 680或Alexa Fluor 700的Alexa Fluor分子。在一些实施方案中,染料分子是Alexa Fluor 647染料分子。在一些实施方案中,染料分子包括第一类型和第二类型的染料分子,例如,两种不同的Alexa Fluor分子,例如,在第一类型和第二类型的染料分子具有不同发射谱的情况中。第一类型与第二类型染料分子的数量比可以为例如,4:1,3:1,2:1,1:1,1:2,1:3或1:4。结合伴体可以是例如抗体。
在一些实施方案中,本发明提供了用于检测本发明的生物指示剂的标记,其中标记包含指示剂的结合伴体和荧光部分,其中当通过所述部分激发波长下的激光发射光刺激时,所述荧光部分能够发射至少约200个光子,其中激光聚焦于含有所述部分的不小于约5微米直径的点上,并且其中在所述点处由激光指引的总能量不超过约3微焦耳。在一些实施方案中,荧光部分包含荧光分子。在一些实施方案中,荧光部分包含多个荧光分子,例如,约2至10,2至8,2至6,2至4,3至10,3至8或3至6个荧光分子。在一些实施方案中,标记包含约2至4个荧光分子。在一些实施方案中,荧光染料分子包含至少一个取代的吲哚环系统,其中吲哚环的3-碳上的取代基含有化学反应性基团或偶联物质。在一些实施方案中,荧光分子选自Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 647、Alexa Fluor 680或Alexa Fluor 700。在一些实施方案中,荧光分子选自Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 680或Alexa Fluor 700。在一些实施方案中,荧光分子是Alexa Fluor 647分子。在一些实施方案中,结合伴体包括抗体。在一些实施方案中,抗体是单克隆抗体。在其他实施方案中,抗体是多克隆抗体。
在各种不同的实施方案中,用于检测目标指示剂(例如,Eno1或HbA1c)的结合伴体是抗体或其抗原结合片段。如本文中使用的术语“抗体”是宽泛术语并且以其普通含义来使用,包括,不限于,是指天然产生的抗体以及非天然产生的抗体,包括,例如,单链抗体、嵌合、双功能和人源化抗体,及其抗原结合片段。抗体的“抗原结合片段”是指抗体参与抗原结合的部分。抗原结合位点由重(“H”)和轻(“L”)链的N-末端可变(“V”)区的氨基酸残基形成。将认识到抗体由其产生的表位或分子区域的选择将决定其特异性,例如,对于分子的各种形式(如果存在)的特异性,或对于总体(例如,全部,或基本上全部的分子)的特异性。
用于生产抗体的方法是良好确定的。本领域技术人员将认识到许多程序可用于抗体的生产,例如,如Antibodies,A Laboratory Manual(抗体,实验室手册),Harlow和David Lane编辑,Cold Spring Harbor Laboratory(1988),Cold Spring Harbor,N.Y中描述的。本领域技术人员还理解,模拟抗体的结合片段或Fab片段也可以通过各种程序从遗传信息制备(Antibody Engineering:A Practical Approach(抗体工程:实践方法)(Borrebaeck,C.等),1995,Oxford University Press,Oxford;J.Immunol.149,3914-3920(1992))。分子(例如,蛋白质)和标志物的单克隆和多克隆抗体也可以从商业上购得(R and D Systems,Minneapolis,Minn.;HyTest,HyTest Ltd.,Turku Finland;Abcam Inc.,Cambridge,Mass.,USA,Life Diagnostics,Inc.,West Chester,Pa.,USA;Fitzgerald Industries International,Inc.,Concord,Mass.01742-3049USA;BiosPacific,Emeryville,Calif.)。
在一些实施方案中,抗体是多克隆抗体。在其他实施方案中,抗体是单克隆抗体。
可以通过本领域普通技术人员已知的多种技术中的任何一种来制备抗体(参见,例如,Harlow和Lane,Antibodies:A Laboratory Manual(抗体:实验室手册),Cold Spring Harbor Laboratory,1988)。通常,可以通过细胞培养技术来生产抗体,包括如本文中所述的单克隆抗体的产生,或通过抗体基因转染至合适的细菌或哺乳动物细胞宿主中,以允许产生重组抗体。
可以使用杂交瘤方法,如Kohler和Milstein(Eur.J.Immunol.6:511-519,1976)的技术,及其改进来制备单克隆抗体。这些方法涉及能够产生具有所需特异性的抗体的永生细胞系的制备。还可以通过重组DNA方法,如美国专利No.4,816,567中所述的那些,来制得单克隆抗体。可以使用常规程序来分离和测序编码所公开的方法中使用的抗体的DNA。重组抗体、抗体片段和/或其融合体可以在体外或在原核细胞(例如,细菌)或真核细胞(例如,酵母、昆虫或哺乳动物细胞)中表达,并进一步按照需要使用公知方法来纯化。
更特别地,可以通过使用公知技术,如美国专利No.4,196,265(按引用并入本文中)中举例说明的那些,来容易地制备单克隆抗体(MAb)。通常,这种技术涉及用选定的免疫原组合物(例如,纯化或部分纯化的表达的蛋白质、多肽或肽)免疫合适的动物。免疫组合物以有效刺激抗体产生细胞的方式来施用。用于产生单克隆抗体(MAb)的方法通常沿着与用于制备多克隆抗体的那些相同的路线开始。啮齿动物,如小鼠和大鼠,是优选的动物,然而,使用兔子、绵羊或青蛙细胞也是可能的。使用大鼠可以提供特定的优势(Goding,1986,pp.60-61),但优选是小鼠,BALB/c小鼠是最优选的,因为这是最常规使用的并且通常给予较高百分比的稳定融合体。
给动物注射如上所述的抗原。如果需要,抗原可以与载体分子如钥孔血蓝蛋白偶联。抗原通常与佐剂混合,如弗氏完全或不完全佐剂。用相同抗原的增强注射将以大约两周间隔进行。免疫后,选择具有产生抗体潜能的体细胞,尤其是B淋巴细胞(B细胞),用于MAb产生方案中。这些细胞可以获自活检的脾、扁桃体或淋巴结,或来自外周血样品。脾细胞和外周血细胞是优选的,前者是因为它们是处于分裂浆母细胞期中的抗体产生细胞的丰富来源,而后者是因为外周血容易获得。通常,一组动物进行免疫并去除具有最高抗体滴度的动物的脾,且通过用注射器均质脾来获得脾淋巴细胞。
然后将来自免疫动物的抗体产生B淋巴细胞与永生化骨髓瘤细胞的细胞融合,通常是与免疫动物相同物种的细胞。适用于杂交瘤产生融合过程的骨髓瘤细胞系优选是非抗体产生的,具有高融合效率和使得其不能够在只支持所需融合细胞(杂交瘤)生长的特定选择性培养基中生长的酶缺陷。
然后将选定的杂交瘤连续稀释,并克隆至单个抗体产生细胞系中,该克隆随后可以无限繁殖以提供MAb。可以以两种基本方式来利用细胞系用于MAb生产。可以将杂交瘤的样品注射(常常是注射入腹膜腔中)到用于提供原始融合的体细胞和骨髓瘤细胞的类型的组织相容性动物中。被注射的动物产生分泌由融合细胞杂合体产生的特异性单克隆抗体的肿瘤。然后可以汲取动物的体液,如血清或腹水,以提供高浓度的MAb。也可以在体外培养单独的细胞系,其中MAb天然地分泌至培养基中,从其中可以容易地获得高浓度的MAb。如果需要,通过任一种方式产生的MAb可以使用过滤、离心和各种色谱方法,如HPLC或亲和性色谱来进一步纯化。
还可以通过在体内繁殖杂交瘤细胞来获得大量的本发明的单克隆抗体。将细胞克隆注射入与亲本细胞组织相容的哺乳动物中,例如,同系小鼠,以引起抗体产生肿瘤的生长。任选地,在注射前,用烃,尤其是油,如姥鲛烷(四甲基十五烷),刺激动物。
根据本发明,可以通过包括用酶(如胃蛋白酶或木瓜蛋白酶)消化和/或通过化学还原切割二硫键的方法从按照上述产生的单克隆抗体获得本发明的单克隆抗体的片段。或者,可以使用自动化肽合成仪来合成本发明包括的单克隆抗体片段。
抗体还可以源自基于氨基酸序列的重组抗体文库,所述氨基酸序列在计算机(in silico)中设计并由合成产生的多核苷酸编码。用于设计和获得计算机产生的序列的方法是本领域已知的(Knappik等,J.Mol.Biol.296:254:57-86,2000;Krebs等,J.Immunol.Methods254:67-84,2001;美国专利No.6,300,064)。
可以使用本领域公知的技术来进行抗体的消化以产生其抗原结合片段。例如,蛋白水解酶木瓜蛋白酶优先切割IgG分子以产生几个片段,其中两个(“F(ab)”片段)各自包括共价异二聚物(其包括完整的抗原结合位点)。胃蛋白酶能够切割IgG分子以提供几个片段,包括“F(ab’)2”片段,其包括两个抗原结合位点。“Fv”片段可以通过IgM、IgG或IgA免疫球蛋白分子的优先蛋白水解切割来产生,但更通常使用本领域已知的重组技术来衍生。Fv片段包括非共价VH::VL异二聚体(其包括抗原结合位点),其保留天然抗体分子的许多抗原识别和结合能力(Inbar等,Proc.Natl.Acad.Sci.USA 69:2659-2662(1972);Hochman等,Biochem.15:2706-2710(1976)和Ehrlich等,Biochem.19:4091-4096(1980))。
也可以使用已知技术,如美国专利No.5,885,793中描述的那些,从scFv文库分离特异性地结合本文中公开的多肽指示剂的抗体片段。
广泛的表达系统在本领域中可得而用于抗体片段的产生,包括Fab片段、scFv、VL和VH。例如,原核和真核两者来源的表达系统可以用于抗体片段的大规模生产。特别有利的是允许大量抗体片段分泌至培养基中的表达系统。已经描述了用于抗体片段和抗体融合蛋白的大规模生产的真核表达系统,其基于哺乳动物细胞、昆虫细胞、植物、转基因动物和低等真核细胞。例如,可以在酵母发酵系统中实现抗体片段的经济的、大规模的生产。这些生物体的大规模发酵是本领域公知的并且目前用于几种重组蛋白的大量生产。
结合本发明方法中使用的多肽生物标志物的抗体是本领域技术人员公知的并且在一些情况能够使商业上可购得的或不需要过度实验即可获得。
在再其他实施方案中,特别是在其中将寡核苷酸用作结合伴体来检测和与mRNA生物标志物或其他基于核酸的生物标志物杂交的情况中,结合伴体(例如,寡核苷酸)可以包括标记,例如,荧光部分或染料。此外,本发明的任何结合伴体,例如,抗体,也可以用荧光部分来标记。作为本文中使用的术语,“荧光部分”包括一种或多种其总荧光使得在本文中所述的单分子检测仪中可以检测所述部分的荧光实体。因此,荧光部分可以包括单个实体(例如,量子点或荧光分子)或多个实体(例如,多个荧光分子)。将认识到作为本文中使用的术语,在“部分”是指一组荧光实体时,例如,多个荧光染料分子,每个单独实体可以独立地连接于结合伴体或所述实体可以一起连接,只要实体作为一组提供待检测的足够荧光。
通常,所述部分的荧光涉及量子效率和缺乏漂白的组合,足够使得所述部分在单分子检测器中高于背景水平而可检测,具有对于试验的期望检测限、准确性和精确性所需要的一致性。例如,在一些实施方案中,荧光部分的荧光使得其允许在本文中所述的仪器中以低于约10,5,4,3,2,1,0.1,0.001,0.00001或0.000001pg/ml的检测限和低于约20,15,14,13,12,11,10,9,8,7,6,5,4,3,2,1%或更低的变异系数,例如,约10%或更低,检测和/或定量分子,例如,标志物。在一些实施方案中,荧光部分的荧光使得其允许在本文中所述的仪器中以低于约5,1,0.5,0.1,0.05,0.01,0.005,0.001pg/ml的检测限和低于约10%的变异系数检测和/或定量分子,例如,标志物。作为本文中使用的那些术语,“检测限”或LoD,包括可以将样品鉴定为含有目标物质的分子的最低浓度,例如,第一个非零值。其可以通过零位(zeros)的变化性和标准曲线的斜率来定义。例如,可以通过运行标准曲线,确定标准曲线零值并给该值添加2个标准偏差来确定试验的检测限。可以产生等于该值的信号的目标物质的浓度即为“检测下限”浓度。
此外,所述部分具有与其在所选择的试验中的使用一致的特性。在一些实施方案中,所述试验是免疫分析,其中荧光部分连接于抗体;所述部分必须具有使得其不会与其他抗体或蛋白聚集或不经历超过与所需的试验准确性和精确性一致的聚集的特性。在一些实施方案中,优选的荧光部分是具有1)高吸收系数;2)高量子产率;3)高光稳定性(低光漂白);和4)与目标分子(蛋白)的标记的相容性的组合的荧光部分,例如,染料分子,使得其可以使用本发明的分析仪和系统进行分析(例如,没有引起目标蛋白的沉淀、所述部分已经连接的蛋白的沉淀)。
可以使用任何合适的荧光部分。实例包括,但不限于,Alexa Fluor染料(Molecular Probes,Eugene,Oreg.)。Alexa Fluor公开于美国专利No.6,977,305;6,974,874;6,130,101和6,974,305中,将其全部按引用并入本文中。本发明的一些实施方案利用选自Alexa Fluor 647、Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 555、Alexa Fluor 610、Alexa Fluor 680、Alexa Fluor 700和Alexa Fluor 750的染料。本发明的一些实施方案利用选自Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 647、Alexa Fluor 700和Alexa Fluor 750的染料。本发明的一些实施方案利用选自Alexa Fluor 488、Alexa Fluor 532、Alexa Fluor 555、Alexa Fluor 610、Alexa Fluor 680、Alexa Fluor 700和Alexa Fluor 750的染料。本发明的一些实施方案利用Alexa Fluor 647分子,其具有约650至660nm之间的最大吸收和约660至670nm之间的最大发射。单独或结合其他Alexa Fluor染料来使用Alexa Fluor 647染料。
在一些实施方案中,用于使用本发明的分析仪系统检测样品中的指示剂的荧光标记部分是量子点。量子点(QD),也称为半导体纳米晶体或人造原子,是含有100至1,000个之间的任何数目的电子并且范围为2-10nm的半导体晶体。一些QD可以直径为10-20nm。QD具有高量子产率,这使得它们对光学应用特别有用。QD是通过形成激子而发荧光(这与传统荧光团的激发态相似),但具有长达200纳秒的长各多的寿命。这种特性提供了具有低光漂白的QD。QD的能量水平可以通过改变QD的大小和形状以及QD电位的深度来控制。小的激子QD的一种光学特征是着色,其通过点的大小来决定。点越大,荧光越红,或更朝向于光谱的红光端。点约小,荧光越蓝或更朝向于其蓝光端。决定能量并因此决定荧光颜色的带隙能量与QD的大小的平方成反比。越大的QD具有更高能量水平,其更紧密地间隔,因此允许QD吸收含有较低能量的光子,即更接近于光谱红光端的那些。因为点的发射频率取决于带隙,有可能以极高精确性控制点的输出波长。在一些实施方案中,使用单分子分析仪系统检测的蛋白用QD标记。在一些实施方案中,使用单分子分析仪来检测用一个QD标记的蛋白,并使用滤波器以允许在不同波长下检测不同蛋白质。
E.分离的大分子血糖指示剂
1.分离的多肽指示剂
本发明的一个方面涉及分离的指示剂蛋白及其生物活性部分,以及适宜用作免疫原来产生针对指示剂蛋白或其片段的抗体的多肽片段。在一个实施方案中,可以使用标准蛋白质纯化技术通过合适的纯化方案从细胞或组织源分离天然指示剂蛋白。在另一个实施方案中,通过重组DNA技术产生包含完整指示剂蛋白或其区段的蛋白质或肽。作为重组表达的替代方案,可以使用标准肽合成技术通过化学方式合成这样的蛋白质或肽。重组蛋白可以被修饰,例如,糖化,以提供用于HbA1c检测的合适抗原。相似地,血红蛋白的非糖化片段可以用于产生结合单独的非糖化血红蛋白或总血红蛋白的抗体。
“分离的”或“纯化的”蛋白质或其生物活性部分基本上不含来自蛋白质从其衍生的细胞或组织源的细胞物质或其他污染蛋白质,或在化学合成时,基本上不含化学前体或其他化学物质。语言“基本上不含细胞物质”包括其中蛋白质与该蛋白质从其分离或重组产生的细胞组分分离的蛋白质制备物。因此,基本上不含细胞物质的蛋白质包括具有少于约30%,20%,10或5%(干重)的异源蛋白质(在本文中也称为“污染蛋白质”)的蛋白质制备物。当重组产生蛋白质或其生物活性部分时,还优选基本上不含培养基,即,培养基占蛋白质制备物的低于约20%,10%或5%体积。当通过化学合成产生蛋白质时,优选基本上不含化学前体或其他化学物质,即,其与参与蛋白质合成的化学前体或其他化学物质分离。因此,这样的蛋白质制备物具有低于约30%,20%,10%,5%(干重)的除目标多肽以外的化学前体或化合物。
指示剂蛋白的生物活性部分包括包含与指示剂蛋白的氨基酸序列足够相同的或源自指示剂蛋白的氨基酸序列的氨基酸序列的多肽,其包括少于全长蛋白质的氨基酸,并且呈现出相应全长蛋白的至少一种活性。通常,生物活性部分包含具有相应全长蛋白的至少一种活性的结构域或基序。指示剂蛋白的生物活性部分可以是例如为长度10,25,50,100或更多个氨基酸的多肽。此外,其中标志物蛋白的其他区域被删除的其他生物活性部分可以通过重组技术来制备,并且针对天然形式的指示剂蛋白的一种或多种功能活性进行评价。
优选的指示剂蛋白由序列表中提供的核苷酸序列来编码。其他有用的蛋白与这些序列之一基本上相同(例如,至少约40%,优选50%,60%,70%,80%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%)并且保留相应的天然产生指示剂蛋白的功能活性,但由于天然等位基因变异或诱变,氨基酸序列不同。
为了测定两个氨基酸序列或两个核酸的百分同一性,序列为了最佳比较目的进行比对(例如,为了与第二氨基酸或核酸序列最佳比对,可以在第一氨基酸或核酸序列中引入空位)。然后比较相应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。在第一序列中的位置被与第二序列中相应位置处相同的氨基酸残基核苷酸占据时,那么分子在该位置处是相同的。优选地,使用全局比对来计算两个序列之间的百分同一性。或者,使用局部比对来计算两个序列之间的百分同一性。两个序列之间的百分同一性是序列共有的相同位置数的函数(即,%同一性=相同位置#/总位置#(例如,重叠位置)×100)。在一个实施方案中,两个序列是相同长度的。在另一个实施方案中,两个序列是不同长度的。
可以使用数学算法来完成两个序列之间百分同一性的测定。用于两个序列比较的数学算法的优选的、非限制性实例是Karlin和Altschul(1990)Proc.Natl.Acad.Sci.USA 87:2264-2268的算法,如Karlin和Altschul(1993)Proc.Natl.Acad.Sci.USA 90:5873-5877中改进的。将这样的算法结合至Altschul等,(1990)J.Mol.Biol.215:403-410的BLASTN和BLASTX程序中。使用BLASTN程序进行BLAST核苷酸检索,评分=100,字长=12,以获得与本发明的核酸分子同源的核苷酸序列。可以使用BALSTP进行BLAST蛋白质检索,评分=50,字长=3,以获得与本发明的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的空位比对,可以按照Altschul等,(1997)Nucleic Acids Res.25:3389-3402中所述的,利用称为空位BLAST的BLAST算法的较新版本,其能够进行用于程序BLASTN,BLASTP和BLASTX的空位局部比对。或者,可以使用PSI-Blast来进行迭代检索,其检测分子之间的距离关系。利用BLAST、空位BLAST和PSI-Blast程序时,可以使用相应程序(例如,BLASTX和BLASTN)的缺省参数。参见http://www.ncbi.nlm.nih.gov。用于序列比较的数学算法的另一种优选的非限制性实例是Myers和Miller(1988)CABIOS 4:11-17的算法。将这样的算法结合至ALIGN程序(版本2.0)中,其是GCG序列比对软件包的部分。当利用ALIGN程序比较氨基酸序列时,可以使用PAM120加权残差表,12的空位长度罚分和4的空位罚分。用于鉴定局部序列相似性的区域和比对的再另一个有用的算法是FASTA算法,如Pearson和Lipman(1988)Proc.Natl.Acad.Sci.USA 85:2444-2448中所述的。当使用FASTA算法比较核苷酸或氨基酸序列时,例如,PAM120加权残差表可以与2的k-tuple值一起使用。
可以使用与上述那些相似的技术来测定两个序列之间的百分同一性,具有或不具有允许的空位。在计算百分同一性时,只对精确匹配计数。
本发明的另一个方面涉及针对本发明蛋白质的抗体。在优选实施方案中,所述抗体特异性地结合标志物蛋白或其片段。术语“抗体(antibody)”和“抗体类(antibodies)”在本文中可互换使用,是指免疫球蛋白分子及其包含免疫球蛋白分子的免疫活性部分的片段和衍生物,(即,这样的部分含有特异性结合抗原(如标志物蛋白,例如,标志物蛋白的表位)的抗原结合位点)。特异性地结合本发明蛋白质的抗体是结合蛋白但基本上不结合天然地含有该蛋白质的样品(例如,生物样品)中的其他分子的抗体。免疫球蛋白分子的免疫活性部分的实例包括,但不限于,单链抗体(scAb)、F(ab)和F(ab’)2片段。
本发明的分离蛋白质或其片段可以用作免疫原来产生抗体。可以使用全长蛋白,或可选地,本发明提供用作免疫原的抗原性肽片段。本发明蛋白质的抗原性肽包含本发明蛋白质之一的氨基酸序列的至少8个(优选10、15、20或30或更多个)氨基酸残基,并且包括该蛋白质的至少一个表位,使得针对该肽产生的抗体与蛋白质形成特异性的免疫复合物。在特定实施方案中,蛋白质是翻译后修饰的。抗原性肽包括的优选表位是位于蛋白质表面上的区域,例如,亲水性区域。疏水性序列分析、亲水性序列分析或相似分析可以用于鉴定亲水性区域。在优选实施方案中,将分离的标志物蛋白或其片段用作免疫原。
本发明提供了多克隆和单克隆抗体。如本文中使用的,术语“单克隆抗体组合物”或“多克隆抗体组合物”是指只含有能够与特定表位免疫反应的一个种类的抗原结合位点的抗体分子群。优选的多克隆和单克隆抗体组合物是针对本发明蛋白质的抗体已经选择的那些组合物。特别优选的多克隆和单克隆抗体制备物是只含有针对标志物蛋白或其片段的抗体的制备物。制备多克隆、单克隆以及重组抗体和抗体片段的方法是本领域公知的。
2.分离的核酸指示剂
本发明的一个方面涉及分离的核酸分子,包括编码Eno1或其一部分的核酸。本发明的分离的核酸还包括足以用作杂交探针来鉴定Eno1核酸分子及其片段的核酸分子,例如,适宜用作PCR引物用于标志物核酸分子的特定产物或突变的扩增的那些。如本文中使用的,术语“核酸分子”打算包括DNA分子(例如,cDNA或基因组DNA)和RNA分子(例如,mRNA)以及使用核苷酸类似物产生的DNA或RNA的类似物。核酸分子可以是单链或双链的,但优选是双链DNA。
“分离的”核酸分子是与存在于核酸分子的天然来源中的其他核酸分子分离的核酸分子。在一个实施方案中,“分离的”核酸分子(优选蛋白编码序列)是不含在所述核酸来源的生物体基因组DNA中天然侧邻该核酸的序列(即,位于该核酸5’和3’端的序列)。例如,在各种不同的实施方案中,分离的核酸分子可以含有少于约5kb、4kb、3kb、2kb、1kb、0.5kb或0.1kb的在所述核酸来源的细胞基因组DNA中天然侧邻该核酸分子的核苷酸序列。在另一个实施方案中,“分离的”核酸分子(如cDNA分子)通过重组技术生产时,可以基本上不含其他细胞物质或培养基,或在化学合成时,基本上不含化学前体或其他化学物质。基本上不含细胞物质的核酸分子包括具有低于约30%、20%、10%或5%的异源核酸(在本文中也称为“污染核酸”)的制备物。
可以使用标准分子生物学技术和本文中所述的数据库记录中的序列信息来分离本发明的核酸分子。使用这样的核酸序列的全部或一部分,可以使用标准杂交和克隆技术(例如,如Sambrook等编辑,Molecular Cloning:A Laboratory Manual(分子克隆:实验室手册),第2版,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY,1989中所述的)来分离本发明的核酸分子。
可以根据标准PCR扩增技术,使用cDNA、mRNA或基因组DNA作为模板和合适的寡核苷酸引物来扩增本发明的核酸分子。可以将由此扩增的核酸克隆至合适的载体中并通过DNA序列分析来表征。此外,可以通过标准合成技术,例如,使用自动化DNA合成仪,来制备对应于本发明的核酸分子的全部或一部分的核苷酸。
在另一个优选实施方案中,本发明的分离核酸分子包括具有与标志物核酸的核苷酸序列或与编码Eno1的核酸的核苷酸序列互补的核苷酸序列的Eno1分子。与给定的核苷酸序列互补的核酸分子是与与给定核苷酸序列充分互补使得其可以与给定的核苷酸序列杂交由此形成稳定的双链体的核酸分子。
此外,本发明的核酸分子可以只包含核酸序列的一部分,其中全长核酸序列包括Eno1核酸或其编码Eno1蛋白。这样的核酸可以用作例如探针或引物。探针/引物通常作为一个或多个基本上纯化的寡核苷酸使用。寡核苷酸通常包含在严格条件下与至少约15个,更优选至少约25,50,75,100,125,150,175,200,250,300,350或400个或更多个Eno1的连续核苷酸杂交的核苷酸序列区域。
基于Eno1序列的探针可以用于检测对应于Eno1的转录物或基因组序列。在特定实施方案中,探针与跨越剪接点的核酸序列杂交。探针包括与其连接的标记基团例如放射性同位素、荧光化合物、酶或酶辅因子。这样的探针可以用作用于鉴定表达或错表达Eno1蛋白的细胞、组织或个体的诊断测试试剂盒或试剂组的部分,如通过测量来自受试者的样品中编码Eno1的核酸分子的水平,例如,检测mRNA水平或确定编码Eno1的基因或其翻译控制序列是否已经突变或删除。
本发明进一步包括由于遗传密码的简并性而不同于编码Eno1蛋白(例如,具有序列表中提供的序列的蛋白质)的核酸的核苷酸序列的核酸分子,并由此编码相同的蛋白。
本领域技术人员将认识到导致氨基酸序列变化的DNA序列多态性可以存在于群体(例如,人群)内。由于天然的等位基因变异,这样的遗传多态性可以存在于群体内的个体之间。等位基因是在给定的基因座处择一地出现的一组基因之一。此外,将认识到影响RNA表达水平的DNA多态性也可以存在,其可能影响该基因的整体表达水平(例如,通过影响调控或降解)。
如本文中使用的,短语“等位基因变体”是指在给定基因座处存在的核苷酸序列或由核苷酸序列编码的多肽。
如本文中使用的,术语“基因”和“重组基因”是指包含编码对应于本发明指示剂的多肽的开放阅读框的核酸分子。这样的天然等位基因变异通常可以导致给定基因的核苷酸序列中1-5%的变异度。可以通过将许多不同个体中的目标基因测序来鉴定可选的等位基因。这可以通过使用杂交探针以鉴别多个个体中相同基因座来容易地进行。作为天然等位基因变异的结果并且没有改变功能活性的任何的所有这样的核苷酸变异和所得到的氨基酸多态性或变异意图在本发明的范围内。
在另一个实施方案中,本发明的分离核酸分子长度为至少15,20,25,30,40,60,80,100,150,200,250,300,350,400,450,550,650,700,800或更多个核苷酸并且在严格条件下与Eno1核酸或编码Eno1的核酸杂交。如本文中使用的,术语“在严格条件下杂交”是旨在描述至少60%(65%,70%,优选75%)彼此相同的核苷酸序列通常保持彼此杂交的杂交和洗涤条件。这样的严格条件是本领域技术人员已知的并且可以在Current Protocols in Molecular Biology(分子生物学中的通用实验方案),John Wiley&Sons,N.Y.(1989)的6.3.1-6.3.6章节中找到。严格杂交条件的优选的、非限制性实例是在约45℃下在6×氯化钠/柠檬酸钠(SSC)中杂交,接着在50-65℃下在0.2×SSC,0.1%SDS中洗涤一次或多次。
F.指标应用
本发明提供了用于诊断受试者中升高的血糖的方法,例如,前驱糖尿病、2型糖尿病、1型糖尿病、妊娠糖尿病。本发明进一步提供了用于预后或监测血糖升高的受试者的进展或监测血糖升高的受试者对治疗性处理的反应的方法。
在一个方面中,本发明构成了结合分析、检测和/或测量Eno1及至少一种血糖的其他指标(例如,血糖,例如,餐后血糖、空腹血糖、葡萄糖耐量、酮水平)的水平和HbA1c水平通过本发明的方法可获得的诊断信息的应用。
例如,按照本文中所述的,当进行本发明的用于检测和/或测量多肽指示剂的方法时,将生物样品接触选择性地结合目标指示剂的检测试剂,例如,单克隆抗体,从而形成蛋白质-蛋白质复合物,其随后被直接(如果抗体包括标记)或间接(如果使用第二检测试剂,例如,第二抗体,其随之被标记)地进一步检测。因此,本发明的方法将本发明的多肽指示剂转化成包括可检测初级抗体或者初级抗体和进一步第二抗体的蛋白质-蛋白质复合物。为了鉴定目标生物标志物的存在,需要形成这样的蛋白质-蛋白质复合物,并且作为进行本发明方法的结果,必定改变目标指示剂的物理特征和特性。
当进行用于检测Eno1核酸的本发明方法时,适用同样的原理。特别地,将扩增方法用于检测Eno1 mRNA时,扩增方法实际上导致形成新的扩增子群体-即,新合成的并且不存在于初始生物样品中的分子,由此物理转化生物样品。相似地,当使用杂交探针来检测Eno1时,实际上通过探针(任选包括标记)与靶生物标志物mRNA(或其他核酸)杂交形成了物理上新的分子物质,其随后检测。作为进行本发明方法的结果,有效地新产生或形成了这样的多核苷酸产物。
在一个实施方案中,本发明提供了用于诊断升高的血糖的方法,例如,前驱糖尿病、糖尿病(例如,2型糖尿病、1型糖尿病、妊娠糖尿病)。本发明的方法可以结合本领域技术人员用来预后血糖升高的发生或复发和/或对待治疗血糖升高的受试者的治疗干预的反应的任何其他方法来进行。本文中提供的诊断和预后方法可以用来确定是否应当对受试者进行其他和/或更多的复杂或麻烦的测试或监测(例如,葡萄糖耐量测试、持续的葡萄糖监测)。将理解很少能使用单一测试来诊断如前驱糖尿病或糖尿病这样复杂的疾病。因此,将理解本文中提供的诊断、预后和监测方法通常结合本领域已知的其他方法来进行。例如,本发明提供的用于检测Eno1水平的方法可以结合Hb1Ac水平的检测、空腹或餐后条件下的血糖水平的检测或葡萄糖耐量测试来进行。
还提供了用于评价治疗方案(例如,药物治疗、行为矫正、外科手术或用于治疗受试者的升高血糖的任何其他治疗途径)的功效的方法。在这些方法中,评价了一对样品(较早时间点或治疗方案之前从受试者获得的第一样品和较后时间点(例如,受试者已经经历至少一部分治疗方案时的较后时间点)从受试者获得的第二样品)中的Eno1量。将理解本发明的方法包括以规律或不规律的间隔获得和分析超过两个样品(例如,3,4,5,6,7,8,9或更多个样品)用于评价标志物水平。可以在连续或非连续受试者样品之间进行成对比较。可以针对任何两个或更多个连续或非连续受试者样品分析标志物水平的趋势和标志物水平的变化率。可以结合用于检测血糖监控的其他方法来进行Eno1水平的测量。
本发明的方法还可以用于选择能够通过Eno1表达或活性的调节来调节血糖的化合物。在这种方法中,将细胞,优选具有改变的胰岛素敏感性或改变的葡萄糖摄取的细胞,接触测试化合物,并且测定测试化合物调节细胞中的Eno1表达和/或活性的能力,由此选择能够调节Eno1表达或活性(优选提高Eno1表达或活性,由此提高细胞中的葡萄糖摄取)的化合物。
使用本文中所述的方法,可以筛选多种分子以鉴别调节(优选提高)Eno1的表达和/或活性的分子。可以将由此鉴别的化合物提供给受试者以通过提高血糖摄取、提高胰岛素敏感性和/或降低胰岛素抵抗中的一种或多种使血糖标准化,由此治疗升高的血糖,例如,前驱糖尿病或糖尿病,例如,2型糖尿病、1型糖尿病或妊娠糖尿病。
本发明涉及预测医学的领域,其中将诊断分析、预后分析、药物基因组学和监控临床试验用于预后(预测)目的,以由此预防性地治疗个体。因此,本发明的一个方面涉及用于测定Eno1蛋白或核酸表达水平的诊断分析,以确定个体是否处于产生与血糖升高相关的疾病或失调的风险中,所述疾病或失调如,不限于,前驱糖尿病或糖尿病,包括2型糖尿病、1型糖尿病或妊娠糖尿病。这样的分析可以用于预后或预测目的,以由此在失调发作之前预防性地治疗个体。
本发明的再另一个方面涉及监控临床试验中试剂(例如,药物或其他治疗化合物)或行为和/或膳食改变对Eno1的表达或活性的影响。在以下部分中将进一步详细地描述这些和其他应用。
1.诊断分析
用于检测生物样品中指示剂蛋白质或核酸的存在或不存在或变化的示例性方法包括从测试受试者获得生物样品(例如,血液或血清)并将生物样品接触能够检测多肽或核酸(例如,mRNA或cDNA)的化合物或试剂。因此本发明的检测方法可以在体外以及在体内检测例如生物样品中的mRNA、cDNA或蛋白质,包括翻译后修饰的蛋白质。
本文中提供的用于检测生物样品中的指示剂蛋白或核酸的存在、不存在、水平变化的方法包括从受试者获得可能含有或不含待检测标志物蛋白或核酸的生物样品,将样品接触能够与待检测的指示剂蛋白或核酸形成复合物的指示剂特异性的结合剂(例如,一种或多种标志物特异性的结合剂),并且将样品接触用于检测指示剂-指示剂特异性结合剂复合物(如果形成)的检测试剂。将理解本文中提供的用于检测生物样品中的指示剂水平的方法包括进行所述分析的步骤。在检测方法的特定实施方案中,样品中的指示剂蛋白或核酸的水平为零或低于检测阈值。
所述方法包括指示剂和指示剂特异性结合剂之间瞬时或稳定复合物的形成。所述方法需要复合物(如果形成)形成足够的时间以允许检测试剂与复合物结合并产生可检测信号(例如,荧光信号、来自酶促反应的产物的信号,例如,过氧化物酶反应、磷酸酶反应、β-半乳糖苷酶反应或聚合酶反应)。
在特定实施方案中,使用相同方法检测全部指示剂。在特定实施方案中,使用相同生物样品(例如,相同体液)检测全部指示剂。在特定实施方案中,使用不同方法检测不同指示剂。在特定实施方案中,在不同生物样品(例如,血液和血清)中检测指示剂。
2.蛋白质检测
在本发明的特定实施方案中,待检测的指示剂是蛋白质。在特定实施方案中,待检测的指示剂是翻译后修饰的蛋白质。使用多种分析来检测蛋白质,其中待检测的指示剂蛋白和指示剂特异性结合剂之间的复合物不是天然存在的,例如,因为组分之一不是天然存在的化合物或者用于检测的指示剂和指示剂特异性结合剂不是来自相同的生物体(例如,使用来自小鼠、大鼠或山羊的指示剂特异性结合抗体来检测人指示剂蛋白)。在本发明的优选实施方案中,用于检测的指示剂是人指示剂蛋白。在某些检测分析中,用于检测的人指示剂被指示剂特异性的非人抗体结合,因此,复合物在自然界中不会形成。指示剂蛋白的复合物可以直接检测,例如,通过使用直接结合指示剂的经标记的指示剂特异性抗体,或者通过将进一步的组分结合指示剂-指示剂特异性抗体复合物来检测。在特定实施方案中,进一步的组分是能够在与第一指示剂特异性抗体同时结合指示剂的第二指示剂特异性抗体。在特定实施方案中,进一步的组分是结合指示剂特异性抗体的第二抗体,其中第二抗体优选连接可检测标记(例如,荧光标记、酶标记、生物素)。在第二抗体连接于酶学可检测标记(例如,过氧化物酶、磷酸酶、β-半乳糖苷酶)时,通过将酶学可检测标记接触合适的底物以产生比色、荧光或其他可检测的(优选可定量检测的)产物来检测第二抗体。用于本发明的方法中的抗体可以是多克隆的,然而,在优选实施方案中,使用单克隆抗体。完整抗体或其片段或衍生物(例如,Fab或F(ab’)2)可以用于本发明的方法中。指示剂蛋白的这类检测策略可以用于例如ELISA、RIA、western印迹和免疫荧光分析方法中。
在特定检测分析中,在用于检测的生物样品中存在的指示剂是酶,例如,Eno1,并且检测试剂是酶底物(例如,2-磷酸甘油酸(2-PG)或磷酸烯醇丙酮酸(PEP),或产生可检测产物的任一化合物的类似物)。在优选实施方案中,与待检测的指示剂酶形成复合物的底物不是人受试者中的酶的底物。
在特定实施方案中,将指示剂-指示剂特异性结合剂复合物连接于固体支持物用于指示剂的检测。复合物可以在基质上形成或在捕获于基质上之前形成。例如,在ELISA、RIA、免疫沉淀分析、western印迹、免疫荧光分析、凝胶酶学分析中,将用于检测的指示剂直接或间接地连接于固体支持物。在ELISA、RIA或免疫荧光分析中,指示剂通常通过抗体或结合蛋白间接连接于固体支持物。在western印迹或免疫荧光分析中,指示剂通常直接连接于固体支持物。对于凝胶酶学分析,指示剂溶解于凝胶中,通常是丙烯酰胺凝胶,其中掺入了酶的底物。
3.核酸检测
在本发明的特定实施方案中,指示剂是核酸,例如,Eno1核酸。使用多种分析来检测核酸,其中待检测的指示剂核酸和指示剂特异性探针之间的复合物不是天然存在的,例如,因为组分之一不是天然存在的化合物。在特定实施方案中,分析物包括核酸,而探针包括一个或多个合成的单链核酸分子,例如,DNA分子、DNA-RNA杂合体、PNA或含有一个或多个人造碱基、糖或主链部分的修饰核酸分子。在特定实施方案中,合成的核酸是单链的,是包括荧光标记的DNA分子。在特定实施方案中,合成的核酸是约12至约50个核苷酸长的单链寡核苷酸分子。在特定实施方案中,待检测核酸是mRNA,并且形成的复合物是与单链DNA分子杂交的mRNA,所述单链DNA分子与mRNA互补。在特定实施方案中,通过使用作为引物与RNA杂交的单链DNA首先从RNA模板产生DNA分子(即,cDNA分子)来检测RNA,所述引物例如通用多聚-T引物以转录多聚A RNA。然后可以使用标志物特异性的探针,将cDNA用作用于扩增反应的模板,例如,PCR、引物延伸试验。在特定实施方案中,标记的单链DNA可以与样品中存在的RNA杂交用于通过原位荧光杂交(FISH)的RNA检测或用于通过northern印迹的RNA检测。
例如,用于mRNA检测的体外技术包括northern杂交、原位杂交和rtPCR。用于检测基因组DNA的体外技术包括Southern杂交。用于mRNA检测的技术包括PCR、northern杂交和原位杂交。方法包括定性和定量方法。
这样的诊断、预后和监测分析的一般原理涉及制备可能含有用于检测的核酸和探针的样品或反应混合物,其在合适的条件下和足以允许指示剂核酸和探针相互作用并结合的时间,由此形成可以在反应混合物中取出和/或检测的复合物。这些分析可以以本领域已知的多种方式来进行,例如,PCR、FISH、northern印迹。
4.表达水平的检测
可以基于绝对表达水平或者标准化的或相对表达水平来检测Eno1水平。在监控受试者治疗或确定受试者中血糖水平或血糖调节是否存在变化时,绝对Eno1水平的检测可能是优选的。例如,可以监测正接受异常血糖治疗的受试者的Enol的表达水平,例如,以规律的间隔来监测,如每月间隔。可以随着时间监测Eno1水平的调节以观察Eno1水平的变化趋势。受试者中Eno1的表达水平可能高于正常样品中的Eno1表达水平,但也可能高于之前的表达水平,因此表明治疗方案对于受试者的益处。相似地,Eno1水平的变化率在用行为或膳食矫正而不是治疗性干预治疗的受试者中可能是重要的。个体受试者中Eno1水平的变化或无变化与群体中存在的Eno1水平相比,可能与针对受试者的治疗决策更相关。另外显示出具有正常血糖的受试者中Eno1水平的快速变化可能指示异常血糖或具有产生与异常血糖相关的病症的倾向,即使标志物在该群体的正常范围内。可以结合一种或多种血糖升高的其他指示剂,例如,HbA1c,提高的血糖(包括提高的餐后或空腹血糖中的一种或多种)或葡萄糖耐量测试中降低的葡萄糖清除率,来测定或监测Eno1水平。
作为基于Eno1的绝对表达水平做出决定的替代方案,表达水平可以基于Eno1的标准化表达水平来决定。通过将指示剂的绝对表达水平与不是指示剂的基因(例如,组成型表达的管家基因)的表达进行比较来标准化。用于标准化的合适基因包括管家基因如肌动蛋白基因,以及用于血液或血清中的标准化的合适蛋白质包括白蛋白。这种标准化允许一个样品(例如,来自血糖正常受试者的样品)中的表达水平与另一个样品(例如,来自怀疑具有或具有异常血糖的样品)的比较,或来自不同来源的样品之间的比较。
或者,表达水平可以作为与合适的对照(例如,群体对照、较早时间点对照等)比较的相对表达水平来提供。优选地,基线测定中使用的样品将来自正常血糖的受试者的样品。细胞来源的选择取决于相对表达水平的使用。此外,随着更多数据累积,可以修正平均表达值,从而基于累积的数据提供改进的相对表达值。
5.监测临床试验
监测药剂(例如,药物化合物)对血糖指示剂水平的影响不仅可以应用于基础药物筛选或监测单一受试者的治疗中,而且也可以应用于临床试验中。例如,可以在接受针对血糖升高的治疗的受试者的临床试验中监测药剂影响Eno1表达的有效性。在优选实施方案中,本发明提供了监测使用药剂(例如,激动剂、拮抗剂、肽模拟物、蛋白质、肽、核酸、小分子或其他药物候选物)治疗受试者的有效性的方法,包括步骤(i)在施用药剂前,从受试者获得施用前样品;(ii)检测施用前样品中的指示剂Eno1的表达水平和任选一种或多种其他的血糖指示剂(例如,血糖、酮或HbA1c);(iii)从受试者获得一个或多个施用后样品;(iv)检测施用后样品中的指示剂的表达水平;(v)将施用前样品中的指示剂水平与一个或多个施用后样品中的指示剂水平进行比较;和(vi)因此改变对受试者的药剂施用。例如,在治疗过程中降低的Eno1表达和缺少其他指示剂的正常化可以表明无效的剂量并希望提高剂量。相反,提高的Eno1表达和其他指示剂的正常化可以表明有效的治疗并且不需要改变剂量。
VI.受损的血糖水平、受损的血糖水平控制和糖尿病的治疗
如本文中证明的,Eno1蛋白的施用提高了葡萄糖摄取和反应,从而使血糖水平和血糖水平的控制正常化。本发明提供了通过将Eno1施用于受试者来改善病症的至少一个体征或症状治疗患有受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、胰岛素不足和糖尿病(例如,2型糖尿病、1型糖尿病、前驱糖尿病和妊娠糖尿病)的受试者的方法。在特定实施方案中,Eno1,优选Eno1的转录物变体1,可以施用于受试者,其中将用于治疗受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、胰岛素不足或糖尿病的至少一种其他药剂施用于受试者。如本文中使用的,药剂可以以任何顺序按序施用或同时施用。多种药剂施用于受试者不需要药剂的共同配制或相同的给药方案。
使用Eno1治疗受损的葡萄糖耐量、提高的血糖、胰岛素抵抗、胰岛素不足或糖尿病(尤其是2型糖尿病)的方法可以结合用于糖尿病治疗的已知方法和药剂。许多药剂和方案目前可用于糖尿病的治疗。选择用于治疗的特定药剂取决于受试者、特定的症状和病况的严重性。例如,在特定实施方案中,Eno1可以结合膳食和/或行为矫正(例如,热量限制)来施用(单独地或结合减肥手术和/或增加的身体活动)。在特定实施方案中,Eno1可以与用于治疗2型糖尿病的药剂一起施用,例如,二甲双胍(Glucophage、Glumetza、其他)、格列酮类,例如,匹格列酮(Actos)、格列吡嗪(Glucotrol)、格列本脲(Diabeta、Glynase)、格列美脲(Amaryl)、阿卡波糖(Precose)、二甲双胍(Glucophage)、西格列汀(Januvia)、沙格列汀(Onglyza)、瑞格列奈(Prandin)、那格列奈(Starlix)、艾塞那肽(Byetta)、利拉鲁肽(Victoza)或胰岛素。胰岛素通常只用于晚期2型糖尿病的治疗中,并且包括速效胰岛素(门冬胰岛素(NovoLog)、赖谷胰岛素(Apidra)和赖脯胰岛素(Humalog));短效胰岛素(常规胰岛素(Humulin R,Novolin R));中效胰岛素(胰岛素NPH人(Humanlin N,Novolin N))和长效胰岛素(甘精胰岛素(Lantus)和地特胰岛素(Levemir))。用于糖尿病的治疗还可以包括行为矫正,包括锻炼和减重,其可以通过使用药物或外科手术来促进。可以结合用于升高的血糖和糖尿病的治疗。例如,药物治疗可以结合行为矫正治疗。用于1型糖尿病治疗中的胰岛素包括,但不限于,通常仅用于后期2型糖尿病治疗中的胰岛素,并且包括速效胰岛素(门冬胰岛素(NovoLog)、赖谷胰岛素(Apidra)和赖脯胰岛素(Humalog));短效胰岛素(常规胰岛素(Humulin R,Novolin R));中效胰岛素(胰岛素NPH人(Humanlin N,Novolin N))和长效胰岛素(甘精胰岛素(Lantus)和地特胰岛素(Levemir))。
因此,在一些方面中,本发明涉及治疗受试者的升高的血糖的方法,包括:(a)从怀疑具有升高血糖的受试者获得生物样品,(b)提交生物样品以获得关于Eno1水平的诊断信息,和(c)当样品中的Eno1水平高于阈值水平时,将治疗有效量的抗糖尿病治疗施用于受试者。
在一些方面中,本发明涉及治疗受试者的升高的血糖的方法,包括:(a)获得关于来自受试者的生物样品中的Eno1水平的诊断信息,和(b)在样品中的Eno1水平高于阈值水平时,将治疗有效量的抗糖尿病治疗施用于受试者。
在一些方面中,本发明涉及治疗受试者的升高的血糖的方法,包括:(a)从怀疑具有升高血糖的受试者获得生物样品用于鉴定关于Eno1水平的诊断信息,(b)检测生物样品中的Eno1的水平,(c)在样品中的Eno1水平低于阈值水平时,向健康护理提供者推荐血糖降低治疗以施用于受试者。
上述的方法可以进一步包括获得关于升高血糖的一种或多种其他指示剂水平的诊断信息。在一些实施方案中,所述方法进一步包括测量升高血糖的一种或多种其他指示剂的水平。升高血糖的一种或多种其他指示剂可以选自HbA1c水平、空腹血糖水平、餐后血糖水平和葡萄糖耐量。
在上述方法的一些实施方案中,如果样品中的Eno1水平低于阈值水平并且检测到升高血糖的至少一种其他指标,步骤(c)进一步包括将治疗有效量的葡萄糖降低治疗施用于受试者。在一些实施方案中,如果样品中的Eno1水平低于阈值水平并且检测到升高血糖的至少一种其他指标,步骤(c)进一步包括对健康护理提供者推荐葡萄糖降低治疗以施用于受试者。
在上述方法的一些实施方案中,生物样品是血液或血清。在一些实施方案中,通过免疫分析或ELISA来测定Eno1的水平。在一些实施方案中,Eno1的水平通过(i)将生物样品接触选择性地结合Eno1的试剂以形成生物标志物复合物,和(ii)检测生物标志物复合物来测定。在一些实施方案中,选择性地结合Eno1以形成生物标志物复合物的试剂是选择性地结合Eno1的至少一个表位的抗Eno1抗体。
在上述方法的一些实施方案中,通过测量生物样品中的Eno1mRNA的量来检测Eno1的水平。例如,可以通过扩增反应来检测Eno1 mRNA的量。在一些实施方案中,扩增反应是(a)聚合酶链式反应(PCR);(b)基于核酸序列的扩增试验(NASBA);(c)转录介导的扩增(TMA);(d)连接酶链式反应(LCR);或(e)链置换扩增(SDA)。
在一些实施方案中,将杂交分析用于检测生物样品中的Eno1mRNA的量。在一些实施方案中,将与Eno1 mRNA的一部分互补的寡核苷酸用于杂交试验中来检测Eno1 mRNA。
VI.糖尿病和胰岛素抵抗的动物模型
本领域中充分表征了代谢症状(如1型糖尿病和2型糖尿病、胰岛素抵抗、高脂血症)的多种遗传和诱导的动物模型。这样的动物可以用于证明Eno1在胰岛素抵抗和糖尿病治疗中的作用。1型糖尿病的模型包括,但不限于,NOD小鼠以及大鼠和小鼠中链脲霉素诱导的糖尿病(1型糖尿病模型)。2型糖尿病的遗传和诱导模型包括,但不限于,瘦素缺陷ob/ob小鼠,瘦素受体缺陷db/db小鼠和高脂饮食小鼠或大鼠模型。在每种模型中,产生特定疾病特征的时间线是公知的。可以在糖尿病或胰岛素抵抗症状出现之前或之后施用Eno1,以证明Eno1在这些动物模型中预防或治疗糖尿病和/或胰岛素抵抗中的功效。
根据选择的特定动物模型和干预时间,例如,在糖尿病和/或胰岛素抵抗出现之前或之后,动物模型可以用于证明本文中提供的方法用于预防、治疗、诊断和监控糖尿病和/或胰岛素抵抗的功效。
VII.药物筛选
Eno1的施用导致具有诱导的糖尿病的动物中血糖的正常化,使得Eno1成为用于通过筛选来检测增强Eno1表达的化合物或实体而鉴定新治疗剂的有吸引力的靶标。因此,本发明提供了用于鉴定对于调节血糖和糖尿病潜在有用的化合物的方法。特别地,本发明提供了用于鉴定对于调节Eno1潜在有用的化合物的方法,其中所述化合物调节血糖和糖尿病。
这样的分析通常包括Eno1和一种或多种分析组分(例如,测试化合物)之间的反应。其他组分可以是测试化合物自身,或测试化合物和Eno1的天然结合伴体的组合。通过如本文中所述那些分析鉴定的化合物例如对于调节(例如,抑制、缓解、治疗或预防)疾病是有用的。针对调节Eno1的表达水平鉴定的化合物优选进一步针对在异常血糖和/或糖尿病治疗中有用的活性(例如,使餐后和/或空腹血糖正常化、在葡萄糖耐量测试中使葡萄糖清除和/或胰岛素水平正常化、使HbA1c水平正常化)进行测试。
本发明的筛选分析中使用的测试化合物可以获自任何可用的来源,包括天然和/或合成化合物的系统文库。还可以通过本领域已知的组合文库方法中的多种途径中的任何一种来获得测试化合物,所述文库包括:生物学文库;类肽文库(具有肽的功能性但具有抵抗酶降解的新的、非肽主链的分子的文库,但所述分子仍然保留生物学活性;参见,例如,Zuchermann等,1994,J.Med.Chem.37:2678-85);空间寻址的平行固相或液相文库;需要去卷积的合成文库方法;‘一珠一化合物’文库方法;和使用亲和性色谱选择的合成文库方法。生物学文库和类肽文库途径限于肽文库,而其他四种途径适用于肽、非肽寡聚物或化合物的小分子文库(Lam,1997,Anticancer Drug Des.12:145)。
用于分子文库合成的方法的实例可以在现有技术中找到,例如,在:DeWitt等,(1993)Proc.Natl.Acad.Sci.U.S.A.90:6909;Erb等,(1994)Proc.Natl.Acad.Sci.USA 91:11422;Zuckermann等,(1994).J.Med.Chem.37:2678;Cho等,(1993)Science 261:1303;Carrell等,(1994)Angew.Chem.Int.Ed.Engl.33:2059;Carell等,(1994)Angew.Chem.Int.Ed.Engl.33:2061;和Gallop等,(1994)J.Med.Chem.37:1233。
化合物文库可以存在于溶液中(例如,Houghten,1992,Biotechniques 13:412-421),或者珠子(Lam,1991,Nature 354:82-84)、芯片(Fodor,1993,Nature 364:555-556)、细菌和/或孢子(Ladner,USP 5,223,409)、质粒(Cull等,1992,Proc Natl Acad Sci USA 89:1865-1869)或噬菌体上(Scott和Smith,1990,Science249:386-390;Devlin,1990,Science 249:404-406;Cwirla等,1990,Proc.Natl.Acad.Sci.87:6378-6382;Felici,1991,J.Mol.Biol.222:301-310;Ladner,上文)。
本发明的筛选方法包括将细胞,例如,患病的细胞,尤其是具有异常胰岛素反应和/或葡萄糖摄取的细胞,接触测试化合物并测定测试化合物调节细胞中Eno1的表达和/或活性的能力。可以使用本领域已知的任何方法,如本文中所述的那些,来测定Eno1的表达和/或活性,任选结合血糖水平的检测方法。
在另一个实施方案中,本发明提供了用于筛选作为Eno1或其生物活性部分的底物的候选物或测试化合物的测试。在再另一个实施方案中,本发明提供了用于筛选结合Eno1或其生物活性部分的候选物或测试化合物的分析。例如,以通过本领域已知的任一种方法来完成测试化合物直接结合Eno1的能力的测定。
本发明进一步涉及通过上述筛选分析鉴定的新药剂。因此,进一步将按照本文中所述鉴定的药剂用于合适的动物模型中在本发明的范围内。例如,能够调节Eno1的表达和/或活性的药剂可以用于动物模型中来测定使用这样的药剂治疗的功效、毒性或副作用。或者,如本文中所述鉴定的药剂可以用于动物模型中来测定这种药剂的作用机理。此外,本发明涉及通过上述筛选分析鉴定的新药剂用于如上所述的治疗中的用途。
在特定实施方案中,使用多孔分析平板的多个孔中所含的细胞来进行筛选方法。这样的分析平板是商业上可购得的,例如,从Stratagene Corp.(La Jolla,Calif.)和Corning Inc.(Acton,Mass.)购得,并且包括例如,48-孔、96-孔、384-孔和1536-孔平板。
通过使用相同浓度的相同候选化合物进行超过一次的分析来测试结果的可重复性(例如,通过在分析平板的超过一个孔中孵育细胞)。另外,由于根据化合物的性质及其作用机理的性质,候选化合物在不同浓度下可能是有效的,因此可以测试候选化合物的不同浓度。通常,将1fM至约10mM的候选化合物浓度用于筛选。优选的筛选浓度通常为约10pM至约100μM。
本发明的筛选方法将提供“命中物(hits)”或“先导物(leads)”,即,具有所需的但不是最佳的生物活性的化合物。对这些化合物进行满足临床有用性需要的所有理化、药代动力学和毒理学因素的先导优化可以提高改进的药物候选物。本发明还包括这些改进的药物候选物及其作为用于调节血糖和胰岛素反应的治疗剂的用途。
VIII.试剂盒/试剂组
本发明还提供了用于诊断、预后或监控疾病或失调、失调的复发或待治疗失调(例如,异常血糖和/或糖尿病)的受试者的存活的组合物。这些试剂盒包括以下的一个或多个:特异性地结合Eno1的可检测抗体,特异性地结合Eno1的可检测抗体,用于获得和/或制备用于染色的受试者组织样品的试剂和使用说明书。
本发明还包括用于检测生物样品中的Eno1蛋白或核酸的存在的试剂盒。这样的试剂盒可以用于确定受试者是否患有异常血糖和/或糖尿病或处于产生异常血糖和/或糖尿病的提高风险中。例如,试剂盒可以包括能够检测生物样品中的Eno1蛋白或核酸的标记化合物或试剂和用于测定样品中的蛋白或mRNA量的工具(例如,结合蛋白或其片段的抗体,或结合编码蛋白的DNA或mRNA的寡核苷酸探针)。试剂盒还可以包括试剂盒用于实施本文中提供的任一种方法或基于本文中提供的教导解释使用试剂盒获得的结果的使用说明书。试剂盒还可以包括包括用于检测样品中与异常血糖不相关的对照蛋白的试剂,例如,组织样品的肌动蛋白、用于对样品中存在的Eno1量标准化的血液或血液衍生样品中的白蛋白。试剂盒还可以包括用于检测的纯化标志物,用作对照或用于使用试剂盒进行的分析的定量。
试剂盒包括用于方法中以诊断受试者中的异常血糖(或鉴定易于产生异常血糖和/或糖尿病的受试者)的试剂组,所述试剂组包括至少两种检测试剂,其包括用于检测Eno1水平的试剂和用于检测血糖的另一种指标(例如,HbA1c)的试剂。
对于基于抗体的试剂盒,试剂盒可以包括,例如:(1)结合Eno1的第一抗体(例如,连接于固体支持物);和任选地(2)结合Eno1或第一抗体并与可检测标记偶联的不同的第二抗体。在特定实施方案中,试剂盒包括(1)结合第二标志物蛋白的第二抗体(例如,连接于固体支持物);和任选地(2)结合HbA1c或血红蛋白(总的或未修饰的血红蛋白)或结合第二抗体并与可检测标记偶联的不同的第二抗体。第一和第二标志物蛋白是不同的。
对于基于寡核苷酸的试剂盒,试剂盒可以包括,例如:(1)与编码Eno1的核酸序列杂交的寡核苷酸,例如,可检测地标记的寡核苷酸,或(2)一对可用于扩增Eno1核酸分子的引物。在特定实施方案中,试剂盒包括对于每种核酸标志物特异性的第三引物以允许使用定量PCR方法的检测。在特定实施方案中,试剂盒进一步包括直接或间接(例如,使用HbA1c水平)地测量受试者中的血糖的说明书。
对于色谱方法,试剂盒可以包括标志物,包括标记的标志物,以允许通过色谱法检测和鉴定一种或多种血糖指标,例如,Eno1和HbA1c。在特定实施方案中,用于色谱方法的试剂盒包括用于一种或多种血糖指示剂衍生化的化合物。在特定实施方案中,用于色谱方法的试剂盒包括用于解析所述方法的指示剂的柱。
对于Eno1的检测特异性的试剂允许检测和定量复杂混合物(例如,血清、血液)中的标志物。在特定实施方案中,试剂是物种特异性的。在特定实施方案中,Eno1试剂不是物种特异性的。在特定实施方案中,Eno1试剂是异形体特异性的。在特定实施方案中,Eno1试剂不是异形体特异性的。在特定实施方案中,试剂检测总Eno1。
在特定实施方案中,用于升高的血糖和/或糖尿病的诊断、监控或表征的试剂盒包括至少一种对于Eno1表达水平的检测特异性的试剂。在特定实施方案中,试剂盒进一步包括检测(直接或间接或两者)样品中的血糖水平的说明书。在特定实施方案中,试剂盒包括至少一种用于检测HbA1c水平的试剂。
在特定实施方案中,试剂盒还可以包括例如缓冲剂、防腐剂、蛋白稳定剂、反应缓冲剂。试剂盒可以进一步包括检测可检测标记(例如,酶或底物)所必需的组分。试剂盒还可以含有可以测定并与测试样品比较的对照样品或一系列对照样品。对照可以是对照血清样品或(适宜的话)纯化蛋白或核酸的对照样品,具有已知水平的指示剂。试剂盒的每种组分可以包装在单个容器内并且所有的各种不同容器可以在单一包装内,连同用于解释使用试剂盒进行的分析的结果的说明书一起。
本发明的试剂盒可以任选地包括可用于进行本发明的方法的其他组分。
例如,在一些方面中,本发明涉及用于检测生物样品中的Eno1的试剂盒,其包括至少一种用于测量生物样品中的Eno1水平的试剂,和用于测量Eno1水平的一套说明。在一些实施方案中,试剂是抗Eno1抗体。在一些实施方案中,试剂盒进一步包括检测抗Eno1抗体的工具。在一些实施方案中,检测抗Eno1抗体的工具是可检测的第二抗体。在一些实施方案中,用于测量Eno1水平的试剂是与Eno1 mRNA互补的寡核苷酸。
在上述试剂盒的一些实施方案中,说明书给出了用于检测生物样品中的Eno1水平的免疫分析或ELISA。在一些实施方案中,说明书给出了用于测定生物样品中的Eno1 mRNA水平的扩增反应。在一些实施方案中,扩增反应用于检测生物样品中的Eno1 mRNA的量。在一些实施方案中,扩增反应是(a)聚合酶链式反应(PCR);(b)基于核酸序列的扩增分析(NASBA);(c)转录介导的扩增(TMA);(d)连接酶链式反应(LCR);或(e)链置换扩增(SDA)。
在上述试剂盒的一些实施方案中,说明书给出了用于检测生物样品中的Eno1 mRNA的量的杂交分析。在一些实施方案中,试剂盒进一步包括至少一个与Eno1 mRNA的一部分互补的寡核苷酸。
本发明进一步提供了用于检测受试者样品中的一种或多种血糖指示剂的试剂组和至少一种对照试剂。在特定实施方案中,对照试剂用于检测生物样品中的指示剂,其中试剂组提供含有用作阳性对照以及任选用于定量生物样品中存在的指示剂量的指示剂的对照样品。在特定实施方案中,试剂组包括用于已知存在或不存在于生物样品中的与异常血糖不相关的蛋白质或核酸的检测试剂以分别提供阳性或阴性对照。试剂组可以提供用于检测样品中与异常血糖不相关的对照蛋白的试剂,例如,血液或血液衍生样品中的白蛋白,用于样品中存在的指示剂量的标准化。试剂组可以提供纯化的指示剂,例如,Eno1,用作对照用于检测或用于使用所述试剂组进行的分析的定量。
在优选实施方案中,试剂组包括用于Eno1检测的试剂,优选结合对照试剂。在该试剂组中,通过对于该Eno1特异性的试剂来检测Eno1。在特定实施方案中,试剂组进一步包括用于HbA1c检测的试剂。在特定实施方案中,试剂组包括重复孔、点或部分以允许各种稀释度(例如,连续稀释)的生物样品和对照样品的分析。在优选实施方案中,试剂组允许血糖的一种或多种指示剂的定量检测。
在特定实施方案中,试剂组是用于检测一种或多种标志物的蛋白质芯片。在特定实施方案中,试剂组是用于检测一种或多种标志物的ELISA平板。在特定实施方案中,套组是用于检测一种或多种标志物的定量PCR的平板。
在特定实施方案中,在单一装置上提供检测试剂组,包括用于本发明的一种或多种标志物的检测试剂和至少一个对照样品。在特定实施方案中,可以在单一装置上提供检测试剂组,包括用于本发明的两种或更多种标志物的检测试剂和至少一个对照样品。在特定实施方案中,用于检测本发明的不同标志物的多个试剂组提供有至少一种统一的对照样品以有助于试剂组之间的结果比较。
在特定实施方案中,试剂组和试剂盒进一步包括用于测量受试者中的血糖的说明或建议。在特定实施方案中,试剂盒或试剂组提供有一种或多种用于血糖测量的试剂或装置。
本发明还提供了用于治疗至少一种糖尿病的试剂盒,例如,1型糖尿病、2型糖尿病、妊娠糖尿病、前驱糖尿病、胰岛素抵抗、葡萄糖不耐性、异常血糖和血糖控制的丧失。试剂盒包括Eno1以及使用说明和(按照需要)用于施用的装置中的一个或多个。
通过以下实施例来进一步说明本发明,所述实施例不应当解释为限制。在整个申请中引用的所有参考文献以及公开专利和专利申请的内容在此按引用并入。
实施例
实施例1-使用平台技术来鉴定作为糖尿病病因学中的重要活性节点的烯醇酶1(Eno1)
在这个实施例中,使用国际专利申请No.PCT/US2012/027615中详细描述的平台技术来整合获自定制的糖尿病模型的数据和鉴定驱动糖尿病(特别是2型糖尿病)的发病机理的新蛋白质/途径。从这个分析获得的关系图已经鉴定了Eno1作为糖尿病病因学中的重要活性节点。因此,Eno1是重要的糖尿病治疗靶标,以及与糖尿病相关的诊断/预后标志物。
实施例2-肌管中葡萄糖摄取的Eno1调节
使用商业上可购得的表达载体,Eno1在大肠杆菌中作为6X HIS蛋白标签重组表达。使用本领域已知的亲和性色谱方法纯化标记的Eno1。优选地,切割6X HIS标签以产生用于本文中提供的方法中的蛋白质。
人骨骼肌成肌细胞(HSMM)获自PromoCell并且在零售商推荐的生长培养基中培养。在实验前,在96孔平板中用2%马血清将HSMM成肌细胞(20,000细胞/孔)分化7天。用人Eno1(500ug/ml)处理细胞。用200μl含有0.1%BSA的MBSS改良平衡盐溶液(MBSS)缓冲液洗涤细胞两次,然后用100ul MBSS 0.1%BSA进行血清饥饿4小时。开始胰岛素刺激时,将MBSS 0.1%BSA缓冲液中的100ul 2×试剂加入100ul饥饿培养基中以制得用于实验的1×浓度。2×试剂为:胰岛素(0,20nM和200nM);荧光葡萄糖类似物2-NBDG(500uM)。用胰岛素和荧光脱氧-葡萄糖类似物2-NBDG处理细胞30min,然后用MBSS缓冲液洗涤两次,然后将50ul MBSS缓冲液加入孔中。用荧光计检测葡萄糖摄取,连同使用其中无细胞的孔的背景检测。荧光计读出后,将固定剂(福尔马林,50ul)加入孔中的50ul MBSS中,然后将100ul 1Um DAPI加入100ul福尔马林和MBSS混合物中。
如图1A和1B中所示,用Eno1处理肌管显著提高了不存在和存在胰岛素的情况下的葡萄糖摄取(p=0.025非胰岛素依赖性葡萄糖摄取,未处理的vs.Enol处理的)。这些结果证明了Eno1在胰岛素依赖性和非胰岛素依赖性葡萄糖摄取中的作用。由Eno1诱导的胰岛素依赖性葡萄糖摄取证明了Eno1在受试者中对于胰岛素敏感的至少骨骼肌中与胰岛素信号传导途径复杂地关联。结果还证明了Eno1在非胰岛素依赖性葡萄糖摄取中的作用。这种观察对于1型和2型糖尿病受试者的治疗是重要的,所述受试者患有胰岛素抵抗且还具有高胰岛素血症,使得胰岛素作用受损并且因此是非胰岛素依赖性的。这些结果证明Eno1在刺激葡萄糖摄取中是有用的,即使在不再具有正常胰岛素信号传导的个体中。
用上述纯化Eno1蛋白处理人骨骼肌肌管的细胞培养物48小时以测量Eno1摄取。然后通过Western印迹测定细胞中的Eno1水平。如图2A和2B中所示,用500μg/ml Eno1或1000μg/ml Eno1处理的细胞中的Eno1水平相对于未处理细胞具有显著较高的Eno1水平。用1000μg/ml Eno1处理的细胞中的Eno1水平也高于用500μg/ml Eno1处理的细胞中的水平。这些结果表明Eno1以剂量依赖性的方式递送至人骨骼肌肌管中。
为了测定Eno1酶活性在葡萄糖摄取中的作用,通过在88℃下处理90秒来热灭活纯化的Eno1,并且比较原始的和热灭活的Eno1的活性水平。使用来自Abcam(Cambridge,MA;Cat.No.ab117994)的Eno1人活性分析试剂盒通过比色分析测定Eno1活性。如图3A中所示,热灭活极大地降低了Eno1酶活性,但保留了一些残留活性。
按照上述方法,在人骨骼肌肌管中比较了原始和热灭活的Eno1对葡萄糖摄取的作用。如图3B中所示,相对于未用Eno1处理的肌管,用原始(活性)Eno1处理的肌管呈现出显著较高的葡萄糖摄取。与用活性Eno1处理的肌管相比,用热灭活的Eno1处理的肌管呈现出显著较低的葡萄糖摄取。这些结果表明Eno1对葡萄糖摄取的作用依赖于Eno1酶活性。热灭活的Eno1相对于不含Eno1的对照观察到的葡萄糖摄取的提高很可能是由于热灭活酶的残留Eno1活性。
实施例3-膳食诱导肥胖(DIO)小鼠的小鼠模型
将两个基本上等同的膳食诱导肥胖症模型用于本文中提供的方法中。
在第一种方法中,雄性C57BL/6J小鼠获自Jackson实验室(Bar Harbor,ME)并且最初4-5只/笼圈养在22℃下,使用12:12hr白天-黑夜循环。在6周龄开始,给小鼠饲喂高脂肪膳食(Research Diets Cat#:D12492;60kcal%脂肪、20kcal%蛋白和20kcal%碳水化合物)。还获得了瘦的对照小鼠并饲喂标准膳食。实验前DIO小鼠的体重显著重于瘦对照小组。在一个研究中,DIO小鼠称重38.4±0.6g,而瘦小鼠称重29.9±0.5g(p<0.05)。
在第二种方法中,膳食诱导肥胖雄性C57BL/6J小鼠(12周大)和对照瘦小鼠(12周大)获自Jackson实验室(Bar Harbor,ME),并且最初4-5只/笼圈养在22℃下,使用12:12hr白天-黑夜循环。在处理前将小鼠在动物实验设施中适应一周并对DIO组维持高脂肪膳食(Research Diets Cat#:D12492;60kcal%脂肪、20kcal%蛋白和20kcal%碳水化合物)或对瘦组维持低脂肪膳食(10%kcal%脂肪)。
实施例4-在膳食诱导肥胖症(DIO)小鼠中用Eno1治疗葡萄糖不耐性
在高脂肪膳食维持7周后小鼠(n=10只/组)肥胖时,开始实验方案。按照制造商的指导,将微型渗透泵(型号1004,Alzet,Cupertino,CA)填充0.1ml Eno1肽或溶媒(磷酸盐缓冲盐水(PBS),pH 7.0)。将泵在无菌盐水中在4℃下准备过夜。用异氟烷将小鼠麻醉(100%氧中1-3%)并在外科手术前用70%异丙醇和聚维酮碘溶液擦洗。在中肩胛区域中形成小的皮下切口,将泵插入并且缝合伤口。在返回其圈养笼子之前,使得动物恢复。皮下微型渗透泵的植入以0.11μl/hr的恒定速率持续灌注肽,持续四周。每4周进行泵更换手术。通过泵灌注速率计算的纯化Eno1处理剂量为10μg/kg体重。
在6h禁食后,使用常规方法进行葡萄糖耐量测试(GTT)。简而言之,测定了初始空腹血糖水平,接着以1.5g/kg体重的剂量腹膜内(ip)注射20%右旋糖溶液。在葡萄糖注射后15,30,60,90和120分钟,使用 Advantage血糖仪(Diagnostics,Indianapolis,IN)从尾静脉测量血糖水平。使用Graphpad软件计算GTT过程中的曲线下面积(AUC),并且针对不同处理组之间的显著性进行了student t-检验。结果显示于图4A和4B中。
如可以容易地观察到的,用Eno1处理的小鼠与未处理小鼠相比,血糖曲线下面积显著降低(p=0.017)。这些数据证明了用Eno1蛋白处理肥胖小鼠提高了葡萄糖耐量,如通过葡萄糖耐量测试证明的,并且表明了Eno1在胰岛素抵抗、葡萄糖不耐性和2型糖尿病的治疗中是有效的。
实施例5-PAMAM树状聚合物、肌肉靶向Eno1的产生
已经证明了全身施用时Eno1提高肌管中的葡萄糖摄取和提高葡萄糖耐量的功效,因此产生了肌肉靶向的Eno1来分析其提高葡萄糖耐量的功效。使用下文所述的方法产生了含有肌肉靶向肽(MTP)ASSLNIA和/或Eno1的可检测地标记的G5-PAMAM树状聚合物。评价了各种不同比率的MTP与树状聚合物,包括含有MTP的树状聚合物,其含有约10个MTP肽/树状聚合物,约3个MTP肽/聚合物或约1个MTP肽/树状聚合物。
制备Eno1树状聚合物复合物的过程包括试剂的最佳比例和浓度的鉴定。在缓冲液中制备了Eno1的原液,并将蛋白溶液以不同比率与G5树状聚合物-肌肉靶向肽(MTP)偶联物混合。还评价了各种不同比率的树状聚合物与Eno1,包括含有Eno1的树状聚合物,其含有约一个树状聚合物/Eno1蛋白分子或约五个树状聚合物/Eno1蛋白分子。
在不同温度下评价了Eno1-树状聚合物-SMTP复合物的稳定性,并且使用商业上可购得的Eno1分析通过测量Eno1活性测定了在3-4个月的时间段内的稳定性。还是用生物物理技术,包括动态光散射(DLS)和UV-Vis光谱学,来评价选定的偶联物以证实树状聚合物-肽偶联物和Eno1之间的复合。
Eno1纯度的测定:通过考马斯和银染以及Western印迹检查了Eno1蛋白的5.32mg/L溶液的纯度。制备了范围从10μg/孔至100ng/孔的Eno1蛋白的几个稀释液并加载于12-孔,4-12% TGX凝胶[BIO-RAD Cat#456-1095Lot#4000 79200]上。泳道分配如下:泳道1:梯(Precision Plus Protein Standard Dual Color[BIO-RAD Cat#161-0374];泳道2:Eno1(10.0μg);泳道3:Eno1(1.0μg);泳道4:Eno1(0.1μg);泳道5:梯(Precision Plus Protein Standard Dual Color[BIO-RAD Cat#161-0374];泳道6:Eno1(10.0μg);泳道7:Eno1(1.0μg);泳道8:Eno1(0.1μg);泳道9:梯(Precision Plus Protein Standard Dual Color[BIO-RAD Cat#161-0374];泳道10:Eno1(10.0μg);泳道11:Eno1(1.0μg);泳道12:Eno1(0.1μg)。SDS-PAGE在200V下运行20-25min。
考马斯染色:跑胶后,将凝胶分割成3个相等部分。一个部分用考马斯染色。简而言之,将凝胶浸没在100mL考马斯染色液(40%甲醇和7%乙酸中的0.025%考马斯染料)中并在微波炉中加热一分钟。然后,凝胶伴随温和搅拌使染色45分钟。完成染色后,使用脱色液(40%甲醇和7%乙酸)将凝胶脱色直至背景染色可接受。
如图5中所示,蛋白呈现为约47kDa的单个条带,这与Eno1的大小一致。
银染:由于考马斯染色对于蛋白条带的可视化不是一种灵敏的方法,另一部分的凝胶使用BIO-RAD的银染试剂盒[BIO-RAD Cat#161-0443]用银染来染色。遵循改良的银染实验方案进行。
如图6中所示,在每个泳道中看到了额外的条带,其对应于梯的条带。这是由于梯状条带漏入了邻近泳道中。用箭头标记的三个条带不是来自梯。最明显的条带为约47kDa,这与Eno1的大小一致。在纯化蛋白中存在两个额外条带,但这些条带微弱,表明Eno1的整体纯度是相对高的。
Western印迹分析:通过Western印迹进一步确认Eno1的身份。为了这个目的,将最后部分的凝胶转移至100mL Tris-甘氨酸缓冲液中并使用transblot SD半干式转移装置(BIO-RAD)在20V下转移至0.2μm PVDF膜(BIO-RAD)上2.0h。通过观察膜上预染色梯状条带的存在来检查转移的效率。将膜干燥1.0h。然后膜用甲醇润湿1.0min,并用15.0mL封闭缓冲液(LICOR)在室温下封闭2.0h。
封闭完成后,用15.0mL的含有30μL抗-ENOA-1 m-Ab(小鼠)(购自ABNOVA)的封闭缓冲液将膜在4℃下孵育过夜。然后用3×30mL的1×PBS-T洗涤膜,每次振荡5分钟。然后用15.0mL的含有5μL用800CW(购自LICOR)标记的山羊抗小鼠二抗的封闭缓冲液将膜在室温下孵育2.0h。孵育后,用3×30mL的1×PBS-T,接着2×30mL的1×PBS洗涤膜,每次振荡5分钟。最后,使用LICOR ODYSSEY红外成像仪将膜成像。如图7中所示,Western印迹分析证实了47kDa的主要订带是Eno1。
烯醇酶-I/G5-PAMAM-SMTP的Zeta(ζ)-电位表征:以改变的比率复合Eno1和带有2-3个骨骼肌靶向肽(SMTP)的5代PAMAM树状聚合物以形成Eno1/G5-SMTP蛋白/树状聚合物复合物。将树状聚合物的浓度保持恒定在1.0μM,而Eno1浓度在0.1μM-10.0μM之间变化。以下表2描述了怎样制备烯醇酶-I/G5-树状聚合物/SMTP混合物。
表2.用于形成树状聚合物复合物的Eno1和G5-树状聚合物/SMTP的各种组合
通过将G5-树状聚合物/SMTP加入相应量的PBS中制备了各个样品。然后将烯醇酶以逐滴方式加入G5-树状聚合物/SMTP溶液中,同时低速涡旋。然后在分析前,将样品在室温下孵育20分钟。
使用来自Malvern Instruments的Zetasizer Nano Z90s仪器进行大小测量。使用缺省参数用于测量,并且收集每个样品的三个单独测量。图8显示了针对具有2:1的Eno1与树状聚合物/SMTP摩尔比的Eno1/G5-树状聚合物/SMTP复合物的三个样品的Zeta(ζ)-电位数据。使用动态光散射测量Zeta(ζ)-电位。如图8中所示,三个样品的峰匹配,表明烯醇酶-SMTP树状聚合物复合物的均一电荷分布。
烯醇酶-I/G5-SMTP复合物的稳定性:通过使用ENO1人活性分析试剂盒(ABCAM,Cambridge,MA;目录No.ab117994)测量了烯醇酶-I/G5-树状聚合物/SMTP偶联物的稳定性。简而言之,将样品加入含有Eno1特异性的单克隆小鼠抗体的微平板中。将微平板在室温下孵育2小时,并将Eno1免疫捕获在微平板的孔内。洗涤微平板的孔以除去所有其他酶。通过按照在包括丙酮酸激酶(PK)、乳酸脱氢酶(LDH)以及所需底物2-磷酸-D-甘油酸(2PG)和NADH的分析缓冲液中的NADH消耗来测定Eno1活性。Eno1将2PG转化成磷酸烯醇丙酮酸,其通过PK转化成丙酮酸。丙酮酸通过LDH转化成乳酸,并且这种反应需要NADH。作为340nm处吸光度的下降来监测NADH的消耗。
使用上述分析测量了不同时间点在不同温度下储存的烯醇酶-I/G5-树状聚合物/SMTP偶联物的活性。选择500ng的Eno1浓度用于测试,因为这个浓度落入分析试剂盒的动态范围的中间。制备了两个不同组的溶液。一组(对照)仅含有Eno1(即,未偶联的Eno1),而另一组含有Eno1/G5-树状聚合物/SMTP混合物。然后将这些混合物保持在-80℃、-20℃、4℃、22℃和37℃。结果显示出在第一周中,全部样品是有活性的,并且Eno1/G5-树状聚合物/SMTP偶联物看来具有略高于单独的Eno1的活性。然而,溶液的活性,无论是否它们含有树状聚合物,在接下来的两周中稳定地降低。到第3周,储存在4℃、22℃和37℃下的溶液未显示出活性,而储存在-80℃和-20℃的溶液显示出显著的稳定性。在研究结束时(第10周),保持在-80℃的Eno1/G5-树状聚合物/SMTP溶液保留约90%的活性,而单独的Eno1仅有35%活性。另一方面,保持在-20℃的Eno1/G5-树状聚合物/SMTP溶液为约24%活性的,而储存在-20℃的单独Eno1无活性(图9)。
实施例6-使用G5 PAMAM树状聚合物的体内Eno1靶向研究
使用之前实施例中提供的方法制备了含有Eno1的可检测地标记的PAMAM树状聚合物并在皮下注射后分析在小鼠中的组织分布。具体地,在注射前72小时,给小鼠饲喂无苜蓿食物以限制背景荧光。给小鼠皮下注射3μg ENO1/小鼠,总共150μl(75μl左侧,75μl右侧)。复合物中树状聚合物与Eno1的摩尔比为5:1。注射后1、4和24小时,将动物处死、去皮并取出器官准备用于LI-COR成像。结果显示于图10A中。
如所示的,在1小时时,观察到了Eno1-PAMAM树状聚合物的总体全身分布。4小时后,观察到了Eno1-PAMAM树状聚合物在肝脏、肾脏和皮下脂肪以及在上部躯体中的明显累积。24小时后,Eno1-树状聚合物基本上清除,并且基本上在肝脏和肾脏中观察到。
使用骨骼肌靶向的含有SMTP“ASSLNIA”的Eno1-PAMAM树状聚合物复合物进行了追踪研究。使用之前实施例中提供的方法制备了含有Eno1和SMTP的可检测地标记的PAMAM树状聚合物复合物((烯醇酶-Vivo Tag680xl)-(G5-SMTP))。复合物中树状聚合物与SMTP的摩尔比为1:1。基本上按照以上所述的进行了实验。以50μg/kg体重的剂量施用了骨骼肌靶向的Eno1-PAMAM树状聚合物复合物。在注射1hr后获取了图10B中的这些图像。心脏以外的器官保留在体内。如可以容易地观察到的,肌肉靶向Eno1树状聚合物复合物靶向骨骼肌而不是心脏。这些结果证明了骨骼肌靶向Eno1-PAMAM树状聚合物复合物可以用于将Eno1递送至骨骼肌细胞。
实施例7-用肌肉靶向Eno1在膳食诱导肥胖症(DIO)小鼠中治疗葡萄糖不耐性
膳食诱导肥胖雄性C57BL/6J小鼠(12周大)和对照瘦小鼠(12周大)获自Jackson实验室(Bar Harbor,ME)并且最初4-5只/笼圈养在22℃下,使用12:12hr白天-黑夜循环。在处理前将小鼠在动物实验设施中适应一周并对DIO组维持高脂肪膳食(Research Diets Cat#:D12492;60kcal%脂肪、20kcal%蛋白和20kcal%碳水化合物)或对瘦组维持低脂肪膳食(10%kcal%脂肪)。
在13周大开始,所有小鼠接受每日皮下注射盐水或具有G5树状聚合物、骨骼肌靶向肽(SMTP)和纯化Eno1(50μg/kg体重)的组合的不同复合物,持续4周。在实验的处理部分的4周过程中,每周进行了腹膜内葡萄糖耐量测试(IPGTT)。在处理期过程中,每周测量体重、餐后血糖和空腹血糖。处理组如下所示:
1.LFD-瘦对照-无注射
2.HFD-盐水对照(体积等同于G5+SMTP+Eno1)
3.HFD-只有G5(等同于50μg/kg的G5+SMTP+Eno1)
4.HFD--G5+SMTP(等同于50μg/kg的G5+SMTP+Eno1)
5.HFD--G5+Eno1(50μg/kg体重)
6.HFD--G5+SMTP+Enol(50μg/kg体重)
复合物中树状聚合物与Eno1的摩尔比为5:1,复合物中树状聚合物与SMTP的摩尔比为1:1,并且树状聚合物是乙酰化的。来自该研究的结果提供于图11、12、13、14和15中。
在这个小群组中,发现没有治疗方案在研究过程中的任何时间对DIO小鼠的体重具有显著影响(参见图11)。
用单剂量的树状聚合物结合的肌肉靶向Eno1处理小鼠证明了在最早测试时间点对血糖水平具有作用。如图12中所示的,在施用50μg/kg的G5+SMTP+Eno1后一小时,与盐水对照相比观察到血糖的降低,在4小时时观察到最大降低。在单次注射后24小时时不再观察到作用。
在开始施用树状聚合物结合的肌肉靶向Eno1后一周时,用Eno1树状聚合物SMTP复合物(DIO烯醇酶-1+NP+SMTP)处理的DIO小鼠中的葡萄糖耐量显著低于用单独的树状聚合物SMTP复合物(DIO NP+SMTP)处理的DIO小鼠中的葡萄糖耐量(参见图13A和13B)。
在开始施用树状聚合物结合的肌肉靶向Eno1后两周时,DIO小鼠中的葡萄糖耐量仍然显著提高(参见图6C和6D)。葡萄糖耐量的提高依赖于树状聚合物复合物中Eno1的存在(DIO G5+SMTP vs.DIO Eno1G5+SMTP,p=5.7×10-5,p=0.002)。在单次注射后23小时不再观察到作用(数据未显示)。
在第1和第2周时观察到的G5+SMTP+Eno1处理的有益作用持续至第4周(参见图14A和14B)。具体地,DIO Eno1G5+SMTP处理小鼠中的葡萄糖耐量与瘦小鼠中的相似。葡萄糖耐量的提高是显著的并且依赖于树状聚合物复合物中Eno1的存在(DIO G5+SMTP vs.DIO Eno1G5+SMTP,p=0.0017)。在单次注射后23小时不再观察到作用(数据未显示)。
这些结果表明树状聚合物结合的肌肉靶向Eno1在提高膳食诱导肥胖症模型中的葡萄糖耐量中是有效的,并且G5+SMTP+Eno1在使膳食诱导肥胖症小鼠模型中的血糖正常化是有效的。这些结果证明了Eno1在升高的血糖、葡萄糖不耐性和糖尿病,特别是2型糖尿病的治疗中是有用的。
按照以上所述的将小鼠再处理4周(总共8周处理),并且测定了瘦小鼠、膳食诱导肥胖症(DIO)小鼠、用G5-树状聚合物处理的DIO小鼠和用Eno1/G5-树状聚合物/SMTP复合物处理的小鼠在处理8周后的血清乳酸盐水平。使用来自Biovision(Milpitas,CA)的乳酸盐比色分析试剂盒测量了血清中的乳酸盐水平。如图15中所示,Eno1/G5-树状聚合物/SMTP复合物显著降低了乳酸盐血清水平。这个结果表明用Eno1/G5-树状聚合物/SMTP复合物处理的DIO小鼠中观察到的降低的葡萄糖水平是由于提高的葡萄糖氧化,而不是糖酵解至乳酸盐的分流。这将最小化乳酸盐酸中毒的不利影响。
实施例8-用肌肉靶向Eno1在肥胖的遗传模型db/db小鼠中治疗葡萄糖不耐性
雄性肥胖和糖尿病db/db小鼠(雄性BKS.Cg-m+/+Leprdb/J)小鼠获自商业零售商。所有小鼠2-3只/笼圈养在22℃下,使用12:12hr白天-黑夜循环,并且在动物实验设施中饲喂标准饲料适应3周。在8周大时,通过皮下施用(n=6/组),每日一次施用盐水或具有G5树状聚合物、骨骼肌靶向肽(SMTP)和纯化Eno1组合的不同复合物的以下皮下注射。处理组如下:
1.使用盐水注射的db/db
2.使用G5+SMTP(体积等同于25ug/kg剂量的Eno1+G5+SMTP)的db/db
3.使用Eno1(25ug/kg体重)+G5+SMTP的db/db
4.使用Eno1(50ug/kg体重)+G5+SMTP的db/db
复合物中树状聚合物与Eno1的摩尔比为5:1,而复合物中树状聚合物与SMTP的摩尔比为1:1,并且树状聚合物是乙酰化的。
在第7天,小鼠施用合适的药剂并在按照以上实施例所述的施用IPGTT之前返回笼子6小时而没有食物。结果显示于图16A和16B中。如可以容易地观察到的,用Eno1+G5+SMTP处理小鼠导致葡萄糖负荷后葡萄糖耐量提高,与用G5+SMTP处理的小鼠相比用Eno1(50ug/kg体重)+G5+SMTP处理的小鼠中观察到葡萄糖清除的显著提高(p=0.015)。
使用上述所列每个处理组中六只小鼠中的三只继续研究。小鼠施用所示药剂再一周(总共2周)。测试了Eno1对降低餐后血糖的作用。具体地,在不控制食物摄入的情况下,在施用活性剂后立即评价小鼠中的血糖水平两小时。如所示的,Eno1(50ug/kg体重)+G5+SMTP的施用证明了降低餐后血糖并且导致与G5+SMTP的施用相比在施用后30分钟血糖的统计学显著的降低。然而,Eno1+G5+SMTP处理后30分钟观察到的降低的血糖在Eno1注射后24小时时没有维持(图18)。
因此,还在db/db小鼠中评价了每日两次给药Eno1+G5+SMTP对血糖水平的作用。每日两次通过皮下注射来给予处理,一次在早晨和一次在晚上,持续四周。处理组如下:
1.PBS
2.100μg/kg体重Eno1+G5+SMTP
3.200μg/kg体重Eno1+G5+SMTP
Eno1+G5+SMTP复合物中树状聚合物与Eno1的摩尔比为5:1,而Eno1+G5+SMTP复合物中树状聚合物与SMTP的摩尔比为1:1,并且树状聚合物是乙酰化的。
处理组2的总日剂量为200μg/kg体重Eno1+G5+SMTP,和处理组3的总日剂量为400μg/kg体重Eno1+G5+SMTP。在不控制食物摄入的情况下,在晚上注射后16小时(即在早晨注射前)评价了小鼠中的餐后血糖水平。如图19中所示,每日两次注射200μg/kg体重Eno1+G5+SMTP相对于对照PBS处理降低了餐后血糖水平。
因此,用Eno1G5+SMTP处理小鼠显示出使db/db小鼠中的葡萄糖反应标准化。实施例7和8中所述的数据一起证明了Eno1在提高2型糖尿病的诱导模型和遗传模型中的葡萄糖耐量都是有效的。
实施例9-含树状聚合物的乙酰化vs.非乙酰化SMTP的比较毒性
使用肌氨酸激酶和半胱天冬酶3分析比较了含有乙酰化和非乙酰化树状聚合物的SMTP的毒性。给小鼠注射十字孢碱(staurosporine)(阳性对照)、十字孢碱+抑制剂(阴性对照);G5 PAMAM树状聚合物、SMTP-G5 PAMAM树状聚合物和乙酰化SMTP-G5 PAMAM树状聚合物中的一种。复合物中树状聚合物与Eno1的摩尔比为5:1,而复合物中树状聚合物与SMTP的摩尔比为1:1。注射后,收集样品并使用商业上可购得的试剂盒测定作为总细胞裂解物的百分比的肌氨酸激酶水平和半胱天冬酶3活性。结果显示于图20中。如图20中所示,1uM和3uM浓度的G5 PAMAM树状聚合物的施用以及3uM浓度的SMTP-G5 PAMAM树状聚合物的施用导致肌氨酸激酶活性的显著提高。使用乙酰化SMTP-G5 PAMAM树状聚合物观察到没有这种作用。相似地,3uM G5 PAMAM树状聚合物和SMTP-G5 PAMAM树状聚合物施用后,观察到半胱天冬酶3活性的显著提高。然而,施用乙酰化SMTP-G5 PAMAM树状聚合物时,没有观察到半胱天冬酶3活性的提高。这些结果证明了SMTP-G5 PAMAM树状聚合物的乙酰化降低了毒性。
实施例10-在2型和1型糖尿病的遗传和诱导模型中用肌肉靶向Eno1治疗葡萄糖不耐性
获得或产生雄性肥胖小鼠、糖尿病db/db小鼠(雄性BKS.Cg-m+/+Leprdb/J)小鼠、NOD1小鼠或链脲霉素处理的小鼠。所有小鼠2-3只/笼圈养在22℃下,使用12:12hr白天-黑夜循环,并且在动物实验设施中饲喂合适饲料(即,用于肥胖小鼠的高脂肪膳食,用于其他小鼠的正常饲料)适应至少1周。在合适年龄时,通常约8周大时,每日施用盐水或具有G5树状聚合物、骨骼肌靶向肽(SMTP)和纯化Eno1(25或50μg/kg体重)的组合的不同复合物的皮下注射,持续1-2周。可以将如上所述的可植入泵(例如,ALZET泵)用于每日或持续的施用。或者,可以在不同配方中通过肌肉内施用药剂。通常以低于皮下注射的频率来进行肌肉内注射(例如,通常约每周一次)。
在2周时间过程中,进行了腹膜内葡萄糖耐量测试(IPGTT),并监控空腹和餐后血糖(随机地或在药剂施用后的时间过程中)。在处理期间,每周测量体重。处理组包括至少一个对照(例如,1或2)和至少一个来自以下所示列表中的Eno1处理:
1.盐水注射
2.G5+SMTP(体积等同于25ug/kg体重/天的Eno1+G5+SMTP)
3.Eno1(25ug/kg体重/天)+G5+SMTP
4.Eno1(50ug/kg体重/天)+G5+SMTP
5.Eno1(25ug/kg体重/天)
6.Eno1(50ug/kg体重/天)
提供的剂量是示例性的并且不认为是限制性的。
用Eno1 G5+SMTP处理小鼠证明使糖尿病小鼠中的葡萄糖反应正常化。
实施例11-小鼠中血糖水平和葡萄糖反应的评价
以上描述了腹膜内葡萄糖耐量测试(IPGTT)并常规地用于评价葡萄糖耐量和胰岛素反应。以下提供了可以用来证实Eno1在正常化血糖和胰岛素反应中的功效的其他示例性方法。以下还提供了评价身体组成和代谢的方法。
腹膜内胰岛素耐量测试(IPITT)
在禁食1小时后进行胰岛素耐量测试(ITT)来评价丙酮酸代谢。测定了初始的血糖水平,接着注射(ip)人胰岛素(1-2U/kg;Humulin R;Eli Lilly,Indianapolis,IN)。在胰岛素注射后15、30、60、90和120min时,如上所述从尾静脉测量血糖水平。由于接受高脂肪膳食的小鼠中肝胰岛素抗性的发作,胰岛素注射量通过胰岛素反应根据经验确定。
腹膜内丙酮酸耐受测试(IPPTT)
在禁食6h后给予丙酮酸耐受试验。测定了初始血糖水平,接着注射(ip)溶解于盐水中的丙酮酸(2g/kg;Sigma,St.Louis,MO)。在丙酮酸注射后15、30、60、90和120min,如上所述从尾静脉测量血糖水平。计算测试过程中的曲线下面积(AUC)。
餐后血糖水平
从自由进食的小鼠获得血液样品(随机地或在在目标药剂施用后限定的时间或时间间隔)。测量血糖水平。
空腹血糖水平
在禁食预定时间段(通常约6-8小时)后,在目标药剂施用后的限定时间或时间间隔从小鼠获得血液样品。测量血糖水平。
指示剂水平的评价来评价血糖水平
用本发明的一种或多种药剂和合适的对照处理1型或2型糖尿病的小鼠模型。监测HbA1c和/或Eno1蛋白和/或RNA的水平来测定持续时间段内的血糖水平。
双能X-射线吸收测定法(DEXA)
按照制造商推荐的程序,使用LUNAR小鼠光密度计通过双能x-射线吸收测定法(DEXA)扫描来测定不同处理组的身体质量组成。记录并分析了瘦体质量、脂肪体质量、总身体组织重量、骨密度和骨矿物质含量。
综合实验室动物监控系统(CLAMS)
使用CLAMS(Columbus Instruments,Columbus,OH,USA)代谢监测笼来同时监测水平和垂直活动、进食和饮水、氧消耗和CO2产生。ASO注射的和对照小鼠单独地置于CLAMS笼中并在笼中适应1-2天后监测4-天时间。在禁食和进食条件下记录各种参数。作为累积数据直接测量食物和水消耗。每小时文件显示了针对每个参数的所有测量:消耗的氧的体积,ml/kg/h(VO2),产生的二氧化碳的体积,ml/kg/h(VCO2),呼吸交换率,热量(kcal/h),累积的食物(g),累积的饮水(g),XY总活动(全部水平束中断计数),XY走动活动(最少三个不同的、连续水平束中断计数)和Z活动(全部垂直束中断计数)。在30-s取样时间段中记录数据。通过用瘦体质量标准化来分析CLAMS数据。
实施例12-Eno1对人骨骼肌肌管中胰岛素刺激的p-Akt的作用
在具有或不具有胰岛素处理的情况下在人骨骼肌肌管的细胞培养物中测定了纯化的Eno1对胰岛素刺激的p-Akt(S473)蛋白水平的作用。通过ELISA测量p-Akt蛋白水平。如图21中所示,在Enol处理不存在的情况下,胰岛素处理提高了p-Akt蛋白水平,且胰岛素对p-Akt蛋白水平的作用在具有或不具有Eno1处理的情况下是相似的。这些结果显示Eno1不影响p-Akt蛋白水平的胰岛素刺激,表明Eno1对肌细胞中的葡萄糖摄取的作用与胰岛素无关并且将在呈现胰岛素抵抗的细胞中出现。
实施例13-Eno1与人骨骼肌肌管中提高的葡萄糖流量相关
葡萄糖转运蛋白1(Glut1)和葡萄糖转运蛋白4(Glut4)涉及葡萄糖跨越质膜的转运,并且是骨骼肌内的主要促进性葡萄糖转运蛋白(Jones等,1998,Journal of Applied Physiology,Vol.84,pp.1661-1666)。Glut4负责胰岛素调节的至细胞中的葡萄糖转运。肌细胞生成素是可以参与调节Glut1和Glut4表达的肌肉特异性转录因子(参见Jones等,上文)。己糖激酶2(HK2)将葡萄糖磷酸化以形成葡萄糖-6-磷酸(G6P)并且是骨骼肌中的主要己糖激酶。
在具有或不具有Eno1处理的情况下,在人骨骼肌肌管细胞培养物中测量了Glut1、Glut4、HK2和肌细胞生成素的表达。用按照实施例2中所述制备的纯化Eno1处理肌管。通过定量PCR测定了Glut1、Glut4、HK2和肌细胞形成素mRNA水平。通过MS蛋白质组学分析测定了Glut1蛋白水平。如图22A和22B中所示,Eno1处理提高了Glut1、Glut4和HK2mRNA水平,以及Glut1蛋白水平。因为这些蛋白质参与葡萄糖转运和代谢,这些结果表明Eno1处理与骨骼肌中提高的葡萄糖流量相关。
为了进一步研究Eno1在葡萄糖流量中的作用,在具有或不具有纯化Eno1处理的情况下测量葡萄糖饥饿和葡萄糖刺激的人骨骼肌肌管中G6P和磷酸烯醇丙酮酸(PEP)水平。通过在无葡萄糖DMEM中孵育肌管15min来进行葡萄糖饥饿。通过用5mM葡萄糖处理肌管15min进行葡萄糖刺激。使用来自Biovision的分析试剂盒(Milpitas,CA;Cat.No.K657-100和K365-100)测量了G6P和PEP水平。如图23和24中所示,Eno1处理提高了葡萄饥饿和葡萄糖刺激的人骨骼肌肌管中的G6P和PEP水平,进一步表明Eno1处理与骨骼肌中提高的葡萄糖流量相关。
实施例14-Eno1作用方式
为了进一步研究在葡萄糖摄取中的Eno1作用方式,测量了人骨骼肌肌管细胞中的氧消耗率(OCR)和细胞外酸化率(ECAR)。OCR是线粒体呼吸的指示,而ECAR是糖酵解的指示。
对于OCR实验,将各种化合物按序添加到细胞以诱导OCR的变化。例如,加入棕榈酸盐和羰基氰化物m-氯苯基腙(CCCP,氧化磷酸化的解偶联剂)以提高OCR,并加入乙莫克舍(脂肪酸氧化抑制剂)以降低OCR。将KHB缓冲剂(pH 7.4)加入每个孔中,并每3min进行测量,具有2min的测量间混合。按序注射BSA偶联的棕榈酸盐(终浓度200mmol/L)、CCCP(终浓度2μM)和乙莫克舍(终浓度50mmol/L)。如图25中所示,Eno1处理提高了OCR。这些结果表明Eno1处理与人骨骼肌肌管中提高的线粒体游离脂肪酸氧化相关。
对于使用葡萄糖作为底物的ECAR实验,使用无碳酸钠和葡萄糖/丙酮酸的DMEM培养基。按序注射葡萄糖、寡霉素和2-DG以获得25mmol/L的终浓度。如图26中所示,Eno1处理提高了ECAR,表明Eno1处理与提高的糖酵解活性和能力相关。
为了测定用Eno1处理的人骨骼肌肌管的线粒体含量,用500ug/ml或1000μg/ml Eno1处理肌管48小时,并随后加入Mitotracker green(Invitrogen),一种绿色荧光线粒体染料。15min染色后,将肌管胰蛋白酶化、洗涤并接受流式细胞术分析以测定线粒体含量。如图27A中所示,Eno1处理没有影响线粒体含量。
还检测了上述Eno1处理的人骨骼肌肌管中的线粒体ROS。通过用二氢若丹明123(Life Technologies)处理细胞来测定线粒体ROS,二氢若丹明123是一种不带电的和非荧光的反应性氧物质(ROS)指示剂,其可以被动跨膜扩散,在其中氧化成阳离子若丹明123(其定位于线粒体中并呈现出绿色荧光)。然后将肌管胰蛋白酶化、洗涤并接受流式细胞术分析。用Eno1处理人骨骼肌肌管没有影响线粒体的反应性氧物质产生(图27B)。
这些结果表明Eno1的作用方式不是由于线粒体含量或ROS产生的变化。
为了进一步研究Eno1的作用方式,在用0、500或1000μg/ml Eno1处理的基础的和血清饥饿的人骨骼肌肌管中测量了非磷酸化的5’AMP激活的蛋白激酶(AMPK)和磷酸化AMPK(pAMPK)水平。用含有2%马血清的正常分化培养基处理基础人骨骼肌肌管,而血清饥饿的肌管在肌管裂解前用含有0.5%BSA的无血清DMEM饥饿3小时。使用对于激酶的磷酸化或非磷酸化形式特异性的抗体通过Western印迹测定了AMPK和pAMPK水平。将对于核纤层蛋白(Lamin)A/C特异性的抗体用于证实样品之间均匀的加载。如图28A和28B中所示,Eno1处理没有影响基础或血清饥饿肌管中的pAMPK水平。AMPK激活或磷酸化是调节骨骼肌中的葡萄糖摄取的主要非胰岛素依赖性途径之一,例如,在肌肉收缩过程中。因此,Eno1对pAMPK水平的作用的缺乏表明超越了常规信号转导的Eno1的新作用方式。
实施例15-人骨骼肌肌管中的Eno1结合伴体
为了进一步研究Eno1的作用方式,在未处理的人骨骼肌肌管(含有内源性Enol)和用50μg/ml或100μg/ml 6X组氨酸标记的外源性Enol处理的人骨骼肌肌管中比较了Eno1的结合伴体。使用Eno1特异性的抗体在未处理肌管中免疫沉淀内源性Eno1。使用6X组氨酸标签抗体将外源性Eno1免疫沉淀。通过定量蛋白质组学鉴定内源性Eno1和外源性Eno1的结合伴体,并且通过Western印迹和/或反向免疫沉淀来证实结合伴体的性质。
烟酰胺磷酸核糖基转移酶(Nampt)被鉴定为内源性和外源性Eno1两者的结合伴体。Nampt催化从烟酰胺合成烟酰胺单核苷酸(NMN)并且参与肌肉收缩和分泌。Eno1可以与作为糖酵解复合物的部分的Nampt相互作用,如图29中所示。
实施例16-Eno1和Nampt的相互作用
在4天分化后,在分化培养基中用500ug/ml或1000μg/ml Enol处理48小时的人骨骼肌肌管中测定了Nampt活性。将肌管裂解物使用IgG或来自Cyclex(Nagano,日本)的抗Nampt抗体(Clone AF-1E12)进行免疫沉淀。将免疫沉淀的肌管裂解物使用Cyclex Nampt活性分析试剂盒(#CY-1251)进行Nampt活性分析。如图30中所示,Eno1处理提高了Nampt活性。Eno1处理还提高了人骨骼肌肌管中Nampt(eNampt)的分泌(数据未显示)。
在已经血清饥饿3小时并随后用来自Abcam(Cambridge,MA)的重组细胞外Nampt(eNampt)处理的人骨骼肌肌管中测量2-DG摄取。使用来自Abcam的荧光葡萄糖摄取分析试剂盒(Cat.No.ab136956)测量了2-DG摄取。如图31中所示,eNampt的添加提高了2-DG摄取。
为了测定Nampt在Eno1诱导的葡萄糖摄取中的作用,如上所述用Eno1处理人骨骼肌肌管48小时,并在Eno1处理开始后24小时加入Nampt抑制剂FK866,总的FK866处理时间为24小时。使用上述Abcam葡萄糖摄取分析试剂盒,在3小时血清饥饿后测量了2-DG摄取。如图32中所示,通过FK866的Nampt抑制消除了Eno1诱导的葡萄糖摄取。这个结果表明Nampt在Eno1诱导的葡萄糖摄取中起着作用。
等同
本领域技术人员将认识到或仅使用常规实验能够获知本文中所述的特定实施方案和方法的许多等同物。这样的等同物打算包括在以下权利要求的范围中。
按引用并入
将本申请中提及的每篇参考文献、专利、专利申请和GenBank编号由此按引用并入,如同每篇参考文献注明单独并入。
序列描述
- 还没有人留言评论。精彩留言会获得点赞!