用于过继细胞疗法的肿瘤浸润淋巴细胞的制作方法
本申请要求2014年3月20日提交的美国临时申请No.61/955,970和2014年3月31日提交的美国临时申请No.61/973,002的权益,所述临时申请在此通过引用整体并入本文。
背景
用肿瘤浸润淋巴细胞(TIL)进行的过继细胞疗法(ACT)是一种有前途形式的基于T细胞的免疫疗法。TIL的制备涉及手术切除和从黑色素瘤肿瘤扩增TIL。在足够的TIL扩增后,患者经历淋巴细胞消除性化学疗法,TIL过继转移,然后高剂量IL-2。美国国家癌症研究所(National Cancer Institute)的手术部门已经开发了针对转移性黑素瘤的这种疗法,且报道了在经治疗的患者中约50%响应率,其中~20%的患者获得持久的完全响应(Rosenberg SA,等Clinical cancer research:an official journal of the American Association for Cancer Research.2011 17(13):4550-7)。对ACT响应令人印象深刻的持久性是该治疗的标志并且看起来优于现有的黑素瘤治疗。ACT取决于收集前T细胞向肿瘤内的浸润、TIL的成功离体扩增以及转移后有效的抗肿瘤效应子功能。尽管TIL ACT对黑素瘤是有效的,但持久的响应率还需要改进。缩短初始TIL生长扩增期且改善经扩增的TIL的肿瘤特异性可增加用自体TIL治疗的患者体内的响应率。
概述
公开了用于过继细胞疗法(ACT)中所用的肿瘤浸润淋巴细胞的离体扩增的组合物和方法。在一些实施方案中,所述方法涉及培养淋巴细胞以便在培养基中产生经扩增的淋巴细胞,所述培养基包含有效改善所述经扩增的淋巴细胞的肿瘤-特异性的量的toll样受体(TLR)激动剂。在一些实施方案中,所述方法涉及培养淋巴细胞以便在包含刺激性肽或拟肽的培养基中产生经扩增的淋巴细胞。在一些实施方案中,拟肽是类肽或肽-类肽杂合体。在一些实施方案中,所述类肽或肽-类肽杂合体由烃钉稳定化。
还公开了使用由所公开的方法扩增的肿瘤浸润淋巴细胞治疗癌症的方法。在一些实施方案中,所述方法涉及从受试者获得自体肿瘤浸润淋巴细胞、在包含toll样受体(TLR)激动剂的培养基中培养淋巴细胞以便产生经扩增的淋巴细胞、用非清髓性淋巴细胞消除性化学疗法治疗受试者以及向哺乳动物施用经扩增的淋巴细胞。
在一些实施方案中,所述癌症是实体肿瘤。在一些情况下,所述癌症是黑素瘤、卵巢癌、乳腺癌和结直肠癌。所述癌症可为转移性的、复发性的或其组合。
在一些实施方案中,TLR激动剂是选自由TLR1、TLR2、TLR3、TLR4和TLR9组成的组的TLR的配体。例如,TLR激动剂可为选自由Pam3CSK4、Pam3CSK4、聚I:C、Ribomunyl和CpG ODN组成的组的配体。
还公开了鉴定用于ACT中所用的肿瘤浸润淋巴细胞的离体扩增的试剂的组合物和方法。所述方法可涉及使肿瘤浸润淋巴细胞与来自的肽或拟肽文库的候选肽或拟肽接触,用于选择性结合肿瘤浸润淋巴细胞的能力。在一些实施方案中,拟肽是类肽或肽-类肽杂合体。在一些实施方案中,类肽或肽-类肽杂合体由烃钉稳定化。所述方法还可涉及筛选结合肽或拟肽对肿瘤浸润淋巴细胞增殖的作用。在一些实施方案中,鉴定增加肿瘤浸润淋巴细胞增殖的候选肽或拟肽鉴定了用于ACT中所用的肿瘤浸润淋巴细胞的离体扩增的试剂。通过这些方法鉴定的试剂可用于扩增ACT中所用的肿瘤浸润淋巴细胞。
本发明的一个或多个实施方案的详情示于以下附图和描述中。本发明的其它特征、目标和优势将根据描述和附图及根据权利要求书将显而易见。
附图描述
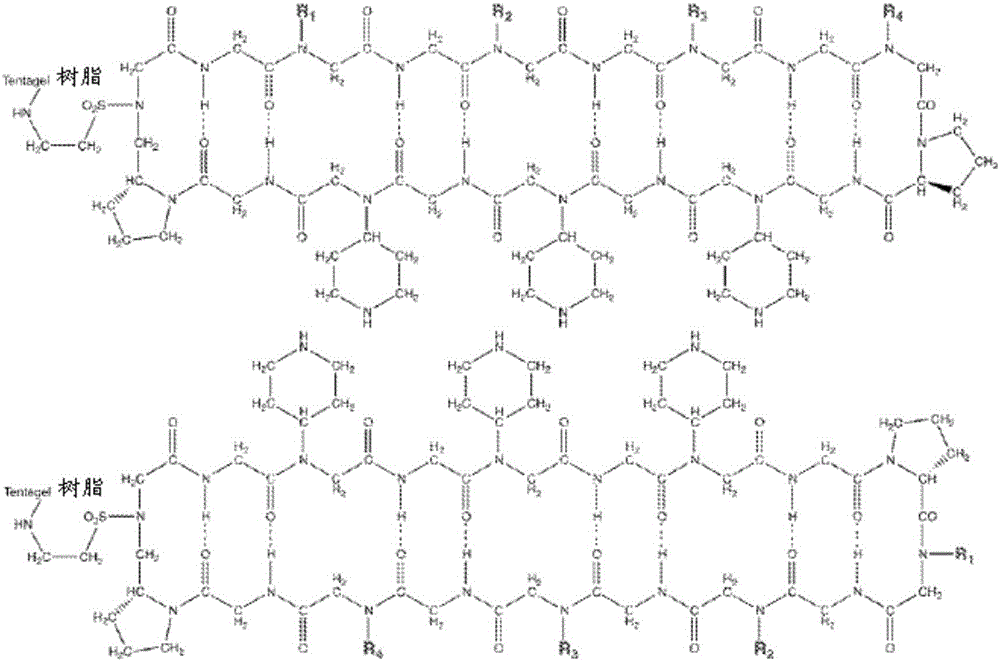
图1A至1D显示了类肽-体的实例。
图2显示了用于制备包含结合至树脂的接头以及包含类肽-类肽序列的第二接头的类肽-体的示意图。
图3显示了用于制备包含结合至树脂的接头以及为β-转角启动子的第二接头的类肽-体的示意图。
图4A至4C显示了经装订的类肽-肽杂合体(stapled peptoid-peptide hybrid)的实例。
图5显示了定位文库扫描板的实例。
图6显示了使用间二甲苯基基团使环状β-发夹状类肽-肽杂合体支架稳定化的反应方案的实例。
图7显示了通过装订在更邻近的肽侧链上的炔丙基侧链使环状β-发夹状类肽-肽杂合体支架稳定化的反应方案的实例。
图8显示了使用叠氮化物和炔使环状β-发夹状类肽-肽杂合体支架稳定化的反应方案的实例。
图9显示了使用闭环复分解(RCM)使环状β-发夹状类肽-肽杂合体支架稳定化的反应方案的实例。
详述
过继细胞转移(ACT)是一种非常有效形式的免疫疗法,并且涉及将具有抗肿瘤活性的免疫细胞转移至癌症患者体内。ACT是涉及以下的治疗方法:具有抗肿瘤活性的淋巴细胞的体外鉴定、这些细胞的体外大量扩增以及它们向携带癌症的宿主内的输注。用于过继转移的淋巴细胞可源自切除的肿瘤的基质(肿瘤浸润淋巴细胞或TIL)。如果它们经遗传工程化以表达抗肿瘤T细胞受体(TCR)或嵌合抗原受体(CAR)、富含混合的淋巴细胞肿瘤细胞培养物(MLTC)或使用自体抗原呈递细胞和肿瘤来源的肽克隆,则它们还可源自或来自血液。其中淋巴细胞来源于待输注的荷癌宿主的ACT被称为自体ACT。US 2011/0052530涉及用于进行过继细胞疗法以促进癌症消退、主要用于治疗罹患转移性黑素瘤的患者的方法,所述专利通过引用这些方法整体并入。
公开了用于ACT中所用的肿瘤浸润淋巴细胞(TIL)的离体扩增的组合物和方法。在一些实施方案中,所述方法涉及在培养基中培养淋巴细胞以便产生经扩增的淋巴细胞,所述培养基包含有效改善经扩增的淋巴细胞的肿瘤特异性的量的toll样受体(TLR)激动剂。在一些实施方案中,TLR激动剂是选自由TLR1、TLR2、TLR3、TLR4和TLR9组成的组的TLR的配体。例如,TLR激动剂可为选自由Pam3CSK4、Pam3CSK4、聚I:C、Ribomunyl和CpG ODN组成的组的配体。
在其它实施方案中,所述方法涉及在培养基中培养淋巴细胞以便产生经扩增的淋巴细胞,所述培养基包含有效改善经扩增的淋巴细胞的肿瘤-特异性的量的肽或拟肽。在一些实施方案中,拟肽是类肽或肽-类肽杂合体。例如,在一些实施方案中,类肽或肽-类肽杂合体由烃钉稳定化。
类肽部分可提供对蛋白水解耐受,且类肽-肽杂合体的肽部分可提供实现β-发夹状二级结构的能力。这两种贡献可产生用于疗法的良好药物候选物的杂合体,在所述疗法中蛋白水解通常是所述疗法的限制。如本文所公开,这些肽-类肽杂合体还可用于ACT中所用的肿瘤浸润淋巴细胞(TIL)的离体扩增。
肽-类肽杂合体的实例描述于McLaughlin等,WO 2013/192628中,所述专利通过引用本文所述的类肽体文库并入本文。WO 2013/192628中的类肽体是环状类肽-肽杂合体,其可使用配对组合法提供支架文库。环状类肽-肽杂合体可采用β-发夹状二级结构。该环状β-发夹状设计通过两条反平行β-链中肽-类肽亚基的改变产生。例如,所公开的肽-类肽杂合体可具有例如式I中所示的化学结构:
或其药学上可接受的盐或水合物,其中R1-R6独立地是有机基团。
在一些实施方案中,环状类肽-肽杂合体具有式II所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式III所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式IV所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式V所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团;R’是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式VI所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’独立地是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式VII所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’独立地是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式VIII所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’独立地是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式IX所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,环状类肽-肽杂合体具有式X所示的化学结构:
或其药学上可接受的盐或水合物,其中R基团独立地是有机基团、R’是有机基团或者至树脂或其它基质的有机桥接基团,且x是1至3。
在一些实施方案中,至少两条相邻的类肽-甘氨酸序列的R基团是4-哌啶基基团,例如式II的化合物,其中x是2:
上式I至XII的环状类肽-肽杂合体的R基团可具有几乎任何结构,使得其不含破坏环状类肽-肽杂合体内的β折叠结构的互补氢键合的部分。R基团可与氨基酸的侧链、氨基酸的非胺部分或氨基酸经修饰的非胺部分等效。R基团可为糖,诸如单糖或二糖、或脂肪酸、或其经修饰的变型。R基团可为但不限于C1-C12烷基、C1-C12羟基烷基、C1-C12氨基烷基、C1-C12羧酸烷基、C2-C12烷氧基烷基、C2-C12烯基、C2-C12羟基烯基、C2-C12氨基烯基、C1-C12羧酸烯基、C3-C14烷氧基烯基、C6-C14芳基、C6-C14羟基芳基、C6-C14氨基芳基、C6-C14羧酸芳基、C7-C15烷氧基芳基、C4-C14杂芳基、C4-C14羟基杂芳基、C4-C14氨基杂芳基、C4-C14羧酸杂芳基、C5-C15烷氧基杂芳基、C7-C15烷基芳基、C7-C15羟基烷基芳基、C7-C15氨基烷基芳基、C7-C15羧酸烷基芳基、C8-C15烷氧基烷基芳基或这些R基团的任一种的化学转移产物,诸如酯、硫酯、硫醇、酰胺或磺酰胺,其中烷基基团可为直链、支链、多支链、环状或多环状的。例如,R可为伯胺的残基,所述伯胺可为但不限于作为环状类肽-肽杂合体中的类肽N-R单元并入的以下基团:4-氨基哌啶、乙醇胺、烯丙胺、1,4-二氨基丁烷、胡椒基胺、4,(2-氨基乙基)苯、异丁胺、色胺、4-吗啉代苯胺、5-氨基-2-甲氧基吡啶、(R)-甲基苄胺、1-(2-氨基丙基)-2-吡咯烷酮、糠胺、苄胺、4-氯苄胺、4-甲氧基苄胺、甲氧基乙胺、2-氨基己二酸、N-乙基天冬酰胺、3-氨基己二酸、羟基赖氨酸、β-丙氨酸、别-羟基赖氨酸丙酸、2-氨基丁酸、3-羟基脯氨酸、4-氨基丁酸、4-羟基脯氨酸哌啶酸、6-氨基己酸、异锁链素、2-氨基庚酸、别-异亮氨酸、2-氨基异丁酸、N-甲基甘氨酸、3-氨基异丁酸、N-甲基异亮氨酸、2-氨基庚二酸、6-N-甲基赖氨酸、2,4-二氨基丁酸、N-甲基缬氨酸、锁链素、正缬氨酸、2,2'-二氨基庚二酸、正亮氨酸、2,3-二氨基丙酸、鸟氨酸、N-乙基甘氨酸或其经保护的等效物。
在一些实施方案中,类肽-肽杂合体可在诸如树脂的固体载体上产生。然后可从支持树脂上切割杂合体以用于公开的方法中。图1和2示出了为树脂结合的中间体的示例性类肽-肽杂合体。
示例性类肽-肽杂合体
实施方案1:一种具有β-发夹状构象的类肽-肽杂合体,其包含多个交替的类肽-肽序列,其各自具有至少一个类肽残基和氨基酸残基,其中所述类肽-肽序列在多个接头之间形成至少两个反平行β-链,且其中至少一个接头是β-转角启动子。
实施方案2:根据实施方案1所述的杂合体,其中至少一个接头是来自以下结构的接头前体的缩合的氨基酸残基:
其中R’是有机基团或连接至树脂或其它基质的有机桥接基团,且R”是H或羧酸保护基团。
实施方案3:根据实施方案2所述的杂合体,其中R”是叔丁基、烯丙基或苄基。
实施方案4:根据实施方案2所述的杂合体,其中连接至树脂或其它基质的有机桥接基团包括-NH(CH2)2-桥接基团。
实施方案5:根据实施方案1所述的杂合体,其中接头之一是两种肽残基。
实施方案6:根据实施方案1所述的杂合体,其中环状类肽-肽杂合体是:
其中R基团独立地是有机基团、R’独立地为有机基团或连接至树脂的有机桥接基团,且x是1至3。
实施方案7:根据实施方案6所述的杂合体,其中R独立地为C1-C12烷基、C1-C12羟基烷基、C1-C12氨基烷基、C1-C12羧酸烷基、C2-C12烷氧基烷基、C2-C12烯基、C2-C12羟基烯基、C2-C12氨基烯基、C1-C12羧酸烯基、C3-C14烷氧基烯基、C6-C14芳基、C6-C14羟基芳基、C6-C14氨基芳基、C6-C14羧酸芳基、C7-C15烷氧基芳基、C4-C14杂芳基、C4-C14羟基杂芳基、C4-C14氨基杂芳基、C4-C14羧酸杂芳基、C5-C15烷氧基杂芳基、C7-C15烷基芳基、C7-C15羟基烷基芳基、C7-C15氨基烷基芳基、C7-C15羧酸烷基芳基、C8-C15烷氧基烷基芳基或其任何化学转移的结构。
实施方案8:根据实施方案7所述的杂合体,其中经化学转移的结构包括酯、硫酯、硫醇、酰胺或磺酰胺。
实施方案9:根据实施方案6所述的杂合体,其中R独立地为伯胺的残基:4-氨基哌啶;乙醇胺;烯丙胺;1;4-二氨基丁烷;胡椒基胺;4;(2-氨基乙基)苯;异丁胺;色胺;4-吗啉代苯胺;5-氨基-2-甲氧基吡啶;(R)-甲基苄胺;1-(2-氨基丙基)-2-吡咯烷酮;糠胺;苄胺;4-氯苄胺;4-甲氧基苄胺;甲氧基乙胺.2-氨基己二酸;N-乙基天冬酰胺;3-氨基己二酸;羟基赖氨酸;β-丙氨酸;别-羟基赖氨酸丙酸;2-氨基丁酸;3-羟基脯氨酸;4-氨基丁酸;4-羟基脯氨酸哌啶酸;6-氨基己酸;异锁链素;2-氨基庚酸;别-异亮氨酸;2-氨基异丁酸;N-甲基甘氨酸;3-氨基异丁酸;N-甲基异亮氨酸;2-氨基庚二酸;6-N-甲基赖氨酸;2,4-二氨基丁酸;N-甲基缬氨酸;锁链素;正缬氨酸;2,2'-二氨基庚二酸;正亮氨酸;2,3-二氨基丙酸;鸟氨酸;N-乙基甘氨酸;或其任何经保护的等效物。
实施方案10:根据实施方案6所述的杂合体,其中至少一个R是4-氨基哌啶的残基。
实施方案11:根据实施方案1所述的杂合体,其中所有氨基酸残基是甘氨酸残基。
类肽-肽杂合体可通过氨基酸侧链之间交联和/或甘氨酸上的N-取代和/或主链环化进一步稳定化。此类类肽在本文中被称为“装订类肽”;而此类类肽-肽杂合体在本文中被称为“装订类肽-肽杂合体”。
类肽或类肽-肽杂合体的装订涉及侧链-与-侧链键合和/或主链环化以使类肽或类肽-肽杂合体稳定化。因此,本发明将使用稳定化的侧链键合使肽稳定的方法延伸至使类肽或类肽-肽杂合体稳定的方法。
为了本发明的目的,术语“侧链”包括氨基酸上的侧链以及连接至N-取代的甘氨酸的N原子的部分。
可设计若干种可能的侧链-与-侧链键合(在下文中被称为分子内交联)。本发明的类肽或类肽-肽杂合体的两条侧链之间的分子内交联可通过侧链之间的化学反应介导,其还可涉及另外的化学品。
例如,分子内交联可通过化学部分介导,所述化学部分不是侧链的一部分且其中侧链经由化学部分彼此相连。形成分子内交联的化学部分的实例描述于图6-9中。
在一些实施方案中,分子内交联通过RCM(闭环复分解)方法根据美国专利No.5,811,515中所述的Aileron或点击反应(Click reaction)(如铜催化的3+2环加成)建立,所述专利通过引用整体并入本文。通过RCM方法介导的分子内交联的实例描述于图9中。
在另一个实施方案中,两条侧链之间的分子内交联通过例如经由所述侧链上存在的官能团之间的缩合反应化学键的形成建立。缩合反应是一种化学反应,其中两个分子或部分(官能团)经由化学键合并且所述反应涉及一个或多个小分子的损失。可用于产生根据本发明的分子内交联的侧链之间的缩合反应的实例是本领域普通技术人员熟知的,且此类实施方案在本发明的权限内。
用某些分子内交联装订的类肽的另外实例显示于图4A-4C中。
肽内交联的另外实例公开于美国专利No.8,592,377、8,324,428、8,198,405、7,786,072、7,723,469、7,192,713中,所述专利的内容通过引用整体并入本文。本领域普通技术人员可考虑使用这些专利文件中所述的各种交联用于制备装订类肽,并且根据本发明和此类实施方案的经装订的类肽-肽杂合体在本发明的权限内。
因此,本发明提供包含多种N-取代的甘氨酸的经装订的类肽,其中至少两个N-取代的甘氨酸通过分子内交联彼此连接,且其中分子内交联的长度和几何形状为类肽提供稳定性。
在一些情况下,经装订的类肽-肽杂合体可包含多个氨基酸和多个N-取代的甘氨酸,其中多个氨基酸和多个N-取代的甘氨酸的至少两个残基通过分子内交联彼此连接,并且其中分子内交联的长度和几何形状为类肽-肽杂合体提供稳定性。
在一个实施方案中,两个N-取代的甘氨酸残基或两个氨基酸残基通过交联彼此连接。在另一个实施方案中,N-取代的甘氨酸残基通过交联连接至氨基酸残基。
在另一个实施方案中,装订类肽-肽杂合体是环状类肽-肽杂合体。环状类肽-肽杂合体包含各自具有至少一个类肽残基和氨基酸残基的多条交替的类肽-肽序列,其中所述类肽-肽序列来自至少两条反平行β-链。
在一些实施方案中,分子内交联是完全烃交联。
在一些实施方案中,类肽或类肽-肽杂合体包含超过一个分子内交联,例如两个、三个或四个分子内交联。
在一些实施方案中,所述交联在两个或多个氨基酸残基或者位于β折叠同侧的N-取代的甘氨酸残基之间,从而为类肽或类肽-肽杂合体提供稳定性。在另一个实施方案中,所述分子内交联在两个或多个氨基酸残基或者位于β折叠残基上的N-取代的甘氨酸残基之间,从而为类肽或类肽-肽杂合体提供稳定性。
在一些实施方案中,侧链可选自环状或非环状、支链或非支链、取代的环状或非环状、支链或非支链、取代的或未取代的亚烷基;环状或非环状、支链或非支链、取代的或未取代的亚烯基;环状或非环状、支链或非支链、取代的或未取代的亚炔基;环状或非环状、支链或非支链、取代的或未取代的杂亚烷基;环状或非环状、支链或非支链、取代的或未取代的杂亚烯基;环状或非环状、支链或非支链、取代的或未取代的杂亚炔基;取代的或未取代的亚芳基;取代的或未取代的杂亚芳基;或者取代的或未取代的亚酰基(acylene)。
可应用于本发明中的侧链和交联的另外实例公开于例如美国专利No.8,592,377,第37列,第26行至第43列,第14行;美国专利No.8,198,405,第3列,第54行至第10列,第2行及第25列,第14行至第26列,第21行;美国专利No.7,786,072,第5列,第44行至第9列,第43行及第11列,第16行至第12列,第8行;美国专利No.7,723,469,第5列,第30行至第9列,第12行及第24列,第60行至第26列,第3行;及美国专利No.7,192,713,第4列,第26行至第9列,第45行及第11列,第23行至第12列,第18行中。
本发明的经装订的类肽、类肽-肽杂合体和经装订的环状类肽-肽杂合体还可在氨基酸和/或N-取代的甘氨酸残基的侧链中任选地含有取代,其中侧链内的取代进一步使类肽、类肽-肽杂合体和环状类肽-肽杂合体稳定化。可用于本发明中的各种取代的非限制性实例提供于表2中。
肿瘤浸润淋巴细胞(TIL)产生是2步过程:1)前-REP(快速扩增)阶段,其中将细胞生长在诸如RPMI的标准实验室培养基内,并处理TIL w/试剂诸如经辐射的饲养细胞及抗-CD3抗体以获得所需作用;和2)REP阶段,其中将TIL以足够大的培养量扩增以用于治疗患者。REP阶段需要cGMP级试剂和30-40L培养基。然而,前-REP阶段可使用实验室级试剂(假定实验室级试剂在REP阶段被稀释掉),从而使得其更易于并入用于改善TIL产生的替代策略。因此,在一些实施方案中,公开的TLR激动剂和/或肽或拟肽可在前-REP阶段期间被包含在培养基中。
ACT可通过(i)从哺乳动物获得自体淋巴细胞、(ii)培养自体淋巴细胞以产生经扩增的淋巴细胞和(ii)向哺乳动物施用经扩增的淋巴细胞进行。优选地,淋巴细胞是肿瘤来源的,即它们是TIL,且从待处理的哺乳动物分离,即自体转移。
如本文所述的自体ACT还可通过(i)培养自体淋巴细胞以产生经扩增的淋巴细胞;(ii)向哺乳动物施用非清髓性淋巴细胞消除性化学疗法;及(iii)在施用非清髓性淋巴细胞消除性化学疗法之后,向哺乳动物施用经扩增的淋巴细胞进行。自体TIL可获自切除的肿瘤的基质。肿瘤样品获自患者并且获得单一细胞混悬液。所述单一细胞混悬液可以任何适合的方式获得,如机械方式(使用如gentleMACS(TM)Dissociator,Miltenyi Biotec,Auburn,Calif.来分散肿瘤)或酶促方式(如胶原酶或DNA酶)。
淋巴细胞(包括肿瘤浸润淋巴细胞,诸如T细胞)的扩增可通过如本领域已知的多种方法的任一种实现。例如,T细胞可使用非特异性T-细胞受体刺激在饲养淋巴细胞和白细胞介素-2(IL-2)、IL-7、IL-15、IL-21或其组合的存在下快速扩增。非特异性T-细胞受体刺激物可例如包括约30ng/ml OKT3、小鼠单克隆抗-CD3抗体(可获自Ortho-McNeil(R)、Raritan,N.J.或Miltenyi Biotec,Bergisch Gladbach,Germany)。可替代地,T细胞可通过用一种或多种抗原(包括其抗原部分(诸如表位)或癌症细胞,其可任选地从载体表达,诸如人类白细胞抗原A2(HLA-A2)结合肽、如约0.3μΜMART-1:26-35(27L)或gp100:209-217(210M))在T-细胞生长因子(诸如约200-400Ill/ml、诸如300lU/ml IL-2或IL-15(优选IL-2))的存在下体外刺激外周血单核细胞(PBMC)快速扩增。体外诱导的T-细胞通过用脉冲至HLA-A2-表达抗原-呈递细胞上的所述癌症的相同的抗原再刺激快速扩增。可替代地,T-细胞可例如用经辐射的自体淋巴细胞或用经辐射的HLA-A2+同种异体淋巴细胞和IL-2再刺激。
在一些实施方案中,在向哺乳动物施用经扩增的肿瘤浸润淋巴细胞之前向哺乳动物施用非清髓性淋巴细胞消除性化学疗法。淋巴细胞消除的目的是为输注的淋巴细胞腾出空间,特别是通过消除调节性T细胞和其它非特异性T细胞(其竞争内衡细胞因子)。非清髓性淋巴细胞消除性化学疗法可为任何适合的此类疗法,其可通过本领域技术人员已知的任何适当的途径施用。非清髓性淋巴细胞消除性化学疗法可包括例如施用环磷酰胺和氟达拉滨,特别是如果癌症是其可为转移性的黑素瘤的话。施用环磷酰胺和氟达拉滨的优选途径是静脉内。类似地,可施用任何适合剂量的环磷酰胺和氟达拉滨。优选地,施用约40-80mg/kg、诸如约60mg/kg环磷酰胺约两天,之后施用约15-35mg/m2、诸如约25mg/m2氟达拉滨约五天,特别是如果癌症是黑素瘤的话。
经扩增的TIL的特定肿瘤反应性可通过本领域已知的任何方法、如通过在与肿瘤细胞共培养之后测量细胞因子释放(如干扰素-γ)来测试。在一个实施方案中,自体ACT方法包括在快速扩增细胞之前针对CD8+T细胞富集培养的TIL。在于IL-2中培养TIL后,使用例如CD8微珠分离(如使用CliniMACS<plus>CD8微珠系统(Miltenyi Biotec))消耗T细胞的CD4+细胞且富集其CD8+细胞。在该方法的一个实施方案中,向哺乳动物与自体T细胞同时施用或在自体T细胞之后施用促进自体T细胞生长和活化的T-细胞生长因子。T-细胞生长因子可为促进自体T-细胞的生长和激活的任何适合的生长因子。适合的T-细胞生长因子的实例包括白细胞介素(IL)-2、IL-7、IL-15、IL-12和IL-21,其可单独使用或以各种组合使用,诸如IL-2和IL-7,IL-2和IL-15,IL-7和IL-15,IL-2、IL-7和IL-15,IL-12和IL-7,IL-12和IL-15或IL-12和IL2。IL-12是优选的T-细胞生长因子。
优选地,由这些方法产生的经扩增的淋巴细胞作为气管内或静脉内输注施用,其优选持续约30至约60分钟。施用途径的其它实例包括腹腔内、硬膜内和淋巴管内。类似地,可施用任何适合剂量的淋巴细胞。在一个实施方案中,施用约1x 1010个淋巴细胞至约15x 1010个淋巴细胞。
通过所公开的组合物和方法治疗的癌症可为任何癌症,包括任何急性淋巴细胞癌、急性髓细胞样白血病、腺泡状横纹肌肉瘤、骨癌、脑癌、乳腺癌、肛门癌、肛管癌或肛门直肠癌、眼癌、肝内胆管癌、关节癌、颈癌、胆囊癌或胸膜癌、鼻癌、鼻腔癌或中耳癌、外阴癌、慢性淋巴细胞白血病、慢性骨髓癌、宫颈癌、神经胶质瘤、霍奇金氏淋巴瘤(Hodgkin lymphoma)、下咽癌、肾癌、喉癌、肝癌、肺癌、恶性间皮细胞瘤、黑素瘤、多发性骨髓瘤、鼻咽癌、非霍奇金氏淋巴瘤、卵巢癌、腹膜癌、网膜癌和肠系膜癌、舌咽癌、前列腺癌、直肠癌、肾癌、皮肤癌、软组织癌、睾丸癌、甲状腺癌、输尿管癌、尿膀胱癌和消化道癌诸如如食管癌、胃癌(gastric cancer)、胰腺癌、胃癌(stomach cancer)、小肠癌、胃肠道类癌肿瘤、口腔癌、结直肠癌和肝胆癌。
所述癌症可为复发性癌。优选地,所述癌症是实体癌。优选地,所述癌症是黑素瘤、卵巢癌、乳腺癌和结直肠癌,甚至更优选的是黑素瘤,特别是转移性黑素瘤。
定义
术语“受试者”是指为施用或治疗靶标的任何个体。所述受试者可为脊椎动物,例如哺乳动物。因此,所述受试者可为人或兽医患者。术语“患者”是指在如医师的临床医师的治疗下的受试者。
术语“治疗有效的”是指所用的组合物的量是足以改善疾病或病症的一种或多种原因或症状的量。此类改善仅需要减少或改变,而非必然消除。
术语“治疗”是指意图治疗、改善、稳定或预防疾病、病理病状或病症的患者的医学管理。该术语包括积极治疗,即特别针对改善疾病、病理病状或病症的治疗,并且还包括病因治疗,即针对相关的疾病、病理病状或病症的原因去除的治疗。此外,该术语包括姑息治疗,即经设计用于以下目的的治疗:缓解症状、病理病状或病症而非治愈疾病;预防性治疗,即针对使相关疾病、病理病状或病症的发生最小化或者将其部分或完全抑制的治疗;以及支持性治疗,即用于补充针对改善相关疾病、病理病状或病症的另一种特定疗法的治疗。
术语“肽”、“蛋白质”和“多肽”可互换使用以指代包含通过一个氨基酸的羧基基团连接至另一个氨基酸的α氨基基团的两个或多个氨基酸的天然或合成分子。
如本文所用,“拟肽”意指包含正常肽化学的一些改变的肽的模拟物。拟肽通常增强原始肽的一些性质,诸如增加稳定性、增加的功效、增强的递送、增加的半衰期等。基于已知的多肽序列制备拟肽的方法描述于例如美国专利No.5,631,280;5,612,895;和5,579,250中。拟肽的使用可涉及并入非氨基酸残基,其中在给定位置处有非酰胺键连。本发明的一个实施方案是拟肽,其中所述化合物具有用适合的模拟物替换的键、肽主链或氨基酸组分。可为适合的氨基酸模拟物的非天然氨基酸的一些非限制性实例包括β-丙氨酸、L-α-氨基丁酸、L-γ-氨基丁酸、L-α-氨基异丁酸、L-ε-氨基己酸、7-氨基庚酸、L-天冬氨酸、L-谷氨酸、N-ε-Boc-N-α-CBZ-L-赖氨酸、N-ε-Boc-N-α-Fmoc-L-赖氨酸、L-甲硫氨酸砜、L-正亮氨酸、L-正缬氨酸、N-α-Boc-N-δCBZ-L-鸟氨酸、N-δ-Boc-N-α-CBZ-L-鸟氨酸、Boc-p-硝基-L-苯基丙氨酸、Boc-羟基脯氨酸和Boc-L-硫代脯氨酸。
术语“类肽”是指一类拟肽,其侧链附接至肽主链的氮原子,而非α-碳(如它们在氨基酸中一样)。
术语“肿瘤浸润淋巴细胞”或“TIL”是指已经离开血流且迁移至肿瘤内的白细胞。
术语“消退”不一定意指100%或完全消退。相反,存在本领域的普通技术人员认为具有潜在益处或治疗效果的各种程度的消退。术语还涵盖延缓疾病或其症状或疾患的发作。
如本文所用的术语“钉”或“烃钉”是指用于稳定合成肽或拟肽的二级结构的烃。
已描述了本发明的多个实施方法。然而,应理解可进行各种修改而不偏离本发明的精神和范围。因此,其它实施方案在以下权利要求的范围内。
实施例
实施例1:靶向TLR以改善TIL扩增和活性
Toll样受体(TLR)是识别各种各样微生物分子的模式识别受体。结合TLR配体至巨噬细胞和树突细胞(DC)上表达的TLR导致有效的抗原呈递以用于激活T细胞和宿主免疫。在肿瘤环境内,巨噬细胞和DC的功能受到抑制。如本文所公开,该抑制状态可通过施用TLR配体(表1)逆转。添加至TIL培养物的外源性TLR配体可改善DC和巨噬细胞的功能,从而导致TIL扩增增加和肿瘤-特异性免疫应答改善。
表1.TLR受体和配体
为了确定添加至TIL培养物的外源性TLR配体是否能够增加TIL扩增且改善肿瘤-特异性,将新鲜黑色素瘤肿瘤在补充有6000IU/ml IL-2的培养基中切碎成1-2mm2片段。将十二个片段在IL-2中单独培养。将另一组的12个片段用以下TLR配体处理:TLR1/2配体Pam3CSK4(1μg/ml)、TLR3配体聚(I:C)(12.5μg/ml)、TLR4配体Ribomunyl、临床级细菌提取物(1μg/ml)、TLR9配体CpG ODN2006(10ug/ml)。每2-3天用新鲜培养基替换培养基。当TIL达到汇合时,将它们分到新孔内。在培养10天、20天和30天后,记录导致TIL生长的肿瘤片段的总数。此外,从每个片段收集细胞并计数。比较IL-2对照组和TLR-配体处理组的细胞数目。将每个片段的单独的TIL汇集物与自体或HLA-匹配和错配的黑素瘤细胞共培养24小时。收集培养上清液,且通过标准ELISA测量IFN-γ。这些实验的目的是测定添加TLR配体是否导致片段的TIL生长、TIL增殖增加和/或TIL的肿瘤-特异性激活增加。
实施例2:鉴定类肽的TIL增殖和激活
除了TLR激动剂之外,其它共刺激性分子可由TIL表达。类肽文库可经筛选以鉴定导致TIL增殖和激活改善的化合物。以384-孔状格式筛选含有约200,000种化合物的类肽文库。将TIL细胞系用红量子点标记并筛选以鉴定选择性结合红细胞的文库命中物。一旦鉴定了若干种结合类肽,在类肽的存在下检查TIL的增殖。在功能测定中进一步检查导致TIL增殖(刺激性类肽)的类肽。
使用人T细胞系(AS1),测量刺激性类肽对T细胞功能的作用。AS1细胞是表现出针对624黑素瘤细胞系、而非HLA-错配的888黑素瘤细胞系的特异性的激活的人CD8+T细胞。在6000IU/ml IL-2中在增加剂量的刺激性类肽的存在下培养AS1细胞。在第3、7、10、14和21天对细胞计数以确定导致AS1细胞增殖增加的刺激性类肽的剂量。为了确定具有刺激性类肽的培养物是否导致T细胞功能增强,测量IFN-γ(一种由激活的T细胞分泌的细胞因子)。用如上所测定的最佳剂量的刺激性类肽体处理AS1细胞。对照包括仅AS1细胞和用抗-41BB抗体处理的AS1细胞。7天后,收集AS1细胞并与624黑素瘤细胞共培养。作为阴性对照,AS1细胞与888黑素瘤细胞共培养。24小时后,收集上清液并通过ELISA测量IFN-γ产生。对比仅AS1与用刺激性类肽处理的AS1。为了进一步探索刺激性类肽的功效,从招募到进行中的IRB批准的临床试验的10名转移性黑素瘤患者的肿瘤收集T细胞。如前所述,将肿瘤的片段在含6000IU/ml IL-2的培养基中培养以产生T细胞的汇集物(Pilon-Thomas S,等J Immunother.2012 35(8):615-20)。每种疾患添加不相关的类肽或刺激性类肽至12个片段。将同种型IgG或抗-41BB抗体(10μg/ml)处理的片段用作对照。21天后,收集T细胞并计数。为了测量激活,将T细胞与自体或HLA-匹配的肿瘤细胞共培养。包括仅T细胞和与HLA-错配的肿瘤细胞共培养的T细胞作为阴性对照。包括在CD3/CD28的存在下培养的T细胞作为阳性对照。24小时后,收集上清液并通过ELISA测量IFN-γ产生。此外,在第7、14和21天测量T细胞的增殖以确定与刺激性类肽共培养是否导致肿瘤浸润T细胞的增殖增加。这些研究确定了用抗-PD1类肽-体处理T细胞是否改善抗-黑素瘤T细胞的增殖和激活。
实施例3:鼠模型中TIL活性的评估
TIL研究的主要缺点是不能在体内模型中测试TIL。开发鼠模型以测量TIL功效。使用NSG小鼠(缺乏B和T细胞的小鼠,从Jackson Laboratories购得),将原代患者黑色素瘤肿瘤植入侧面。当肿瘤达到直径5mm时,从匹配的患者样品转移1x107个经扩增的TIL。测量肿瘤生长和存活。使用该模型,检查在标准IL-2培养基中用TLR配体或用刺激性类肽生长的TIL是否导致更好的体内肿瘤排斥。
实施例4:使用69种不同取代基的位置扫描
在一些实施方案中,制备展示由图4A中一般结构所定义的在R1或R2、R3位具有各种取代基(表2中所列)的69种化合物的混合物的分子文库,其中所有剩余的R1和R2或者R1和R3或者R2和R3位展示可能的69x 69组合的每一种。这等于69x 69x 3,即14,283个不同点。这个数目远远少于使得69x 69x 69即328,509个点(将需要952.2个板,每个板345个点)的每个可能的组合。位置扫描法仅需要41.4个板。
在位置扫描法的该实施方案中,每个点仅展示约1/69纯基质。当筛选发现命中物时,重新制备所述命中物以验证其活性。这种方法得到每个孔代表~1.4%的特定序列,且通过与分散地展示三条侧链中的每一个中的侧链的其它板的命中物比较,可确定优选的侧链。
表2.R1、R2或R3位的取代基的实例:
图5是用于位置筛选的板的实例。点1-69将具有所有点中相同的R1、R2中单独和不同的69条侧链的每一个以及R3位展示的所有69种化合物的混合物。点70-138将类似地具有展示侧链2的所有R1位,然后是R2位的69条不同侧链的每一个以及R3位展示的69条不同侧链的混合物,以此类推涵盖所有可能的组合。特定R2板将具有R1位展示的69种化合物的混合物,然后是R2位具有等于化合物1的相同侧链的所有69个点,然后是类似于上述R1特定板的R3的69种化合物的单独的每一个,然后是剩余组合,其中R1位将展示69中的每一个,R2将展示69种化合物的混合物,并且点1-69在R3位都将具有相同的侧链。
位置筛选结果的实例还示于图5中。第一个阴影点具有最佳的R1侧链,其侧链等于化合物2且R2等于化合物26,且在位置R3具有69种可能的化合物的至少一种。下一个点显示了化合物3在R1中有活性,R2具有化合物10,且在位置R3具有69种化合物中的至少一种。板上的最后点显示R1等于化合物5,R2等于化合物55,且位置R3等于69种化合物的至少一种。通过分析所定义的R2和R3位板的类似筛选结果,可确定精确的序列。
需要在SN2反应中具有类似反应性以制备仲胺的69种化合物。可能有相当大的结构可变性,但一些可能的侧链显示在表2中。
实施例5:稳定环状β-发夹状类肽-肽杂合体支架的装订方法
存在若干种可行的装订方法可用于使环状β-发夹状类肽-肽杂合体支架稳定化。两条类肽侧链的装订从合成角度看最容易实现,并且将预先组织那两条类肽侧链彼此邻近,并且所述邻近力促与所需环状β-发夹状二级结构相容的总支架构象。最容易的装订对是待装订且使那两个末端炔与具有稳定的有机接头(横跨那些类肽侧链之间的距离)的双功能二叠氮化物反应的类肽侧链中的炔丙基胺。有机接头还需要3个原子来跨过此距离。间二甲苯基基团显示于图6中;然而,可使用任何稳定的原子组合。此外,该链不需要仅是接头,因为所述基团还可用于例如优化药代动力学性质。
可替代地,如图7所示,相同或不同的接头可用于装订在更多邻近类肽侧链上的炔丙基侧链。如本文所述,氨基酸侧的侧链和邻近类肽侧链也是可能的,但并未显示。使用叠氮化物和炔的更通用的方案显示于图8中。如图9中通用实例所示,还可使用RCM(闭环复分解)反应。
除非另外定义,否则本文所用的所有技术和科学术语具有与公开的本发明所属的领域的技术人员通常所理解的含义相同的含义。本文引用的出版物和引用它们的材料通过引用明确并入。
本领域技术人员将认识到或能够仅使用常规实验确定许多与本文所述的本发明的特定实施方案的等效形式。此类等效形式意在由以下权利要求涵盖。
- 还没有人留言评论。精彩留言会获得点赞!