用于局部递送的适体的制作方法
本申请要求2014年3月17日提交的美国申请序列号61/953,953的优先权。该在先申请的内容考虑作为本申请内容的一部分(且引入作为参考)。
背景技术:
适体(aptamer)为合成衍生的核酸分子,其除了经典的Watson-Crick碱基配对外还通过相互作用对分子具有特异的结合亲和力。适体具有许多用作治疗剂和诊断剂的期望特征,包括高特异性和亲和力、生物功效和优异的药代动力学性质。
技术实现要素:
皮肤为人体的主要器官,其作为与外部环境的界面,起到半渗透屏障的作用以防止人体被外部物质进入,同时允许失去过量的内源性物质如水。皮肤为最易于接触的人体器官,使其本身能进行药物的局部和经皮递送。一些局部和药物递送系统的优点为避免首过代谢、方便施加、易于目测评价、将药物成分直接递送至作用位点、避免由全身递送所见的变动(例如胃排空、酶的存在、pH变化等)、如果产生安全性信号时易于终止给药的能力、使用高度有效的化合物、和适于自行用药(Brown等人Drug Deliv.(2006)13(3):175-187)。然而,皮肤对局部递送存在强大的屏障,尤其是分子量大于500道尔顿的化合物。非常少的(如果有的话)分子量大于1,000道尔顿的化合物显示出在没有使屏障物理破坏的情况下具有局部递送的临床功效。克服这种尺寸排阻现象能在皮肤和局部药物递送方面提供重要的突破,因为其可开发新的研究领域和使用传统小分子不能接触的潜在靶点。
在一些方面,本发明提供治疗受试者(例如,哺乳动物受试者,例如,人)皮肤病的方法,该方法包括局部给药(例如,涂覆)一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)至患有皮肤病的受试者的皮肤(其中所述皮肤包括表皮和真皮),其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入(例如,渗透)至皮肤的表皮(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(spray)(例如,气溶胶(aerosol))、液体(liquid)、软膏(ointment)、乳膏(cream)、洗剂(lotion)、溶液(solution)(例如,水溶液)、悬浮液(suspension)、乳剂(emulsion)、糊剂(paste)、凝胶(gel)、粉末(powder)、泡沫(foam)、缓释纳米颗粒(slow release nanoparticle)、缓释微米颗粒(slow release microparticle)、生物粘附剂(bioadhesive)、贴片(patch)、绷带(bandage)、半固体剂型(semi-solid dosage form)或创伤敷料(wound dressing)给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃(alopecia greata)、硬肿症、瘢痕形成(例如瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),所述生物或化学实体包括可溶配体和/或其受体、细胞外、跨膜和细胞内酶,支架/结构蛋白、RNA、DNA、脂质、脂肪酸、辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如蛋白质),例如IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供向受试者(例如,哺乳动物受试者,例如,人)局部给药适体的方法,该方法包括:
给药一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)至受试者皮肤(其中所述皮肤包括表皮和真皮);
其中所述适体进入(例如,渗透)至皮肤的表皮;和
其中施加的剂量的至少0.01%(例如至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入(例如,渗透)至表皮(例如,给药15分钟内、30分钟内,或给药1、2、3、4、6、12、15、24、48或72小时内);
从而向受试者局部给药该适体。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤患有皮肤病。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕),荨麻疹,酒渣鼻,黑素瘤,或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如,银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如,天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如,毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化,从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如,mir21),PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中,所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供治疗受试者(例如,哺乳动物受试者,例如,人)中的皮肤病的方法,该方法包括局部给药(例如,涂覆)一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)至受试者皮肤(其中所述皮肤包括表皮和真皮),其中所述适体在皮肤中具有内在活性(例如,引起药效学反应)。
在一些实施方案中,该内在活性在表皮中。
在一些实施方案中,该内在活性在真皮中。
在一些实施方案中,该内在活性以EC50值测量(例如,相对于感兴趣的靶点)。
在一些实施方案中,所述内在活性作为IC50值测量(例如,相对于感兴趣的靶点)。
在一些实施方案中,该适体以适体的IC50的至少10倍(例如,至少10-、100-、200-、500-、或1000-倍)的水平存在于表皮中。
在一些实施方案中,该适体以适体的IC50的至少10倍(例如,至少10-、100-、200-、500-、或1000-倍)的水平存在于真皮中。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕),荨麻疹,酒渣鼻,黑素瘤,或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中,所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供局部递送负载物至受试者的方法,该方法包括:
给药适体(例如,一定剂量的包含适体的药学上可接受的组合物)至受试者皮肤,其中所述皮肤包括表皮和真皮;
其中负载物附着至该适体;
其中所述适体和附着的负载物进入皮肤的表皮;
从而局部递送负载物至受试者。
在一些实施方案中,适体和附着的负载物的施加剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入表皮。
在一些实施方案中,所述负载物(例如,附着(例如,缀合)至适体),包括小分子、成像染料、荧光团或放射性标记。
在一些实施方案中,局部给药的适体和附着负载物的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体和附着的负载物进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药的适体和附着负载物的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体和附着的负载物的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药的适体和附着负载物的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体和附着的负载物进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药的适体和附着负载物的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体和附着的负载物达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些方面,本发明提供一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)以用于治疗受试者(例如,哺乳动物受试者,例如,人)的皮肤病,其中该剂量局部给药(例如,涂覆)至患有皮肤病的受试者皮肤;(其中所述皮肤包括表皮和真皮);且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入(例如,渗透)至皮肤的表皮(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%,少于0.5%,少于0.1%,少于0.05%,少于0.01%,少于0.001%,或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕),荨麻疹,酒渣鼻,黑素瘤,或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)用于制备局部治疗受试者(例如,哺乳动物受试者,例如,人)的皮肤病的药物中的用途,(其中所述皮肤包括表皮和真皮);其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入(例如,渗透)至皮肤的表皮(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内),且其中所述剂量用于局部给药(例如,涂敷)至患有皮肤病的受试者皮肤。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤的施加剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%,少于0.5%,少于0.1%,少于0.05%,少于0.01%,少于0.001%,或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物),其用于局部给药至受试者(例如,哺乳动物受试者,例如,人),其中该剂量的适体给药至受试者皮肤;(其中所述皮肤包括表皮和真皮);其中所述适体进入(例如,渗透)至皮肤的表皮;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入(例如,渗透)至表皮(例如,给药15分钟内、30分钟内,或给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤患有皮肤病。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中,所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)在制备用于局部给药至受试者(例如,哺乳动物受试者,例如,人)的药物中的用途,(其中所述皮肤包括表皮和真皮);其中所述适体进入(例如,渗透)至皮肤的表皮;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、或至少50%)进入(例如,渗透)至表皮(例如,给药15分钟内、30分钟内,或给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%,少于0.5%,少于0.1%,少于0.05%,少于0.01%,少于0.001%,或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤患有皮肤病。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中,所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)以用于治疗受试者(例如,哺乳动物受试者,例如,人)的皮肤病,其中该剂量局部给药(例如,涂覆)至患有皮肤病的受试者皮肤;(其中所述皮肤包括表皮和真皮);且其中所述适体在皮肤中具有内在活性(例如,引起药效学反应)。
在一些实施方案中,该内在活性在表皮中。
在一些实施方案中,该内在活性在真皮中。
在一些实施方案中,该内在活性以EC50值测量(例如,相对于感兴趣的靶点)。
在一些实施方案中,所述内在活性作为IC50值测量(例如,相对于感兴趣的靶点)。
在一些实施方案中,该适体以适体的IC50的至少10倍(例如,至少10-、100-、200-、500-、或1000-倍)的水平存在于表皮中。
在一些实施方案中,该适体以适体的IC50的至少10倍(例如,至少10-、100-、200-、500-、或1000-倍)的水平存在于真皮中。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中,所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
在一些方面,本发明提供一定剂量(例如,有效剂量,例如,治疗有效剂量)的适体(例如,包含适体的药学上可接受的组合物)在制备用于局部治疗受试者(例如,哺乳动物受试者,例如,人)的皮肤病的药物中的用途;(其中所述皮肤包括表皮和真皮);其中所述适体在皮肤中具有内在活性(例如,引起药效学反应);且其中该剂量用于局部给药(例如,涂敷)至患有皮肤病的受试者皮肤。
在一些实施方案中,该内在活性为在表皮中。
在一些实施方案中,该内在活性为在真皮中。
在一些实施方案中,该内在活性以EC50值测量(例如,相对于感兴趣的靶点)。
在一些实施方案中,所述内在活性作为IC50值测量(例如,相对于感兴趣的靶点)。
在一些实施方案中,该适体以适体的IC50的至少10倍(例如,至少10-、100-、200-、500-、或1000-倍)的水平存在于表皮中。
在一些实施方案中,该适体以适体的IC50的至少10倍(例如,至少10-、100-、200-、500-、或1000-倍)的水平存在于真皮中。
在一些实施方案中,该适体存在于药学上可接受的组合物中(例如,载体)(例如,本文所述的载体,例如,表4或9所示的载体)。
在一些实施方案中,药学上可接受的组合物中适体的浓度为0.001%至20%(例如,0.001%至15%、0.001%至10%、0.001%至5%、0.001%至2%、0.01%至20%、0.01%至10%、0.01%至5%、0.01%至2%、0.1%至20%、0.1%至15%、0.1%至10%、0.1%至5%、或0.1%至2%)。
在一些实施方案中,所述药学上可接受的组合物作为喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液(例如,水溶液)、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带、半固体剂型或创伤敷料给药。
在一些实施方案中,所述药学上可接受的组合物作为水溶液给药。
在一些实施方案中,所述药学上可接受的组合物作为半固体剂型给药。
在一些实施方案中,所述药学上可接受的组合物作为乳膏给药。
在一些实施方案中,所述药学上可接受的组合物不包含渗透促进剂(例如,丙二醇)。
在一些实施方案中,药学上可接受的组合物至皮肤施加的剂量为0.01至20mg/cm2(例如,0.01至15mg/cm2、0.01至10mg/cm2、0.01至5mg/cm2、0.01至2mg/cm2、0.05至20mg/cm2、0.05至15mg/cm2、0.05至10mg/cm2、或0.05至5mg/cm2、0.05至2mg/cm2、0.1至20mg/cm2、0.1至15mg/cm2、0.1至10mg/cm2、0.1至5mg/cm2、或0.1至2mg/cm2)。
在一些实施方案中,局部给药适体的施加剂量进入表皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,该适体进入(例如,渗透)至皮肤的真皮中;且其中施加的剂量的至少0.01%(例如,至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%)进入(例如,渗透)至真皮中(例如,在给药的15分钟内、30分钟内,或在给药1、2、3、4、6、12、15、24、48或72小时内)。
在一些实施方案中,局部给药适体的施加剂量进入真皮的百分比在体外测试中使用离体的人皮肤测定(例如,在Franz池设置中或流通扩散池中)(例如,在32℃)(例如,如本文所述)。
在一些实施方案中,少于5%(例如,少于1%、少于0.5%、少于0.1%、少于0.05%、少于0.01%、少于0.001%、或低于检测极限)的局部施加的适体达到体循环(例如,在给药2、3、4、6、12、15、24、48或72小时后)。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,所述药学上可接受的组合物每天给药一次。
在一些实施方案中,所述药学上可接受的组合物每天给药两次。
在一些实施方案中,所述药学上可接受的组合物每周给药一次。
在一些实施方案中,所述皮肤病包括哮喘加重、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、慢性阻塞性肺疾病(COPD)加重、关节痛加重或胰岛细胞移植炎症加重。
在一些实施方案中,所述皮肤病包括银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、化脓性汗腺炎、口腔扁平苔癣、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、或源自肾移植的炎症。
在一些实施方案中,所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些实施方案中,所述皮肤病包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,所述皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)。
在一些实施方案中,所述药学上可接受的组合物与第二药剂组合给药,该第二药剂包括对皮肤病的治疗。
在一些实施方案中,所述适体结合至第一靶点和/或第一靶点的靶点,其可包括与其它可被调节的生物或化学实体的相互作用(包括,例如,通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),包括可溶配体和/或其受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
在一些实施方案中,所述适体结合至皮肤中的靶点(例如,蛋白质),例如,IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP、CCR1、CXCR4、CRTH2、aTLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体、miRNA(例如、mir21)、PI3K/AKT、PTEN、FAS、DGAT、SCD1、EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4、β-整联蛋白、CD44、E-钙粘着蛋白、CLA、HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47、VEGFC、VEGFD、VEGFEGF、FGF、GMCSF、IL-1、PDGF、或TGF-β1。
在一些实施方案中,所述适体结合至表皮中的靶点。在一些实施方案中,所述适体结合至真皮中的靶点。
在一些实施方案中,该皮肤为正常皮肤。
在一些实施方案中,该皮肤为受损皮肤。
在一些实施方案中,该受损皮肤为患病皮肤。
在一些实施方案中,该受损皮肤包含改变的屏障。
在一些实施方案中,所述适体包括负载物(例如,附着(例如,缀合)至其上),例如,小分子、成像染料、荧光团或放射性标记。
本发明提供结合至白介素(IL)-23的适体(IL-23适体)和其使用方法,例如,用于治疗(例如,局部治疗)炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))。
在一些实施方案中,该IL-23适体结合至IL-23且抑制IL-23活性,例如,抑制(例如,降低例如约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约95%或更多)IL-23信号传递。在一些实施方案中,该适体对IL-23活性的作用可通过评估IL-23受体(IL-23R)的IL-23接合下游的响应而评估,例如,使用本文所述的方法,例如,磷酸化STAT3测试或其它ELISA方法例如在PBMC中定量IL-17(IL-17a)、IL-17f或IL-22水平。在一些实施方案中,所评估的响应为STAT3磷酸化、IL-17表达、或IL-22表达,其中IL-23适体降低该响应,例如,与对照相比(例如,在相同条件下但不存在IL-23适体时该响应的水平)。
在一些方面,本发明提供结合至人白介素(IL)-23的适体,其中所述适体包含与选自以下的序列具有至少80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%)同一性的核酸序列:SEQ ID NO:1和2。
在一些实施方案中,所述适体由与选自以下的序列具有至少80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%)同一性的核酸序列组成:SEQ ID NO:1和2。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体包括类似(例如,等同)于由SEQ ID NO:1组成的适体的二级结构。
在一些实施方案中,该适体例如与对照相比,例如在相同条件(除了不存在适体)下,减少了STAT3磷酸化,例如,如通过体外磷酸化STAT3测试确定。
在一些实施方案中,该适体例如与对照相比,例如在相同条件(除了不存在适体)下,减少了IL-17表达,例如,通过ELISA测定。
在一些实施方案中,所述适体包含SEQ ID NO:1。
在一些实施方案中,所述适体由SEQ ID NO:1组成。
在一些实施方案中,所述适体包含SEQ ID NO:2。
在一些实施方案中,所述适体由SEQ ID NO:2组成
在一些实施方案中,所述适体例如在相同条件下结合至人IL-23以及(例如,至少约75%、约50%、约40%、约30%、或还有约20%)由SEQ ID NO:1组成的适体。
在一些实施方案中,所述适体例如在相同条件下抑制STAT3磷酸化以及(例如,至少约75%、约50%、约40%、约30%、或还有约20%)由SEQ ID NO:1组成的适体。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些方面,本发明提供药物组合物(例如,药学上可接受的组合物),其包含结合至人白介素(IL)-23的适体,其中所述适体包含与选自以下的序列具有至少80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%)的同一性的核酸序列或其盐:SEQ ID NO:1和2;以及药学上可接受的载体或稀释剂。
在一些实施方案中,所述药物组合物包括半固体剂型。
在一些实施方案中,所述药物组合物包括乳膏。
在一些实施方案中,所述适体由与选自以下的序列具有至少80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%)的同一性的核酸序列组成:SEQ ID NO:1和2。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体包括类似(例如,等同)于由SEQ ID NO:1组成的适体的二级结构。
在一些实施方案中,该适体例如与对照相比,例如在相同条件(除了不存在适体)下,减少了STAT3磷酸化,例如,如通过体外磷酸化STAT3测试确定。
在一些实施方案中,该适体例如与对照相比,例如在相同条件(除了不存在适体)下,减少了IL-17表达,例如,通过ELISA测定。
在一些实施方案中,所述适体包含SEQ ID NO:1。
在一些实施方案中,所述适体由SEQ ID NO:1组成。
在一些实施方案中,所述适体包含SEQ ID NO:2。
在一些实施方案中,所述适体由SEQ ID NO:2组成。
在一些实施方案中,所述适体例如在相同条件下结合至人IL-23以及(例如,至少约75%、约50%、约40%、约30%、或还有约20%)由SEQ ID NO:1组成的适体。
在一些实施方案中,所述适体例如在相同条件下抑制STAT3磷酸化以及(例如,至少约75%、约50%、约40%、约30%、或还有约20%)由SEQ ID NO:1组成的适体。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些方面,本发明提供在受试者(例如,人受试者)中治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))的方法,该方法包括给药适体(例如,其治疗有效量)(例如,包含该适体的药物组合物(例如,药学上可接受的组合物))至受试者,其中所述适体结合至人白介素(IL)-23,其中所述适体包括与选自以下的序列具有至少80%(例如,至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,或至少99%)同一性的核酸序列:SEQ ID NO:1和2。
在一些实施方案中,所述适体由与选自以下的序列具有至少80%(例如,至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%)同一性的核酸序列组成:SEQ ID NO:1和2。
在一些实施方案中,适体的长度小于100(例如,少于95、90、85、80、75、或70)个核苷酸。
在一些实施方案中,适体的长度大于30(例如,大于35、40、45、50、55、60、或65)个核苷酸。
在一些实施方案中,所述适体长度为30至90个核苷酸(例如,35至85个核苷酸)。
在一些实施方案中,所述适体包括类似(例如,等同)于由SEQ ID NO:1组成的适体的二级结构。
在一些实施方案中,该适体例如与对照相比,例如在相同条件下(除了不存在适体),减少了STAT3磷酸化,例如,如通过体外磷酸化STAT3测试确定。
在一些实施方案中,该适体例如与对照相比,例如在相同条件下(除了不存在适体),减少了IL-17表达,例如,通过ELISA测定。
在一些实施方案中,所述适体包含SEQ ID NO:1。
在一些实施方案中,所述适体由SEQ ID NO:1组成。
在一些实施方案中,所述适体包含SEQ ID NO:2。
在一些实施方案中,所述适体由SEQ ID NO:2组成
在一些实施方案中,所述适体例如在相同条件下结合至人IL-23以及(例如,至少约75%、约50%、约40%、约30%、或还有约20%)由SEQ ID NO:1组成的适体。
在一些实施方案中,所述适体例如在相同条件下抑制STAT3磷酸化以及(例如,至少约75%、约50%、约40%、约30%、或还有约20%)由SEQ ID NO:1组成的适体。
在一些实施方案中,所述适体的至少一个核苷酸包括化学修饰。
在一些实施方案中,所述适体的所有核苷酸包括化学修饰。
在一些实施方案中,所述化学修饰包括糖的2’位上的修饰。
在一些实施方案中,所述化学修饰包括加入2′-O-甲氧基乙基。
在一些实施方案中,所述化学修饰包括加入2’氟。
在一些实施方案中,所述适体在其3’端包括单个的倒置脱氧胸苷残基(idT)。
在一些实施方案中,该适体局部给药。
在一些实施方案中,该适体每天给药一次。
在一些实施方案中,该适体每天给药两次。
在一些实施方案中,该适体每周给药一次。
在一些实施方案中,该适体在半固体剂型中。
在一些实施方案中,该适体在水溶液中。
在一些实施方案中,该适体在乳膏中。
在一些实施方案中,该炎性皮肤病(例如,慢性炎性皮肤病)包括银屑病。
在一些实施方案中,所述银屑病为轻度银屑病。
在一些实施方案中,所述银屑病为中度银屑病。
在一些实施方案中,所述银屑病为重度银屑病。
在一些实施方案中,该炎性皮肤病(例如,慢性炎性皮肤病)包括特应性皮炎。
在一些实施方案中,该适体与用于炎性皮肤病(例如,慢性炎性皮肤病)的第二治疗组合给药。
在一些方面,本发明提供检测寡核苷酸(例如,适体)的方法,该方法包括:
将第一探针(例如,检测探针)与寡核苷酸(例如,适体)接触,从而产生混合物;
加热该混合物至一定温度(例如,95℃),其导致寡核苷酸(例如,适体)的解折叠;
冷却该混合物;
使第一探针与寡核苷酸(例如,适体)相互作用(例如,通过互补碱基配对)(例如,提供允许第一探针与寡核苷酸相互作用的条件),从而形成探针:寡核苷酸复合物(例如,探针:适体复合物);
将该混合物与第二探针(例如,捕获探针)接触,其中所述接触在允许第二探针与探针:寡核苷酸复合物(例如,探针:适体复合物)的寡核苷酸(例如,适体)相互作用的条件下发生(例如,通过互补碱基配对),从而形成捕获的复合物;和
检测该捕获的复合物。
在一些实施方案中,该方法还包括例如在捕获的复合物中定量表面上寡核苷酸(例如,适体)的量。
在一些实施方案中,第二探针在其5’端包含游离胺。
在一些实施方案中,第二探针通过游离胺连接(例如,共价连接)至表面。
在一些实施方案中,第二探针连接(例如,共价连接)至表面(例如,板或珠)。
在一些实施方案中,第一探针在其3’端包含可检测标记(例如,生物素)。
在一些实施方案中,检测该捕获的复合物包括检测表面上的该可检测标记(例如,使用链霉亲和素以结合至生物素,例如,该链霉亲和素缀合至可被检测和/或定量的试剂,或该试剂(例如,辣根过氧化物酶或碱性磷酸酶)例如在比色测定中作用于可被检测和/或定量的底物(例如,四甲基联苯胺或对硝基苯基磷酸酯))。
在一些实施方案中,该方法在检测步骤前还包括清洗步骤。
在一些实施方案中,第二探针在游离胺和核苷酸的5’端之间包含间隔区(例如,3、4或5个核苷酸的间隔区)(例如,4个核苷酸的间隔区),其提供与寡核苷酸(例如,适体)的相互作用(例如,互补碱基配对)。
在一些实施方案中,第一探针在可检测标记(例如,生物素)和该核苷酸的3’端之间包含间隔区(例如,3、4或5个核苷酸的间隔区)(例如,4个核苷酸的间隔区),其提供与寡核苷酸(例如,适体)的相互作用(例如,互补碱基配对)。
在一些方面,本发明提供检测寡核苷酸(例如,适体)的方法,该方法包括:
将第一探针(例如,检测探针)与寡核苷酸(例如,适体)接触,从而产生混合物,其中所述接触在允许第一探针与寡核苷酸(例如,适体)相互作用的条件下发生,从而形成探针:寡核苷酸复合物(例如,探针:适体复合物);
将该混合物与第二探针(例如,捕获探针)接触,其中所述接触在允许第二探针与探针:寡核苷酸复合物(例如,探针:适体复合物)的寡核苷酸(例如,适体)相互作用的条件下发生,从而形成捕获的复合物;和
检测该捕获的复合物。
在一些实施方案中,所述相互作用包括互补碱基配对。
在一些实施方案中,该方法还包括例如在捕获的复合物中定量表面上寡核苷酸(例如,适体)的量。
在一些实施方案中,该方法还包括在检测步骤之前的清洗混合物步骤。
在一些实施方案中,第一探针在其3’端包含可检测标记(例如,生物素)。
在一些实施方案中,第二探针在其5’端包含游离胺。
在一些实施方案中,第二探针通过游离胺连接(例如,共价连接)至表面。
在一些实施方案中,第二探针连接(例如,共价连接)至表面.
在一些实施方案中,第一探针在其3’端包含可检测标记(例如,生物素)。
在一些实施方案中,检测该捕获的复合物包括检测表面上的该可检测标记(例如,使用链霉亲和素以结合至生物素,例如,该链霉亲和素缀合至可被检测和/或定量的试剂,或该试剂(例如,辣根过氧化物酶或碱性磷酸酶)例如在比色测定中作用于可被检测和/或定量的底物(例如,四甲基联苯胺或对硝基苯基磷酸酯))。
在一些实施方案中,第二探针在游离胺和核苷酸的5’端之间包含间隔区(例如,3、4或5个核苷酸的间隔区)(例如,4个核苷酸的间隔区),其提供与寡核苷酸(例如,适体)的相互作用(例如,互补碱基配对)。
在一些实施方案中,第一探针在可检测标记(例如,生物素)和该核苷酸的3’端之间包含间隔区(例如,3、4或5个核苷酸的间隔区)(例如,4个核苷酸的间隔区),其提供与寡核苷酸(例如,适体)的相互作用(例如,互补碱基配对)。
在一些方面,本发明提供包含至少一种化学修饰的适体(例如,用于局部递送)。在一个实施方案中,所述修饰选自:在核酸的糖位置的化学取代;在核酸的磷酸位置的化学取代;和在核酸的碱基位置的化学取代;掺入修饰的核苷酸;3'封端(例如,3’-idT);缀合至高分子量、非免疫源性化合物;缀合至亲脂化合物;和磷酸骨架修饰。在一个实施方案中,缀合至本发明的适体的非免疫源性、高分子量化合物为聚亚烷基二醇,优选聚乙二醇。在一个实施方案中,所述骨架修饰包括向磷酸骨架中掺入一个或多个硫代磷酸酯。
在一些方面,本发明提供包含(例如,治疗有效量的)适体以及药学上可接受的载体或稀释剂的药物组合物,该适体包含选自以下的核酸序列或其盐:SEQ ID NO:1或2。
在一些方面,本发明的特征为本文所述的适体,其用于局部使用以治疗皮肤病,其中所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些方面,本发明提供本文所述的适体在制备用于局部治疗皮肤病的药物中的用途,其中所述皮肤病包括持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
在一些方面,本发明的特征为本文所述的适体,其用于局部使用以治疗如本文所述的皮肤病(例如银屑病、皮炎(例如特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重)。
在一些方面,本发明提供本文所述的适体在制备用于局部治疗如本文所述的皮肤病的药物中的用途(例如银屑病、皮炎(例如特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成(例如瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重)。
在一些方面,本发明的特征为本文所述的适体,其用于治疗如本文所述的炎性皮肤病(例如慢性炎性皮肤病(例如皮炎(例如特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如银屑病或特应性皮炎))。
在一些方面,本发明提供本文所述的适体在制备用于治疗如本文所述的炎性皮肤病(例如慢性炎性皮肤病(例如皮炎(例如特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如银屑病或特应性皮炎))的药物中的用途。
附图简述
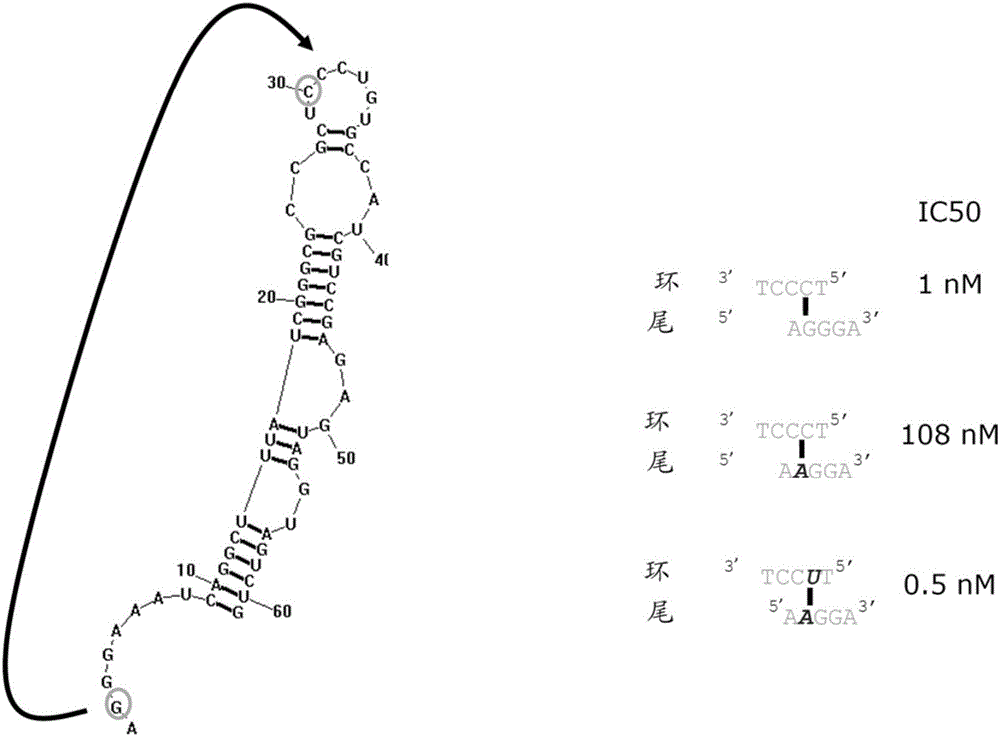
图1A和1B。图1A为显示ARC32225(SEQ ID NO:1)的推定二级结构的示意图。ARC32225包含2’-甲氧基(环)和2’-氟核苷酸且在其3’-端被倒置脱氧胸苷残基(idT)修饰以增加核酸酶抗性。图1B为显示ARC32225中的三级接触的示意图。还示出了来自补充的突变研究的IC50值,其表明IL23分子中的三级相互作用包括环-尾接触。突变示于粗斜体。
图2为线状图,显示了ARC20122至ARC32225的最小化和优化不影响其功能活性。
图3为线状图,显示了p-40和p-19中和性单克隆抗体二者均抑制了纯化的内源性IL-23磷酸化-STAT3诱导。
图4为线状图,显示了PHA Blast磷酸化-STAT3测试中内源性IL-23的ARC32225抑制。
图5为线状图,显示了ARC32225相对eIL-23(内源性IL-23)和rIL-12(重组IL-12)的活性。
图6为线状图,显示了确定对于ARC32225合适的用于DHA的检测探针。
图7为线状图,显示了确定对于ARC32225合适的用于DHA的捕获探针。
图8为线状图,显示了鼠血浆中DHA的敏感性。
图9为线状图,显示了猪血浆中DHA的敏感性。
图10为线状图,显示了猕猴血浆中DHA的敏感性。
图11为一组条线图,显示了人离体皮肤中IL23适体(ARC32225)的皮肤渗透。
图12为两组条线图,显示了人离体皮肤中IL23适体(ARC32225)的皮肤渗透的制剂增强作用。
图13A和13B为两组线状图,显示了在单一局部施加至表皮皮肤切片后在接收流体中测量的在水性载体中经24小时的IL23适体(ARC32225),以累积量(A)和通量(B)显示。
图14为两组条线图,显示了IL23适体(ARC32225)至表皮和真皮的被动渗透,其比较了在施加后6小时(上图)和15小时(下图)处封闭、水合、和有限给药相对无限给药的效果。
图15为两组条线图,显示了IL23适体(ARC32225)至表皮和真皮的被动渗透,其比较了在施加后6小时(上图)和15小时(下图)处限定剂量(10mg/cm2)的氯化钙和EDTA的作用。
图16为一组条线图,显示了IL23适体(ARC32225)的被动渗透,其比较了温度对限定剂量(10mg/cm2)的作用。
图17A、17B和17C为:其中两组条线图显示了在施加后6小时(A)和24小时(B)处不同的2’修饰的IL23适体对离体人皮肤的皮肤渗透,以及一组显示在施加24小时(C)后二级结构被扰乱的4种不同变体(变体1;1.1mg/mL,变体2;0.4mg/mL,变体3;0.9mg/mL,和变体4;0.9mg/mL)和三级结构被扰乱的一种变体(变体5;1.1mg/mL)和IL23适体(ARC32225)(1.0mg/mL)在水溶液中的皮肤渗透(作为施加剂量的百分比)。
图18A和18B为两组条线图,显示了局部IL23适体(ARC32225)在人皮肤中的生物活性,如通过IL17f(A)和IL22(B)细胞因子水平的减少而评估。
发明详述
通常理解大于1,000道尔顿的试剂在局部递送后不能穿过完整的(例如,未受损的)哺乳动物(例如,人)皮肤,例如,穿过角质层(SC)且进入表皮和/或真皮的活的层。克服哺乳动物皮肤屏障的尺寸排阻现象代表了皮肤病学和局部药物递送方面的主要突破点。小于1,000道尔顿的该尺寸排阻现象已被可作为经皮和局部产品商购的药物加强[1]。皮肤进化为保护人体免受物理、机械和化学损害,同时防止内源性水损失。这通过表皮最外层薄的(10-30um)角质层实现,通过基底角质形成细胞的末端分化以最终形成角质层。该最外层由富含角蛋白、含脂蛋白的平扁包膜(被脂质包膜围绕)组成,其约每过30天通过磨损和补充不断去除[2,3]。这种脂质包膜在角质细胞和周围细胞间脂质之间产生了内聚力,其具有良好限定的横向堆叠和层状相以形成该高度有效的保护屏障[4]。这种高度进化的屏障不仅保护了人体,而且限制了局部给药对治疗靶点的可达性。
适体为相对新的种类的基于寡核苷酸的技术,其可以高亲和力和特异性结合至很宽范围的分子,包括蛋白质、核苷酸、抗生素、小分子有机或无机化合物,甚至全细胞[5]。反义寡核苷酸和适体之间的一个主要差异为构象结构和柔性[10]。反义分子的结构被主动避开,因为其可对功效有影响。适体的一个优点为结构可被修饰且仍然保持活性。已描述基于RNA的适体具有构象‘塑性’,产生许多不同的三级结构;RNA的高塑性潜能可源自使用不同的功能活性蛋白架构在RNA和蛋白质之间产生分子模拟[6]。目前已确定塑性、可逆的变性(柔性)和高稳定性的属性使得其自身可局部递送以穿过皮肤屏障。单链适体,例如,具有2’修饰的核苷酸,代表能在不对屏障产生物理破坏时渗透人皮肤(例如,完整的人皮肤)(即,被动递送)以治疗皮肤病的大分子量化合物的一个亚组。此外,反义寡核苷酸通常长度为约20个核苷酸;相反,适体通常更大,例如,长度至少30个核苷酸,且通常更大,例如,50-90个核苷酸。
本发明首次描述了局部递送适体通过完整的(例如,未受损的)人皮肤。而且,该局部递送的适体可在皮肤中产生治疗效果,例如,在表皮和/或真皮中。尽管存在研究局部递送的动物模型(例如,啮齿类,猪),但这些模型体系的皮肤通常比人皮肤更易渗透,且可能不对人皮肤的作用有预言性,例如,穿过角质层(SC)且进入表皮和/或真皮。
已显示IL23适体的局部给药以治疗相关的浓度穿透完整的人皮肤到达表皮和真皮。该浓度使用双杂交分析定量,该分析显示能够从人皮肤以皮摩尔浓度提取并定量适体。表皮中定量的水平始终为:在表皮中大于IC50的1,000倍(微摩尔)且在真皮中大于IC50的100倍(纳摩尔至微摩尔)。此外,计算渗透至表皮和真皮二者中的适体施加剂量的量。取决于载体(例如,药学上可接受的组合物),超过11%的施加的剂量渗透至表皮且超过1%渗透至真皮中。皮肤中定量的水平使用荧光证实且显示同时位于角质形成细胞内和周围(细胞内和细胞外)。这表明适体可靶向细胞外靶点以及细胞内或甚至细胞核靶点。皮肤中定量的浓度证实了皮肤中的生物活性,其通过细胞因子抑制证实细胞外级分能结合至蛋白质以引发生物响应。使用新切离的人皮肤证实了皮肤中定量的水平在药效学模型中的生物活性。
如本文所述,在皮肤病中抑制IL-23,例如,通过使用IL-23适体(例如,局部给药),可阻断Th17淋巴细胞在皮肤中的活化和扩张,且改善炎性皮肤病(例如,慢性炎性皮肤病(例如,银屑病或特应性皮炎))的症状,例如,不以受试者的(例如,人受试者的)全身免疫应答作为妥协。
本文所述的一种适体,ARC32225,为一种优化和稳定的61-核苷酸(MW=20,395.27)mRfY适体。3’-端携带附加的倒置dT帽以防止核酸酶降解。对于局部给药,其未被PEG化。ARC32225结合至IL-23,该IL-23已通过活化的人单核细胞体外产生(内源性IL-23或eIL-23)。ARC32225为内源性IL-23诱导的STAT3活化的有效抑制剂,但不是IL-12诱导的STAT3活化的有效抑制剂(如在主要人T-细胞中的eIL-23-依赖性STAT3活化中测定(IC50=~300pM))。尽管ARC32225并不抑制大多数非人IL-23蛋白质,其却抑制食蟹猕猴IL-23,促成了基于靶点的毒理学研究。ARC32225通常对核酸酶降解有抗性。在90%人血清中培养24小时后仍保留大量的全长ARC32225。当配制为乳膏在室温保持2周后,ARC32225也几乎保持100%完整。在体外皮肤渗透研究中,当以1%乳膏制剂局部施加时,在健康人皮肤中完整的ARC32225渗透且聚集于表皮达至少4小时。该适体通过表皮的所有层和真皮的上层以穿透健康离体皮肤。在初步的体内实验中,在胶带剥离的活的猪皮肤中ARC32225渗透且停留至少4小时。局部施加IL-23适体如ARC32225可减少皮肤中Th17-细胞活性,导致局部炎性作用减少,且不影响全身Th1或Th17-细胞活性,例如,其为对感染的有效免疫应答且减少癌症风险所需要的。
皮肤结构
皮肤可为完整的(例如,健康或未患病皮肤)或可为受损的(例如,患病皮肤或具有改变的屏障)。正常(完整)皮肤是指具有完整的角质层的皮肤,其不为疾病所影响,具有正常的屏障功能以保护身体对抗环境,和维持正常皮肤温度(通常为30-36℃的范围)。
受损皮肤为受疾病影响的皮肤,如下定义,其中角质层损伤、增厚(例如角化过度)、受损、渗透性变大或变少,或缺少至少一些角质层(例如,由于暴露于试剂引起的皮肤损伤;免疫应答或其加重;炎症应答或其加重;物理创伤如切伤、创伤,或擦伤;发育不全的皮肤如早产儿中发生的;其中全部或部分表皮被暴露的病症;其中部分真皮被去除的病症如表面重修手术(如化学脱皮、擦皮术和激光换肤术,等)中遇到的二度创面)。
皮肤具有两个主要的层,表皮和真皮。在这些层之下为皮下脂肪层。皮肤的外表面为表皮,其本身包含多层:存活(例如,活的)层(基底细胞层,棘层,颗粒细胞层),和非活角质层外层。表皮最深层为基底细胞层。在此,细胞连续分裂产生新的皮肤细胞。这些细胞朝皮肤表面运动,被在其之下的分裂细胞向上推动。真皮中的血管(在基底细胞层之下),提供营养物以支持该新的皮肤细胞的主动生长。由于基底细胞向上运动且远离其血液供应,它们的细胞内含物和形状改变。基底细胞层之上的细胞变得形状更不规则且形成棘层。在这之上,细胞移动至颗粒层。由于远离真皮中的血液供给,细胞开始死亡且聚集角蛋白。
角质层为表皮的顶(非活)层。这里的细胞形状是扁平的和鳞状的(`棘`)。这些细胞是死的,包含大量角蛋白且以重叠的层设置,其赋予皮肤表面以强韧和防水特性。死的皮肤细胞连续从皮肤表面脱落。这通过基底细胞层中的分裂细胞而平衡,从而产生不断更新的状态,其约每30天发生一次。基底细胞层中还有产生黑色素的细胞。黑色素为吸收至分裂的皮肤细胞中的颜料以帮助其抵抗阳光(紫外线)损伤。皮肤中黑色素的量由基因组成和对阳光的暴露而确定。
表皮之下为称为真皮的层。真皮的顶层,即直接在表皮之下的层,具有许多隆起,其被称为乳头状突起。在指尖,皮肤表面遵照这种隆起方式以产生我们个体的指纹。真皮包含可变量的脂肪,以及胶原和弹力蛋白纤维,其对皮肤提供提供强度和柔性。血管对基底层中的分裂细胞提供营养物且去除任何废产物。
皮肤病:
适体的局部制剂和/或局部给药可用于治疗皮肤障碍(皮肤病)(即,表皮、真皮、和/或皮下组织异常状态)。皮肤病包括炎性皮肤病学疾病,其包括(部分或完全)由免疫疾病引起的皮肤病学疾病,(例如自身免疫性疾病(例如,湿疹,银屑病,特应性皮炎));增殖疾病(例如,黑素瘤);与过敏原和/或刺激物接触;皮脂脂质过度产生(例如,痤疮);成纤维细胞疾病(例如,创伤(例如,外科手术)后结疤);或其组合.皮肤病学(皮肤)疾病的实例包括,但不限于,银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成,(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重。
其它可通过适体的局部制剂和/或局部给药治疗的皮肤病包括:
-持续炎症、细胞动力学和分化的皮肤疾病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、汗孔角化症等);
-表皮粘连、水泡性和大疱性疾病的皮肤疾病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、手掌和脚底的脓疱疹等);
-表皮附属器的皮肤疾病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、毛囊综合症等);
-表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、梅克尔细胞癌等);
-黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、黑素瘤等);
-真皮的炎性和肿瘤疾病的皮肤疾病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、Kaposi肉瘤等);
-皮下组织疾病(例如脂膜炎、脂肪营养障碍等);
-涉及改变的反应性的皮肤变化的皮肤疾病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、脂溢性皮炎等);
-由于机械和物理因素的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、老茧等);
-光损伤(例如急性和慢性UV辐射、光敏作用等);
-由于微生物试剂的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、朊病毒等)。
皮肤病靶点.涉及介导皮肤病的蛋白质已被鉴定且因此可在方法中被靶向以治疗皮肤病(例如,通过用适体局部靶向)。炎性皮肤病学疾病(例如,特应性皮炎、银屑病、痤疮、等)包括但不限于细胞因子和/或受体如IL2、IL12、IL17、IL22、IL23、IFNγ、TNFα、TSLP等或趋化因子CCR1、CXCR4、CRTH2的靶点。皮肤中的增殖疾病包括(例如,黑素瘤和非-黑素瘤皮肤癌)包括但不限于TLR、p53、RAS、MEK、PATCH1、音猬因子信号传递的介体的靶点,等。皮肤中的成纤维细胞疾病(例如,创伤或外科手术后结疤)或纤维化、硬肿症、瘢痕形成(例如,瘢痕疙瘩或肥厚性瘢痕(miRNA(例如,mir21),PI3K/AKT,PTEN))。皮肤中皮脂脂质的过度产生(例如、痤疮、等)包括但不限于FAS、DGAT、SCD1等的靶点。慢性发疱(大疱)疾病的靶点,细胞生长、增殖和分化的靶点(EGFR、EGF、HB-EGF、TGF-α、EPR、BTC、NRG1-4,等)或粘连的靶点(β-整联蛋白、CD44、E-钙粘着蛋白、CLA,等)。传染病的靶点(HPV1、HPV5、HPV8、HPV14、HPV16、HPV17、HPV20、HPV31、HPV47,等)。光损伤和光致老化的靶点。脉管系统和血管发生的靶点(VEGFC、VEGFD、VEGF、VEGF-R,等)。创伤修复或再生涉及的靶点(EGF、FGF、GMCSF、IL-1、PDGF、TGF-β1,以及它们的受体,例如,EGF-R、FGF-R,等)。
单独的靶点和/或它们的靶点可包括与其它可被调节的生物或化学实体的相互作用(包括通过适体的激动作用、拮抗作用、稳定化、去稳定化、从细胞、器官或全身系统的增强清除),所述实体包括可溶配体和或它们的受体,细胞外、跨膜和细胞内酶,支架/结构蛋白,RNA,DNA,脂质,脂肪酸,辅助因子和各自的特异和/或非特异的相互作用。
针对这些靶点(例如,涉及介导皮肤病的蛋白质)的适体可用于治疗皮肤病,例如,局部给药,例如,如本文所述。
炎性皮肤病
IL-23适体的局部制剂和/或局部给药可用于治疗炎性皮肤病。炎性皮肤病是指涉及一系列临床体征和症状的疾病,如搔痒、水肿、红斑和脱皮(stripping),这是由于在皮肤中引起一系列炎症反应的多种刺激因素。已知的炎性皮肤病包括,但不限于,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤。
炎性皮肤病为皮肤病学常见的问题。它们有多种形式,从伴随皮肤搔痒和发红的偶发皮疹,到慢性病症如皮炎、酒渣鼻和银屑病。皮肤炎症特征可为急性的或慢性的。急性炎症可源自对UV辐射(UVR)、电离辐射、过敏原的暴露,或与化学刺激物(肥皂、染发剂,等)的接触。这种类型的炎症通常在1至2周内解决,其中很少伴随有组织破坏。慢性炎症源自皮肤本身中持续的免疫细胞介导的炎症应答。这种炎症是长效的且可引起显著和严重的组织破坏。
慢性炎性皮肤病
慢性炎性皮肤病包括皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎和脂溢性皮炎)、痤疮、银屑病、酒渣鼻和老化皮肤。
银屑病.银屑病为一种皮肤上出现的慢性、自身免疫性疾病。
认为其身体少于3%具有银屑病的人是轻微病例。身体的3-10%被银屑病影响的人被认为是中度病例。多于10%被认为是严重的。
特应性皮炎。特应性皮炎为长期(慢性)皮肤疾病,其涉及鳞状和发痒的皮疹。
慢性炎性皮肤病治疗:
局部治疗:慢性炎性皮肤病(例如,银屑病或特应性皮炎)的局部治疗包括:水杨酸;煤焦油;芦荟;霍霍巴;巯氧吡啶锌;辣椒素;角质软化剂(例如,包含活性成分水杨酸、乳酸、尿素或苯酚);炉甘石;樟脑;苯海拉明盐酸盐(HCl);苯佐卡因和薄荷醇;维生素D类似物如卡泊三烯(例如,)或骨化三醇(例如,或);卡泊三烯和二丙酸倍他米松(例如,);局部用的类维生素A如他扎罗汀(例如,或);地蒽酚(例如,ZITHRANOLTM-RR);皮质类固醇,如丙酸氯倍他索、二丙酸倍他米松、丙酸卤倍他索、醋酸氟轻松、二乙酸二氟拉松、糠酸莫米松、二乙酸二氟拉松、哈西奈德、去羟米松、丙酸氟替卡松、戊酸倍他米松、丙酮缩氟氢羟龙、曲安奈德、氟西奈德、戊酸氢化可的松、泼尼卡酯、地奈德、氢化可的松、二丙酸阿氯米松,钙调神经磷酸酶抑制剂如他克莫司(例如,)和/或吡美莫司(例如,)。为治疗慢性炎性皮肤病(例如,银屑病或特应性皮炎),本文所述的IL-23适体可与一种或多种局部治疗组合使用。
光疗:光疗包括:紫外线B(UVB)光疗,如窄带UVB治疗;紫外线A(UVA)光疗;日光;光化学治疗,如PUVA(补骨脂素和UVA);和/或Goeckerman治疗(UVB治疗和煤焦油治疗的组合)。为治疗慢性炎性皮肤病(例如,银屑病或特应性皮炎),本文所述的IL-23适体可与一种或多种光疗组合使用。
激光治疗:激光治疗包括:准分子激光和/或脉冲染料激光。为治疗慢性炎性皮肤病(例如,银屑病或特应性皮炎),本文所述的IL-23适体可用于与一种或多种激光治疗组合使用。
非生物全身治疗:全身治疗慢性炎性皮肤病(例如,银屑病或特应性皮炎)包括:类维生素A,如阿昔曲丁(例如,或);环孢菌素;甲氨蝶呤;羟基脲(例如,);异维甲酸;吗替麦考酚酯;柳氮磺吡啶;和/或6-硫鸟嘌呤。为治疗慢性炎性皮肤病(例如,银屑病或特应性皮炎),本文所述的IL-23适体可用于与一种或多种非生物全身治疗组合使用。
生物全身治疗:生物制剂为一类全身治疗。慢性炎性皮肤病(例如,银屑病或特应性皮炎)的生物治疗包括:阿法赛特(例如,);依法珠单抗(例如,);肿瘤坏死因子-α(TNF-a)阻断剂,如依那西普(例如,),阿达木单抗(例如,),英夫利昔单抗(例如,),或高利单抗(例如,);和/或优特克单抗(例如,)。为治疗慢性炎性皮肤病(例如,银屑病或特应性皮炎),本文所述的IL-23适体可用于与一种或多种生物全身治疗组合使用。
组合治疗
术语“组合”是指使用两种或更多种药剂或疗法以治疗同一受试者,其中所述药剂或疗法的使用或作用在时间上重叠。所述药剂或疗法可同时给予(例如,作为单一制剂给予至受试者或作为两个单独的制剂同时给药)或以任何顺序相继给药。相继给药为在不同时间给药。给药一种药剂和另一种药剂之间的时间可为几分钟、几小时、几天或几周。IL-23适体也可适用于减少另一治疗的剂量,例如,减少与被给药的另一种药剂相关的副作用(反之亦然)。因此,组合可包括以比不存在IL-23适体情况下的剂量低至少10%、20%、30%或50%的剂量给药第二药剂(反之亦然)。
IL-23、IL-12和自身免疫性疾病
细胞因子的白介素(IL)-12家族(其中IL-23为一个成员)是一组结构相关的蛋白,其通过抗原呈递细胞产生,包括巨噬细胞和树突细胞,且其活化T-细胞和自然杀伤(NK)细胞[18-19]。最早的成员IL-12为由p40和p35亚单位组成的异质二聚蛋白质。IL-12刺激天然T-细胞分化为Th1细胞,其产生IFN-γ(IFN-g)和其它Th1细胞因子,且进一步刺激Th1细胞增殖[20-21]。
IL-23为IL-12家族相对新的成员,其由IL-12的p40亚单位和独特的p19亚单位组成。IL-23通过与IL-12受体不同的受体结合至Th17和NK细胞。IL-23/IL-23R相互作用具有不同的作用,包括刺激Th17细胞以增殖并产生IL-17和IL-22[22-25]。使用仅缺失IL-23(p19-/-)、仅缺失IL-12(p35-/-)、或缺失两种细胞因子(p40-/-)的小鼠的研究表明分别在MS、RA和IBD的小鼠模型中,IL-23而非IL-12是与小鼠EAE、小鼠CIA和肝螺杆菌-诱导的T细胞-依赖性结肠炎的更相关的细胞因子[26-29]。而且,Chen等人[30]报告了抗小鼠p19抑制性抗体防止小鼠EAE诱导且能够使所建立的疾病恢复。
IL-23与IL-12的不同还在于其作用位点被认为主要在局部组织中(即,皮肤、CNS、肺,等),而非全身(即,血液、淋巴结)。许多证据支持该假说(参见31)。首先,IL-23并不涉及循环Th17细胞的产生,但刺激已存在的Th17细胞的活化和增殖[31]。因此,在一些情况下,IL-23缺失并不导致循环Th17细胞的显著降低。与此一致,IL-23通常在炎症位点上调,导致在创伤处显著更多的表达IL-23R的T-细胞,而表达IL-23R的T-细胞的水平在循环中保持正常[32]。其次,当表达载体注射入脑而非注射入血液中时,外源性IL-23可拯救IL-23敲除小鼠中的EAE[26]。第三,在Rag1-/-结肠炎小鼠模型中使用IL-23R-/-代替野生型(wt)CD4+T-细胞强烈抑制了结肠炎症,而不影响全身炎症[33]。
人IL-23和IL-12都为异质二聚体,它们具有一个共同的亚单位和一个独特的亚单位。该共同的亚单位为p40亚单位,其包含以下氨基酸序列(访问号AF180563)(SEQ ID NO:3):
MCHQQLVISWFSLVFLASPLVAIWELKKDVYVVELDWYPDAPGEMVVLTCDTPEEDGITWTLDQSSEVLGSGKTLTIQVKEFGDAGQYTCHKGGEVLSHSLLLLHKKEDGIWSTDILKDQKEPKNKTFLRCEAKNYSGRFTCWWLTTISTDLTFSVKSSRGSSDPQGVTCGAATLSAERVRGDNKEYEYSVECQEDSACPAAEESLPIEVMVDAVHKLKYENYTSSFFIRDIIKPDPPKNLQLKPLKNSRQVEVSWEYPDTWSTPHSYFSLTFCVQVQGKSKREKKDRVFTDKTSATVICRKNASISVRAQDRYYSSSWSEWASVPCS
p19亚单位是IL-23特有的且包含以下氨基酸序列(访问号BC067511)(SEQ ID NO:4):
MLGSRAVMLLLLLPWTAQGRAVPGGSSPAWTQCQQLSQKLCTLAWSAHPLVGHMDLREEGDEETTNDVPHIQCGDGCDPQGLRDNSQFCLQRIHQGLIFYEKLLGSDIFTGEPSLLPDSPVGQLHASLLGLSQLLQPEGHHWETQQIPSLSPSQPWQRLLLRFKILRSLQAFVAVAARVFAHGAATLSP
IL-23和炎性皮肤病
皮肤中的IL-23表达与慢性炎性皮肤病相关(例如,银屑病和特应性皮炎)(Lowes,等人,Trends Immunol.Epublished:pii:S1471-4906(12)00199-8.doi:10.1016/j.it.2012.11.005(2013),“The IL-23/T17pathogenic axis in psoriasis is amplified by keratinocyte responses”和Toussirot,Inflamm Allergy Drug Targets 11(2):159-68(2012))。遗传相关性研究将位于p19亚单位中的某些基因变体(基因IL-23a)和IL-23受体的具体亚单位(基因IL-23R)与银屑病关联,尽管这些变体的功能结果仍需要阐明[34]。
皮肤中的许多细胞类型或者产生IL-23或者响应于IL-23。真皮上部中的树突状细胞和表皮中的朗格汉斯细胞加角质形成细胞在银屑病皮损中产生IL-23,但不在银屑病患者的正常皮肤中产生(参见35)。真皮中的CD4+T-细胞和表皮中的CD8+T-细胞、角质形成细胞和中性粒细胞在银屑病皮损中响应于IL-23、IL-17和IL-22[36]。不仅IL-23存在于银屑病患者的皮损中,而且小鼠皮肤中的直接注射或过度表达的IL-23也证实其足以发展出银屑病-样病损[37]。病损形成与小鼠IL-17a、IL-23和IL-22的增加的表达相关。通过全身递送抗-IL-23单克隆抗体(Mab)阻断注射的IL-23抑制了这些病损的形成。最后,注射抗-IL-23Mab可抑制银屑病的小鼠异种移植模型中的炎性病损的发展[38].
适体
适体为合成衍生的核酸分子,其通过除了经典Watson-Crick碱基配对之外的相互作用对分子具有特异的结合亲和力。适体能特异结合至选择的靶点并调节靶点活性。适体通过无规序列寡核苷酸的群体的体外选择过程产生,已经对超过100种蛋白质产生适体,所述蛋白质包括生长因子、转录因子、酶、免疫球蛋白和受体(参见,例如,美国专利号5,270,163和5,843,653,和Bouchard等人,Annu.Rev.Pharmacol.Toxicol.(2010)50:237-257)。典型的适体可以低于纳摩尔的亲和力结合其靶点且可辨别密切相关的靶点。
适体具有许多所需的特征以用作治疗剂和诊断剂,包括高特异性和亲和力、生物功效和优异的药代动力学性质。
适体比反义寡核苷酸尺寸大。反义寡核苷酸通常长度为约20个核苷酸;相反,适体通常更大,例如,长度至少30个核苷酸,且通常更大,例如,50-90个核苷酸。
反义寡核苷酸和适体的另一主要差异为构象结构和柔性(Nomura,Y.,等人,(2010)Nucleic Acids Res 38(21):7822-9)。反义分子的结构被主动避免,因为其可对功效有影响。适体的一个优点为结构可被修饰且仍保持活性。
适体可包含修饰,包括例如,缀合至亲脂或高分子量化合物(例如,PEG),在磷酸骨架中掺入CpG基序、掺入封端部分、掺入修饰的核苷酸、和掺入硫代磷酸酯,如本文另外所述。
在一个实施方案中,提供了结合至IL-23(IL-23)的分离的和/或非天然存在的适体。在一些实施方案中,该分离的和/或非天然存在的适体对IL-23具有的IC50少于100nM、少于10nM、少于5nM、少于1nM、少于0.5nM、少于0.25nM、或少于0.1nM。在一些实施方案中,该分离的和/或非天然存在的适体对IL-23具有的IC50为0.3nM。在本发明一些实施方案中,该IC50在体外测试中测定,其测量适体抑制PHA/IL-2活化的T细胞(源自PHA/IL-2处理的PBMC)的内源性IL-23活化的能力,通过ELISA测量磷酸化-STAT3的水平,如本文所述(“磷酸化-STAT3测试”)。
在一个实施方案中,该适体具有与SEQ ID NO:1或2的适体基本上相同的结合至IL-23的能力(例如,至少约75%、约50%、约40%、约30%、或还有约20%)。
在本发明另一实施方案中,该适体具有与SEQ ID NO:1或2的适体类似的结构(例如,类似的二级结构,例如,保留一些或全部环;和/或类似的三级结构)且也可结合至IL-23。
在本发明另一实施方案中,结合至IL-23的适体具有与SEQ ID NO:1或2的适体类似的结构(例如,类似的二级结构,例如,保留一些或全部环;和/或类似的三级结构)且可抑制(例如,减少)Stat3磷酸化,例如,在本文所述的磷酸化-STAT3测试中。
在另一实施方案中,适体(例如,结合至IL-23的适体)被用作药物组合物中的活性成分。
在另一实施方案中,本发明的适体(例如,结合至IL-23的适体)或包含该适体的组合物被用于治疗银屑病。
在另一实施方案中,本发明的结合至IL-23的适体或包含该适体的组合物被用于治疗特应性皮炎。
适体(例如,结合至IL-23的适体)可使用标准亚磷酰胺化学合成(Beaucage,S.L.and R.P.Iyer."Advances in the Synthesis of Oligonucleotides by the Phosphoramidite Approach."Tetrahedron 48(12):2223-2311(1992))。
适体(例如,结合至IL-23的适体)可作为冻干制剂提供,例如,其可在溶液或乳膏中重构,例如,用于给药,例如,局部给药。
同一性百分比:术语“序列同一性”在两种或更多种核酸序列的语境下,是指当比较和比对最大一致性时,两种或更多种序列或子序列为相同的或具有指定百分比的相同核苷酸,其使用以下序列比较算法之一或通过目测测量。对于序列比较,通常一个序列作为参考序列,将测试序列与其比较。当使用一个序列比较算法时,将测试和参考序列输入电脑,如果必要,指定子序列坐标,且指定序列算法程序参数。序列比较算法然后基于指定的程序参数计算测试序列相对于参考序列的百分比序列同一性。可以进行用于比较的最优序列比对,例如通过Smith&Waterman,Adv.Appl.Math.2:482(1981)的局部同源性算法,通过Needleman&Wunsch,J.Mol.Biol.48:443(1970)的同源性比对算法,通过Pearson&Lipman,Proc.Nat'l.Acad.Sci.USA 85:2444(1988)的寻找相似性方法,通过这些算法的计算机实施(Wisconsin Genetics软件包中的GAP、BESTFIT、FASTA和TFASTA,Genetics Computer Group,575Science Dr.,Madison,Wis.),或通过目测(通常参见,Ausubel等人)。
适合确定百分比序列同一性的算法的一个实例为用于基本的局部比对搜索工具的算法(下文称为“BLAST”),参见,例如,Altschul等人,J.Mol.Biol.215:403-410(1990)和Altschul等人,Nucleic Acids Res.,15:3389-3402(1997)。用于进行BLAST分析的软件是通过国家生物技术信息中心为公众可得的(下文称为“NCBI”)。使用可获自NCBI的软件,例如,BLASTN(用于核苷酸序列)确定序列同一性的默认参数描述于McGinnis等人,Nucleic Acids Res.,32:W20-W25(2004)。
用于炎性皮肤病的局部的抗-IL-23适体
表面、局部施加的IL-23抑制剂可为治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))的有用的方法。这种抑制剂可如例如,p40全身抑制剂一样有效,而没有全身性的免疫抑制。例如,这种抑制剂可将可治疗的银屑病患者的范围扩展为包括更多患有轻度银屑病的受试者人群。
由62-聚体寡核苷酸序列(SEQ ID NO:1)组成或包含该序列的适体(如ARC32225)可结合和抑制IL-23,且可用于,例如,治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,银屑病或特应性皮炎))(例如,可局部施加以治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))):
ARC32225为具有以下序列(SEQ ID NO:1)的62-聚体寡核苷酸:
5'-mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-fC-fG-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG-idT-3'
各碱基的糖的2’位通过2’氟或2′-O-甲氧基乙基(2′OME)基团修饰。添加3’-倒置胸苷残基以增加核酸酶抗性。包含SEQ ID NO:_的适体的一个或多个核苷酸(例如,在碱基或糖上)可如本文所述修饰。由62-聚体寡核苷酸序列(SEQ ID NO:1)组成或包含该序列的适体可结合且抑制IL-23。
由SEQ ID NO:2的61-聚体寡核苷酸组成或包含该序列的适体可结合且抑制IL-23,且可用于,例如,治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))(例如,可局部施加以治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,银屑病或特应性皮炎))):
5'-mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-fC-fG-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG-3'
包含SEQ ID NO:2的适体的一个或多个核苷酸(例如,在碱基或糖上)可如本文所述修饰。
SEQ ID NO:1或2的适体可通过本文所述的一种或多种方法稳定化。
给药
施加剂量的百分比:局部制剂以少量或薄层施加至皮肤,该少量或薄层称为限定剂量,其被认为模拟体内临床情况。这些量表示为载体(例如,药学上可接受的组合物)的量(重量)除以表面积,从而描述表面积覆盖。FDA指导为2mg/cm2或2μL/cm2,其基于20μm限定厚度的均匀膜的需求(FDA,Sunscreen drug products for over-the-counter human use,Fed Reg 43;38206-38269页,(1978))。其它引文表明该范围取决于制剂或载体及其粘度(表1)以及疾病状态。对于涉及较大体表面积的皮肤病,Surber和Davis综述了与局部制剂的施加剂量相关的领域。他们表明施加的量从0.7变化至4mg/cm2(Surber和Davis,Bioavailability and bioequivalence,in Walters,K.A.(Ed.),Dermatological and Transdermal Formulations,Marcel Dekker,New York,Basel,pp.401–498(2002))。这些量在临床情况可改变且可令人信服地以高达20mg/cm2的较高量施加。
体外实验使用范围为2-20mg/cm2的剂量用于限定剂量给药,且标准剂量平均为约10mg/cm2。该给药体积可用于估算有多少化合物渗透皮肤,其被作为施加剂量的百分比。例如,如果1%适体制剂(10mg/mL)以10mg/cm2局部施加至离体皮肤,则施加至皮肤表面的活性药物成分(“API”)或在该情况下为适体或包含该适体的组合物的总量等于100μg(假定1.0cm2给药面积)。皮肤中的浓度可转化为该量的百分比,其中1.0μg相当于1%的施加剂量,4.0μg相当于4%的施加剂量,10.0μg相当于10%的施加剂量,等等。已显示表皮中的浓度通常高于1%施加剂量且真皮中的浓度高于0.1%。这些水平是出人意料的和显著的,因为它们是通常由小分子观察到的水平。考虑到适体通常比传统API小分子更有效的,显示这些组织水平实现(达到)了治疗水平。
表1.临床(体内)情况中使用的限定剂量体积(源自Griffiths和Wilkinson,Topical Therapy:Rook A,Wilkinson DS,等人编辑。Textbook of Dermatology,London:Blackwell Scientific,3037-3084页(1992))。
使用本文所述的方法,局部施加的适体的施加剂量的0.01%至50%或0.1%至50%(0.1%至30%、0.1%至20%、0.1%至15%、0.1%至10%、或0.1%至5%)进入(渗透)至表皮中(例如,存活表皮)。
使用本文所述的方法,局部施加的适体的施加剂量的至少0.01%、至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%或至少50%进入(渗透)至表皮(例如,存活表皮)。
使用本文所述的方法,局部施加的适体的施加剂量的0.01%至50%(0.1%至40%、0.1%至30%、0.1%至20%、0.1%至15%、0.1%至10%、或0.1%至10%)进入(渗透)至真皮中。
使用本文所述的方法,局部施加的适体的施加剂量的至少0.01%、至少0.05%、至少0.1%、至少0.5%、至少1%、至少5%、或至少10%进入(渗透)至真皮中。
药效学反应.根据本文所述的方法,可以实现以实现药效学(PD)响应的水平递送适体,即,将适体与生物靶点关联以引发生理响应。这可与适体的亲和力或内在功效/活性相关。该内在功效/活性可通过代理系统定量测量以预测治疗情况中的活性,且通常呈现为IC50、EC50、pEC50等,取决于药理学靶点(即,激动剂vs.拮抗剂,等)。内在功效/活性的计算是本领域常规的:其为开发过程中药物发现和工业的标准方法(Terry Kenakin.“Pharmacodynamics in Pharmacology”,Pharmacology vol.1,319-354页,编辑:Harry Majewski;Encyclopedia of Life Support Systems,UNESCO(2009))。如本文所证实,根据本文所述的方法局部施加的适体实现的水平–在表皮(例如,存活表皮)和真皮二者中-远远超过适体的IC50。事实上,如本文所示,对于示例的适体,可在表皮(例如,存活表皮)中获得的适体水平为IC50的100-、500-、1,000-、10,000-和甚至100,000-倍;且可在真皮中获得的适体水平为IC50的10-、50-、100-、500-、1,000-和甚至5,000-倍。在本发明一个实施方案中,向受试者(例如,人受试者)皮肤局部施加适体组合物包括给药一定剂量的适体组合物至受试者,其中所述适体组合物在受试者皮肤的表皮或真皮中引起内在活性。在一个实施方案中,所述响应在表皮中。在另一实施方案中,其在真皮中。在一个实施方案中,所述活性以EC50值测量(例如,相对于感兴趣的靶点)。在另一实施方案中,所述活性作为IC50值测量(例如,相对于感兴趣的靶点)。
如本文所述,内在活性与药效学反应同义。
药物组合物
本发明提供包含适体的药物组合物(例如,药学上可接受的组合物)。在一些实施方案中,该组合物适合局部使用且包含,例如,有效量的适体,其单独存在或与一种或多种载体(例如,药学上可接受的组合物或例如,药学上可接受的载体)组合。
本发明提供用于局部给药的药物组合物,其包含结合至涉及介导皮肤病的靶点的适体。在一些实施方案中,用于局部使用的组合物可包含,例如,有效量的适体,其单独存在或与一种或多种载体(例如,药学上可接受的载体)组合。
可使用包含适体的组合物(例如,通过局部给药)以治疗或预防皮肤病。皮肤病的治疗包括改善皮肤病的至少一种症状。
包含适体的组合物可用于局部给药至患有或易患皮肤病的受试者。皮肤病包括:持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)。
患有皮肤病(例如持续炎症、细胞活跃和分化的皮肤病(例如银屑病、银屑病性关节炎、剥脱性皮炎、玫瑰糠疹、扁平苔癣、光泽苔藓、或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如天疱疮、大疱性类天疱疮、获得性大疱性表皮松解症、或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如毛发病症、指甲疾病、酒渣鼻、口周皮炎、或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如鳞状上皮细胞癌、基底细胞癌、角化棘皮瘤、良性上皮肿瘤、或梅克尔细胞癌);黑素细胞疾病(例如色素性疾病、白化病、黑色素过少症和黑色素过度病、黑素细胞痣、或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如持久隆起性红斑、嗜酸性粒细胞、面部肉芽肿瘤、坏疽性脓皮症、恶性萎缩性丘疹病、真皮和软组织的纤维性损伤、或Kaposi肉瘤);皮下组织疾病(例如脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如荨麻疹、血管性水肿、移植物抗宿主、过敏性接触性皮炎、自身敏感性皮炎、特应性皮炎、或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如热损伤、辐射性皮炎、鸡眼、或老茧);光损伤(例如急性和慢性UV辐射、或光敏作用);或由于微生物制剂引起的皮肤病(例如麻风、莱姆疏螺旋体病、甲癣、足癣、风疹、麻疹、单纯疱疹、EBV(Epstein–Barr病毒)、HPV(人乳头状瘤病毒)(例如HPV6&7)、疣、或朊病毒)的受试者,即,通过本发明方法治疗的受试者,可为脊椎动物,更具体为哺乳动物,或更具体为人。
包含适体的组合物可用于局部给药至患有或易患皮肤病的受试者。皮肤病包括:银屑病、皮炎(例如特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成、(例如瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重。该组合物可用于治疗患有炎性皮肤病(例如慢性炎性皮肤病(例如银屑病或特应性皮炎))的受试者的方法。该方法包括向受试者局部给药适体或包含该适体的组合物,使得适体至其靶点的结合降低(例如,抑制)其生物功能,从而治疗皮肤病。
患有皮肤病(例如银屑病、皮炎(例如特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成、(例如瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重)的受试者,即,通过本发明方法治疗的受试者,可为脊椎动物,更具体为哺乳动物,或更具体为人。
该适体可以一定量(有效量)局部给药,其足以在皮肤中发挥其所需生物活性。
本发明提供结合至IL-23的适体(例如,包含序列SEQ ID NO:1或2的适体,如ARC32225)的药物组合物。在一些实施方案中,该组合物适合局部使用且包含,例如,有效量的适体,其单独存在或与一种或多种载体(例如,药学上可接受的载体)组合。在一些实施方案中,该组合物适合内部使用且包含,例如,有效量的适体,其单独存在或与一种或多种载体(例如,药学上可接受的载体)组合。
包含结合至IL-23的适体的组合物可用于治疗或预防与IL-23相关的病症,例如,炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,慢性炎性皮肤病(例如,银屑病或特应性皮炎))。
包含结合至IL-23的适体的组合物可用于给药(例如,局部给药)至受试者,该受试者患有或易患炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))。该组合物可用于治疗患有炎性皮肤病(例如,慢性炎性皮肤病(例如,银屑病或特应性皮炎))的受试者的方法。该方法包括向受试者给药适体或包含该适体的组合物,使得适体与IL-23的结合降低(例如,抑制)IL-23的生物功能,从而治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))。
患有炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))的受试者,即,通过本发明方法治疗的受试者,可为脊椎动物,更具体为哺乳动物,或更具体为人。
结合至IL-23的适体可以一定量(有效量)给药,该量足以发挥其所需生物活性,例如,抑制IL-23功能,例如,如本文所述评估,例如,通过评估STAT3磷酸化、IL17表达或IL22表达;和/或通过其对炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))或其症状的作用(例如,改善)(例如,减少损伤的尺寸或数量,或,例如,减少发红)而评估。
治疗性或药理学组合物通常包含有效量的溶解或分散于载体(例如,药学上可接受的载体或介质)中的治疗活性成分(例如,适体)。药学上可接受的介质或载体包括溶剂、分散介质、增稠剂、防腐剂、包衣、抗细菌和抗真菌试剂、等渗和吸收延迟剂等。补充的活性成分也可掺入治疗组合物。
药物组合物的制备是本领域技术人员根据本发明知晓的。该组合物可作为液体溶液或悬浮液制备为局部、可注射;适合在注射前溶于或悬浮于液体的固体形式;作为延时释放胶囊;或目前使用的任何其它形式,包括滴眼剂、乳膏、洗剂、药膏、吸入剂等。使用无菌制剂也可为特别有用的。组合物也可通过微型装置,微型颗粒或海绵递送。
一旦配制后,该组合物可以与给药制剂相容的方式给药(例如,局部给药,例如,作为乳膏),且以药理学有效的量(例如,局部制剂中的固定浓度)给药。该制剂易于以多种剂型,如局部制剂(例如,乳膏)、可注射溶液,等等给药。
在本文中,待给药的组合物的活性成分的浓度或量以及组合物的体积取决于待治疗的主体受试者。给药所需的适体的精确量可取决于执业医生的判断。
可使用分散适体所需的最少体积的组合物。合适的给药方案可变化,但可包括首先给药预定剂量的适体且监测结果,然后在其它区间给予进一步的可控剂量。
该药物组合物可被灭菌和/或包含佐剂,如防腐剂、稳定剂、润湿剂或乳化剂、溶液促进剂、调节渗透压的盐和/或缓冲剂。此外,它们还可包含其它有治疗价值的物质。该组合物根据常规混合、造粒或包衣方法制备,且通常包含约0.1%至约75%、优选约0.5%至约50%或约0.75%至约10%(例如,1%)的活性成分。
液体,特别是可注射的组合物,可例如,通过溶解、分散等制备。该适体可溶于药物纯的溶剂或与其混合,例如,该药物纯的溶剂为水、盐水、水性右旋糖、甘油、乙醇等,从而形成可注射的溶液或悬浮液。此外,可配制适合于在注射前溶于液体的固体形式(例如,冻干形式)。
本发明的适体可以静脉内(弹丸注射和输注)、腹腔内、皮下或肌内形式给药,均使用药物领域技术人员已知的形式。注射剂可以常规形式制备,其为液体溶液或悬浮液。
肠胃外注射给药通常用于皮下、肌内、或静脉注射和输注。此外,肠胃外给药的一种方法使用缓慢释放或持续释放体系的植入。
而且,本发明的适体可以鼻内形式通过局部使用合适的鼻内载体、吸入剂,或通过经皮途径给药,例如,使用本领域技术人员已知的经皮皮肤贴片的形式。为以经皮递送体系的形式给药,该剂量给药可为连续的而非间歇的。其它优选的局部制剂包括乳膏、软膏、洗剂、气雾喷雾剂和凝胶,其中活性成分的浓度范围可为,例如,0.01%至25%(例如,1%),w/w或w/v或v/v。
对于固体组合物,赋形剂包括药品级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、蔗糖、碳酸镁,等。该适体可配制为栓剂,使用例如,聚亚烷基二醇,例如,丙二醇,作为载体。在一些实施方案中,栓剂有利地由脂肪乳剂或悬浮液制备。
本发明的化合物也可以脂质体递送系统形式给药,如小型单层囊泡、大型单层囊泡和多层囊泡。脂质体可由多种磷脂形成,包含胆固醇、硬脂胺或磷脂酰胆碱。在一些实施方案中,脂质成分的膜与药物水溶液水合以形成包裹药物的脂质层,如美国专利5,262,564所述。例如,该适体可作为使用本领域已知的方法构造的与亲脂化合物或非免疫源性、高分子量化合物的复合物提供。核酸相关的复合物的实例提供于美国专利6,011,020。
该适体也可与可溶聚合物偶联。这些聚合物可包括聚乙烯吡咯烷酮,吡喃共聚物,聚羟丙基-甲基丙烯酰胺-苯酚,多羟基乙基天冬酰胺(aspanamide)苯酚,或被棕榈酰基残基取代的聚氧乙烯聚赖氨酸。而且,本发明的化合物可与用于实现药物可控释放的一类生物可降解的聚合物偶联,例如,聚乳酸、聚ε己内酯、多羟基丁酸、聚原酸酯、聚缩醛、聚二氢吡喃、聚氰基丙烯酸酯、和水凝胶的交联或两亲性嵌段共聚物。
如果需要的话,待给药的药物组合物也可包含少量的无毒辅助物质如润湿剂或乳化剂、pH缓冲剂,和其它物质例如,乙酸钠和三乙醇胺油酸盐。
使用适体的剂量方案可根据多种因素选择,包括受试者的类型、物种、年龄、体重、性别、体表面积和医疗状况;待治疗疾病的严重性;给药途径;受试者的肾和肝功能;和使用的具体适体或其盐。
本发明的组合物可以单一日剂量给药,或总日剂量可以分开的剂量给予,例如,每日两次、三次或四次(等)。
局部制剂
适体可配制为局部给药。适体合适的局部制剂包括液体或半固体剂型(例如,喷雾剂(包括气溶胶)、软膏、乳膏、凝胶、洗剂、溶液、泡沫、和糊剂)。适体的制剂也可包括脂质体、胶束和/或微球体。适体也可为液体、悬浮液或粉末形式,以在悬浮液或乳剂中(包括复合乳剂),作为缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带或创伤敷料。
在一些实施方案中,该IL-23适体了配制为用于局部给药。IL-23适体的合适的局部制剂包括液体,或半固体剂型(例如,喷雾剂(包括气溶胶),软膏、乳膏、凝胶、洗剂、溶液、泡沫和糊剂)。IL-23适体的制剂还可包括脂质体、胶束和/或微球体。该IL-23适体也可为液体、悬浮液或粉末形式,以在悬浮液或乳剂(包括复合乳剂)中,作为缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带或创伤敷料。
用于局部给药的适体可配制在载体中,如喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带或创伤敷料。
用于局部给药的IL-23适体可配制在载体中,如喷雾(例如,气溶胶)、液体、软膏、乳膏、洗剂、溶液、悬浮液、乳剂、糊剂、凝胶、粉末、泡沫、缓释纳米颗粒、缓释微米颗粒、生物粘附剂、贴片、绷带或创伤敷料。
软膏为半固体制剂,其通常基于矿脂或其它石油衍生物。使用的具体的软膏底物能提供最佳药物递送,且优选地,还能提供其它所需的特征,例如,柔润性。如同其它载体或介质,该软膏底物应为惰性、稳定、不刺激和不敏感的。如Remington:The Science and Practice of Pharmacy,20th edition(Lippincott Williams&Wilkins,2000)中解释,软膏底物可分为四类:油质的、可成乳状的、乳剂、和水可溶的。油质软膏底物包括,例如,植物油、动物脂肪、和获自石油的半固体烃。可成乳状的软膏底物,也称为吸收性软膏底物,包含少量水或无水,且包括,例如,硫酸羟基甘油三硬脂酸酯、无水羊毛脂和亲水性矿脂。乳剂软膏底物为油包水(W/O)乳剂或水包油(O/W)乳剂,且包括,例如,鲸蜡醇、甘油基单硬脂酸酯、羊毛脂和硬脂酸。一些水溶性软膏底物由不同分子量的聚乙二醇制备。
乳膏为粘性液体或半固体乳剂,其为水包油(O/W)或油包水(W/O)。乳膏底物倾向于为水-可洗的,且包含油相、乳化剂和水相。
油相,也称为"内"相,可包括,但不限于,一种或多种油和/或脂肪。示例性油和脂肪包括,但不限于,脂肪酸、酯、甘油酯、脂肪醇、蜡、固醇、硅氧烷和硅烷、羊毛脂、烃、精油、植物油、矿物油和食用油,及其混合物。
在一个实施方案中,所述油为矿脂和/或脂肪醇如鲸蜡醇、或硬脂醇,或鲸蜡基硬脂醇中的至少一种。水或水相通常(尽管并不必需)超出油相的体积,且可包含至少一种乳化剂或表面活性剂。油/水中的乳化剂可为非离子、阴离子、阳离子或两性表面活性剂。
表面活性剂的亲水性/亲脂平衡(HLB)描述了表面活性剂对水或油的亲和力。HLB尺度范围为1(总体亲脂)至20(总体亲水),其中10表示两种特性是均等平衡的。亲脂表面活性剂易于形成油包水(w/o)乳剂,而亲水性表面活性剂易于形成水包油(o/w)乳剂。两种表面活性剂的混合物的HLB等于表面活性剂A的重量分数乘以其HLB值加上表面活性剂B的重量分数乘以其HLB值(加权平均值)。
该制剂可包含其他药学上可接受的赋形剂,如共溶剂、防腐剂、抗氧化剂、pH调节剂、螯合剂和渗透促进剂。
合适的乳膏制剂的一种非限制性实例可包括以下的一种或多种:羟丙基甲基纤维素;肉豆蔻酸异丙酯;甘油基单硬脂酸酯;聚乙二醇40硬脂酸酯;甘油基单硬脂酸酯;对羟基苯甲酸甲酯;和对羟基苯甲酸丙酯.
凝胶为半固体、悬浮液-类型的体系。单相凝胶包含基本上均匀分布于整个载体液体中的有机大分子,其通常为水性,但优选也包含醇,且任选地,包含油(如如上所述)。合适的胶凝剂包括但不限于交联丙烯酸聚合物如“卡波姆”家族的聚合物,例如,可作为商购获得的羧基聚亚烷基。其它胶凝剂(也称为粘度剂)为亲水性聚合物如聚氧化乙烯,聚氧乙烯-聚氧丙烯共聚物和聚乙烯基醇;纤维素聚合物如羟丙基纤维素,羟基乙基纤维素,羟丙基甲基纤维素,羟丙基甲基纤维素邻苯二甲酸酯,和甲基纤维素;胶类如黄蓍胶和黄原胶;藻酸钠;和明胶。为制备均匀的凝胶,可添加分散剂如醇或甘油,或该胶凝剂可通过研磨,机械混合或搅拌,或其组合分散。
洗剂为施加至皮肤表面而没有摩擦的制剂,且通常为液体或半液体制剂,其中固体颗粒,包括活性剂,存在于水或醇基质中。洗剂通常为固体悬浮液,且可包含水包油类型的液体油性乳剂。通常需要洗剂中的不溶物为细微的。洗剂通常包含悬浮剂以产生更好的分散且包含用于聚集和保持活性剂与皮肤接触的化合物,例如,甲基纤维素、羧基甲基-纤维素钠,等。
溶液为通过将一种或多种化学物质(溶质)溶于另一液体使得溶解物质的分子分散于那些溶剂中而制备的均匀混合物。该溶液可包含其它药学上可接受的化学物质以缓冲、稳定或保存溶质。用于制备溶液的常用的溶剂或共溶剂的实例包括,但不限于,醇如乙醇、异丙醇、苄醇,水,二醇,如丙烯或乙二醇,以及其它多元醇,如甘油。
泡沫定义为包含一种或多种活性成分、表面活性剂、水性或非水性液体和推进剂的乳剂(美国药典32(General Chapters:1151)。泡沫可从多种定义总结为用于施加至皮肤的动态剂型;通常包含活性剂、推进剂、表面活性剂、溶剂和其它赋形剂;在给药前它们密封在加压的罐中以乳剂或悬浮液或溶液形式;给药后或打开阀后,该推进剂从加压系统蒸发以产生液体或半固体泡沫产物,其随空气膨胀(Zhao等人Dynamic Foams in Topical Drug Delivery.J.Pharm&Pharmacology,2010年6月)。
糊剂为半固体剂型,其中活性剂悬浮于合适的底物。根据底物的性质,糊剂分为脂肪糊剂或由单相、水凝胶制备的糊剂。脂肪糊剂中的底物通常为矿脂或亲水性矿脂等。由单相水凝胶制备的糊剂通常掺入羧基甲基纤维素等作为底物。
制剂也可用脂质体、胶束和/或微球体制备。脂质体为微观囊泡,其具有包含脂质双层的脂质壁,且可用作药物递送系统。通常,脂质体制剂优选用于溶解性差或不溶的药物。用于本发明的脂质体制剂包括阳离子(带正电荷的)、阴离子(带负电荷的)和中性制剂。阳离子脂质体易于获得。例如,N-[1-2,3-二油基氧基)丙基]-N,N,N-三乙基铵脂质体可以商标名(GIBCO BRL,Grand Island,NY)获得。阴离子和中性脂质体也易于获得,例如,获自Avanti Polar Lipids(Birmingham,AL),或可易于使用容易获得的材料制备。这些材料包括磷脂酰胆碱、胆固醇、磷脂酰乙醇胺、二油酰基磷脂酰胆碱、二油酰基磷脂酰甘油和二油酰基磷脂酰乙醇胺。这些材料也可与N-[1-2,3-二油基氧基)丙基]-N,N,N-三乙基铵(DOTMA)以合适的比例混合。使用这些材料制备脂质体的方法是本领域已知的。
胶束包含表面活性剂分子,该表面活性剂分子设置使得它们的极性头基形成外部球壳,而疏水烃链朝向球中心取向,形成核。胶束在水溶液中形成,该水溶液包含足够高浓度的表面活性剂使得胶束自然得到。用于形成胶束的表面活性剂包括,但不限于,月桂酸钾,辛烷磺酸钠,癸烷磺酸钠,十二烷磺酸钠,月桂基硫酸钠,多库酯钠,癸基三甲基溴化铵,十二烷基三甲基溴化铵,十四烷基三甲基溴化铵,十四烷基三甲基-氯化铵,十二烷基氯化铵,聚乙二醇8十二烷基醚,聚乙二醇12十二烷基醚,壬苯醇醚10和壬苯醇醚30。例如,胶束制剂可通过掺入局部或经皮递送系统贮器,或掺入待施加至身体表面的制剂而使用。
微球体可掺入制剂和药物递送系统。类似于脂质体和胶束,微球体基本上包裹药物或包含药物的制剂。它们通常(虽然不必须),从脂质,优选带电荷脂质如磷脂形成。脂质微球体的制备是本领域已知的。
多种添加剂可包含在局部制剂中。例如,溶剂,包含相对少量的醇,可用于溶解某些药物物质。其它任选添加剂包括遮光剂、抗氧化剂、芳香剂、着色剂、胶凝剂、增稠剂、稳定剂、表面活性剂等。也可添加其它试剂,如抗微生物剂,以防止储存后腐败,即,抑制微生物如酵母和霉菌的生长。
该制剂也可包含减轻刺激的添加剂以最小化或消除由适体、碱性增强剂,或制剂的其它组分产生的皮肤刺激或皮肤损伤的可能性。合适的减轻刺激的添加剂包括,例如:α-生育酚;单胺氧化酶抑制剂,特别是苯基醇如2-苯基-1-乙醇;甘油;水杨酸和水杨酸盐;抗坏血酸和抗坏血酸盐;离子载体如莫能菌素;两亲型胺;氯化铵;N-乙酰基半胱氨酸;顺-尿刊酸;辣椒素;和氯喹。减轻刺激的添加剂,如果存在的话,可以有效减轻刺激或皮肤损伤的浓度掺入制剂,通常不超过制剂的约20wt%,更通常不超过约5wt%。
活性剂(例如,适体)在制剂中的浓度通常取决于多种因素,包括待治疗的疾病或病症(例如,炎性皮肤病,例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))、活性剂(例如,适体)的性质和活性、所需效果、可能的不利反应、活性剂(例如,适体)达到其预期靶点的能力和速度、体表面积,和其它因素。制剂可包含,例如,约0.001-50wt%,0.5-50wt%,或约0.75-10%wt%,或例如,约1w/w或v/v%数量级的活性剂(例如,适体)。
示例性载体.在本文提供的研究的过程中,研发了用于局部递送(例如,递送至皮肤表面,例如,完整的(例如,未受损的)皮肤)活性成分,如适体(例如,IL-23适体)或其它寡核苷酸(例如,反义寡核苷酸),或小分子,至受试者(例如,至哺乳动物受试者,例如,人)的多种载体。参见,例如,表4和9,且例如,其中所列的IL23适体被感兴趣的另一活性成分代替。
在本发明一个实施方案中,所述适体组合物不包含常规表面活性剂。在另一实施方案,该适体组合物包含少于2%的表面活性剂,且在另一实施方案中少于1%的表面活性剂。
在本发明一个实施方案中,该适体组合物不包含渗透促进剂。在另一实施方案,该适体组合物包含少于5%的渗透促进剂,且在另一实施方案中少于2%的渗透促进剂。
在一个实施方案中,本发明提供局部药物组合物,其包含治疗有效量的适体、油相、水相和表面活性剂,其中该组合物为水包油乳膏。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括辛酸/癸酸甘油三酯、甘油单辛酸酯、聚山梨酯80、脱水山梨醇油酸酯和去矿物质水,例如,约以表4所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括辛酸/癸酸甘油三酯、甘油单辛酸酯、聚山梨酯80、脱水山梨醇油酸酯、异丙醇和去矿物质水,例如,约以表4所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括聚山梨酯80、去矿物质水、丙二醇单辛酸酯、丙二醇二辛酸酯/二癸酸酯和二乙二醇单乙醚,例如,约以表4所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括异丙醇、去矿物质水、苄醇、Drakeol-5、Brij O2、Brij O10和西曲氯铵30%溶液,例如,约以表4所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去矿物质水、Benecel MP333C、肉豆蔻酸异丙酯、甘油基单硬脂酸酯NSE400、聚乙二醇-40-硬脂酸酯和Phenonip,例如,约以表4所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、肉豆蔻酸异丙酯、甘油基单硬脂酸酯NSE 400、聚乙二醇-40-硬脂酸酯、Phenonip、和Benecel MP333C,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、黄原胶、肉豆蔻酸异丙酯、甘油基单硬脂酸酯NSE 400、聚乙二醇-40-硬脂酸酯、无水柠檬酸、柠檬酸钾一水合物、苯氧基乙醇和苄醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、肉豆蔻酸异丙酯、Cithrol GMS 40SE–PW-(SG)、聚乙二醇-40-硬脂酸酯、Benecel MP333C、苯氧基乙醇和苄醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、鲸蜡硬脂醇、白色矿脂、Drakeol 9、聚西托醇1000BP、EDTA四钠、EDTA二钠、甘油、苯氧基乙醇和苄醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、肉豆蔻酸异丙酯、鲸蜡硬脂醇、Drakeol 9、聚西托醇1000BP、无水柠檬酸、柠檬酸钾一水合物、丙二醇、苯氧基乙醇和苄醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、肉豆蔻酸异丙酯、ST-5环二甲基硅酮、白色矿脂、Drakeol 9、聚西托醇1000BP、鲸蜡醇、脱水山梨醇单月桂酸酯、无水柠檬酸、柠檬酸钾一水合物、丙二醇和苯氧基乙醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、肉豆蔻酸异丙酯、ST-5环二甲基硅酮、Drakeol 9、聚西托醇1000BP、鲸蜡醇、脱水山梨醇单月桂酸酯、无水柠檬酸、柠檬酸钾一水合物、丙二醇和苯氧基乙醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、DIPA、肉豆蔻酸异丙酯、Drakeol 9、Eumulgin B1 PH-鲸蜡硬脂醇聚醚12、无水柠檬酸、柠檬酸钾一水合物、丙二醇和苄醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、DIPA、轻液状石蜡、Eumulgin B1PH-鲸蜡硬脂醇聚醚12、BHT、无水柠檬酸、柠檬酸钾一水合物、山梨酸和山梨酸钾,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、鲸蜡硬脂醇、白色矿脂、Drakeol 9、聚西托醇1000BP、无水柠檬酸、柠檬酸钾一水合物、丙二醇、苯氧基乙醇和苄醇,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、肉豆蔻酸异丙酯、丙二醇、苄醇、Transcutol P和二甲基异山梨醇酯,例如,约以表9所列的量。
本发明提供用于局部递送活性剂(例如,适体)的载体,其中所述载体包括去离子水、聚山梨酯20和苄醇,例如,约以表9所列的量。
如本文所述,“约”是指与表中所列的量相差不超过10%(例如,多10%或少10%)的量。优选地,“约””是指比所述量大5%或小5%的量。更优选“约””是指比所述量大2%或小2%的量。
本发明还提供局部给药活性成分至受试者的方法(例如,哺乳动物受试者,例如,人)(例如,至皮肤表面,例如,完整的(例如,未受损的)皮肤),该方法包括:
向受试者局部给药载体,例如,包含其中所列的组分(包括所列的IL-23适体)的表4或9所列的载体,例如,其中载体的组分以约其中所列的量,其中所述载体包括活性成分。
在一些实施方案中,该活性成分为适体(例如,IL-23适体)。
在该方法的一些实施方案中,所述载体包括辛酸/癸酸甘油三酯、甘油单辛酸酯、聚山梨酯80、脱水山梨醇油酸酯和去矿物质水,例如,约以表4所列的量。
在该方法的一些实施方案中,所述载体包括辛酸/癸酸甘油三酯、甘油单辛酸酯、聚山梨酯80、脱水山梨醇油酸酯、异丙醇和去矿物质水,例如,约以表4所列的量。
在该方法的一些实施方案中,所述载体包括聚山梨酯80、去矿物质水、丙二醇单辛酸酯、丙二醇二辛酸酯/二癸酸酯、和二乙二醇单乙醚,例如,约以表4所列的量。
在该方法的一些实施方案中,所述载体包括异丙醇、去矿物质水、苄醇、Drakeol-5、Brij O2、Brij O10和西曲氯铵30%溶液,例如,约以表4所列的量。
在该方法的一些实施方案中,所述载体包括去矿物质水、Benecel MP333C、肉豆蔻酸异丙酯、甘油基单硬脂酸酯NSE 400、聚乙二醇-40-硬脂酸酯和Phenonip,例如,约以表4所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、肉豆蔻酸异丙酯、甘油基单硬脂酸酯NSE 400、聚乙二醇-40-硬脂酸酯、Phenonip和Benecel MP333C,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、黄原胶、肉豆蔻酸异丙酯、甘油基单硬脂酸酯NSE 400、聚乙二醇-40-硬脂酸酯、无水柠檬酸、柠檬酸钾一水合物、苯氧基乙醇和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、肉豆蔻酸异丙酯、Cithrol GMS 40SE–PW-(SG)、聚乙二醇-40-硬脂酸酯、Benecel MP333C、苯氧基乙醇和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水,鲸蜡硬脂醇,白色矿脂,Drakeol 9、聚西托醇1000BP、EDTA四钠、EDTA二钠、甘油、苯氧基乙醇和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、肉豆蔻酸异丙酯、鲸蜡硬脂醇、Drakeol 9、聚西托醇1000BP、无水柠檬酸、柠檬酸钾一水合物、丙二醇、苯氧基乙醇和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、肉豆蔻酸异丙酯、ST-5环二甲基硅酮、白色矿脂、Drakeol 9、聚西托醇1000BP、鲸蜡醇、脱水山梨醇单月桂酸酯、无水柠檬酸、柠檬酸钾一水合物、丙二醇和苯氧基乙醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、肉豆蔻酸异丙酯、ST-5环二甲基硅酮、Drakeol 9、聚西托醇1000BP、鲸蜡醇、脱水山梨醇单月桂酸酯、无水柠檬酸、柠檬酸钾一水合物、丙二醇和苯氧基乙醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、DIPA、肉豆蔻酸异丙酯、Drakeol 9、Eumulgin B1PH-鲸蜡硬脂醇聚醚12、无水柠檬酸、柠檬酸钾一水合物、丙二醇和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、DIPA、轻液状石蜡、Eumulgin B1PH-鲸蜡硬脂醇聚醚12、BHT、无水柠檬酸、柠檬酸钾一水合物、山梨酸和山梨酸钾,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、鲸蜡硬脂醇、白色矿脂、Drakeol 9、聚西托醇1000BP、无水柠檬酸、柠檬酸钾一水合物、丙二醇、苯氧基乙醇和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、肉豆蔻酸异丙酯、丙二醇、苄醇、Transcutol P和二甲基异山梨醇酯,例如,约以表9所列的量。
在该方法的一些实施方案中,所述载体包括去离子水、聚山梨酯20和苄醇,例如,约以表9所列的量。
在该方法的一些实施方案中,该活性成分局部给药以治疗皮肤病(例如,银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现,秃头症,斑秃,成人呼吸窘迫综合征,肺纤维化,硬肿症,瘢痕形成,(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重)。
在该方法的一些实施方案中,该活性成分局部给药以治疗皮肤病,例如,持续炎症、细胞活跃和分化的皮肤病(例如,银屑病,银屑病性关节炎,剥脱性皮炎,玫瑰糠疹,扁平苔癣,光泽苔藓,或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如,天疱疮,大疱性类天疱疮,获得性大疱性表皮松解症,或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如,毛发病症,指甲疾病,酒渣鼻,口周皮炎,或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如,鳞状上皮细胞癌,基底细胞癌,角化棘皮瘤,良性上皮肿瘤,或梅克尔细胞癌);黑素细胞疾病(例如,色素性疾病,白化病,黑色素过少症和黑色素过度病,黑素细胞痣,或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如,持久隆起性红斑,嗜酸性粒细胞,面部肉芽肿瘤,坏疽性脓皮症,恶性萎缩性丘疹病,真皮和软组织的纤维性损伤,或Kaposi肉瘤);皮下组织疾病(例如,脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如,荨麻疹,血管性水肿,移植物抗宿主,过敏性接触性皮炎,自身敏感性皮炎,特应性皮炎,或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如,热损伤,辐射性皮炎,鸡眼,或老茧);光损伤(例如,急性和慢性UV辐射,或光敏作用);或由于微生物制剂引起的皮肤病(例如,麻风,莱姆疏螺旋体病,甲癣,足癣,风疹,麻疹,单纯疱疹,EBV(Epstein–Barr病毒),HPV(人乳头状瘤病毒)(例如,HPV6&7),疣,或朊病毒)。
在一些实施方案中,所述药物用于治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))。
本发明还提供用于局部给药活性成分至受试者(例如,哺乳动物受试者,例如,人)(例如,至皮肤表面,例如,完整的(例如,未受损的)皮肤)的载体,其中所述载体为包含其中所列的组分的表4或9所列的载体(不包括所列的适体),例如,其中载体的组分以约其中所列的量,其中所述载体包括活性成分。
在一些实施方案中,所述活性成分为适体(例如,IL-23适体)。
在一些实施方案中,所述载体局部给药以治疗皮肤病(例如,持续炎症、细胞活跃和分化的皮肤病(例如,银屑病,银屑病性关节炎,剥脱性皮炎,玫瑰糠疹,扁平苔癣,光泽苔藓,或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如,天疱疮,大疱性类天疱疮,获得性大疱性表皮松解症,或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如,毛发病症,指甲疾病,酒渣鼻,口周皮炎,或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如,鳞状上皮细胞癌,基底细胞癌,角化棘皮瘤,良性上皮肿瘤,或梅克尔细胞癌);黑素细胞疾病(例如,色素性疾病,白化病,黑色素过少症和黑色素过度病,黑素细胞痣,或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如,持久隆起性红斑,嗜酸性粒细胞,面部肉芽肿瘤,坏疽性脓皮症,恶性萎缩性丘疹病,真皮和软组织的纤维性损伤,或Kaposi肉瘤);皮下组织疾病(例如,脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如,荨麻疹,血管性水肿,移植物抗宿主,过敏性接触性皮炎,自身敏感性皮炎,特应性皮炎,或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如,热损伤,辐射性皮炎,鸡眼,或老茧);光损伤(例如,急性和慢性UV辐射,或光敏作用);或由于微生物制剂引起的皮肤病(例如,麻风,莱姆疏螺旋体病,甲癣,足癣,风疹,麻疹,单纯疱疹,EBV(Epstein–Barr病毒),HPV(人乳头状瘤病毒)(例如,HPV6&7),疣,或朊病毒)。
在一些实施方案中,所述载体局部给药以治疗皮肤病(例如,银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现,秃头症,斑秃,肺纤维化,硬肿症,瘢痕形成,(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重)。
在一些实施方案中,所述药物用于治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))。
本发明还提供载体在制备用于局部给药活性成分至受试者(例如,哺乳动物受试者,例如,人)(例如,至皮肤表面,例如,完整的(例如,未受损的)皮肤)的药物中的用途,其中所述载体为包含其中所列的组分的表4或9所列的载体(不包括所列的适体),例如,其中载体的组分以约其中所列的量,其中所述载体包括活性成分。
在一些实施方案中,所述活性成分为适体(例如,IL-23适体)。在一些实施方案中,所述药物用于治疗皮肤病(例如,持续炎症、细胞活跃和分化的皮肤病(例如,银屑病,银屑病性关节炎,剥脱性皮炎,玫瑰糠疹,扁平苔癣,光泽苔藓,或汗孔角化症);表皮粘连、水泡性和大疱性疾病的皮肤病(例如,天疱疮,大疱性类天疱疮,获得性大疱性表皮松解症,或手掌或脚底的脓疱疹);表皮附属器的皮肤病和相关疾病(例如,毛发病症,指甲疾病,酒渣鼻,口周皮炎,或毛囊综合症);皮肤病如表皮和附属器肿瘤(例如,鳞状上皮细胞癌,基底细胞癌,角化棘皮瘤,良性上皮肿瘤,或梅克尔细胞癌);黑素细胞疾病(例如,色素性疾病,白化病,黑色素过少症和黑色素过度病,黑素细胞痣,或黑素瘤);真皮的炎性和肿瘤疾病的皮肤病(例如,持久隆起性红斑,嗜酸性粒细胞,面部肉芽肿瘤,坏疽性脓皮症,恶性萎缩性丘疹病,真皮和软组织的纤维性损伤,或Kaposi肉瘤);皮下组织疾病(例如,脂膜炎或脂肪营养障碍);涉及改变的反应性的皮肤变化的皮肤病(例如,荨麻疹,血管性水肿(angiodererma),移植物抗宿主,过敏性接触性皮炎,自身敏感性皮炎,特应性皮炎,或脂溢性皮炎);由于机械和物理因素引起的皮肤变化(例如,热损伤,辐射性皮炎,鸡眼,或老茧);光损伤(例如,急性和慢性UV辐射,或光敏作用);或由于微生物制剂引起的皮肤病(例如,麻风,莱姆疏螺旋体病,甲癣,足癣(tinea pedra),风疹,麻疹,单纯疱疹,EBV(Epstein–Barr病毒),HPV(人乳头状瘤病毒)(例如,HPV6&7),疣,或朊病毒)。
在一些实施方案中,所述活性成分为适体(例如,IL-23适体)。在一些实施方案中,所述药物用于治疗皮肤病(例如,银屑病、皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、慢性发疱(大疱)疾病、痤疮、免疫介导的疾病的脂溢性皮肤表现、秃头症、斑秃、硬肿症、瘢痕形成,(例如,瘢痕疙瘩或肥厚性瘢痕)、荨麻疹、酒渣鼻、黑素瘤、慢性阻塞性肺疾病(COPD)加重、源自肾移植的炎症、哮喘加重、化脓性汗腺炎、类风湿性关节炎加重、银屑病性关节炎加重、Sjogren综合征加重、葡萄膜炎加重、移植物抗宿主病(GVHD)加重、口腔扁平苔癣、关节痛加重或胰岛细胞移植炎症加重)。
在一些实施方案中,所述药物用于治疗炎性皮肤病(例如,慢性炎性皮肤病(例如,皮炎(例如,特应性皮炎、接触性皮炎、湿疹性皮炎或脂溢性皮炎)、痤疮、银屑病、酒渣鼻或老化皮肤,例如,银屑病或特应性皮炎))。
调节适体治疗剂的药代动力学和生物分布
重要的是所有基于寡核苷酸的治疗,包括适体,的药代动力学性质被定制以匹配所需的药物应用。尽管针对细胞外靶点的适体不会遇到细胞内递送相关的困难,但该适体必须也能够分配以靶向器官和组织,且保持在治疗位点(例如,患病(例如,银屑病)皮肤)或在体内(未改变)达到与所需给药方案一致的一段时间。
本发明提供影响适体组合物的药代动力学的材料和方法,且,特别是,调节适体药代动力学的能力。适体药代动力学的可调性(即,调节能力)可通过将修饰部分(例如,PEG聚合物)缀合至适体和/或掺入修饰的核苷酸(例如,2'-氟或2'-O-甲基,例如,在糖基上)以改变核酸的化学组成而实现。调节适体药代动力学的能力用于改善现有治疗应用,或者,用于开发新的治疗应用。例如,在一些治疗应用中,例如,其中作用位点局部接触(例如,治疗皮肤,例如,患病(例如,银屑病皮肤))或在抗肿瘤或急性护理设置中或当适体持续的全身分布不需要时,其中快速药物清除或断开可能是需要的,期望的是减少适体在循环中的停留时间。或者,在其它治疗应用中,例如,其中需要治疗剂的体循环的维持疗法中,可能期望的是增加适体在循环中的停留时间。
此外,适体药代动力学的可调性可用于修饰适体在受试者中的生物分布。例如,在一些治疗应用中,可能期望改变适体治疗剂的生物分布以靶向具体类型的组织或具体器官(或器官组)。在这些应用中,适体优选聚集在具体组织或器官中。在其它治疗应用中,可能期望靶向展示细胞标记或与给定疾病相关的症状、细胞损伤或其它异常病理的组织,使得适体治疗剂优选聚集在受影响的组织。
为确定适体治疗剂(例如,适体缀合物或具有改变的化学性质的适体,如修饰的核苷酸)的药代动力学和生物分布概况,可监测多种参数。这些参数包括,例如,适体组合物的半衰期(t1/2)、血浆清除率(C1)、分布体积(Vss)、浓度-时间曲线下面积(AUC)、最大观测的血清或血浆浓度(Cmax)、和平均停留时间(MRT)。如本文所述,术语“AUC”是指在适体给药后适体治疗剂的血浆浓度对时间的曲线下面积。AUC值用于估算给定适体的生物利用度(即,适体给药后给药的适体治疗剂在循环中的百分比)和/或总清除率(C1)(即,适体治疗剂从循环中去除的速率)。分布体积将适体治疗剂的血浆浓度与体内存在的适体的量相关联。Vss越大,在血浆外发现的适体越多(即,外渗更多)。
本发明提供以可控的方式,体内调节稳定的适体组合物的药代动力学和生物分布的材料和方法,例如,通过将适体缀合至调节部分如小分子、肽或聚合物末端基,或通过将修饰的核苷酸掺入适体。如本文所述,缀合修饰部分和/或改变核苷酸的化学组成可改变适体在循环中的停留时间和向组织分布的根本方面。
除了被核酸酶清除,寡核苷酸治疗剂通过肾过滤进行消除。例如,静脉内给药的核酸酶-抗性的寡核苷酸可显示<10min的体内半衰期,除非过滤可被阻断。这可通过促进从血流快速分布进入组织或通过增加寡核苷酸的表观分子量至大于小球的有效尺寸截留而实现。以下描述的适体与PEG(聚乙二醇)聚合物的缀合(聚乙二醇化),可显著加长适体在循环中的停留时间,从而减少给药频率。
适体可缀合至多种修饰部分,如高分子量聚合物,例如,PEG;肽,例如,Tat(HIV Tat蛋白的13-氨基酸片段(Vives,等人,(1997),J.Biol.Chem.272(25):16010-7)),Ant(衍生自果蝇控制触角的基因同源异型蛋白的第三个螺旋的16-氨基酸序列(Pietersz,等人,(2001),疫苗19(11-12):1397-405))或Arg7(由多聚精氨酸(Arg.sub.7)构成的短的、带正电荷的细胞渗透肽(Rothbard,等人,(2000),Nat.Med.6(11):1253-7;Rothbard,J等人,(2002),J.Med.Chem.45(17):3612-8));和小分子,例如,亲脂化合物如胆固醇。在本文所述的多种缀合物中,适体的体内性质最深刻地通过与PEG基团复合而改变。例如,混合的2'-F和2'-OMe修饰的适体治疗剂与20kDa PEG聚合物复合可阻止肾过滤且促进适体分布至健康和发炎的组织。而且,该20kDa PEG聚合物-适体缀合物可证明在防止适体肾过滤方面几乎与40kDa PEG聚合物一样有效。尽管聚乙二醇化的一个作用是作用于适体清除,但20kDa部分的存在得到的延长的全身暴露也促进适体至组织的分布,特别是高度灌注器官的那些。
修饰的核苷酸可用于调节适体的血浆清除率。例如,掺入2'-F和2'-OMe稳定化学的未缀合的适体,其为典型的当代适体因为其展示高度的核酸酶体外和体内稳定性,当与未修饰的适体比较,其可显示从血浆的快速损失(即,快速血浆清除率)和快速分布至组织。
2'-O-甲基、2'-氟和其它修饰的核苷酸修饰可针对核酸酶稳定适体且增加其半衰期体内。3'-idT帽可增加核酸外切酶抗性。参见,例如,U.S.Pat.Nos.5,674,685;5,668,264;6,207,816;和6,229,002。
PEG-衍生的核酸
如上所述,核酸被高分子量非免疫源性聚合物的衍生化具有改变核酸的药代动力学和药效学性质的潜能,使得它们为更有效的治疗剂。活性有利的变化可包括增加的对核酸酶降解的抗性,减少的通过肾过滤,减少的暴露于免疫系统,和改变的治疗剂通过身体的分布。
本发明的适体可用聚亚烷基二醇(“PAG”)部分衍生化。本发明使用的典型聚合物包括聚乙二醇(“PEG”),也称为聚氧化乙烯(“PEO”)和聚丙二醇(包括聚异丙二醇)。此外,不同环氧烷(例如,环氧乙烷和环氧丙烷)的无规或嵌段共聚物可在许多应用中使用。在其最常见形式,聚亚烷基二醇,如PEG,为在各末端以羟基终止的线性聚合物:HO--CH2CH2O--(CH2CH2O)n--CH2CH2--OH。该聚合物,α-,ω-二羟基聚乙二醇,也可表示为HO-PEG-OH,其中应理解-PEG-符号代表以下结构单元:--CH2CH2O--(CH2CH2O)n--CH2CH2—其中n通常范围为约4至约10,000。
如所示,所示PEG分子为二官能性并且有时称为“PEG二醇”。PEG分子的末端部分为相对无反应性的羟基部分,--OH基团可活化或转化成用于使PEG与其它化合物在所述化合物上的反应性位点连接的官能部分。所述活化的PEG二醇在本文中称为双活化的PEG。例如,PEG二醇的末端部分已被官能化为活性碳酸酯以用于与氨基部分选择性反应,其通过用N-羟基琥珀酰亚胺的琥珀酰亚胺基活性酯部分取代相对无反应性的羟基部分--OH。
在许多应用中,需要对PEG分子在一个末端上用基本上无反应性的部分加帽,以使PEG分子成为单官能(或单活化型)。为生成单活化型PEG,通常将PEG二醇分子末端上的一个羟基部分用非反应性甲氧基末端部分--OCH3取代。PEG分子的其它未加帽末端通常转化成反应性末端部分,其可活化以供在表面或分子(如蛋白质)上的反应性位点连接。
PAGs为通常具有在水和许多有机溶剂中的溶解性、没有毒性、且没有免疫原性的性质聚合物。PAGs的一个用途为共价连接聚合物至不溶的分子以使得所得PAG-分子“缀合物”可溶。例如,已表明水不溶性药物紫杉醇,当偶联至PEG时,变为水溶性。Greenwald,等人,J.Org.Chem.,60:331-336(1995)。PAG缀合物经常不仅应用增强溶解性和稳定性,而且延长分子的血液循环半衰期。
本发明的多烷基化化合物通常尺寸为5至80kDa,但可使用任何尺寸,其选择其具有适体和应用。例如,其它PAG化合物尺寸可为10至80kDa或10至60kDa。例如,PAG聚合物的尺寸可为至少10,20,30,40,50,60,或80kDa。这些聚合物可为直链或支链的。在一些实施方案中,该聚合物为PEG。在一些实施方案中,该聚合物为支链PEG。
与生物表达的蛋白质治疗剂形成对照,核酸治疗剂通常由活性单体核苷酸化学合成。PEG-核酸缀合物可使用相同的迭代单体合成通过掺入PEG而制备。例如,通过转化为亚磷酰胺形式活化的PEG可掺入固体-相寡核苷酸合成。或者,寡核苷酸合成可通过位点-特异性掺入反应性PEG连接位点而完成。最常见的是这已通过在5'-端添加游离伯胺而实现(在固相合成的最后的偶联步骤使用修饰物亚磷酰胺掺入)。使用该方法,反应性PEG(例如,其被活化以使得其将与胺反应和形成键)与纯化的寡核苷酸组合且偶合反应在溶液中进行。
PEG缀合以改变治疗剂的生物分布的能力与多种因素相关,包括缀合物的表观尺寸(例如,针对水力半径测量)。已知更大的缀合物(>10kDa)更有效阻断经由肾的过滤且因此增加小的大分子(例如,肽、反义寡核苷酸)的血清半衰期。已显示PEG缀合物阻断过滤的能力随着PEG尺寸增加至约50kDa而增加。
产生更高分子量的活化PEG的一个方法包括形成支链的活化PEG,其中两个或更多个PEG连接至携带活化基团的中心核。这些更高分子量的PEG分子的末端部分,即,相对无反应性的羟基(--OH)部分,可被活化,或转化为官能团部分,用于在化合物的反应性位点将一个或多个PEG连接至其它化合物。支链活化PEG将具有多于两个末端,且在两个或更多个末端被活化的情况下,这些活化的更高分子量的PEG分子在此称为多活化的PEGs。在一些情况下,支链PEG分子中并非所有末端被活化。在支链PEG分子的任何两个末端被活化的情况下,这些PEG分子称为双活化的PEGs。在支链PEG分子中仅有一个末端被活化的一些情况下,这些PEG分子称为单-活化的。作为该方法一个实例,已描述了通过将两个单甲氧基PEG连接至赖氨酸核(其随后活化以用于反应)制备的活化的PEG(Harris等人,Nature,vol.2:214-221,2003)。
反应性核酸的PEG-衍生化
高分子量PEG-核酸-PEG缀合物可通过将单-官能活化的PEG与包含多于一个反应性位点的核酸反应制备。在一个实施方案中,该核酸为双反应性的,或双活化的,且包含两个反应性位点:通过常规亚磷酰胺合成,例如:3'-5'-二-聚乙二醇化引入寡核苷酸的5'-氨基和3'-氨基。在替代实施方案中,反应性位点可在内部位置引入,使用例如,嘧啶的5-位、嘌呤的8-位,或核糖的2'-位作为伯胺的连接位点。在这些实施方案中,核酸可具有多个活化的或反应性位点且据称为多活化的。合成和纯化后,修饰的寡核苷酸在促进与寡核苷酸反应性位点的选择性反应同时最小化自发水解的条件下与单-活化的PEG组合。在一个实施方案中,单甲氧基-PEG被琥珀酰亚胺基丙酸酯活化且该偶联反应在pH 8.3进行。为驱动二取代的PEG的合成,提供相对寡核苷酸化学计量过量的PEG。反应后,PEG-核酸缀合物通过凝胶电泳或液相色谱法纯化以分离完全、部分和未缀合的物质。
连接区域也可具有一个或多个聚亚烷基二醇部分与其连接。这些PEG可为不同长度且可以合适的组合使用以实现所需组合物分子量。
特定连接基的作用可被其化学组成和长度影响。连接基太长、太短或与IL-23形成不利位阻和/或离子相互作用将阻碍适体和IL-23的复合物的形成。连接基的长度长于所需长度,可通过降低配体有效浓度而减少结合稳定性。因此,可能需要优化连接基组成和长度以最大化适体与靶点的亲和力。
局部给药的作为生物传感器的适体
适体已被选择针对很宽范围的靶点,如金属离子、小分子、肽、蛋白质和细胞(Keefe等人,Nat.Rev.Drug Discov.(2010)9:537–550)。
由于可获得对感兴趣靶点的高特异性和亲和力,适体特别适合检测感兴趣的(例如,由于诊断目的)。利用这些所需特征,基于适体的传感器已被开发以检测多样的靶点集、包括腺苷、三磷酸腺苷(ATP)、可卡因、Hg2+、毒素、凝血酶、血管内皮生长因子(VEGF)、IgE,等等。参见,例如,Wang等人,Curr Med Chem(2011)18(27):4175-4184。
如本文公开,局部施加的适体能渗透皮肤,即使是完整皮肤。因此,局部施加的适体作为生物传感器可为有价值的工具,其针对皮肤中可能存在的(例如,表皮(例如,存活表皮)或真皮)感兴趣的靶点,例如,用于诊断目的(例如,用于癌症(例如,黑素瘤)细胞检测,例如,使用结合至癌症-特异的靶点的适体,例如使用适体以结合至癌细胞)。一般情况下,该方法包括向受试者(例如,人)的皮肤(例如,完整皮肤)局部施加对皮肤中可能存在的感兴趣的靶点特异的适体,且检测该结合至靶点的适体(且例如,或者定量结合至其靶点的适体量,或者定性标记该靶点)。该适体可缀合至荧光标记(荧光团),其中多种实例是本领域已知的,如基于荧光素-、双-芘基-、DMDAP-、ATMND-、和量子点的荧光团。检测方法可基于在适体结合至其靶点后荧光信号的增加;或其可基于在适体结合至其靶点后荧光信号的减少。更具体地,可使用多种方法以使用局部施加的适体作为生物传感器以用于可存在于皮肤(例如,表皮(例如,存活表皮)或真皮)中的感兴趣的靶点,如以下实施例所证实。荧光变化可通过以下方法被检测和测量:如荧光显微镜、MRI、PET、或荧光寿命成像显微镜检查(FLIM)。在一些方法中,适体与其靶点的结合可使用扩增方法如PCR或DHA检测和测量。
已知适体在与靶点结合前后具有显著不同的构象/结构。通过直接用荧光团修饰,适体的构象和/或结构可硬染料的荧光。信号变化,增加(即,“信号-开”模式)或减少(即“信号-关”模式),可反映结合过程的程度,从而允许定性或定量测量靶点浓度。
在基于荧光标记的适体的典型的“信号-开”生物传感器中,适体的一端缀合至荧光团,且其荧光信号被猝灭剂(其也可可为另一荧光团)猝灭。一旦分离荧光团和猝灭剂(通过适体结合),该荧光信号恢复,其可用于检测和定性或定量测量靶浓度。
在许多情况下,靶点结合后适体的构象变化可显著影响缀合染料的荧光。
荧光团可用于在多种适体的所选位置修饰2’-核糖,其显示在靶点与适体结合后增加的荧光(Merino等人,J.Am.Chem.Soc.(2005)127:12766-12767)。这些生物传感器可在缓冲溶液和甚至在生物样品中具有宽的检测范围。因为荧光团缀合可减少适体的靶点结合亲和力,通过位阻或干扰其折叠,荧光素-修饰的尿苷可掺入三磷酸核苷(NTP)库以用于结合至ATP的RNA适体的体外SELEX(Jhaveri等人,Nat.Biotechnol.(2000)18:1293-1297)。为避免在一个适体中有多重荧光残留(其可导致在靶点结合后不可检测的荧光信号变化),NTP库中仅有较小的百分比为荧光素修饰的尿苷。所选的适体能在μM范围检测ATP,其中最好的仅包含一个荧光素修饰的尿苷。此外,其它荧光染料也可用于实现类似的信号传递特异性和敏感性。
尽管基于“信号-关”模式的传感器可能比基于“信号-开”模式的那些较不敏感,但它们可导致对具有低亲和力适体的靶点有更好的检测。更重要的是,对于“信号-关”传感器需要较少步骤的更简单设计,其可能是方便的和成本有效的(Stojanovic等人,Am.Chem.Soc.(2001)123:4928–4931;Liu等人,Anal.Chem.(2009)81:2383–2387)。
通常,荧光供体和猝灭剂分别缀合至适体的两端。在靶点结合后,适体的构象变化使供体和猝灭剂改变位置以紧密靠近,其导致荧光淬灭。
在一些情况下,在结合至适体后,分析物(靶点)可淬灭某些染料的荧光。
基于“信号-开”适体的生物传感器的另一策略包括使用无标记适体,其在靶点结合后,可置换之前淬灭或荧光较少的荧光团。
金纳米颗粒和某些荧光团可通过核酸碱基淬灭。包含脱碱基位点(如“dSpacer”)的ssODN,可被构建和杂交至结合至感兴趣靶点的适体(Xiang等人,J.Am.Chem.Soc.(2009)131:15352-15357)。所得双联体可在dSpacer用2-氨基-5,6,7-三甲基-1,8-萘啶(ATMND)嵌入,dSpacer的荧光被淬灭。靶点结合后,适体经历结构变化且释放包含dSpacer的ssODN,导致ATMND的荧光恢复。
基于PCR或基于DHA的方法也可用于检测结合至其靶点的适体。例如,可制备结合至感兴趣的靶点的两个适体(一个包含如发夹结构的结构)。一旦结合靶点后,适体中发生结构变化,使得适体的一部分(例如,3’端)可用于引物结合和PCR扩增。例如,在适体局部施加至受试者皮肤后,可获取治疗皮肤的样品用于引物结合和PCR扩增。参加,He等人,Anal.Chem.(2010)82:1358-1364。适体的自由部分(例如,3’端)可通过探针结合且通过DHA检测。
为测量与小分子结合的适体,可设计置换试验,其中荧光素标记的寡核苷酸与适体预杂交,其随后被可被适体识别的小分子置换(Cruz-Aguado和Penner,Anal.Chem.(2008)80:8853-8855)。类似的,适体可用于检测或评估结合至其靶点的小分子。例如,荧光被淬灭的标记的适体在结合至其靶点后经历结构变化,在分离荧光团和猝灭剂(通过适体结合)后,荧光信号恢复,其可用于检测和定性或定量测量未结合至小分子的靶点。如果小分子结合至靶点,适体荧光团将保持淬灭。
本文提及的所有出版物、专利申请、专利和其它文献以其整体在此引入作为参考。在由矛盾的情况下,以本说明书(包括定义)为准。此外,所述材料、方法和实例仅为解释性的,不用来限制。
实施例
大多数描述局部递送大分子量化合物的文献依赖于使用动物模型,其中皮肤更易渗透,且分析技术受其精确评估这些分子在皮肤中的局部递送和与靶点结合的能力所限。已开发了对人IL23细胞因子具有高亲和力和特异性的IL23的62-核苷酸(MW=20,395Da)适体抑制剂(ARC32225)。如本文所示,基于RNA的适体可渗透人皮肤而不物理破坏角质层,其使用良好验证的模型以评估被动局部递送。使用新的分析技术以提取和检测适体,使用不同的递送载体以治疗水平定量该被动递送。这些治疗水平使用离体人皮肤模型证实其生物活性,该模型仅可从局部施加来解释。该研究首次显示了大分子的被动递送穿过人皮肤从而能与靶点结合以引发局部生物响应,且代表了宽泛种类的生物化合物,其可打开用于局部靶向皮肤病和诊断的领域。
实施例1:ARC32225的选择和初始表征
ARC32225为62-残基寡核苷酸(图1A)。该寡核苷酸由10个2'-O-甲基腺苷(mA)、1个2'-氟腺苷(fA)、14个2'-O-甲基鸟苷(mG)、6个2'-氟鸟苷(fG)、3个2'-O-甲基胞嘧啶(mC)、13个2'-氟胞嘧啶(fC)、1个2'-O-甲基尿苷(mU)、13个2'-氟尿苷(fU)构成,且3’-端被单个的倒置脱氧胸苷残基(idT)封端以防止被核酸酶降解。使用一系列修饰的寡核苷酸分子进行产生ARC32225的体外选择实验,其各自使用mA、mG、fC和fU残基产生。选择中使用的重组白介素23(IL-23)获自R&D Systems(目录#1290-IL-010/CF)。
进行选择的重复循环以结合至IL-23然后扩增,从而产生ARC20122,其为ARC32225的84个核苷酸长度的前体。
ARC20122的序列为SEQ ID NO:5:
5'mG-mG-mA-mG-mG-mG-mA-mA-mA-mA-mG-fU-fU-mA-fU-fC-mA-mG-mG-fC-fU-fU-fC-fU-mA-fU-fC-mG-mG-mG-fC-mG-fC-fC-mG-fC-mG-fU-fU-fU-fU-fC-fC-fC-fU-mG-fU-mG-fU-fU-mA-mG-fC-fC-mA-fU-fC-mG-fU-fC-fC-mG-mA-fC-mG-mA-mG-fU-mA-mG-mG-fC-fU-mA-mG-fU-fC-fU-mG-mA-fU-mG-fC-fC 3'
ARC20122使用计算折叠预测程序和系统删除从84个核苷酸最小化为61个核苷酸。对各碱基在糖2’位的修饰进行评估以改善活性以及预测体外稳定性,其通过用2′-O-甲氧基乙基(2′OME)取代2’氟(2’F->2’OMe)或用2’氟取代2′-O-甲氧基乙基(2’OMe->2’F)。所有可承受的或增加效能的取代与所有可承受的删除在寡核苷酸中组合。添加3’-倒置胸苷残基,以增加核酸酶抗性,产生了62个核苷酸长度的分子(ARC32225)。ARC32225也在实施例中称为“IL23适体(IL23 aptamer)”、“IL23适体(IL23 Aptamer)”、“IL-23适体”或“IL-23适体”。
三级结构相互作用已在ARC32225中在2位的G残基和30位的C残基之间鉴定(图1B)。该相互作用通过定点突变发生实验证明。A残基在2位的取代破坏了预测的Watson-Crick碱基配对且在STAT3抑制测试中显著将适体活性减少至108nM。U在30位的补偿取代(其修复Watson-Crick碱基配对潜能以及抑制活性)导致在STAT3测试中IC50为0.5nM。
分子结构和化学名:ARC32225为具有以下序列的62-聚体寡核苷酸(SEQ ID NO:1):
5'-mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-fC-fG-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG-idT-3'
ARC32225以其游离酸形式计算的分子量为20395.27Da。ARC32225的钠盐具有的分子量为21736.17Da。该适体计算的消光系数为586,400L mol-1cm-1。
在竞争者tRNA的存在下研究结合至重组人IL-23的适体的KD。
ARC20122,ARC32225的全长母体,结合至重组人IL-23,且KD为9.1nM±2.5nM。在~18,000倍过量核酸竞争者存在下的高亲和结合表明ARC20122的结合对IL-23是特异的(数据未显示)。
此外,ARC20122及其缩小物ARC32225抑制对STAT3活性的IL-23依赖性刺激的能力在PHA-Blast细胞中测试。该测试使用纯化的单核细胞产生的内源性IL-23,如本文所述。该测试中ACR20122具有的IC50为0.26nM±0.036nM(图2)。ARC32225比其母体克隆表现稍好,IC50为0.075nM±0.030nM。在两种情况下,活性都显著好于对照抗-p19抗体,IC50=0.69nM±0.12nM。
发现ARC32225对血清核酸酶有抗性。ARC32225在90%汇集的人血清和大鼠血清中在37℃培养24小时。全长适体的相对量通过15%变性聚丙烯酰胺凝胶的SYBR金染色而显现。在大鼠血清中培养24-小时后,~50%的全长适体保持完整。在90%人血清中培养后保持显著量的全长适体(数据未显示)。
实施例2:ARC32225对内源性IL-23活性的作用
在可得的重组IL-23和内源性IL-23之间存在显著的结构差异。内源性IL-23通过亲和力纯化从活化的纯化原代人单核细胞的条件培养基制备。外周血单核细胞(PBMC)获自由新鲜人血制备的血沉棕黄层。单核细胞通过粘附至CD14涂覆的磁珠(Miltenyi,Cologne,Germany)而分离。为诱导和增强IL-23表达,单核细胞用LPS和抗-IL-10封闭抗体处理。24小时后,将条件培养基收集且冷冻。Sepharose NHS琼脂糖珠(Sigma,St.Louis,MI)与p19非中和受体单克隆抗体(eBioscience,San Diego,CA)偶联且用源自多种供体的汇聚的条件培养基培养过夜。清洗珠子且用酸洗脱内源性IL-23,且用TRIS-碱、包含BSA的缓冲液中和。洗出液用PBS透析,且将纯化的蛋白质分成等分试样且冷冻。
IL-23由单核细胞的表达通过测试条件培养基证实,其使用eBioscience(San Diego,CA)的p19/p40ELISA。ELISA板用抗-p19抗体涂覆且捕获的抗原用抗-p40抗体检测,从而特异性测量IL-23细胞因子。使用该ELISA,确定了IL-23以约8+/-4ng/mL的量存在于条件培养基中且该条件培养基在用亲和力珠培养后已耗尽IL-23。
纯化的内源性IL-23活性通过蛋白质在PHA Blast溶解产物中活化STAT3的能力评估。将纯化蛋白质滴定施加至IL-2/PHA活化的T-细胞保持15分钟以诱导STAT3的磷酸化。细胞溶解产物中的pSTAT3(磷酸化-STAT3)水平随后通过ELISA(Cell Signaling Technologies,Danvers,MA)测量。用纯化的内源性IL-23处理的源自PHA Blast细胞的磷酸化STAT3的量在用透析洗出液刺激15分钟后通过比色ELISA测量(数据未显示)。内源性蛋白质随后以落在曲线的线性范围内的体积用于PHA Blast磷酸化-STAT3测试。
大多数磷酸化-STAT3信号诱导是由于纯化的内源性IL-23。抗-p40和抗-p19中和抗体分别在50nM时抑制超过90%的信号。两种抗体的抑制曲线示于图3。
ARC32225抑制PHA/IL-2活化的T-细胞的内源性IL-23活化的能力通过测量磷酸化-STAT3的水平来测试(“磷酸化-STAT3测试”)。在活化的T-细胞上IL-23与其受体的结合刺激多种STAT通路,包括STAT3。源自新鲜人血的外周血单核细胞(PBMC)通过在Histopaque梯度液中离心分离且用PHA/IL-2处理以富集T-细胞和上调IL-23受体。细胞进行血清饥饿处理且用内源性IL-23处理15分钟,然后裂解。在ARC32225或中和p19抗体存在或不存在时,磷酸化-STAT3在IL-23处理的溶解产物中的相对水平通过ELISA测量(Cell Signaling Technologies,Danvers,MA)。适体/抗体的滴定用于产生抑制曲线,由此确定IC50。p19和ARC32225抑制曲线的代表性图示于图4。
7个12-点滴定曲线,各自一式两份,用于计算平均(+/-SEM)IC50,其对p19为2.0+/-1.2nM且对ARC32225为0.296+/-0.090nM。对所有供体测试的各浓度记录抑制百分比(数据未显示)。也记录各供体单独的IC50(数据未显示)。
我们也测试了ARC32225抑制PHA/IL-2活化的T-细胞的IL-12活化的能力。类似于IL-23,在活化的T-细胞上IL-12与其受体的结合刺激多种STAT通路,包括STAT3。磷酸化-STAT3测试用于滴定IL-12且选择在STAT3活化的线性范围内的浓度以用于将来的测试。对细胞进行血清饥饿处理且用IL-12(20ng/ml)处理15分钟,然后裂解。在ARC32225或p19中和抗体存在或不存在时,通过ELISA(Cell Signaling Technologies,Danvers,MA)在IL-12处理的溶解产物中测量磷酸化-STAT3的相对水平。适体/抗体的滴定用于产生抑制曲线,由此确定IC50。p19和ARC32225抑制曲线的代表性图示于图5。
实施例3:体外缺少ARC32225对TLR 3、7、8或9的活化
测试了在人PBMC中ARC32225刺激Toll-样受体(TLR)3、7、8或9的能力。先天免疫系统安置了快速防御以抵抗侵入的细菌、RNA和DNA病毒以及其它病原体。一些寡核苷酸被先天免疫系统识别为刺激炎症应答的潜在病原体。TLR3识别双链RNA且诱导在浆细胞样树突状细胞中的IL-6释放。TLR7/8和9的活化是序列依赖性的。富含鸟苷/尿苷的单链RNA活化TLR7/8,而包含未甲基化的胞嘧啶/鸟苷六聚体基序(CpG)的DNA活化TLR9。而且,不同种类的合成CpG在PBMC中诱导不同的作用:A类CpG诱导干扰素α和干扰素γ表达且不引起B细胞增殖。B类CpG诱导强的白介素-6响应且在B细胞中引发增殖响应。CpG的存在并非是免疫刺激的绝对需求,因为缺少CpG的序列已报告能诱导免疫刺激。因此,针对其诱导先天免疫系统活化的能力筛选ARC3225。
在PBMC中测试ARC32225诱导IL-6和干扰素(IFN)α分泌以及B-细胞增殖的能力。IL-6释放是TLR 3/7/8和TLR9B类活化的一个量度。B-细胞增殖是TLR9B类CpG刺激的一个量度。干扰素α释放指示TLR9A类CpG激动作用。PBMC在Histopaque梯度液中通过离心分离且用100nM或25nM ARC32225或CpG对照处理。24小时和48小时后,收集上清液且通过ELISA分析IL-6和IFNα释放。通过比色ELISA,释放的IFNα的量与450-600nM的吸光度相关。由基因组DNA的复制评估细胞增殖,其通过掺入胸苷类似物5-溴-2’脱氧尿苷(BrdU)测量。PBMC用100nM或25nM适体或CpG B对照处理一天。在随后的24小时脉冲后,将细胞固定且使用化学发光ELISA探测BrdU(Roche,Mannheim,Germany)。
在体外,ARC32225不与人PBMC的免疫刺激相关,其通过缺少IL-6或IFNα产生或PBMC增殖证实(数据未显示)。PBMC响应于阳性对照寡核苷酸(CpG),产生了IL-6和IFNα分泌和PBMC增殖(数据未显示)。
实施例4:局部施加IL23适体渗透使人皮肤受损和未受损(完整的)
首先使用新切离的皮肤进行荧光评估局部施加后IL23适体渗透人皮肤的能力,其中屏障被完全去除、部分损坏或保持完整。将预处理的皮肤切片安装在流通扩散池上,其使用供体块(donor block)以提供防漏密封,暴露的表面积为1.0cm2。扩散池连接至多通道泵,且PBS流速为约3.6mL/hr。各池然后在加热歧管中平衡以保证皮肤表面温度为32℃(在给药前保持至少30分钟)。ARC32225用DyLight 488标记(ARC32778),以11mg/ml(~1%v/v)配制为乳膏且使用正排量式吸量管(positive displacement pipette)均匀分布至处理和未处理的皮肤的角质层。该乳膏制剂类似于Mehta等人,J.Invest.Derma.115:805-812(2000)中所述的乳膏。在施加后的0和4小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗以从皮肤表面去除残余制剂。清洗的皮肤然后在OCT(最佳切割温度)介质中冷冻。安装切片且通过显微镜检查荧光。
在0小时的样品中(其中在完整和部分受损皮肤中观察到不存在ARC32225(即ARC32778)(数据未显示))显示清洗步骤能有效从皮肤表面去除适体。有趣的是,角质层被完全去除、局部给药和被立即清洗的皮肤显示ARC32225(即ARC32778)适体以从皮肤表面至基底膜逐渐下降的梯度渗透至表皮(数据未显示)。这表明该适体可几乎立即部分通过该存活表皮且不进一步被表皮的紧密连接所限制,其也被认为调节了被动扩散。4小时的局部暴露后,显示ARC32225(即ARC32778)适体渗透所有皮肤样品(完整的、胶带剥离的(tape stripped)、和部分受损的),且对所有样品观察到了从皮肤表面至基底膜的梯度(数据未显示)。
为证实被施加至组织块以及在组织块内的适体是完整标记的ARC32225(ARC32778),从两个处理的组织块提取该适体,然后针对标准适体进行PAGE。具体地,对应于完整皮肤(0小时)和擦伤的皮肤(4小时)的两个组织块在室温静置10分钟以熔融OCT。各块包含两个样品,每个测量为~5-8mm x 2-3mm。一个样品再冷冻且另一个用刀片切碎且置于200uL dPBS。
推断该适体应在细胞外且该组织破坏本身应释放一些递送的适体。将组织在单独的dPBS中进行三次冷冻/融化循环且强烈涡旋。将各次中的10微升装载至变性聚丙烯酰胺凝胶上。分离的材料用Molecular Dynamics PhosphorImager荧光显现禀移动,与已知的ARC 32778标准一致(数据未显示)。这些结果证实分离的适体是全长和荧光标记的,确认皮肤中存在完整的适体。
实施例5:局部施加IL23适体体内渗透猪的皮肤
为确定在人银屑病皮损模型中ARC32225衍生物是否可渗透活的猪皮肤,ARC32778(Dylite 488标记的ARC32225)以11mg/ml配制为与体外实验使用相同的乳膏。在胶带-剥离(施加20次透明胶带)或未胶带-剥离的雌性白色Yucatan小型猪背部的1”x 1”正方形面积上施加100ul测试制品。0或4小时后,从指定的给药位点收集全厚度的活组织切片。通过使用#10手术刀片收集各0-小时活组织切片。各组织然后置于2ml冷冻小瓶且在液氮中快速冷冻。在各动物用过量戊巴比妥钠安乐死后以相同方式采取4小时活体组织切片。
活体组织切片通过荧光显微镜分析。仅从两个样品获得可用的图像(数据未显示)。在胶带-剥离的4-小时样品中,在整个表皮至真皮层观察到显著量的ARC32778,除了细胞核(数据未显示)。相反,在未胶带-剥离的、0-小时对照的角质层之外未观察到荧光(数据未显示)。这些初步结果与体外研究一致,且表明在活的、胶带-剥离的猪皮肤中适体能渗透且停留4小时。
实施例6:适体的制备
ARC32225适体为合成制备的磷酸二酯寡核苷酸,其掺入了具有2’-氟和2’-O-甲基组合修饰的核苷酸。ARC32225由核61-聚体寡核苷酸组成。3’-端携带另外的倒置dT帽作为对核酸酶降解的保护。该适体可作为冻干粉末提供。制备中使用的起始材料和试剂、溶剂和辅助材料示于表2和3。
表2.药物制备中使用的起始材料
表3.药物制备中使用的试剂、溶剂和辅助材料
合成:
ARC32225在Oligopilot 100自动固相合成仪上使用类似于标准方案的亚磷酰胺方法以2.5mmol规模合成(Beaucage,S.L.;In Current Protocols in Nucleic Acid Chemistry;Beaucage,S.L.,Bergstrom,D.E.,Glick,G.D.,Jones,R.A.,Eds.;John Wiley&Sons:New York,NY,2001;第三章)。
将固定体积的合成柱(4.5x10cm)用第一核苷残基(idT)衍生的固体载体装载,且连接至合成器。当使脱三苯甲基化溶液泵送过柱以去除酸不稳定的二甲氧基三苯甲基而产生第一核苷的5’-OH时,合成开始。为合成ARC32225,有利的是添加额外的酸处理以用于固体载体上的倒置脱氧胸苷,和用于嘧啶碱基。此外,在观察周期中UV临界值从500mAU降低至100mAU。总之,n-x失败的数量随着额外的酸处理而减少。乙腈中的亚磷酰胺和活化剂(SET)然后同时递送至合成柱,导致亚酰胺(amidite)与5’-羟基的偶联。对于ARC32225,发现3.0当量的2’-氟和2’-O-甲基亚酰胺产生一致的产率和FLP。偶联后,然后用乙腈洗涤柱。氧化之前,用1CV(柱体积)的Cap B溶液处理柱以保证载体在氧化中保持碱性。在Cap B处理后,将氧化溶液泵送过柱以将亚磷酸三酯连接基P(III)转化为其磷酸三酯类似物P(V)。乙腈洗涤后,残余的未反应的5'-羟基使用Cap A和Cap B溶液的混合物加帽。该步骤防止在合成周期中任何未反应的5’-OH进一步反应,且因此防止缺失序列不希望的链生长。就产率和FLP(全长产物)而言,对于合成ARC32225,异丁酸酐优于标准的乙酸酐溶液。
乙腈洗涤后,使用另一脱三苯甲基化步骤引发新的延伸循环以产生生长的核苷酸链的5’-OH,然后是随后的亚磷酰胺掺入。重复该过程直到所需序列被合成。以添加末端己基胺修饰物亚磷酰胺结束该合成。
碱洗涤和裂解/脱保护:合成完成后,固体载体用乙腈中的20%二乙基胺溶液洗涤,以去除磷酸骨架上的氰基乙基保护基。该固体载体然后连接至真空并去除过量溶剂。固体载体然后被转移至脱保护容器;添加饱和氢氧化铵且将混合物加热至约45℃保持14-16小时以实现从固体载体的裂解、和环外碱基保护基的脱保护。将该脱保护冷却至环境温度且固体载体使用烧结玻璃漏斗过滤,用水和乙醇冲洗,且用在下一步骤中。碱洗涤和裂解/脱保护都被优化以最大化产率和最小化杂质。此外,设置时间和体积的限制。
三苯甲基-关于ARC32225的纯化:ARC32225使用RP色谱法纯化。在合成过程中留下最后的5’三苯甲基以帮助从n-x杂质分离FLP。对于反相色谱法,硅胶基质与固定化至凝胶(Sepax Technologies,Inc.)上的硅烷醇羟基的C4烷基配体一起使用。该柱以<18mg/mL在>40℃装载,其中使用疏水性增加的梯度液完成分离。
三苯甲基去除和ARC32225的抗衡离子交换:将源自RP色谱法的纯化的材料汇集且以~20mg/mL在>40℃装载至琼脂糖基质IEX柱(Q-Sepharous,GE Amersham)以用于三苯甲基的去除和骨架抗衡离子的交换。在25℃将装载的材料暴露于80%乙酸且使用UV监测以确定三苯甲基-脱落步骤的完成。该柱被中和至pH 6-7,然后在>40℃在增加的离子强度的缓冲水溶液中洗脱FLP。
超滤:ARC32225的柱纯化后,将该溶液装载至配备5KDa MWCO(分子量截留)膜的超滤装置上(AKTA Crossflow,GE Lifesciences),且该溶液用水渗滤至恒定的传导性以去除过量盐。
冻干:将纯化和脱盐的ARC32225溶液转移至LyoGuard托盘(Gore Associates)。该产物然后被冷冻-干燥为无水的灰白色至浅黄色粉末。
实施例7:双杂交测试(DHA)研发
通过静脉内(IV)或皮下(SC)注射给药的未PEG化的适体的药代动力学已在历史上用HPLC测量。在这些情况HPLC足以定量适体,这是由于在研究中注射的相对高浓度的适体。然而,适体也可局部给药。考虑到假定较低的给药浓度和局部给药的ARC32225至皮肤的渗透,适体在给定组织或血浆样品中的浓度很可能低于HPLC的定量下限(LLOQ)(约10x10-9至50x10-9M)。由于这个原因,研发了双杂交测试(DHA)。
在DHA中,互补碱基配对驱动特异性和敏感性,从而在10x10-12至40x10-12M的范围内对ARC32225浓度进行定量。简言之,合成检测探针和捕获探针,其分别互补于适体的5’和3’端。设计探针使得捕获探针在其5’端具有游离胺。该游离胺允许探针共价连接至96-孔板(Nunc Immobilizer,#436006)。该检测探针设计为具有生物素分子共价连接至探针的3’端以允许使用四甲基联苯胺(TMB)底物通过链菌亲和素缀合的辣根过氧化物酶检测。过量的检测探针用适体标准或PK样品培养,且加热溶液使得ARC32225解折叠。该熔化步骤后,缓慢冷却溶液,从而允许检测探针和适体之间进行互补碱基配对。该溶液然后添加至已共价连接至96-孔板的捕获探针。通过该方法,样品中适体的浓度可通过与相同测试中包含的适体的标准曲线比较而确定。
测试的研发通过确定最佳ARC32225捕获和检测探针(分别为ARC35141和ARC35156)开始,(图6和7)。ARC35141为15个核苷酸的探针,其在提供互补碱基配对的11个核苷酸的5’-端的游离胺之间包含4个核苷酸的间隔区。ARC35156为13个核苷酸的探针,其在探针的3’端的生物素和提供互补碱基配对的9个核苷酸之间包含4个核苷酸的间隔区。
评估的检测探针如下所示。各探针的结果示于图6。生物素化的检测探针的评价证实所有探针行为类似,除了ARC35157,其未能与ARC32225杂交。为平衡敏感性和特异性,功能类似于较长的探针的ARC35156被选择作为检测探针(n=1)。
评估的捕获探针如下所示。各探针的结果示于图7。使用ARC35156检测ARC32225,评估了多种ARC32225-特异性捕获探针。随着捕获探针的长度减少(ARC35140包含最互补的碱基,而ARC35145包含最少的碱基),对ARC32225的捕获减少。尽管ARC35140和ARC35141敏感性存在轻微差异,该差异最小且两种探针的敏感性类似。由于这个原因以及较短捕获探针将提供特异性的优点,ARC35141被选作捕获探针(n=1)。显示DHA选择性对抗IL23,其中从适体或探针去除单个核苷酸导致检测的丧失。当去除两个或更多个核苷酸时观察到<1,000pM的浓度范围的完全丧失。
检测探针:
捕获探针:
确定在鼠、猪和猕猴血浆中的测试敏感性。为了确定各血浆中测试的LLOQ,在不同浓度的物种-特异性血浆中确定测试敏感性。当存在血浆时,需要知晓各样品中血浆的百分比。在血浆浓度>25%时,该样品不能被加热至高于65℃以熔化适体,否则源自血浆的蛋白质将凝固。包含≤25%血浆的样品不能被加热至95℃以熔化适体。作为这些研究的结果,对各物种-特异性血浆确定ARC32225的LLOQ,使用ARC35141和ARC35156作为探针。约5x10-12至10x10-12M ARC32225可在25%鼠血浆中检测到(图8)。在50%或100%鼠血浆中,双杂交信号较弱且被认为不足以给出确信的定量ARC32225。因此,鼠血浆中ARC32225的LLOQ为约20x10-12至40x10-12M。如图8的结果所示,为预测鼠血浆中可检测的ARC32225的LLOQ,使用之前描述的捕获和检测探针在不同浓度的稀释血浆中滴定ARC32225。在25%鼠血浆中,测试敏感性为~5-10pM,因此LLOQ为~20-40pM(n=1)。
在猪的血浆中,在25%血浆时得到类似结果,该25%血浆代表应使用的最高浓度血浆,而50%和100%猪血浆导致弱的信号(图9)。此外,猪血浆中ARC32225的LLOQ为约20x10-12至40x10-12M,类似于鼠血浆。如图9的结果所示,为了预测猪血浆中可检测的ARC32225的LLOQ,使用之前描述的捕获和检测探针在不同浓度的稀释血浆中滴定ARC32225。在25%猪血浆中,测试敏感性为~5-10pM,因此LLOQ为~20-40pM(n=1)。
在猕猴血浆中,ARC32225在50%和100%血浆中显示较强的信号,表明可使用较大范围的猴血浆样品(图10)。基于该数据,猴血浆中ARC32225的LLOQ计算为约10x10-12至20x10-12M。如图10的结果所示,为了预测猕猴血浆中可检测的ARC32225的LLOQ,使用之前描述的捕获和检测探针在不同浓度的稀释血浆中滴定ARC32225。在50%猕猴血浆中,测试敏感性为~5-10pM,因此LLOQ为~10-20pM(n=1)。
因此,在所有测试的血浆中,双杂交测试能够定量比HPLC方法低约一千倍浓度的ARC32225浓度。
实施例8:局部递送IL23适体和负载适体(Cargo Aptamer)通过人皮肤且进入角质形成细胞
在局部施加于人离体皮肤后使用荧光目视评估IL23(IL-23)适体(ARC32225)渗透皮肤的能力。这种渗透的大小(分子量)和广度也使用荧光通过三种不同的负载适体和一系列分子量评估。负载适体1以两种大小(39-聚体和85-聚体)产生以研究适体的被动渗透的效应大小。第二负载适体以三种大小(36-聚体、45-聚体和86-聚体)产生以探索适体被动渗透的广度和大小的影响。最后为了进行比较,将第三负载适体(85-聚体)作为第三适体包含在内。所有三种适体被设计为没有治疗活性的负载适体,因此无法探究生物活性。
方法
新切离的人腹部皮肤切皮成500±100μm的厚度,并固定在流通扩散池上使用供体块以提供防漏密封,暴露的表面积为1.0cm2。扩散池连接至多通道泵,且PBS流速为约3.6mL/hr。各池然后在加热歧管中平衡以保证皮肤表面温度为32℃(在给药前保持至少30分钟)。IL23和负载适体用Cy3标记且溶于水性载体(97.9%DI水,0.1%聚山梨酯20,1%苯甲酰基醇)。水性制剂以10uL/池(10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。在施加后的0、6和24小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的IL23适体(ARC32225)且未被分析。将该干燥的胶带剥离过的皮肤以表皮朝下置于清洁的刀板上且使用干净的刀片切割较小的切片。这些切片被竖着置于15x15mm模具中,然后立即使用异戊烷/干冰浴在OCT中冷冻。该模具然后从异戊烷浴移除,包裹于铝箔中,且储存在-80℃直到进行免疫荧光(IFC)分析。将冷冻组织块从-80℃冷冻机取出且置于-20℃低温恒温器3分钟,然后切片。切成5μm切片且将其安装于单独的Richard Allen Bond-Rite载玻片上。该载玻片固定于冷-20℃丙酮中保持10min,然后风干30分钟。载玻片在Tris缓冲盐水(TBS)(Dako Ref S3006)中清洗,其中替换三次TBS。所有载玻片用盖玻片覆盖,该盖玻片负载具有二脒基-2-苯基吲哚(DAPI)的Gold Antifade Reagent(Invitogen,P36935)。渗透的量使用荧光显微镜评估。使用装配Nikon DS-QiMc单色相机和NIS Elements BR 3.2的Leica DMRXA2显微镜获取摄影影像。
结果
IL23 Cy3标记的适体:清洗步骤再次显示在0小时样品中从皮肤表面有效去除了适体(数据未显示)。显示早在6小时的时候IL23适体渗透表皮而没有任何屏障破坏,到24小时具有显著增加(数据未显示)。在整个皮肤切片的多个区域显示荧光信号,在荧光显微镜下其位于角质形成细胞中(数据未显示)。共焦成象显示IL23适体在细胞中且可能在角质形成细胞的细胞核中(数据未显示)。IL23适体在人皮肤中的渗透已使用不同荧光标记重复,且该递送呈现为细胞内和细胞外。
Cy3标记的负载适体:负载适体1以两种大小(39-聚体和85-聚体)产生以研究适体被动渗透的效应大小。第二负载适体以三种大小(36-聚体,45-聚体和86-聚体)产生以探索适体被动渗透的广度和大小的影响。最后为了进行比较,将第三负载适体(85-聚体)作为第三适体包含在内。所有三种适体被设计为没有治疗活性的负载适体,因此无法探究生物活性。
所有三种基于货物的适体导致在整个表皮显著渗透,且在6至24小时具有增加的荧光。难以定量,但似乎大小不产生影响,因为36-聚体负载适体相比86-聚体负载适体显示很少的不同。许多切片显示出现在细胞内的荧光,表明这些适体能结合细胞内或细胞外两者的靶点。而且,这些结果表明适体的被动递送可以成为IL23适体之外基础更广范的现象。
实施例9:乳膏和微乳剂
简单溶剂体系显示可以发生大分子量适体的被动渗透,其中具有较高水浓度的载体对真皮具有增加的递送。油包水微乳剂已被建议作为局部递送肽和蛋白质的有效方式且可在递送宽范围的水溶性分子中具有更通用的作用[7]。感兴趣的是微乳剂是否可用于改善IL23适体(ARC32225)的递送。Mehta等人显示乳膏载体可将大分子量的反义寡核苷酸递送至移植在严重受损的免疫缺陷小鼠上的人皮肤[8]。考虑到IL23也是寡核苷酸;将该乳膏载体与微乳剂比较。该研究的目的是将微乳剂中的剂量响应与文献中的水基乳膏比较。
方法
新切离的人腹部皮肤切皮成厚度为500±100μm且安装在流通扩散池上,使用供体块以提供防漏密封,暴露的表面积为1.0cm2。扩散池连接至多通道泵,且PBS流速为约3.6mL/hr。各池然后在加热歧管中平衡以保证皮肤表面温度为32℃(在给药前保持至少30分钟)。IL23适体(ARC32225)制剂以10uL/池(10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。局部载体的组成可参见表4。测试制品施加至1至3个单独的供体且每个皮肤供体重复至少5次。在施加后的6和24小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的IL23适体(ARC32225)且未被分析。从皮肤表面去除残余局部制剂后,剩余的表皮和真皮置于60℃烘箱保持2min。将表皮和真皮从烘箱取出且使用镊子和戴手套的手指手动分离。将表皮和真皮层置于单独的瓶中且立即冷冻。将源自皮肤渗透研究的表皮和真皮样品置于单独的瓶且将1mL 0.25%胰蛋白酶分别单独添加至表皮和真皮。将瓶置于设定在37℃的烘箱中保持16至20小时,然后去除萃取稀释剂且在13,000RPM离心10分钟以去除所有未溶解的材料和颗粒。
表4.乳膏和微乳剂的组成
双杂交测试:双杂交测试(DHA)之前已描述用于定量血浆和玻璃体液样品[9]。也参见本文的实施例7。简言之,该测试类似于酶联免疫吸附测定(ELISA),其中使适体杂交至捕获和检测脱氧核糖核酸(DNA)寡核苷酸探针。该捕获探针(ARC35141;Integrated DNA Technologies)互补于适体的5'-端的13个核苷酸且通过3'-末端氨基连接基共价连接至板。该检测探针(ARC35156;Integrated DNA Technologies)互补于在适体的3'-末端的15个核苷酸且在5'-末端被生物素化。已显示该测试具有选择性和敏感性,从而能够从皮肤组织提取适体并以皮摩尔浓度定量。
DHA测试板通过用100μL捕获探针(250nM,在1mM EDTA/DPBS中)涂覆96孔板而制备且在4℃培养过夜。去除捕获探针溶液且该板用3x300μL清洗缓冲液(具有Tween的tris缓冲盐水(TBST))洗涤,其对3次清洗周期的每一次具有最少1分钟的浸泡时间,且在每次清洗后将板在吸水纸上吸干。去除清洗缓冲液后,将200μL封闭液(在TBST中的5%w/v BSA)添加至各孔且将测试板密封且在室温在定轨振荡器上培养60分钟。去除封闭液且将板如上所述洗涤。该适体的适体标准曲线通过加倍稀释获得以产生10nM至10pM的标准,且DPBS作为空白样品(0pM)一式两份添加(60μL/孔)至新的96孔板(杂交板)。将提取的表皮和真皮样品添加至杂交板(60μL)。向包含样品和标准品的杂交板的各孔添加60μL检测探针(DPBS中150nM)。检测探针的终浓度为75nM且适体标准浓度为0pM、5nM至5pM。将杂交板密封且置于设置在65℃的加热烘箱中保持40分钟以允许适体与探针杂交,然后冷却至室温。100μL适体标准/样品:检测探针混合物从杂交板转移至DHA测试板,密封且在4℃培养过夜以允许适体和捕获探针的杂交。去除该测试溶液且DHA测试板用TBST洗涤,如上所述。将用DPBS 1:20,000稀释的100μL链霉亲和素-聚-HRP添加至DHA测试板,然后将板密封且在室温培养1h同时震摇。去除链霉亲和素-聚-HRP溶液且将板再次用TBST洗涤且100μL TMB底物溶液(在室温)添加至各孔且将板在室温培养5分钟直到显示足够的颜色。将100μL终止溶液添加至各孔,然后在反应停止后将板在450nm在30分钟内读数。对各板使用Prism 5进行数据分析,在样品设置中从所有值减去背景A450值(0pM适体)。DHA的捕获探针为ARC35141(SEQ ID NO:15):
5'NH2 mU mU mU mU mC mA mG mA mC mU mA mC mC mU mA 3′
DHA的检测探针为ARC35156(SEQ ID NO:12):
5'mG mA mU mU mU mC mC mC mU mU mU mU mU biotin 3′
寡聚蛋白沉淀测试:为证实从DHA的适体定量,开发了称为寡聚-沉淀“OP”的新测试。该测试使用相同的源自DHA的生物素化捕获引物以与100μL消化的皮肤样品(表皮或真皮)混合。将该样品加热且冷却以使得引物杂交。添加链霉亲和素珠以破坏(pull down)适体-引物复合物。该适体然后从装载在15%尿素凝胶上的珠子上洗脱且用Sybr Gold染色以显现和比较适体带。
结果
发现,在储存几个月后,基于Mehta等人的该研究使用的乳膏载体不是物理稳定的,因此不是可开发的制剂。因此,进一步的研究使用具有已知稳定性的乳膏载体。
使用DHA在表皮和真皮中定量的源自不同制剂的IL23适体的量可参见图11且与IC50值的比较可参见表5。该微乳剂(0.45%,0.5%,0.75%,&1%)在24小时处显示对表皮的非线性剂量响应递送。所有制剂从6至24小时显示IL23适体的量的增加。微乳剂显示从6至24小时的最大增加,其中表皮具有>10-倍增加且真皮具有>1.9-倍增加。该测试可表明微乳剂更长的停滞期而乳膏可在施用后的前几小时递送更多API。相比微乳剂,1%乳膏显示最大递送(1.5-5.5-倍)。在6小时,1%乳膏向皮肤(表皮&真皮)递送>3.4-倍的IL23适体(p<0.06),而相比之下,其在24小时向皮肤(表皮&真皮)递送>1.5倍的IL23适体(p<0.07)。在局部施加后6和24小时,该1%乳膏递送>0.6μg IL23适体至真皮和>4.3μg至表皮。原代人T-细胞的STAT3活化中IL23适体的IC50为约300pM。该乳膏制剂在24小时递送120,000倍的IC50至表皮,且在6和24小时递送>3,000倍的IC50至真皮。这表明1%乳膏从局部载体向皮肤递送显著高于治疗量的量而没有屏障破坏。该乳膏制剂包含约60%水,而微乳剂包含<20%水。该IL23适体显示具有高水溶性,因此递送机理之一可能是通过角质层水合以增加渗透。
表6显示IL23适体在人离体皮肤中的皮肤渗透,作为施加剂量的百分比(%)。如其中所示,在6小时处,有意义量的适体渗透至表皮和真皮且在给药后24小时内一直增加。
为证实DHA获得的值,使用寡聚-沉淀测试以从组织提取适体且通过Sybr Gold证实以显现和比较适体带。所述带与IL23标准一致,且总强度相关,其中源自乳膏的样品显示比微乳剂更暗,证实了源自DHA的值。
图11显示IL23适体在人离体皮肤中的皮肤渗透。离体腹部皮肤用在微乳剂或乳膏制剂中的20uL(200ug/cm2)IL23适体局部处理。IL23适体在施加后6小时和24小时从表皮和真皮提取。柱代表IL23适体的平均量,其源自在6小时在1个皮肤供体上的5次平行测定(其中减去0小时值),或在24小时在2个皮肤供体上对微乳剂的5次平行测定或在3个皮肤供体上对乳膏的5次平行测定。样品通过DHA分析,显示为平均值±SEM。
表5.在人离体皮肤中IL23适体的皮肤渗透大于IC50。施加后6和24小时的递送至表皮和真皮中的IL23适体的量。数值表示源自>5次平行测定和1-3个供体(n≥5)的转化为μM的IL23的量±SEM。样品通过DHA分析,范围为10x10-12至40x10-12M。体积假定为1.0cm2给药面积,且表皮厚度为0.015cm且没有细胞(即,液体)。皮肤体积=0.015cm3。IL23适体的分子量为20,395.27。在原代T-细胞中IL23适体的IC50为≈300pM(0.0003μM)。
表6.IL23适体在人离体皮肤中的皮肤渗透,作为施加剂量百分比(%)。施加后6和24小时的递送至表皮和真皮中的IL23适体的量。数值表示源自>5次平行测定和1-3个供体(n≥5)的转化为施加剂量%的IL23适体的量。样品通过DHA分析,范围为10x10-12至40x10-12M。制剂以10μL/cm2施加且针对重量校正,假定1μL=1mg。
还在Franz池设置中进行实验以评估非水性载体对IL23适体至人皮肤的渗透的影响。评估了作为适体递送的载体的水载体(97.9%DI水,0.1%聚山梨酯20,1%苯甲酰基醇,所有为%w:w)、100%甘油和100%乙醇。使用10mg/cm2适体的剂量。接收流体为PBS。IL23适体在6和15小时的表皮和真皮组织水平通过DHA定量。在两个时间点且在所有三种条件下,在表皮和真皮中检测到适体,在两个时间点在表皮中都有具有更大的量(数据未显示)。因此,IL23适体在非水性载体和水性载体中都可渗透至表皮和真皮。
在Franz池设置中进行额外的实验以评估其它载体对IL23适体至人皮肤的渗透的影响。评估了作为适体递送的载体的水载体(97.9%DI水,0.1%聚山梨酯20,1%苯甲酰基醇,所有为%w:w)、1:1甘油:DI水和1:1乙醇:DI水。使用10mg/cm2适体的剂量。接收流体为PBS。IL23适体在6和15小时的表皮和真皮组织水平通过DHA定量。在两个时间点且在所有三种条件下,在表皮和真皮中检测到适体(数据未显示)。因此,IL23适体在这些额外的载体中可渗透至表皮和真皮。
实施例10:概念验证(POC)载体(泡沫、溶液和乳膏)
渗透促进剂和制剂优化常用来改善小分子的递送,且这些赋形剂中的一些也可有利于改善大分子递送(Williams和Barry(2004)Adv Drug Deliv Rev 56(5):603-18;Karande等人(2004)Nat Biotechnol 22(2):192-7)。相比于微乳剂,乳膏显示递送更高量的IL23适体(ARC32225)至人皮肤中,表明有进一步改善IL23适体的渗透的机会。建立在水浓度假设上,IL23适体(ARC32225)配制在水性载体(97.9%水)、泡沫溶液(82%水)和乳膏(62.5%水)中。为探索渗透促进剂(PE)的作用,将IL23适体(ARC32225)配制在二醇溶液(15%水和78%PE)中。
该研究的目的是评估来自一系列可潜在发展到临床情况的水基乳膏和溶液的IL23适体(ARC32225)在未受损皮肤中的被动渗透。
方法
新切离的人腹部皮肤切皮成厚度为500±100μm且固定在流通扩散池上,使用供体块以提供防漏密封,暴露的表面积为1.0cm2。扩散池连接至多通道泵,且PBS流速为约1.8mL/hr。各池然后在加热歧管中平衡以保证皮肤表面温度为32℃(在给药前保持至少30分钟)。IL23适体(ARC32225)制剂以10uL/池(10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。测试制品施加至两个单独的供体,且每个皮肤供体至少6次平行测定。在施加后6小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的IL23适体(ARC32225)且未被分析。从皮肤表面去除残余局部制剂后,将剩余的表皮和真皮置于60℃烘箱中保持2min。将表皮和真皮从烘箱取出且使用镊子和戴手套的手指手动分离。将表皮和真皮层置于单独的瓶中且立即冷冻。随后将瓶解冻且且使用DHA(之前描述)分析。
乳膏和溶液:该研究使用的制剂被开发的目的是提供物理稳定的‘临床/商品’制剂,其可发展为人类首次(FTIH)研究。该制剂分为两组;水包油乳膏和水基溶液。水基溶液衍生自市售的泡沫载体(Luxiq SME、他扎罗汀SME)。泡沫基溶液表示在为了在封闭容器系统中的最终泡沫产品而加入推进剂之前的载体。该乳膏基于多种具有假定的稳定性的市售制剂(Sorbolene乳膏,水性乳膏BP,和Hydrozole乳膏)。‘基于ISIS的乳膏’作为与之前研究的联系以及水性的水对照(具有少量的Tween以使得更好的润湿皮肤)而被包括在内。此外,具有大浓度渗透促进剂的基于二醇的溶液(丙二醇、二甲基异山梨醇酯和)也被包括以探索渗透促进剂的作用。乳膏和溶液的制剂组成可参见表9。
结果
在施加后6和15小时从表皮和真皮确定源自12个原型活性制剂的IL-23适体至表皮和真皮的渗透(表7&图12)。
在所有制剂中从6至15小时在表皮中观察到IL23适体递送的增加,除了ISIS乳膏(含有黄原胶)。在施加后6小时,除了一种IL-23适体制剂(Sorbolene乳膏(含有PG))之外都实现了IC50 13,000倍或更大的增加,且到15小时所有IL-23适体制剂均实现这种增加。在t=6和15h时间点从表皮回收的IL-23适体的量都高于真皮。在6h源自表皮的前三名制剂的排序为原始ISIS乳膏>无PG的他扎罗汀SME>Hydrozole乳膏,而在15小时前三名的排序为Hydrozole乳膏>ISIS乳膏(含有GMS)>无PG的他扎罗汀SME。表皮中观察到的IL23的最高浓度来自施加后15小时的Hydrozole乳膏(6.92±1.35μg,相对IC50增加约75,000倍),其显著高于(P<0.05)阴性对照(未处理皮肤)。尽管在施加后6小时较低(3.23±0.26ug),源自Hydrazole乳膏的递送至表皮的IL-23适体的量也显著高于(P<0.05)原始ISIS乳膏安慰剂和未处理的皮肤(阴性对照)。在表皮中发现源自ISIS乳膏(含有GMS)和Sorbolene乳膏(含有甘油)的IL-23适体的量显著高于(P<0.05)阴性对照,但相对原始ISIS乳膏安慰剂未显示显著改善(P>0.05)。
在真皮中,在6h通过这些制剂递送的IL-23适体的量排序为他扎罗汀SME(无PG)>二醇溶液>Luxiq SME,且在15小时保持类似。然而在15小时他扎罗汀SME(含有PG)替代Luxiq SME。与在表皮中观察到的IL-23适体的量的方式(其中该量随时间(6至15小时)增加)相反,施加后真皮中IL-23适体的量的前三名排序的制剂(他扎罗汀SME(无PG),二醇溶液和Luxiq SME)显示了逆转,相比于15小时,在6小时后具有更高渗透。此外,在施加他扎罗汀SME(无PG)(1.43±0.39ug)后6小时真皮中IL-23适体的量低于表皮中的量(达到相比IC50最大约6,600倍的增加)。所有包含IL-23适体的制剂实现相比IC50最少约600倍的增加。
有趣的是注意到,在表皮和真皮样品二者中,向他扎罗汀SME制剂添加已知的渗透促进剂丙二醇在两个时间点都反常地降低IL23适体的渗透,且在制剂Luxiq SME中也观察到这一点,其中向制剂添加更多肉豆蔻酸异丙酯在6小时对递送至表皮的IL23适体的量具有很少作用,但在15小时减少了IL-23适体在表皮中的量和在两个时间点减少了其在真皮中的量。
观察到IL23适体早在6小时已渗透至完整的离体人皮肤的表皮和真皮二者且持续至15小时。回收的IL23适体的量在表皮和真皮中分别为IC50的13,000–75,000倍和IC50的600–16,000倍(参见,表7)。递送至真皮中作用位点的IL-23适体的显著量提供了大分子量适体能够渗透皮肤并呈现治疗相关水平的证据。还显示某些载体可改善该递送。二醇溶液和他扎罗汀SME(没有丙二醇)都显示≥4倍(P>0.001)的改善递送。
表8显示IL23适体在人离体皮肤中的皮肤渗透,以施加剂量百分比(%)表示。如其中所示,到6小时处,有意义量的适体渗透至表皮和真皮且其在给药后在15小时内持续或增加。
表7.施加后6和15小时递送至表皮和真皮的IL-23适体的量。数值代表源自2个皮肤供体(3至12次平行测定)的平均量±SEM。样品通过DHA分析。
图12显示IL23适体在人离体皮肤中的皮肤渗透的制剂增强。离体腹部皮肤用在10uL的泡沫、乳膏或二醇溶液中的IL23适体(100ug/cm2)局部处理。IL23适体在施加后6小时(深灰色)和15小时(浅灰色)从表皮和真皮提取。柱表示源自在2个皮肤供体上的6次平行测定的IL23适体的平均量(n=12)。样品通过DHA分析,显示为平均值±SEM。
表8.IL23适体在人离体皮肤中的皮肤渗透,作为施加剂量百分比(%)。施加后6和15小时的递送至表皮和真皮中的IL23适体的量。数值表示源自6次平行测定和2个供体的转化为施加剂量%的IL23的量(n≥12)。样品通过DHA分析,具有的范围为10x10-12至40x10-12M。制剂以10μL/cm2施加且针对重量校正,假定1μL=1mg。
表9.适体局部乳膏和溶液的组成(量以%W/W计)
实施例11:渗透途径和适体动力学
为确定IL23适体(ARC32225)至皮肤和穿过皮肤的被动渗透的途径和动力学,使用分离的表皮进行通量实验。
方法
表皮膜通过将全厚度皮肤浸渍于热去离子水(60±3℃)保持45秒而制备。用戴手套的手指将表皮膜从下面的真皮去除且丢弃真皮。然后将表皮膜在滤纸上SC面朝上漂浮于去离子水直到开始实验。将表皮膜安装在流通扩散池上,使用供体块以提供防漏密封,暴露的表面积为1.0cm2。扩散池连接至多通道泵,且PBS流速为约0.3mL/hr。各池然后在加热歧管中平衡以保证皮肤表面温度为32℃(在给药前保持至少30分钟)。IL23适体(ARC32225)制剂以10uL/池(10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。测试制品施加至两个单独的供体且每个皮肤供体进行至少16次平行测定。在24小时中在96孔板中每两小时收集接收流体且立即冷冻。将板随后解冻且IL23适体在磷酸盐缓冲盐水(PBS)接收流体中的浓度使用DHA(之前描述)定量。
结果
IL23适体(ARC32225)经24小时的累积量显示,在前4个小时IL23适体快速初始渗透至接收流体,没有明显停滞期(图13)。这种快速递送后是随后12小时的较慢的IL23适体(ARC32225)渗透,其与拟稳态曲线更一致,但也没有可观察到的停滞期。当将该数据对各单独的通量曲线表示为通量(ng/cm2/hr)时,在4小时观察到峰,且在随后6小时时间的收集中具有快速下降,然后在随后10至12小时恢复到IL23适体(ARC32225)至接收流体的稳态递送(图13)。当表皮膜由全厚度皮肤制备时,在分离过程中毛干可被去除,导致基本上开放的通道以用于毛囊递送。这可以解释在一些样品中观察到的快速递送,如标记为“毛囊”的线所示(图13)。这些样品在随后6小时时间点显示明显降低,表明这不是开放的通道以用于持续渗透。第二条标记为“细胞间”的线显示IL23适体(ARC32225)被动渗透通过角质层,其可在角质层中的细胞间或细胞内通路中发生。IL23适体(ARC32225)的被动递送似乎为毛囊和细胞间途径的组合,且该研究过程中的主要途径为被动递送通过角质层的细胞间或细胞内通路。24小时内渗透至接收流体的总量为1.9μg或约施加剂量的2%。
图13显示在表皮皮肤切片上单一局部施加后在接收流体中测量在水性载体中经24小时的IL23适体(ARC32225),示为累积量(A)和通量(B)。线表示IL23适体源自在2皮肤供体上16次平行测定的平均累积量(n=32)。样品通过DHA分析,显示为平均值±SEM。
实施例12:水梯度和IL23适体的被动递送
已显示IL23适体(ARC32225)以治疗相关水平被动渗透完整的人皮肤。似乎有一些载体作用,其中水基载体早在单一局部施加后6小时就在真皮中显示显著浓度的IL23适体。考虑到这种大分子量和在文献中非常缺乏大分子被动递送的支持数据,这是特别出人意料的。已表明RNA适体具有构象可塑性,其中这些分子处于不断变化的状态以尝试保持最低能量状态[6,10]。这种柔性可与这种大分子量分子如何渗透皮肤有关,但其没有完全解释这种递送的机理或途径。两种可影响或帮助解释该递送的潜在途径或驱动力是基于在皮肤中发生的独特的离子和水梯度。
在水载体中以及更加临床可行的载体中观察到初始实验的被动渗透。具有更高水浓度的载体导致IL23适体向皮肤的递送增强。该皮肤具有独特的水梯度,估计为在角质层约15%且在基底膜增加至约80%[11]。这种皮肤表面至内部水含量的差异产生了渗透梯度,其可作为大分子的驱动力[12]。已显示IL23适体具有高水溶性。通过组合这些观察值,推测渗透梯度与适体的构象可塑性和水溶性的组合可在IL23适体被动递送方面起作用。
方法
新切离的人腹部皮肤切皮成厚度为250±100μm且安装在Franz扩散池,其中平均表面及为约0.6cm2且体积为约2.0mL。切下的皮肤安装在供体和接收器隔室之间且将扩散池用和夹子密封在一起。将接收器隔室填充接收流体(水,MS级)。之前的溶解性结果显示水不会影响沉降条件。各池然后被平衡以保证表面温度为32℃(在给药前保持至少30分钟)。也安装额外的Franz池但不给药(以作为空白对照),从而用于评估对样品定量的干扰。IL23适体(ARC32225)以1%w/w溶于水溶液(97.9%w/w去离子水、0.1%w/w聚山梨酯20和1.0%w/w苄醇)。IL23适体(ARC32225)制剂以限定剂量6mg(即10mg/cm2)或非限定剂量180mg(即300mg/cm2)局部施加,其使用正排量式吸量管均匀分布至角质层表面。处理后被封闭的池的供体隔室用覆盖。无封闭的池的供体隔室将保持打开。为润湿皮肤,将1mL水(LCMS级)分配至Franz池供体室且Franz池在37℃置于水浴保持12h,然后施加测试项目。测试制品施加至一个皮肤供体且每个皮肤供体进行至少4次平行测定。在施加后6和15小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的IL23适体(ARC32225)且未被分析。从皮肤表面去除残余局部制剂后,剩余的表皮和真皮置于60℃烘箱保持2min。将表皮和真皮从烘箱取出且使用镊子和戴手套的手指手动分离。将表皮和真皮层置于单独的瓶中且立即冷冻。随后将瓶解冻且且使用DHA(之前描述)分析。
结果
在施加后6和15小时,源自限定剂量(6mg或10mg/cm2)的皮肤水合(hydration)和封闭(occlusion)对IL23适体在离体皮肤中被动递送的作用的结果分别可参见图14。在施加后6和15小时比较水合、封闭和限定(6mg或10mg/cm2)相对非限定(180mg或300mg/cm2)的作用的IL23适体被动递送的结果也可参见图14。
水合该皮肤在施加后6小时降低递送至真皮的IL23适体(ARC32225)的量至约二分之一。有趣的是,递送至表皮的IL23适体(ARC32225)的量似乎没有任何改变。到15小时,水合对递送至真皮的IL23适体(ARC32225)的量具有类似的不利影响,降低至约二分之一。水合影响的递送的减少在15小时在表皮中更明显,其中在未封闭的皮肤切片中减少为六分之一,而封闭的皮肤切片显示在表皮中减少为23分之一。通过水的预处理水合的封闭皮肤在表皮中具有非常少的适体。不清楚为何这没有导致在皮肤更深处直至真皮层递送较少的IL23适体(ARC32225)或为何相比较早的6小时时间点这种趋势仅在较晚时间点(15小时)观察到。不能通过渗透至接收流体的IL23适体(ARC32225)来解释,除非该水平低于DHA的检测极限。
从非限定剂量(180mg或300mg/cm2)在真皮中在15小时对未水合的皮肤实现IL23适体(ARC32225)的最高水平。当比较限定剂量与非限定剂量时,更大的剂量导致在15小时递送至皮肤(表皮或真皮)的IL23适体(ARC32225)2-4倍的增加。这些作用似乎在15小时未水合的皮肤中更明显。类似于限定剂量给药,皮肤水合减少表皮和真皮中IL23适体(ARC32225)的量至约二分之一,但在15小时时间点更明显。
图14显示IL23适体(ARC32225)的被动渗透,比较了封闭、水合、和有限相对于非限定剂量给药的作用。显示了施加后6和15小时的递送至表皮和真皮的IL23适体(ARC32225)的量。柱表示源自4次平行测定和1个供体的IL23适体(ARC32225)的平均量(n=4)±SEM。样品通过DHA分析,其范围为10x10-12至40x10-12M。
实施例13:皮肤中的离子梯度
在人IgG RNA适体的研究中,活性结构使用EDTA溶液被去稳定化,其中二价阳离子通过螯合剂去除,且通过再次添加二价阳离子快速再折叠[10]。这些二价阳离子在活性适体构象结构的折叠中是重要的,且这些快速折叠和解折叠的观察结果表明构象可塑性是通过皮肤屏障的被动递送的促成因素之一。这是特别感兴趣的,因为存在不同的穿过表皮的钙离子(Ca2+)梯度,其在保持表皮稳态方面起重要作用[13]。该梯度在上部颗粒层中达到最大值,然后穿过SC时迅速下降[14]。因此,这些SC中独特的梯度在适体局部递送中起一定作用。基于Nomura等人的观察结果,其中Ca2+能通过改变构象结构解离IgG RNA适体结合,该研究探索了包含EDTA的溶剂体系结合二价阳离子(即,Ca2+,Mg,等)。IL23适体(ARC32225)在水载体、EDTA载体或氯化钙载体中施加。接收流体反映被给药的载体,例如EDTA载体在紧接皮肤之下的接收流体中也具有相同的EDTA浓度。
方法
新切离的人腹部皮肤切皮成厚度为250±100μm且安装在Franz扩散池,其中平均表面积为约0.6cm2且体积为约2.0mL。切下的皮肤安装在供体和接收器隔室之间且将扩散池用和夹子密封在一起。将接收器隔室填充接收流体(水,MS级)。之前的溶解性结果显示水不会影响沉降条件。各池然后被平衡以保证表面温度为32℃(在给药前保持至少30分钟)。也安装额外的Franz池但不给药(以作为空白对照),以评估对样品定量的干扰。为探索钙和其它离子梯度的作用,制备10mM EDTA溶液且制备10mM CaCl2溶液,其中IL23适体作为局部载体且与没有钙或EDTA的水载体中的IL23比较。接收流体匹配给药载体(即,10mM EDTA载体和10mM EDTA接收流体)。IL23适体(ARC32225)制剂以6mg(即10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。测试制品被施加至一个皮肤供体且每个皮肤供体进行至少4次平行测定。在施加后6和15小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的IL23适体(ARC32225)且未被分析。从皮肤表面去除残余局部制剂后,剩余的表皮和真皮置于60℃烘箱中保持2min。将表皮和真皮从烘箱取出且使用镊子和戴手套的手指手动分离。将表皮和真皮层置于单独的瓶中且立即冷冻。随后将瓶解冻且且使用DHA(之前描述)分析。
结果
在施加后6和15小时,源自限定剂量(6mg或10mg/cm2)的EDTA对IL23适体在离体皮肤中被动递送的作用的结果可参见图15。在载体和接收流体中包含EDTA似乎没有对IL23适体在皮肤中的渗透有显著影响。在载体和接收流体中包含钙也似乎没有对IL23适体在皮肤中的渗透有显著影响。
图15显示IL23适体的被动渗透,比较了源自限定剂量的适体(10mg/cm2)的EDTA或CaCl2的作用。显示了在施加后6和15小时递送至表皮(深灰色)和真皮(浅灰色)的IL23适体的量。柱表示源自4次平行测定和1个供体的IL23适体的量(n=4)±SEM。样品通过DHA分析,其范围为10x10-12至40x10-12M。
也在类似条件下进行实验,但观察载体中10mM或100mM EDTA的作用。在两种EDTA浓度IL23适体均渗透至表皮和真皮(数据未显示)。
也评估了EDTA预处理(少于5分钟)(10mM EDTA)皮肤的作用。EDTA预处理后IL23适体渗透至表皮和真皮(数据未显示)。
实施例14:被动渗透和主动运输
MARCO,清道夫受体(SR-A亚类II),最近显示负责单纯疱疹病毒1型(HSV-1)在人角质形成细胞中的摄取和感染[15]。在2014Society for Investigative Dermatology的海报展示中,该受体显示在角质层中的阳性染色[16]。角质层中清道夫受体的存在与该屏障作为被动运输的手段和完全不存在任何主动运输这种被广泛接受的观点相反。进行实验以评估该IL23适体(ARC32225)是通过主动运输还是被动运输渗透皮肤。
方法
新切离的人腹部皮肤切皮成厚度为250±100μm且安装在Franz扩散池,其中平均表面及为约0.6cm2且体积为约2.0mL。切下的皮肤安装在供体和接收器隔室之间且将扩散池用和夹子密封在一起。将接收器隔室填充接收流体(水,MS级)。之前的溶解性结果显示水不会影响沉降条件。各池然后被平衡以保证表面温度为32℃(在给药前保持至少30分钟)。额外的Franz池也安装但不给药(以作为空白对照),以评估对样品定量的干扰。IL23适体(ARC32225)以1%w/w溶于水溶液(97.9%w/w去离子水,0.1%w/w聚山梨酯20和1.0%w/w苄醇)。IL23适体(ARC32225)制剂以6mg(即10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。测试制品施加至一个皮肤供体且每个皮肤供体进行至少4次平行测定。在施加后6和15小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的IL23适体(ARC32225)且未被分析。从皮肤表面去除残余局部制剂后,剩余的表皮和真皮置于60℃烘箱保持2min。将表皮和真皮从烘箱取出且使用镊子和戴手套的手指手动分离。将表皮和真皮层置于单独的瓶中且立即冷冻。随后将瓶解冻且且使用DHA(之前描述)分析。
结果
施加后6和15小时源自限定剂量(6mg或10mg/cm2)的温度和表皮对IL23适体在离体皮肤中被动递送的影响的结果可参见图16。对于在32℃或4℃保持的皮肤,IL23适体在6和15小时都渗透皮肤。对于在32℃保持的皮肤,在皮肤中发现IL23适体的量在6至15小时中增加。温度不影响IL23适体在皮肤中的渗透,因此排除主动运输的概念且进一步支持该渗透是被动的。
图16显示IL23适体的被动渗透,比较了在限定剂量(10mg/cm2)下温度的作用。显示了施加后6和15小时递送至表皮和真皮的IL23适体的量。柱表示源自4次平行测定和1个供体的IL23适体的平均量(n=4)±SEM。样品通过DHA分析,其范围为10x10-12至40x10-12M。
实施例15:化学和结构修饰对IL23适体局部递送的作用
通常通过用氟-(F)、氨基-(NH2)或O-甲基(OCH3)取代2′位以对核苷酸糖或核苷酸间磷酸二酯连接基进行化学修饰以增强核酸酶抗性(Keefe等人(2010)Nat Rev Drug Discov 9(7):537-50)。为确定不同的2’修饰是否对IL23适体的局部递送有影响,对IL23适体进行2’甲基或2’氟修饰。反义寡核苷酸和适体之间的一个主要差异为构象结构和柔性(Nomura,Y.,等人,(2010)Nucleic Acids Res 38(21):7822-9)。反义分子的结构被主动避免,因为其可对功效有影响。适体的一个优点为结构可被修饰且仍然保持活性。该IL23适体折叠,其中磷酸骨架占据分子外部,且大部分碱基被包进二级结构中。为更好的理解构象结构是否对IL23适体的局部递送有影响,对IL23适体进行点突变,其预计改变二级和三级结构。最后,从大的汇集随机库探究适体渗透的广度以帮助理解适体通常的不同物理化学性质。
方法
新切离的人腹部皮肤切皮成厚度为500±100μm且安装在流通扩散池上,使用供体块以提供防漏密封,暴露的表面积为1.0cm2。扩散池连接至多通道泵,且PBS流速为约1.8mL/hr。各池然后在加热歧管中平衡以保证皮肤表面温度为32℃(在给药前保持至少30分钟)。IL23适体(ARC32225)和IL23类似物以1%w/w溶于水溶液(97.9%w/w去离子水,0.1%w/w聚山梨酯20和1.0%w/w苄醇)。IL23适体(ARC32225)和变体溶于100%DI水。适体以10uL/池(10mg/cm2)的剂量局部施加,其使用正排量式吸量管均匀分布至角质层表面。测试制品被施加至一个皮肤供体,且每个皮肤供体进行2至7次平行测定。在施加后的6和24小时,皮肤表面使用5个浸泡于0.05%v/v Tween 20/PBS溶液中的棉签清洗。清洗的皮肤随后立即使用胶带从皮肤表面进行三次剥离以从角质层的第一层去除残余制剂。这些样品被认为是不渗透皮肤的适体且未被分析。从皮肤表面去除残余局部制剂后,剩余的表皮和真皮置于60℃烘箱保持2min。将表皮和真皮从烘箱取出且使用镊子和戴手套的手指手动分离。将表皮和真皮层置于单独的瓶中且立即冷冻。随后将瓶解冻且且使用DHA(之前描述)分析。
IL23变体:变体1-4包含破坏2°结构的点突变,而变体5包含破坏三级接触点的突变。该突变限制为不会扰乱DHA所需的探针结合的适体部分。3’和5’端需要保守以允许使用DHA定量适体。适体变体溶于100%DI水,其随后发现没有完全覆盖皮肤的给药面积,这是由于角质层中脂质的表面张力。
变体1(2°结构破坏):
mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mC-fC-fG-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG.(SEQIDNO:20)
变体2(2°结构破坏):
mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-mA-fG-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG.(SEQIDNO:21)
变体3(2°结构破坏):
mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-fC-mA-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG.(SEQIDNO:22)
变体4(2°结构破坏):
mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-fC-fG-fC-fC-mG-fC-fU-fC-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mC-mG-mG-fU-mA-mG-fU-fC-fU-mG.(SEQIDNO:23)
变体5(3°结构破坏):
mA-fG-fG-fG-mA-mA-mA-fU-fC-fA-mG-fG-fC-fU-fU-fU-mA-fU-fC-mG-mG-mG-fC-fG-fC-fC-mG-fC-fU-mA-fC-fC-fU-mG-mU-mG-mC-fC-mA-fU-fC-mG-fU-mC-mC-fG-mA-mG-mA-mG-fU-mA-mG-mG-fU-mA-mG-fU-fC-fU-mG.(SEQIDNO:24)
适体汇集库:fCmD结构库,具有2′-氟-C;2′-甲氧基-A,G,U的组成,浓度为2.5uM。fGmH结构库,具有2′-氟-G;2′-甲氧基-A,C,U的组成,浓度为2.5uM。fRmY,具有2’-氟-A,G;2’-甲氧基-C,U,浓度为541uM。rGmH池,具有2’-羟基-G;2’-甲氧基-A,C,U,浓度为549uM。
IL23类似物(修饰):MNA IL23类似物(全部为2’-OMe核糖)以12.15mg/mL溶于包含97.9%DI水、0.1%聚山梨酯20、1%苯甲酰基醇的载体,其中向2'羟基添加甲基。fCmD IL23类似物(2’-氟胞苷;2’-OMe腺苷、鸟苷、尿苷)以3.29mg/mL溶于包含97.9%DI水、0.1%聚山梨酯20、1%苯甲酰基醇的载体。fGmH IL23类似物(2’-氟鸟苷;2’-OMe腺苷、胞苷、尿苷)以10.87mg/mL溶于包含97.9%DI水、0.1%聚山梨酯20、1%苯甲酰基醇的载体。
结果
IL23 2’修饰:具有不同2’修饰的IL23适体早在6小时和24小时都以治疗水平(IC50的560至34、100-倍)渗透表皮和真皮(图17)。MNA IL23适体类似物在6和24小时在表皮中显示最高量的适体,表明甲氧基化与更好的皮肤渗透具有正相关性(图17)。这些甲氧基化的化合物可具有不同的溶解性,其可影响化合物的热力学且最终影响其渗透皮肤的能力。
也制备了基于DNA的IL23适体。然而,该适体渗透表皮和真皮的能力不能被评估,因为DHA不能检测该适体,这通过在标准曲线中缺少信号而证实。
表10显示IL23适体在人离体皮肤中的皮肤渗透,作为施加剂量百分比(%)。如其中所示,在6小时处有意义量的适体渗透表皮和真皮且在给药后15小时内增加或保持。
表10.2’修饰的IL23适体在人离体皮肤中的皮肤渗透,作为施加剂量百分比(%)。在水溶液中施加后6和15小时递送至表皮和真皮的2’修饰的IL23适体的量。数值表示源自2-7次平行测定和1个供体的转化为施加剂量%的IL23的量。样品通过DHA分析,其范围为10x10-12至40x10-12M。制剂以10μL/cm2施加且针对重量校正,假定1μL=1mg。
结构改变(变体):所有具有二级结构变化的4个变体在24小时内在表皮中显示显著浓度,其中施加剂量的4-16%渗透皮肤(图17)。变体5,其中点突变破坏或改变三级结构,也在24小时内渗透表皮(图17)。变体1和变体4没有在真皮中产生可检测的水平。相比之前研究,皮肤中的总体低水平很可能通过由于角质层中载体和脂质之间的表面张力,水载体没有充分润湿皮肤所解释。建议在水性载体中包含表面活性剂(即,聚山梨酯20)以破坏该表面张力。修改IL23适体的二级或三级结构对渗透没有主要影响,表明该适体的能力不完全依赖于结构。
适体汇集库:
fCmD、fGmH、fRmY和rGmH适体库使用生物素化杂交探针从蛋白酶K消化的皮肤样品提取,且进行qPCR。从各皮肤样品回收的适体的平均数为超过两千亿,且平均回收率为0.051%。这些大的回收量表明适体作为一类分子渗透皮肤。
因为回收的量如此大,不可能取样整个序列空间。然而,将fCmD和fGmH和fRmY和rGmH库测序以寻找富集(>2复制),其中将数据处理且分析以仅储存从统计的角度认为富集的序列。这些结果显示产生五百一十万序列,其中仅有252个被富集。然而,这些富集的序列大部分是引物:二聚体和人工产物。所观察到的回收率优于其它序列的序列将提供超过两个序列。例如,源自fRmY库的真皮样品显示3.9e+11个分子的回收,且回收率为0.024%。源自该真皮样品的序列数为351,241。如果在该回收率对特定序列有偏好,则将期待看到84个序列。
在总数据集中约五百一十万序列仅发现一次或两次,表明没有对任何特定序列的偏好。如果具有特定化学(序列或组成)的适体导致更好的渗透,将预期在测序数据中具有更多复制。这种在测序中没有差异也表明适体渗透为这些分子的普遍特质。各库中的回收率示于表11。
表11.测试制品的序回收率,通过qPCR测量。
图17显示不同的2’修饰的IL23适体对离体人皮肤的皮肤渗透。离体腹部皮肤用10μL的在水溶液中的4种不同的2’修饰的IL23适体(IL23 108ug/cm2,MNA 121.5ug/cm2,fCmD 32.9ug/cm2,和fGmH 108.7ug/cm2)局部处理。柱表示在6小时(A)和24小时(B)源自2-7次平行测定的IL23适体在单一皮肤供体上的平均量。离体腹部皮肤用10uL的在水溶液中的4种不同的破坏二级结构的变体(变体1;1.1mg/mL,变体2;0.4mg/mL,变体3;0.9mg/mL,和变体4;0.9mg/mL)和1种破坏三级结构的变体(变体5;1.1mg/mL)和IL23适体(1.0mg/mL)局部处理。柱表示在24小时源自4次平行测定的IL23适体在单一皮肤供体上的量(n≥4)±SEM(C)。递送至表皮(黑色柱)和真皮(灰色柱)的IL23适体的量。样品通过DHA分析,显示为平均值±SEM。
实施例16:治疗适体在人皮肤中的生物活性
为证实所有皮肤渗透研究的真皮中IL23适体的治疗浓度为生物活性的,使用包含生长培养基的静止池将新切离的人皮肤安装且固定在适当地方且对其进行刺激以诱导Th17响应。将IL23适体配制在水载体(97.9%w/w去离子水,0.1%w/w聚山梨酯20和1.0%w/w苄醇)中,局部施加,并与介质中的IL23适体和RORγ反向激动剂比较。
方法
Th17刺激的人离体皮肤模型
使用静止池的组织培养:新切离的健康人皮肤切皮为750um且使用抗生素/抗霉菌溶液清洁,该溶液由1%GIBCOTM抗生素-抗霉菌素(100X)、0.1%庆大霉素在1x Dulbecco磷酸盐缓冲盐水中制备。使用一次性活检穿孔器(Acupunch,Acuderm,Inc.)切离12mm直径的活体组织,且将其在抗生物/抗霉菌溶液中洗涤5-10分钟。皮肤活体组织切片置于被高压蒸汽处理过的7mm(0.38cm2)无包套静止池中,且具有2mL受体体积(PermeGear,Inc;No.6G-01-00-07-02),且使用金属夹和供体室保持防漏密封。受体室用使用巴士德吸量管以分配于采样口的角化物质(cornification)填充。静止池然后在37℃被置于润湿的培养箱中。在第1天(第-1天)测试制品在介质中局部给药或全身给药。24小时之后(第0天),更换培养基且将Th17刺激‘混合物’添加至Franz池的受体室。24小时之后(第1天)将该组织移除并切碎成小于1x1x1mm的块且随后储存在10x体积的RNA中(Qiagen,Cat#76104),其中300μL的RNeasy裂解缓冲液(Qiagen,Cat#79216)补充有1%2-β-疏基-乙醇以用于RNA分离。
角化培养基:培养基由以下组成:237mL Dulbecco改良Eagle培养基(DMEM)(Cat#11995-065),237mL Ham's F-12K(Kaighn's)培养基(21127-022),1mL 90mM腺嘌呤,1mL 0.94M CaCl,1mL 10nM三碘甲状腺原氨酸,1mL胰岛素-转铁蛋白-硒-乙醇胺(ITS-X)(100X)(5100-056),5mL抗生素-抗霉菌素(100X)(15240-062),10mL胎牛血清(FBS)(HyCloneTM,SH30071.01HI),5mL GlutaMAXTM补剂(35050-061),0.1mL 50mg/ml庆大霉素(Invitrogen,#15750060)。
Th17刺激混合物:将细胞因子混合物优化以刺激天然CD4T-细胞,防止TH1和TH2细胞的刺激,且聚集TH17细胞的刺激。天然的CD4刺激通过1ug/ml纯化的NA/LE小鼠抗-人CD3(BD Pharmingen,Cat#555329)和2ug/ml人CD28抗体(R&DSystems,Cat#MAB342)的组合实现。TH1和TH2细胞的阻止通过组合1ug/ml人IFN-γ抗体(R&DSystems,Cat#MAB2851)、1ug/ml人IL-4抗体(R&DSystems,Cat#MAB304)而实现。TH17细胞的刺激是通过10ng/ml重组人IL-1b/IL-1F2(R&DSystems,Cat#201-LB-025/CF)、10ng/ml重组人IL-6(R&DSystems,Cat#206-IL-010/CF)、1ng/ml重组人TGF-b1(R&DSystems,Cat#240-B-010/CF)和重组人IL-21(Southern Biotech,Cat#19000-00)的混合物实现的。所有组分与角化培养基一起被加入单一混合物。
RNA分离和定量:将约40mg切碎的组织添加至包含2.8和1.4mm陶瓷珠的均匀化管。将组织用高通量珠磨匀化器(24Atkinson,NH)以6300rpm破坏30秒,循环10次,间隙用冰冷却2-分钟。匀浆通过在55℃添加包含10uL蛋白酶K(Thermo Scientific,Cat#E00491)的490μL水保持15分钟而消化。将消化的组织以10,000xg旋转沉降3分钟以沉淀细胞碎片,且上清液被用于根据制造商的方案使用Qiagen’s Mini RNA分离试剂盒(Cat#74106)分离RNA。总RNA使用Nanodrop 2000(Thermo Scientific,Wilmington,DE)定量。源自皮肤组织的分离的RNA(1.4ug)以20uL PCR体积用作模板,使用Invitrogen SuperScript VILO cDNA合成试剂盒(#11754-050)以产生cDNA模板。cDNA以1:25稀释以用于随后的qPCR,且特定的TaqMan探针用于各待定量基因。Life Technologies AVii7PCR机器用于qPCR 40扩增循环。GAPDH、IL17A、IL17F和IL22相对表达的RNA水平使用Delta Delta CT式计算。
结果
Th17刺激条件导致IL17f和IL22二者显著上调(图18)。IL23适体的局部施加导致IL17f和IL22二者降低(分别为p<0.001和0.05),且这些减少类似于培养基中包含的IL23适体。有趣的是,源自局部施加IL23适体的IL22的减少类似于小分子RORγ反向激动剂。这证实了之前定量的治疗水平是由于其能够以生物有意义的水平结合至皮肤微环境中的细胞外IL23的构象结构。
图18显示局部施加IL23适体在人皮肤中抑制Th17衍生的细胞因子。使用包含生长培养基的静止池将新切离的人腹部皮肤安装且固定在适当地方且随后刺激24小时以诱导Th17响应。皮肤在Th17刺激前后用8μL(210μg/cm2)局部处理。10μM IL23适体和RORγ反向激动剂被包含在培养基中作为系统对照。刺激24小时后收集皮肤,且通过qPCR确定Th17-型细胞因子、IL17f和IL22的相对转录水平。柱表示源自在3个不同皮肤供体上3次平行测定(n=9)的最大刺激的平均百分比(设定为100%)。
参考文献
1.Watkinson,A.C.,A commentary on transdermal drug delivery systems in clinical trials.J Pharm Sci.,2013.102(9):p.3082-3088.
2.Nemes,Z.and P.M.Steinert,Bricks and mortar of the epidermal barrier.Exp Mol Med,1999.31(1):p.5-19.
3.Bos,J.D.and M.M.Meinardi,The 500Dalton rule for the skin penetration of chemical compounds and drugs.Exp Dermatol,2000.9(3):p.165-9.
4.Bouwstra,J.A.,Gooris,G.S.,The Lipid Organisation in Human Stratum Corneum and Model Systems.The Open Dermatology Journal,2010.4,:p.10-13.
5.Kim,Y.S.and M.B.Gu,Advances in Aptamer Screening and Small Molecule Aptasensors.Adv Biochem Eng Biotechnol.
6.Nakamura,Y.I.,A.Miyakawa,S.,RNA plasticity and selectivity applicable to therapeutics and novel biosensor development.Genes Cells,2012.17(5):p.344-64.
7.Russell-Jones,G.and R.Himes,Water-in-oil microemulsions for effective transdermal delivery of proteins.Expert.Opin.Drug Deliv.,2011.8(4):p.537-546.
8.Mehta,R.C.,et al.,Intercellular adhesion molecule-1suppression in skin by topical delivery of anti-sense oligonucleotides.J Invest Dermatol,2000.115(5):p.805-12.
9.Drolet,D.W.,et al.,Pharmacokinetics and safety of an anti-vascular endothelial growth factor aptamer(NX1838)following injection into the vitreous humor of rhesus monkeys.Pharm Res,2000.17(12):p.1503-10.
10.Nomura,Y.,et al.,Conformational plasticity of RNA for target recognition as revealed by the 2.15A crystal structure of a human IgG-aptamer complex.Nucleic Acids Res,2010.38(21):p.7822-9.
11.Cevc,G.and G.Blume,Lipid vesicles penetrate into intact skin owing to the transdermal osmotic gradients and hydration force.Biochim Biophys Acta,1992.1104(1):p.226-32.
12.Cevc,G.,A.Schatzlein,and H.Richardsen,Ultradeformable lipid vesicles can penetrate the skin and other semi-permeable barriers unfragmented.Evidence from double label CLSM experiments and direct size measurements.Biochim Biophys Acta,2002.1564(1):p.21-30.
13.Tanojo H,M.H.,Role of calcium ions in relation to skin barrier function.,in Percutaneous Absorption:Drugs-Cosmetics-Mechanisms-Methodology.,M.H.Bronaugh RL,Editor.1999.p.939-950.
14.Elias,P.,et al.,Origin of the epidermal calcium gradient:regulation by barrier status and role of active vs passive mechanisms.J Invest Dermatol,2002.119(6):p.1269-74.
15.MacLeod,D.T.,et al.,HSV-1 exploits the innate immune scavenger receptor MARCO to enhance epithelial adsorption and infection.Nat Commun,2013.4:p.1963.
16.Song,Q.,Briley,W.,Narayan,S.,Wang,X.,Mirkin,C.,Paller,A.S.,Epidermal Class A Scavenger Receptors are Critical for Penetration of Topically Delivered Sperical Nucleic Acid Nanoconjugates(SNA)and Gene Supression,in Society for Investigative Dermatology.2014:Poster 366.
17.Keefe,A.D.,S.Pai,and A.Ellington,Aptamers as therapeutics.Nat Rev Drug Discov,2010.9(7):p.537-50.
18.Immunological Reviews(2008)Vol.226:103
19.Annu.Rev.Immunol.(2007)Vol.25:221
20.Trends Immunol.(2006)Vol.27:17
21.Curr.Med.Chem.(2006)Vol.13:1149
22.Immunity(2000)Vol.13:715
23.J.Immunol.(2002)Vol.168:5699
24.Nat.Rev.Immunol.(2003)Vol.3:133
25.Nat.Immunol.(2009)Vol.10:314
26.Nature(2003)Vol.421:744
27.J.Exp.Med.(2003)Vol.198:1951
28.Immunol.Lett.(2005)Vol.96:211
29.Semin.Immunol.(2007)Vol.19:372
30.J.Clin.Invest.(2006)Vol.116:1317
31.Curr.Opinion Immun.(2008)Vol.20:663
32.J.Immun.(2010)Vol.185:5688
33.Immunity(2010)Vol.33:279
34.Am.J.Hum.Genet.(2007)Vol.80:273;Hum.Genet.(2007)Vol.122:201
35.F1000 Biol.Reports(2010)Vol.2:40
36.Semin.Cutan.Med.Surg.(2010)Vol.29:3
37.J.Immunol.(2011)Vol.186:1495
38.J.Immun.(2010)Vol.185:5688
39.Ther.Clin.Risk Manag.(2010)Vol.6:123
40.Cytokine Therapies:Ann.N.Y.Acad.Sci.(2009)Vol.1182:97
41.Prescrire Int.(2009)Vol.18:202
42.Semin.Cutan.Med.Surg.(2010)Vol.29:48
43.J.Invest.Dermatol.(2000)Vol.115:805
- 还没有人留言评论。精彩留言会获得点赞!