用于脑的非侵入式神经刺激治疗的方法、系统以及装置与流程
本发明涉及用于神经刺激治疗的方法、系统以及装置,并且更具体地,涉及用于脑的鼻内和/或经颅神经刺激治疗的方法、系统以及装置。
背景技术:
对制药工业的许多批评者认为,对于许多慢性神经病症,缺乏有效的药物治疗。这些病症可以包括创伤性脑损伤(TBI)、中风、多发性硬化(MS)、精神分裂症、孤独症、失眠症、创伤后压力心理障碍症(PTSD)、痴呆和阿尔茨海默病(阿尔茨海默病)、震颤麻痹(帕金森病)以及许多其它神经病症和障碍症。一些人认为,针对精神病的可用药物治疗并不比安慰剂更好,甚至可能是有害的。结果,具有神经病症的许多患者寻求替代治疗。
替代治疗的一个领域,脑刺激技术已经使用了一段时间,其基于神经系统以实质方式对这些技术做出响应的事实。这些技术中的许多技术基于电和磁脉冲。以下列表构成了目前用于刺激人脑以用于治疗目的的主要方法。
1、电休克疗法(ECT)
电休克疗法(ECT)是用于在麻醉患者中电诱导发作以便治疗严重抑郁症、躁狂症以及紧张症的困难病例的最古老方法之一(例如,参见Rudorfer,MV,Henry,ME,Sackeim,HA(2003).“Electroconvulsive therapy”.In Tasman A,Kay J,Lieberman JA(eds)Psychiatry,Second Edition.Chichester:John Wiley&Sons Ltd,1865–1901)。ECT方法的作用机制尚未完全被理解,并且对治疗方案没有普通一致意见。而且,ECT方法具有损害脑的风险,这种损伤的代表是认知缺陷(例如,参见Breggin P(2007)."ECT Damages the Brain:Disturbing News for Patients and Shock Doctors Alike".Ethical Human Psychology and Psychiatry.9(2):83–86)。另外,由于治疗造成的IQ和记忆损失也是显著的(参见Andre L(2009).“Doctors of Deception:What They Don't Want You to Know About Shock Treatment”.Rutgers University Press)。
2、经颅微电流刺激疗法(CES)
另一种电脑刺激技术涉及经颅微电流刺激疗法(“CES”)。CES方法在患者的头上施加小脉冲电流。一些开业医生声称CES有助于诸如压力、焦虑、抑郁以及失眠的症状。然而,其仍是一种实验技术(例如,参见Klawansky S(1995).“Meta-Analysis of Randomized Controlled Trials of Cranial Electrostimulation:Efficacy in Treating Selected Psychological and Physiological Constitutions”.Journal of Nervous&Mental Disease 183(7):478–484)。所提出的针对CES的作用机制是,电流的脉冲增加神经细胞产生血清素(serotonin)、多巴胺、DHEA、内啡肽以及稳定神经激素系统的其它神经递质的能力(参见Gilula MF,Kirsch DL(2005).“Cranial Electrotherapy Stimulation Review:A Safer Alternative to Psychopharmaceuticals in the Treatment of Depression”.Journal of Neurotherapy.9(2))。有些人认为CES可能有助于缓解某些压力相关症状,但是尚未充分研究以确定其使用是否实用和成本效益(参见Barrett S(2008).“Dubious Claims Made for NutriPax and Cranial Electrotherapy Stimulation”.QuackWatch online,accessed on May 2012)。
3、脑深部刺激(DBS)
脑深部刺激(DBS)利用植入物,植入物通过经由贯穿患者颅骨中的小孔用手术插入的薄电极传递测量剂量的电刺激而起作用,并且其尖端被植入目标脑区域中。美国食品和药物管理局(FDA)1997年批准了用于治疗称为“原发性震颤”的障碍的DBS装置和方法;2002年批准了用于治疗帕金森氏病的DBS装置和方法;2003年批准了治疗肌张力障碍的DBS装置和方法(参见Kringelbach ML,Jenkinson N,Owen SLF,Aziz TZ(2007)."Translational principles of deep brain stimulation".Nature Reviews Neuroscience.8:623–635)。最近,据报道,阿尔茨海默病也对DBS有反应(参见Wood J(2012).“Brain Pacemaker Shows Promise in Fighting Alzheimer’s Disease”.PSychCentral.com online(May 12,2012))。尽管他们成功,但是DBS治疗在其效果上可能过度活跃,导致可能触发眩晕、刺痛以及其它不良副作用的结果。研究人员仍然不明白DBS治疗实际在体内如何工作。
4、经颅光疗法(TLT)
经颅光疗法(“TLT”)或经颅光生物调节(“tPBM”)由于健全科学原理、成功的结果,缺少副作用并且是非侵入性的,近年来正在受到关注。这种方法涉及使光穿过颅骨外侧引导至脑。光源可以是发光二极管(LED)或者低水平激光源,通常在频谱的红或近红外(NIR)部分中。NIR频带是优选的选择,以提供穿过脑膜、颅骨材料并且然后穿过脑物质的较深穿透,以便到达脑的较深部位。最近的研究支持经颅光疗法用于治疗中风、创伤性脑损伤、帕金森病、轻度认知损伤、阿尔茨海默病、抑郁症、以及一些其它认知问题的潜力(例如,参见Rojas JC,Gonzalez-Lima F(2011).“Low-level light therapy of the eye and brain”.Eye and Brain.3:49-67)。最近,还发现这种物理疗法(modality)还可以增强皮质代谢能力和消退记忆的保持,减少恐惧更新,并且暗示低水平光疗法作为一种新型干预来改善记忆(Rojas JC et al(2012).“Low-level light therapy improves cortical metabolic capacity and memory retention”.J Alzheimer’s Dis.2012;32(3):741-52)。
5、耳道经颅光疗法
耳道经颅光疗法是在芬兰的一项研究后开发的,其表明当将亮光引导到耳中时,其有助于治疗季节性情感障碍(SAD)或冬季抑郁症(Timonen M et al(2012).“Can transcranial brain-targeted bright light treatment via ear canals be effective in relieving symptoms in seasonal affective disorder?”Medical Hypothesis.78(4):511-515)。商业上销售的装置具有二极管,该二极管采用具有非常明亮的白色LED的耳塞形式,LED通过线缆附接至控制器单元。其是消费者友好的,并且看起来对SAD有效。
6、光遗传神经刺激
在光遗传神经刺激(光遗传学)过程中,研究人员首先将用于光敏分子的基因(称作光敏感通道2(ChR2))引入特定神经元子集中。在这些神经元上照耀蓝光,然后使它们发光。这种方法的一个优点是其特异性,即,仅将具有该基因的神经元激活。该过程还提供了一种通过引入不同分子(盐细菌视紫红质(“NpHR”))来阻断神经元的方式,其使用黄光的能量来使该细胞静默。这些要素的组合使得该技术在实现特定神经结果方面非常精确。光遗传学研究可以导致在使脑的解剖位置与可预测行为结果相关方面的重要理解。可以如何操纵行为的精确性对推进神经科学有极大的吸引力。然而,这时,挑战是将动物实验转化为人类应用。该技术仍然在实验室领域,涉及小动物(主要是大鼠和小鼠)。其是一种侵入式方法,该方法涉及植入插入到脑中的光探针,并且经由保持光纤的导管从瞄准脑区域连接至控制器单元。为了实现精确刺激结果,还要求将ChR2引入到脑的特定区域,以使期望神经元发光。光遗传学方法的精度对科学家非常有吸引力,但是预计在可预见的将来仍留在研究实验室领域。如今,超过500个实验室正在将光遗传学工具应用于帕金森病、失明、脊柱损伤、抑郁症、发作性睡病、成瘾性以及记忆的动物模型(参见Williams M(2010).“A brain implant that uses light”.Technology Review online article published on February 24,2010)。
7、鼻内光疗法
鼻内光疗法涉及将光能引导通过鼻腔并且进入脑中。研究发现鼻内光疗法为人类的神经病症(诸如失眠、轻度认知障碍、阿尔茨海默病、帕金森病、精神分裂症、偏头痛和头痛、以及中风(脑梗塞))提供积极的结果。
当前脑刺激技术的概要:
存在支持所有这些常规已知方法的功效的良好数据,由此,确认脑对光的响应,并且产生各种形式的治疗结果。然而,它们都是刺激脑以用于治疗目的的非常不同的方式。大多数治疗方法在实验室条件下部署在动物身体上;或者如果部署在人类身体上,则很大程度上必须在临床监督下施用。可理解地,光遗传学方法在神经科学界引起了大量的关注,这是因为它可以通过对脑的精确解剖操作来提取神经结果的精确性。然而,所要求的侵入性和设置保持在实验室领域。迄今为止,具有成为消费者友好产品的显著潜力的一种常规方法-耳道经颅方法被单独且特别地用于治疗季节性情感障碍。
似乎具有治疗广泛医学病症的巨大潜力的方法是经颅法。十多年来,经颅光生物调节(PBM)在实验室动物和人类对象(subject)中产生了积极效果。动物研究包括急性创伤性脑损伤(TBI)、阿尔茨海默病、抑郁症以及中风,而人类研究包括TBI、抑郁症以及中风。而且,已经发现低水平光能在中风研究中对于人是安全的,而没有通常与药物相关的副作用。
然而,经颅装置尚未开发到它们是便携式的并且以低成本大量生产的程度。相反,这种装置主要仅在研究实验室中可用,因为它们制造昂贵,具有不允许它们是便携式的功率要求,以及要求训练来使用。而且,这种经颅装置被设计成使得光能不可能到达位于脑下侧的重要原始区域。在其它功能中,这些原始区域控制记忆、行为以及情绪。
鼻内光疗法可以被用于到达位于脑下侧的这些区域中的一些区域,因为它们比头皮更靠近鼻区。通过鼻腔传递光能具有另外的优点,这是因为对象的头皮或头发不充当屏障。然而,来自鼻内源的光能量不太可能到达远离鼻腔的脑区域,诸如头顶周围的背部皮层区域。
脑照射治疗的科学基础和根据:
因为药物在寻求治疗许多神经障碍方面的无效性,日益增加的关注被引导至替代治疗,如光疗法。各种研究清楚地显示和事实上证明低水平光疗法(LLLT)对大脑的多种有益体内作用。在动物研究中,已经发现低水平光疗法有望治疗治疗缺氧性脑损伤、动脉粥样硬化血栓形成性中风、栓塞性中风、帕金森病、轻度认知损伤以及阿尔茨海默病。类似地,在人类研究中,已经发现低水平光疗法有望改善对缺血性中风、创伤性脑损伤、抑郁症以及前额叶皮层的功能的作用。
脑照射治疗的作用机制:
图17示出了低水平光疗法的细胞内机制。如所示,脑的治疗反应的一个关键在于,存在于所有细胞线粒体中的光受体呼吸酶(细胞色素氧化酶)的存在。细胞色素氧化酶表示代谢活动的最好已知神经内标志物;并且其酶活性与自由基代谢、细胞死亡通路、以及谷氨酸能(神经递质相关)激活紧密耦合,对于学习和记忆是重要的(例如,参见Wong-Riley MT(1989).“Cytochrome oxidase:an endogenous metabolic marker for neural activity”.Trends Neurosc.12(3):94-101)。
与在眼睛内部发现的光受体不同,光受体不处理光能,而相反是正常代谢通路的组成部分。光受体对光谱的可见红光区和近红外区中的光敏感,并且能够将这些红光波长和近红外波长的吸收光转换成三磷酸腺苷(ATP)的细胞能量分子。当这些可见红光和近红外波长的光(以低能量水平)进入活细胞(包括神经细胞)时,光能通过调节内部线粒体功能、神经元内信令系统以及氧化还原态来调节细胞的代谢活动(光生物调节)。而且,经验实验表明,神经元中的电活动的光神经生物调节可以独立于热效应而实现(参见Fork RL(1971).“Laser stimulation of nerve cells in Aplysia”.Science.171(974):907-908)。而且,当以低能量水平被采用并传递时,脑吸收光能的治疗效果不伴有任何实质性并发症或主要副作用。由此,脑的神经元事实上影响活体的所有功能和活动,将脑暴露于调制光能的影响因此影响人类的整体医疗状况。
在细胞级,细胞色素氧化酶对红光和近红外红光的敏感性可以通过发色团在蛋白质结构中的作用来解释。发色团是存在于所有光受体中的有机结构实体,诸如存在于眼睛中并且赋予我们对颜色的感觉的那些发色团。这些发色团仅吸收特定光波长而拒绝所有其它光波长;并且发色团中的细胞色素氧化酶已知接受红光和近红外红光能量。
这些基本事实准确地识别光能照射的潜在影响,光能照射可以根据需要有目的地被引导到活脑的一个或多个解剖部位,导致对多种医学上识别的神经病症和病理状态的有益治疗和预防这两者。
神经系统中的光受体:
尽管早先报道的动物实验暗示了光受体在脑中的存在,但是只有首次在2000年报道的那些特定实验和经验结果,其正确地证明了孤立线粒体对在光谱的红光和近红外红光区域中的单色光的照射敏感。由此,其经验性地证明了,利用红光低功率激光器照射隔离的大鼠肝线粒体增加了ATP合成和氧消耗(Karu T(2000).“Mechanism of low-power laser light action on cellular level”.Proc SPIE.2000;4159:1-17)。另外,已经根据经验证明受损的线粒体氧化代谢与神经变性有关(参见Wong-Riley MT et al(2001).“Light emitting diode treatment reverses the effect of TTX on cytochrome oxidase in neurons”.Neuroreport.12(14):3033-3037)。而且,研究揭示暴露于低水平红光的大鼠神经元培养物显示细胞色素氧化酶活性增加(参见Wong-Riley MT et al(2005).“Photobiomodulation directly benefits primary neurons functionally inactivated by toxins:role of cytochrome c oxidase”.J Biol Chem.280(6):4761-4771)。
因此,旨在改善体内线粒体代谢的光调节方法、系统以及装置对患病和正常脑组织两者的功能具有主要益处。这种光调节方法也被认为潜在地减轻人的疼痛(参见Chow Rt et al(2009).“Efficacy of low-level laser therapy in the management of neck pain:a systematic review and meta-analysis of randomised placebo or active treatment controlled trials”.Lancet.374(9705):1897-1908)。
还值得注意的是,观察到光照射对脑的作用在波长特定范围内有效。介导光的作用的初级光受体并非仅局限于线粒体;还认为细胞中的吸收光的分子是呼吸链的一部分(参见Karu T(1989).“Laser biostimulation:a photobiological phenomenon”.J Photochem Photobiol B.3(4):638-640)。
平衡和体内平衡:
认识到,存在当光受体(如细胞色素氧化酶)对进一步光刺激不反应时的点。这种临界事件在光受体由所吸收的光能完全还原或完全氧化时发生;由此,光受体只有在它们处于它们的中间阶段时才能够对光能暴露作出反应(参见Karu TI,et al(2008).“Absorption measurements of cell monolayers relevant to mechanisms of laser phototherapy:reduction or oxidation of cytochrome c oxidase under laser radiation at632.8nm”.Photomed Laser Surg.26(6):593-599)。因此,当光受体变得被完全还原或完全氧化时,进一步连续的低功率照射将不会从光受体产生进一步代谢活性。这表明身体内的活细胞在它们未体内平衡(ex-homeostasis)时具有编码动作电位限制;并且由此,脑的神经元具有仅对光照射积极响应的电位,直到它们达到体内平衡状态为止。
适于光照射治疗的神经病症:
存在可以在体内从脑的一个或多个区域的光照射受益的许多潜在神经病症。下面,对这些医学病症中的一些进行概要描述。另外,应当注意和明白的是,还预想使用本发明在治疗上可有效治疗的广泛范围的其它神经疾病、障碍以及和病理状态。这些其它神经病证的示例预期包括但不限于癫痫症、偏头痛、慢性疲劳综合征、脑炎、多发性硬化、焦虑性障碍、注意力欠缺障碍、精神分裂症以及学习无能。
1、中风、神经外伤、认知以及情绪心理状态的治疗
与中风、神经外伤、认知、情绪状态以及类似神经障碍的治疗相关的人和动物研究已被很好地证明(例如,参见Rojas JC,Gonzalez-Lima F.“Low level light therapy of the eye and brain”.Eye and Brain.2011;3:49-67)。作为系统身体健康的神经控制中心的脑对所有身体健康有直接影响。例如,作为全身体内平衡的关键调节腺的下丘脑的健康对整个身体健康具有深远影响;并且由此,在功能上改善的下丘脑将伴随地产生更大程度的全身体内平衡。而且,研究已广泛地调查研究了针对中风和神经外伤两者的脑照射。例如,Uozemi等人最近的研究已经证明了,经颅传递的低能量光能够将血流量增加30%(Uozumi Y et al(2010).“Targeted increase in cerebral blood flow by transcranial near-infrared laser irradiation”.Lasers SurgMed.42(6):566-576)。利用光照射的这种经证明的有益结果伴随着一氧化氮产生的显著增加,一种与血管壁的舒张相关联以实现改善的血液循环的机制。由此,显示出脑血流量在治疗和未治疗的脑半球两者中增加。而且,用光照射预处理的对象在梗塞时段期间显示改善的血流量,具有稳定的体温、心率以及呼吸率。总体结果是在中风事件期间凋亡性细胞显著减少。
利用低水平近红外红光(NIR)的常规照射也已经发现与中风事件后的显著神经恢复相关(参见Detaboada L et al(2006).“Transcranial application of low-energy laser irradiation improves neurological deficits in rats following acute stroke”.Lasers Surg Med.38(1):70-73)。而且,这些恢复效果与脑室下区(其在神经发生中起作用)中的增加神经元增殖和迁移相关(参见Oron et al(2006).“Low-level laser therapy applied transcranially to rats after induction of stroke significantly reduces long-term neurological deficits”.Stroke.37(10):2620-2624;还参见Lampl Y et al(2007).“Infrared laser therapy for ischemic stroke:a new treatment strategy:results of the NeuroThera Effectiveness and Safety Trial-1(NEST-1)”.Stroke.38(6):1843-1849)。
2、创伤性脑损伤的治疗
已发表的研究提供了体内证据,低水平光照射对细胞色素氧化酶和一氧化氮释放的影响在光照射治疗的神经保护作用方面不仅对缺血而且对创伤性脑损伤起主要作用(参见Naeser MA et al(2010).“Improved cognitive function after transcranial,light-emitting diode treatments in chronic,traumatic brain injury:two case reports”.Photomed Laser Sur.29(5):351-358)。
3、神经变性疾病的治疗
已经发现对脑的光照射支持体内神经生成。由此,光能照射可以在治疗上治疗一系列不同的神经变性疾病和障碍,诸如黑质(位于下丘脑后面的中脑区域的一部分)特有的帕金森病;并且其可以利用NIR光波长到达。在使用像小鼠的小动物的研究中,证明在670nm波长下的低水平光照射有助于防止黑质中多巴胺能细胞的损失(参见Shaw VE et al(2010).“Neuroprotection of midbrain dopaminergic cells in MPTP-treated mice after near-infrared light treatment”.J Comp Neurol.518(1):25-40)。然而,更长波长的光能(诸如近红外光(NIR))被认为对于远远更大的哺乳动物对象(诸如人类)更可行。
4、抑郁症和类似情感缺失的治疗
诸如抑郁症和创伤后应激障碍(PTSD)的心境障碍的表型表现已显示出与前额叶皮层区的代谢能力降低有关(参见Shumake J,Gonzalez-Lima F(2003).“Brain systems underlying susceptibility to helplessness and depression”.Behav Cogn Neurosci Rev.2(3):198-221)。前额叶皮层的电刺激已显示出具有抗抑郁效果(Hamani C et al(2010).“Antidepressant-like effects of medial prefrontal cortex deep brain stimulation in rats”.Biol Psychiatry.67(2):117-124)。由此,用红光和近红外红光对前额叶皮层区的光照射可以引起前额叶皮层区中的代谢能力的增加,并且提供针对这些医学病症的潜在神经保护。实际上,一项初步研究显示出,当用810nm波长的低水平光照射遭受严重抑郁和焦虑的人类患者的额头时,流向额叶皮层的血流增加,并且导致抑郁得分缩减63%(参见Schiffer F(2009).“Psychological benefits 2 and 4 weeks after a single treatment with near infrared light to the forehead:a pilot study of 10 patients with major depression and anxiety”.Behav Brain Funct.5:46)。
5、记忆缺失治疗
研究表明,用1072nm波长的近红外红光照射脑的前额叶皮层区改善了个体的功能记忆(参见Mikhalikova S et al(2008).“Emotional responses and memory performance of middle-age CD1mice in a 3D maze:effects of low infrared light”.Neurobiol Learn Mem.89(4):480-488)。由于这种记忆缺失病症在更多的老年人中常见,因而,使用光照射方法来治疗脑的前额叶皮层区可以帮助工作记忆缺失的与老龄化相关的问题。
6、痴呆和阿尔茨海默病的治疗
神经变性可以导致认知损伤,认知损伤在医学上通常识别为痴呆。导致改善的血流具有寻求解决和治疗血管性痴呆的治疗潜力。阿尔茨海默病尽管在医学上是一种痴呆的形式,但是显然具有多种不同的原因。这种神经变性病症的早期征兆/症状通常显露为以降低的细胞色素氧化酶活性形式的局部脑代谢缺失,这是阿尔茨海默病的潜在风险的明显征兆(参见Valla J et al(2001).“Energy hypometabolism in posterior cingulated cortex of Alzheimer’s patients:superficial laminar cytochrome oxidase associated with disease duration”.J Neurosci.21(13):4923-4930)。因为用红光和红外红光能量的脑照射可证明地激活细胞色素氧化酶,所以光照射治疗过程可以帮助控制完全阿尔茨海默病状态的症状发作。
动物研究证明,近红外(NIR)光能的传递可以改善与阿尔茨海默病(AD)相关联的认知受损脑的状况。研究已经发现低水平光疗法(LLLT)改善小鼠的皮层代谢能力和记忆保持。据认为,LLLT增加线粒体能量代谢的能力可用于恢复受与AD相关联的局部脑代谢减退影响的脑过程(参见Rojas JC,Bruchey AK and Gonzalez-Lima F(2012).Low-level Light Therapy Improves Cortical Metabolic Capacity and Memory Retention.Jnl.Alzheimer’s Disease.32(3):741-52)。
利用两种转基因小鼠模型的进一步研究间接表明了NIR光可能具有作为用于减轻甚至逆转与痴呆和AD相关联的进行性脑变性的有效微创干预的潜力。它们的结果间接表明NIR治疗诱导AD病理的显著逆转(参见Porushothuman S,Johnstone DM,Nandasena C,Mitrofinas J and Stone J(2014).Photobiomodulation with near infrared light mitigates Alzheimer’s disease-related pathology in cerebral cortex,evidence from two transgenic mouse models.Alzheimer’s Research&Therapy.6:2)。
还提出了可以指向增殖间充质干细胞(MSC)的LLLT。这可以改善AD的进展,如在小鼠模型中所证明的(参见Farfara D,Tuby H,Trudler D,Doron-Mandel E,Maltz L,Vassar RJ,Frenkel D and Oron U(2015).Low-level Laser Therapy Ameliorates Disease Progression in a Mouse Model of Alzheimer’s Disease.J Mol Neurosc.55:430-436)。
而且,已经提出鼻内光疗法可以增强SIRT1酶活性的活性(参见Liu TCY,Wu DE,Gu ZQ and Wu M(2010).Applications of Intranasal Low Intensity Laser Therapy in Sports Medicine.Jnl.Innovative Optical Health Sc.3(1):1-16),并且这种活性有助于间充质干细胞的分化(参见Joe IS,Jong SG and Cho GW(2015)Resveratrol-induced SIRT1 activation promotes neuronal differentiation of human bone marrow mesenchymal stem cells.Neurosci Lett.Jan1;584:97-102)。
以AD和痴呆脑对LLLT的反应为基础的组织活动可以通过观察几个已公布的调查来解释。在2002年,证明了弱光可以用于引导由神经细胞的前缘或生长锥所采取的方向。在主动扩展生长锥中,将激光点放置在神经的前缘的特定区域前面,增强生长到束焦点中并且导致所引导的神经元转向以及增强生长(参见Erlicher A,Betz T,Stuhtmann,Koch D,Milner V and Raizen J(2002).Guiding neuronal growth with light.PNAS 99(22):16024-16028。这种现象在2013年的另一个实验中重复(参见Black B,Mondal A,Kim Y and Mohanty SK(2013).Neuronal Beacon.Optical Society of America Optics Letter.38(13):2174-2176)。神经细胞呈现出对低能量光力具有先天的吸引力。
研究人员还发现,细胞在暴露于低水平红光时自我修复,如在图18中看出。图18示出体外后氧化应激的神经突延长实验(670nm、3mW、20秒钟/天、5天)。通过氧化应激缩短的神经元的神经突将再伸长。该数据间接表明红光照射保护细胞在氧化应激情况下的生存力。它也刺激神经突生长(参见Giuliani A,Lorenzini L,Gallamini M,Masella A,Giardino L and Calza L(2009).Low infrared laser light irradiation on cultured neural cells:effects on mitochondria and cell viability after oxidative stress.BMC Com Alt Med.9:8)。同样地,存在认为如果低水平红光能和NIR光能可以被传递至功能不是最佳的神经元则愈合反应是可能的基础。
默认模式网络(DMN):
脑的默认模式网络(DMN)吸引了人们的兴趣,这是因为它已经与阿尔茨海默病、痴呆、孤独症、精神分裂症、抑郁症、慢性疼痛、帕金森病、多发性硬化(MS)以及创伤后应激障碍(PTSD)相关。当个人参与内部聚焦任务(包括记忆提取、展望未来、想象他人的全景)时,DMN是活跃的(参见Buckner RL,Andrews-Hanna JR and Schacter DL(2008).The Brain’s Default Network:Anatomy,Function,and Relevance to Disease.Ann.N.Y.Acad.Sci.1124:1-38)。
关于脑障碍,研究人员已经发现DMN中的瞄准连结(targeted nexuses),称为“皮层中枢”。如图19所示,该皮层中枢包括:(i)背内侧前额叶皮层502;(ii)腹内侧前额叶皮层504;(iii)海马状突起和内嗅皮层506;(iv)楔前叶508;(v)侧顶叶510;以及(vi)后扣带皮层512。这些中枢在DMN中高度连接,但是它们中的一些可以位于网络之外。Buckner等人间接表明皮层中枢互连独特的功能专用系统。通过正电子发射淀粉样蛋白断层扫描,这些中枢显示出高淀粉样蛋白-β沉积在与该中枢在充当信息处理的关键方式站(critical way station)的同时也可以增加AD中的病理级联的可能性一致的位置中(Buckner RL,Sepulcre,Talukar T,Krienen FM,Liu H,Hedden T,Andrews-Hanna JR,Sperling RA and Johnson KA(2009).Cortical Hubs Revealed by Intrinsic Functional Connectivity:Mapping,Assessment of Stability,and Relation to Alzheimer’s Disease.J.Neurosci.29(6):1860-1873)。实验表明,阿尔茨海默病中的Aβ沉积优先发生在皮层中枢的位置(参见Stam CJ(2014).Modern Network science of neurological disorders.Neuroscience 15:683)。
另一个重要的脑网络可以是突显网络(Salience Network(SN))。神经变性疾病(诸如阿尔茨海默病和帕金森病)的目标是DMN,而行为变异障碍(诸如额颞叶痴呆(FTD))的目标是更靠前定位的SN。虽然DMN利用整个脑被识别,但是SN着重脑的前部,其由前岛和前扣带皮层锚定。虽然看起来DMN和SN可能彼此不同,但是它们在许多活动中彼此连接。SN在驱动DMN和中央执行网络之间的交换中起重要作用。这些网络被认为在处理我们的一些“自动”心理过程的领域之外大量参与处理新情况。
与皮层中枢损伤相关联的神经障碍:
已经提出皮层中枢中的损伤与至少下列脑障碍相关联:精神分裂症、阿尔茨海默病、额颞叶痴呆、帕金森病、颞叶癫痫、抽动秽语综合征(Gilles de la Tourette syndrome)、急性脑损伤(昏迷),以及偏头痛。局部缺血和氧化应激利用这些损伤被标识。
光生物调节(PBM)可以潜在地刺激皮层中枢中的这些损伤以愈合。如上提到,已经表明弱光吸引神经细胞的生长锥的前缘。当光束位于神经的前缘的特定区域前面时,引起其生长朝向光的方向,并且增强其整体生长。神经细胞看来似乎以低能量光为“食(feed)”。如图18所示,研究人员还发现,细胞在暴露于低能量红光时自我修复。通过氧化应激缩短的神经元的神经突将再伸长。该数据间接表明,在氧化应激的情况下,红光照射保护细胞的生存力并且刺激神经突生长。在阿尔茨海默病相关损伤的特定情况下,具有阿尔茨海默病的转基因小鼠随着经颅PBM而恢复记忆功能和认知功能。对这些小鼠的脑进行尸体解剖显示出与生物标志物(Aβ斑块和神经原纤维缠结)相关联的损伤减少。
技术实现要素:
本发明涉及通过利用光照射脑的多个部位(–即,神经刺激)来刺激治疗结果的新系统、装置以及方法。这通过以下自动实现:(i)将包括一个或更多个光生成单元的耳机施加至患者的头(经颅神经刺激);和/或(ii)经由鼻腔插入小透明塑料封装光生成单元(鼻内神经刺激)。该经颅和鼻内光生成单元两者都通过控制组装件单元控制,并且通过可补充干电池供电。没有侵入身体组织。
该照射光可以是非瞄准的(即,广泛地被引导以刺激一般脑区域)或有目的地瞄准脑的特定区域,以便实现特定治疗结果。通过选择恰当波长的光、其方向、有效能量输出、曝光时间、以及相干性(如涉及激光源)来影响光刺激的覆盖区域和深度。考虑到用户的完全移动性和便携性,该神经刺激系统和装置较小并且是免提的;并且提供了一种出于治疗目的而刺激脑的新且容易的方法。可以用小控制单元或者用具有适当下载的应用软件的智能电话来控制这些参数。
在一个方面,本发明提供了一种用于在需要时对活哺乳动物的脑执行非侵入式神经刺激治疗的可自我管理系统,所述可自我管理非侵入式神经刺激系统包括:
第一配置照射单元、第二配置照射单元、第三配置照射单元以及第四配置照射单元,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元中的每个都包括便携式空心壳体(casing),该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于施加至颅骨的外表面构造,每个配置照射单元的所述便携式空心壳体包括:
(i)光能透射材料,该光能透射材料形成用于每个配置照射单元的所述空心壳体的配置外表面的至少一部分;以及
(ii)至少一个光生成单元,该至少一个光生成单元被容纳并包含在每个配置照射单元的所述空心壳体的所述内部空间体积内,并且该至少一个光生成单元能够在需要时以预定能量强度并且在预置持续时间内生成足以穿过该颅骨并进入脑的光能,该光能具有选自由近红外红光波长和可见红光波长构成的组中的至少一个预选波长,
由此,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元可以在施加至颅骨之后发射光能,并且实现在体内将所述发射光能通过颅骨传送到脑的至少一部分中;
框架,该框架适于支承所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元,并且适于在颅骨上以固定位置和期望照射方向按意愿布置所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元的所述光透射外表面;
便携式控制器组装件,该便携式控制器组装件能够控制光能在体内从所述配置照射单元到脑的至少一部分中的按需传递,所述控制器组装件包括:
(a)按需直流电的便携式且可补充电源,
(b)用于控制和引导这种直流电的流动的中央处理单元,
(c)与该电源电连通以用于将直流电按需传输至该中央处理单元的至少一个连接器,以及
(d)与该配置照射单元电连通以用于将直流电从所述中央处理单元按需传输至所述光生成单元的至少一个连接器;
其中:
(A)所述第一配置照射单元被定位成将光能引导至脑的第一区域,该第一区域包括左腹内侧前额叶皮层区和右腹内侧前额叶皮层区,并且可选地包括扣带前回区;
(B)所述第二配置照射单元被定位成将光能引导至脑的第二区域,该第二区域包括左楔前叶皮层区和右楔前叶皮层区,并且可选地包括扣带后回区;
(C)所述第三配置照射单元被定位成将光能引导至脑的第三区域,该第三区域包括侧下顶叶皮层中的左角回区,并且可选地包括左扣带后回;以及
(D)所述第四配置照射单元被定位成将光能引导至脑的第四区域,该第四区域包括侧下顶叶皮层中的右角回区,并且可选地包括右扣带后回。
在另一方面,本发明提供了一种用于在需要时对活哺乳动物的脑执行非侵入式神经刺激治疗的可自我管理专用装置,所述可自我管理专用装置包括:
第一配置照射单元、第二配置照射单元、第三配置照射单元以及第四配置照射单元,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元中的每个都包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于施加至颅骨的外表面构造,每个配置照射单元的所述便携式空心壳体包括:
(i)光能透射材料,该光能透射材料形成用于每个配置照射单元的所述空心壳体的配置外表面的至少一部分;以及
(ii)至少一个光生成单元,该至少一个光生成单元被容纳并包含在每个配置照射单元的所述空心壳体的所述内部空间体积内,并且该至少一个光生成单元能够在需要时以预定能量强度并且在预置持续时间内生成足以穿过该颅骨并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长构成的组中选择的至少一个预选波长,
由此,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元可以在施加至颅骨之后发射光能,并且实现将所述发射光能在体内传递通过颅骨到脑的至少一部分中;
框架,该框架适于支承所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元,并且适于在颅骨上以固定位置和期望照射方向按意愿布置所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元的所述光透射外表面;
便携式控制器组装件,该便携式控制器组装件能够控制光能在体内从所述配置照射单元到脑的至少一部分中的按需传递,所述控制器组装件包括:
(a)按需直流电的便携式且可补充电源,
(b)用于控制和引导这种直流电的流动的中央处理单元,
(c)与该电源电连通以用于将直流电按需传输至该中央处理单元的至少一个连接器,以及
(d)与配置照射单元电连通以用于将直流电从所述中央处理单元按需传输至所述光生成单元的至少一个连接器;
其中:
(A)所述第一配置照射单元被定位成将光能引导至脑的第一区域,该第一区域包括左腹内侧前额叶皮层区和右腹内侧前额叶皮层区,并且可选地包括扣带前回区;
(B)所述第二配置照射单元被定位成将光能引导至脑的第二区域,该第二区域包括左楔前叶皮层区和右楔前叶皮层区,并且可选地包括扣带后回区;
(C)所述第三配置照射单元被定位成将光能引导至脑的第三区域,该第三区域包括侧下顶叶皮层中的左角回区,并且可选地包括左扣带后回;以及
(D)所述第四配置照射单元被定位成将光能引导至脑的第四区域,该第四区域包括侧下顶叶皮层中的右角回区,并且可选地包括右扣带后回。
在另一方面,本发明提供了一种用于在需要时经由鼻腔并且通过活哺乳动物的颅骨对脑执行非侵入式神经刺激治疗的可自我管理方法,所述可自我管理非侵入式神经刺激方法包括以下步骤:
获取光能发射装置,该光能发射装置包括:
第一配置照射单元、第二配置照射单元、第三配置照射单元以及第四配置照射单元,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元中的每个都包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于施加至颅骨的外表面构造,每个配置照射单元的所述便携式空心壳体包括:
(i)光能透射材料,该光能透射材料形成用于每个配置照射单元的所述空心壳体的配置外表面的至少一部分;以及
(ii)至少一个光生成单元,该至少一个光生成单元容纳并包含在每个配置照射单元的所述空心壳体的所述内部空间体积内,并且能够在需要时以预定能量强度并且在预置持续时间内生成足以穿过该颅骨并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长构成的组中选择的至少一个预选波长,
由此,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元可以在施加至颅骨之后发射光能,并且实现在体内将所述发射光能传递通过颅骨到脑的至少一部分中;
框架,该框架适于支承所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元,并且适于在颅骨上以固定位置和期望照射方向按意愿布置所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元的所述光透射外表面;
便携式控制器组装件,该便携式控制器组装件能够控制光能在体内从所述配置照射单元到脑的至少一部分中的按需传递,所述控制器组装件包括:
(a)按需直流电的便携式且可补充电源,
(b)用于控制和引导这种直流电的流动的中央处理单元,
(c)与该电源电连通以用于将直流电按需传输至该中央处理单元的至少一个连接器,以及
(d)与该配置照射单元电连通以用于将直流电从所述中央处理单元按需传输至所述光生成单元的至少一个连接器;
将所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元的透明外表面放置在与对象的颅骨相邻的期望固定位置处,以使通过所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元发射的光能在体内穿过对象的颅骨并且进入脑的至少一部分中;以及
使定位后的所述配置照射单元的所述光生成单元在需要时以预定能量强度并且在预置持续时间内生成足以穿过该对象的颅骨并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长,以使得实现对脑的至少一部分的神经刺激;
其中:
(A)所述第一配置照射单元被定位成将光能引导至脑的第一区域,该第一区域包括左腹内侧前额叶皮层区和右腹内侧前额叶皮层区,并且可选地包括扣带前回区;
(B)所述第二配置照射单元被定位成将光能引导至脑的第二区域,该第二区域包括左楔前叶皮层区和右楔前叶皮层区,并且可选地包括扣带后回区;
(C)所述第三配置照射单元被定位成将光能引导至脑的第三区域,该第三区域包括侧下顶叶皮层中的左角回区,并且可选地包括左扣带后回;以及
(D)所述第四配置照射单元被定位成将光能引导至脑的第四区域,该第四区域包括侧下顶叶皮层中的右角回区,并且可选地包括右扣带后回。
优选的是,所述系统和/或装置还包括:
配置照射透镜,该配置照射透镜包括:
便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及外表面构造,该便携式空心壳体适于体内插入鼻孔的鼻腔空间中,而不对对象的呼吸能力造成实质性损伤并且不侵入活对象的鼻组织,所述配置照射透镜的所述便携式套管包括:
(i)光能透射材料,该光能透射材料形成用于所述配置照射透镜的所述空心壳体的配置外表面的至少一部分,
(ii)至少一个光生成单元,该至少一个光生成单元被容纳并包含在所述配置照射透镜的所述空心壳体的所述内部空间体积内,并且能够在需要时以预定能量强度并且在预置持续时间内生成足以穿过该鼻组织并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长,
由此,所述配置照射单元可以在体内插入之后在该鼻腔内沿任何期望方向发射光能,并且实现在体内将所述发射光能从该鼻腔传递到脑的至少一部分中;
可自我管理施用器装置,该可自我管理施用器装置适于支承所述配置照射透镜,并且适于在与对象的鼻腔的内部衬里相邻的鼻孔内以固定位置和期望照射方向按意愿布置所述配置照射透镜的所述光透射外表面;
其中,所述便携式控制器组装件还能够控制光能从所述配置照射透镜的按需传递。
由此,本发明提供了一种新装置,其从经颅(通过颅骨)和鼻内(经由鼻通道)位置的组合将治疗光能量全面地引导到脑中。
附图说明
在结合附图时可以更容易理解且更容易想到本发明,其中:
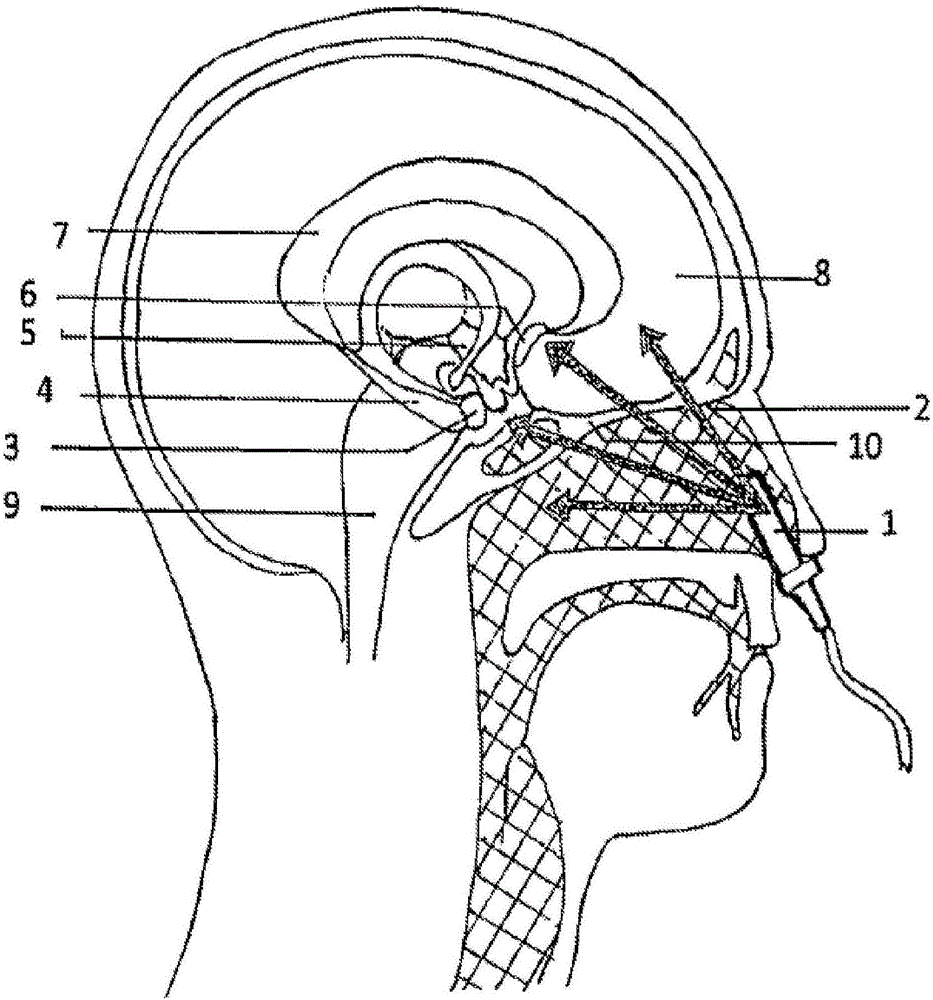
图1总体上例示了有关来自该系统的光一般怎样照射脑的概念,其间具有很少的组织屏障;
图2例示了来自发光二极管(LED)的可见红光怎样显著地以大覆盖区穿透脑的概念;
图3例示了当与如图2所示的LED相比时,通过来自低水平激光二极管的可见红光穿透脑但具有更小覆盖区的相对穿透深度的概念;
图4例示了与如图2所示的可见红光LED和如图3所示的可见红光低水平激光相比时,通过来自LED二极管的近红外红(NIR)光穿透脑的相对穿透深度和分布(spread)的概念;
图5是示出包括本发明的装置的优选实施方式的照片;
图6示出了包括本发明的装置的优选实施方式;
图7a和图7b分别例示了设置形式版本的施用器和基于悬臂版本的施用器;
图8a和图8b分别是该施用器组装件的侧视图和俯视图的工程图;
图9a和图9b分别是该施用器的L状透明透镜单元的侧视图和俯视图的工程图;
图10例示了定位通过鼻夹固定的该装置的施用器并且示出了发射光线的方向;
图11例示了该装置的鼻夹怎样最小化光泄露并且将它们重定向回到鼻腔中并朝向脑,以及怎样操纵悬臂以使照射透镜能够滑入鼻孔中;
图12还例示了在影响光的方向时定位该装置的二极管、微透镜、照射透镜以及鼻夹的作用;
图13例示了该施用器的发光二极管实施方式;
图14例示了用于该控制器组装件的外部形状因子;
图15例示了该控制器组装件的关键内部组件;
图16例示了作为该控制器组装件的另选的智能电话的概念;
图17例示了低水平光疗法的细胞内作用机制;
图18例示了体外后氧化应激的神经突延长实验;
图19例示了脑的默认模式网络中的皮层中枢;
图20例示了本发明的装置的一优选实施方式的立体图;
图21例示了本发明的装置的一优选实施方式的正视图;
图22例示了本发明的装置的一优选实施方式的后视图;
图23例示了本发明的装置的一优选实施方式的左视图;
图24例示了本发明的装置的一优选实施方式的右视图;
图25例示了将光能量引导至脑的默认模式网络中的皮层中枢的本发明的装置的一优选实施方式;
图26是例示具有500nm与1150nm之间的波长的光透射到中枢神经系统的组织中的示图;
图27是例示水、黑色素以及血红蛋白针对各种波长的光的吸收百分比;
图28是例示由于通过组织生色团缩减吸收红光和近红外光波长(大约600nm至1200nm)而造成的组织中的光学窗口的示图;
图29例示了本发明的装置的一优选实施方式的立体图;
图30例示了利用本发明的系统和装置对患有焦虑的患者执行预处理的定量脑电图测试的结果;以及
图31例示了利用本发明的系统和装置对患有焦虑的患者执行后处理的定量脑电图测试的结果。
具体实施方式
本发明是一种便携式非侵入式系统、装置以及方法,其用于经由经由活哺乳动物对象的:(i)颅骨;和/或(ii)鼻孔,对脑组织执行照射光疗法,以用于在体内刺激脑的医疗目的。常规上,现今,存在刺激脑的多种已知方法,但这些技术很大程度上涉及对实验室动物的研究实验或者是需要临床/医学监督的过程。
在与这些常规已知治疗过程的显著区别方面,本发明利用经颅和/或鼻内通路作为解剖进入点,并且遵循针对该概念性方法建立的原理,即,利用具有特定固定参数的光能照射脑组织将在体内实现治疗效果。按这种方式,本发明利用指定强度、波长、相干性、持续时间以及脉冲模式的光能来实现治疗结果。
本发明的系统、装置以及方法优选地经由颅骨将治疗光照射传递至脑的DMN的特定皮层中枢。为此,该光能发射装置包括至少一个配置照射单元,该配置照射单元包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于施加至颅骨的外表面构造。该系统和装置被设计成使得利用耳机将光能传递穿过颅骨,该耳机容易施加至对象的头并且舒适佩戴达延长时段。该耳机优选地包括用于支承每个配置照射单元的框架。每个配置照射单元都优选地定位在该框架内,使得当将对象佩戴了该耳机时,光能被引导至脑的特定皮层中枢。
本发明的系统、装置以及方法还优选地经由与鼻腔相邻定位的组织将治疗光照射传递至脑。为此,该光能发射装置包括配置照射透镜,该配置照射透镜包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于体内插入鼻孔的鼻腔空间中的外表面构造。该鼻插入装置组件被设计成为小且舒适的,并且避免对用户的呼吸能力造成显著或有意损害。在插入之后,该装置可以被调节或预置成:引导释放从该装置发射的光的照射角,设置期望功率水平,生成针对发射光的脉冲频率,以及选择针对疗程的持续时间,以便实现期望治疗效果。
本发明优选地提供许多结果,包括但不限于:
●该治疗系统、装置以及方法利用事实上被公开的科学研究所支持和证实的原理并且应用其操作参数。
●没有与该治疗方法和系统相关联的已知主要副作用或并发症。
●该装置在每个实施方式和使用实例中在医学上是非侵入的和可自我管理的。
●该装置专用于并且被设计用于按意愿自我附接至和自我脱离对象的颅骨和鼻子。
●该装置重量极其轻、便携,并且容易用手传输通过任何距离。
●该装置舒适且容易使用,并且具体来说,与目前经颅治疗中使用的全头盔相比更舒适。
●该装置由患者自己在需要时定期和重复地自我施用以用于治疗性治疗,并且不需要医疗技术人员或医生的任何辅助。
●该装置可以另选地采用激光器或者发光二极管作为光生成单元。
●该装置可以生成按从近红外和红光范围中选择的任何期望的医学有效波长的光能波和粒子。
●该装置不对其它医疗设备造成显著电磁或其它干扰,并由此适于供具有植入起搏器或除颤器的人使用。
●功率和电池需求特定于可以是激光器或非激光发光二极管的光源。
●优选实施方式可以传递脉冲光,其中,对于某些医学病症来说,脉冲光已经被测试出支持更多治疗益处。
●该装置的优选实施方式易于由任何人使用,因为仅使用他或她的手将耳机放置在他或她的颅骨上和/或将施用器夹到鼻孔上并按压“通电”按钮。
●该装置的优选实施方式包括定时器和自动关闭开关两者,其在20至25分钟或其它时间长度之后自接合。
●优选治疗持续时间是医学相关的;并且实际治疗时间可以根据光源和瞄准流体(或剂量)的选择而改变。
●该装置的优选实施方式高度耐受意外毁坏,并且能够经受住5英尺的掉落而不引起任何损坏。
●该装置的优选实施方式采用过程控制器组装件,其确保传递至颅骨或鼻腔的光能一致。如果电池不能够维持一致的功率来驱动该电路以给光源供电,则该过程控制器组装件将发出警告并将关闭该装置。
●另选实施方式包括使用“智能电话”,其下载代替该过程控制器组装件来执行的软件应用。
脑的目标区域:
脑的特定解剖部位控制头脑和身体的特定功能。例如,间脑(大致围绕中脑)区域是一些最重要的生存功能的所在地,并且保持针对人的身体健康的某些关键。对于通过光源接近来说,这是一个难于到达的区域。
这里,在解剖脑组件(component)中,下丘脑是针对许多自主功能的控制中心。下丘脑与内分泌和副交感神经系统的结构连接,以支持其在遍布身体维持体内平衡中的至关重要的作用。下丘脑是边缘(limbic)系统的一部分,影响各种情感和快乐反应、存储记忆、调节激素、感觉知觉、运动功能,以及嗅觉。边缘系统的其它组件是扁桃体、扣带回、海马状突起、嗅皮质以及丘脑。
虽然中脑区域可以是主要目标,但发散光线也将照射脑的一些其它部位,以获得更广泛的益处。治疗如何在下一阶段遍布脑被分布到次要区域中的假设还基于神经系统在其网络中快速运送信号的能力。
光能可以被操纵到朝向脑的瞄准部位的点,以在特定主要区域中具有更多效力。例如,位于中脑区域的底部的黑质(其功能障碍可归因于帕金森病;或者在另一种情况下,处于分离位置的前额叶皮层可以被瞄准,以改善高阶认知功能和平衡原始情绪。
系统/装置/方法规格和剂量测定:
与本发明兼容的有效且安全的光照射方法和系统提供对某些操作参数的选择和控制。这些操作参数包括以下选择:光波长、相干性或不相干性、能量(如按焦耳(J)测量的)、功率(如按瓦特(W)或毫瓦特(mW)测量的)、辐照度(W/cm2)、辐射曝露量(J/cm2)、暴露时间(秒)、波类型(连续或脉冲)、分次方案(患者疗程数量)、光束尺寸(着陆射束面积),以及光束穿透(传递)距离。
1、治疗波长的选择:
被示出为在诱发活体神经细胞中的体内有益效果方面最有效的波长已经处于光谱的红光和近红外红光范围(NIR)的光学窗口中(即,620nm与1400nm波长之间)。针对脑照射的成功治疗在动物和人两者中通常按633-670nm(可见红光)波长或808-1072nm(近红外)波长执行。因此,可以将范围在大约620nm与1400nm之间变动的任何光波长视为对于利用本发明的治疗用途来说是可接受的。
然而,一般来说,光波长越长,用于成功治疗所需的能量就越低,而且完全确定光波长越长,光传送到活组织并贯穿活组织的穿透距离就越深。在本发明中,针对某些病症,大约600nm-780nm之间的更短可见红光波长能够执行,并且大约780nm-1400nm之间的近红外(NIR)波长能够执行。研究人员认识到,正是这种波长范围吸引最大的细胞反应,这与需要使这种波长仅用于组织穿透相反。当对大鼠进行测试时,630nm与800nm之间的光子已经示出即使在具有相对较低透明度的组织层(诸如皮肤、结缔组织、肌肉、骨,以及脊髓)中也可以穿透高达28mm(即使在最初的1mm之后已经消散了很多),并且在前侧表面处可检测大约6%的总能量密度。更深的组织穿透显然提供更好的头部起始点,因此应考虑更长的NIR。
非常重要的事实是,正是这些宽范围的光波长可以诱发最大的线粒体反应,这与需要使一个特定波长用于体内的有效组织穿透距离相反。而且,630nm与800nm之间的光子波长将穿透活组织并且贯穿具有相对较低透明度的层(诸如皮肤、结缔组织、肌肉、骨、以及脊髓)行进直至28mm距离,并且可检测总能量密度的大约6%。因此,万一穿透深度是所治疗的医学病症或病理状态的关键因素,就基于波长越长穿透进入组织越深的事实,优选使用大约620nm-1400nm之间的NIR光波长。
还应注意到,光能穿过活组织不仅取决于选定波长,而且取决于被瞄准组织的光学特性。具体来说,光能在脑的灰色和白色物质内的最大穿透距离在NIR光区域的大约620nm-1400nm之间的波长处出现。而且,因为这个原因,大约620nm-1400nm之间的NIR光波长被高度优选使用。
还通常优选的是,选择并使用单一单色光波长用于单一治疗应用。因此,典型地,选定的单一单色波长应为大约670nm(可见红光)或大约810nm(近红外红光)。而且,同时二色照射改变酶的还原和氧化形式的比率。由此,推荐用户选择纯单色波长光源用于大多数治疗应用。作为选择特定治疗波长的光的指南,建议将633nm至670nm区域中的光波长用于一般脑照射,而使用大约808nm至1072nm的光波长来穿透并到达脑的更深解剖区域。
以前的研究间接表明,如果利用红光或低强度光照射阿尔茨海默病脑细胞,则他或她可以改善阿尔茨海默病患者的病症。科学事实支持基于NIR的一组改进参数以获得更好的结果。一项研究还显示,使用808nm激光二极管的经颅光疗法减弱了转基因小鼠模型中的淀粉样斑块发展,这意味着该治疗方法在这个波长附近针对人类的所有重要AD的可能功效。
2、相干与非相干辐射的选择(激光器与激光二极管)
激光器提供单向的相干电磁辐射,因此考虑到与高能量输入耦合的更集中能量。而且,现代激光源通常按低强度半导体格式构造,具有考虑到高度安全性的内置发散(通常大约57度发散)。这种激光源具有独特的优点,其包括:(i)更高程度的组织穿透;(ii)高效光耦合;以及(iii)高单色性。当需要活组织的更深穿透距离时,假设相同参数的波长、能量剂量以及强度,激光器的相干光通常比由发光二极管(LED)生成的非相干光更合意。
然而,对于大多数治疗应用来说,光相干性本身不要求用于临床功效,而且在需要更大距离的组织穿透的那些医疗情况下,认为以来自发光二极管(LED)的更长波长使用非相干光能更好地满足。近年来,发光二极管(LED)已经成为作为光源的激光器的可行治疗替代物。假定细胞的光受体(特别是细胞色素氧化酶)在所接收的光子的相干性或非相干性之间不进行辨别。因此,假设相同波长的光、能量剂量以及强度,利用发光二极管(LED)在细胞的光受体接收的输入将产生与由激光光源的相干光提供的治疗结果非常相似或相同的治疗结果。尽管利用LED非相干光的穿透通常较浅,但LED生成的非相干光具有提供更宽区域的照射束覆盖区域的优点。
本发明的系统、装置以及方法识别存在于来自激光源的光与来自发光二极管源的光之间的相干与非相干差异,并且通过基于针对特定应用目的的最佳条件在它们之间谨慎选择而提供两种可能性(即,要治疗性治疗的特定疾病状态或病症将决定哪种是更好的形式)。
因此,仅作为第一说明性示例,当在照射脑区域中的仅一个指定区域时存在优点时(诸如照射更深定位的松果体以便恢复正常昼夜节律和纠正睡眠障碍),激光源的相干光因其更大的组织穿透距离而通常被优选。然而,作为有意义的另选,使用按更长波长(优选为NIR范围内)的非相干LED光结合更长处理时间将充分地补偿可以由激光源的相干光所提供的最大组织穿透距离的损失。
作为第二说明性示例,来自NIR810nm激光源的相干光因其更深的组织穿透能力将是最有利的,该810nm激光本身对于人眼来说不可见。由此,本发明的用户没有这样的可见光来触发作为针对意外眼睛暴露的自主防御机制的眨眼,而且如果该用户不小心,则他/她冒着不注意对眼睛造成严重视网膜损伤的重大风险。因此,本发明提供了一种指导方法,其推荐何时采用810nm光波长,并且旨在用于在家里的无人监督个人治疗用途,这种810nm的光应当优选为在LED光源版本中对购买公众可用。类似地,810nm光波长的激光源优选地被保留并且仅限于在研究领域内或者在监督医疗治疗环境中的治疗用途。另选的是,建议使用激光源生成大约655nm波长的可见红光,以便受益于具有可见红光的安全方面,并且伴随提供激光的更大组织穿透优点。
非相干LED生成光的另一重要方面是,与激光器生成光相比,使用这种非相干光产生完全可忽略量的热。非相干LED生成光的这个宝贵特征允许利用相对低功率密度的波长暴露活脑组织达更长时段。这依次允许更有效地调节神经代谢。由此,如果治疗时间为了医疗功效而被延长(如通过创伤性脑损伤的治疗所例证的),则相对低功率密度的非相干LED生成光波长比使用激光生成光更优选,以便避免对脑组织造成不期望的热损伤的风险。
因此,出于一般治疗使用目的,本发明优选地使用LED光源和非相干光波长(尤其是因其更大的组织穿透质量而导致在NIR波长范围中),用于治疗处理并且用于预防医学应用。该偏好通常包括并涵盖与人的认知功能、神经变性、血管性痴呆、偏头痛、疼痛、以及人类记忆缺失有关的那些医学/临床/病理病症。
比较起来,假设相同波长,来自激光源的低功率水平相干光可优选用于治疗急性和慢性神经障碍和病症,并且期望用于治疗在解剖学上更深地位于脑内部的特定瞄准区域/范围。由此,当与相同波长的LED相比时,利用来自激光器的低水平相干光治疗优选地治疗帕金森病(涉及黑质)的可见红光照射治疗、与昼夜节律(松果体)相关的睡眠障碍、以及加速康复(下丘脑)。而且,出于安全原因,优选使用具有最小安全限制的处于620nm至780nm之间的可见红光波长。
3、治疗能量和其它参数
光能传统上被测量为焦耳(J)=功率(W)×时间(秒)。出于脑刺激的目的,需要极小光能来刺激线粒体活性,但是同样仍要建立用于医疗功效的确定最小阈值量。作为代替,针对现今使用中的医疗功效的适当参考点是时间测试静脉内光照射技术,其涉及光直接注入静脉(主要在俄罗斯、德国以及世界上许多其它国家使用了几十年),并且其通常遵循波长为632.8nm、功率为1.5mw的激光器参数、以及每疗程30分钟的时间。以此为基础,患者通常在头三个日历日一天治疗一次,然后每两个日历日治疗一次,直到达到总共十个患者疗程为止。对于每一个患者疗程来说,传递光能2.7焦耳(1.5/1000W×30分钟×60秒)。
当在本发明中应用激光生成光(与632.8nm波长相同或相似)的脑照射时,相邻组织深度问题需要加以考虑。这些问题通过将功率(以瓦特(W)或毫瓦(mW)为单位测量的)增加几个数量级来克服,诸如5毫瓦达25分钟,由此生成7.5焦耳(5/1000W×25分钟×60秒)的能量输出。而且,向脉冲光源添加更大功率传递更多能量,这依次可以原位激活更多ATP;然而,这种针对系统的增加功率损害了鼻内实施方式中的方法的可用性。针对本发明的激光器实施方式的基准功率参数是将功率因数限制到5mw,以便将功率保持在3R级的低风险级别[美国食品和药物管理局(FDA)设定的标准]。由此,用于激光器实施方式的优选一组操作参数将为每个患者疗程提供5mw的功率因数和限制到25分钟的治疗持续时间。
比较起来,注意到LED光源大部分是发散的。因此,当利用本发明的LED实施方式时,能量输出要增加大约60%达大约12焦耳。能量输出的这种变化还要求更高的功率因数,现在设置为8mw(12焦耳/(25×60秒)×1000)。
因此,总之,对于激光源来说,一个优选目标(aimed for)能量大约为7.5焦耳(5/1000W×25×60秒),而对于LED光源来说,一个优选目标能量大约为12焦耳(8/1000W×25×60秒)。
4、连续波(CW)与脉冲频率
已发表的科学文献事实上确定了当利用808nm激光时,对于100Hz和1000Hz的连续波(CW)束来说,100Hz和1000Hz的脉冲激光束产生优异结果,并且与100Hz以下的连续波束相比,以10Hz脉动的810nm激光束产生从创伤性脑损伤的更大临床恢复。为什么以10Hz脉动比100Hz(或任何其它频率)更好地工作仍然并且是一个思考的问题。应注意到,10Hz是α脑电波的频率,并且由此10Hz的脉动与静止的整个脑谐振。而且,脑的海马状突起区域也在4-10Hz范围的波中起作用。该海马状突起负责记忆、情绪保持良好状态、行为管理、空间记忆以及导航。它也是在年老阿尔茨海默病中遭受严重损伤的区域之一。
一般来说,在某些条件下,超短脉冲可以比连续波(CW)照射更深地穿透到组织中,这是因为可以使用更多功率。脉动(pulsing)还防止了在热累积情况下的不期望热效应。将更大功率推动到脉冲光源传递更多能量,这可以激活更多细胞能量(ATP),如在针对兔子的研究中所证明的。在脉冲模式下,有效剂量由于更深地行进到组织中而导致比常规计算更高。另一种作用机制涉及包含光子的脉冲的第一部分,以将上组织层中的所有发色团分子带到激发态,在下一脉冲期间为更多光子进入组织提供机会。对兔子使用808nm激光,研究人员证明,100Hz和1000Hz的脉冲激光产生了对连续波的更好结果。研究人员用810nm激光测试还发现,与100Hz相比,10Hz的脉动产生来自创伤性脑损伤的更大恢复。它们间接表明光疗法的抗抑郁活性是影响因素。
如果在本发明中使用可见波长的光,则可能因感光性癫痫事件的可能风险而导致优选避免对人类使用脉冲模式。为此原因,在本发明中优选使用脉冲不可见近红外光,诸如具有大约810nm波长的光。而且,光通过头皮和鼻腔的方向降低了感光性癫痫的风险。
总之,对于利用本发明的脑治疗来说,而且特别是对于中脑区域的治疗来说,对于有效临床结果来说,优选10Hz脉冲模型,尤其是当与NIR 810mw光源组合时,其给出良好穿透深度。
本发明的瞄准经颅光疗法:
本发明提供了瞄准治疗在特定位置的DMN的皮层中枢,如可以在图25中看出。因为皮层中枢彼此高度连接(有时标注为“连接体(connectome)”),所以刺激这些主要中枢中的几个可以以整体方式刺激整个网络。这允许设计指向几个选择位置的轻量/便携式经颅NIR光疗装置,以代替在经颅光疗研究中常用的不太舒适的封闭头盔。
首要设计目标是具有一种便携式且易于使用的装置,更类似于立体声耳机而不是重型头盔或与经颅光疗设备共同的一组多个灯。具体来说,如图20至图24和图29所示,本发明提供一种支承一个或更多个簇头(cluster head)的轻型框架,其中,每一个簇头都容纳一个或更多个光生成单元。
本发明优选地以海马状突起和前脑前侧的其它位置为目标,因为这些解剖区域与AD相关联。利用该包括(inclusion),与AD有关的中枢网络现在更加全面。针对本发明的优选的一组目标包括但不限于脑的楔前叶、扣带后回皮质、内侧前额叶皮层、中额叶、海马状突起、顶叶以及颞叶。这些选定目标因中枢彼此高度连接而导致对脑的综合整体治疗效果。
本发明的鼻内光疗法:
插入到鼻腔中的光源在解剖学上位于中脑区域(大约3英寸,主要是空气腔和软组织)附近。如图1所示,当使该鼻内位置处的光源1指向中脑区域时,因为到脑组织的物理路径距离的大部分是鼻孔的空气腔2,所以要求很少的能量用于有效光照射。出于例示的目的,被加亮的中脑区域在解剖学上是:扁桃体3、海马状突起4、下丘脑5、隔区6、以及扣带回皮质7。新皮层区的容易被光源照明的部分是前额皮质8。除了脑干9的将脊髓连接至脑的区域以外,保护性颅骨的最薄部分是筛骨10的薄垂直板。由于其对脑的低屏障阻力的历史证明,因而筛骨10也是颅骨的在古埃及木乃伊化过程期间通常被破坏以排出脑材料的一部分。承认的是,存在呈现为通向中脑区域的通道中的鼻中隔壁的一部分的一些组织材料,但是这种组织材料具有低密度。
在鼻内定位光源与瞄准脑区域之间存在很少的组织材料是值得注意的,这是因为红光波和红外红光波穿透(如根据Beer-Lambert定律所定义的)可能在相距表面1mm距离处遭受多达80%的光学功率衰减[例如,参见Abdo A,Sahin M(2007).“NIR light penetration depth in the rat peripheral nerve and brain cortex”.Conf Proc IEEE Eng Med Biol Soc 2007:1723-1725]。在解剖学上,光照射的鼻内通路主要具有存在于脑与光源之间的筛骨的更薄垂直板,并且跨该距离存在很少其它组织结果干预,因此允许更多光能量穿透到脑中,假设所有其它操作参数仍保持相同。
因此,上述解剖学优点允许这样的治疗处理系统,其采用指向适当解剖方向的具有恰当光波长源的低能量二极管,如图1所示。用于管理该光生成源和光能发射的控制单元可以被最小化以允许用于便携式和个人使用系统。这方法和系统具有超过当前可用的治疗的另选模式的独特优点。其提供了治疗有效性、低能量需求、个人便利、可自我管理能力、非常适度的成本、以及非常容易的使用模式。
该装置的组件:
本发明的非侵入式系统和装置包括下面四个组成部分:
(i)便携式空心壳体;
(ii)容纳并包含在该空心壳体的内部空间体积中的分立光生成单元;
(iii)可标识电流源;以及
(iv)处理和功率控制器组装件。
这四个组件通过与用于将直流电按需传送到控制器组装件的电流源电连通的至少一个连接器、以及与该控制器组装件和用于从该控制器组装件按需传输直流电的光生成单元电连通的至少一个连接器电链接在一起。共同地,这些组件实现本发明的目的,使该装置在将所选规格的光传递至脑的期望区域的同时赋予用户完全移动性,无论是瞄准还是未瞄准。
分别通过图6至图12例示了针对这四个组件中的每个组件的结构性细节和属性的优选详情,并且下面呈现了每个必需组成部分的更详细描述。
1、便携式空心壳体
本发明的每个实施方式都包括至少一个便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及外表面构造,该至少一个便携式空心壳体适于施加至头部和/或体内插入鼻孔的鼻腔空间中,而不对对象的呼吸能力造成实质性损伤。
优选的是,该便携式套管在其外表面的至少一部分上可以由光透射材料构造并形成,并且将包含旨在容纳和包容至少一个光生成单元的体积区域(volumetric zone)。根据定义,这种光透射材料包括和包含透明、半透明以及不透明物质。然而,在大多数情况下,认为最好使用完全透明和透明的物质。
同样重要的是注意,该便携式套管的期望目的和目标是双重的:(i)用作容纳室,其被配置为容易应用于颅骨和/或体内插入鼻孔的鼻腔空间;和(ii)充当将发射光波反射并引导至脑的模制透镜。
对于本发明中的鼻内光疗法来说,该便携式空心壳体必须具有以下尺寸:足够小以允许插入一个鼻孔中,最小化对对象的呼吸能力的损伤,而且还能够最大化朝着对象的鼻腔壁散射光粒子。为了这些原因,非常期望用于鼻内治疗的空心壳体在尺寸和构造上被制成通过人类对象可以用他的手指握持的有形保持器或固定器来支承。由此,虽然便携式套管可以被制成任何总体上细长且延长的形状(诸如管状、雪茄状或圆筒形式),但是认为既有用且适合的是,该便携式空心壳体的总体构造还提供用于支持允许将其按意愿放置到鼻腔空间中的结构性装置。而且,为了这个原因,图9所示的“L”形形式是非常期望的,并且被视为最佳构造。
2、光检测单元
每个光生成单元都能够在需要时生成具有至少一个预选波长的光能。期望光生成单元能够按这样的波长来传递治疗光,该波长包括以下:(i)在可见色谱范围内,范围在大约620nm-780nm之间变动的可见红光波长;和(ii)在不可见光谱范围内,范围在大约780nm-1400nm之间变动的近红外光波长。
另外,所生成的光能波和粒子可以另选地为:(i)相干的(如在激光器中)或不相干的;(ii)在传递时脉动或不脉动(连续波);(iii)强度恒定或不恒定;(iv)相位均匀或不均匀;(v)被极化或不被极化;以及(vi)具有规则或不规则通量。
用于生成电磁辐射的任何常规已知装置或用于传播辐射能的物品都可接受以用于在本装置中使用。在多数实施方式中,期望并且预期出于照射目的而采用低水平激光器单元或发光二极管(LED)作为光生成单元。因此,该装置作为整体仅要求一个或多个功能性光生成单元,而且该光产生单元的性质、或者构造或者形式可能是什么对于本发明来说不重要,只要其生成并且发送具有至少一个预选且治疗上有效的波长的光即可。
治疗上有用的光波长:
该优选实施方式使用处于光谱的可见红光和近红外红光(“NIR”)波长(即,在大约620nm至1400nm之间)的光。这不排除部署为从紫外线B(大约280nm)至可见红光波长区(至620nm)的其它波长的光的可能性。
为了完整性,如果并且在期望或需要时,可见光和不可见光波长的整个光谱可以通过该装置的所述一个或更多个光生成单元来提供。如果期望,可以通过该装置在需要时生成的可见光和不可见光波长的光谱通过下表1标识。
表1:可见和近可见颜色波长范围
治疗上有效的光范围和波长:
本发明的指导原则是发送和传递用于神经系统的治疗上有效的能量。为此目的,通常优选的是,至少使用由低水平激光器生成的相干可见红光、或者由LED生成的非相干可见红光,并且固定在范围在620nm-1400nm之间的波长。为了这些原因,该装置和系统的各种优选实施方式将发送和引导范围在620nm-1400nm之间变动的红色波长的相干或者非相干可见光能量,辐射功率在10mW至1000mW之间。比较起来,该照射射置和系统的一些实施方式将发射和传递490nm-570nm之间的可见光能量,辐射功率在10mW至1000mW之间(绿色范围)。在另选例中,还有其它实施方式以10mW至1000mW之间的辐射功率发送波长在400nm-490nm之间的可见光能量(蓝色范围)。
有关电磁波和穿透的一般原理是波长越长,穿透越深。基于该原理,与具有更短波长的红光或近红外光相比,期望具有更长波长的远红外光具有更优越的穿透。然而,光穿过组织可以行进的距离取决于波长和目标组织的光学特性。在中枢神经系统的组织的情况下,诸如血液和水的成分在确定穿透深度方面具有显著作用。
本发明的一个特别优选的实施方式使用波长大约810nm的光能。如图26所示,大约810nm的波长最深地穿透到中枢神经系统的组织中。而且,如图27和图28所示,具有大约810nm波长的光不被血液(血红蛋白)和水吸收至与具有其它波长的光相同的程度。
3、电流源
要求存在按需直流电的便携式和可补充源作为本发明的装置和系统的组成部分。通过本发明提供的治疗处理系统和方法旨在传递特定能量剂量(按焦耳测量的),其是功率(按瓦特)和时间(按秒)的函数,并且其被视为针对每个治疗处理有效。
在图5至图6分别所示的优选实施方式中,采用1.5伏特干电池来向二极管供电以用于鼻内光疗法。相应嵌入程序使得组件能够传递鼻内治疗能量如下:
(i)对于633nm LED实施方式来说,11-12焦耳/cm2;
(ii)对于655nm低水平激光器实施方式来说,7-8焦耳/cm2;以及
(iii)对于810nm脉冲LED来说,11-13焦耳/cm2(在脉冲模式占空比之前)。
还预期并且期望的是,存在具有这些组件的不同组合的其它另选实施方式,并且其要求不同功率配置、能量剂量以及治疗时间。
电源典型地以直流电形式来传输能量。足够量的电流可以从单一电池源或者从串联或并联连接起来的几个干电池重复传输。在一些其它期望实施方式中,电源将为可再充电直流电池单元的形式(可从普通家用交流电插座充电)或者作为经由电力适配器的交流电(AC)。
至于定位,在所有优选实施方式中,该电源是保持并且整体包含在控制器组装件28的内部界限内的分立实体。然而,在不太优选的实施方式中,该电流源可以是自包含式的、分离的并且独立式单元,其经由电缆和连接器模块连接与控制器组装件电连通。
4、过程控制器组装件
该过程控制器组装件是具有至少三个结构特征的便携式单元组件。由此,如图14和图15分别所示,每个过程控制器组装件将包括:
(i)用于接收如从电源传送至控制器组装件的这种直流电的接收电路;
(ii)用于随着时间控制并引导如通过控制器组装件接收的这种电流的流动的中央处理单元(CPU);以及
(iii)用于从控制器组装件向另一组件传递直流电的传递电路。
同样重要的,期望并且预期的是,该过程控制器组装件电链接至该装置的其它基本组件并由此典型地还具有:
(a)与该电流源电连通以用于将电流按需传递至控制器组装件的至少一个连接器;以及
(b)与光生成单元电连通以用于将电流从控制器组装件按需传输至该光生成单元的至少一个连接器。
这些连接器典型地形成为绝缘铜线电缆和插孔模块,其允许快速且容易链接和与光生成单元两者的电连通电源。
在该装置的所有实施方式中,该过程控制器组装件在缺少电流源的情况下不操作。另外,该控制器组装件除了在预定时间之后切断单元之外,还主要是提供电力以适当且有效地驱动光生成单元的电路。该控制器还确保传递到光生成单元的电力恒定。因此,期望监测电池强度,并且如果该电池不能够提供用于适当地驱动该电路的充足电力,则切断该单元。
因此,如图5–图6和图14–图15分别所示,优选过程控制器组装件28在尺寸上尺度小、重量轻并且便携。其优选地具有固定尺度,该固定尺度不大于平均衬衫口袋(即,长度大约4.5.英寸×宽度4.5英寸×深度1英寸),并且由诸如可模制热塑性塑料的弹性材料形成。该控制器组装件的优选实施方式典型地包括在电路板52中的中央处理单元(CPU),中央处理单元能够按剂量、功率、以及时间控制来自电源(其在优选实施方式53中为单一AA干电池)的电流的流动并且将其引导至所配置照射透镜39。
还应注意到,在图5和图6所示的优选实施方式中,直流电源位于内部并且包含在控制器组装件的内部空间体积内,并且呈现为电池29(干电池或可再充电单元)。在这种情况下,控制器组装件28还具有适于附接绝缘铜线电缆和模块化插孔连接器51的插座,模块化插孔连接器51的另一端连接至设置在图8所示空心壳体39内的光生成单元38。
图14–图15所示的控制器组装件28整体上能够随着时间重复地从发光二极管传递所需剂量,该计量足以实现对脑的一致神经刺激。而且对于便携性,电能的典型电池源以1.5伏特提供直流电。然而,根据使用的光源类型的电路,可接受更宽范围的直流电压。
该控制器组装件的中央处理单元(“CPU”)优选地能够以10mW至1000mW或以上来调节光能功率输出。当其被调节时,该功率通常被固定。对于该优选实施方式,这些光能功率输出导致该装置的发射光在每疗程持续时间仅10至30分钟的治疗时间之后在治疗上有效。
期望并且预期的是,使用任何常规已知且可互换的电缆和连接器来将该控制器组装件链接至照射透镜。这向用户提供了独特优点和益处,即,交换一个配置照射透镜(能够以第一波长发送光)与另一个照射透镜(能够以第二和不同波长发送光)的选项,并且由此准许使用能够利用一个单一控制器组装件来传递不同波长的可见光或不可见光能量的不同激光器和另选发光二极管。
在另一实施方式中,该控制器组装件可以具有提供更多传递的控件和用于提供更多通用性的操作选项。该特定优点和益处通过选择针对该控制器的各种预先配置设置以使光的类型与其波长匹配,改进用户界面并减少误差来提供。按意愿或在需要时交换光生成单元的这种模式和方式允许通过单个患者治疗使用不同光范围和另选光波长,而没有用于购买多个治疗系统或多于一个装置的任何需要。
移动智能电话选项:
在另一实施方式中,该控制器组装件28的功能可以用在流行移动平台之一上操作的智能电话来替换,并且其可以包括如图16所示的来自Apple、Android、Blackberry以及Windows的那些。下面,将施用器组装件23经由线缆(由与其它实施方式27相似的材料形成)连接至智能电话54,而非利用分立控制器单元。该智能电话54携带主要复制控制器组装件28中的软件功能的可下载软件应用(“App”)。在计算机芯片55中包含接口处理软件的已修改附件将在现有施用器与专有智能电话平台之间提供接口。利用该实施方式,用户不需要携带附加或分立控制器单元,而该“App”也将包含更多软件控件和图形接口。
本发明的优选系统和装置实施方式:
如图20至图25和图29所示,本发明提供了装置100的优选实施方式,其组合经颅光疗耳机102和鼻内光疗单元104。该便携式控制器组装件106可以用作电源和用于经颅耳机102和鼻内单元104两者的中央处理单元。
该耳机102包括一个或更多个配置照射单元108、110、112以及114,该配置照射单元108、110、112以及114中的每个都包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于施加至颅骨116的外表面构造。该便携式套管包括:(i)光能透射材料,该光能透射材料形成用于所述空心壳体的配置外表面的至少一部分,以及(ii)至少一个光生成单元,该至少一个光生成单元整个地容纳并包含在所述空心壳体的所述内部空间体积内,并且该至少一个光生成单元能够在需要时以预定能量强度并且在预置持续时间生成足以穿过颅骨并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长。
在该耳机102中设置有框架118,以支承该配置照射单元108、110、112以及114,并且适于在颅骨116上以固定位置和期望照射方向按意愿布置该配置照射单元108、110、112以及114的光透射外表面。优选地设置支承垫128,以帮助将耳机102固定至颅骨116,并且使该耳机102对于患者来说佩戴更舒适。
在图20至图25和图29所示的优选实施方式中,框架118支承四个配置照射单元108、110、112以及114,并且每个配置照射单元108、110、112以及114都形成皆具有三个光生成单元的簇头(cluster head)。这四个簇头被定位在耳机102中,使得它们瞄准脑中的特定皮层中枢。在图25所示的优选实施方式中,该簇头被定位成瞄准脑的下列部位:
A、在中线上,前发际线处:该被瞄准的脑区域包括左腹内侧前额叶皮层区和右腹内侧前额叶皮层区,并且可选地包括扣带前回区,扣带前回区是突显网络的一部分;
B、在中线上,在枕骨隆突和头的顶点之间的中间部位:该被瞄准的脑区域包括左楔前叶皮层区和右楔前叶皮层区,并且可选地包括扣带后回区,次于楔前叶区域;
C、在头的左侧上,左耳边缘后方和上方:该被瞄准的脑区域是侧下顶叶皮层中的左角回区,并且可选地包括左扣带后回,从左角回区起定位得非常深(在中线处);以及
D、在头的右侧上,右耳边缘后方和上方:该被瞄准的脑区域是侧下顶叶皮层中的右角回区,并且可选地包括右扣带后回,从右角回区起定位得非常深(在中线处)。
如可以在图20、图24以及图29中看出,该鼻内光疗单元104包括鼻夹102。该鼻夹120将配置照射透镜122保持在对象的一个鼻孔内部。该配置照射透镜122包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及适于施加至鼻孔内部的外表面构造。该便携式套管包括:(i)光能透射材料,该光能透射材料形成用于所述空心壳体的配置外表面的至少一部分,和(ii)至少一个光生成单元,该至少一个光生成单元整体地容纳并包含在所述空心壳体的所述内部空间体积内,并且至少一个光生成单元能够在需要时以预定能量强度并且在预置持续时间内生成足以穿过该鼻组织并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长。
第一连接器124与经颅耳机102的配置照射单元108、110、112以及114电连通。第二连接器126与鼻内光疗单元104的配置照射透镜电连通。这允许将直流电从便携式控制器组装件106按需传输至配置照射单元108、110、112以及114中的光生成单元、以及鼻内光疗单元104的配置照射透镜的光生成单元。
如在图25中看出,经颅耳机102的配置照射单元108、110、112以及114将光能引导至脑的难于利用鼻内光疗法到达的背部或上部区域中的皮层中枢。相反的是,鼻内光疗单元104的配置照射透镜122将光能引导至脑的难于利用经颅光疗法到达的前侧或下侧区域中的皮层中枢。
用于优选实施方式的操作参数:
在图20至图25和图29所示的优选实施方式中,本发明的系统和装置具有下列操作参数:
1、经颅耳机102中的配置照射单元108、110、112以及114中的每个都优选地包括发光二极管(LED)簇头。每个簇头尺寸上优选为大约4cm乘4cm。经颅耳机102中的每个簇头优选地包括三(3)个发光二极管。
2、经颅耳机102的四个LED簇头同时被用来治疗作为脑的默认模式网络的一部分(和突显网络的一部分)的下列皮层区:
A、在中线上,前发际线处:该被瞄准的脑区域包括左腹内侧前额叶皮层区和右腹内侧前额叶皮层区,并且可选地包括扣带前回区,扣带前回区是突显网络的一部分;
B、在中线上,在枕骨隆突和头部的顶点之间的中间部位:该被瞄准的脑区域包括左楔前叶皮层区和右楔前叶皮层区,并且可选地包括扣带后回区,次于楔前叶区域;
C、在头的左侧上,左耳边缘后方和上方:该被瞄准的脑区域是侧下顶叶皮层中的左角回区,并且可选地包括左扣带后回,从左角回区起定位得非常深(在中线处);以及
D、在头的右侧上,右耳边缘后方和上方:该被瞄准的脑区域是侧下顶叶皮层中的右角回区,并且可选地包括右扣带后回,从右角回区起定位得非常深(在中线处)。
3、该鼻内单元104包括优选地具有一个鼻内发光二极管(LED)的一个配置照射透镜122。该鼻内二极管瞄准前脑的左全腹侧和右全腹侧,后脑的前喙部的部分以及下颞叶的部分(包括海马状突起区域的内侧颞下回区和侧内嗅皮层)。
4、电源:优选为具有NiMH电池的可再充电电源组。
5、所有光生成单元优选地提供620nm至1400nm波长的光能量,更优选为700nm至1000nm波长的光能量,甚至更优选为810nm波长的光能量。
6、功率输出:
A、经颅耳机102LED簇头:经颅耳机102LED簇头中的3个二极管中的每个优选地具有20mW至60mW的功率输出,更优选为大约41mW的功率输出。每个经颅LED簇头具有60mW至180mW的优选组合功率输出,更优选为大约123mW。同时使用的四个经颅耳机102LED簇头的总功率优选为240mW至720mW,更优选为大约492mW。
B、鼻内单元104LED:鼻内单元104的单个二极管的功率输出优选为10mW至30mW,更优选为大约23mW。
四个经颅耳机102LED簇头加单个鼻内单元104LED的总功率输出优选为250mW至750mW,更优选为大约515mW。这些全部同时使用用于优选20至25分钟治疗。
7、功率密度:
A、每个经颅耳机102LED簇头的功率密度优选为20至60mW/cm2,更优选为大约41mW/cm2。
B、单个鼻内单元104二极管的功率密度优选为10至30mW/cm2,更优选为大约23mW/cm2。
8、每次治疗的能量密度剂量:
A、每个经颅耳机102LED簇头:优选的是20至30J/cm2,更优选为大约25J/cm2。
B、鼻内单元LED:优选的是10至20J/cm2,更优选为大约14J/cm2。对于鼻内单元来说存在较低能量密度,这是因为对光能穿透的屏障与对经颅耳机相比不太显著。
9、经颅单元102LED簇头中的所有二极管和单一鼻内单元104耳机二极管优选地以10Hz、50%占空比脉动。
10、总治疗时间:优选为大约20至25分钟。
11、使用这种优选经颅-鼻内装置100优选地应限于不超过每2或3天一次,以避免对电磁能特别敏感的对象或具有脑感染的对象可能过量。
利用上述操作参数的优选装置已经在现场测试中示出成功改善诸如脑翳影(brain fogginess)、认知受损以及慢性面部疼痛的病症。
用于鼻内光治疗单元的优选系统和装置特征:
图5–图12和图15–图18分别示出了用于鼻内光疗单元作为统一系统并且马上可以使用的医疗装置的优选实施方式。如在其中看出,图5和图6的非侵入式装置提供了可自我管理施用器装置23,一种方便的结构制品,其将配置照射透镜24保持并支承在鼻腔内的期望固定位置中,并且其在尺寸上尺度较小,至少部分透明,并且被有目的地整形成允许其插入鼻腔空间中,而不使对象的呼吸能力遭受有目的的损伤。
该可自我管理施用器装置23被形成为两个分离结构实体的合成组合和集成:透明且部分空心配置的照射透镜24(在其外壳25内具有至少一个分立发光二极管)和支承基部26(其将配置照射透镜24与连接电力电缆27连接)。
在结构上,该配置照射透镜24封装二极管外壳25,该二极管外壳25包含采用作为发光二极管(LED)或者作为激光器的形式的二极管光源。另外,该配置照射透镜24至少部分地由光透射材料形成,并且与二极管外壳25一起成角并且与该透镜集成,以按任何期望方向和分散角释放光子。
在图5–图7所示的可自我管理施用器装置的实施方式中,该装置可以包括由不同塑料形成的一个或多个支承结构,其用于将配置照射透镜24(即,透镜/二极管复合体)沿期望方向刚性地保持,然后将配置照射透镜24安全舒适地保持至鼻子的解剖体(anatomy)。该施用器装置可以采用如在图7a中看到的设置形式,或者可以利用如图7b所示的悬臂操纵。
在该更优选实施方式中,该系统规范通过包含嵌入式软件程序的电路板来控制,该电路板容纳在控制器单元28中,并且其通过一次性干电池供电。在该优选实施方式和图7b所示的施用器的设置形式中,该支承结构30是刚性的和固定的,而该夹子31是柔性的。支承结构30和夹子31两者由耐用塑料材料模制而成。
在具有如图7a所示的基于悬臂的施用器装置的实施方式中,该支承基部承载悬臂32,在利用手指压下时,悬臂32将打开并且然后允许该施用器将透镜滑入鼻孔的鼻腔空间中。夹子33将该施用器装置安全地保持至鼻子。
在图8a、图8b、图9a、以及图9b分别所示的优选形式中,该施用器装置是单个协作实体,其包括用于配置照射透镜35的支承基部34,并且被共同构造为分立托架部36和轮廓鼻夹或配件37,轮廓鼻夹或配件37被形成为容易按意愿附接至人类鼻孔的外表面和从其脱离。该配置照射透镜是在尺度上延伸至支承基部39的埋入部分的单个透明塑料模制品的一部分。鼻夹37除了物理上用作轮廓摩擦配件(通过该配件将配置照射透镜35保持在鼻孔内的适当位置)以外,还优选地由白色或不透明材料组成,其有助于用作光屏障和反射器;并且其用于将通过鼻孔的组织壁的实质杂散光重定向回鼻腔壁的内部。
另外,如图5–图6分别所示,可自我管理施用器装置23与过程控制器组装件28、控件以及电源构造电连通(经由线缆和插孔模块连接器27),其紧凑、重量轻且足够便携以用手携带,适合放在衬衫口袋内,或者被夹至衬衫。在该优选实施方式中,过程控制器组装件28包括便携式和一次性/可补充按需直流电源,并且能够根据需要将谨慎调节的电功率剂量传输到包含在用于光照射治疗的施用器组装件23内的光生成单元29。在这种情况下,该过程和功率控制器组装件28还包括并提供自动计时器和电源开关28a。该控制器在经过预选时间量之后自动切断向光生成单元传输的电流。
用于鼻内光治疗单元的配置照射透镜:
结构上,如图8和图9分别详细地示出的,用于鼻内光疗法的优选配置照射透镜39呈现为大致”L”形构造。然而,该配置照射透镜39同样优选地由两个其它分离结构实体形成并且是组合和集成两个其它分离结构实体的结果:
(i)便携式空心壳体35,其至少部分地由光透射材料形成,并且其至少部分地用作沿期望方向反射光的反射透镜;以及
(ii)至少一个分立光生成单元或二极管38,其整体容纳并包含在该空心壳体35的内部空间体积中。
该分立光生成单元38和便携式空心壳体35一起共同形成配置照射透镜39,被配置成能够根据需要的功率和脉冲(或者连续波)模式下发射和引导至少一个预定波长的光能量。
重要的是,理解和想到该“L”形构造用于鼻内光疗法的意义和效果,并且因此将特别注意力引导至由图8a–图8b和图9a–图9b分别提供的视图。如其中所示,尽管空心壳体35被形成为透镜并且包括整体“L”形结构39,但光生成单元38通常仅放置在“L”形套管39的垂直或直立体积部分中并被其包含。从而,经由图8a、图8b、图9a、以及图9b分别所示的这种布置,水平或轴向部分39通常没有任何内部容纳物,并且仅存在用于施用器中的支承基部34的托架部36的物理支承。
而且,经由这种定位布置。只有”L”形套管的垂直或直立体积部分35必须由透光或透明材料形成。与此相反,空心壳体39的水平或轴向部分可以由任何弹性材料(透明的或不透明的)形成。
作为反射附件的鼻夹及其功能:
在图10和图11分别所示的优选实施方式中,鼻夹40兼作功能性夹子,通过该夹子将施用器装置固定到鼻子解剖体;并且充当最小化光子泄露的附件;以及将这些光子反射回到鼻腔中以最大化功率效率。施用器制品模制有悬臂,悬臂通过压下底部42(用手指)以允许夹子打开43透镜组装件35并且舒适地滑到鼻子上而起作用。一旦释放手指压力,该夹子就恢复其先前默认位置,并由此将该施用器装置固定至结构鼻子解剖体。
用于鼻内光疗单元的微透镜和其它光引导构造:
图12是示出具有微透镜44的低水平激光器实施方式的例示图,该微透镜用于使通过二极管45释放的光朝着选定目标区偏转。通过并入该特征,该实施方式最小化光46的分散,并且最小化用于实现功效的功率需求。而且,大部分剩余泄露被鼻夹40捕获并被反射回。所有这些发生在该装置作为整体被安全地附接至鼻子47时。
该微透镜结构可以被不同地设计以迎合不同波长,并且迎合光的相干性因素。因此,微透镜构造可以另选为反向泪滴形状,或者卵形,或者椭圆形,或者任何其它圆形构造,并且具有将光粒子重定向到期望方向的任何尺度尺寸。
图13示出了LED实施方式,其取决于LED二极管48和侧支承部49的安装角,以提供对光方向的主要操纵。除了上述形状因子以外,该透明空心壳体35还被设置成将光偏转回到鼻腔48中。
总之,几个形状因子有助于将生成的光引导到鼻腔空间中,并且然后朝向脑的瞄准区域。这些包括:用于低水平激光器实施方式的微透镜44、用于LED实施方式48的安装角、空心透镜套管35以及鼻夹40。以这种方式,将实现治疗功效所需的电能量保持到最小,并且实现小的、便携且方便使用的装置的期望目标。
用于鼻内光治疗单元的可自我管理施用器装置:
如图6–图13分别呈现的施用器装置23是有目的地将结构上设计的部件分组在一起以形成期望手持物品,期望手持物品可以由患者用他的手指操纵并且适于按意愿附接至鼻孔和从鼻孔脱离。具体来说,如图6a–图6b和图13a–图13b所示,配置照射透镜39与支承基部34和鼻夹35或40一起的组合共同形成并构成施用器装置23,并且同样地,施用装置23对于用户来说是个人方便的可自我管理构造。
因此,应当想到,配置照射透镜组装件39是真正必要的部件,是期望保持在支承基部34中的托架36内并由该托架36支承的独特实体。该托架36保持并对准配置照射透镜39,以便容易且快速插入鼻腔空间中。
还应注意到,施用器23的造型(styled)鼻夹40是支承基部34的结构材料臂和向外延伸。典型地,鼻夹40由柔性和弹性的白色或不透明材料形成。鼻夹的两种不同结构形式由图7a、图7b、图8a、图8b、图9a、以及图9b分别示出。
在其优选实施方式中,鼻夹用于两个不同的目的和功能,如图11所表示的。首先,其被用于抵着人鼻子的外表面直接压力接触和与鼻子外表面配合摩擦接合。这种接合将插入的照射透镜保持在鼻腔空间内的适当位置。第二,鼻夹的白色或不透明材料将减少一些光粒子的泄漏并将杂散光粒子反射回鼻孔的内部组织中。鼻夹40执行作为施用器23的合并部分的这两种期望功能。为此原因,施用器23作为独特实体,并且与配置照射透镜39形成对比,仅仅是易于作为整体使用该装置的便利物品。
施用器装置23易于利用人手的手指进行操作,并且由此是将便携式套管28和光生成单元45用于以图12所示的方式邻近对象的鼻腔的内部衬里适当定位的非常理想的工具。另外,容纳光生成器单元的施用器装置的可互换性允许家庭中的不同用户具有他们的个人施用器(出于卫生原因),而共用单个控制器,从而节省具有分离控制器的成本。
尽管如此,图6–图12分别所示的可自我管理施用器装置23被认为仅是一个优选示例性实例和用于将配置照射透镜39支承并适当地放置在鼻孔内的有形装置,并且仅表示使配置照射透镜39在鼻腔内的体内放置更容易、更快速、且更简单的一种支承构造。
用于鼻内光治疗单元的操作参数:
本发明中的用于鼻内脑刺激的操作参数可以广泛地划分成三个子组,三个子组涵盖宽范围和多种临床应用。图2、图3以及图4分别示出了这三个子分组如何瞄准人类脑的概念性表述,并且可以总结如下:
图2例示了利用633nm LED源的模型系统。来自LED光源12的光线11通常不受阻碍并且分散在宽区域上,直到它们到达筛骨13的垂直板为止。到脑中的穿透相对浅,但是广泛神经网络遍布整个脑分布信号。其首先瞄准前额叶皮层14,并且然后总体上瞄准脑。然而,该光源可以成角以在需要时指向脑的任何区域。
图3例示了利用655nm激光源的模型系统。来自激光源16的光线15通常不受阻碍并且通常在窄分散内保持相干,直到它们穿透筛骨17的垂直板为止。相对于图2中的633nm LED模型,该穿透更深,并且到达主要瞄准的中脑区域18。然而,次级信号发送仍将遍布其它脑区分布。
图4例示了利用810nm LED光源的模型系统。来自LED光源20的光线19通常不受阻碍并且分散在宽区域上,直到它们到达筛骨21的垂直板为止。相对于图2中的633nm LED模型,该穿透更深,并且分散(和组织覆盖)比图3中的655nm激光更宽,覆盖整个脑,包括位于更深处的中脑区域22。该模型系统提取上述其它两个模型的许多有益特征。商业缺点是光不可见,并且一些用户利用他们可以看到的光线可能更舒适和安全。
本发明的系统和装置的属性和能力:
该装置提供了许多正面属性、特性、以及能力。它们如下:
1、该装置和系统可以通过多种选定波长传递光能,以实现脑和神经系统的治疗结果。
2、该装置和系统具有非常低的电功率需求。
3、该装置和系统提供了一种轻质经颅耳机,与在其它经颅光疗方法中使用的全头盔相比,其使用起来更舒适。
4、该装置和系统提供了一种易于使用的鼻内施用器,其可以夹至鼻孔的外壁,同时将包封的固态电子光源(诸如发光二极管或低水平激光二极管)插入鼻腔内以传递光治疗。
5、该装置和系统克服了现有技术的缺点和常规技术的限制,特别是在便携性和可自我管理方面。其因将光治疗传递至脑的方法而与已知系统明显不同。
6、该装置和系统能够通过引导光线和光波长来照明脑的各个瞄准区域。在这方面,预先选择光的波长以便期望穿透到脑材料中。这导致针对相应神经疾病和病症的改善结果。
7、该装置和系统出于卫生和节约成本的目的,分离从处理和功率控制器组装件传递的光能,并且还潜在地提供利用单个处理控制器组装件来互换和置换不同光生成单元,该单个处理控制器组装件将传输用于该目的的适当功率剂量,并且与移动智能电话界面连接。
8、该装置和系统优选地组合经颅和鼻内光疗法,其中:(i)经颅耳机将光能引导至脑的背侧/上部区域;和(ii)鼻内单元将光能引导至脑的前侧或下侧。这提供比单独当前经颅方法和单独当前鼻内方法更全面的覆盖。
9、该装置和系统优选地瞄准默认模式网络的特定皮层中枢,由此旨在治愈与脑障碍(诸如阿尔茨海默病和痴呆)相关联的中枢的损伤。
治疗方法:
上述系统和装置可以在本发明的优选方法中使用。在该方法中,将光能优选地传递至DMN的瞄准皮层中枢。如上提到,这些皮层中枢的损伤与许多脑障碍相关联,诸如阿尔茨海默病和痴呆。将光有效传递至这些受损区域旨在刺激愈合。具体来说,光吸引脑细胞中的生长锥的前缘,以引起沿光的方向生长。在细胞级,光受体呼吸酶细胞色素氧化酶对光谱的可见红光区和近红外区中的光特别敏感,并且将这些红光波长和近红外波长的吸收光转换成三磷酸腺苷(ATP)的细胞能量分子。这导致ATP合成和氧消耗的增加,由此改善体内线粒体代谢。这优选地促进神经元细胞的生长和愈合,并且旨在改善脑障碍的病症。
用于执行非侵入式照射光疗法以便在活哺乳动物对象中实现脑神经刺激的方法优选地包括以下步骤和动作:
步骤1:获取光能发射装置,该光能发射装置由以下组成:
第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元中的每个都包括便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积以及适于施加至颅骨的外表面构造,每个配置照射单元的所述便携式空心壳体包括:
(i)光能透射材料,该光能透射材料形成用于每个配置照射单元的所述空心壳体的配置外表面的至少一部分;以及
(ii)至少一个光生成单元,该至少一个光生成单元整体地容纳并包含在每个配置照射单元的所述空心壳体的所述内部空间体积内,并且其能够在需要时以预定能量强度并且在预置持续时间内生成足以透过该颅骨并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长,
由此,所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元可以在施加至颅骨之后发射光能,并且实现在体内将所述发射光能传送通过颅骨进入脑的至少一部分中;
框架,该框架适于支承所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元,并且适于在颅骨上以固定位置和期望照射方向按意愿布置所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元的所述光透射外表面;
便携式控制器组装件,该便携式控制器组装件能够控制光能从所述配置照射单元到脑的至少一部分中的按需传递,所述控制器组装件包括:
(a)按需直流电的便携式且可补充电源,
(b)用于控制和引导这种直流电的流动的中央处理单元,
(c)与该电源电连通以将直流电按需传输至该中央处理单元的至少一个连接器,以及
(d)与该配置照射单元电连通以将直流电从所述中央处理单元按需传输至所述光生成单元的至少一个连接器;
其中,所述光能发射装置还包括:
配置照射透镜,该配置照射透镜包括:
便携式空心壳体,该便携式空心壳体具有固定尺度、一定大小的内部空间体积、以及外表面构造,该便携式空心壳体适于体内插入鼻孔的鼻腔空间中,而不对对象的呼吸能力造成实质性损伤并且不侵入活对象的鼻组织,所述配置照射透镜的所述便携式套管包括:
(i)光能透射材料,该光能透射材料形成用于所述配置照射透镜的所述空心壳体的配置外表面的至少一部分,
(ii)至少一个光生成单元,该至少一个光生成单元整体地容纳并包含在所述配置照射透镜的所述空心壳体的所述内部空间体积内,并且其能够在需要时以预定能量强度并且在预置持续时间内生成足以穿过该鼻组织并进入脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长,
由此,所述配置照射单元可以在体内插入之后在该鼻腔内以任何期望方向发射光能,并且实现在体内将所述发射光能从该鼻腔传送进入脑的至少一部分中;
可自我管理施用器装置,该可自我管理施用器装置适于支承所述配置照射透镜,并且适于在与对象的鼻腔的内部衬里相邻的鼻孔内以固定位置和期望照射方向按意愿布置所述配置照射透镜的所述光透射外表面;
其中,所述便携式控制器组装件还能够控制光能从所述配置照射透镜的按需传递。
步骤2:将所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元的透明外表面放置在与对象的颅骨相邻的期望固定位置处,以使通过所述第一配置照射单元、所述第二配置照射单元、所述第三配置照射单元以及所述第四配置照射单元发射的光能在体内穿过对象的颅骨并且进入脑的至少一部分中;以及
将所述配置照射透镜的透明外表面放置在鼻孔内的、与对象的鼻腔的内部衬里相邻的期望固定位置处,以使通过所述配置照射透镜发射的光能在体内穿过对象的鼻组织并且进入脑的至少一部分中。
步骤3:使所述定位配置照射单元的所述光生成单元在需要时以预定能量强度并且在预置持续时间内生成足以穿过该对象的颅骨并进入脑的光能,以使得实现对该脑的至少一部分的神经刺激,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长;以及使所述定位配置照射透镜的所述光生成单元在需要时以预定能量强度并且在预置持续时间内生成足以穿过该对象的鼻组织并进入脑的光能,以使得实现对该脑的至少一部分的神经刺激,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长。
如图23和图24所示,该经颅耳机102被放置在对象的头上。该配置照射单元108、110、112以及114由框架118支承。而且,该配置照射单元108、110、112以及114彼此相对定位成使得在将经颅耳机102放置在对象的头上时,每个配置照射单元108、110、112以及114的外表面与颅骨上的目标位置相邻。优选的是,如图25所示,配置照射单元108、110、112以及114被定位成将光能引导穿过颅骨至脑中的以下相应区域:
(A)脑的第一区域,该第一区域包括左腹内侧前额叶皮层区和右腹内侧前额叶皮层区,并且可选地包括扣带前回区;
(B)脑的第二区域,该第二区域包括左楔前叶皮层区和右楔前叶皮层区,并且可选地包括扣带后回区;
(C)脑的第三区域,该第三区域包括侧下顶叶皮层中的左角回区,并且可选地包括左扣带后回;以及
(D)脑的第四区域,该第四区域包括侧下顶叶皮层中的右角回区,并且可选地包括右扣带后回。
配置照射透镜122被放置在对象的一个鼻孔内部。配置照射透镜122的外表面被定位成引导能量通过鼻腔并且进入脑。使用鼻夹120将该配置照射透镜122保持在对象的鼻孔内部的位置中。
在对象期望时,将直流电从便携式控制器组装件106传输通过第一连接器124,并且直至配置照射单元108、110、112以及114的光生成单元。这使得配置照射单元108、110、112以及114中的光生成单元在需要时以预定能量强度并且在预置持续时间内生成足以穿过该对象的颅骨并传递至脑的瞄准区域的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长。
而且,在对象期望时,将直流电从便携式控制器组装件106传输通过第二连接器126,并且直至配置照射透镜122的光生成单元。这使得配置照射透镜122中的光生成单元在需要时以预定能量强度并且在预置持续时间内生成足以穿过该对象的鼻腔并传递至脑的光能,该光能具有从由近红外红光波长和可见红光波长所构成的组中选择的至少一个预选波长。
有关利用鼻内单元的步骤的更具体详情可以在图10中看到,其中,利用可自我管理施用器装置23将配置照射透镜35插入到人鼻子的鼻腔空间2中,并且然后使直流电从其源传输至过程控制器组装件(未示出),并且然后直至设置在空心壳体39内的光单元35。这使得该光单元45生成并且发送具有预选波长的光波和粒子46。
在该优选激光实施方式中,所发送光波和粒子46被套管壁40和微透镜44引导并且偏转,该微透镜覆盖在空心壳体35内的光生成单元45上。这分别通过图11和12最佳地例示。
通过该过程,发源于配置照射透镜35的该光波和粒子46被聚焦、瞄准,并且被引导进入脑的不同区域,如图1所示。来自光生成单元45的瞄准光能在很大程度上朝着鼻腔的内部偏转,并且这样的光可能穿过整个鼻腔2,并且泄露光然后被鼻夹40的反射性白色不透明材料反射并且重定向回到鼻腔空间中。由此,如图12所示,大部分初始生成光被捕获并且瞄准(通过偏转和反射)到鼻腔2中。
在这些实施方式中,该过程和功率控制器组装件整体上能够传递以焦耳/cm2测量的期望能量剂量,其足以实现对脑的一致治疗刺激。而且,该控制器组装件内的电能的电池源提供直流电,并且该控制器组装件的CPU能够以10至1000mW,一致地调节总光能功率输出。所传递的能量密度处于大约5至1800J/cm2的范围中。这导致该装置的发射光在仅10至30分钟(优选为20至25分钟)持续时间的治疗时间之后在治疗上有效。在该另选例中,该功率控制器的功能和工作可以另选地通过具有恰当下载的“App”的智能电话来执行。
研究No.1:
本发明人和共同研究者执行研究来测试本发明的系统、装置以及方法对具有阿尔茨海默病和痴呆的18名随机选择的对象的有效性。在基线(第0周)和第12周进行具有标准认知和功能量表的评估。12名对象利用本发明的系统和装置进行了治疗。6名对象利用安慰剂装置进行了治疗。
结果
在第12周,利用本发明的真实系统和装置治疗的所有对象在记忆/认知和功能能力方面显示出不同程度的改善。至于有关安慰剂装置的那些对象,2个对象显示略微改善,而其余4个继续下降。
与药物的比较和指示
这是在阿尔茨海默病和痴呆患者的随机安慰剂对照(placebo-controlled)研究中产生记忆/认知和功能能力改善的第一种医学形态。迄今为止,没有提供显着积极结果并且都具有显著负面副作用的药物选项。另外,正在考虑药物提供减缓认知衰退,而不是改善它。本发明的系统和装置没有增加任何显著的负面副作用。在继续使用药物的志愿者中也没有禁忌症。
研究No.2:
对患有焦虑的患者进行研究。利用本发明的系统和装置对该患者进行单次治疗20分钟。
定量脑电图(QEEG)测试通常用于测量和分析脑的电活动,并且可以检测脑的神经振荡或脑电波的异常。QEEG已被用于诊断癫痫、脑血管疾病以及其它病症。在两个时间点对该患者进行QEEG测试:(i)在利用本发明的系统和装置治疗之前;和(ii)在利用本发明的系统和装置治疗20分钟之后。图30中示出了该结果,
如可以在图30中看出,在利用本发明的系统和装置治疗之前,在通过QEEG检测的患者的脑电波中存在几种异常。例如,异常由第一、第三以及第四行中的圆形区域表示。然而,如图31所示,在单次20分钟治疗之后,那些异常中有许多被消除或减少,尤其是在QEEG的第一行。这是仅单次20分钟治疗之后的显著改善。
权利要求的范围不应由在示例中阐述的优选实施方式限制,而应赋予作为整体与说明书一致的最广泛解释。
- 还没有人留言评论。精彩留言会获得点赞!