用于评估阴道萎缩的方法与流程
本发明涉及用于评估阴道萎缩的方法,所述方法涉及阴唇和阴道口的感觉传感器、pH、生物化学、基因组学、和/或组织学。
背景技术:
绝经是影响所有妇女的正常自然老化事件。绝经可定义为在无明显病理原因的情况下,排卵和月经停止至少12个月。绝经的典型年龄为51岁,并且估计在当今美国(2010人口普查),多于5300万妇女具有后绝经年龄(50+岁)。其它妇女由于全子宫切除术(去除子宫和两个卵巢)而属于后绝经类别。与后绝经相关联的是循环雌二醇急剧下降至小于妇女生育年龄期间的典型水平的10%。减少的雌激素导致主要的解剖学变化,从而导致独特的症状和生活质量问题。
虽然已经报道了雌激素减少对女性的身体、皮肤和毛发具有全身影响,但该影响也见于泌尿生殖区,其被诊断为阴道萎缩或VA。VA评估可能需要将窥器插入女性的阴道中。进行主观评估,其包括丧失处女膜硬度、存在尿道展开、可伸缩式前庭、阴道中存在瘀点、并且经阴道口处指触(手指)诊断的弹性丧失。女性报道的主要症状包括阴道干燥的感觉、性交疼痛、性交出血、阴道瘙痒、和生殖器皮肤瘙痒等。
VA的客观测量和测试方法依赖于在阴道中在黏膜表面处的测试。处女膜是围绕或部分覆盖外部阴道口的膜(围绕该开口的组织可被称为处女膜环)。处女膜是内生殖器和外生殖器之间的界限。其由薄纤维膜组成,所述薄纤维膜作为下阴道的衬里,其外表面上由角质化分层鳞状上皮覆盖并且内表面上由具有糖原的非角质化分层鳞状上皮(如阴道上皮)覆盖。就具有VA的许多女性而言,处女膜可收缩并丧失弹性从而使得客观上测试VA是困难的或令人不悦的。与阴道口相关联的组织也被称为阴道口。VA的客观测量主要限于阴道pH(通常需要窥器以产生足够的触及),其中大于或等于5.5的pH应被分类为VA的信号。可对上皮衬里的阴道刮擦物(也需要窥器插入阴道中)进行成熟细胞的相对丰度(称为阴道成熟指数或VMI)分析。然而,VMI与VA之间的关系在临床医生间变化,并且所述变化可能相当宽。类似地,在女性的症状和临床评估,或阴道pH的客观测量之间没有明显的关系。
用于诊断VA和治疗的效果的另一种潜在的客观方法可包括收集转录表达图的阴道活组织标本。获得阴道活组织标本非常困难,需要使用窥器。另外,关于活组织标本来源之处不可能是精确的并且也不能确保活组织标本的均一特性。例如,活组织标本厚度的差异可偏离来源于真皮的数据。
用于诊断VA和治疗的效果的另一种潜在客观方法可包括从处女膜环或大阴唇或小阴唇收集浅表组织用于代谢表达谱。
另外,除了阴道pH之外,所有其方法均是主观的并且不可靠。另一个问题是所有阴道程序诸如主观阴道萎缩评级或收集阴道pH或收集阴道刮擦物用于VMI均需要将窥器插入阴道中。该程序可能非常疼,尤其是在遭受VA的女性中。虽然为了更容易插入可润滑窥器(通常用商业超声凝胶),但这可不利于pH和VMI的收集。由插入窥器造成的疼痛可能影响妇女是否决定寻求诊断并治疗VA。
因此,需要VA诊断方法和评估治疗对VA的潜在功效的方法,其不依赖于使用窥器、对阴道组织取样,并通过使用定量和客观方法来减少主观性程度。
技术实现要素:
本发明公开了用于识别与阴道萎缩相关联的泌尿生殖道变化的一种或多种方法的系列。所述方法系列包括:测量大阴唇、小阴唇、阴道口或它们的组合处的pH;测定阴道口处的刷敏感性;评估阴道口处的糖原量;采集阴道口处的活组织标本并分析阴道口处的上皮细胞;评估阴道口或大阴唇或小阴唇处测试的蛋白质量;评估阴道口或大阴唇或小阴唇处的代谢物及其量;评估阴道口或大阴唇或小阴唇处的组胺量;在大阴唇或小阴唇或阴道口处转录组热成像;以及对于一组基因探针组评估大阴唇处的基因表达。
本发明还公开了评估阴道萎缩治疗方案的功效的方法。用于评估阴道萎缩治疗方案的功效的方法包括:使用一种或多种诊断方法进行阴道萎缩的治疗前评估;将一种或多种局部治疗施用于大阴唇、小阴唇、阴道口、阴道或它们的组合;使用与用于阴道萎缩的治疗前评估中相同的诊断方法进行阴道萎缩状态的治疗后评估;以及测定阴道萎缩的治疗前评估和治疗后评估之间的差异以评估局部治疗的总体效果。用于治疗前和治疗后的一种或多种诊断方法包括:测量大阴唇、小阴唇、阴道口或它们的组合处的pH;测定阴道口处的刷敏感性;评估阴道口处的糖原测试;阴道口处上皮细胞的活组织检查分析;评估得自阴道口、大阴唇、小阴唇、或它们的组合的代谢物;评估阴道口处测试的蛋白质;在大阴唇或小阴唇处转录组热成像;对于一组基因探针评价大阴唇处的基因表达;使用与用于阴道萎缩的治疗前评估中相同的诊断方法进行阴道萎缩状态的治疗后评估;以及测定阴道萎缩的治疗前评估和治疗后评估之间的差异以评估局部治疗的总体效果。
一种用于评估阴道萎缩治疗方案的功效的试剂盒,该试剂盒包括:用于阴道萎缩的治疗前评估方法,该试剂盒包括:施用于大阴唇、小阴唇、阴道口、阴道或它们的组合的局部治疗;用于阴道萎缩状态的治疗后评估方法,其包括与用于阴道萎缩的治疗前评估相同的诊断方法;以及测定阴道萎缩的治疗前评估和治疗后评估之间的差异以评估局部治疗的总体效果的方式。用于治疗前和治疗后的一种或多种诊断方法包括:测量大阴唇、小阴唇、阴道口或它们的组合处的pH;测定阴道口处的刷敏感性;评估阴道口处的糖原测试;评估大阴唇、小阴唇、阴道口或它们的组合处的代谢物;阴道口处的上皮细胞的活组织检查分析;评估阴道口处测试的蛋白质;大阴唇或小阴唇处的转录组热成像;或对于一组基因探针评价大阴唇处的基因表达。
附图说明
虽然本说明书通过特别指出并清楚地要求保护本发明主题的权利要求书作出结论,但据信由以下与附图有关的说明可更容易理解本发明,其中:
图1示出在阴道口处进行活组织检查的图像。
图2示出用于上皮组织的测量中的图像。
图3为在绝经后女性中增加的那些基因探针的维恩图。
具体实施方式
用于评估阴道萎缩和评估用于阴道萎缩的治疗的功效的本发明方法系列中所包括的方法不需要使用窥器也不需要触及阴道。以下方法系列通过使用定量且客观的方法降低主观性程度。应当理解,可仅依赖单个方法或下述方法的组合。以下方法利用不是阴道腔的位点,其容易触及并且可用于客观地测量与泌尿生殖器萎缩相关联的变化并且不需要侵入式工具诸如窥器。另外,这些位点可与女性报道的症状和治疗的功效密切相关联。这些位点包括阴唇(其包括大阴唇或小阴唇)和泌尿生殖器区的处女膜环。两个位点由于其可触及性而特别有吸引力。类似于阴道,处女膜环是黏膜表面,其不同于阴唇的分层上皮。
利用阴唇和处女膜环(或者阴道口)的以下方法可包括pH、组织学、对刷涂搽的敏感性、代谢物的表达谱、以及基因转录物的表达谱。
如本文所用,术语代谢物或蛋白质或转录物的“不同含量”可包括任何增加或减小的含量。出于该讨论的目的,代谢物的不同含量也可延伸至意指蛋白质或转录物。在一个实施方案中,不同含量是指增加下列百分比的含量:至少5%;至少10%;至少20%;至少30%;至少40%;至少50%;至少60%;至少70%;至少80%;至少90%;至少100%;至少110%;至少120%;至少130%;至少140%;至少150%;或更多。在另一个实施方案中,不同含量是指减小下列百分比的含量:至少5%;至少10%;至少20%;至少30%;至少40%;至少50%;至少60%;至少70%;至少80%;至少90%;至少100%(即,代谢物不存在)。代谢物以统计意义上显著的不同含量表达(即,p-值小于0.05和/或q-值小于0.10,如使用t检验、Welch T检验或Wilcoxon秩和检验法测定的)。
如本文所用,术语代谢物(或蛋白质或转录物)的“参考含量”是指指示萎缩或未萎缩、表型、或其缺失,以及萎缩状态、表型或其缺失的组合的代谢物含量。在一个实施方案中,萎缩参考含量或代谢物是指指示受检者中的VA的阳性诊断的代谢物含量。在另一个实施方案中,代谢物的“健康参考含量”是指指示受检者中未萎缩状态的阳性诊断的代谢物含量。
在一个实施方案中,代谢物(或蛋白质或转录物)的“参考含量”可以为下列中的一种或多种:代谢物的绝对或相对量或浓度;代谢物的存在或缺失;代谢物的量或浓度的范围;代谢物的最小和/或最大量或浓度;代谢物的平均量或浓度;和/或代谢物的中值量或浓度。在另一个实施方案中,代谢物的组合的“参考含量”还可以为彼此相关的两种或更多种代谢物的绝对或相对的量或浓度的比率。对于特定萎缩状态、表型或其缺失的代谢物的适当阳性和阴性参考含量可以通过测量一个或多个合适的受检者中的期望代谢物的含量来测定,并且可对特定受检者人群定制此类参考含量(例如,参考含量可以为年龄匹配的或与自上次月经周期以来的年数匹配的,使得可在来自特定年龄的受检者的样品中的代谢物含量与特定年龄组中的具体萎缩状态、表型或其缺失的参考水平之间进行比较)。在另一个实施方案中,可对用于测量生物样品中的代谢物含量的特定技术(例如,LC-MS、GC-MS等)定制参考含量,其中代谢物的含量可基于所用的特定技术不同。
在另一个此类实施方案中,“参考代谢物”可包括选自下列的至少一种化合物:由氨基酸代谢生成的化合物、由尿素循环生成的化合物;在谷胱甘肽转化中生成的化合物;在脂质代谢中生成的化合物;在烃代谢中生成的化合物;由核酸代谢生成的化合物;维生素;和辅因子。在另一个实施方案中,“参考代谢物”可包括下列氨基酸中的一种或多种:丙氨酸、半胱氨酸、谷氨酰胺、谷氨酸、组氨酸、亮氨酸、异亮氨酸、赖氨酸、精氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸、苯乙酸、N-乙酰甲硫氨酸、N-甲酰甲硫氨酸、和两种氨基酸的组合的二肽。
在另一个实施方案中,“参考代谢物”可包括选自下列的化合物中的一种或多种:由嘌呤或嘧啶代谢生成的化合物、腺嘌呤、腺苷、胞苷、胞嘧啶、胸腺嘧啶、肌苷、次黄嘌呤、尿苷、鸟苷、鸟嘌呤、鸟氨酸和胸腺嘧啶核苷。
另一个实施方案中,“参考代谢物”可包括选自下列的至少一种化合物:由鞘脂类和溶血脂代谢生成的化合物、二氢鞘氨醇、鞘氨醇、N-棕榈酰鞘氨醇、棕榈酰鞘磷脂、硬脂酰鞘磷脂、1-硬脂酰甘油磷酸乙醇胺、1-亚油酰甘油磷酸丝氨酸、1-油酰甘油磷酸甘油、1-棕榈油酰甘油磷酸胆碱、还原型谷胱甘肽、氧化型谷胱甘肽、胆碱和尿酸。
在另一个此类实施方案中,“参考代谢物”可包括选自下列的至少一种化合物:由烟碱(烟酰胺)代谢生成的化合物;由烟酰胺腺嘌呤二核苷酸(NAD)代谢生成的化合物;由烟酰胺单核苷酸(NMN)代谢生成的化合物;烟酸单核苷酸(NaMN)代谢物;以及维生素B3。测量结果可表达为NAD与其还原形式NADH的比率,或者NADPH与其氧化形式NADP(烟酰胺腺嘌呤二核苷酸磷酸酯)的比率。
在另一个此类实施方案中,“参考代谢物”可包括选自下列的至少一种化合物:由果糖、半乳糖和半乳糖代谢生成的化合物,诸如山梨醇、甘露糖醇、甘露糖醇-1-磷酸。
在另一个此类实施方案中,“参考代谢物”可包括选自下列的至少一种化合物:由糖原代谢生成的化合物,诸如麦芽六糖、麦芽五糖、麦芽四糖、麦芽三糖或麦芽糖。
在另一个此类实施方案中,“参考代谢物”可包括选自下列的至少一种化合物:由葡萄糖代谢生成的化合物,诸如乳酸、丙酮酸、葡萄糖-1-磷酸、葡萄糖-6-磷酸、果糖-6-磷酸、或3-磷酸甘油酸。
代谢技术可用于鉴定新型且化学上未命名的化合物。所述方法可描述于至少美国专利7,884,318;Evans等人,2009,Analytical Chemistry 81:6656-6667;以及Lawton等人,2008,Pharmacogenomics 9:383-397中。
代谢表达谱技术可更详细地描述于下文所示的实施例以及美国专利7,005,255、US7,329,489、US7,550,258、US7,550,260、US7,553,616、US7,635,556、US7,682,783、US7,682,784、US7,910,301和US7,947,453中,其全部内容以引用方式并入本文。
代谢物可使用所述分析方法鉴定并由来源于刷样品和条带的提取物定量。
代谢组学是指代谢物在活生物体中的表达。如本文所用,术语“代谢物”是指由代谢产生的或用于或参与具体代谢过程所必需的任何物质。所述术语不包括大分子,诸如大蛋白质(例如,分子量超过2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000或10,000的蛋白质);大核酸(例如分子量超过2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000或10,000的核酸);或者大多糖(例如分子量超过2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000或10,000的多糖)。术语代谢物包括将来源于食物的能量转化成可用形式的化学反应中的信号分子和中间体,其包括但不限于:糖、脂肪酸、氨基酸、核苷酸、抗氧化剂、维生素、辅因子、脂质、在细胞过程中形成的中间体、和其它小分子。
测量大阴唇、小阴唇和处女膜环处的pH
本领域技术人员可以不受本说明书的限制。
可使用可商购获得的pH试纸或平头pH探针来测量pH。pH试纸或pH条的非限制性示例包括pHydrion试纸(3.0-5.5范围;Hydrion MicroEssentials Laboratory Inc.,New York,New York,USA)和pHion诊断测试条(4.5-9.0范围,iHerb.com)。平头pH探针的非限制示例包括,例如,SkinCheck HI-98109(Hanna Instruments,Woonsocket,Rhode Island,USA)。
可使用pH条,通过使用镊子固定pH条以将所述pH条与期望区域接触30秒来测量pH。
使用pH探针的程序如下。
1.在使用pH探针之前,移除保护性顶盖并且通过将顶端浸泡(优选地,离开底部边缘5cm/2英寸,更优选地离开底部边缘3cm/1.5英寸)在新鲜的pH 7缓冲溶液(例如得自Hanna Instruments的溶液HI7007P)中并持续1小时至长达24小时来调理电极。在调理期间,探针应当在“关闭”位置。
2.校准pH探针。打开pH探针。首先,在蒸馏水,优选地去离子蒸馏水中冲洗经调理的探针。将探针电极顶端浸渍在pH 7缓冲液中(即小于30天的缓冲液,优选地新鲜缓冲液)。使得读数至稳定(即,优选小于1小时,更优选地小于15分钟)。在读数稳定之后,使用小螺丝刀以利用微调器(左上角的螺丝,如在电极显示处所看到的)调节至pH 7.00+/-0.02,至读数7.00。用水(即,蒸馏水,优选地去离子蒸馏水)冲洗电极端部,甩掉过量水,并使用新鲜pH 4.0缓冲液(例如得自Hanna Instruments的溶液HI70004P)重复过程。使得读取至稳定(即,优选小于1小时,更优选地小于15分钟)。在读数稳定之后,使用小螺丝刀以利用微调器(右上角,如在电极显示处可见)调节至pH 4.00+/-0.02,至读数4.00。pH计准备好进行测量。可将探针顶端留在缓冲溶液(优选离开底部边缘5cm/2英寸内,更优选地离开底部边缘3cm/1.5英寸内)并持续至多2小时。
3.测量。pH计开关应当为开。用蒸馏水,优选地去离子蒸馏水,冲洗电极顶端,并且使得过量水滴落或温和甩去过量水。将电极顶端保持离皮肤表面45-135度,优选地离皮肤表面60-120度,更优选地离皮肤表面75-105度。使得pH探针显示器稳定小于15分钟,优选地小于5分钟,更优选地小于1分钟。使用之后,用水(即,蒸馏水,优选地去离子蒸馏水)冲洗电极顶端,甩去过量水,并且开始在相同受检者的另一泌尿生殖位点处进行测量。如果不立即使用探针,则探针可用水(即,蒸馏水,优选地去离子蒸馏水)冲洗并转移到pH 4.0或7.0缓冲液浴中直至使用并持续最多达2小时。
4.使用后或在受检者之间。在已经使用pH计之后,将pH计开关转到关闭位置。为储存pH探针或在另一个受检者上使用,需要净化或消毒pH探针。这以两种优选方法之一来实现。一种方式通过将探针浸入(优选地离底部边缘5cm/2英寸内,更优选地离底部边缘3cm/1.5英寸内)70%异丙醇中,优选地持续20至40分钟,更优选地25至35分钟。然后,用水(即,蒸馏水,优选地去离子蒸馏水)冲洗探针并重新校正。另选地,可使用杀菌手部擦拭物(Sani-Cloth HB,无乙醇,得自PDI(Orangeburg,New York,USA)或喷雾(Citrex医院喷雾消毒剂,得自Cardinal Health(Columbus,Ohio,USA)。在施用之后,等待3至5分钟,优选地3-4分钟,更优选地2.5至4分钟。这之后利用水(即,蒸馏水,优选地去离子蒸馏水)冲洗,并重新校正。为在去污之后储存pH探针,用水(即,蒸馏水,优选地去离子蒸馏水)冲洗探针,甩去过量水,并且将保护性顶盖放在探针顶端上,或在放在探针顶端上之前,将一至10滴HI 70300储存溶液(Hanna Instruments)加入保护性顶盖中。
pH探针或pH条可用于测量外大阴唇、内大阴唇、小阴唇、和处女膜环处的pH。对于阴唇和处女膜环处的测量而言,优选pH探针,然而在阴道中优选pH条。对于在阴唇处的测量而言,可将探针或条置于解剖位点的终点处(后面和前面之间)。为在处女膜区处测量,pH探针几乎垂直于解剖位点或可偏离解剖位点45°至135°。
利用软刷和生物化学分析测量阴道口的敏感性
本方法还可包括使用软工具例如刷测量阴道口的敏感性的方法。刷的示例包括圆形刷,例如得自Epicentre Biotechnologies(Madison,Wisconsin,USA)的MasterAmp颊黏膜刷。刷应当对于组织是柔软的,如由刷毛边缘、刷毛长度、和刷毛硬度所定义的。可将刷放置成与处女膜环接触,作为测量敏感性的方式和/或作为收集刷毛上的生物学组织样品的方式。
所述方法包括使刷与处女膜环接触。与处女膜环接触进行至少1秒。
使刷与处女膜环接触可包括以下步骤:将受检者置于适当位置使得测试探针可正确定位,使处女膜环暴露,保持刷柄并将刷放置成在介于1psi和0.01psi之间(诸如小于1psi、小于0.5psi、或小于0.1psi)的力下与处女膜组织轻微接触,并且在期望的组织区域上移动刷用于组织收集。
在使刷与处女膜环接触之前,应当将受检者置于适当位置使得测试探针可正确定位。在许多情况下,但不受限制,这可以为妇科检查椅。该椅具有调节受检者的位置的能力。
一旦将受检者正确地定位,就扩张阴唇,使得处女膜区暴露。
下一步骤是抓握刷的柄部,插入并将刷(得自Epicentre Biotechnologies的MasterAmp颊黏膜刷)静置于沿处女膜环的任何位置,优选地在3点钟或6点钟或9点钟或12点钟位置处。
为测定对刷的敏感性,可将塑料柄部端保持在食指和拇指之间,并且在捻转旋转运动情况下,将刷在组织表面上旋转1至25个循环,优选地2至15个循环,更优选地3至10个循环。每次循环将花费小于5秒,优选地小于2秒。
一旦刷与处女膜环接触,就应当移除刷并且切割使得刷落入收集小瓶中(Bio Plas微离心管(Bio Plas 4204)和具有O形环的螺纹顶盖(Bio Plas4215R),得自VWR(VWR International LLC,Radnor Pennsylvania,USA),#20170-710,有缘锥形管和VWR 20170-770),并且利用螺纹顶盖将所述小瓶密封。
然后可将小瓶置于干冰中,并且可储存在-70℃(或更低)的冷冻机中至多六个月。
可收集一个或多个刷样品,例如可重复所述方法2-10次,优选地2至5次。
可提取刷样品以测量蛋白质、DNA、糖原、组胺、细胞因子、和代谢物。
所述方法还可包括让消费者填写与体验相关的问卷调查。所述问卷调查可包括与阴道干燥度相关的问题。所述问卷调查可确认消费者是否感觉到刷和所述接触是否令人不悦。所述问卷调查可要求消费者描述感觉。所述问卷调查还可询问消费者关于下列主题的问题,例如:生殖器皮肤干燥度、阴道干燥度、生殖器皮肤瘙痒、阴道骚痒、性交困难、以及它们的组合所述问卷调查可要求消费者评价与刷接触的各方面,例如不愉悦度的等级。所述等级可基于1至10的分数,其中一表示体验到无感觉,并且10表示最大感觉。
如上所述,可分析刷以测量蛋白质、DNA、糖原、组胺、细胞因子、和代谢物。可使用EnzyChromTM糖原测定试剂盒(BioAssay Systems,Hayward,California,USA)来分析刷的糖原含量。EnzyChromTM糖原测定试剂盒利用单一工作试剂,其将经由α-淀粉酶和淀粉葡糖苷酶酶促分解(水解)糖原和通过葡萄糖氧化酶氧化葡萄糖以及经由比色/荧光染料试剂检测过氧化氢(得自EnzyChromTM糖原测定试剂盒所附的材料安全数据表)进行组合。反应产物在570nm的波长下的颜色强度,或在λex/em=530/585nm的荧光强度与样品中的糖原浓度成正比(Zhou M等人Analytical Biochem 253:162-168,1997)。样品中的葡萄糖浓度通过将包含葡萄糖氧化酶和染料但不具有水解酶的试剂加入空白样品中来测定。糖原含量通过从总葡萄糖(糖原+游离的葡萄糖)中减去游离的葡萄糖来测定。使用原液来制备逐渐增加浓度的葡萄糖(以微克/毫升(μg/mL)为单位表达)生成校准曲线。将由原液制备的三种质量对照样品(高QC、中QC和低QC)用于在样品分析期间监测测定性能。
收集活组织标本
方法系列还可包括从大阴唇、小阴唇或阴道口采集活组织标本。活组织标本可用于组织学分析、生物化学分析、转录组学分析。为收集活组织标本,首先用聚维酮碘清洁皮肤表面,并且然后用局部麻醉剂,诸如约0.05至4ml/cm2的利多卡因麻醉。麻醉剂应位于待活组织检查的区域正下方。一旦麻醉剂麻醉所述区域,就用乙醇清洁表面。皮肤活组织标本可通过受训练的医生使用Tischler Morgan活组织检查仪(购自Gynex Corporation,Redmond,Washington,USA),使用标准无菌技术,之后如果需要的话进行缝合闭合来收集。如果需要的话,可使用附加措施用于止血。在该程序中可使用铬缝合线并且期望自然吸收使得将不需要移除缝合线。活组织检查区域可用Polysporin处理并用医用纱布垫或伤口绷带覆盖。可为每位受检者安排术后访问以注意活组织检查位点的愈合。
应当理解可采集多于一个活组织标本。活组织检查样品可根据以下程序进行处理。可通过首先将活组织标本转移到预标记的含福尔马林瓶中(10%中性缓冲福尔马林,VWR 89370-094或等同物),将活组织检查样品用于组织学评价。样品可保持在福尔马林中过夜并且然后转移到包含70%乙醇的塑料盒中,用于最终的石蜡包埋、切片和染色(例如但不限于苏木精/曙红)。还可将活组织标本冷冻用于最终的冷冻切片和染色。
可首先通过将活组织标本转移到RNALater溶液(Life Technologies目录号AM7021,Thermo Fisher Scientific,Waltham,Massachusetts,USA)中,之后浸入磷酸盐缓冲盐水(Life Technologies目录号10010031或等同物)中,并且然后用(由Kimberly Clark Corporation生产,Irving,Texas,USA)芯吸干燥,将活组织检查样品用于转录组学分析。然后可将样品转移到1.5ml Eppendorf管(VWR目录号#022363204)中并且顶盖闭合并置于干冰-乙醇浴中或置于–70C(或更冷的)冷冻机中,直至RNA处理。
可将活组织检查样品用于组织学评价和转录组学分析。
组织学评价可通过以下程序来进行:
1.在福尔马林和乙醇处理之后,组织可用二甲苯(VWR目录号MK866802或等同物)清洁并且然后在基础模具中包埋于石蜡中并使其固化。
然后在冷却板上冷却组织块,并从基础模具中移除,将其置于冷冻机中(约-4C)直至切片。
从冷冻机中移除组织并在冰上的冰盘(或等同物)中保持冷却。使用超薄切片机(Leica RM2125RTS,Leica Microsystems GmbH,Wetzlar,Germany或等同物)修剪所述块并切割成3-4μ厚度的切片。将所述切片置于水浴中并且移除任何折叠和褶皱。
可将切片置于带正电荷的显微镜载玻片(VWR目录号89500-498或等同物)上,并使过量的水从载玻片排出或芯吸。
将载玻片加载到Ventana Symphony染色盘中并对苏木精和曙红(H&E)染色,或者其它期望的组织学染色(诸如PAS、Trichrome等),或者使用Ventana Symphony体系(Ventana Medical Systems,Inc.,Tucson,Arizona,USA)进行免疫染色(诸如Ki67、CD3、S100等)。
可提取活组织检查样品、刷样品或条带样品以测量蛋白质、DNA、糖原、组胺、和代谢物。
糖原的测量
可使用EnzyChromTM糖原测定试剂盒(BioAssay Systems,Hayward,California,USA)分析刷的糖原含量。EnzyChromTM糖原测定试剂盒利用单一工作试剂,其将经由α-淀粉酶和淀粉葡糖苷酶酶促分解(水解)糖原和通过葡萄糖氧化酶氧化葡萄糖以及经由比色/荧光染料试剂检测过氧化氢(得自EnzyChromTM糖原测定试剂盒所附的材料安全数据表)进行组合。反应产物在570nm的波长下的颜色强度,或在λex/em=530/585nm的荧光强度与样品中的糖原浓度成正比(Zhou M.等人Analytical Biochem 253:162-168,1997)。样品中的葡萄糖浓度通过将包含葡萄糖氧化酶和染料但不具有水解酶的试剂加入空白样品中来测定。糖原含量通过从总葡萄糖(糖原+游离的葡萄糖)中减去游离的葡萄糖来测定。使用原液来制备逐渐增加浓度的葡萄糖(以微克/毫升(μg/mL)为单位表达)生成校准曲线。将由原液制备的三种质量对照样品(高QC、中QC和低QC)用于在样品分析期间监测测定性能。
可将以下试剂用于糖原的分析:
1)EnzyChromTM糖原测定试剂盒,BioAssaySystems,目录号:E2-GN-100。储存在-20℃下冷冻的试剂盒至多6个月。所述试剂盒包含以下试剂:
a)测定缓冲液,12mL
b)染色试剂,120μL
c)酶A(α-淀粉酶,淀粉葡糖苷酶),干燥的
d)酶B(葡萄糖氧化酶),120μL
e)淀粉标准品,50mg/mL,50μL;
2)水,用Millipore Milli-Q过滤体系(Merck Millipore,Billerica,Massachusetts,USA)纯化;或等同物;
3)5M氯化钠(NaCl),Sigma-Aldrich目录号:S5150,Sigma-Aldrich Corp.(St.Louis,Missouri,USA);或等同物;
4)蛋白酶抑制剂混合片,COMPLETETM,Roche Diagnostics GmbH(Mannheim,Germany),目录号:11-697-498-001;
5)磷酸盐缓冲盐水(PBS)缓冲液包,Sigma-Aldrich Corp.,目录号:P3813。将1PBS缓冲液包稀释于1升水中。在室温下储存PBS溶液至多1个月;或者
6)提取缓冲液(“EB”,PBS+0.25M NaCl+蛋白酶抑制剂)。将50mL 5M NaCl(试剂#3)加入950mL PBS中以制备0.25MNaCl。使用0.2μm过滤瓶(真空过滤器单元,无菌,Nalgene目录号:567-0020或等同物,Nalge Nunc International Corporation(Rochester,New York,USA)过滤试剂。向该溶液中,溶解20个蛋白酶抑制剂片(试剂#4)/1000mL。在室温下储存至多1个月。
制备刷样品以测量糖原
可使用以下步骤制备样品从而测量糖原。
1.从-70℃冷冻机中移除容纳刷样品的聚丙烯管。
2.向每个聚丙烯管中添加提取缓冲液(EB,试剂#6):
a)等分1.5mL EB到每个管。
b)重置每个螺纹顶盖,牢固拧紧顶盖。
3.在冰浴(4-10℃)中超声处理小瓶约30分钟(超声波清洁器,Branson Ultrasonics Corporation(Danbury,Connecticut,USA);或等同物)。
4.使用多管涡旋器(多管涡旋器,VWR目录号:VX2500;或等同物)将管涡旋10秒。
5.使用已经用杀菌擦拭物(Plus,PDI,Inc.,目录号:Q89072;或等同物)清洁的镊子,从每个管中抓取并取出刷样品,同时将刷压向管内部以避免任何残余的流体。用灭菌一次性布擦拭镊子,并且在处理下一个刷样品之前风干。
6.在3000rpm下将提取物离心5分钟(室温;Allegra X-12R,Beckman-Coulter(Fullerton,California,USA);或等同物)。
7.将提取物转移到深孔板:
a)将每个提取物管开盖。
b)根据板模板,将管按顺序置于(自动液体处理器的)液体处理器管架中。
c)使用自动液体处理器(JANUS,Perkin-Elmer,PackardMultiPROBE;或等同物),将上清液的等分试样(在离心步骤后,等分试样应该接近足够测量糖原所需的量,例如可以为250μL等分试样)转移到用于糖原的空的96孔2ml深孔板中(Axygen Scientific,目录号:P-DW-20-C;或等同物,Corning Inc.,Corning New York,USA)。取决于结果,即,过高浓度的糖原,可能需要稀释上清液样品。
d)将盖垫牢固紧固于深孔板上(滴定板振荡器,Lab-lineInstruments,Inc.,VWR目录号:57019-0600或等同物)。
e)使用多管涡旋器将深孔板涡旋10秒。
f)在-70℃或更低下,将深孔板和容纳提取物的管冷冻,以用于将来的分析。
8.如果进行第二次提取,则将提取的刷置于其它聚丙烯管中,并且重复步骤2-7。
糖原测定
1)在工作台上使测定试剂和研究样品提取物平衡至室温(20-25℃)。**在实验期间,将从EnzyChromTM测定试剂盒中解冻的酶保持在冰上或冷藏(2-8℃)。
2)重组酶A。
a.将120μL测定缓冲液加入干燥酶A的小瓶中。
b.使小瓶涡旋以完全溶解。
3)制备工作标准品。如下将50mg/mL淀粉标准品稀释于提取缓冲液(EB)中以制备工作标准品。在每次稀释之后涡旋以混合溶液。
Std1=200μg/ml糖原=10μL淀粉标准品(50mg/mL)+2.49mL EB
Std2=150μg/ml糖原=300μL的200μg/ml糖原+100μL EB
Std3=100μg/ml糖原=200μL的200μg/ml糖原+200μL EB
Std4=50μg/ml糖原=200μL的100μg/ml糖原+200μL EB
Std5=25μg/ml糖原=200μL的50μg/ml糖原+200μL EB
Std6=12.5μg/ml糖原=200μL的25μg/ml糖原+200μL EB
Std7=6.25μg/ml糖原=200μL的12.5μg/ml糖原+200μL EB
Std8=3.125μg/ml糖原=200μL的6.25μg/ml糖原+200μL EB
空白=EB
4)制备糖原测定QC
HQC=80μg/ml糖原=80μL的200μg/ml糖原+120μL EB
MQC=40μg/ml糖原=40μL的200μg/ml糖原+160μL EB
LQC=10μg/ml糖原=50μL的MQC+150μL EB
5)使用多管涡旋器将样品提取物的深孔板涡旋(30秒,速度#7)
6)根据96孔板模板,使用单通道10μL移液器,将10μL标准品,测定QC或研究样品一式两份加入测定板(透明的聚苯乙烯96孔平底板;Becton Dickinson,目录号3072(Becton Dickinson and Company,Franklin Lakes,New Jersey,USA)或等同物)的每个孔中。
7)通过向6.3mL测定缓冲液中加入70μL酶A+70μL酶B+70μL染色试剂,制备工作试剂(足以用于64孔)。
8)通过向3.6mL测定缓冲液中加入40μL酶B+40μL染色试剂,制备样品空白试剂(足以用于32孔)。
9)使用电子多通道移液器以多分配模式(2×90μL),向每个标准的测定QC和测定板的样品孔加入90μL工作试剂。
10)使用电子多通道移液器以多分配模式(2×90μL),向每个样品空白孔(无酶A)(如在测定板模板上以红色指示的)加入90μL样品空白试剂。
11)在设定为速度5的滴定板振荡器上将测定板混合并持续10秒。
12)用塑料盖覆盖板;在室温(20-25℃)下在工作台上培养30min。
13)测量光学密度:利用计算机控制的酶标仪(SpectraMax340PC384,Molecular Devices Corporation(Sunnyvale,California,USA);或等同物)在570nm的波长下读取所述板。使用对应的读板器软件(用于酶标仪的PRO软件,用于Windows的PRO,Molecular Devices Corporation(Sunnyvale,California,USA);或等同物)生成数据。推荐以下读板器设置:
仪器参数:
模式:Endpt L1
波长:L1:570nm
自动混合:开启
数据分析
统计计算:
在两个孔中测定标准和质量对照,产生两个光学密度值(OD)。OD结果记录为两个OD值的均值(平均值)。用于数据分析的回归算法是校准基准的标称浓度和平均OD值的二次拟合。
%CV(变异系数)=(标准偏差/平均OD)*100%
%偏差(仅适用于标准品和QC)=((计算的浓度-标称浓度)/标称浓度)*100%
糖原测定:
如果存在样品包含葡萄糖的可能性,则应当制备独立的样品空白孔,其不包含酶A试剂。为计算每个样品中的糖原浓度,从在对应的样品孔(酶A+酶B)中测定的糖原+葡萄糖的总浓度中减去在每个样品空白孔(无酶A)中测定的葡萄糖浓度:
[糖原]样品=[糖原+葡萄糖]样品–[葡萄糖]样品
蛋白质的测量
可使用以下试剂进行蛋白质的测量:
1)Pierce BCATM蛋白质测定试剂A,Thermo Scientific,目录号:23223,1000mL,其包含碳酸钠、碳酸氢钠、二辛可宁酸和酒石酸钠的0.1M氢氧化钠溶液。
2)Pierce BCATM蛋白质测定试剂B,Thermo Scientific,目录号:23224,25mL,其包含4%硫酸铜。
3)白蛋白标准品,2mg/mL,Thermo Scientific,目录号:#23210,50mL,其包含2.0mg/mL的牛血清白蛋白(BSA)的0.9%生理盐水和0.05%叠氮化钠的溶液。
4)水,用Millipore Milli-Q过滤体系纯化;或等同物。
5)5M氯化钠(NaCl),Sigma目录号:S5150;或等同物。
6)蛋白酶抑制剂混合片,COMPLETETM,Roche Diagnostics GmbH(Mannheim,Germany),目录号:11-697-498-001。
7)磷酸盐缓冲盐水(PBS)缓冲液包,Sigma.,目录号:P3813。将1PBS缓冲液包稀释于1升水中。在室温下储存PBS溶液至多1个月。
8)牛血清白蛋白(BSA),30%Sigma,目录号:A8577;或等同物。
9)提取缓冲液(“EB”,PBS+0.25M NaCl+蛋白酶抑制剂)。制备PBS溶液(试剂#5)。将50mL 5M NaCl(试剂#3)加入950mL PBS以制备0.25M NaCl。使用0.2μm过滤瓶过滤。向该溶液中,溶解20个蛋白酶抑制剂片(试剂#4)/1000mL。在室温下储存至多1个月。
程序
重复自“制备刷样品以测量糖原”以上的步骤1至6。在“制备刷样品以测量糖原”的步骤6之后,将提取物转移到深孔板:
1.将每个提取物管开盖。
2.根据板模板,将管按顺序置于MultiPROBE架中。
3.使用自动液体处理器,将上清液的等分试样(在离心步骤后,等分试样应该接近足够测量蛋白质所需的量,例如可以为250μL等分试样)转移到空的96孔2ml深孔板中。取决于结果,即,过高浓度的蛋白质,可能需要稀释上清液样品。
4.将盖垫牢固紧固于深孔板上。
5.使用多管涡旋器将深孔板涡旋10秒。
6.在-70℃或更低下,将深孔板冷冻,以用于将来的分析。
测定
1)制备牛血清白蛋白(BSA)标准品
a)通过将12mL的2mg/mL白蛋白标准品(试剂#3)加入12mL提取缓冲液(EB,试剂#9)中制备1mg/mLBSA原液。
b)如下制备400μg/mL中间BSA原液:中间原液,400μg/mL=16mL 1mg/mL BSA+24mL EB。
将1mL体积等分到预标记的管中并在-80℃下冷冻直至分析那天。
c)为制备BSA标准品,进行中间原液(400μg/mL)的2倍系列稀释。每次稀释后将孔涡旋。每个标准品的500μL剩余体积足以在两个孔中运行4个板。
Std1,200μg/mL=500μL 400μg/mL+500μL EB
Std2,100μg/mL=500μL 200μg/mL+500μL EB
Std3,50μg/mL=500μL 100μg/mL+500μL EB
Std4,25μg/mL=500μL 50μg/mL+500μL EB
Std5,12.5μg/mL=500μL 25μg/mL+500μL EB
Std6,6.25μg/mL=500μL 12.5μg/mL+500μL EB
Std7,3.125μg/mL=500μL 6.25μg/mL+500μL EB
Std8,1.56μg/mL=500μL 3.125μg/mL+500μL EB
空白=500μL EB
*注意:Std 8用作校准曲线的锚点,并且将不被认为是校准
物。方法的LLOQ为3.125μg/mL。
2)制备牛血清白蛋白(BSA)测定QC
a)如下制备HQC、MQC和LQC溶液:
HQC,75μg/mL=3mL 1mg/mL BSA+37mL EB
MQC,40μg/mL=1.6mL 1mg/mL BSA+38.4mL EB
LQC,20μg/mL=800μL 1mg/mL BSA+39.2mL EB
b)将300μL的每种QC等分到预标记管中并且在-80℃下冷冻储存直至分析那天。
3)制备BCATM工作试剂。
a)将240μL BCATM试剂B与12mL BCATM试剂A/96孔板(透明的聚苯乙烯96孔平底板;Becton Dickinson目录号:#3072,或等同物)混合。
b)将孔涡旋。
4)根据板图,使用单通道电子移液器以多分配模式将50μL/孔标准品和QC一式两份加入测定板中。在添加之前,将每个管涡旋。
5)使用多管涡旋器,将样品的深孔板涡旋30秒。
6)根据板图,使用8通道电子移液器以反向移液模式将50μL/孔未知样品从深孔板单倍加入测定板中。
7)使用8通道电子移液器以多分配模式添加100μL/孔BCATM工作试剂(在步骤#3中制备的)。用塑料盖覆盖。
8)在干燥块加热器上在39℃下将板培养45分钟。(注意:测定板中的溶液的实际温度为约37℃)
9)测量光学密度:利用计算机控制的酶标仪在562nm的波长下读取所述板。使用对应的板读取软件生成数据。推荐以下酶标仪设置:
仪器参数:
模式:Endpt L1
波长:L1:562nm
自动混合:开启
数据分析:
统计计算:
在两个孔中测定标准和对照,产生两个光学密度值(OD)。OD结果记录为两个OD值的均值(平均值)。用于数据分析的回归算法是校准基准的标称浓度和平均OD值的二次拟合。
%CV(变异系数)=(标准偏差/平均OD)*100%
%偏差(仅适用于标准品和QC)=((计算的浓度-标称浓度)/标称浓度)*100%
验收标准:
1)两个孔(%CV)
介于两个OD值之间的%CV必须满足以下标准:
a)就标准品1-6和未知样品而言(如果以一式两份分析),%CV必须为≤20.0%。
b)LLOQ的%CV(标准品7,3.125μg/mL)将从验收标准中排除;参见%偏差的验收标准(部分2a)。
c)不满足这些标准的任何未知的样品将被记录为“NR”,并且必须在后续运行中重新分析。
d)在每个QC含量下,对于至少50%的测定QC而言,%CV必须为≤20.0%。对于至少67%的测定QC而言,%CV必须为≤20.0%。
2)%偏差
a)标准品:就偏差%而言,最少75%的校准物必须满足以下验收标准:
i)标准品1-6的反算浓度必须在标称浓度的20%以内(偏差±20.0%)。
ii)LLOQ(标准品7,3.125μg/mL)的反算浓度必须在标称浓度的25%内(偏差±25.0%)。标准品8(1.56μg/mL)用作校准曲线的锚点,并且将不被认为是校准物。
b)测定QC:在每个QC含量下,至少50%的测定QC值必须在标称浓度的20%内(偏差±20.0%)。至少67%的测定QC的反算浓度必须在标称浓度的20%内(偏差±20.0%)。
3)只有在方法执行期间发生记录的技术错误,并且该错误证明隐藏了一个或多个空白孔时,才允许隐藏一个或多个空白孔。
4)对于标准品1-7的每个孔而言,在平板空白校正之后的光学密度(OD)值必须≥0.001。如果在任何标准孔中的OD值小于0.001,则应当在后续运行中重新分析样品。
组胺的测量
该测定是基于:(1)US 8420054(其是指来自分层上皮且不是黏膜上皮组织的测量)以及(2)Kerr,K.,Schwartz,J.R.,Filloon,T.,Fieno,A.,Wehmeyer,K.,Szepietowski,J.C.和Mills,K.J.;Scalp Stratum Corneum Histamine Levels:Novel Sampling Method Reveals Association with Itch Resolution in Dandruff/Seborrhoeic Dermatitis Treatment,Acta Derm Venereol91:404-408,2011)。
程序
在“制备刷样品以测量糖原”的步骤6之后,将提取物转移到深孔板中。
1.将每个提取物管开盖。
2.根据板模板,将管按顺序置于MultiPROBE架中。
3.使用自动液体处理器,将上清液的等分试样(在离心步骤后,等分试样应该接近足够测量组氨所需的量,例如可以为100μL等分试样)转移到空的96孔深孔板(Axygen板)中。取决于结果,即,过高浓度的组氨,可能需要稀释上清液样品。
4.可用常规试剂诸如白蛋白补充样品,以有助于防止分析物到实验室器皿壁的损失。
5.将盖垫牢固紧固于深孔板上。
6.使用多管涡旋器将深孔板涡旋10秒。
7.在-80℃下,将深孔板冷冻,以用于将来的分析。
检测结果
1.可通过常规方法制备组胺标准品和对照物。组氨将利用组胺酶免疫测定(EIA)试剂盒(Histamine EIA Kit(美国分销商,Cayman Chem Co.#589651/Histamine EIA kit Manufacture(France),SPbio#A05890)来定量。
2.洗涤缓冲液、衍生化试剂、组胺ACHe示踪剂和Ellman试剂可以通过常规方法制备。
3.将标准品、对照和样品在深孔板中衍生化。
4.利用缓冲液和标准品洗涤所述板,将空白、样品和质量对照加入板中并且在4℃下培养24小时。
5.然后洗涤所述板,然后添加Elman试剂并且在室温下在黑暗中培养。
6.可通过标准分光光度法读板。通过标准统计方法和计算进行数据分析。
在另一个实施方案中,将从刷获得的提取物置于96孔板中。每个孔添加稳定同位素标记的组胺(Dsub.4-组胺)内标(ISTD)并用酸化水稀释。在96-孔聚丙烯板中用加入ISTD的酸化水制备一组组胺标准品,其包括合适的校准范围。使用反相梯度高效液相色谱法与串联质谱仪(HPLC/MS/MS)分析标准品和刷提取物。通过正离子电喷雾(ESI)监测组胺和ISTD。通过给信号绘图构建标准曲线,本文将其定义为每个标准品与对应标准品的组胺质量的峰面积比率(峰面积组胺/峰面积ISTD)。然后使用生成的回归公式返算在校准基准和刷提取物样品中的组胺质量。可将结果报告为组胺的质量,或者可通过除以也存在于刷提取物中的蛋白质的量将结果标准化。
细胞因子的测量
虽然本文所述的程序详细描述了白介素1α(IL-1α)和白细胞介素1受体拮抗剂(IL-1ra)的测定,但是对于其它白介素诸如IL-6、IL-8、IL-10等(不受限制)的类似测定可以类似的方式进行。
试剂
1.Bio-Plex ProTM人细胞因子IL-1α测定,Bio-Rad Laboratories,Inc.Hercules,California,USA,目录号:YF0001DVXM。试剂盒包含以下组分,其全部在2–8℃下储存:
a)人细胞因子23-Plex标准品,第II组(目录号:171-D60001),冻干的。
b)IL-1α偶合磁串珠(10X,目录号:171-B6001M),600μL
c)IL-1α检测抗体(10X),320μL
d)链霉亲和素-藻红蛋白,100X;光敏的,储存在黑暗中。
e)测定缓冲液,50mL
f)洗涤缓冲液,130mL(目录号:171-304500,1.5L)
g)检测抗体稀释剂,5mL
2.人细胞因子27-Plex标准品,第I组(目录号:171-D50001),冻干的。
3.Bio-Plex ProTM人细胞因子IL-1ra组,Bio-Rad Laboratories,Inc.,目录号:171B5002M。储存在2–8℃下:
a)IL-1α偶合磁串珠(10X,目录号:171-B5002M),600μL
b)IL-1ra检测抗体(10X),320μL
4.水,用Millipore Milli-Q过滤体系纯化;或等同物。
5.5M氯化钠(NaCl),Sigma目录号:S5150;或等同物。
6.蛋白酶抑制剂混合片,COMPLETETM,Roche Diagnostics GmbH(Mannheim,Germany),目录号:11-697-498-001。
7.磷酸盐缓冲盐水(PBS)缓冲液包,Sigma.,目录号:P3813。将1PBS缓冲液包稀释于1升水中。在室温下储存PBS溶液至多1个月。
8.牛血清白蛋白(BSA),30%Sigma,目录号:A8577;或等同物。
9.提取缓冲液(“EB”,PBS+0.25M NaCl+蛋白酶抑制剂)。制备PBS溶液(试剂#7)。将50mL 5M NaCl(试剂#6)加入950mLPBS中以制备0.25M NaCl。使用0.2μm过滤瓶过滤。向该溶液中,溶解20个蛋白酶抑制剂片(试剂#6)/1000mL。在室温下储存至多1个月。
10.细胞因子样品缓冲液(“CSB”,PBS+0.25M NaCl+蛋白酶抑制剂+2%BSA)。将2mL的30%BSA(试剂#8)加入28mL细胞因子提取缓冲液(试剂#9)中。在2–8℃下储存至多一周。
11.Bio-Rad鞘液,20L,目录号:171-000055,或等同物。
12.Bio-Rad校准试剂盒,目录号:171-203060。
设备和材料:
1.自动液体处理器,Packard MultiPROBE,Perkin-Elmer;Waltham,Massachusetts,USA,或等同物。
2.Bio-Plex悬浮液测定体系,Bio-Rad Laboratories,Inc.;或等同物。
3.Bio-Plex Workstation,Bio-Rad Laboratories,Inc.的Bio-Plex管理软件;或等同物。
4.Bio-Plex Pro II清洗站(用于基于磁性和聚苯乙烯串珠的测定),目录号:300-34377,Bio-Rad Laboratories,Inc.;或等同物。
5.超声波清洗机,Branson Ultrasonics Corporation(Danbury,Connecticut,USA);或等同物。
6.离心机,Allegra X-12R,Beckman-Coulter(Fullerton,California,USA);或等同物。
7.涡旋搅拌器,Vortex Genie-2,VWR Scientific Products Inc.,目录号:58815-178;或等同物。
8.滴定板振荡器,Lab-line Instruments,Inc.(VWR目录号:57019-0600),或等同物。
9.96-孔黑色平底微型板,目录号:171-025001,Bio-Rad Laboratories,Inc.。
10.96-孔V型底微型板,目录号:651261,Greiner Bio-One International AG(Kremsmünster,Austria);或等同物。
11.铝密封膜,目录号:PCR-AS-200,Axygen Scientific;或等同物。
12.粘合剂微型板密封膜,VWR目录号:60941-062;或等同物。
13.一次性试剂贮存器,Vista Lab,50mL,VWR目录号:802026-350;或等同物。
14.电子多通道和单通道分配移液器,具有对应的一次性移液端的手动移液器;或等同物。
15.聚丙烯微离心管,2.0mL,Bio-Plas,Inc.,San Rafael,CA,目录号:4204;或等同物。
16.微离心管,1.7mL,Sorenson BioScience,目录号:11700;或等同物。
17.聚丙烯锥形离心管(15ml,目录号:352097和50mL,目录号:352098),Becton Dickinson,或等同物。
18.Nunc 96孔2mL深孔板,VWR目录号:73520-474;或等同物。
19.密封垫96深圆孔收集板(2.0mL),目录号:AM-2ML-RD Axygen Scientific;或等同物。
20.真空过滤器单元,PES膜,0.2μm孔径,无菌,NALGENE目录号:567-0020;或等同物。
程序:
在“制备刷样品以测量糖原”的步骤6之后,将提取物转移到深孔板中。
1.将每个提取物管开盖。
2.根据板模板,将管按顺序置于MultiPROBE架中。
3.将40μL/孔的30%BSA(试剂#8)加入96孔深孔板中。
4.使用自动液体处理器,将上清液的等分试样(在离心步骤后,等分试样应该接近足够测量细胞因子所需的量,例如可以为250μL等分试样)转移到空的96孔深孔板(Axygen板)中。取决于结果,即,过高浓度的蛋白质,可能需要稀释上清液样品。
5.将盖垫牢固紧固于深孔板上。
6.使用多管涡旋器将深孔板涡旋10秒。
7.在-80℃下,将深孔板冷冻,以用于将来的分析。
测定
1)在工作台上使测定试剂、基质QC和研究样品平衡至室温(20-25℃)。
2)通过将2mL的30%BSA(试剂#8)加入28mL细胞因子提取缓冲液(试剂#9)中来制备细胞因子样品缓冲液(CSB,试剂#10)。
3)制备人细胞因子标准品。
a)利用250μL CSB重构每瓶人细胞因子标准品:组I(试剂#2)和组II(试剂#1a)。将每个小瓶温和涡旋3秒。使小瓶在冰上培养30分钟。
b)为制备工作标准品,进行组I/II标准混合物的系列稀释。每次稀释后将孔涡旋。对于工作Std 1的浓度,参考每个批次的标准值卡。
Std 1=190μL组I Std混合物+190μL组II Std混合物+215μL CSB
Std 2=150μL Std 1+450μL CSB
Std 3=150μL Std 2+450μL CSB
Std 4=150μL Std 3+450μL CSB
Std 5=150μL Std 4+450μL CSB
Std 6=150μL Std 5+450μL CSB
Std 7=150μL Std 6+450μL CSB
Std 8=150μL Std 7+450μL CSB
Std 9=150μL Std 8+450μL CSB
空白=CSB
*将标准品1从IL-1α校准曲线中排除(隐藏),并且将不认为是IL-1α的校准物。标准品2是IL-1α的方法的ULOQ(定量的上限)。
**将标准品9从IL-1ra校准曲线中排除(隐藏),并且将不认为是IL-1ra的校准物。标准品8是IL-1ra的方法的LLOQ(定量的下限)。
人细胞因子校准品浓度(pg/mL)–示例:批号:5023535、5015357
4)制备人类细胞因子测定QC
a)为制备测定QC-1(AQC-1),向900μL CSB中加入100μLStd 1,涡旋。
b)通过向900μL CSB中加入100μL AQC-1,涡旋,来制备Std1的100倍稀释液。
c)为制备测定QC-2(QC-2),向400μL CSB中加入100μL步骤4b中制备的溶液,涡旋。
5)向200μL的CSB中加入200μL每种新鲜解冻的HQC和LQC,涡旋来制备基质QC的2倍稀释液。
6)制备1X抗体固定化串珠,避光。
a)在中等速度下将所述串珠瓶涡旋30秒。将任何滞留液体从顶盖中移除。
b)将串珠稀释10倍:575μL IL-1α_串珠(试剂#1b)+575μLIL-1ra串珠(试剂#3a)+4.6ml测定缓冲液(试剂#1e);涡旋。
c)在使用之前,在室温下平衡20min。
7)制备经稀释的样品提取物。
a)样品提取物的深孔板在多管涡旋器上涡旋30秒。
b)以3000rpm将深孔板离心以移除碎片。
c)通过使用8通道移液器(反向移液模式),根据96孔板模板,将50μL样品提取物加入50μL CSB中到V型底附加板中,来制备2倍样品稀释物。
8)加载附加的板
a)使用单通道移液器(多分配模式,2×100μL),根据板模板,将100μL标准品、测定QC和经稀释的基质QC加入V型底附加板的每个孔中。
b)利用塑料板密封器密封。
9)Prime Bio-Plex Pro II清洗站。
a)利用DI水填充液体瓶2;Prime通道2。
b)将容纳足够的Bio-Plex洗涤缓冲液的液体瓶1附接到清洗站;Prime通道1。
10)将1X抗体固定化串珠加入黑色的平底测定板中。
a)以中等速度将稀释的串珠涡旋30秒。
b)将经稀释的串珠倒入试剂贮存器中并且使用8通道移液器(多分配模式)将50μL加入黑色平底板的每个孔中。
11)使用Bio-Plex Pro II清洗站将测定板洗涤两次。
a)使得板位于磁铁上15秒。
b)使用MAG X2程序将孔洗涤两次。
c)利用洗涤缓冲液–通道1冲洗一白天。
12)加载黑色平底测定板
a)将附加板在板振荡器上(300rpm)温和涡旋3秒。
b)使用8通道移液器(反向移液模式),根据板膜板,将50μL标准品、测定QC、经稀释的基质QC、和经稀释的样品提取物加入黑色平底测定板的每个孔中。
13)利用箔板密封器将测定板密封,并且在室温(20-25℃)下在板振荡器上培养40分钟。
a)利用箔粘合剂板密封器密封板以避光。
b)缓慢增加板振荡器速度直至1100rpm(速度10);振摇30秒。
c)缓慢降低板振荡器速度直至300rpm(速度3)
d)在室温(20-25℃)下在板振荡器上培养40分钟。
14)制备1X检测抗体(DAb)
a)以中等速度将10X DAb涡旋20s,之后,进行30秒快速旋转。
b)添加300μL的10X IL-1α_DAb(试剂#1c)+300μL的10XIL-1ra DAb(试剂#3b)+2.4ml检测抗体稀释剂(试剂#1g)。
15)使用Bio-Plex Pro II清洗站将测定板洗涤三次。
a)使得板位于磁铁上15秒。
b)使用MAG X3程序将孔洗涤两次。
c)利用洗涤缓冲液–通道1冲洗一白天。
16)将1X检测抗体加入黑色的平底测定板中。
a)将1X检测抗体温和涡旋3秒。
b)倒入试剂贮存器中并且使用8通道移液器(多分配模式)将25μL 1X检测抗体加入每个孔中。
17)利用箔板密封器将测定板密封,并且在室温(20-25℃)下在板振荡器上培养30分钟。
a)利用箔粘合剂板密封器密封板以避光。
b)缓慢增加板振荡器速度直至1100rpm(速度10);振摇30秒。
c)缓慢降低板振荡器速度直至300rpm(速度3)
d)在室温(20-25℃)下在板振荡器上培养30分钟。
18)制备1X链霉亲和素-PE。优选在使用之前10min,制备链霉亲和素-PEP并避光。
a)以中等速度将100X链霉亲和素-PE(试剂#1d)涡旋20秒,之后,进行30秒快速旋转。
b)将60μL的100X链霉亲和素-PE加入5.94ml测定缓冲液中。将孔涡旋。
19)使用Bio-Plex Pro II清洗站将测定板洗涤三次。
a)使得板位于磁铁上15秒。
b)使用MAG X3程序将孔洗涤两次。
c)利用洗涤缓冲液–通道1冲洗一白天。
20)将1X链霉亲和素-PE加入黑色平底测定板中。
a)以中等速度将1X链霉亲和素-PE涡旋5秒。
b)倒入试剂贮存器中并且使用8通道移液器(多分配模式)将50μL 1X链霉亲和素-PE加入每个孔中。
21)利用箔板密封器将测定板密封,并且在室温(20-25℃)下在板振荡器上培养10分钟。
a)利用箔粘合剂板密封器密封板以避光。
b)缓慢增加板振荡器速度直至1100rpm(速度10);振摇30秒。
c)缓慢降低板振荡器速度直至300rpm(速度3)
d)在室温(20-25℃)下在板振荡器上培养10分钟。
22)使用Bio-Plex Pro II清洗站将测定板洗涤三次。
a)使得板位于磁铁上15秒。
b)使用MAG X3程序将孔洗涤两次。
c)利用水–通道2的冲洗过夜。
23)将串珠重新悬浮于测定缓冲液中。
a)使用8通道移液器将120微升测定缓冲液加入每个孔中。
b)利用箔粘合剂板密封器密封板以避光。
c)缓慢增加板振荡器速度直至1100rpm(速度10);振摇30秒。
24)在Bio-Plex悬浮液测定读数器中运行板。每个区域读取50个串珠,样品体积:50μl。DD门:5,000至25,000
25)在分析第二测定板时,重复步骤3–25。
96-孔板模板
数据分析:
统计计算:
在两个孔中测定标准品,产生两个荧光强度(FI)值。使用5-参数逻辑拟合(5-PL)非线性回归曲线拟合法,将每个细胞因子的标准品的两个FI值的均值(平均值)作图并分析。从标准曲线内推每个细胞因子的浓度。
%CV(变异系数)=(标准偏差/平均FI)*100%
%偏差(仅适用于标准品和测定QC)=((计算的浓度-标称浓度)/标称浓度)*100%
%回收率(仅适用于标准品和测定QC)=(计算的浓度/标称浓度)*100%
计算的浓度=观察到的浓度;从标准曲线内推
标称浓度=预期的浓度
验收标准:
1)两个孔(%CV)
介于两个FI值之间的%CV必须满足以下标准:
a)对于每个细胞因子的至少75%的标准品,%CV必须为μ_20%(或者对于LLOQ(定量的下限)为μ_25%)。
b)对于样本,%CV必须为μ_20%(如果以一式两份运行)。不满足这些标准的任何未知的样品将被记录为“NR”,并且必须在后续运行中重新分析。
2)%偏差(%回收率)
代谢物的测量
在“制备刷样品以测量糖原”的步骤6之后,将上清液的等分试样转移到新鲜管中并冷冻至-70℃或以下,用于将来的分析。将样品运输至Metabolon,Inc.(Durham,NC)用于鉴定和量化代谢物。进行功能元件的Heirarchal图谱绘制,其包括与下列相关联的代谢物:(1)氧化应激反应(示例不限于谷胱甘肽、S-甲基谷胱甘肽、半胱氨酸、甲硫氨酸),(2)蛋白质代谢(示例不限于甲硫氨酸、N-甲酰甲硫氨酸、丙氨酰谷氨酸、苏氨酰亮氨酸),(3)糖原分解(示例不限于麦芽六糖、麦芽五糖、麦芽糖、麦芽三糖),(4)戊糖磷酸化途径或PPP(示例不限于阿糖醇、山梨醇、甘露醇),(5)炎症(示例不限于12-羟基二十碳四烯酸或12-HETE、花生四烯酸酯、亚油酸酯),烟酰胺代谢和膜成形(示例不限于磷酸胆碱、磷酸乙醇胺、甘油磷酸乙醇胺)。
除了处女膜区之外,还可使用带条收集程序,之后进行提取和分析,从阴唇区获得浅表组织样品。可将得自Cuderm的D-Squame带用于收集样品。
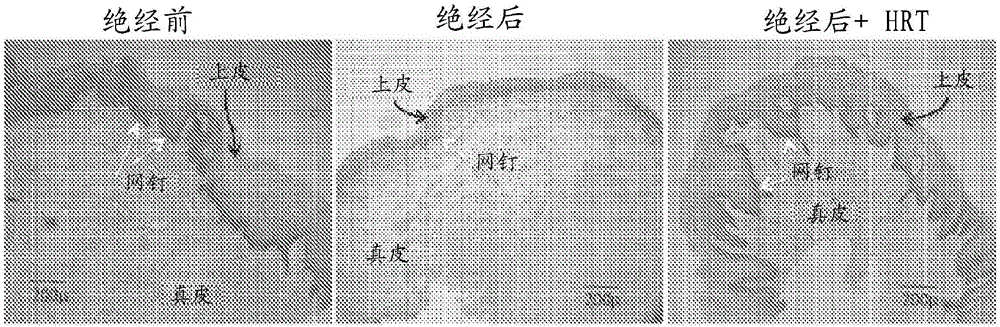
申请人已经发现阴道口的黏膜组织经历类似于阴道腔的显著变化。如图1中所示,组织学图像示出类似于阴道的阴道口处的显著解剖学和组织学变化。例如,从绝经后组获取的样品中的上皮组织相对于从绝经前组或绝经后+HRT组获取的样品看起来显著更薄。通常由糖原填充的上皮细胞是扁平的。与阴道口相关联并且受绝经状态影响的新的特征结构是网嵴或网钉的出现(由白色箭头表示)。这些是侵入真皮中并用于稳定或提供与下面真皮的强结合的上皮组织。该特征结构通常对于暴露于空气的分层鳞状上皮观察到。在绝经情况下,相对于绝经前,存在网钉的衰减或缩短/消失。在HRT治疗的情况下,上皮组织的厚度和网钉的尺寸两者均增加(绝经后+HRT图)。
在图2中,可使用下式(使用4倍或10倍放大倍数的图像,优选地10倍图像)测量上皮组织的相对厚度和网钉的相对丰度:
曲线“O”是指介于上皮组织和空气或石蜡界面之间的界面。曲线“U”是指介于上皮组织和真皮组织之间的边界。形成组织图像的边界线使得在没有网钉的区域中穿过“O”和“U”线绘制垂直线(或几乎这种线)。测定边界之间的线“O”和“U”的长度(以像素测量)。为测定网钉丰度的近似值,将“U”的长度除以“O”。形成跨“O”和“U”线绘制的附加垂直线(或几乎此类线;d1,d2,…dn),并测量上皮厚度“d”(以像素测量)。为测定上皮厚度的近似值,使用下式。
Eth=上皮厚度
O=上皮-空气界面的以像素计的测量线。
U=上皮-真皮界面的以像素计的测量线。
d1,d2,…dn=穿过上皮组织的线
类似地,申请人已发现使用转录组热图可用于确定处女膜区和大阴唇中的变化。
基因活性分析(也被称为转录组学)可对于从阴唇或处女膜区获得的活组织标本进行,以确定与绝经和治疗效果相关联的变化。转录图谱是本领域普通技术人员已知的,如Cotreau等人所示(Cotreau MM,Chennathukuzhi VM,Harris HA,Han L,Dorner AJ,Apseloff G,Varadarajan U,Hatstat E,Zakaria M,Strahs AL,Crabtree JS,Winneker RC,和Jelinsky SA.Maturitas 58:366-376,2007),其中转录图谱源自阴道活组织检查以确定雌激素的皮肤贴片对阴道萎缩的影响。其中分析数据以分级群聚从而使全局模式可视化的转录组学分析的更普遍方法可使用OmniViz 6.1.4版软件(Instem Scientific,Cambridge,UK)来进行。可使用与DAVID生物信息学资源(http://david.abcc.ncifcrf.gov)相似并且还可存在于以下参考文件中的基因本体论术语和方法来进行生物学主题分析以鉴定调节的生物过程,(1)Huang da,W.,B.T.Sherman,和R.A.Lempicki,Systematic and integrative analysis of large gene lists using DA VID bioinformatics resources.Nat Protoc,2009。4(1):第44-57页,和(2)Huang da,W.,B.T.Sherman,和R.A.Lempicki,Bioinformatics enrichment tools:paths toward the comprehensive functional analysis of large gene lists。Nucleic Acids Res 25,33892009。37(1):第1-13页。转录组图谱还可得自来自大阴唇或小阴唇的浅表上皮收集物,其得自条带。
使用Affymetrix HT 3’IVT表达盒(目录号#901253,Santa Clara,California,USA)和由Affymetrix提供的方案,将从提取的活组织标本获得的纯化RNA转换成生物素标记的cRNA副本,如在BeckmanFXp实验室自动化工作站(Beckman目录号#A31842,Beckman Coulter,Brea,California,USA)上进行的。通过有限的碱解将生物素化的cRNA片段化并且然后使用Affymetrix仪和由Affymetrix提供的方案杂交过夜至AffymetrixHG-U219阵列板。在处理之后,使用PLIER算法将芯片图像转换成数值数据,如在Affymetrix基因芯片表达控制台中所执行的。
具体地,申请人发现在对应于约22,000个基因的大约49,000个基因探针组中,可预期大约2500个探针组或约5%仅在p<0.05下是偶然显著的(t检验比较)。申请人已经发现,女性的雌激素状态(绝经前对绝经后,或绝经后对绝经后+HRT)导致基因探针表达的显著变化多于偶然性(表1)。
表1:
就在处女膜环处(上表中的阴道口)获得的样品而言,利用HRT治疗绝经后女性导致基因探针的约18%变化(其活性变化(8787/49293)),即转录活性增加或减小。就在大阴唇处获得的样品而言,利用HRT治疗绝经后女性导致约8%的基因组受到HRT显著影响(4032/49293)。当在更严格的p<0.01(t-检验比较)下过滤数据时,从绝经后对绝经前女性获得的处女膜环样品的分级基因簇分析示出共计9060个基因探针组满足该标准。维恩图分析示出(图3)在绝经后女性中增加的那些基因探针(5610个基因探针组)中,93.7%(5256个)通过HRT治疗绝经后女性逆转。在绝经后女性中减少的那些基因探针(3450个)中,97.1%(3349)通过HRT治疗绝经后女性逆转。就从绝经后对绝经前女性的大阴唇处获得的样品,和以p<0.01的相同严格性类似地过滤的数据而言,共计1620个基因探针组满足该变化标准。在绝经后女性中增加的来自大阴唇的那些基因探针(846个基因探针组)中,89.4%(756个)通过HRT治疗绝经后女性逆转。在绝经后女性中减少的那些基因探针(774个)中,84.9%(657个)通过HRT治疗绝经后女性逆转。
具体地讲,申请人已经发现,在处女膜区调节胶原相关的基因,这是与利用绝经治疗逆转的绝经相关联的变化(增加或减少)。其活性通过绝经改变并通过绝经治疗逆转的胶原相关的基因的示例包括:I型胶原蛋白、III型胶原蛋白、V型胶原蛋白、VIII型胶原蛋白、XVI型胶原蛋白、XVII型胶原蛋白、赖氨酰氧化酶、原纤蛋白、纤调蛋白、整联蛋白、硫酸乙酰肝素蛋白聚糖、组织蛋白酶L1、光蛋白聚糖、皮连蛋白、微原纤缔缔合的蛋白4、结缔组织生长因子、基质金属肽酶10。另外,衰老相关的基因类似地通过绝经萎缩治疗以及绝经前和经历阴道萎缩的那些之间的变化来调节。其它线粒体结构蛋白、核糖体RNA和与能量产生相关联的酶(包括电子传输链和细胞呼吸)类似地通过绝经萎缩治疗以及绝经前和经历阴道萎缩的那些之间的变化来调节。申请人已经发现用于评估萎缩的基因探针组的变化可限于与胶原表达相关联的基因探针。申请人已经发现用于评估萎缩的基因探针组的变化可限于细胞周期进展。
申请人已经发现经历阴道萎缩的绝经前女性对绝经后女性在其临床萎缩等级、阴道干燥度和性交疼痛等级方面不同。申请人还已经发现处女膜区处的pH与阴道腔处的pH最密切相关。申请人还已经发现,大阴唇的pH随绝经的开始增加可测量的量并且随着绝经萎缩治疗逆转。
在大阴唇、小阴唇、和/或阴道口处测试允许评估阴道萎缩,但不需要在阴道腔内插入窥器。上述方法系列允许使用下列方法来评估:pH、刷敏感性、来自刷或活组织标本的糖原水平评估、来自刷或活体组织标本的蛋白质评估、分析从活体组织标本获取的上皮细胞、使用热图、用于测定基因表达的基因活性、或它们的组合。
申请人已经发现上述方法可用于评估治疗方案之前和之后的阴道萎缩程度。
在一个实施方案中,方法系列可用于评估治疗。所述治疗可以使pH相对于萎缩降低0.1至2.0个pH单位或0.3个单位至1.5个单位。在一个实施方案中,方法系列可用于评估治疗。所述治疗可导致阴道口具有3.5至5.8个单位的pH。
在一个实施方案中,方法系列可用于通过分析阴道口处的上皮细胞和处女膜环处的网钉丰度来评估治疗。所述治疗可示出使网钉丰度增加10至100%的效果。
在一个实施方案中,分析阴道口处的上皮细胞的方法还可包括测量治疗之前和之后的处女膜上皮的厚度。治疗可示出使厚度相对于萎缩增加10至300%的效果。
在一个实施方案中,分析阴道口处糖原的方法还可包括测量治疗之前和之后的糖原量。所述治疗可示出使糖原的量增加10至300%的效果。
在一个实施方案中,分析阴道口处的蛋白质合成的组分诸如N-甲酰甲硫氨酸和/或甲硫氨酸的方法还可包括测量治疗之前和之后的N-甲酰甲硫氨酸和/或甲硫氨酸的量。治疗可示出使蛋白质合成的组分诸如N-甲酰甲硫氨酸和/或甲硫氨酸增加10至1000%的效果。
在一个实施方案中,分析阴道口处的糖原代谢的组分诸如麦芽六糖、和/或麦芽五糖、和/或麦芽三糖、和/或麦芽四糖、和/或麦芽糖的方法还可包括测量治疗之前和之后的麦芽六糖、和/或麦芽五糖、和/或麦芽三糖、和/或麦芽四糖、和/或麦芽糖的量。治疗可示出使糖原代谢的组分诸如麦芽六糖、和/或麦芽五糖、和/或麦芽三糖、和/或麦芽糖增加10至1000%的效果。
在一个实施方案中,分析糖酵解的组分诸如葡萄糖、乳酸盐和丙酮酸盐的方法。治疗可示出使糖酵解的组分诸如葡萄糖、和/或乳酸盐和/或丙酮酸盐增加10-500%的效果。
在一个实施方案中,分析阴道口处的果糖、半乳糖和半乳糖代谢的组分诸如山梨醇、甘露醇和甘露醇-1-磷酸酯的方法还可包括测量治疗之前和之后山梨醇、甘露醇、和甘露醇-1-磷酸酯的量。治疗可示出使果糖、半乳糖和半乳糖代谢的组分诸如山梨醇、甘露醇和甘露醇-1-磷酸酯降低10-200%的效果。
在一个实施方案中,分析阴道口处的蛋白质合成和蛋白质代谢的组分(包括如上所述的氨基酸和二肽)的方法还可包括测量治疗之前和之后的氨基酸和二肽的量。治疗可示出使氨基酸和二肽的量增加10-5000%的效果。
在一个实施方案中,分析阴道口处的炎症的组分诸如12-HETE、和/或花生四烯酸、和/或亚油酸酯的方法还可包括测量治疗之前和之后的12-HETE、和/或花生四烯酸、和/或亚油酸酯的量。治疗可示出使炎症的组分诸如12-HETE、和/或花生四烯酸、和/或亚油酸酯减小10至400%的效果。
在一个实施方案中,分析阴道口处基因探针活性的方法还可包括测量治疗之前和之后的转录基因探针变化。治疗可示出使总基因探针组的1至90%的转录基因探针活性增加的效果。
治疗可示出使总基因探针组的1至90%的转录基因探针活性减小的效果。
在一个实施方案中,分析处女膜环处胶原相关基因的活性的方法还可包括测量治疗之前和之后的转录变化。治疗可示出使胶原相关基因的活性增加10至400%的效果。
治疗可示出使胶原相关基因的活性减小10至400%的效果。
治疗物可以包括阴唇或阴道施用的润肤剂,其包含:雌激素化合物、异黄酮或植物甾醇、选择性雌激素受体调节剂和皮肤治疗剂(诸如但不限于烟酰胺和/或泛醇)、透明质酸、脂肪油、缓冲酸、保湿剂、以及它们的混合物。治疗物还可包括口服或皮肤递送体系,其包含雌激素。通常经由口服或皮肤给药的雌激素治疗,也被称为激素替代疗法或HRT。
在一个实施方案中,油物质选择成在110℃或120℃下具有至少约10小时、至少约14小时,或至少约18小时的油稳定性指数(“OSI”)。用于监测氧化稳定性的常用措施是随时间推移氢过氧化物的形成(过氧化物值或PV)。氧化稳定性还可以在高温下使样品通气时获得二次氧化产物所需的时间来表示。该时间(称为油稳定性指数或OSI)通常使用Rancimat仪(Brinkmann Instruments,Inc.)或OSI仪(Omnion,Inc.)在110C或20C下测量[Amer Oil Chem Soc Oil Stability Index Method Cd 12b-92]。据信,包含相对高含量的油酸的油物质在本发明的情况下趋于更稳定。在一个实施方案中,油物质包含按所述油物质的重量计至少约10%,约10%至约80%,或约15%至约70%的油酸。在一个实施方案中,所述洗剂组合物包含按所述洗剂组合物的重量计约0.0005%至约16%,约0.005%至约8%,或约0.01%至约2.4%的油酸。表现出本文所述适宜特性的适宜油物质的非限制性示例包括油酸卡诺拉油(芸苔、油菜,芜菁;特征在于具有大于70%的油酸含量,例如高油酸卡诺拉油、非常高的油酸卡诺拉油、或部分氢化的卡诺拉油)、马鲁拉仁油(伯尔硬胡桃)、棕榈油(油棕油)、棕油、棕榈硬脂、精制棕榈油、山核桃油、南瓜籽油、油酸红花油(草红花;特征在于具有大于约30%的油酸含量,和小于约50%的ω-6脂肪酸含量,例如高油酸红花油)、芝麻油(芝麻,东方大蒜芥)、大豆油(大豆,例如高油酸大豆、低亚麻酸大豆油,部分氢化的)、油酸向日葵油(向日葵;特征在于具有大于约40%的油酸含量,例如中等油酸向日葵或高油酸向日葵油)、以及它们的混合物。油酸卡诺拉油、棕榈油、芝麻油、高油酸红花油、高油酸大豆油、中等油酸向日葵油、和高油酸向日葵油是常见的育种植物衍生的油,并且还可衍生自未经基因修饰的生物体(non-GMO)。油物质的非限制性示例可从许多供应商商购获得,包括提供部分氢化的大豆油(即110W大豆油或300高度稳定大豆油)、中等油酸向日葵油(即中等油酸向日葵油)、高油酸向日葵油(即Clear高油酸向日葵油)、高油酸卡诺拉油、超高油酸卡诺拉、以及部分氢化的低芥酸油菜籽油(即Clear65高油酸卡诺拉油和Clear75高油酸卡诺拉油)的Cargill;提供高油酸卡诺拉油(即Oleocal C104)的Lambert Technology;提供马鲁拉仁油的Arch Personal Care;提供高油酸大豆油(即)的Pioneer;提供低亚麻酸大豆油的Asoyia(即Ultra Low Linolenic Soybean);以及提供精制芝麻油的Dipasa,Inc.。
皮肤处理剂还可包含辅助性皮肤处理剂,如烟酰胺、氧化锌、去氧苯比妥、泛醇等、以及它们的混合物。适宜的皮肤处理剂描述于US2003/0082219A1中。
在一个实施方案中,保湿剂通常以0.1-20%(重量/重量),优选地1-15%(重量/重量),且更优选地2-12%(重量/重量)的质量存在。合适的保湿剂为,例如氨基酸、吡咯烷酮羧酸、乳酸及其盐、乳糖醇、尿素和尿素衍生物、尿酸、葡糖胺、肌酸酐、胶原的裂解产物、脱乙酰壳多糖或脱乙酰壳多糖盐/衍生物,并且具体地多元醇和多元醇衍生物(例如乙二醇、丙二醇、丁二醇、戊二醇、己二醇、赤藓糖醇、1,2,6-己三醇、聚乙二醇诸如PEG-4、PEG-6、PEG-7、PEG-8、PEG-9、PEG-10、PEG-12、PEG-14、PEG-16、PEG-18,PEG-20,PEG-135、PEG 150)、糖和糖衍生物(例如果糖、葡萄糖、麦芽糖、麦芽糖醇、甘露糖醇、肌醇、山梨醇、山梨醇硅烷二醇、蔗糖、海藻糖、木糖、木糖醇、葡萄糖醛酸及其盐、乙氧基化山梨醇(Sorbeth-6、Sorbeth-20、Sorbeth-30、Sorbeth-40)、蜂蜜和氢化蜂蜜、氢化淀粉水解物、以及氢化小麦蛋白的混合物、水解乳蛋白、卵磷脂、植烷三醇、透明质酸及其盐、和PEG-20-乙酸酯聚合物。特别优选的保湿剂是甘油、甘油二酯和甘油三酯。
在一个实施方案中,雌激素物质通常以0.001-10%,优选的0.01-8%,更优选的0.05-5%的量存在。合适的雌激素物质是雌二醇、雌酮和雌三醇。
植物甾醇表示从植物中提取的物质。代表性成分可包括甾族和非甾族结构,两者均具有甾体化合物样生物活性。甾体物质的示例包括植物油衍生的甾体化合物,即谷甾醇、豆甾醇和菜油甾醇。非甾体结构包括异黄酮、黄酮、和香豆酸。异黄酮(其包括染料木黄酮、黄豆苷原、芒柄花黄素和牛尿酚)已经被鉴定为与下列相关联的症状的有用治疗剂:绝经和停经期前症候(1996年3月12日授予GORBACH的美国专利5498631)、抑郁症和痴呆(1998年3月31日授予GORBACH的美国专利US 5733926,2000年7月4日授予GORBACH的美国专利US 6083526)、皮肤皱纹(2000年5月9日授予GORBACH的美国专利6060070)、以及癌症(授予NOVOGEN的WO 2004022023)。
在一个实施方案中,异黄酮物质通常以0.001%至约40%的异黄酮,优选的0.001%至约4%,更优选的0.01%至约2%异黄酮的量存在。异黄酮可以选自大豆异黄酮、三叶草异黄酮、染料木黄酮、黄豆甙原、芒柄花素、鹰嘴豆素A、S-牛尿酚、R-牛尿酚或模拟植物提取物。所谓模拟植物提取物,在本申请上下文中是指能够模拟所识别的异黄酮作用的任何植物提取物。
在一个实施方案中,所述方法系列中的一种或多种方法可被包括在用于评估阴道萎缩治疗方案的功效的试剂盒中,该试剂盒包括治疗前评估方法;施用于大阴唇、小阴唇、阴道口、阴道或它们的组合的局部治疗;用于阴道萎缩的治疗后评估方法;以及确定阴道萎缩的治疗前评估和治疗后评估之间的差异以评估局部治疗的总体效果的方式。治疗前评估方法和治疗后评估方法可以为用于评估阴道萎缩的任何上述方法中的一种或多种,其包括但不限于:测量大阴唇、小阴唇、阴道口或它们的组合处的pH;测定阴道口处的刷敏感性;评估阴道口处的糖原;阴道口处上皮细胞的活组织检查分析;评估阴道口处测试的蛋白质;在大阴唇或小阴唇处的转录组热成像;或评价对大阴唇、小阴唇、阴道口、阴道或它们的组合的基因表达。
试剂盒还可包括与评估方法组合使用的一种或多种吸收制品。如本文所使用的,吸收制品可包括女性卫生制品、女性卫生垫、阴唇间制品、女性卫生衬里、成人失禁垫、成人失禁裤、成人失禁尿布、无菌纱布、湿擦拭物、和伤口敷料。
本文所公开的量纲和值不应理解为严格限于所引用的精确数值。相反,除非另外指明,否则每个这样的量纲旨在表示所述值以及围绕该值功能上等同的范围。例如,公开为“40mm”的量纲旨在表示“约40mm”。
本文所公开的作为范围端值的数值不应被理解为严格限于所引用的精确值。相反,除非另外指明,每个数值范围均旨在表示所引用的值和所述范围内的任何整数。例如,公开为“1至10”的范围旨在表示“1,2,3,4,5,6,7,8,9和10”。
在发明详述中引用的所有文件都在相关部分中以引用方式并入本文中。对于任何文件的引用不应当解释为承认其是有关本发明的现有技术。当本发明中术语的任何含义或定义与以引用方式并入的文件中术语的任何含义或定义矛盾时,应当服从在本发明中赋予该术语的含义或定义。
虽然已经举例说明和描述了本发明的具体实施方案,但是对于本领域的技术人员来说显而易见的是,在不脱离本发明的实质和范围的情况下可做出多个其它改变和修改。因此,本文旨在于所附权利要求中涵盖属于本发明范围内的所有这些改变和变型。
- 还没有人留言评论。精彩留言会获得点赞!