用于在血管手术期间感测、测量和/或表征血管和/或病变顺应性和/或弹性变化的方法、装置和系统与流程
Victor L.Schoenle,美国公民,居住在Greenfield,Minnesota
Thomas B.Hoegh,美国公民,居住在Edina,Minnesota
Bruce J.Persson,美国公民,居住在Shoreview,Minnesota
Kayla Eichers,美国公民,居住在Minneapolis,Minnesota
Matthew Tilstra,美国公民,居住在Rogers,Minnesota
Richard C.Mattison,美国公民,居住在Zimmerman,Minnesota
Joseph P.Higgins,美国公民,居住在Minnetonka,Minnesota
Michael J.Grace,美国公民,居住在Brooklyn Park,Minnesota
Matthew Saterbak,美国公民,居住在Robbinsdale,Minnesota
Matthew D.Cambronne,美国公民,居住在Mounds View,Minnesota
Robert E.Kohler,美国公民,居住在Lake Elmo,Minnesota
相关申请的交叉引用
本申请是2014年6月26日提交的题为“Devices,Systems and Methods for Locally Measuring Biological Conduit and/or Lesion Compliance,Opposition Force and Inner Diameter of a Biological Conduit”的申请序号14/315,774的部分继续申请,并且进一步要求2014年7月18日提交的题为“Magnetic Carrier Wave Sensor and RF Emitter and Sensor in Atherectomy Procedures”的申请序号62/026,288和2014年8月22日提交的题为“Devices,Systems and Methods for Performing Vascular Procedure(s)with Integrated Fractional Flow Reserve”的申请序号62/040,598以及2014年10月9日提交的题为“Devices,Systems and Methods for Performing Vascular Procedures with Integrated Intravascular Ultrasound Lesion and Vessel Compliance Measurement”的申请序号62/061,883以及2015年2月23日提交的题为“Magnetic Carrier-Chord Method”的申请序号62/119,635的优先权,通过引用将这些中的每个的全部内容并入本文中。
技术领域
本发明一般地涉及在血管手术(vascular procedure)期间使血管内的病变可视化、表征病变组成、测量血管直径和/或感测、测量并表征血管和/或病变顺应性和/或弹性变化。
背景技术:
已经开发了多种技术和仪器以便在去除或修复动脉和类似人体通路(例如,生物导管)中的组织时使用。此类技术和仪器的常见目标是去除患者的动脉中的动脉粥样硬化斑块。动脉粥样硬化的特征在于患者的血管的内膜层(在内皮下面)中的脂肪沉淀(动脉粥样化)的积聚。随时间推移,最初作为相对软的富胆固醇的动脉粥样化物质而沉淀的东西常常硬化成钙化的动脉粥样硬化斑块。此类动脉粥样化限制血液的流动,并且因此常常称为狭窄病变或狭窄,阻挡物质称为狭窄物质。如果未予治疗,此类狭窄可以致使心绞痛、高血压、心肌梗塞、中风等。
受试者生物导管(例如,血管)的顺应性和/或弹性以及导管(例如,血管)内的病变的顺应性和/或弹性是血管手术期间的关键元素,所述血管手术例如不限于诸如旋切术(旋转或其它旋切过程)、消融、血管成形术、支架植入术或生物血管支架术(biovascular scaffolding)。
使用血管内超声波(IVUS)或光学相干断层成像(OCT)技术的受试者导管的成像是已知的。IVUS可以涉及到插入承载一个或多个超声波换能器的可操纵IVUS装置(例如,导管或引线)以使导管和其中的病变(如果存在的话)可视化并进行评定。IVUS成像过程可以在特定血管手术之前、期间和/或之后发生。通过参考美国专利号5,771,895;美国申请2005/0249391;美国申请2009/0195514;美国申请2007/0232933;以及美国申请2009/0284332可以找到关于IVUS成像的更多信息,其中的每一个的内容被整体地通过引用结合到本文中。IVUS超声波换能器可以被安装在导线、导管和/或其它可操纵插入式血管内工具上以使得能够使导管、病变(当存在时)可视化、评估导管的直径以及提供用于评定病变的类型和/或组成以及血管手术的进展的信息,包括关于手术完成的信息。此类成像数据可以与诸如机能数据之类的其它数据相组合地使用。
还可以使用已知技术来获得关于导管和/或其中的病变的机能数据。例如,已知要测量压降—速度关系(诸如血流储备分数(FFR)或冠状动脉血流储备(CFR))以获得关于导管条件和由于病变或其它堵塞介质而引起的阻塞程度的信息。例如可以使用如本领域中已知的安装在导线上的压力传感器来获得FFR测量结果。因此,可以例如在导管内的感兴趣区域的近侧且在没有限制的情况下接近于病变且在感兴趣区域(例如,病变)的远侧获取压力测量结果,以确定所采用的血管手术的严重性和状态。
此外,可以使用可膨胀装置(例如,气囊)在受试者导管和/或其中的病变内来获得机能数据。已知可膨胀装置具有结合在其上面的压力传感器,具有压力水平和膨胀速率的手动测量和控制。在某些情况下,使用注射器和关联压力计来使可膨胀装置膨胀和/或收缩。在已知解决方案中,气囊膨胀装置是手持式装置,其包括螺旋驱动注射器,具有指示气囊在操作期间所处于的膨胀压力的压力计。操作员可以手动地旋转螺钉至期望的膨胀压力。操作员然后必须直观地估计装置有多好地接触血管的壁并将装置与血管(例如,动脉)匹配。每当操作员要求血管与装置符合性的可视化时,必须给患者注射造影剂流体,随后产生x射线底片以使得能够实现可视化。可视化过程是不期望的,因为其是费时的,并且要求有害的药物和x射线。
这些已知系统或测量过程中没有一个能够准确地测量导管的顺应性或弹性。
血管顺应性和弹性是重要的生理参数。针对顺应性,当血管中的压力增加时,在血管中发生体积增加。动脉和静脉响应于压力而拉伸的趋势对输注和血压具有很大影响。这在物理上意指具有较高顺应性的血管响应于压力或体积条件的变化而比较低顺应性的血管更容易变形。
顺应性是生物导管(例如,血管)随着跨壁压增加而扩张并增加体积的能力或者生物导管(例如,血管)在施加扩张或压缩力时对朝着其原始尺寸的弹回进行抵抗的趋势。其是“弹性”的倒数。因此,弹性是生物导管(例如,血管)在扩张或压缩力去除时朝着其原始尺寸弹回的趋势的度量。
健康血管的顺应性取决于两个因素:(1)初始血管形状;以及(2)血管组成部分,其包括血管平滑肌、胶原质、弹性蛋白及其它间隙元素。体积与压力关系是非线性的,这进而意味着不存在可以用来呈现血管顺应性的单个参数。
系统化动脉硬度例如是由于心室射血的脉动效应而引起的示例性动脉的总体障碍物。压力曲线被用来估计硬度。动脉硬度的局部评定是在具有生理重要性(诸如动脉心外血管和肢体)的动脉区域处完成的。在反映的壁硬度下测量硬度的局部评定。
因此,用于导管(例如,血管)的顺应性是在外加压力下变形的能力。在物理上,其是硬度的倒数。因此,可以将顺应性表示为在考虑中的内腔的面积、直径或体积中的一个或多个的变化除以作用于内腔上的内部压力或力的变化。心动周期期间的顺应性是用于单位长度的血管的横截面面积的变化和动脉压力的变化,其通常被量化为心脏收缩压与心脏舒张压之间的差。因此,顺应性是给定压力下的体积—压力曲线的斜率。换言之,顺应性是体积—压力曲线的切线的斜率。通过将顺应性(体积(或面积)变化/压力变化)除以导管(例如,血管)直径而获得归一化顺应性以消除血管尺寸的影响。
用于动脉和静脉的体积—压力关系(即,顺应性)在不仅确定阻塞的严重性、而且还有特别地病变的组成和/或类型(当存在时)、血管手术(例如,旋切术)的发展的评定以及血管手术(诸如旋切术)到达终点或结束的确定时是非常重要的。已知的是顺应性在较高压力和体积下减小(即,在较高压力和体积下血管变得“较硬”)。
尽管有这些领域中的已知能力,在受试者导管的顺应性或特别位置(例如,阻塞位置)处的导管(例如,血管)内的病变的顺应性的量化中仍存在未满足的需要。例如,在血管手术之前、期间和/或之后必须知道导管和/或病变的顺应性。
技术实现要素:
本系统在各种实施例中针对用于感测、测量和评估身体导管中的顺应性的方法、装置和系统。在其它实施例中,所述方法、装置和系统感测、测量、确定、显示和/或解释身体导管和/或身体导管内的病变中的顺应性。在所有实施例中,感测、测量、确定、显示和/或解释可以发生于在身体导管内执行的手术之前、期间和/或之后。示例性导管包括血管,并且示例性手术包括血管手术,诸如旋切术、血管成形术、支架植入术和/或生物血管支架术。
附图说明
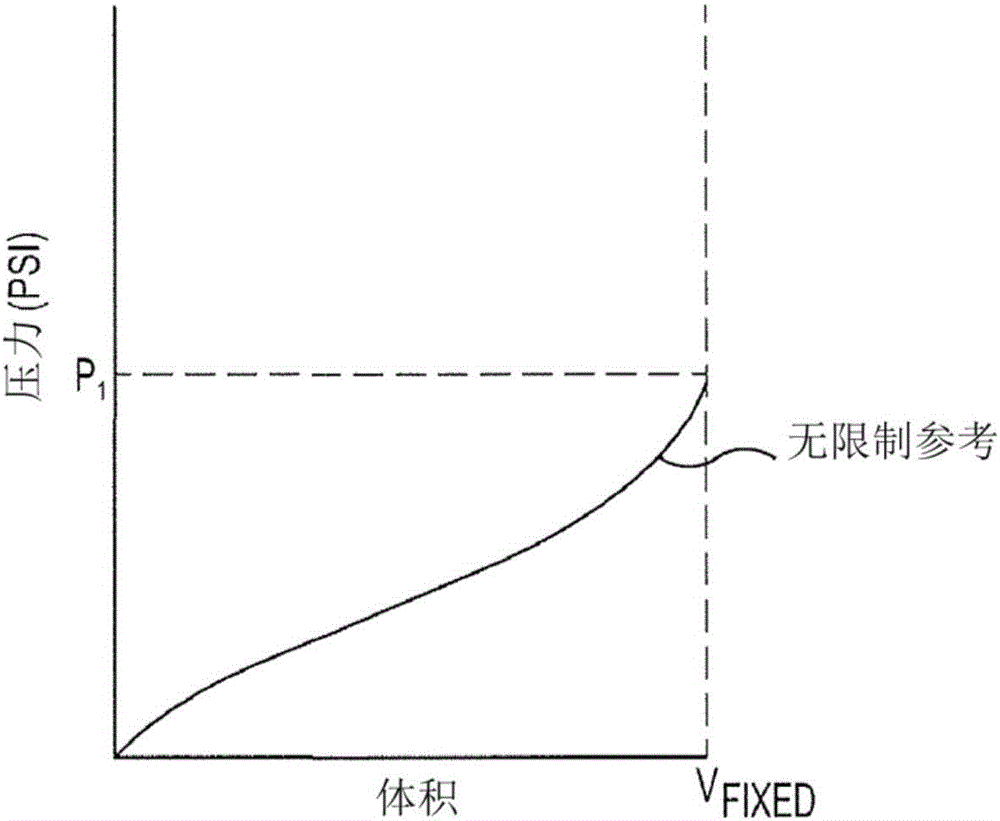
图1图示出用于具有固定膨胀体积和固定膨胀速率的无限制气囊的参考膨胀顺应性曲线(无限制参考);
图2图示出图1的参考顺应性曲线与来自健康生物导管(例如没有病变的血管)内的在限制条件下具有相同的固定膨胀体积和膨胀速率的相同气囊的膨胀顺应性曲线(限制参考)之间的差;
图3图示出具有相同固定膨胀体积和速率的被与来自图1的无限制气囊参考曲线和来自图2的限制健康生物导管参考曲线数据相比较的阻塞血管治疗前(限制)生物导管(例如具有病变的血管)的膨胀顺应性曲线;
图4图示出具有相同固定膨胀体积和速率的被与来自图1的无限制气囊参考曲线和来自图2的限制健康血管参考曲线数据相比较的阻塞血管治疗后(限制)生物导管(例如具有病变的血管)的膨胀顺应性曲线;以及
图5图示出本发明的装置和系统的一个实施例。
图6图示出用于流速、压力以及阻力的波形。
图7图示出在操作中的现有技术装置的部分剖视图。
图8图示出本发明的一个实施例的侧面剖视图。
图9图示出本发明的一个实施例的侧面剖视图。
图10图示出本发明的一个实施例的侧面剖视图。
图11A图示出本发明的一个实施例的侧面剖视图。
图11B图示出关于本发明的两个变量之间的图形关系。
图12A图示出本发明的一个实施例的侧面剖视图。
图12B图示出由本发明的一个实施例随时间推移而生成和检测的信号。
图12C图示出本发明的载波信号的图形峰到峰量值(peak to peak magnitude)。
图13A图示出本发明的一个实施例所采取的示例性轨道。
图13B以图形方式图示出由图13A的实施例生成和检测的检测峰到峰信号。
图14图示出本发明的实施例。
图15A图示出用于本发明的实施例的移动矢量。
图15B图示出用于本发明的实施例的检测位置的密度。
图16图示出本发明的磁载波的一个实施例。
图17A图示出用于本发明的一个实施例的轨道。
图17B图示出用于本发明的一个实施例的轨道。
图18A图示出用于本发明的一个实施例的轨道。
图18B图示出用于本发明的一个实施例的轨道。
图18C以图形方式图示出本发明的磁载波的一个实施例。
图18D以图形方式图示出本发明的磁载波的一个实施例。
图19图示出具有本发明的磁载波的图形表示本发明的一个实施例。
图20图示出身体外面的传感器阵列的一个实施例和本发明的自旋磁体的一个实施例的剖视图。
图21图示出用于本发明的一个实施例的位置估计。
图22图示出本发明的一个实施例的回转。
图23图示出用于估计内腔直径的本发明的一个实施例。
图24图示出用于估计内腔直径的本发明的一个实施例。
图25图示出用于估计变化条件下的内腔直径的本发明的一个实施例。
图26图示出用于估计内腔直径的本发明的一个实施例。
图27以图形方式且以数学方式图示出用于处理移动伪像的本发明的一个实施例。
图28图示出用于估计内腔直径的本发明的多个实施例。
具体实施方式
虽然本发明可修改为多种改型和替代形式,但是已经在附图中以示例的方式示出其特定细节,并将在本文中进行详细描述。然而,应理解的是并不意图使本发明的各方面局限于所描述的特定实施例。相反地,意图涵盖落在本发明的精神和范围内的所有修改、等价物以及替换方案。
本系统在各种实施例中针对用于在血管手术的执行之前、期间和/或之后感测、测量、确定、显示和/或解释生物导管中的顺应性的方法、装置和系统,所述血管手术诸如旋切术,在没有限制的情况下包括旋转旋切术、消融、血管成形术、支架植入术和/或生物血管支架术。
在各种实施例中,本发明进一步针对用于在血管手术的执行之前、期间和/或之后感测、测量、确定、显示和解释生物导管和/或生物导管内的病变中的顺应性的方法、装置和系统,所述血管手术诸如旋切术,在没有限制的情况下包括旋转旋切术、消融、血管成形术、支架植入术和/或生物血管支架术。
示例性生物导管可以包括血管,诸如动脉,并且示例性血管手术可以包括旋转旋切术。
图1图示出使用无限制气囊和具有固定膨胀速率的固定膨胀体积的无限制参考顺应性曲线的发展。因此,记录了由在操作上被附着到气囊且如稍后将讨论的换能器测量的压力并在y轴上绘图,同时记录了在膨胀过程期间向气囊增加的体积并在x轴上绘图。总体积是固定的(V-Fixed),如膨胀速率一样。在膨胀过程期间在没有气囊(诸如血管壁)上的任何限制性力的情况下完成此过程。
结果是用于特定气囊或具有特定的一组特性(例如,尺寸、形状、弹性)的气囊的参考顺应性膨胀曲线。由于气囊是无限制的且体积和膨胀速率两者是固定的,所以可以测量并记录纵贯整个膨胀过程的气囊的外径(OD),即,可以将膨胀过程中的任何点处的无限制气囊的OD映射到特定的一组压力、体积坐标数据。连同压力和体积数据一起记录OD数据以供未来参考。OD数据可以用来量化气囊在其内部扩张的任何生物导管(例如,血管)的内径,如下面进一步描述的。
图2图示出使用具有与用来发展图1的无限制气囊顺应性曲线的相同的物理性质以及被用于图1的无限制参考顺应性曲线的相同固定体积和膨胀速率的气囊的限制健康生物导管(例如血管)参考顺应性膨胀曲线的发展。其余公开参考在本文中被宽泛地定义为哺乳动物体内的具有边界或壁的通道的更宽泛种类生物导管内的血管的子集。此参考仅仅是为了便于公开而不意图使本公开以任何方式局限于血管。针对由以固定膨胀速率输注到限制气囊中的固定体积而捕捉、记录并用图形描绘关于由操作附着的压力换能器测量的压力的限制健康血管参考顺应性曲线信息。
图2还包括用于如被用于限制参考顺应性曲线数据生成的相同气囊或者具有相同物理性质的气囊且用于相同固定体积和膨胀速率的无限制参考顺应性曲线数据。
在图2上出现多个显著特征。首先,随着达到固定体积,很明显在无限制参考内测量的压力处于P1,低于处于P2的在限制参考内测量的压力。这是对膨胀的限制的效应。同样地,还可以监视给定压力下的体积变化。
另外,从原点开始跟随数据,到达分歧点,在那里限制参考开始经历比无限制参考更高的压力。此分歧点在图2上被标记为ID-healthy,并且表示在该处限制气囊以在其内进行扩张的健康血管壁的形式遭遇阻力的扩张点。换言之,扩张的气囊首先由于扩张气囊遭遇健康血管壁的内径而在ID-Healthy处经历反向力。因此,现在可以通过将图2的顺应性曲线与图1的无限制参考顺应性曲线相比较并定位被标记为ID-Healthy的分歧点来确定扩张气囊的位置处的血管的内径。接下来,对与沿着图1的无限制参考顺应性曲线的给定体积和压力相对应的先前映射的一组OD进行参考并如上所述地确定ID-Healthy处的限制健康血管参考气囊的外径。ID-Healthy处的限制健康血管参考气囊的外径与健康血管壁的内径相同。
此外,本发明使得能够将本文中定义的量测量为反向力,即由血管壁抵靠着扩张气囊施加的力,图1的无限制参考气囊未经历的力。这在上文所讨论的分歧点ID-Healthy之后的无限制参考顺应性曲线与限制参考顺应性曲线之间用各图2中的阴影区域以图形方式图示出。可以通过使用压力值将反向“力”量计算为力的替代物。例如,在图2中,在V-Fixed处,可以将反向力表征为ΔP或P2-P1。此计算可以针对任何给定体积在膨胀过程中的任何点处完成。替换地,可以通过将用于超过分歧点的任何点处的限制和无限制参考顺应性曲线的压力除以膨胀气囊的表面面积(已知和/或可测量量)并计算限制参考力与无限制参考力之间的差而将膨胀过程内的任何给定体积下的压力转换成实际的力。更加替换地,可以使用已知数学技术来计算超过分歧点的限制参考顺应性曲线与无限制参考顺应性曲线之间的面积以便计算总的反向力。
此外,可以在其中限制参考血管内的压力达到上文所讨论的分歧点ID-Healthy的点处开始,基于与无限制参考顺应性曲线的斜率相比的限制参考顺应性曲线的斜率(即与体积变化相比的压力变化)来测量该限制参考顺应性曲线血管的弹性或顺应性。与无限制参考顺应性曲线相比的限制参考顺应性曲线的斜率越陡,限制参考气囊在其内部扩张的限制血管的弹性或顺应性越低。相反地,与无限制参考顺应性曲线相比对于限制顺应性曲线而言不那么陡的斜率指示顺应性或弹性更高的血管。请注意,在这种情况下,限制参考血管是健康的,并且因此顺应性测量仅针对血管而不是其中的病变。可以通过比较给定压力下的体积变化来测量和/或量化顺应性或弹性。替换地,可以通过比较给定体积下的压力变化来量化顺应性或弹性。可以使用斜率比较来评估这些方法中的任一个。
还注意到可以在被阻塞的相同血管中但是在相对健康的区段中生成患者体内的限制健康血管参考顺应性曲线。替换地,可以使用患者体内的另一类似血管来生成参考数据。更加替换地,可以使用已知弹性的套管来执行实验室测量以便构建增量体积、输注速率和针对增量弹性的套管而匹配测试矩阵中的那些变量的参考库。在本文中,将弹性定义为顺应性,并且可以可互换地使用两个术语。一般地,弹性或顺应性是血管或套管随着增加的体积和结果产生的压力增加而适应、即在内径方面增加的能力。注意直径和体积的增加是用于面积的代理。因此,可以将顺应性表示为相比于压力变化而言的面积变化。所有这些参考库数据可以出于实际工作手术(诸如旋切手术、支架输送和经导管主动脉瓣置换(TAVR))期间的比较的目的而被存储在可访问的数据库中以使得操作员能够确定针对受试者生物导管的内径变化、反向力变化和/或顺应性(即弹性)的手术的实时进展和充分性。简而言之,本发明可以单独地或者与期望关于导管的内径及其变化、反向力变化和导管和/或病变(当存在时)的顺应性的数据的任何手术相组合地使用。
已知的是健康的动脉例如当经受约100mm的压力时具有约5至7%的顺应性或弹性。这一般地是健康动脉适应体力活动的极端条件(即从睡眠至艰苦的锻炼)下的压力和体积变化所需的范围。因此,具有健康顺应性的血管在压力和/或体积增加期间将经历内径的变化。因此,在血流体积由于较大通道而也增加时就增加的压力而言缓解了体积的增加。相反地,缺少健康顺应性的血管将抵抗响应于压力和/或体积的增加而引起的内径适应的变化。因此,不健康的血管可以在体积变化期间保持静态的直径,其迫使压力达到潜在地不健康的水平。
除由于阻塞物质而具有小于正常的内径之外,具有阻塞的血管还可以显示出这些非顺应性质。可以采用用以去除阻塞的手术(例如,旋转和/或轨道旋切术)来增加先前部分地或完全阻塞的位置处的血管的内径以及去除黏着到血管的内壁的可以对顺应性或弹性的失去有所贡献的物质。
此外,在某些情况下,可以在没有另外使用限制健康血管参考顺应性曲线的情况下将无限制参考顺应性曲线用于针对测试数据的分析比较。在其它情况下,可以在没有另外使用无限制顺应性曲线的情况下将限制参考顺应性曲线用于针对测试数据的分析比较。在其它情况下,可以使用无限制参考顺应性曲线和限制健康血管参考顺应性曲线来针对测试数据进行比较。参考顺应性曲线数据(无论是限制还是无限制)可以被表格化并存储在数据库中和/或外部装置(诸如可编程计算机或类似装置)的存储器中。此数据因此可以出于比较的目的被访问,如在本文中将讨论的。在所有情况下,本发明可以用来量化生物导管(例如,血管)和/或导管内的病变的顺应性。
现在转到图3,与上文所讨论的限制和无限制参考顺应性曲线相组合地将用于测试阻塞血管的顺应性膨胀曲线图示为限制的(治疗前)。治疗前指的是例如存在阻塞且去除过程或治疗尚未发生。采用与参考顺应性曲线中的一者或两者(当使用无限制和限制顺应性曲线两者时)气囊匹配的气囊以及一起采用用来生成所使用的参考顺应性曲线的相同固定体积和膨胀速率参数。可以如所示地使用无限制参考顺应性曲线和/或限制参考顺应性曲线。在某些实施例中,如上文所讨论的,参考顺应性曲线可以被预先存储在计算装置的数据库和/或存储器中并且在如图3中的测试数据的生成期间是可访问的以用于比较分析。
限制治疗前血管数据的分析在比较限制和无限制参考顺应性曲线时可以以如上文所讨论的类似的方式进行。用于测试限制治疗前血管的给定体积下的压力的分歧点在比限制健康血管参考或无限制参考顺应性曲线更小的体积下发生。此分歧点被标记为ID-pre,并且指示如从限制健康血管参考顺应性曲线和无限制参考顺应性曲线导出的用于限制治疗前血管的内径。ID-pre在图形上小于ID-healthy。数据还指示无限制健康参考顺应性曲线的内径的相对尺寸,其被标记为如与无限制参考顺应性曲线相比的给定体积下的其压力分歧所指示的ID-healthy。因此,现在可以在健康血管内径与如在图3中以图形方式所示很明显小于健康血管内径的限制治疗前血管内径之间进行比较。用于确定测试血管的内径的方法是用对针对如上文所讨论的用于无限制参考顺应性曲线的任何给定体积和压力而产生的OD表格的比较和参考来完成的。由于测试和无限制参考气囊具有相同的物理特性,并且在具有相同固定体积的情况下被以相同的膨胀速率填充,所以两个气囊的外径将是相同的,只要在曲线图上尚未到达分歧点ID-pre即可。这指示尚未遇到血管壁,并且因此不向扩张测试气囊施加反向力。如上文所讨论的,壁的内径是根据分歧点ID-pre确定的,在该处扩张的气囊遇到壁。用于测试血管和健康参考血管的相对内径和给定体积下的相对压力的容易且实时的图形可视化重要的是使得手术操作员能够看到测试位置就内径而言与类似的健康血管相比有多不同。另外,操作员可以容易地看到测试和参考曲线之间的面积和曲线的相对斜率并直观地确定顺应性或弹性以及反向力度量。替换地,用于计算每个前述度量的可执行指令可以被存储在可编程计算装置的存储器中并可被与存储器通信的处理器执行以便在显示装置上显示。
因此,还可以进行来自图3的限制健康血管顺应性曲线的限制治疗前血管压力的超过分歧点ID-pre的任何点处的相对测量压力的比较。很明显,限制治疗前血管压力P3在超过分歧点的任何给定体积下高于限制健康参考顺应性曲线的压力P2或无限制顺应性曲线的压力P1。
此外,现在可以将用来生成用于限制治疗前血管的顺应性曲线的气囊的反向力被量化为超过那些顺应性曲线的分歧点ID-Healthy的限制治疗前顺应性曲线与限制参考顺应性曲线之间的面积。替换地,反向力可以是在ID-Healthy的任何点处的限制测试顺应性曲线与限制健康血管参考曲线之间的任何给定体积下的ΔP。
此外,可以通过将图3的限制治疗前顺应性曲线的斜率与限制健康参考顺应性曲线的斜率相比较来测量包括阻塞且被用来生成该限制治疗前顺应性曲线的血管和/或其中的病变的弹性或顺应性。如将预期的,治疗前血管和/或病变随着增加的体积具有比限制健康参考血管更高的压力变化的斜率。这指示与参考血管相比的由于病变的存在而引起的治疗前血管中的弹性或顺应性的损失程度,并且可以在沿着用于给定体积的顺应性曲线的任何点处计算。
图4类似于图3,只是现在测试顺应性曲线是来自阻塞物质中的某些或全部被去除或者经历了另一手术以增加内径和/或顺应性的血管(即,是“治疗后”的)。因此,可以随着使用相同的气囊或者具有类似物理性质、相同固定体积和相同膨胀速率的气囊来生成每个顺应性曲线而比较限制(治疗后)顺应性曲线、限制(治疗前)、限制健康参考顺应性曲线和无限制顺应性曲线的压力。
因此,限制治疗后顺应性曲线的压力P4被图示为在超过ID-post处的相关分歧点的任何给定体积下略微高于在限制参考健康血管内产生的顺应性曲线压力P2,并且仍高于由无限制参考顺应性曲线生成的压力P1。包括来自图3的用于限制治疗前的顺应性曲线以便在比较ID-Healthy处的分歧点之后的给定体积下的其压力P3时使用。
除相对压力数据之外,本发明还允许将限制治疗前(ID-pre)、限制治疗后(ID-post)和健康参考血管(ID-Healthy)的内径(由相关分歧点)进行量化。如可能预期的,ID-healthy略大于限制治疗后内径,而ID-post和ID-healthy明显大于ID-pre,指示出成功的手术至少在进行中。
可以在阻塞去除手术或者被设计成增加血管的直径和/或其顺应性以便使得能够实现如上文所讨论的图形比较和显示的其它手术期间实时地捕捉测试数据。在图4的数据的情况下,操作员可以确定可能需要其它旋切术、血管成形术或其它手术,因为实时数据指示ID-healthy仍大于ID-post,用于限制治疗后顺应性曲线的反向力大于健康血管参考顺应性曲线。此外,如由限制治疗后顺应性曲线的斜率的相对陡峭度确定的其顺应性或弹性可以小于限制健康血管顺应性曲线,从而提供关于治疗后的血管和/或病变的顺应性的数据。
如上文所讨论的,顺应性曲线的图形显示以及(在替换实施例中)内径、反向力和/或顺应性/弹性度量的计算和显示在确定需要什么附加工作(如果有的话)以优化阻塞去除或其它类似手术时对操作员是很大的辅助。
可以使用多种装置来实现上述方法的功能。所需元件包括已知弹性或顺应性的气囊、能够注入已知且固定体积的流体以使气囊以已知且固定的速率膨胀的装置(例如,注射器)、与膨胀的气囊可操作地通信且相连以随着气囊膨胀而测量气囊所经历的压力的压力传感器。在图5中图示出一个此类示例性系统。图示出能够使注射器的柱塞以固定速率平移的示例性线性马达。提供恒定的已知膨胀速率的替换手段也是已知的且在本发明的范围内。注射器充满用于使气囊膨胀的已知且固定体积的流体。压力换能器与气囊可操作地通信并相连以测量并显示和/或记录压力数据以及相应体积数据。
在某些装置中,可以使用如本领域中已知的无线控制装置来控制线性马达或者提供恒定且已知的膨胀速率的其它手段。
操作员还可以向计算装置中输入数据,例如可以选择预选的期望反向力并输入到计算装置中。结果是气囊到所选反向力的自动膨胀。
装置还可以具有学习并存储用于各种气囊和装置的顺应性曲线轮廓以便在后续手术期间便于访问的能力。
可以采用替换装置和/或系统。例如,可以将压力和体积数据输出到可编程计算装置并存储在计算装置内的存储器中。然后可以使存储的数据经受可编程指令,该可编程指令被存储在装置的存储器内,并且在被与存储器可操作通信的处理器执行时诸如键盘等输入端和图形显示器将数据变换成如本文中的附图中所示的图形形式。还可以将参考顺应性曲线存储在装置的存储器中并连同测试数据一起以图形方式显示以用于与为了便于可视化而被标记并突出显示的密钥度量的可视比较。例如,可以图示出用于测试数据的顺应性曲线的内径尺寸量化(治疗前和/或治疗后)并与健康参考顺应性曲线的相比较,以帮助确定手术是否完成。另外,可以实时地测量、量化并显示如本文中所述的反向力以允许操作员确定手术进展。此外,可以作为如本文中所述的参考顺应性曲线的斜率比较而测量、量化并以图形方式显示血管的顺应性或弹性。
还可以在本发明的各种实施例中使用血流储备分数(FFR)以获得生物导管和其中的感兴趣区域(例如,在其中具有示例性病变的血管)的机能测量结果。
在本文中公开了具有病变的示例性血管的顺应性和弹性的测量。本发明的本实施例中的主要方面是提供生物导管(例如,血管)和其中的感兴趣区域(例如,病变)的顺应性和/或弹性的测量以便以与导管的感兴趣区域内的手术集成组合的方式使用。例如,血管手术在没有限制的情况下包括旋切术手术—包括旋转旋切手术、血管成形术、支架植入术和生物血管支架术。涉及到病变或阻塞的评估、减少、改型和/或去除的所有其它手术也在手术或血管手术的范围内。
因此,FFR是用来测量跨例如示例性动脉内的狭窄或病变的压力差以确定该狭窄障碍氧到位于该病变远侧的器官和组织的输送的可能性的技术。FFR被定义为相对于病变前面(近侧)的压力而言的病变后面(远侧)的压力。结果是绝对数;0.80的FFR意指给定病变引起血压的20%下降。压力传感器和FFR对于技术人员而言是众所周知的。例如,在美国专利号5,450,853;5,715,827;5,113,868;5,207,102中更详细地描述了在FFR技术中可以使用的压力传感器。
还可以用已知装置和技术来测量导管(例如,血管)内的流速。关于可以采用的示例性流量传感器参见例如美国专利号4,733,669;5,125,137;5,163,445。
最后,可以用被用于FFR和流速的已知装置和技术来测量导管(例如,血管)内的流动阻力,因为可以将例如包括血管内的病变的感兴趣区域中的局部化阻力值计算为压力的变化(在病变近侧对比在病变远侧)除以流量。因此,随着示例性血管手术的进行,阻力波形将开始改变,并且可以被用作改变病变和/或血管的顺应性的指示。
在导管(例如,血管)内测量的压力、流速和流动阻力是部分地取决于顺应性和弹性的参数,每个参数以诊断波形方式体现。对于本发明而言重要的是非顺应性血管中的压力、流速和流动阻力波形中的至少一个由于速度波形、压力波形和阻力波形的阻尼而与顺应性(健康)血管的不同。因此,手术(例如,血管手术)期间的将改变血管和/或其中的示例性病变的顺应性和/或弹性的流速、压力和阻力波形的变化直接地反映由手术引起的顺应性和/或弹性变化,并且可以因此进行监视。
机能含义:动脉顺应性(C)和可扩张性(C/A)由跨壁压(p)与内腔横截面积(A)之间的非线性相关的斜率给定,为血流动态与血管壁力学之间的弹性动力学耦接的表达式。还可以使用Moens–Korteweg等式来计算与壁可扩张性的平方根成反比的压力波的速度。动脉钙化负面地影响血流动态和血管壁力学。动脉中层钙化可以根据患病动脉隔室而具有多个主要后果。在微循环中,动脉壁的硬化与脉波速度的增加、脉压的增加和脉波失真(早发波反射、心脏舒张衰落变陡)相关联。
图6提供了在手术或血管手术期间实现的血管和/或病变顺应性的修改期间的波形变化的示例。波形包括流速(在流量传感器中测量)、压力(用压力传感器和FFR技术测量)和流动阻力的测量参数以帮助确定是否已产生顺应性的变化以及确定或评定顺应性变化是否指示已经用手术或血管手术恢复了充分的顺应性。
图7图示出具有沿着导线设置且接近于远侧不透射线尖端并设置于具有阻塞的示例性血管内的至少一个压力传感器的示例性FFR压力监视导线。压力传感器被集成到具有示例性扭矩装置的装置中以便执行示例性旋转旋切手术。在所示实施例中,远侧压力传感器702位于阻塞的远侧,并且近侧压力传感器704位于阻塞的近侧。请注意,FFR测量和因此的顺应性和/或弹性测量可以在示例性血管手术之前、期间和/或之后发生。同样地,监视导线可以包括沿着导线的替换压力传感器或者与之组合的流量传感器(未示出但在本领域中也是已知的),其中,在血管手术之前、期间和/或之后在示例性病变近侧和远侧测量流速以确定病变和/或血管的顺应性和/或弹性的变化。如众所周知的,可以将FFR计算为远侧和近侧压力传感器测量的比。
可以在相同或类似的导管或血管内获取一组监视参数(例如,流速、压力和/或流动阻力)以便确立用于受试患者的参考顺应性数据的至少一个集合。替换地,可以针对多种导管(例如,血管)尺寸和类型(其可以被存储为将用于受试患者的参考顺应性数据的至少一个集合)而确立预定标准数据的库。这些类型的参考顺应性数据集合中的两者或任一者可以被存储并在示例性血管手术期间被访问以用于参考目的和与在血管手术之前、期间和/或之后获得的测试顺应性数据的比较。
这些参考顺应性数据(无论是从预定库还是直接地从相同或类似血管获取)可以被用作参考点以将协助手术(例如,血管手术)操作员确定示例性血管内的病变的类型或组成、在给定病变的类型和/或组成的情况下要使用的血管手术的最佳类型以及将执行血管手术的最佳工具。例如,可以基于病变的类型或组成来指示旋转旋切装置。此外,病变组成类型可以指示扭矩装置的尺寸确定、旋转速度和将在旋切手术期间使用的研磨元件的类型(例如同心、非同心)。另外,这些数据可以当病变和/或血管顺应性开始响应于示例性血管手术而改变时在手术(例如,血管手术)期间提供指示。可以在示例性手术的初始运行之后、示例性手术之前和之后以及在示例性手术期间评估这些顺应性变化。最终,这些数据可以提供血管和/或病变顺应性和/或弹性处于通过测试顺应性或弹性数据集合与所述至少一个参考顺应性数据集合的比较而确定的正常极限内的指示,在某些情况下是实时指示。
图8图示出其中可以由设置在尖端804处的压力和流量监视器802针对系统800的尖端804处的流速以及压力变化而监视流体(例如,盐水)通过血管手术系统800(例如,旋转旋切系统)的流动。在本实施例中,可以监视压力和流量的变化并与至少一个参考数据集合比较。
包括创建的磁场及其变化的其它方法、装置和系统允许评估和评定病变类型和组成、导管(例如,血管)内的自旋旋转装置的位置估计以及允许实时地测量顺应性和因此的弹性。优选实施例包括创建由嵌入轨道旋切装置研磨元件(例如,冠状物或毛刺)中的永久磁体发出的AC磁场。我们相对于旋转旋切术来讨论此概念,但技术人员将认识到公开的概念用在生物导管(例如,血管)内工作的任何旋转装置将很好地工作。因此,与在生物导管内工作的任何旋转装置一起进行的本公开的装置、系统和方法的使用落入在本发明的范围内。
在轨道旋切手术期间,医生并未随着手术进展而具有关于血管的增加尺寸(例如,动脉开口)的良好信息。医生随着动脉开口在手术期间在尺寸方面增加而具有实时反馈将是期望的。
问题的解决方案:嵌入自旋冠状物中的永久磁体。
一个或多个磁体在如图9中所示的旋转轨道旋切装置的研磨头或冠状物中、上面或附近。替换地,冠状物由磁体材料构成。随着冠状物自旋或旋转,将发出AC磁场,如下面将进一步讨论的。此AC磁场是载波信号。基本上处于垂直于自旋磁体的轴线(例如旋转研磨头或冠状物的纵轴)的平面中且基本上以与冠状物自旋的轴线成直角地放置的AC磁场传感器将是对发射的载波信号最敏感的。
如图10中所示,在与自旋冠状物内部的磁体相同的距离处放置了三个传感器。传感器“A”在自旋磁体的平面中,并且将接收到三个传感器A、B&C的最强信号。传感器“C”本质上被沿着旋转轴放置,并且将几乎检测不到发射的AC磁场。
在实践中,AC磁场传感器将在身体外面,但是位于合理地尽可能接近于自旋冠状物处,同时仍尽可能接近于自旋冠状物的平面。
随着自旋冠状物相对于AC磁性传感器移动,载波信号强度将改变。载波信号强度将随着磁体—传感器距离d减小而增加。针对远场情况的此关系将为约B′∝d-2,其中,B'是由AC磁场传感器检测到的信号强度1102,并且d是自旋冠状物与AC磁场传感器之间的距离1104。请注意,用于D的指数还可以是约-3。本文中所使用的说明性等式表示具有指数-2的距离d,但是如技术人员将很容易理解的,该关系式还可以包括具有指数-3的距离d。在图11A和11B中图示出这些关系。
载波信号强度B'将根据自旋冠状物和AC磁场传感器的相对取向而改变。可以通过取B′∝d-2的泰勒级数近似的一阶项(其为ΔB′∝-2·d-3·Δd)并对两个比例做除法(其提供等式)来在很大程度上去除此类系统噪声因数的影响。在图12A—12C中示出了此等式的解释。在图12A的左侧示出了自旋磁体,其为与AC磁性传感器的距离d。在图12A的右侧,自旋磁体与AC磁性传感器之间的距离已减小Δd。图12B示出了由AC磁性传感器检测到的原始信号,其中,信号的每个循环对应于自旋磁体的一个回转。在图12B的左侧的载波信号的量值对应于距离d,并且在图12B的右侧的略微较大量值的载波信号对应于自旋磁体与AC磁性传感器之间的距离减小Δd时。
检测自旋磁体的小的移动
图12在左侧示出了针对其中自旋磁体和AC磁性传感器分离距离d的情况的载波信号的峰到峰量值1202(|B'|)并在右侧示出了针对其中距离减小Δd的情况的载波信号的略微较大的量值。如果这些量中的任何三个是已知的,则可以根据来计算第四个。
此关系式被用来估计短时间段内的自旋冠状物的小的移动Δd。
对约束自旋磁体的空间的一个维度进行估计。
此关系式的概念扩展适用于自旋磁体,其在短时间间隔内在约束空间内自由盘旋或移动。
在这种情况下,检测到的载波信号量值|B'|将如图13A中所示随着自旋磁体沿着路径(点“a”至“h”)相对于AC磁性传感器移动而改变。在图13B的曲线图中示出了检测到的峰到峰载波信号强度,点“a”至“h”随着自旋磁体沿着该路径行进而被标记。可以以某种方式(诸如载波信号量值的范围Range|B'|)在感兴趣的时间间隔内估计|B'|的变化。信号量值|B'|的估计可以简单地是感兴趣时间间隔内的平均值AVG|B'|。
以这种方式,可以随着自旋磁体在约束空间内到处移动而连续地估计约束空间的维度。
存在用于计算|B'|的变化估计的多个选项,诸如四分位数间距(90%—10%)和标准偏差。实际上,将非参数度量用于对离群数据点及其它噪声不那么脆弱的变化和点估计两者可以是有用的。
对于约束自旋磁体的空间的维度进行估计。
可以使用传感器来仅在从传感器至自旋磁体的方向上估计约束空间(诸如动脉开口)的维度。2个或更多传感器可以围绕着约束空间定位以从不同的视角获得开口尺寸的多个估计。图14图示出其中使用三个AC磁性传感器:“A”、“B”&“C”来获得多个独立维度估计的示例,并且示出了肾形约束空间或导管。在其中独立地考虑来自多个传感器的信息的情况下,确定约束空间的形状是肾形(与椭圆类型的形状相反)将是非常困难的。替换地,存在在很适合于这种情况的通信系统和信号处理中常见的解调方法。
对约束空间的形状进行估计
当使用两个或更多传感器时,可以使用传感器数据来估计约束自旋磁体在空间或导管内的移动的空间或导管的形状。
可以使用如上文图示出的两个或更多传感器来导出用于自旋磁体的每个回转的移动矢量。最简单的情况是两个传感器被相对于所述传感器相互成直角地安装,但是如果更多传感器可用或者如果两个传感器并未相互成直角,则此概念可以被广义化。可以将来自自旋磁体的连续回转的移动矢量1502拼接在一起以产生如图15A中所示的约束空间内的移动路径。如果跟踪移动路径在足够长的时间段内被跟踪,则检测到的位置1504的密度将定义如图15B中所示的约束空间的形状。
在其中磁体被结合到冠状物中的情况中,可以期望对冠状物使用没有铁磁材料的材料,除非冠状物的铁磁材料被磁化,使得冠状物的磁场与磁体的磁场对准。替换地,冠状物可以由可以被磁化的材料(诸如铁磁)构成。替换地,冠状物可以简单地是非金属的以缓解发射信号的干扰。
动脉壁钙化的指示
在轨道旋切手术期间,医生并不具有关于随着手术发展而被治疗的动脉壁的组成的良好信息。使医生在手术期间具有作为动脉壁的组成或钙化的实时反馈将是期望的。
发射的载波将对冠状物的突然速度或位置变化非常敏感。此传感器性质将以至少四个不同方式体现,其可以用来识别冠状物接触的动脉壁材料。
首先,冠状物自旋速率可以在其接触到一个类型的壁材料(与其它的相反)时可以短暂地减速。此短暂减速和返回的增速将表现为如图16中所示的载波1602中的干扰D。在这种情况下,从矢量1502的峰值p至峰值p的距离可以增加。因此,距离d1=d2<距离d3。例如,随着自旋冠状物接触钙,可以存在许多摩擦,其促使自旋冠状物短暂地减速并表现出此特征性质。
其次,假定壁的组成与壁的顺应性紧密相关,自旋冠状物可以与其将从健康动脉壁或部分钙化壁弹回不同地从钙化壁弹回。图17A是自旋冠状物可能如何缓慢地从健康且高顺应性的动脉壁弹回的图示。相反地,图17B是针对迅速地从非顺应性钙化壁弹回的自旋冠状物而检测到的移动矢量1502的检测到的Δd的图示。
第三,如果动脉壁是健康的或钙化的,自旋冠状物在约束空间内的一般移动的速度和模式可以相当不同。图18A图示出在其从刚性的钙化壁弹回时的在约束空间内快速地到处移动的冠状物的路径,而图18B图示出在其从健康动脉的柔软且具有顺应性的壁缓慢地弹回时的在类似约束空间(未示出)内非常缓慢地移动的冠状物,如移动矢量1502的Δd所指示的。
第四,在上文给出的第二和第三示例的情况下,钙化的指示符将主要基于运动路径。然而,在两种情况下,从软的顺应性壁和硬的钙化壁的弹回也可以更直接地以载波信号1602的方式体现,如图18C和18D中所示。图18C图示出当自旋冠状物与硬质壁接触时载波1602如何可以很好地在一般平均峰到峰包络1802外面出现尖峰1804。图18D图示出当自旋冠状物与软的顺应性健康动脉壁接触时每个循环时的载波峰到峰振幅将如何或多或少地保持在峰到峰包络内,虽然可能发生尖峰1805。
检测到的AC磁载波信号的信噪比可以根据诸如从自旋磁体至AC磁场传感器的距离之类的因素而不佳。
如果信噪比不佳,则可能必须使用来自马达的旋转位置传感器数据来锁相到AC磁载波信号上。
冠状物可能被推入阻塞中,使得其使装置停顿。具有即将发生的停顿的指示将是期望的。
作为轴上的加载和即将发生的停顿的指示的马达旋转位置的使用
检测到即将发生的停顿的一个可能手段是将冠状物的旋转位置与马达的旋转位置相比较。旋转位置上的差别将是由于可以用来指示即将发生的停顿的冠状物上的加载而引起的轴上的扭矩的函数。
与上述小节相反,检测到的AC磁载波信号的信噪比可以是优良的是可能的。在这种情况下,可以根据载波来确定近实时冠状物旋转位置。可以根据可从马达驱动器获得的输出信号1902来确定近实时马达旋转位置。比较冠状物和马达旋转位置是驱动轴上的负荷的指示符。如果马达与冠状物之间的相位滞后增加,则其可以指示冠状物正在被推入材料中,这正在引起增加的拖曳并可以接近停顿。图19图示出相位滞后被示为如“A'”<“B'”<“C'”<“D'”所指示的那样在冠状物的每次旋转时增加时的此概念。
约束空间的维度的定量估计取决于AC磁性传感器与自旋磁体之间的距离的准确度。假定将可能存在在皮肤表面上或附近的多个此类传感器和大范围的解剖结构变化,到用于每个传感器的磁体的距离将随患者而改变。
自校准AC磁性传感器阵列
必须具有从自旋磁体至给定传感器(y)的距离的粗略估计以获得相对于该传感器的Δy的定量估计。为了保持高信号质量,使AC磁性传感器尽可能接近于自旋磁体将是期望的。这是在皮肤表面上或者合理地尽可能接近。这意味着磁体至传感器距离对于不同的患者而言可以不同。其意味着磁体至传感器距离对于给定患者身上的不同传感器而言可以不同。如果如上所述地使用多个传感器,则阵列中的相邻传感器可以在y方向上略微偏移。相邻的等同传感器之间的此类小偏移可以用来获得从阵列中的一对相邻传感器至自旋磁体的距离d的估计。图20图示出其中在相邻传感器之间存在已知偏移的身体外面的传感器阵列。
存在在概念上类似的四个实施方式。第一个是优选实施方式,并且另外3个是替换实施方式。
替换实施例:
可以将如上所述的使用载波的概念扩展至其它实施方式。首先,发出的信号可以来自在身体外面的一个或多个源,并且该信号可以被放置于冠状物上或附近的传感器接收到。其次,作为使用磁场作为发出信号的替代,其可以是源自于冠状物或一个或多个发射器的RF场。
替换实施例#2:检测到来自在身体外面的一个或多个发射器的AC磁场的在自旋冠状物中、上面或附近的AC磁场传感器。
替换实施例#3:嵌入冠状物中、上面或附近的偶极子发射AC信号。发射的AC信号可以是冠状物的自旋所固有的,或者其可以发射RF信号。位于身体外面的一个或多个RF接收机将检测到发出的信号。
替换实施例#4:使用在冠状物中、上面或附近嵌入的偶极子来检测由一个或多个外部RF发射器发出的RF信号。
随着旋转旋切手术的进展的动脉壁顺应性以及弹性的实时指示。
在本文中举例说明的磁载波方法和装置可以用来监视由于心跳的压力脉冲变化而引起的动脉横截面变化。随着示例性血管研磨和/或磨光手术的进展,测量的动脉横截面从类似于刚性管的某些东西演进成随着每个心跳发出脉冲的顺应性管。本文中所述的磁载波方法可以足够快速地获取关于横截面的信息,使得应可以纵贯每个心跳测量动脉横截面的变化。
例如,具有嵌入式磁体的冠状物可以以2000Hz自旋。心率将为约1Hz。如果冠状物在5Hz至400Hz的范围内绕动脉盘旋或穿过动脉,则应可以穿过心跳的过程跟踪动脉的尺寸。理想地,冠状物可以比心率快至少5倍且比自旋速率慢至少5倍地绕感兴趣动脉维度盘旋或穿过该动脉维度以出于此目的获得有效数据。一般地,可以用更复杂的信号处理超过5倍限制直至约2倍的极限。
实施例#1:随着心脏的每次脉动的研磨期间的动脉顺应性的实时监视。
磁体被嵌入冠状物中。AC磁场传感器在基本上垂直于如前所述的冠状物的自旋轴的平面中被布置在身体外面。图21是从在具有嵌入其中的磁体的旋转旋切装置上并在被3个传感器监视的同时在导管中自旋的示例性研磨冠状物获得的数据的示例。随着冠状物的每次旋转/自旋,冠状物的位置的估计被更新3次,针对每个传感器一次。图21中的数据点表示冠状物的位置的估计。连接的数据点2102是来自被用来生成数据的冠状物的最近7次回转/旋转/自旋的位置估计。本示例图示出冠状物在7次旋转回转中尚未完全完成导管(例如血管)的轨道。还显而易见的是可以每次每个轨道而估计动脉的维度。曲线图的轴上的值是来自磁性传感器的原始数据,并且尚未被转换成长度单位。
实施例#2:具有最小研磨的随着心脏的每次脉动的动脉顺应性的实时监视
冠状物表面形貌被设计成使得当在一个方向上自旋时其将进行研磨,并且当在相反方向上自旋时完成最少研磨。以这种方式,冠状物可以用来在研磨过程期间监视动脉顺应性变化或者通过在相反方向上自旋而以最小的研磨监视动脉顺应性。
上文描述了在磁载波(MC)概念底层的操作理论,但是表示该概念的一个手段是用以下等式:
EQ1.
其中:
X是从传感器至自旋冠状物的距离;
Δx是作为冠状物相对于传感器的移动的x的微小变化或改变;
B是感测的磁载波的峰到峰信号强度;以及
ΔB是B的微小变化或改变。
信号积分缓解冠状物振荡的效应
为什么冠状物振荡是个问题
等式#1类似于F=m*A,在于其是可以用多种方式应用和解释的系统的物理参数之间的关系的简单表达式。
例如,假设的是来自磁性传感器的信号与磁场的强度B成正比,并且因此传感器电压与公式中的B是可互换的。
虽然存在可以使用的许多类型的磁场传感器,但在以下示例中使用的MC传感器是感应拾波线圈,其提供与磁场的变化速率成比例的信号强度或如果冠状物旋转的速度在足够长的时间段内是相对恒定的,则基于磁场强度的比ΔB/B和磁场强度的变化速率本质上是可互换的。
然而,冠状物速度不一定在足够长的时间段内是恒定的。因此,图22图示出冠状物振荡在已被过度使用的装置中变得有多严重。垂直2202线来自马达霍尔传感器,其确认马达速度是恒定的。线2204是从感应拾波线圈获得的信号。线2204的每个循环表示随着旋转旋切装置的旋转期间的冠状物的回转。冠状物如当线2204加宽时的时段所指示的那样周期性地减速。当冠状物减速时,峰到峰信号强度也降低。当冠状物返回加速时,峰到峰信号强度也增加。因此,冠状物速度的振荡调制载波的信号强度。
假定磁载波概念依赖于由于动脉内腔内的轨道而引起的信号强度的变化,由于冠状物的振荡而引起的信号强度的调制是潜在的严重噪声源。
冠状物振荡的效应的缓解
虽然冠状物振荡针对磁场传感器的变化速率引入噪声,但其将不会针对磁场传感器引入噪声。
感应传感器输出与磁场的变化速率成线性比例,这意味着其信号与来自磁场传感器的信号的导数成线性比例。因此,通过取来自感应线圈传感器的信号的近似s域变换,产生在很大程度上对冠状物振荡免疫的虚拟磁场传感器。
一个方法的示例是实现近似s域变换。
可以如下基于逐个点而用软件来实现来自感应线圈传感器的信号的积分:
如果Xi是从感应线圈传感器获取的信号数据点,则可以通过如下取输入信号的累加和来充分地近似该近似s域变换:
X_cumsumi=X_cumsumi-l+Xi
如果输入信号具有甚至小的偏移,则此累加和计算可以快速地变成大的正数或负数。因此可以期望在累加和计算之前和/或之后应用高通滤波器,其中,截止频率很好地在冠状物的自旋和轨道频率以下。
存在可以应用于所获取的信号以缓解冠状物振荡的许多可能变换。很可能存在将比累加和更有效的变换,这是技术人员将很容易认识到的。累加和与高通滤波器的组合仅仅是作为可以容易地应用的示例而提供的。
应用于台架测试数据的信号积分的示例
图23和24中所示的曲线图是来自台架上测试(20150105R007)的载波1602结果,其中,具有嵌入式磁体的自旋冠状物每几秒在大(ID=4.02mm)管与小(ID=2.78mm)管之间来回移动。
两个曲线图都具有公共的x轴,其是以秒为单位的时间T。整个曲线图窗口在两种情况下是30秒。
y轴是从磁场传感器的变化(其与具有磁体的自旋冠状物远离3”)的单个速率进行的管ID 2302的未缩放估计。
两个曲线图中的结果基于同一数据集。所示的结果中的唯一差别是所使用的数据处理方法。
图23的曲线图示出了基于被视为平均峰值P至谷值Tr距离的估计内腔直径的方法的一个实施例的载波1602的未缩放结果。随着磁载波冠状物在大和小ID管之间移动的内腔尺寸估计的变化是几乎不能辨别的。
将使得结果对冠状物的振荡免疫的S域变换信号
图24中所示的未缩放结果使用用估计内腔直径的原始方法的积分信号的累加和。该累加和去除由于在冠状物自旋的同时的冠状物振荡而引起的噪声。参考图24,其在冠状物在约束冠状物的轨道的导管的大和小直径截面之间来回移动时更加明显。
进一步细化:弦方法从移动伪像提取冠状物轨道
自旋磁性冠状物发射载波(1个循环/自旋):
载波量值随着冠状物更接近于或更远离传感器盘旋而进行调制;以及
许多轨道内的载波调制被用来估计内腔直径。
总体的移动(诸如由于心搏而在冠状动脉中)引起载波信号量值的附加变化,其可以显著地使从原始方法获得的内腔直径估计偏置。
具有一个传感器的弦方法:
在每次自旋时,计算到最近自旋位置的弦投影。(参见附加的PowerPoint)。由于弦投影基于诸如在先前20ms内的最近自旋位置,所以存在不足以使总体移动具有显著影响的时间;以及
然后可以使用在足够长的时间短(诸如0.5s)内获得的弦投影来提供在很大程度上没有移动伪像的内腔尺寸的精确估计。
具有两个或更多不对准传感器的弦方法:
在每次自旋时,针对每个传感器计算到最近自旋位置的弦投影。
使用来自2个或更多不对准传感器的弦投影来估计实际弦长。
然后可以使用在足够长的时间段(诸如0.5s)内获得的弦长来估计内腔尺寸。
两个或更多不对准传感器应提供比可以从单个传感器获得的显著更加强大的估计。
如果使用三个或更多不对准传感器,则可以进行每个弦长的近实时误差估计。这具有供作为正在获取有效数据的双重检查之用的潜力,以选择提供最有效数据的传感器子集。
应用于动物研究数据的弦方法的工作示例
图25的图形数据是来自在具有2.25mm MC冠状物的活猪的股动脉中获取的动物研究数据。
曲线图的描述:
下面的曲线图中的x轴是以秒为单位的时间。
y轴是猪的内部股动脉的未缩放内腔直径。
相对有噪声的迹线2502是在图23中使用的原始计算方法。
噪声较少的迹线2504是原始计算方法,而且使用累加和信号。
噪声更少的黑色迹线2506是使用累加和信号的基于弦的方法。
可以看见动脉的脉动与血压迹线一致(具有轻微的计算偏距,取决于应用的方法)。
实验技术:自旋冠状物被沿着缩窄动脉推动,然后如下面曲线图上所指示的那样缩回。将此过程重复两次或更多次。
应用于台架上数据的弦方法的工作示例
以下数据来自台架上测试。
图23、24和26中所示的曲线图是来自台架上测试(20150105R007)的结果,其中,自旋MC冠状物每几秒在大(ID=4.02mm)管与小(ID=2.78mm)管之间来回移动。
图23、24和26的所有曲线图具有公共的x轴,其为以秒为单位的时间。整个曲线图窗口是30秒。
Y轴是从磁场传感器的变化(其与自旋冠状物远离3”)的单个速率进行的管ID的未缩放估计。
所有曲线图中的结果基于同一数据集。所示的结果中的唯一差别是所使用的数据处理方法。
图23的曲线图示出了基于原始MC计算方法的未缩放结果。随着MC冠状物在大和小ID管之间移动的信号的变化是几乎不能辨别的。
对信号进行累加和以使得结果对冠状物方法免疫:
图24的曲线图中的未缩放结果使用用原始计算方法的累加和信号。该累加和去除由于在冠状物自旋的同时的冠状物振荡而引起的噪声。当冠状物在两个直径之间来回移动时其更加显而易见。
基于弦的方法:
图26的曲线图中的未缩放结果使用用基于弦的计算方法的累加和信号。基于弦的方法将冠状物轨道(动脉内腔尺寸)从诸如心脏移动/扭绞之类的总体移动分离。
在其中不存在总体移动的情况下,基于弦的方法相比于原始方法具有微小但值得注意的益处。
用于缓解总体移动的效应的传感器的相对构造(Opposed Configuration)
MC传感器的相对构造意图缓解由心脏的总体移动引起的伪像。
先前已公开了远场磁场强度与距离关系,并且在分别地下面用于MC传感器#1和#2的等式(1)和(2)中描述。两个传感器基本上对准,但是在自旋/盘旋冠状物的相对侧,这就是为什么称为“相对构造”的原因。
移动伪像以至少两个方式使内腔估计偏置:
如图27中所示,传感器至自旋冠状物的距离x1和x2将随着心脏移动而略微改变,这将在内腔估计中产生小的振荡偏移。
心脏移动伪像将针对原始方法引起Δx的附加的不想要的变化,其在弦方法的情况下在很大程度上被抑制。
用该相对构造可以用代数方式去除心脏移动伪像,并且在图27中的等式#5中描述了结果。特别地,请注意,从自旋冠状物至两个传感器S1和S2中的每一个的距离x1和x2在等式#5中不再出现。在等式#5中所需的仅有几何输入是xT,其是相对构造中的两个传感器之间的距离。只要两个传感器并未相对于彼此移动,等式#5的结果将在很大程度上对心脏的总体移动免疫。将内腔尺寸与总体移动分离的附加结果是还可以如在图27的等式#6中所述的那样估计总体移动。
在相对构造中具有2个MC传感器并应用弦方法的组合因此有效地缓解了内腔估计中的移动伪像。
应用于动物研究数据的相对构造的工作示例
图28中所示的图形结果的描述:
数据来自对活猪进行的动物研究。
x轴是以秒为单位的时间。
顶部子图是原始信号量值2802。
第二子图迹线是相对内腔估计2804。
第三和第四子图的迹线是分别地使用2和3个弦的来自每个单独传感器2806、2808的基于弦的估计。
第四子图迹线是心脏压力迹线2810。
结论:相对构造内腔估计2804的第二子图迹线与基于单独传感器的第三和第四子图迹线2806、2808相比很明显表现更好并提供预期的结果。请注意已经向图中添加了垂直短划线以帮助血压迹线与内腔尺寸估计的直观对准。
可以使用上述磁载波方法、装置和系统来提取以下信息或数据:
1.导管或示例性血管的内腔的直径。
2.导管或示例性血管的内腔的横截面形状。
3.影响示例性血管的臂的旋转旋切系统中的示例性研磨元件的低频特征声音。
4.影响示例性血管的壁的冠状物的高频特征。
5.示例性研磨元件(例如,旋转旋切系统中的冠状物或毛刺)中的振荡和角度偏转。旋转研磨元件的振荡行为帮助评估和评定示例性血管和/或其中的病变的组成。
如上所述,可以通过特别地去除干扰噪声来使得磁载波实施例的方法、装置和系统逐渐地更准确。从最不准确或噪声最多至最准确或噪声最少,这些方法、装置和系统至少包括以下各项:
1.包括至少一个磁性传感器的初始磁载波方法;
2.用初始磁载波方法进行的信号的积分;
3.弦方法且包括一个传感器,不具有编号2’的积分步骤;
4.弦方法且包括一个磁性传感器,并且具有用初始磁载波方法进行的信号的积分;
5.弦方法且包括并不相对的两个磁性传感器,因此开始缓解总体移动效应;
6.弦方法且包括彼此相对的两个或更多磁性传感器;
7.弦方法且包括三个或更多磁性传感器,传感器中没有一个是相对的;以及
8.弦方法且包括三个或更多磁性传感器,所述三个或更多传感器中的至少两个是相对的。
可以将本发明的各种实施例结合到如一般地在通过引用结合到本文中的题为“ECCENTRIC ROTATIONAL ATHERECTOMY DEVICE”的美国专利号6,494,890中所述的旋转旋切系统中。另外,以下共同所有专利或专利申请的公开被整体地通过引用结合到本文中:美国专利号6,295,712,题为“ROTATIONAL ATHERECTOMY DEVICE”;美国专利号6,132,444,题为“ECCENTRIC DRIVE SHAFT FOR ATHERECTOMY DEVICE AND METHOD FOR MANUFACTURE”;美国专利号6,638,288,题为“ECCENTRIC DRIVE SHAFT FOR ATHERECTOMY DEVICE AND METHOD FOR MANUFACTURE”;美国专利号5,314,438,题为“ABRASIVE DRIVE SHAFT DEVICE FOR ROTATIONAL ATHERECTOMY”;美国专利号6,217,595,题为“ROTATIONAL ATHERECTOMY DEVICE”;美国专利号5,554,163,题为“ATHERECTOMY DEVICE”;美国专利号7,507,245,题为“ROTATIONAL ANGIOPLASTY DEVICE WITH ABRASIVE CROWN”;美国专利号6,129,734,题为“ROTATIONAL ATHERECTOMY DEVICE WITH RADIALLY EXPANDABLE PRIME MOVER COUPLING”;美国专利号8,597,313,题为“ECCENTRIC ABRADING HEAD FOR HIGH-SPEED ROTATIONAL ATHERECTOMY DEVICES”;美国专利号8,439,937,题为“SYSTEM,APPARATUS AND METHOD FOR OPENING AN OCCLUDED LESION”;美国专利公开号2009/0299392,题为“ECCENTRIC ABRADING ELEMENT FOR HIGH-SPEED ROTATIONAL ATHERECTOMY DEVICES”;美国专利公开号2010/0198239,题为“MULTI-MATERIAL ABRADING HEAD FOR ATHERECTOMY DEVICES HAVING LATERALLY DISPLACED CENTER OF MASS”;美国专利公开号2010/0036402,题为“ROTATIONAL ATHERECTOMY DEVICE WITH PRE-CURVED DRIVE SHAFT”;美国专利公开号2009/0299391,题为“ECCENTRIC ABRADING AND CUTTING HEAD FOR HIGH-SPEED ROTATIONAL ATHERECTOMY DEVICES”;美国专利公开号2010/0100110,题为“ECCENTRIC ABRADING AND CUTTING HEAD FOR HIGH-SPEED ROTATIONAL ATHERECTOMY DEVICES”;美国设计专利号D610258,题为“ROTATIONAL ATHERECTOMY ABRASIVE CROWN”;美国设计专利号D6107102,题为“ROTATIONAL ATHERECTOMY ABRASIVE CROWN”;美国专利公开号2009/0306689,题为“BIDIRECTIONAL EXPANDABLE HEAD FOR ROTATIONAL ATHERECTOMY DEVICE”;美国专利公开号2010/0211088,题为“ROTATIONAL ATHERECTOMY SEGMENTED ABRADING HEAD AND METHOD TO IMPROVE ABRADING EFFICIENCY”;美国专利公开号2013/0018398,题为“ROTATIONAL ATHERECTOMY DEVICE WITH ELECTRIC MOTOR”;以及美国专利号7,666,202,题为“ORBITAL ATHERECTOMY DEVICE GUIDE WIRE DESIGN”。本发明设想可以将本发明的实施例中的一个或多个的特征与本文中所述的旋切装置的实施例的一个或多个特征组合。
不应认为本发明局限于上文所述的特定示例,而是应理解成覆盖本发明的所有方面。本发明可以适用于的各种修改、等价过程以及许多结构在回顾本说明书时对于本发明针对的领域的技术人员而言将是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!