抗IL‑17A和IL‑17F交叉反应性抗体变体、包含其的组合物及其制备和使用方法与流程
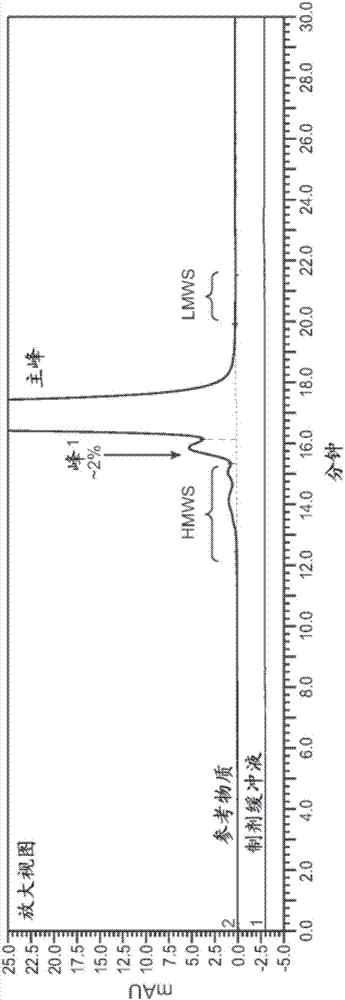
交叉参考本申请要求2014年10月31日提交的美国临时申请号62/073,574的优先权,该美国临时申请在此以其整体引入作为参考。序列表本申请包含已以ascii格式电子提交的序列表,在此以其整体引入作为参考。于2015年10月26日创建的该ascii拷贝命名为p32377wo_pctsequencelisting.txt,大小为13,727字节。本发明涉及抗il-17a和il-17f交叉反应性抗体(抗il-17a/f抗体)的变体。具体而言,本发明涉及糖基化变体、酸性变体、电荷变体、高分子量种类(hmws)变体和抗还原(reduction-resistant,rr)交联变体。本发明还涉及分离的变体,包含该抗体及其变体的组合物和药物组合物,及包含该抗体和该变体的制品,以及制备、评价和表征该变体及其组合物的方法。
背景技术:
:白细胞介素-17(il-17或il-17a)是t细胞来源的刺激上皮细胞、内皮细胞和成纤维细胞产生其他炎性细胞因子和趋化因子(包括il-6、il-8、g-csf和mcp-1)的促炎分子。参见yao,z.等,j.immunol.,122(12):5483-5486(1995);yao,z.等,immunity,3(6):811-821(1995);fossiez,f.等,j.exp.med.,183(6):2593-2603(1996);kennedy,j.等,j.interferoncytokineres.,16(8):611-7(1996);cai,x.y.等,immunol.lett,62(1):51-8(1998);jovanovic,d.v.等,j.immunol.,160(7):3513-21(1998);laan,m.等,j.immunol.,162(4):2347-52(1999);linden,a.等,eurrespirj,15(5):973-7(2000);及aggarwal,s.和gurney,a.l.,jleukocbiol.71(1):1-8(2002)]。il-17a还与其他细胞因子(包括tnf-α和il-1β)协同作用来进一步诱导趋化因子表达(chabaud,m.等,j.immunol.161(1):409-14(1998))。已进一步显示il-17a在人巨噬细胞中通过胞内信号发放刺激ca2+流入和[camp]i减少(jovanovic等,j.immunol.,160:3513[1998])。用il-17处理的成纤维细胞诱导nf-κb激活[yao等,immunity,3:811(1995),jovanovic等,上文],而用它处理的巨噬细胞激活nf-κb和促分裂原活化蛋白激酶(shalom-barek等,j.biol.chem.,273:27467[1998])。此外,il-17还与涉及骨和软骨生长的哺乳动物细胞因子样因子7具有序列相似性。与il-17多肽具有序列相似性的其他蛋白质有人胚胎衍生白细胞介素相关因子(edirf)和白细胞介素-20。白细胞介素17a公认为新出现的细胞因子家族的原型成员。人和其他脊椎动物基因组的大规模测序已揭示编码il-17a相关蛋白质的其他基因的存在,从而定义了新的细胞因子家族。人类和小鼠中存在至少6个il-17家族成员,包括il-17b、il-17c、il-17d、il-17e和il-17f。参见wo01/46420。编码人il-17f的基因邻近il-17定位(hymowitz,s.g.等,emboj,20(19):5332-41(2001))。il-17a和il-17f具有约44%氨基酸同一性,而il-17家族的其他成员具有更有限的15-27%氨基酸同一性,表明il-17a和il-17f形成il-17家族内的不同亚组(starnes,t.等,jimmunol.167(8):4137-40(2001);aggarwal,s.和gurney,a.l.,j.leukocbiol,71(l):1-8(2002))。il-17家族的每个成员形成同二聚体。il-17a和il-17f还形成il-17af异二聚体。人il-17af异二聚体是不同的新细胞因子,在蛋白质结构和基于细胞的活性测定中都不同于人il-17a和il-17f。通过用纯化的重组人il-17af作为标准品,开发了人il-17af特异性elisa。通过使用此特异性elisa,检测了人il-17af的诱导表达,确认il-17af异二聚体从培养的活化人t细胞天然产生。因此,il-17af是不同的新细胞因子,可作为分离的活化人t细胞的天然产物检测到,在蛋白质结构和基于细胞的测定中都将其重组形式表征为不同于和区别于相关细胞因子。参见例如us20060270003和wo2008/067223。类似于il-17a和il-17f同二聚体,已报道il-17af异二聚体细胞因子通过il-17ra/il-17rc受体复合物发放信号(wright等,jimmunol181(4):2799-805(2008))。已开发il-17a和il-17f拮抗剂如抗体拮抗剂(也称为抗il-17a和il-17f交叉反应性抗体或抗il-17a/f抗体)来治疗il-17a和il-17f相关障碍(参见例如us8,715,669和us8,771,697,在此引入作为参考)。发明概述抗il-17a和il-17f交叉反应性抗体包含:含有序列dyamh(seqidno:1)的重链可变结构域cdr1、含有序列ginwssggigyadsvkg(seqidno:2)的重链可变结构域cdr2、含有序列diggfgefywnfgl(seqidno:3)的重链可变结构域cdr3,及含有序列rasqsvrsyla(seqidno:4)的轻链可变结构域cdr1、含有序列dasnrat(seqidno:5)的轻链可变结构域cdr2和含有序列qqrsnwppat(seqidno:6)的轻链可变结构域cdr3。参见us8,715,669,在此以其整体引入作为参考。抗il-17a/f抗体以高亲和力结合人il-17aa同二聚体、il-17ff同二聚体和il-17af异二聚体,并中和人il-17aa同二聚体、il-17ff同二聚体和il-17af异二聚体诱导的促炎症活性。示例性全长人il-17a和il-17f氨基酸序列分别显示在seqidno:12和seqidno:13中。之前未报道过本文所述抗il-17a/f抗体的变体。本发明涉及抗il-17a/f抗体的变体,尤其是糖基化变体、hmws变体、抗还原(rr)交联变体、电荷变体和酸性变体。因此,在第一方面,本发明提供包含抗il-17a和抗il-17f交叉反应性抗体及其糖基化变体的组合物,该抗il-17a和抗il-17f交叉反应性抗体包含:含有氨基酸序列seqidno:1的重链可变结构域cdr1、含有氨基酸序列seqidno:2的cdr2、含有氨基酸序列seqidno:3的cdr3,及含有氨基酸序列seqidno:4的轻链可变结构域cdr1、含有氨基酸序列seqidno:5的cdr2和含有氨基酸序列seqidno:6的cdr3。在某些实施方案中,该糖基化在重链可变区中。在某些实施方案中,该抗体或其变体属于igg种类。在某些实施方案中,该抗体或其变体属于igg1、igg2或igg4同种型。在某些实施方案中,该抗体或其变体是单克隆抗体、全人抗体、人源化抗体、嵌合抗体或多特异性抗体(例如双特异性抗体)。在某些其他实施方案中,该糖基化变体是异二聚体变体,其中只有一个半抗体或只有一个重链可变区是糖基化的。在某些实施方案中,该糖基化变体是同二聚体变体,其中两个半抗体或两个重链可变区都是糖基化的。在某些实施方案中,该糖基化在重链可变区cdr2中,优选在seqidno:2的asn处。在某些实施方案中,该重链可变区包含与氨基酸序列seqidno:7具有至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%序列同一性的氨基酸序列,和/或该轻链可变区包含与氨基酸序列seqidno:8具有至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%序列同一性的氨基酸序列。在某些实施方案中,该抗体包含:含有与氨基酸序列seqidno:9具有至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%序列同一性的氨基酸序列的重链,和/或含有与氨基酸序列seqidno:10具有至少约85%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%或100%序列同一性的氨基酸序列的轻链。在某些实施方案中,该抗体包含含有氨基酸序列seqidno:9的重链和含有氨基酸序列seqidno:10的轻链。在某些实施方案中,该抗il-17a/f抗体称为抗il-17a/f抗体mcaf5352a。在某些实施方案中,组合物中糖基化变体的量不超过4%。在某些其他实施方案中,组合物中糖基化变体的量不超过糖基化变体的2%。在某些其他实施方案中,通过大小排阻高效液相层析(se-hplc)来检测、表征和分析该糖基化变体。在某些实施方案中,如通过se-hplc测量,组合物中糖基化变体的量不超过2%。在某些实施方案中,组合物中糖基化变体的量不超过0%。在某些实施方案中,在哺乳动物细胞如cho细胞中产生该抗体。还在其他实施方案中,该组合物包含糖基化变体,且进一步包含该抗体的一种或多种其他变体,其中该其他变体选自高分子量种类(hmws)变体、抗还原(rr)交联变体和酸性变体。在某些实施方案中,在哺乳动物细胞如cho细胞中产生该抗体。抗il-17a/f抗体mcaf5253a显示非典型光敏感性,最初观察到其导致变色(黄化),amax为~420-440nm,发现这与高分子量种类(hmws)形成相关。n2净化抗il-17样品减少变色和hmws形成二者,提示氧化驱动的过程。用多种生物分析技术(非限制性地包括电荷变体分析、se-hplc、毛细管电泳-十二烷基硫酸钠(ce-sds)、胰蛋白酶肽段作图和完整/还原质量分析)表征了该抗体的光敏感性。开发了新的有机相-大小排阻层析方法(命名为op-sec),以使得能够分级分离和富集假定的不可还原的hmws(nr-hmws或rr-hmws),证明其是光诱导的错配二硫键交联肽。交联级分主要包含重链-重链(hc-hc)(>90%)错配二硫化物,少量成分为重链-轻链(hc-lc)错配二硫化物。因此,在某些实施方案中,该组合物进一步包含rr交联变体。在某些其他实施方案中,该组合物中rr交联变体的量为不超过约1%至不超过约3%。在某些其他实施方案中,该组合物中rr交联变体的量不超过约3%。在某些实施方案中,通过还原抗体的还原型op-sec(有机相大小排阻层析)或还原型ce-sds(毛细管电泳-sds)来测定该组合物中rr交联变体的量。在某些实施方案中,通过还原型ce-sec测定的该组合物中的rr交联变体不超过约1%。在某些实施方案中,通过还原抗体的op-sec测定的该组合物中rr交联变体的量不超过约3%。在某些实施方案中,该rr交联变体包含cys和cys之间的交联。在某些实施方案中,该rr交联变体包含trp和trp之间的交联。在某些实施方案中,该交联是分子间或分子内交联。在某些实施方案中,该rr交联变体包含重链-重链交联。在某些其他实施方案中,rr交联变体包含重链-轻链交联。在某些其他实施方案中,该rr交联变体由光照(例如环境光照)诱导。在某些其他实施方案中,该组合物进一步包含hmws变体。在某些实施方案中,该组合物中hmws变体的量不超过约1%。在某些其他实施方案中,通过se-hplc测定hmws变体的量。在某些具体实施方案中,通过se-hplc测定的该组合物中hmws变体的量不超过约1%。在某些实施方案中,该组合物进一步包含酸性变体。在某些具体实施方案中,该组合物中酸性变体的量不超过约42%。在某些实施方案中,通过成像毛细管等电聚焦(icief)测定酸性变体的量。在某些实施方案中,通过icief测定的该组合物中酸性变体的量不超过约42%。在另一方面,本发明提供包含抗il-17a和抗il-17f交叉反应性抗体的组合物,该抗il-17a和抗il-17f交叉反应性抗体包含:具有氨基酸序列seqidno:1的重链可变结构域cdr1、具有氨基酸序列seqidno:2的重链可变结构域cdr2、具有氨基酸序列seqidno:3的重链可变结构域cdr3,及具有氨基酸序列seqidno:4的轻链可变结构域cdr1、具有氨基酸序列seqidno:5的轻链可变结构域cdr2和具有氨基酸序列seqidno:6的轻链可变结构域cdr3,其中该组合物包含一种或多种糖基化变体、rr交联变体、hmws变体和酸性变体。在某些实施方案中,该组合物包含rr交联变体。在某些实施方案中,通过还原型op-sec测定的该组合物中rr交联变体的量不超过约3%。在某些其他实施方案中,该组合物包含hmws变体。在某些其他实施方案中,通过se-hplc测定的该组合物中hmws变体的量不超过约1%。在某些其他实施方案中,该组合物包含酸性变体。在某些其他实施方案中,通过成像毛细管等电聚焦(icief)测定的该组合物中酸性变体的量不超过约42%。在某些实施方案中,该组合物包含糖基化变体、hmws变体、rr交联变体和酸性变体,其中该组合物中糖基化变体的量不超过约2%,该组合物中rr交联变体的量不超过约3%,该组合物中hmws变体的量不超过约1%,该组合物中酸性变体的量不超过约42%。在另一方面,本发明提供包含本文所述组合物和一种或多种可药用赋形剂的药物组合物。在某些实施方案中,该药物组合物包含抗il-17a/f抗体及其变体的主要种类。还在另一方面,本发明提供制品,其包含含有本文所述药物组合物的容器,及含有处方信息的包装说明书,该处方信息说明其用该药物组合物来治疗有需要的患者的用途。在另一方面,本发明提供制备本文所述组合物的方法,其包括产生包含该il-17a/f抗体的主要种类及其一种或多种变体的组合物;对所产生的组合物进行一种或多种分析测定来评价该组合物中一种或多种变体的量。在某些实施方案中,该方法进一步包括对所产生的组合物进行一轮或多轮纯化。还在另一方面,本发明提供治疗免疫相关疾病或障碍(如自身免疫疾病或障碍和炎性疾病或障碍)或细胞增殖相关疾病或障碍的方法,其包括对有需要的个体施用本文所述的药物组合物。在某些实施方案中,该免疫相关疾病或障碍非限制性地包括系统性红斑狼疮、类风湿性关节炎、银屑病关节炎、骨关节炎、幼年型慢性关节炎、脊椎关节炎、系统性硬化病、特发性炎性肌病、综合征、系统性血管炎、结节病、自身免疫性溶血性贫血、自身免疫性血小板减少症、甲状腺炎、糖尿病、免疫介导的肾病、中枢和外周神经系统脱髓鞘病(如多发性硬化、特应性脱髓鞘性多神经病或guillain-barré综合征和慢性炎性脱髓鞘性多神经病)、肝胆疾病(如感染、自身免疫性慢性活动性肝炎、原发性胆汁性肝硬化、肉芽肿性肝炎和硬化性胆管炎)、炎性肠病、溃疡性结肠炎、克罗恩病、麸质性敏感性肠病和whipple病、大疱性皮肤病、多形性红斑和接触性皮炎、银屑病、变应性疾病(如哮喘、变应性鼻炎、特应性皮炎、食物超敏反应和荨麻疹)、肺免疫性疾病(如嗜酸细胞性肺炎、特发性肺纤维化和过敏性肺炎)、移植相关疾病(包括移植排斥和移植物抗宿主病)。在某些其他实施方案中,该免疫相关障碍是哮喘、多发性硬化、类风湿性关节炎、炎性肠病、溃疡性结肠炎、红斑狼疮、银屑病、慢性阻塞性肺病或特发性肺纤维化。在某些其他实施方案中,该细胞增殖相关障碍非限制性地包括结直肠癌、肾细胞癌症(例如肾细胞癌)、黑素瘤、膀胱癌、卵巢癌、乳腺癌(例如三阴乳腺癌、her2阳性乳腺癌或激素受体阳性癌症)和非小细胞肺癌(例如鳞状非小细胞肺癌或非鳞状非小细胞肺癌)。在一些实施方案中,待通过本公开的方法治疗的癌症包括但不限于癌、淋巴瘤、母细胞瘤、肉瘤和白血病。在一些实施方案中,待通过本公开的方法治疗的癌症包括但不限于鳞状细胞癌、肺癌(包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状细胞癌)、黑素瘤、肾细胞癌、腹膜癌、肝细胞癌、胃或腹部癌(包括胃肠癌)、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝癌、乳腺癌、结肠癌、结直肠癌、子宫内膜或子宫癌、涎腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌和多种类型的头颈癌,以及b细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(nhl)、小淋巴细胞性(sl)nhl、中级/滤泡性nhl、中级弥漫性nhl、高级免疫母细胞性nhl、高级淋巴母细胞性nhl、高级小非裂细胞性nhl、巨块病性nhl、套细胞淋巴瘤、aids相关淋巴瘤和waldenstrom巨球蛋白血症)、慢性淋巴细胞性白血病(cll)、急性髓性白血病(all)、多毛细胞白血病、慢性成髓细胞性白血病和移植后淋巴增生性障碍(ptld),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和meigs综合征相关的异常血管增生。在一些实施方案中,该癌症可以是早期癌症或晚期癌症。在一些实施方案中,该癌症可以是原发性肿瘤。在一些实施方案中,该癌症可以是源自任意以上癌症类型的第二部位处的转移性肿瘤。除非文中清楚地另有说明,上文所述的任何和每个实施方案适用于本发明的任何和每个方面。除非文中清楚地另有说明,不同方面之内和之间的所有实施方案可以组合。本发明的具体实施方案将从以下某些优选实施方案的更详细描述和权利要求书变得显而易见。附图简述图1a:抗il-17a/f抗体mcaf5352a的组合物的sec层析图,显示峰1在组合物中占2%。图1b显示放大视图。图2:胰蛋白酶和pngase消化后的富集的峰1的sec层析图。图3a和3b:pngase处理的富集峰1的lc-ms分析。图3a:ms-tic结果显示去除富集的峰1的聚糖在层析图中产生了新的峰。图3b,上图-原始ms数据,显示未修饰、非糖基化的亲本胰蛋白酶肽hc44-65的质量;下图显示去糖基化的hc44-65,其中asp52取代了asn52。如预期,去糖基化的肽具有不同于非糖基化的hc44-65肽的保留时间,且具有略高的质量。通过所收集的肽的n端测序确认了asp52的存在。图4a和4b:抗il-17a/f抗体mcaf5352a的光诱导变色。图4a,按照ich指南光照暴露0小时、6小时和24小时时可观察到的变色的照片。图4b,光照暴露24小时的mcaf5352a的紫外-可见光光谱。在光照暴露的抗il-17a/f样品中观察到独特的uv吸收光谱,absmax为~430nm。通过暴露更长时间,用环境光照暴露观察到了相似的颜色变化(数据未显示)。图5a和5b:通过sec观察到光诱导高分子量种类(hmws)形成。图5a,光照暴露的抗il-17a/f抗体的完整大小排阻层析(sec)分析。图5b,定量分析显示hmws形成和光照暴露之间的线性相关。图6a和6b:用新的有机相-大小排阻层析(op-sec)鉴定抗还原交联种类。图6a:dtt处理的光照暴露的抗il-17a/fmcaf5352a的op-sec分析。图6b:定量分析显示抗还原交联种类形成和光照暴露之间的线性相关。然后通过级分收集富集交联种类。图7a和7b:光诱导增加mcaf5352a的电荷变体。图7a:光照暴露后用icief分析检测到的电荷变体。图7b:定量分析显示酸性电荷变体的增加。图8a和8b:分子内和分子间交联二者的证据。图8a:还原抗il-17a/f抗体mcaf5352样品的op-sec分析。图8b,定量分析显示sec主峰和hmws级分二者中的nr(不可还原或rr(抗还原))-hmws,分别显示分子内和分子间交联。图9a-c:通过胰蛋白酶作图分析的位点特异性光诱导氧化。图9a,甲硫氨酸氧化的定量分析;图9b,最易氧化的色氨酸氧化的定量分析;图9c,总色氨酸氧化种类的定量分析。图10:通过sec测定的位点特异性氧化、hmws和通过op-sec测定的rr交联种类的水平之间的直接相关。图11a-c:esi-tof-ms分析显示交联种类组成。图11a:从还原型op-sec分级分离/富集的交联种类的全ms。图11b:放大的ms显示假定的重链-重链(hc-hc)交联种类。图11c:放大的ms,显示假定的重链-轻链(hc-lc)交联种类。图12a和12b:n2净化减少变色、hmws和交联种类形成,表明变色、hmws形成和rr交联涉及氧化过程。图12a,n2净化的样品的sec分析,其中观察到n2净化减少变色(插图);图12b:n2净化的样品的op-sec分析。图13a和13b:n2净化减少总氧化。图13a,抗il-17a/fabmcaf5352a的fc、lc(轻链)和fab区的总氧化的rp-hplc分析;图13b,定量分析显示n2净化显著减少fc氧化。图14a和14b:nan3处理显示单一氧化驱动的过程。图14a显示变色和nan3处理浓度之间的直接相关。图14b,通过sec测量的nan3处理对hmws形成的保护作用和通过op-sec测量的nan3处理对交联形成的保护作用。图15a-1和15a-2:用o18标记流程和ms/ms鉴定光照暴露的il-17a/f抗体mcaf5352a中的rr交联肽。图15a-1和图15a-2,c232(铰链)和c373(fc)之间的铰链-fcrr交联二硫键(按出现顺序分别为seqidno14和15);图15b-1和图15b-2,c235(铰链)和c96(fab)之间的铰链-fabrr交联二硫键(按出现顺序分别为seqidno16和15)。图16a和16b:图16a中的图片显示全长抗体中已知的二硫键。图16b列出通过数据库搜索(massmatrixsoftwaresuite)在目标抗体中鉴定的光诱导抗还原错配二硫键。确认了两个错配二硫键,其他错配二硫键用o18标记检测为阳性,表明它们存在于光诱导rr交联变体中。这些错配二硫键中的几个涉及铰链区。图16b。发明详述本文引用的所有出版物、专利和专利申请在此为了所有目的明确引入作为参考。i.定义除非文中清楚地另有说明,本文所用的单数形式“一”、“一个”和“该”包括复数指代物。本文所用的抗体的“糖基化变体”是这样的抗体,与该抗体的在可变区中不糖基化的主要种类相比,其具有一个或多个附着于抗体可变区的糖类部分。在一个实施方案中,该糖基化变体具有附着于抗体的一条或两条重链的寡糖结构。在某些实施方案中,该糖基化位点在重链可变区(vh)cdr2(seqidno:2)氨基酸残基的asn或vh的氨基酸残基52处。在某些实施方案中,两个重链可变区都糖基化(同二聚体变体)。在某些其他实施方案中,两个重链可变区中只有一个糖基化(异二聚体变体)。在某些实施方案中,共价附着于重链可变区中的asn的寡糖在糖基化变体间可以是异质的。术语“抗il-17a和抗il-17f交叉反应性抗体”、“抗il-17a/f抗体”或“抗il-17a/f交叉反应性抗体”指结合并中和il-17a同二聚体、il-17f同二聚体和il-17af异二聚体的抗体。本文中的术语“主要种类抗体”或“野生型抗体”指组合物中的抗体氨基酸序列结构,其是该组合物中在数量上在占优势的抗体分子。优选地,该主要种类抗体是抗il-17a/f抗体,如结合并中和il-17a同二聚体、il-17f同二聚体和il-17af异二聚体的抗体。在一个实施方案中,该主要种类抗体是包含cdr-h1(seqidno:1)、cdr-h2(seqidno:2)和cdr-h3(seqidno:3)、cdr-l1(seqidno:4)、cdr-l2(seqidno:5)和cdr-l3(seqidno:6)的抗体。在某些实施方案中,该抗il-17a/f抗体包含含有序列seqidno:7的重链可变区和/或含有序列seqidno:8的轻链可变区。在一个实施方案中,该主要种类抗体是mcaf5352a。本文中的“完整抗体”是包含两个抗原结合区和fc区的抗体。在某些实施方案中,该完整抗体具有功能性fc区。在一个实施方案中,如通过lc/ms测量,“完整il-17a/f抗体mcaf5352a”具有约148,724da的分子量(包括fc聚糖,不含c端lys)。抗il-17a/f抗体的“低分子量种类”或“lmws”变体包含分子量低于主要种类或完整抗il-17a/f抗体分子量的抗体片段。在某些实施方案中,抗il-17a/f抗体mcaf5352a的lmws变体包含分子量低于主要种类或完整抗il-17a/f抗体mcaf5352a分子量的抗体片段。lmws可以通过大小排阻高效液相层析(se-hplc)和/或非还原型毛细管电泳-十二烷基硫酸钠(ce-sds)来检测。“高分子量种类”或“hmws”变体包含分子量大于主要种类或完整抗il-17a/f抗体的抗il-17a/f抗体制备物。在某些实施方案中,该hmws变体包含分子量大于完整或主要种类抗il-17a/f抗体mcaf5352a的抗il-17a/f抗体mcaf5352a制备物(例如,其中完整抗il-17a/f抗体mcaf5352a分子量约为148,724da)。hmws可以通过大小排阻高效液相层析(se-hplc)和/或非还原型毛细管电泳-十二烷基硫酸钠(ce-sds)来检测。在某些实施方案中,该hmws是光诱导的hmws。氨基酸序列变体抗体是具有不同于主要种类抗体的氨基酸序列的抗体。通常,氨基酸序列变体将与主要种类抗体具有至少约70%同源性,优选地,它们将与主要种类抗体具有至少约80%、更优选至少约90%同源性。在某些实施方案中,氨基酸序列变体将与主要种类抗体具有至少约70%、约80%、约85%、约90%、约92%、约95%、约98%、约99%序列同一性。氨基酸序列变体在主要种类抗体的氨基酸序列内或邻近主要种类抗体的氨基酸序列的某些位置上具有取代、缺失和/或添加。本文的氨基酸序列变体的实例包括脱酰胺抗体变体、在其一条或两条轻链上具有氨基端前导序列延伸(例如vhs-)的抗体、在其一条或两条重链上具有c端赖氨酸残基的抗体等,且包括重链和/或轻链的氨基酸序列变异的组合。在某些实施方案中,提供具有一个或多个氨基酸取代的抗体变体。进行取代诱变的目的位点包括hvr和fr。表1中在“优选的取代”的表头下显示保守取代。表1中在“示例性取代”的表头下提供更实质性的改变,如下文参考氨基酸侧链种类进一步描述。可以在目的抗体中引入氨基酸取代,并针对希望得到的活性(例如保留/改善的抗原结合、降低的免疫原性或改善的adcc或cdc)筛选产物。表1氨基酸可以按照共同的侧链特性分组:(1)疏水性:正亮氨酸、met、ala、val、leu、ile;(2)中性亲水性:cys、ser、thr、asn、gln;(3)酸性asp、glu;(4)碱性:his、lys、arg;(5)影响链取向的残基:gly、pro;(6)芳香族:trp、tyr、phe。保守取代将需要将这些种类之一的成员换为另一种类。“脱酰胺”抗体是这样的抗体,其中其一个或多个天冬酰胺残基已衍生为例如天冬氨酸、琥珀酰亚胺或异天冬氨酸。“酸性变体”是主要种类抗体的变体,其比主要种类抗体更酸。酸性变体相对于主要种类抗体获得负电荷或失去正电荷。在某些实施方案中,该酸性变体可以因甲硫氨酸或色氨酸氧化而存在。这类酸性变体可以用按照电荷分离蛋白质的分离方法(如离子交换层析)解析。在通过阳离子交换层析分离时,主要种类抗体的酸性变体比主峰更早洗脱。“电荷变体”指在给定ph下携带不同于主要种类抗体的总电荷的变体。电荷变体可以是酸性变体(获得负电荷或失去正电荷的变体)或碱性变体(获得正电荷或失去负电荷的变体)。在一个实施方案中,与主要种类抗体相比,抗体的一个或多个氨基酸残基上的修饰导致电荷变体的不同总电荷。“抗还原(rr)交联变体”指主要种类抗体的变体,其不能通过诸如二硫苏糖醇的还原剂化学还原为重链和轻链。rr交联变体也称为不可还原(nr)交联变体。这类变体可以通过用还原剂处理组合物并用评价蛋白质大小的方法(如本文所述的毛细管电泳-十二烷基硫酸钠(ce-sds)或有机相大小排阻层析(op-sec))评价所得到的组合物来评估。在某些实施方案中,该rr交联变体产生自暴露于光照,如环境光照。在某些其他实施方案中,该rr交联发生在cys和cys残基之间,或trp和trp残基之间。在某些实施方案中,该rr交联发生在分子间,例如一个抗体分子和另一个抗体分子之间;在某些其他实施方案中,该rr交联发生在分子内,例如一个全长抗体分子内。“c端赖氨酸变体”指在其重链的c端包含赖氨酸(k)残基的变体。“甲硫氨酸氧化变体”指其中包含一个或多个氧化甲硫氨酸残基的变体,例如含有序列seqidno:9的全长重链的氧化met258、met364和/或met434。“色氨酸氧化变体”指其中包含一个或多个氧化色氨酸残基的变体。在某些实施方案中,该色氨酸氧化变体包含一个或多个色氨酸残基的氧化,该一个或多个色氨酸残基选自含有序列seqidno:7的vh序列的重链可变区的w53、w108及含有序列seqidno:8的vl序列的轻链可变区的w94。术语“抗体”在本文中以最广泛的含义使用,且涵盖多种抗体结果,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们显示希望得到的抗原结合活性。在某些实施方案中,该组合物包含il-17a/f抗体,该il-17a/f抗体是全人抗体、人源化抗体或嵌合抗体。在某些其他实施方案中,该抗体是双特异性或多特异性抗体。在某些实施方案中,该双特异性或多特异性抗体具有至少两种不同的结合特异性,结合特异性之一针对il-17a同二聚体、il-17f同二聚体和il-17af异二聚体。“抗体片段”指除完整抗体以外的包含完整抗体的部分的分子,其结合该完整抗体所结合的抗原。抗体片段的实例包括但不限于fv、fab、fab'、fab’-sh、f(ab')2;双抗体;线性抗体;单链抗体分子(例如scfv);及从抗体片段形成的多特异性抗体。抗体的“种类”指其重链所具有的恒定结构域或恒定区的类型。存在5个主要的抗体种类:iga、igd、ige、igg和igm,这些种类中的几种可以进一步划分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同种类的免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。本文的术语“fc区”用来定义免疫球蛋白重链的c端区域,其包含至少部分恒定区。该术语包括天然序列fc区和变体fc区。在一个实施方案中,人igg重链fc区从cys226或从pro230(在含有氨基酸序列seqidno:9的重链的实例中分别为cys232和pro236)延伸至重链的羧基端。但是,fc区的c端赖氨酸可以存在或不存在。除非本文另有说明,fc区或恒定区中的氨基酸残基的编号按照kabat等,sequencesofproteinsofimmunologicalinterest,第5版publichealthservice,nationalinstitutesofhealth,bethesda,md,1991中所述的eu编号系统,也称为eu指数。“构架”或“fr”指高变区(hvr)残基之外的可变结构域残基。可变结构域的fr一般由四个fr结构域组成:fr1、fr2、fr3和fr4。因此,hvr和fr序列一般按以下顺序出现在vh(或vl)中:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。术语“全长抗体”、“完整抗体”和“全抗体”在本文中可互换使用,指具有基本上类似于天然抗体结构的结构或具有包含本文所定义的fc区的重链的抗体。术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换使用,指已将外源核酸引入其中的细胞,包括这类细胞的后代。宿主细胞包括“转化体”和“转化细胞”,其包括最初转化的细胞及从其衍生的后代,而不考虑传代数。后代的核酸含量可以并非与亲本细胞完全相同,而是可以包含突变。本文包括具有与在最初转化的细胞中筛选或选择的功能或生物学活性相同的功能和生物学活性的突变体后代。“人抗体”是具有这样的氨基酸序列的抗体,该氨基酸序列对应于由人或人细胞产生或衍生自利用人抗体库或其他人抗体编码序列的非人来源的抗体的氨基酸序列。人抗体的此定义明确排除了包含非人抗原结合残基的人源化抗体。本文所用的术语“单克隆抗体”指获自基本上同质的抗体群体的抗体,即除了例如包含天然存在的突变或在产生单克隆抗体制剂期间出现的可能的变体抗体(这类变体通常以较小的量存在)外,包含该群体的单种抗体相同的表位和/或结合相同的表位。与通常包含抗不同决定簇(表位)的不同抗体的多克隆抗体制剂不同,单克隆抗体制剂的每种单克隆抗体抗抗原上的单个决定簇。因此,修饰词“单克隆”指抗体获自基本上同质的抗体群体的特征,而不解释为需要通过任意具体的方法来产生该抗体。例如,将要按照本发明使用的单克隆抗体可以通过多种技术来制备,其包括但不限于杂交瘤法、重组dna法、噬菌体展示法和利用含有全部或部分人免疫球蛋白基因座的转基因动物的方法,本文描述用于制备单克隆抗体的这类方法和其他示例性方法。在本文中使用时,术语“高变区”指抗体的负责抗原结合的氨基酸残基。高变区通常包含来自“互补决定区”或“cdr”的氨基酸残基(例如,轻链可变结构域中的残基24-34(l1)、50-56(l2)和89-97(l3),重链可变结构域中的31-35b(h1)、50-65(h2)和95-102(h3);kabat等,sequencesofproteinsofimmunologicalinterest,第5版publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991))和/或来自“高变环”的那些残基(例如轻链可变结构域中的残基26-32(l1)、50-52(l2)和91-96(l3),重链可变结构域中的26-32(h1)、53-55(h2)和96-101(h3);chothia和leskj.mol.biol.196:901-917(1987))。“构架区”或“fr”残基是除本文定义的高变区残基外的那些可变结构域残基。非人(例如啮齿类)抗体的“人源化”形式是嵌合抗体,其包含最少的衍生自非人免疫球蛋白的序列。在大多数情况下,人源化抗体是人免疫球蛋白(受体抗体),其中用来自具有希望得到的特异性、亲和力和容量的诸如小鼠、大鼠、兔或非人灵长类的非人物种的高变区(供体抗体)的残基取代来自受体的高变区的残基。在一些情况下,人免疫球蛋白的框架区(fr)残基被相应的非人残基取代。此外,人源化抗体可以包含不见于受体抗体中或供体抗体中的残基。产生这些修饰来进一步改进抗体性能。通常,人源化抗体将包含至少一个(且通常为两个)可变结构域的基本上全部,其中全部或基本上全部高变环对应于非人免疫球蛋白的那些,全部或基本上全部fr是人免疫球蛋白序列的那些。人源化抗体还将可选地包含至少部分免疫球蛋白恒定区(fc),通常是人免疫球蛋白的恒定区。进一步的详情参见jones等,nature321:522-525(1986);riechmann等,nature332:323-329(1988);和presta,curr.op.struct.biol.2:593-596(1992)。本文用术语“fc区”来定义免疫球蛋白重链的c端区域,包括天然序列fc区和变体fc区。虽然免疫球蛋白重链fc区的边界可以不同,但人igg重链fc区通常定义为从cys226位或从pro230位的氨基酸残基延伸至其羧基端。fc区c端赖氨酸(按照eu编号系统的残基449)可以例如在产生或纯化抗体期间去除,或通过重组改造编码抗体重链的核酸去除。因此,完整抗体的组合物可以包含去除了所有k449残基的抗体群体、未去除k449残基的抗体群体及具有含k449残基和不含k449残基的抗体的混合物的抗体群体。除非另有说明,可变结构域中的hvr残基和其他残基(例如fr残基)在本文中按照kabat等,sequencesofproteinsofimmunologicalinterest,第5版publichealthservice,nationalinstitutesofhealth,bethesda,md.(1991)编号,其在此明确引入作为参考。“kabat中的eu指数”指人igg1eu抗体的残基编号。“功能性fc区”具有天然序列fc区的“效应子功能”。示例性“效应子功能”包括c1q结合;依赖补体的细胞毒性;fc受体结合;依赖抗体的细胞毒性(adcc);吞噬作用;细胞表面受体(例如b细胞受体;bcr)的下调等。这类效应子功能通常需要fc区与结合结构域(例如抗体可变结构域)组合,且可以用多种测定评估。“天然序列fc区”包含与见于自然界中的fc区的氨基酸序列相同的氨基酸序列。天然序列人fc区包括:天然序列人igg1fc区(非a和a同种异型);天然序列人igg2fc区;天然序列人igg3fc区;和天然序列人igg4fc区;及其天然存在的变体。“裸抗体”指未与异源分子如细胞毒性部分或放射性标记缀合的抗体。“免疫缀合物”是与一个或多个异源分子(包括但不限于细胞毒性剂)缀合的抗体。“分析测定”是定性评估和/或定量测量组合物中分析物(例如抗体变体)的存在或量的测定。进行测定的组合物可以是纯化的组合物,包括药物组合物。“个体”或“对象”是哺乳动物。哺乳动物包括但不限于饲养的动物(例如牛、绵羊、猫、狗和马)、灵长类(例如人类和非人灵长类,如猴)、兔和啮齿类(例如小鼠和大鼠)。在某些实施方案中,该个体或对象是人。本文所用的“处理”(及其语法变形)指改变所处理的个体的自然过程的尝试中的临床干预,且可以为了预防而进行或在临床病理的过程中进行。希望得到的处理作用包括但不限于防止疾病的发生或复发、减轻症状、减少疾病的任何直接或间接的病理结果、防止转移、降低疾病进展的速率、改善或缓和疾病状态及消退或改善的预后。在一些实施方案中,用包含本发明的主要种类抗体及其变体的抗体组合物来延迟疾病的发展或减慢疾病的进展。药物(例如药物制剂)的“有效量”指对在必要的剂量和时间下达到希望得到的治疗或预防结果有效的量。“容器”指可以用来容纳或包含药物组合物或组合物的物体。本文的容器的实例包括小瓶、注射器、静脉注射袋(intravenousbag)等。“静脉注射袋”或“iv袋”是可容纳溶液的袋子,该溶液可以经患者的静脉施用。在一个实施方案中,该溶液是盐水溶液(例如约0.9%或约0.45%nacl)。可选地,该iv袋形成自聚烯烃或聚氯乙烯。“小瓶”是适合用于容纳液体或冻干制剂的容器。在一个实施方案中,该小瓶是一次性使用小瓶,例如具有塞子的20-cc一次性使用小瓶。“包装说明书”是按照美国食品与药品管理局(fda)或其他监管机构的命名必须放置在每种处方药的包装内侧的散页。该散页通常包括药物商标、其通用名及其作用机制;陈述其适应症、禁忌症、警告、预防措施、副作用和剂型;且包括关于建议的给药剂量、时间和途径的说明。“药物组合物”是包含具有药物活性的药物(例如抗il-17a/f抗体mcaf5352a及其变体形式,如本文中公开的那些)和一种或多种可安全地对人患者施用的“药物活性赋形剂”(例如缓冲剂、稳定剂、渗透压调节剂、防腐剂、表面活性剂等)的组合物。这类组合物可以是例如液体或冻干组合物。在某些实施方案中,该组合物进一步包含一种或多种其他活性药物。术语“免疫相关疾病”指其中哺乳动物的免疫系统的成分引起、介导或以其他成分促成哺乳动物中的发病的疾病。还包括其中刺激或干预免疫反应对疾病进程具有改善作用的疾病。免疫介导的炎性疾病、非免疫介导的炎性疾病、感染性疾病、免疫缺陷疾病、瘤形成等也包括在此术语内。术语“t细胞介导的疾病”指其中t细胞直接或间接介导或以其他方式促成哺乳动物中的发病的疾病。t细胞介导的疾病可以与细胞介导的作用、淋巴因子介导的作用等相关,甚至在例如t细胞分泌的淋巴因子刺激b细胞时与b细胞相关作用相关。可以按照本发明治疗的免疫相关和炎性疾病(其中一些为免疫细胞或t细胞介导)的实例包括:系统性红斑狼疮、类风湿性关节炎、幼年型慢性关节炎、脊椎关节炎、系统性硬化病(scieroderma)、特发性炎性肌病(皮肌炎、多肌炎)、综合征、系统性血管炎、结节病、自身免疫性溶血性贫血(免疫性全血细胞减少、阵发性睡眠性血红蛋白尿症)、自身免疫性血小板减少(特发性血小板减少性紫癜,免疫介导的血小板减少症)自身免疫性血小板减少症(特发性血小板减少性紫癜,免疫介导的血小板减少)、甲状腺炎(grave病、桥本甲状腺炎、幼年型淋巴细胞性甲状腺炎、萎缩性甲状腺炎)、糖尿病、免疫介导的肾病(肾小球肾炎、肾小管间质性肾炎)、中枢和外周神经系统脱髓鞘病(如多发性硬化、特应性脱髓鞘性多神经病或guillain-barré综合征和慢性炎性脱髓鞘性多神经病)、肝胆疾病(如感染性肝炎(甲型、乙型、丙型、丁型、戊型肝炎及其他非亲肝病毒)、哮喘、自身免疫性慢性活动性肝炎、原发性胆汁性肝硬化、肉芽肿性肝炎和硬化性胆管炎)、炎性肠病(包括溃疡性结肠炎、克罗恩病、麸质性敏感性肠病和whipple病)、自身免疫或免疫介导的皮肤病(包括大疱性皮肤病、多形性红斑和接触性皮炎)、银屑病、变应性疾病(如哮喘、变应性鼻炎、特应性皮炎、食物超敏反应和荨麻疹)、肺免疫性疾病(如嗜酸细胞性肺炎、特发性肺纤维化和过敏性肺炎)、移植相关疾病(包括移植排斥和移植物抗宿主病)。感染性疾病包括病毒性疾病(如aids(hiv感染)、甲型、乙型、丙型、丁型和戊型肝炎、疱疹等)、细菌感染、真菌感染、原生动物感染和寄生虫感染。术语“细胞增殖相关障碍”或“细胞增殖性障碍”或“增殖性障碍”指与某种程度的异常细胞增殖相关的障碍。在某些实施方案中,该细胞增殖性障碍是癌症。在一些实施方案中,该细胞增殖性障碍是肿瘤。本文所用的“肿瘤”指无论恶性还是良性的所有赘生性细胞生长和增殖及所有癌前和癌细胞和组织。在本文中提到时,术语“癌症”、“癌性的”、“细胞增殖性障碍”、“增殖性障碍”和“肿瘤”不相互排斥。在一些实施方案中,待通过本公开的方法治疗的癌症包括但不限于:结直肠癌、肾细胞癌症(例如肾细胞癌)、黑素瘤、膀胱癌、卵巢癌、乳腺癌(例如三阴乳腺癌、her2阳性乳腺癌或激素受体阳性癌症)和非小细胞肺癌(例如鳞状非小细胞肺癌或非鳞状非小细胞肺癌)。在一些实施方案中,待通过本公开的方法治疗的癌症包括但不限于癌、淋巴瘤、母细胞瘤、肉瘤和白血病。在一些实施方案中,待通过本公开的方法治疗的癌症包括但不限于鳞状细胞癌、肺癌(包括小细胞肺癌、非小细胞肺癌、肺腺癌和肺鳞状细胞癌)、黑素瘤、肾细胞癌、腹膜癌、肝细胞癌、胃或腹部癌(包括胃肠癌)、胰腺癌、成胶质细胞瘤、宫颈癌、卵巢癌、肝癌、膀胱癌、肝癌、乳腺癌、结肠癌、结直肠癌、子宫内膜或子宫癌、涎腺癌、肾癌、肝癌、前列腺癌、外阴癌、甲状腺癌、肝癌和多种类型的头颈癌,以及b细胞淋巴瘤(包括低级/滤泡性非霍奇金淋巴瘤(nhl)、小淋巴细胞性(sl)nhl、中级/滤泡性nhl、中级弥漫性nhl、高级免疫母细胞性nhl、高级淋巴母细胞性nhl、高级小非裂细胞性nhl、巨块病性nhl、套细胞淋巴瘤、aids相关淋巴瘤和waldenstrom巨球蛋白血症)、慢性淋巴细胞性白血病(cll)、急性髓性白血病(all)、多毛细胞白血病、慢性成髓细胞性白血病和移植后淋巴增生性障碍(ptld),以及与瘢痣病、水肿(如与脑肿瘤相关的水肿)和meigs综合征相关的异常血管增生。在一些实施方案中,该癌症可以是早期癌症或晚期癌症。在一些实施方案中,该癌症可以是原发性肿瘤。在一些实施方案中,该癌症可以是源自任意以上癌症类型的第二部位处的转移性肿瘤。“重组”蛋白质是通过遗传修饰的宿主细胞如中国仓鼠卵巢(cho)宿主细胞产生的蛋白质。“生产规模”指用fda或其他监管机构批准的商业化方法按商业化规模(例如按12,000升(l)或更大规模)生产蛋白质药物(例如抗体)。“纯化”指一个或多个纯化步骤,如蛋白a层析、离子交换层析、大小排阻层析、疏水作用柱层析等。“分离的”变体指已通过一个或多个纯化或分析方法从主要种类或野生型抗体分开的变体。这类分离的变体可以针对其生物学活性和/或功效进行评价。ii.抗体组合物(a)主要种类抗体本文的抗体组合物包含结合人il-17a、il-17f和il-17af异二聚体的抗体(抗il-17a/f抗体)。在某些实施方案中,该抗体是人抗体。在某些其他实施方案中,该抗体是人源化抗体。该人源化抗体可以例如包含源自非人来源的高变区,该高变区掺入人可变重链结构域。除非另有说明,可变结构域编号按照kabat等,sequencesofproteinsofimmunologicalinterest,第5版publichealthservice,nationalinstitutesofhealth,bethesda,md(1991)中所示的编号系统。在某些实施方案中,该抗il-17a/f抗体包含cdr-h1(seqidno:1)、cdr-h2(seqidno:2)和cdr-h3(seqidno:3)、cdr-l1(seqidno:4)、cdr-l2(seqidno:5)和cdr-l3(seqidno:6)。本发明还考虑那些cdr残基的氨基酸修饰,例如,其中该修饰基本保持或改善该抗体的亲和力。例如,用于本发明方法的抗体变体可以在以上可变重链cdr序列中具有约1个至约7个或约5个氨基酸取代。这类抗体变体可以通过亲和力成熟来制备。考虑多种形式的人源化抗体或亲和力成熟抗体。备选地,该人源化抗体或亲和力成熟抗体可以是完整抗体,例如完整igg1抗体。在某些实施方案中,该抗il-17a/f抗体包含含有序列seqidno:7的重链可变区和/或含有序列seqidno:8的轻链可变区。在某些具体实施方案中,该抗il-17af抗体包含含有序列seqidno:9的重链和/或含有序列seqidno:10的轻链。在某些实施方案中,c端lys可选地存在于重链中。seqidno:7(vh)seqidno:8(vl)seqidno:9(hc)seqidno:10(lc)seqidno:12(含前导序列的全长人il-17a,swiss-prot检索号q16552.1)seqidno:13(含前导序列的全长人il-17f,swiss-prot检索号q96pd4.3)(b)糖基化变体在一方面,本发明提供处于分离形式、富集形式或处于包含糖基化变体和主要种类抗体的组合物中的糖基化变体抗体。在某些实施方案中,该糖基化是cdr-h2(seqidno:2)的asn残基上的n连接糖基化。在某些实施方案中,该组合物中糖基化变体的量不超过(即等于或小于)约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%或不超过约1%。在某些实施方案中,该组合物中糖基化变体的量不超过约2%。在某些实施方案中,通过lc-ms测定该组合物中糖基化的量。包含高水平糖基化变体的抗il-17a/f抗体组合物显示与il-17a、il-17f和/或il-17af的结合减少,和/或对il-17a、il-17f和/或il-17af的中和活性降低,和/或免疫原性提高,和/或血清清除率提高。(c)lmws和hmws变体本发明提供处于分离形式、富集形式或处于包含lmws和/或hmws变体和主要种类抗体的组合物中的抗il17a/f抗体的低分子量种类(lmws)变体和/或高分子量种类(hmws)变体。该lmws和hmws变体可以用多种技术(非限制性地包括大小排阻高效液相层析(se-hplc)和/或毛细管电泳-十二烷基硫酸钠(ce-sds))分离、表征和定量。使用se-hplc测定(例如,如实施例2中),组合物中主要种类抗il-17a/f抗体和hmws变体或lmws变体的量可以是:主峰:≥约98.9%,例如≥约99.1%、≥约94.9%,例如≥约95.0%。hmws:≤约1%,例如≤约0.8%、≤约4.9%,例如≤约4.6%。lmws:≤约0.5%,例如≤约0.3%、≤约0.2%,例如≤约0.1%。在某些实施方案中,组合物中hmws变体的量不超过(或等于或小于)约10%、不超过约9%、不超过约8%、不超过约7%、不超过约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%或不超过约1%。在某些实施方案中,组合物中lmws变体的量不超过(或等于或小于)约2%、不超过约1%、不超过约0.5%、不超过约0.3%或不超过约0.1%。在某些实施方案中,通过sec(或se-hplc)测量该组合物中hmws变体或lmws变体的量。在某些实施方案中,如通过sec测量,该组合物包含不超过约1%的hmws变体和/或不超过约0.1%的lmws变体。在某些实施方案中,通过光照暴露诱导hmws变体。包含高水平hmws变体的抗il-17a/f抗体组合物显示与il-17a、il-17f和/或il-17af的结合减少,和/或对il-17a、il-17f和/或il-17af的中和活性降低,和/或免疫原性提高,和/或血清清除率提高。(d)rr交联变体本发明涉及处于分离形式、富集形式或处于包含rr交联变体和主要种类抗体的组合物中的抗il17a/f抗体的抗还原(rr)交联变体。该rr交联变体可以用多种技术(非限制性地包括大小排阻高效液相层析(se-hplc)、有机相sec(op-sec)和/或毛细管电泳-十二烷基硫酸钠(ce-sds))分离、表征和定量。在用诸如dtt的还原剂处理过样品时,op-sec也可以称为还原型op-sec。在某些实施方案中,该交联由光照暴露诱导。在某些实施方案中,该交联是在cys和cys残基之间。在某些其他实施方案中,该交联是在trp和trp残基之间。该交联可以是分子间或分子内交联。在某些实施方案中,该组合物中rr交联变体的量不超过(即等于或小于)约6%、不超过约5%、不超过约4%、不超过约3%、不超过约2%或不超过约1%。在某些实施方案中,通过还原型op-sec测定该组合物中rr交联变体的量。在某些实施方案中,如通过还原型op-sec测定,该组合物中rr交联变体的量不超过约3%。在某些实施方案中,包含高水平rr交联变体的抗il-17a/f抗体组合物显示与il-17a、il-17f和/或il-17af的结合减少,和/或对il-17a、il-17f和/或il-17af的中和活性降低,和/或免疫原性提高,和/或血清清除率提高。(e)酸性变体本发明还涉及处于分离形式、富集形式或处于包含酸性变体和主要种类抗体的组合物中的抗il17a/f抗体的酸性变体。该酸性变体可以用多种技术(非限制性地包括成像毛细管等电聚焦(icief)、离子交换层析(iec)或ph梯度iec分析)分离、表征和定量。在某些实施方案中,组合物中酸性变体的量不超过(即等于或小于)约45%、不超过约42%、不超过约40%、不超过约38%、不超过约35%、不超过约32%、不超过约30%、不超过约28%、不超过约25%或不超过约20%、约30%至约42%、约31%至约42%、约32%至约42%、约33%至约42%、约34%至约42%、约35%至约42%、约37%至约42%、约39%至约42%或约40%至约42%。在某些实施方案中,通过icief测定该组合物中酸性变体的量。在某些实施方案中,组合物中酸性变体的量不超过42%。在某些实施方案中,该组合物中主峰的量为至少约50%、至少约54%、至少约56%、至少约58%、至少约59%、至少约60%、至少约61%、至少约63%、至少约66%、至少约68%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或更多。在某些实施方案中,该组合物中的酸性变体可以包括糖化变体、糖基化变体、脱酰胺变体、二硫键还原变体、唾液酸化变体和不可还原变体中的一种、两种、三种、四种或五种。在某些实施方案中,该酸性变体由光照暴露诱导。在某些实施方案中,包含高水平酸性变体的抗il-17a/f抗体组合物显示与il-17a、il-17f和/或il-17af的结合减少,和/或对il-17a、il-17f和/或il-17af的中和活性降低,和/或免疫原性提高,和/或血清清除率提高。通常,纯化可以影响存在于该组合物中的变体的量。纯化方法的选择可以增加或减少存在于该组合物中的每种变体的量。常用的纯化方法非限制性地包括蛋白a亲和柱、疏水作用层析、大小排阻柱和离子交换柱层析。(f)免疫缀合物在某些实施方案中,该组合物包含含有与一种或多种细胞毒性剂缀合的抗il-17a/f抗体的免疫缀合物,该细胞毒性剂如化疗剂或药物、生长抑制剂、毒素(例如蛋白质毒素,细菌、真菌或动物来源的具有酶活性的毒素,或其片段)或放射性同位素。在一个实施方案中,免疫缀合物是抗体-药物缀合物(adc),其中抗体与一种或多种药物缀合,该药物包括但不限于美登木素生物碱(参见美国专利号5,208,020、5,416,064和欧洲专利ep0425235b1);auristatin,如monomethylauristatin药物部分de和df(mmae和mmaf)(参见美国专利号5,635,483和5,780,588和7,498,298);多拉司他汀(dolastatin);棘孢霉素(calicheamicin)或其衍生物(参见美国专利号5,712,374、5,714,586、5,739,116、5,767,285、5,770,701、5,770,710、5,773,001和5,877,296;hinman等,cancerres.53:3336-3342(1993);及lode等,cancerres.58:2925-2928(1998));蒽环类抗生素,如柔红霉素或阿霉素(参见kratz等,currentmed.chem.13:477-523(2006);jeffrey等,bioorganic&med.chem.letters16:358-362(2006);torgov等,bioconj.chem.16:717-721(2005);nagy等,proc.natl.acad.sci.usa97:829-834(2000);dubowchik等,bioorg.&med.chem.letters12:1529-1532(2002);king等,j.med.chem.45:4336-4343(2002);及美国专利号6,630,579);氨甲喋呤;脱乙酰长春花碱(vindesine);紫杉烷(taxane),如多西紫杉醇(docetaxel)、紫杉醇、larotaxel、tesetaxel和ortataxel;单端孢霉烯;及cc1065。在另一实施方案中,免疫缀合物包含与酶活性毒素或其片段缀合的本文所述抗体,该酶活性毒素或其片段包括但不限于白喉a链、白喉毒素的非结合活性片段、外毒素a链(来自铜绿假单胞菌(pseudomonasaeruginosa))、蓖麻毒蛋白a链、相思豆毒蛋白a链、塑莲根毒蛋白a链、α-帚曲霉素、油桐(aleuritesfordii)蛋白质、香石竹毒蛋白、美洲商陆(phytolacaamericana)蛋白质(papi、papii和pap-s)、苦瓜(momordicacharantia)抑制剂、麻风树毒蛋白、巴豆毒蛋白、sapaonariaofficinalis抑制剂、多花白树毒蛋白、米托洁林(mitogellin)、局限曲霉素、酚霉素、伊诺霉素和单端孢霉烯。在另一实施方案中,免疫缀合物包含与放射性原子缀合形成放射性缀合物的本文所述抗体。可用多种放射性同位素来产生放射性缀合物。实例包括at211、i131、i125、y90、re186、re188、sm153、bi212、p32、pb212及lu的放射性同位素。在放射性缀合物用于检测时,它可以包含用于闪烁照相研究的放射性原子,例如tc99m或i123,或者用于核磁共振(nmr)成像(也称为磁共振成像,mri)的自旋标记物,如碘-123、碘-131、铟-111、氟-19、碳-13、氮-15、氧-17、钆、锰或铁。可以用多种双功能蛋白质偶联剂来产生抗体和细胞毒性剂的缀合物,如3-(2-吡啶二巯基)丙酸n-琥珀酰亚胺酯(spdp)、4-(n-马来酰亚胺基甲基)环己烷-1-羧酸-琥珀酰亚胺酯(smcc)、亚胺基硫烷(it)、亚胺酯的双功能衍生物(如己二酰亚氨酸二甲酯hcl)、活性酯(如辛二酸二琥珀酰亚胺酯)、醛(如戊二醛)、二-叠氮基化合物(如二(对-叠氮基苯甲酰基)己二胺)、二-重氮基衍生物(如二-(对-重氮基苯甲酰基)-乙二胺)、二异氰酸酯(如2,6-二异氰酸甲苯酯)和双活性氟化合物(如1,5-二氟-2,4-二硝基苯)。例如,可以按照vitetta等,science238:1098(1987)中所述制备蓖麻毒蛋白免疫毒素。碳14标记的3-甲基二乙烯三胺五乙酸1-异硫氰基苄酯(mx-dtpa)是用于将放射性核苷酸与抗体缀合的示例性螯合剂。参见wo94/11026。接头可以是便于在细胞中释放细胞毒性药物的“可切割接头”。例如,可以使用酸敏感接头、肽酶敏感接头、光敏感接头、二甲基接头或包含二硫化物的接头(chari等,cancerres.52:127-131(1992);美国专利号5,208,020)。本文的免疫缀合物或adc明确考虑但不限于用包括但不限于bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc、磺基-smpb和svsb(琥珀酰亚胺基-(4-乙烯砜)苯甲酸酯)的市售交联剂(例如来自piercebiotechnology,inc.,rockford,il.,u.s.a)制备的这类缀合物。iii.制备和分析方法根据本发明的一个实施方案,提供用于评价抗il-17a/f抗体组合物的方法,其包括以下一步、两步、三步或四步:(1)测量该组合物中糖基化变体的量;和/或(2)测量该组合物中rr交联变体的量;和/或(3)测量该组合物中hmws变体和/或lmws变体的量;和/或(4)测量该组合物中酸性变体的量。可选地,对包含il-17a/f抗体及其变体的组合物进行全部四种分析测定。本发明还涉及用于制备组合物的方法,其包括:(1)产生包含抗il-17a/f抗体及其一种或多种变体的组合物;和(2)对这样产生的组合物进行一种或多种分析测定来评价其中变体的量。该分析测定可以评价和定量以下任何一种或多种的量:(i)糖基化变体和/或(ii)rr交联变体和/或(iii)hmws变体和/或lmws变体和/或(iv)酸性变体。因此,可以分析这些变体中的一种、两种、三种或四种。在某些实施方案中,使这样产生的组合物避光。在某些实施方案中,该分析测定评价、定量或分离糖基化变体(包括异二聚体和/或同二聚体变体)、和/或hmws变体、和/或rr交联变体、和/或酸性变体。例如,该分析测定可以非限制性地包括se-hplc、op-sec、或icief、离子交换柱层析、反相(rp)hplc、lc/ms、肽作图分析、胰蛋白酶作图的lc/ms分析、或胰蛋白酶作图的肽n糖苷酶消化后的lc/ms、毛细管电泳-激光诱导荧光(ce-lif)、2-氨基-苯甲酰胺(2-ab)标记和2-氨基苯甲酸(2-aa)标记。此外,该方法包括评价抗il-17a/f抗体组合物的生物学活性,其包括测量该组合物中糖基化变体、和/或hmws变体、和/或rr交联变体、和/或酸性变体的量,以测定该组合物对il-17a、il-17f和/或il-17af的结合亲和力,和/或该组合物对il-17a、il-17f和/或il-17af诱导活性的抑制、中和作用,并确认该组合物中糖基化变体、和/或hmws变体、和/或rr交联变体、和/或酸性变体的量处于各自的可接受范围内。在某些实施方案中,该结合亲和力可以通过例如ria、elisa或来测定。在某些实施方案中,本文提供的抗体具有≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8m或更小,例如从10-8m至10-13m,例如从10-9m至10-13m)的解离常数(kd)。在一个实施方案中,通过放射性标记抗原结合测定(ria)来测量kd。在一个实施方案中,用fab形式的目的抗体及其抗原进行ria。例如,通过在未标记抗原的滴定系列的存在下用最小浓度的(125i)-标记抗原平衡fab,然后用抗-fab抗体包被的平板捕获结合的抗原,来测量fab对抗原的溶液结合亲和力(参见例如chen等,j.mol.biol.293:865-881(1999))。为了确定用于测定的条件,用含5μg/ml捕获抗-fab抗体(cappellabs)的50mm碳酸钠(ph9.6)过夜包被多孔板(thermoscientific),然后用含2%(w/v)牛血清白蛋白的pbs在室温(约23℃)封闭2至5小时。在非吸附平板(nunc#269620)中,将100pm或26pm[125i]-抗原与目的fab的系列稀释液混合(例如,与presta等,cancerres.57:4593-4599(1997)中的抗vegf抗体fab-12的评估一致)。然后过夜孵育目的fab;但是,孵育可以持续更长时期(例如约65小时),以确保达到平衡。然后,将混合物转移至捕获平板进行室温孵育(例如孵育1小时)。然后去除溶液,用含0.1%聚山梨酸酯的pbs洗涤平板8次。平板干燥后,加入150μl/孔的闪烁体(microscint-20tm;packard),在topcounttmγ计数器(packard)上计数平板10分钟。选择给出小于或等于最大结合的20%的每种fab的浓度用于竞争结合测定。根据另一实施方案,可以用表面等离振子共振测定测量kd。例如,用~10个响应单位(ru)的固定化抗原cm5芯片,在25℃下用或(biacore,inc.,piscataway,nj)进行测定。在一个实施方案中,按照厂家说明书用n-乙基-n’-(3-二甲基氨基丙基)-碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)活化羧甲基化葡聚糖生物传感芯片(cm5,biacore,inc.)。用10mm醋酸钠ph4.8将抗原稀释至5μg/ml(~0.2μm),然后按5μl/分钟的流速注入,以达到约10个响应单位(ru)的偶联蛋白质。注入抗原后,注入1m乙醇胺,以封闭未反应的基团。对于动力学测量,按约25μl/分钟的流速在25℃下注入两倍系列稀释于含0.05%聚山梨酸酯20(tween-20tm)表面活性剂的pbs(pbst)中的fab(0.78nm至500nm)。通过同时拟合结合和解离传感图,用简单的1:1langmuir结合模型(evaluationsoftware,版本3.2)计算结合速率(kon)和解离速率(koff)。将平衡解离常数(kd)计算为比值koff/kon。参见例如chen等,j.mol.biol.293:865-881(1999)。如果通过以上表面等离振子共振测定测量的结合速率超过106m-1s-1,则可以通过使用荧光淬灭技术来测定结合速率,如在分光计,如装配停流的分光光度计(avivinstruments)或具有搅拌杯的8000系列slm-amincotm分光光度计(thermospectronic)中测量,该技术在浓度递增的抗原存在下测量含20nm抗抗原的抗体(fab形式)的pbsph7.2在25℃下的荧光发射强度(激发=295nm;发射=340nm,16nm带通)的提高或降低。该方法可选地进一步包括将该组合物与一种或多种可药用赋形剂组合来制备药物组合物。此外,该药物组合物可以放入与包装说明书(例如含有说明其用该药物组合物来治疗癌症的用途的处方信息)包装在一起的容器,以制备制品。iv.药物组合物通过将具有所希望的纯度的组合物与可选的可药用赋形剂(remington'spharmaceuticalsciences第16版,osol,a.编辑(1980))混合,通常以冻干制剂或水溶液的形式制备用于储存的,包含抗il-17a/f抗体及其一种或多种变体的药物组合物。也考虑抗体晶体(参见美国专利申请号2002/0136719)。可药用赋形剂在所利用的剂量和浓度下对受体无毒性,且包括缓冲剂,如乙酸组氨酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他糖类,包括葡萄糖、甘露糖或糊精;螯合剂,如edta;糖,如蔗糖、甘露醇、海藻糖或山梨醇;成盐抗衡离子,如钠;金属络合物(例如zn-蛋白质络合物);和/或非离子型表面活性剂,如聚山梨酸酯(例如聚山梨酸酯20或80)、pluronicstm或聚乙二醇(peg)。待用于体内施用的药物组合物必须无菌。这可以容易地通过滤过无菌滤膜来达到。v.治疗应用和用途可以对有需要的个体施用本文所述的组合物来治疗免疫相关或炎性疾病或细胞增殖相关疾病如癌症。在一方面,提供本文提供的组合物用作药物。在其他方面,提供用于治疗免疫相关或炎性疾病或细胞增殖相关疾病的组合物。在某些实施方案中,提供用于治疗方法的组合物。在某些实施方案中,本发明提供本文所述组合物用于治疗患有免疫相关疾病或炎性疾病或细胞增殖相关疾病的个体的方法,该方法包括对该个体施用有效量的组合物。在一个这种实施方案中,该方法进一步包括对该个体施用有效量的至少一种例如下文所述的附加治疗剂。在另一方面,本发明提供用于治疗免疫相关疾病或炎性疾病或细胞增殖相关疾病的方法。在一个实施方案中,该方法包括对患有这种免疫相关疾病或炎性疾病或细胞增殖相关疾病的个体施用有效量的本文所述组合物。在一个这种实施方案中,该方法进一步包括对该个体施用有效量的至少一种例如下文所述的附加治疗剂。在另一方面,本发明提供包含本文提供的任意组合物的药物制剂,例如用于任何上述治疗方法。在一个实施方案中,药物制剂包含本文提供的任意组合物和可药用载体。在另一实施方案中,药物制剂包含本文提供的任意组合物和至少一种例如下文所述的附加治疗剂。本发明的组合物可以在治疗中单独使用或与其他药物联合使用。例如,本发明的组合物可以与至少一种附加治疗剂共同施用。在某些实施方案中,该附加治疗剂是拮抗抗体、激动抗体、化疗剂或细胞毒性剂。上文指出的这类联合治疗涵盖联合施用(其中两种或多种治疗剂包含在相同或分开的制剂中)和分开施用,在分开施用的情况下,本发明的组合物的施用可以发生在施用该一种或多种附加治疗剂之前、与之同时和/或之后。在一个实施方案中,本发明的组合物的施用和附加治疗剂的施用发生在彼此的约一个月之内、或约一周、两周或三周之内、或约一天、两天、三天、四天、五天或六天之内。本发明的组合物还可以与放疗联合使用。vi.制品本文的制品的一个实施方案包括容器,如小瓶、注射器或静脉注射(iv)袋,其包含本文的组合物或药物组合物。可选地,该制品进一步包括含有描述如何使用本文前一章节的组合物的处方信息的包装说明书。在某些实施方案中,使该制品避光。以下实施例说明本发明的具体实施方案及其多种用途。它们仅是为了解释的目的而给出,不视为限制本发明。实施例实施例1抗il-17a/fabmcaf5352a的糖基化变体通过中国仓鼠卵巢(cho)细胞产生抗il17a/f抗体mcaf5352a。对抗体进行用tosoh-biosciencesectskgelg3000swxl(7.8x300mm,5μm)柱在agilent1100hplc系统上进行的大小排阻层析(sec)。用流动相缓冲液(0.2mk2hpo4,0.25mkcl,ph6.2)在室温下按0.5ml/分钟等度运行30分钟。每次分析注入稀释在流动相缓冲液中的50μg抗体,并在280nm监测。用chromeleon软件包(dionex)分析数据。如图1a和图1b中所示,额外的峰(峰1)在sec分析中很明显分子量略大于ab主峰。lc-ms(液相层析-质谱分析法)数据确认峰1是质量增加在约2400-3000da范围内的种类的异质混合物(数据未显示)。该质量增加位于fab重链区域(数据未显示)。样品的sec分析显示,组合物包含约2%峰1。峰1抗dtt处理(数据未显示)。肽作图lc-ms数据表明,n连接糖基化造成峰1的存在(数据未显示)。用胰蛋白酶然后用pngase(肽n糖苷酶,newenglandbiolabs)37℃过夜处理富集的峰1样品。如图2中所示,pngase消化后出现新的峰,表明n连接糖基化在肽hc44-65中。随后,测定了fab上的糖基化位点。胰蛋白酶肽hc44-65包含序列glewvsginwssggigyadsvk(seqidno:11,hccdr2序列下划线),其中nws是n连接糖基化的共有序列。富集的峰1的胰蛋白酶图谱的lc-ms分析显示,pngase处理后多出的峰的质量略微增加,与pngase消化引起的asn至asp的转化一致。参加图3a-b。通过所收集的肽的n端测序确认了去糖基化的hc44-65中存在asp52。在质谱中观察到约30种不同的糖肽质量,精确质量结构分配显示,许多聚糖可能唾液酸化,确证了峰1的酸性性质(数据未显示)。在hccdr2中包含约90%糖基化变体的抗il-17a/f抗体的组合物显示功效降低。将峰1或富含糖基化变体的抗体样品的il-17a/f结合与含2%糖基化变体的组合物样品相比较。将不同浓度的抗体标准品、对照和样品加至il-17aa或il-17ff或il-17af包被的96孔板。用抗人-hrp和tmb底物溶液检测结合的il-17a/f抗体。将结果(表示为od)对il-17a/f抗体浓度作图,用4参数曲线拟合程序来估计抗il-17a/f抗体样品相对于参考物质的活性。结果报告为相对功效,指定包含2%糖基化变体的参考物质为100%。如以下表2中所示,hccdr2中糖基化的存在大幅降低通过elisa测量的与il-17aa、il-17ff和il-17af的结合。表2elisa比活性(n=2)结合aa57%结合af69%结合ff67%结果显示,与含有2%糖基化变体的样品相比,包含含有超过2%糖基化变体的抗il-17a/f抗体的样品显示降低很多的结合活性。实施例2抗il17a/fabmcaf5352a的光诱导变色与hmws形成关联抗il-17a/f抗体mcaf5352a显示非典型光敏感性,其可从暴露于光照如实验室环境光照而导致变色(黄化)、抗还原(rr)交联和hmws形成。为了进一步理解光敏感性特性,在ich指南条件(日晒试验)下对抗il-17a/f抗体进行光照暴露,并通过电荷变体分析、大小排阻分析、肽作图和质谱分析来评价。光胁迫样品制备使用以下ich指南条件,用atlassuntestcps+灯箱制备抗体样品:辐照度级=250瓦/平方米、总uv剂量=538瓦特-小时/平方米、总可见光剂量=1,320,000勒克斯-小时/平方米。暴露时间如所示。用成像毛细管等电聚焦(icief)分析进行电荷变体分析用100μm内径x5-cm长度的fc涂层碳氟化合物毛细管(pn101701,proteinsimple,sanjose,california)进行电荷变体分析。按以下配制两性电解质溶液:700μl1%甲基纤维素溶液(proteinsimple,santaclara,ca)、237μl纯化h2o、1ml5murea、44μlpharmalyte8-10.5(gehealthcare)、19μlpharmalyte5-8(gehealthcare,waukesha,wi)、8μlpi标记5.5(beckmancoulter,brea,ca)、8μlpi标记9.77(convergentbioscience,toronto,on)。将160μl两性电解质溶液与羧肽酶(cpb)处理(cpb与抗体比例1:100,37℃20分钟)后的40μl1mg/ml抗体混合。聚焦条件为1500v1分钟,然后3000v10分钟,然后检测280nm吸光度。大小排阻层析(sec)用tosoh-biosciencesectskgelg3000swxl(7.8x300mm,5μm)柱在agilent1100hplc系统上进行大小排阻层析(sec,也称为se-lc或sc-hplc)。用流动相缓冲液(0.2mk2hpo4,0.25mkcl,ph6.2)在室温下按0.5ml/分钟等度运行30分钟。每次分析注入稀释在流动相缓冲液中的50μg抗体,并在280nm监测。用chromeleon软件包(dionex,sunnyvale,ca)分析数据。有机相大小排阻层析(op-sec)用两根串联的tosoh-bioscience大小排阻层析tskgelsupersw3000(2x300mm,4μm)柱在agilent1200hplc系统上进行有机相sec。用有机流动相缓冲液(60%acn(乙腈)于h2o中、0.1%tfa(三氟乙酸))在70℃按0.25ml/分钟等度运行45分钟。所有样品按1mg/ml浓度配制在1ml20mmtris(ph7.5)缓冲液中。通过在10mmdtt中37℃孵育样品15分钟来进行mab的还原,然后加入20μl0.1%tfa,以防止二硫键重新形成。每次分析注入25μgmab,并在280nm监测。用chromeleon软件包(dionex,sunnyvale,ca)分析数据。qtofpremier质谱仪(waters,milford,ma)以正离子电喷雾离子化模式运行,并在线偶联至hplc系统进行op-sec-ms分析。用watersmasslynx软件包(版本4.1)(milford,ma)进行仪器控制和数据分析。用随masslynx提供的maxent1软件进行带多个电荷离子的去卷积。毛细管电泳-十二烷基硫酸钠(ce-sds)毛细管电泳-十二烷基硫酸钠(ce-sds)按以下进行。用荧光染料5羧基四甲基罗丹明琥珀酰亚胺酯衍生样品。通过凝胶过滤(用nap-5柱)去除游离染料后,通过加入sds/40mm碘乙酰胺并在70℃加热5分钟来制备非还原样品。对于还原样品的分析,将衍生的样品与1%(v/v)终浓度的sds和10μl含有1m二硫苏糖醇的溶液混合,并在70℃加热20分钟。用50μm内径的31.2cm熔融石英毛细管在beckmancoulterproteomelabpa800系统上分析所制备的样品,整个分析过程保持20℃。通过10kv电动注射40秒将样品引入毛细管。用ce-sds运行缓冲液作为筛分介质按-15kv恒压进行分离。用在488nm运行的氩离子激光器进行荧光激发,在560nm监测产生的发射信号。rcm(还原c-羧甲基化)胰蛋白酶肽作图和rp-hplc-ms分析将全长抗体样品稀释入变性缓冲液(6m胍、360mmtris、2mmedta、ph8.6),并通过在10mmdtt存在下45℃孵育10分钟来还原。还原后通过在20mm碘乙酸钠存在下45℃孵育样品10分钟进行s-羧甲基化来封闭半胱氨酸,然后用40mmdtt在室温下猝灭。然后通过上样至nap-5柱(gehealthcare)并用800ul胰蛋白酶消化缓冲液(20mmtrisph8.0)洗脱来对样品进行脱盐。用3%胰蛋白酶(w/w,rochelifescience)在37℃消化样品3.5小时。加入tfa至0.3%终浓度来终止消化。用配有phenomenexjupitertmc-18柱(2x250mm,5μm,)的agilent1200hplc分离胰蛋白酶肽。按0.25ml/分钟流速用在215分钟内从100%溶剂a(h2o,0.1%tfa)至45%溶剂b(acn,0.1%tfa)的梯度进行肽洗脱。用以正离子模式运行的orbitrapelitetm质谱仪(thermofisherscientific)进行在214nm观察到的层析峰的质谱分析。用thermoexcalibur软件进行数据分析。完整和还原质谱分析此测定的目的是确认完整抗体的分子量及还原抗体的重链和轻链的分子量。使用proteinchip(ii)43mmx75μm,zorbax300sb-c8,5μm柱,用agilentesi-tof(chiptof)分析样品。完整样品按0.1mg/ml配制在5%乙腈/0.1%甲酸中,并用aglientesi–tof分析。还原样品用20mg/mltcep在60℃处理10分钟,然后按0.05mg/ml配制在5%乙腈/0.1%甲酸中,并用aglientesi–tof分析。按0.05μl注入样品进行分析。用masshunter软件(agilentsoftwaresuit)去卷积(deconvoluted)完整和还原质量。使用o18标记的交联肽鉴定除以下例外之外,按上文所述制备和分析样品。在nap-5脱盐流程之后,将样品一分为二,并speed-vac处理至干燥。然后将样品重新溶解在lc-ms级h2o16或h2o18(99.7%原子纯度)中,并用重新溶解在适当h2o中的冻干胰蛋白酶按上文所述进行胰蛋白酶消化。按上文所述进行rp-hplc分析。用高碰撞诱导解离(hcd)片段化所有母离子,并用fouriertransfer(ft)分析仪检测相关跃迁来进行高质量准确度分析。使用天然胰蛋白酶作图的错配二硫键交联将样品稀释入变性缓冲液(7m胍、0.1mm乙酸钠、10mmn-乙基马来酰亚胺(nem)、ph5.5),并在37℃孵育2小时。然后通过上样至nap-5柱(gehealthcare)并用700ul胰蛋白酶消化缓冲液(0.1mtris、1mm氯化钙、ph7.5)洗脱来对样品进行脱盐。用10%胰蛋白酶(w/w,roche重组)在10%乙腈存在下在37℃过夜消化样品。将消化的样品一分为二(400μl),在15mmtris(2-羧乙基)膦(tcep)存在下37℃还原30分钟。向非还原和还原样品中加入25%tfa。结果光照暴露导致抗il-17a/f抗体的光诱导变色和抗还原hmws形成如图4中所示,暴露于光照的抗il-17a/f抗体mcaf5352a显示显著的光诱导黄化,amax为~430nm。在实验室环境光照和ich指南光照条件下都观察到光敏感性。与色氨酸氧化的预期光吸收(光吸收在315nm-370nm)相比,光吸收显著红移。首先用标准sec方法分析了在不同时间点暴露于光照的样品,以测定完整蛋白质中hmws形成的程度。sec数据表明光诱导的聚集存在线性增加,在24小时时间点达到近30%hmws(图5)。肽侧链的氧化可以影响蛋白质的局部环境,导致疏水部分的暴露和非特异性聚集。为了考察所观察到的聚集的性质,开发了新的有机相sec(op-sec)方法来分析光照暴露样品的还原成分。如图6中可见,光照暴露的抗il17a/f样品包含明显的不可还原种类,其在完整蛋白质和重链之间洗脱。观察到此种类以与在sec中观察到的hmws类似的方式(图5b)随光照暴露线性增加(图6b)。在24小时光照暴露时,此抗还原或不可还原hmws(rr-hmws或nr-hmws)达到观察到的总种类的~16%。还通过ce-sds确认了rr-hmws的存在(数据未显示)。光照暴露增加抗il-17a/f抗体mcaf5352a的酸性电荷变体为了理解光照暴露对il-17a/f抗体的总体影响,我们进行了icief分析来监测电荷变体的变化。icief分析显示光照暴露后酸性变体显著增加,对碱性变体几乎没有影响(图7)。icief数据确认,碱性电荷变体没有增加。不受限于一种或多种机制,酸性变体可能与met和/或trp氧化关联。光诱导的hmws包含分子间和分子内交联二者为了测定从op-sec方法观察到的nr-hmws是否来自分子间交联,我们从sec测定收集了完整hmws聚集体和主峰,并用op-sec方法分析了这些级分。来自sec的hmws级分显示rr-hmws富集近3倍,而来自sec的主峰级分在总rr-hmws中减少(图8)。此数据表明光照暴露后发生分子间和分子内交联二者;但是,sec收集的聚集体中的交联种类显著多于sec收集的主峰,表明主要为分子间交联。24小时光照胁迫后通过胰蛋白酶肽作图检测到甲硫氨酸和色氨酸氧化用lc-ms/ms分析了胰蛋白酶消化产物,用提取离子层析图(xic)来定量氧化肽中相对于天然肽的met和trp氧化的量。最易发生光诱导氧化的残基是见于fc区中的三个met残基(seqidno:9的m258、m364、m434)(图9a)。三个trp残基(两个在hc的cdr中(seqidno:7或seqidno:9的w53和w108),一个在lc的cdr中(seqidno:8或seqidno:10的w94))显示广泛氧化(图9b)。全部三个trp残基都显示总体氧化的线性增加,但各显示不同量的单个氧化种类(图9c)。虽然w53和w108的总体氧化程度几乎相同,但w108的二羟色氨酸转化率高4倍(w108和w53分别为0.45%氧化/小时对0.11%氧化/小时)。w94是最易氧化的trp残基,总体氧化比w53和w108高近2.5倍。此外,与另外两个trp残基相比,w94显示显著量的犬尿氨酸种类。如图10中所示,三个色氨酸(lcw94、hcw56和hcw108)显示对光诱导氧化的显著易感性。这些变体的光诱导增加还对应总体hmws形成的增加和rr交联变体的增加,及着色的定性增加。光诱导的hmws主要包含重链-重链交联变体和较低程度的重链-轻链交联变体收集op-sec光照胁迫样品的级分用esi-tof-ms进行更精确的分析。去卷积的esi-tof-ms数据显示,24小时光照暴露后抗il-17a/f抗体mcaf5352a的hc和lc中都存在显著的氧化,rr-hmws级分主要包含质量~102kda的种类,及较低程度的质量~74.5kda的种类(图11b-c)。这些结果与op-sec-ms数据一致,表明存在hc-hc和hc-lc共价交联二者。实施例3光照诱导着色和hmws形成是反应性氧种类(ros)驱动的过程为了首先考察抗il-17a/f抗体的光敏感性是否由氧化引起,在24小时光照暴露之前用n2净化抗体样品。用n2净化样品观察到了变色程度的可见降低,与hmws和交联种类二者的减少相偶联(图12)。这与通过rp-hplc氧化测定分析的总体氧化的减少相关(参见下文和图13)。用反相(rp)-hplc测定进行总体氧化的检测和定量。样品按1mg/ml浓度配制在50mmtrisph8.0中,并用(ides)(genovis,cambridge,ma)(50单位/100μg抗体)37℃消化4小时。然后用20mmdtt(8m胍、50mmtrisph8.0)37℃还原消化的样品30分钟。然后在进行分析之前加入tcep(tris(2-羧乙基)膦)至25mm终浓度。用配有biobasicphenyltm柱(2.1x150mm,5μm,)(thermofisherscientific,waltham,ma)的agilent1200hplc分离还原的消化产物。按0.3ml/分钟流速用19分钟内从68%溶剂a(h2o,0.1%tfa)至55%溶剂b(acn,0.1%tfa)的梯度进行肽洗脱。在浓度0.1-100mm的nan3存在下使样品暴露于光照,以考察ros的涉及。观察到nan3对抗体的光氧化提供保护作用;但是,nan3浓度与变色程度和rrhmws形成/rr交联形成之间也存在直接相关(图14)。总之,抗体对实验室环境光照和ich指南的光照条件都显示独特的光敏感性,其导致可见区的强光吸收,λmax为~430nm。与色氨酸氧化引起的预期光吸收(315nm-370nm之间的光吸收)相比,此光吸收显著红移。nan3的加入通过以依赖剂量的方式降低430nm光吸收来提供保护作用,强烈表明此独特光吸收是光诱导的单线态氧衍生反应性氧种类的副产物,交联种类的形成源自光诱导的单线态氧,变色与交联种类直接相关。实施例4用o18标记鉴定交联肽o18标记的概念按照以下分析顺序:1)在h2o16和h2o18存在下进行胰蛋白酶消化;2)通过在c端胰蛋白酶羧酸掺入4个o18分子(与h2o16消化的样品相比+8da质量迁移)来鉴定假定的二肽;3)根据蛋白酶特异性限制进行计算机模拟片段质量数据库搜索来鉴定部分肽序列;4)扩展至全部假定的肽;5)推断所涉及的交联化学物和残基。使用此方法,计算机模拟分析了分子量molecularmass=3889.0041da的交联母离子的高质量准确度肽片段,观察到了假定的肽的交联母离子,并确认了所鉴定的铰链(c232)和fc(c373)之间的交联肽(图15a-1和15a-2)。使用相同的方法,计算机模拟分析了分子量molecularmass=4059.9645da的第二交联母离子的高质量准确度肽片段,观察到了假定的肽的交联母离子。鉴定出铰链和fab之间的交联肽,确认交联位点在铰链(c235)和fab(c96)之间(图15b-1和15b-2)。通过lc/ms肽作图鉴定并确认了其他rr交联cys残基(图16b)。实施例5变体的活性测定分析了本文所述变体的生物学活性和功效。通过本公开通篇描述和本领域已知的测定测试了变体的结合和中和活性。例如,可以通过上文所述elisa测定或例如us8,715,669和us8,790,642(在此为了任何目的以其整体引入作为参考)中所述的biacoretm测定来测定变体对il-17a同二聚体、il-17f同二聚体和/或il-17af异二聚体的结合亲和力。简言之,可以用biacoretm-3000仪器通过表面等离振子共振(srp)来测量抗il-17a/f抗体变体的结合亲和力。通过包被在cm5生物传感芯片上的小鼠抗人fc抗体(gehealthcare,cat#br-1008-39)捕获抗体,以达到约200个响应单位(ru)。对于动力学测量,可以在25℃按30μl/分钟流速注入pbt缓冲液(含0.05%tween20的pbs)中的人il-17a、il-17f或il-17a/f的两倍系列稀释液(0.98nm至125nm)。细胞因子可从诸如r&dsystems的商业来源购得。用简单的1:1langmuir结合模型(biacoreevaluationsoftware版本3.2)计算结合速率(kon)和解离速率(koff)。将平衡解离常数(kd)计算为比值koff/kon。与抗il-17a/f抗体的主要种类或主要包含抗il-17a/f抗体的主要种类的组合物相比,分离和/或富集的本文所述变体显示结合亲和力降低。可以通过评价il-17a或f诱导的细胞因子诱导(例如il6或g-csf)来测定变体的中和活性。例如,在第1天按2x104细胞/150μl培养基/孔将人新生儿包皮成纤维细胞(invitrogen)接种在96孔板中。第2天用含细胞因子/抗体的培养基(150μl)替换培养基。可以使用适宜量的重组人il-17a同二聚体(例如5ng/ml)、il-17f同二聚体(例如50ng/ml)和il-17af异二聚体(例如25ng/ml)。24小时后收集上清,进行g-csfelisa来测量g-csf诱导。在prism中对数据进行作图,并用同一软件计算ic50/90值。与抗il17a/f抗体的主要种类相比,该一种或多种糖基化变体、酸性变体、hmws变体和rr交联变体显示中和活性降低。应理解,前述公开强调本发明的具体实施方案,所有与之等同的修改或替代都在所附权利要求书中所示的本发明的精神和范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1