用于治疗戈谢病的NMDA受体拮抗剂的制作方法
发明领域
本发明涉及包含nmda受体拮抗剂的组合物,其用于治疗戈谢病的神经病性形式。
发明背景
戈谢病
溶酶体贮积病(lsd)涵盖约50种不同的遗传疾病。它们由溶酶体酶或转运蛋白的缺陷引起,导致未降解代谢物的溶酶体内积累。虽然lsd是个体罕见的,但总体而言,它们在人群中具有约1/7000新生儿的非常高的流行率(fuller等人,2006)。这个频率与最常见的遗传疾病的频率相当(walker,2007;ratjen和doring,2003)。
在lsd中,戈谢病(gd)是最普遍的,总体频率为40000之一,而在阿什肯纳兹犹太人中,多达500之一受影响(fuller等人,2006)。gd是由编码β-葡糖脑苷脂酶(也称为酸性β-葡糖苷酶、d-糖基-n-酰基鞘氨醇葡糖水解酶,或gcase)的gba1基因中的突变引起的,其是需要通过水解切割葡糖神经酰胺(glccer,也称为葡糖脑苷脂)的β-糖苷键的具有葡糖神经酰胺酶活性的溶酶体酶,葡糖神经酰胺是糖脂代谢中的中间体。因此,细胞积累大量的glccer,并最终死亡。
从临床角度看,gd可以基于发病年龄和神经系统参与的迹象分为三个亚型。1型的主要症状是脾和肝的肿大、贫血、血小板减少和骨骼病变。2型和3型是gd的神经病性形式(ngd),根据神经系统症状发病时间和进展速率进行分类。2型,急性神经病性形式,通常指在6个月龄之前显示神经系统异常并且在2-4岁年龄死亡的儿童。在3型中,即亚急性、慢性神经病性形式,患者表现出与2型中观察到的那些相似的症状,但具有较晚的发病和严重程度(cox,2010)。
戈谢病治疗
1型患者可以用酶替代疗法(ert)进行治疗。该疾病最常见的形式gd1型的治疗和药物可能根据每位患者的疾病严重程度和由医生确定的治疗过程而变化。
有三种可用于治疗gd的ert和一种口服药物,其可以被18岁以上和/或具有gd的轻度形式的那些患者服用。在1991年,genzyme公司与nih合作开发了第一个获fda批准的gd靶向ert。随着1994年引入人β-葡糖脑苷脂酶的冷冻干燥类似物(商品名称
用于注射的taliglucerasealfa(商品名elelysotm)是一种源自植物的水解溶酶体葡糖脑苷脂特异性酶,被指示用于确诊为1型gd的成年人的长期ert。elelysotm于2012年5月1日被美国食品和药物管理局(fda)批准,并且是第一种被指示用于治疗1型gd的基于植物细胞的fda批准的ert。最近综述了taliglucerasealfa在治疗gd患者中的益处(hollak,2012)。
velaglucerasealfa(商品名
除了上述ert药物之外,美格鲁特(ogt918,n-丁基-脱氧野尻霉素,
全基因组关联研究
基因型-表型相关性对于gd来说相当差,因此预测患者将要发展的gd的亚型是一个主要挑战(goker-alpan等人,2005);例如,具有相同基因型的兄弟姐妹可以呈现出广泛不同的表型(eyal等人1991,amato等人2004)。因此,已提出修饰基因的作用作为表型变异的基础(goker-alpan等人,2005)。
修饰基因可以通过至少两个独立的策略来鉴定:
i)检索参与特定症状发展的基因的变化。使用这种策略,scarb2被鉴定为一对具有不一致癫痫表型的兄弟姐妹的gd的修饰基因(velayati等人,2011);和
ii)全基因组关联研究。全基因组关联研究(gwa研究或gwas)也被称为全部基因组关联研究(wga研究或wgas),是对不同个体中许多常见遗传变体的检查,以了解任何变体是否与性状相关。gwas通常关注于单核苷酸多态性(snp)与性状如主要疾病之间的关联。gwas通常比较两组参与者的dna:患有疾病的人(病例)和没有疾病的类似人群(对照)。每个人给出一个dna样品,从中读取数百万个遗传变体。如果一种类型的变体(一个等位基因)在患有该疾病的人中更频繁,则认为该snp与该疾病“相关联”。然后,将相关联的snp视为标记影响疾病风险的人基因组区域。
gwas方法最近用于研究患有1型gd(gd1)的阿什肯纳兹犹犹太gd患者,其中n370s突变是纯合的。该研究揭示了cln8基因作为导致极端表型变异的遗传修饰物的候选物(zhang,2012)。
nmda受体
nmda受体是两个必要的glun1(也称为nr1)和两个区域局部化的glun2亚基(也称为nr2)之间的异四聚体。具有不同脑分布和功能特性的多个受体同种型通过nr1转录物的选择性剪接和nr2亚基的差异表达产生。虽然在无脊椎生物内发现了单个的nr2亚基,nr2亚基的四个不同同种型在脊椎动物中表达,并被命名为nr2a至d(分别由基因grin2a、grin2b、grin2c和grin2d编码)。而nr2b在早期出生后的脑中占主导地位,nr2a亚基的数目增加,并最终nr2a亚基的数目超过nr2b。这被称为nr2b-nr2a发育开关,并且由于每个nr2亚基对受体的动力学不同而显著(liu等人,2004)。nr2b蛋白有几个同义词,如nmdar2b;谷氨酸[nmda]受体亚基ε-2;谷氨酸受体亚基ε-2;谷氨酸受体,离子型,n-甲基-d-天冬氨酸2b;grin2b;hnr3;mgc142178;mgc142180;n-甲基-d-天冬氨酸受体亚型2b;n-甲基-d-天冬氨酸受体亚基3;nmde2或nr3。该蛋白包含1484个氨基酸,其中前26个氨基酸被认为起潜在的信号肽的作用。
谷氨酸和nmda受体
谷氨酸是大脑中主要的兴奋性氨基酸神经递质(nicholls等人,2012)。在生理条件下,谷氨酸通过活化谷氨酸受体(glur)(traynelis等人,2010)在脑交流和可塑性中起着重要作用(bliss和collingridge1993;cooke和bliss2006)。神经损伤过程中glur的过度活化,主要通过称为nmda受体的glur亚型产生过量的向细胞内的钙流入,导致神经元损伤和最终细胞死亡,其称为兴奋性毒性的过程(mehta等人,2013)。nmda受体根据其在神经元中的分布可以分为2组:突触和突触外。突触受体促进存活信号级联,而突触外受体介导兴奋性毒性的毒性作用(parsons和raymond,2014)。由于过量的谷氨酸释放导致的兴奋性毒性发生在几种神经性病症中,如缺血性卒中(kostandy,2005)、自闭症(essa等人,2013)、肌萎缩侧索硬化(costa等人,2010)、帕金森病(caudle和zhang,2009)和阿尔茨海默病(kostandy,2005)。
美金刚和nmda受体
美金刚是通过阻断nmda受体作用于谷氨酸能系统的新一类阿尔茨海默病药物中的第一个。它是由elililly公司于1968年首次合成的。已显示美金刚在中度至重度阿尔茨海默病和路易体痴呆中具有适度的作用,并被批准这些用于人。美国专利号5,061,703描述了美金刚(和其它金刚烷衍生物)在预防脑缺血性损害中的用途。美国专利号us8,168,209和us8,329,752描述了美金刚的延时释放口服剂型。2003年,美国食品和药物管理局(fda)批准美金刚(以商品名namenda)用于治疗中度至重度阿尔茨海默型痴呆。
总之,ert目前静脉内施用于gd1型和3型的非神经性表现,并且目前还没有治疗方法可用于2型,其为最致命的疾病形式,在婴儿期呈现,并在首两年至三年内造成死亡。
因此,在治疗模式的领域中仍然存在未能满足的医疗需求,所述治疗将延迟、改善或减少在gd的神经病性形式中显现其自身的神经性症状。
技术实现要素:
本发明提供用于治疗戈谢病(gd)的神经病性形式的组合物和方法,其包含作为活性成分的至少一种类型的nmda受体拮抗剂。本发明提供了有效地(至少部分地)改善疾病的神经性发病和/或进展的组合物和方法。特别地,本发明的组合物减少或预防该疾病的神经性症状。根据一些实施方案,nmda拮抗剂是谷氨酸能神经传递的特异性抑制剂。根据一些实施方案,nmda拮抗剂可以是作用于其它神经传递途径的较不具特异性的拮抗剂。根据一些实施方案,nmda拮抗剂可具有另外的活性,例如5-羟色胺能、胆碱能或多巴胺能拮抗剂或激动剂活性。
本发明至少部分地基于近交小鼠中的gd模型,其首次公开了编码nmda谷氨酸受体的亚基b的基因grin2b的多态性与gd进展相关联。为了发现涉及gd进展的新基因,通过注射环己烯四醇b环氧化物(cbe),其为一种不可逆的葡糖脑苷脂酶(gba)抑制剂,在近交小鼠品系中诱导gd,并进行全基因组关联研究(gwas)。gwas分析鉴定了编码nmda谷氨酸受体的亚基b的基因grin2b作为gd进展的潜在修饰基因。
因此,在一个方面,本发明提供包含至少一种nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体的药物组合物,用于治疗戈谢病(gd)的神经病性形式。
根据本发明的一些实施方案的一个方面,提供了用于治疗戈谢病(gd)的神经病性形式的nmda受体拮抗剂。
在另一方面,本发明进一步提供了治疗在有其需要的患者中的gd的神经病性形式的方法,其包括向患者施用包含至少一种nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体的药物组合物的步骤,从而治疗gd的神经病性形式。
根据本发明的一些实施方案的一个方面,提供了治疗在有其需要的患者中的戈谢病(gd)的神经病性形式的方法,包括向患者施用治疗有效量的nmda受体拮抗剂,从而治疗gd的神经病性形式。
在一方面,本发明还提供至少一种nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体在制备用于治疗gd的神经病性形式的药物中的用途。
根据本发明的一些实施方案的一个方面,提供了至少一种nmda受体拮抗剂在制备用于治疗戈谢病(gd)的神经病性形式的药物中的用途。
在另一方面,本发明进一步提供了一种试剂盒,其包含至少一个包含药物组合物的容器,所述药物组合物包含至少一种用于治疗gd的神经病性形式的nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体。
根据本发明的一些实施方案,nmda受体拮抗剂或所述用途包括选自酶替代治疗剂、底物减少治疗剂和药理学分子伴侣治疗剂的药剂。
根据本发明的一些实施方案,该方法包括向患者施用治疗有效量的药剂,所述药剂选自酶替代治疗剂、底物减少治疗剂和药理学分子伴侣治疗剂。
根据本发明的一些实施方案的一个方面,提供了经鉴定用于治疗戈谢病(gd)的神经病性形式的试剂盒,其包含包装nmda受体拮抗剂和选自酶替代治疗剂、底物减少治疗剂和药理学分子伴侣治疗剂的药剂的包装材料。
根据本发明的一些实施方案,nmda受体是突触外nmda受体。
根据本发明的一些实施方案,nmda受体包含nr2b亚基。
在某些实施方案中,nmda受体拮抗剂优先结合突触外nmda受体。在某些实施方案中,突触外nmda受体包含nr2b亚基。
在某些实施方案中,相对于相应的健康神经元细胞,nmda受体拮抗剂与具有β-葡糖脑苷脂酶活性缺乏的神经元细胞的nmda受体结合。在某些实施方案中,所述细胞包含gba1基因中的突变。在某些实施方案中,所述细胞表达突变的β-葡糖脑苷脂酶。在某些实施方案中,所述神经元细胞是中枢神经系统(cns)神经元。
在某些实施方案中,nmda受体拮抗剂选自美金刚(memantine)、硝基美金刚(nitromemantine)、neramexane、氯胺酮(ketamine)、金刚烷胺(amantadine)、右美沙芬(dextromethorphan)、l-687,384、阿米替林(amitriptyline)、1-苄基-6’-甲氧基-6’,7’-二氢螺[哌啶-4,4’-噻吩并[3.2-c]吡喃]、艾芬地尔(ifenprodil)、奥芬那君(orphenadrine)、犬尿喹啉酸(kynurenicacid)、非氨酯(felbamate)、d(-)-ap-5、(±)-cpp、eaa-090、tcn-201、ap-5、azd6765、sdz220-581、(±)-去甲氯胺酮、依利罗地(eliprodil)、右啡烷(dextrorphan)、5,7-二氯犬尿喹啉酸一水合物、[glu3,4,7,10,14]-芋螺抑制肽g([glu3,4,7,10,14]-conantoking)、d-ap-7、md-ada、ap-7、ro8-4304、精胺(spermine)、ro25-6981、dcqx、曲索罗地(traxoprodil)、mdl105,519、法那帕奈(fanapanel)、metaphit、ro25-6981、naag、5-氟吲哚-2-羧酸、(s)-(-)-4-氧代-2-氮杂环丁烷羧酸、(s)-(-)-4-氧代-2-氮杂环丁烷羧酸苄酯和(±)-α-氨基-3-甲酯基-5-甲基异噁唑-4-丙酸,及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,所述nmda受体拮抗剂选自美金刚、硝基美金刚、neramexane、氯胺酮、金刚烷胺、右美沙芬、l-687,384、阿米替林、1-苄基-6’-甲氧基-6’,7’-二氢螺[哌啶-4,4’-噻吩并[3.2-c]吡喃]、依利罗地、艾芬地尔、奥芬那君、犬尿喹啉酸、非氨酯及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,所述nmda受体拮抗剂选自美金刚、硝基美金刚、neramexane及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
根据本发明的一些实施方案,所述nmda受体拮抗剂选自美金刚、依利罗地和艾芬地尔或其药学上可接受的盐、水合物或药学上活性的对映异构体。
在某些实施方案中,所述nmda受体拮抗剂是美金刚(3,5-二甲基-1-金刚烷胺盐酸盐)或其药学上可接受的盐、水合物或药学上活性的对映异构体。
在某些实施方案中,所述nmda受体拮抗剂也具有5-羟色胺能活性。在某些实施方案中,所述nmda受体拮抗剂也是5-ht3受体拮抗剂。
在某些实施方案中,所述nmda受体拮抗剂也具有胆碱能活性。在某些实施方案中,所述nmda受体拮抗剂也是烟碱样乙酰胆碱受体(nachr)拮抗剂。
在某些实施方案中,具有nachr拮抗剂活性的nmda受体拮抗剂选自金刚烷胺和右美沙芬及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,所述nmda受体拮抗剂也具有多巴胺能活性。在某些实施方案中,所述nmda受体拮抗剂也是多巴胺d2受体激动剂。
在某些实施方案中,所述nmda受体拮抗剂也具有神经保护活性。在某些实施方案中,所述nmda受体拮抗剂也是σ-1受体激动剂。
在某些实施方案中,具有σ-1受体激动剂活性的nmda受体拮抗剂选自l-687,384、阿米替林和1-苄基-6’-甲氧基-6’,7’-二氢螺[哌啶-4,4’-噻吩并[3.2-c]吡喃]及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,所述nmda受体拮抗剂具有神经保护活性。
在某些实施方案中,上述药物组合物用于治疗亚急性、慢性神经病性gd3型。
根据本发明的一些实施方案,所述gd是亚急性、慢性神经病性gd3型。
在某些实施例中,所述gd3型是gd3a型。
在某些实施例中,所述gd3型是gd3b型。
根据本发明的一些实施方案,将所述nmda受体拮抗剂配制成用于口服递送。
在某些实施方案中,将上述药物组合物配制成用于口服递送。在某些实施方案中,用于口服递送的组合物被配制用于持续释放。
根据本发明的一些实施方案,将nmda受体拮抗剂配制成用于注射。
在某些实施方案中,将上述药物组合物配制成用于注射。
根据本发明的一些实施方案的一个方面,提供了一种诊断患者中的戈谢病(gd)的神经病性形式的方法,所述方法包括在患者的生物样品中确定影响grin2b基因的表达产物的量的序列变异和/或grin2b基因的表达产物的量,其中相对于健康患者或诊断患有gdi型的患者的生物样品,序列变异的存在、高于预定水平的表达产物的量和/或表达产物的增加的量指示gd的神经病性形式,由此诊断患者中的gd的神经病性形式。
根据本发明的一些实施方案,序列变异在grin2b基因的非编码序列中。
根据本发明的一些实施方案,使用dna测序确定序列变异。
根据本发明的一些实施方案,使用rna和/或蛋白检测方法确定表达量。
根据本发明的一些实施方案,所述检测方法选自pcr、寡核苷酸微阵列、免疫沉淀法、蛋白印迹分析和facs。
根据本发明的一些实施方案,通过将患者的生物样品或其部分或其提取物与寡核苷酸杂交来确定表达水平,所述寡核苷酸与由grin2b基因表达的多核苷酸特异性杂交,和/或通过使患者的生物样品或其部分或其提取物与特异性结合由grin2b基因表达的多肽的抗体接触来确定表达水平。
根据本发明的一些实施方案,患者被诊断患有gd。
根据本发明的一些实施方案的一个方面,提供了一种物质的组合物,其包含被诊断患有戈谢病(gd)的患者的多核苷酸样品;以及能够与由grin2b基因表达的多核苷酸特异性杂交的寡核苷酸,并且任选地,其中所述寡核苷酸被标记。
根据本发明的一些实施方案的一个方面,提供了一种物质的组合物,其包含被诊断患有戈谢病(gd)的患者的多肽样品;以及能够特异性结合由grin2b基因表达的多肽的抗体和任选地第二抗体。
根据本发明的一些实施方案,提供了一种治疗被诊断患有戈谢病(gd)的神经病性形式的患者的方法,该方法包括:
(a)按照该方法诊断患者;并且其中指示,相对于健康患者或诊断患有gdi型的患者的生物样品,存在序列变异和/或表达产物的量高于预定水平和/或增加的量的表达产物,
(b)用nmda受体拮抗剂治疗患者,
从而治疗被诊断患有gd的神经病性形式的患者。
根据下文给出的详细描述,本发明的其它实施方案和适用性的全部范围将变得显而易见。然而,应当理解,在说明本发明的优选实施方案时的详细描述和具体实施例仅以说明的方式给出,因为在本发明的精神和范围内的各种改变和修改对于本领域技术人员而言通过该详细的描述将是显而易见的。
附图的若干视图的简述
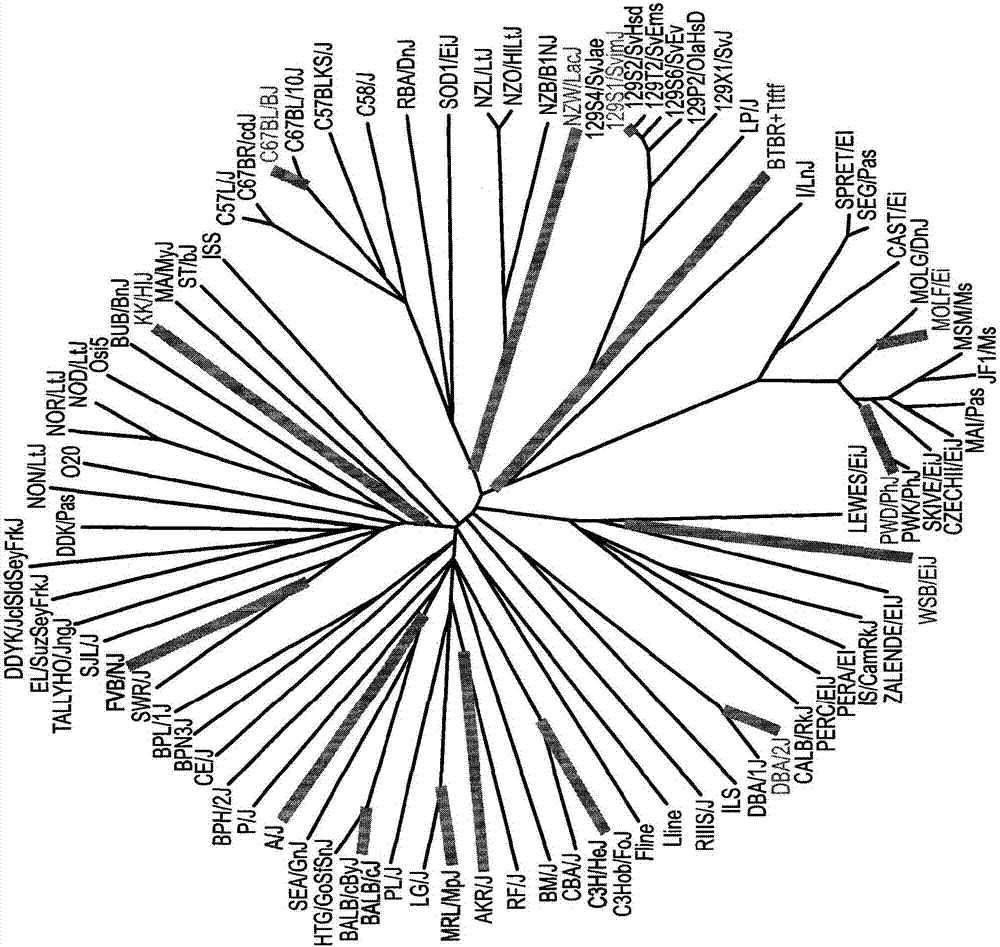
图1a-c显示不同的小鼠品系对cbe处理表现出不同的敏感性。图1a是从kirby等人,genetics.2010年7月;185(3):1081-95改编的图,显示94个小鼠品系的系统树。本申请中使用的品系以粗线突出显示。图1b是例示15种不同的经cbe处理的小鼠品系的存活曲线的kaplan-meier存活曲线。从出生后第(p)8天开始每天用cbe(25mg/kg)处理小鼠。图1c显示pbs(对照,黑线)或cbe(灰线)施用后代表性小鼠品系中运动协调的进展,如通过吊线测试评估。数据以平均值±sem(n=4-5)表示,*p<0.05。
图2是象形图,说明cbe诱导的脑病理学是品系特异性的。用cbe处理akr/j和btbrt+itpr3tf/j小鼠。分别在p22和p208处死小鼠,并分析脑皮质层v中cd68-阳性细胞的存在。akr/j小鼠发展出更快速的脑部疾病,而btbrt+itpr3tf/j小鼠具有抗性。
图3a-f显示了大脑gba1活性和脂质组学分析。图3a是显示在p18时收获的pbs-处理(对照,黑条)或cbe-处理(灰色条)的小鼠脑中的gba1活性的条图。数据以平均值±sem(n=2,重复)表示。图3b是显示cbe处理后的gba1活性与小鼠寿命之间缺乏相关性的图。图3c-f是显示在p18时进行评估的pbs-处理(对照,黑条)和cbe-处理(灰色条)品系的脑中的glccer水平(图3c)、glcso水平(图3d)、galcer水平(图3e)和galso水平(图3f)的条图。每个小组都有一个插图,显示cbe处理后各脂质和小鼠寿命之间缺乏相关性。数据以平均值±sem(n=2)表示。
图4a是使用emma在15个不同小鼠品系中鉴定的snp产生的曼哈顿图。图4b是图3a的曼哈顿图的分解图,集中在染色体6上的位置130000000至140000000。
图5a显示了通过qpcr评估的源自pbs-处理或cbe-处理的小鼠在p18时的皮质匀浆中的grin2b的皮质mrna水平。指示存在于grin2b基因内的rs29869040中的snp的基因型。a/j和c57bl/6/jolahsd(表示为c57)代表短期存活品系,而nzw和fvb代表长期存活品系。结果表示为平均值±sem(n=3)。循环阈值(ct)被归一化为tata盒结合蛋白(tbp)的水平。短期和长期存活的品系之间*p<0.05,pbs和cbe-处理的组织之间#p<0.05。
图5b显示通过对照、1型gd和2型gd患者的额叶、枕叶、顶叶皮质和小脑的蛋白印迹分析评估的nr2b蛋白水平。gapdh水平用作加载对照。
图6是说明阻断nmda受体如何延长c3h小鼠存活的线图。从p8开始每天用cbe(25mg/kg天)(黑线)或cbe(25mg/kg天)加上mk-801(0.3mg/kg天)(灰线)处理来自c3h/hej(c3h)品系的雄性小鼠。
图7显示了说明活化nmda受体如何降低小鼠存活的线图。从p8开始每天用cbe(25mg/kg天)(黑线)或cbe(25mg/kg天)加上d-环丝氨酸(200mg/kg天)(灰线)处理来自balb/cj、fvb/nj、129s1/svimj和btbrt+itpr3tf/j品系的雄性小鼠。
图8a-c显示了说明nmda受体拮抗剂美金刚如何延长神经病性gd小鼠寿命的线图。图8a显示了从p8开始每天用cbe(25mg/kg天)(cbe,黑线)或cbe(25mg/kg)加上美金刚(3mg/kg天)(cbe-m,灰线)处理的a/j(aj)、c3h/hej(c3h)、dba/2j(dba)和c57bl6/jolahsd(c57)品系的雄性小鼠的kaplan-meier存活曲线。图8b-c显示了从p8开始每天用cbe(50mg/kg天)(n=5)或cbe(50mg/kg天)加上美金刚3mg/kg(表示为1x,n=3)或cbe加上美金刚30mg/kg天(表示为x10,n=4)处理的a/j小鼠的kaplan-meier存活曲线(图8b)和平均存活时间(图8c)。图8c中的结果表示为平均值±sem。*p<0.05。
图9a显示a/jpbs-处理的小鼠(黑色连续线)(n=5)、a/jcbe-处理的小鼠(灰点)(n=4)和a/jcbe-美金刚(虚线)(n=5)中的运动协调的进展,如通过吊线测试评估。结果为平均值±sem。与pbs对照相比*p<0.05。
图9b是显示在p18或p70时收获的a/j小鼠脑中用pbs、cbe或cbe加上美金刚处理后的脑gba1活性的条图。数据表示为平均值±sem,n=2个生物重复和2个技术重复*p<0.001。
图10a-b显示了gbaflox/flox的kaplan-meier存活曲线(图10b)和平均存活时间(图10b);从p8开始每天用pbs(对照,n=9)、美金刚3mg/kg(表示为1x,n=4)或美金刚30mg/kg天(表示为10x,n=6)处理巢蛋白-cre小鼠。图10b中的结果表示为平均值±sem。*p<0.05。
图11显示从p8开始每天用cbe(25mg/kg天,黑线)或cbe(25mg/kg天)加上艾芬地尔(灰线)处理的a/j小鼠的kaplan-meier存活曲线。
发明详述
本发明涉及用于治疗被诊断处于发展为戈谢病(gd)的神经病性形式的风险或患有戈谢病(gd)的神经病性形式的受试者的手段和方法。本发明的方法包括向受试者施用有效抑制或阻断nmda受体活性的治疗有效量的nmda受体拮抗剂。本发明适用于gd的所有神经病性形式,包括2型、3a型和3b型。
迄今为止可用于由酶缺乏引起的溶酶体贮积病(包括1型gd)的治疗是非常昂贵的并且并不总是有效的。对于2型和3型gd,不存在用于治疗这些病症的有效治疗方法。对于导致神经病性(也称为神经元病变)gd(ngd)的病理事件的生物化学途径知之甚少。
临床上,gd是非常多种多样的,并且在溶酶体葡糖脑苷脂酶(gba1)基因中具有相同突变的患者可呈现完全不同的表现形式,表明存在修饰基因。本发明的发明人在此首次显示,编码nmda谷氨酸受体的亚基b的grin2b基因与患有gd的小鼠的gd进展相关联。此外,本发明现在显示,当用nmda受体拮抗剂治疗时,证实有gd的小鼠表现出寿命延长。因此,根据本发明,nmda的序列变异和mrna和/或蛋白水平可用于ngd诊断;和能够抑制nmda受体活性的化合物适用于治疗ngd。
如下文和下文实施例部分所示,本发明人表明,不同的小鼠品系不同地响应于通过cbe的gd诱导,这是与其遗传背景相关的响应。此外,表现出短的寿命的小鼠品系也表现出脑病理学和运动功能障碍,并因此可用作神经病性戈谢病(ngd)的小鼠模型(实施例1,图1a-c和2和表2)。重要的是,小鼠的生存率与脑gba1活性以及与glccer、glcso、galcer和galso脂质水平(实施例2,图3a-f)之间没有相关性,表明修饰基因参与了ngd病理学。gwas分析已经将编码nmda谷氨酸受体的亚基b的基因grin2b鉴定为ngd进展的潜在修饰基因(实施例4图4a-b和5a-b)。具体而言,本发明人已经揭示了与ngd相关的grin2b基因的非编码序列中的单核苷酸变异(snpidrs29869040)。
本发明人进一步表明,nmda受体的激动剂(例如d-环丝氨酸)降低了gd小鼠的存活,和nmda受体的拮抗剂(例如mk801、美金刚和艾芬地尔)增加了ngd小鼠的期望寿命并延迟ngd小鼠的运动功能障碍的进展,而不影响脑gba1抑制(实施例4-5,图6-7,8a-c,9a-b,10a-b和11)。
因此,本教导提供了包含用于治疗戈谢病的神经病性形式(ngd)的nmda受体拮抗剂的组合物和诊断ngd的方法。受这些令人惊奇的发现的启发,在一方面,本发明提供包含至少一种nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体的药物组合物,用于治疗gd的神经病性形式。
根据本发明的另一方面,提供了用于治疗gd的神经病性形式的nmda受体拮抗剂。
不希望受任何理论或作用机制的约束,所述nmda受体拮抗剂具有神经保护活性。本文所用的术语“神经保护活性”是指减少或改善神经损伤,以及保护或恢复已遭受神经损伤的神经元细胞的作用。如本文所用,术语“神经损伤”是指由诸如代谢、毒性、神经毒性和化学原因的各种原因导致的对神经元细胞或组织的任何损害。
另一方面,本发明进一步提供了用于治疗在有其需要的患者中的gd的神经病性形式的方法,其包括向患者施用包含至少一种nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体的药物组合物的步骤,从而治疗gd的神经病性形式。
根据本发明的另一方面,提供了用于治疗在有其需要的患者中的gd的神经病性形式的方法,包括向患者施用治疗有效量的nmda受体拮抗剂,从而治疗gd的神经病性形式。
在一方面,本发明还提供至少一种nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体在制备用于治疗gd的神经病性形式的药物中的用途。
根据本发明的另一方面,提供至少一种nmda受体拮抗剂在制备用于治疗gd的神经病性形式的药物中的用途。
在另一方面,本发明进一步提供了一种试剂盒,其包含至少一个包含药物组合物的容器,所述药物组合物包含至少一种用于治疗gd的神经病性形式的nmda受体拮抗剂或其药学上可接受的盐、水合物或药学上活性的对映异构体。
本文所用的术语“治疗”(treating)和“治疗”(treatment)是指撤消、基本上抑制、减缓或逆转病症的进展,基本上延迟病症的临床症状的出现,基本上改善病症的临床症状或基本上防止出现病症的临床症状。本文所用的术语“治疗”还指延长遭受病症的患者的存活或延迟遭受病症的患者的死亡。
如本文所使用的,在本文中可以互换使用的短语“有其需要的患者”和“有其需要的受试者”是指被诊断患有病症(即神经病性gd)的哺乳动物雄性或雌性受试者(例如,人)。在一个特定的实施方案中,该术语包括处于发展病症的风险的个体。患者可以是任何性别或任何年龄,包括新生儿、婴儿、少年、青年、成人和老年人。根据本发明的一些实施方案,为了诊断目的,所述受试者进一步定义如下。
本文所用的术语“戈谢氏病(gd)”或“戈谢病”是指一种溶酶体贮积病(lsd),其特征为细胞内特别是单核细胞谱系的细胞内的葡糖神经酰胺(glccer,也称为葡糖脑苷脂)的积累。葡糖神经酰胺可以在脾、肝、肾、肺、脑和骨髓中聚集。这种疾病是由酶葡糖脑苷脂酶(也称为β-葡糖苷酶、d-糖基-n-酰基鞘氨醇葡糖水解酶,gcd或gcase;ec3.2.1.45)的缺乏引起的,葡糖脑苷脂酶是具有葡糖神经酰胺酶活性的溶酶体酶,其需要通过水解切割葡糖神经酰胺的β-葡糖苷键。
gd根据疾病的具体症状分为两种主要类型:神经病性和非神经病性疾病。在非神经病性疾病中,大多数器官和组织都可以参与,而不是脑。在神经病性疾病(ngd)中,脑也参与其中。
i型(或非神经病性类型,gd1)是最常见的疾病形式,在大约50000活产之一中发生。它最常发生在具有犹太血统的人中。症状可能在生命早期或成年期开始,并且包括肝肿大和肉眼可见的脾肿大(共同称为“肝脾肿大”);脾可能破裂并引起另外的并发症。脾肿大和骨髓替换导致贫血、血小板减少和白细胞减少。骨骼虚弱和骨病可能是广泛的。脑不受病理影响,但可能有肺损害,以及很少有肾损害。该组患者通常容易产生青肿(由于血小板的低水平),并且由于红细胞数目少而经历疲劳。根据疾病的发病和严重程度,1型患者可能良好地活到成年期。一些患者有轻度形式的疾病或可能不会显现任何症状。
本文所用的神经病性gd(ngd)包括2型和3型gd两者。
gd2型也称为急性婴幼儿神经病性gd,通常在出生后6个月内开始,并且具有约100000活产之一的发病率。症状包括肝和脾肿大、广泛性和进行性脑损害、眼运动障碍、痉挛状态、癫痫发作、肢体僵硬,以及吸吮和吞咽能力差。受影响的儿童通常到二岁时死亡。
根据特定的实施方案,所述神经病性gd是gd2型。
gd3型也称为慢性神经病性gd,可以在儿童期或甚至成年期的任何时间开始,并在约100000活产之一中发生。与急性或2型形式相比,其特征是缓慢进行性,但较轻微的神经性症状。gd3型已分为两种变型,称为3b型和3a型。3b型的大面积肝和脾的发病更早,并且患者也可能经历肺的直接参与和快速进行性骨疾病。主要症状包括脾和/或肝肿大、癫痫发作、协调不良、骨骼不规则、眼运动障碍、包括贫血在内的血液病,以及呼吸问题。患者通常活到青少年早期和成年期。
根据特定的实施方案,神经病性gd是亚急性、慢性神经病性gd3型。在某些实施方案中,所述gd3型是gd3a型。在某些实施方案中,所述gd3型是gd3b型。
在某些实施方案中,nmda受体拮抗剂或包含nmda受体拮抗剂的药物组合物用于治疗与gd的神经病性形式相关的至少一种症状。在某些实施方案中,所述症状选自惊厥、张力亢进、精神发育迟缓、呼吸暂停、广泛性和进行性脑损伤、眼运动障碍、痉挛、癫痫发作、肢体僵硬、吸吮和吞咽能力差、协调不良、骨骼不规则、血液病、贫血、肌颤搐(肌阵挛)、惊厥、痴呆、眼肌失用症、呼吸系统疾病及其任何组合。每个可能性代表本发明的不同实施方案。
如本文所用,术语“nmda受体”(也称为n-甲基-d-天冬氨酸受体)是指谷氨酸受体和离子通道蛋白,其是具有至少一个nr1亚基(也称为glun1)和至少一个nr2亚基(也称为glun2)的异四聚体分子。nmda受体根据其在神经元中的分布可以分为2组:突触和突触外。通常,突触受体促进存活信号级联,而突触外受体介导兴奋性毒性的毒性作用。根据特定的实施方案,所述nmda受体是突触外nmda受体。
具有不同脑分布和功能特性的多种受体同种型通过nr1转录物的选择性剪接和nr2亚基的差异表达产生。虽然在无脊椎生物中发现了单个的nr2亚基,nr2亚基的四个不同同种型在脊椎动物中表达,并被命名为nr2a至d(分别由基因grin2a、grin2b、grin2c和grin2d编码)。
如下面的实施例部分所详述,发现编码nmda谷氨酸受体的亚基b(nr2b)的基因grin2b是gd进展的潜在修饰基因。因此,在某些实施方案中,所述nmda受体(突触或突触外)包含nr2b亚基。在特定的实施方案中,突触外nmda受体包含nr2b亚基。
如本文所用,术语“nr2b”,也称为nmdar2b;谷氨酸[nmda]受体亚基epsilon-2;谷氨酸受体亚基epsilon-2;谷氨酸受体、离子型、n-甲基d-天冬氨酸2b;grin2b;hnr3;mgc142178;mgc142180;n-甲基d-天冬氨酸受体亚型2b;n-甲基-d-天冬氨酸受体亚基3;nmde2,或nr3,是指grin2b基因的表达产物。根据特定的实施方案,所述grin2b基因是指如下列基因id号中提供的人基因:2904(seqidno:6)。根据其它特定的实施方案,所述grin2b基因是指如下列基因id号中提供的小鼠基因:14812(seqidno:7)。根据一个特定的实施方案,所述nr2b蛋白是指人蛋白,例如下列genbank编号np_000825(seqidno:8)中提供的。根据一个特定的实施方案,所述nr2b蛋白是指小鼠蛋白,例如下列genbank号np_032197(seqidno:9)中提供的。
如本文使用的术语“nmda受体拮抗剂”是指阻止和/或抑制n-甲基-d-天冬氨酸受体(nmdar)的生物学功能和/或表达的分子。
拮抗剂可以是可逆的或不可逆的拮抗剂。
拮抗剂可以是竞争性或非竞争性拮抗剂。
根据特定的实施方案,所述拮抗剂是非竞争性拮抗剂。
根据其它特定的实施方案,所述拮抗剂抑制受体的生物学功能(例如配体结合,离子通道的开放),如通过例如电生理记录、钙染料或钙信号传导检测。与不存在拮抗剂的情况相比,降低可以是至少10%,至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%或至少99%。根据特定的实施方案,所述拮抗剂完全阻止受体的生物学功能(例如配体结合,离子通道的开放)。
根据特定的实施方案,所述拮抗剂直接结合受体,从而阻止和/或抑制受体的活性和/或表达。结合测定法是本领域熟知的,且包括例如biacore、高效液相色谱法(hplc)或流式细胞术。
根据其它特定的实施方案,所述拮抗剂通过经由中间分子的作用间接地结合nmda受体,例如拮抗剂结合或调节一分子,该分子又结合或调节nmda受体。
如上所述,已知nmda受体可以分为2组,突触受体,其促进存活信号级联;和突触外受体,其介导兴奋性毒性的毒性作用(parsons和raymond,2014)。因此,推测,不限于任何理论或机制,可以通过特异性靶向兴奋性毒性促进的突触外受体来实现神经保护。因此,在某些实施方案中,nmda受体拮抗剂优先结合突触外nmda受体。
因此,根据特定的实施方案,所述nmda受体拮抗剂经由nmda受体阻止和/或抑制过量的钙流入。
某些nmda受体拮抗剂,如mk-801,由于其相关的毒性,不能用于治疗人患者,其不仅经由突触外受体阻断了过量的钙流入的毒性作用,而且阻断了谷氨酸信号传导的关键正常功能。
因此,根据特定的实施方案,所述nmda受体拮抗剂不经由nmda受体干扰谷氨酸信号传导。
此外,确保使用没有不可接受的副作用如引起幻觉作用的nmda受体拮抗剂。因此,由于其特异性和安全性,其它nmda受体拮抗剂,例如优先阻断突触外nmda受体的美金刚是有利的。
如本文使用的术语“优先结合突触外nmda受体”是指任何nmda受体拮抗剂,其结合突触外nmda受体而不干扰谷氨酸信号传导的正常功能。
在某些实施方案中,所述nmda受体拮抗剂优先结合nr2亚基的子集。在某些实施方案中,所述nmda受体拮抗剂优先结合nr2b亚基。在某些实施方案中,所述nmda受体拮抗剂特异性结合nr2b亚基,而与其它nr2亚基没有交叉反应性。
在某些实施方案中,相对于相应的健康神经元细胞,nmda受体拮抗剂与具有β-葡糖脑苷脂酶活性缺乏的神经元细胞的nmda受体结合。本文所用的短语“具有β-葡糖脑苷脂酶活性缺陷的神经元细胞”还指具有比正常健康神经元细胞中β-葡糖脑苷脂酶活性显著更低的β-葡糖脑苷脂酶活性的神经元细胞。
使用干扰受体的转录和/或翻译的多种分子,阻止和/或抑制nmda受体的生物学功能可以在蛋白水平上实现,而且也可以在基因组和/或转录水平上实现。
因此,根据本发明的一些实施方案可以使用的拮抗剂的非限制性实例包括小分子、抗体、抑制肽、切割多肽的酶、适配体同源重组剂、位点特异性内切核酸酶和rna沉默剂。
用于通过血脑屏障(bbb)的平台技术是可利用的并且是本领域已知的,并且包括但不限于定向脂质体、纳米颗粒、微泡、通过鼻施用的噬菌体、外来体、前药和肽掩蔽。药物递送至中枢神经系统(cns)的其它示例性方法在下文进一步描述。
下面将详细描述可用作拮抗剂的药剂的非限制性实例。
在多肽水平抑制生物学功能
根据特定的实施方案,所述拮抗剂是通过结合和/或切割受体而干扰受体功能(例如催化或相互作用)的分子。这样的分子可以是但不限于小分子、抑制肽、切割受体的酶、adnectin、亲合体(affibody)、avimer、anticalin,四连接素(tetranectin)、darpin和经工程改造的kunitz-型抑制剂,其中每种可能性是本发明的一个单独的实施方案。
根据一个特定的实施方案,所述拮抗剂是小分子。
根据一个特定的实施方案,所述拮抗剂是肽分子。
将理解,抑制肽的至少催化或结合部分的非功能性类似物也可以用作拮抗剂。
用作nmda受体拮抗剂的许多化合物在本领域中是已知的,因此以下指定的特定的nmda受体拮抗剂绝不限制本发明的范围。
表1提供了几种已知的nmda受体拮抗剂的列表。
表1.
在某些实施方案中,所述至少一种nmda受体拮抗剂选自美金刚、硝基美金刚,neramexane、氯胺酮、金刚烷胺、右美沙芬、l-687,384、阿米替林、1-苄基-6’-甲氧基-6’,7’-二氢螺[哌啶-4,4’-噻吩并[3.2-c]吡喃]、艾芬地尔、奥芬那君、犬尿喹啉酸、非氨酯、d(-)-ap-5、(±)-cpp、eaa-090、tcn-201、ap-5、azd6765、sdz220-581、(±)-去甲氯胺酮、依利罗地、右啡烷、5,7-二氯犬尿喹啉酸一水合物、[glu3,4,7,10,14]-芋螺抑制肽g、d-ap-7、md-ada、ap-7、ro8-4304、精胺、ro25-6981、dcqx、曲索罗地、mdl105,519、法那帕奈、metaphit、ro25-6981、naag、5-氟吲哚-2-羧酸、(s)-(-)-4-氧代-2-氮杂环丁烷羧酸、(s)-(-)-4-氧代-2-氮杂环丁烷羧酸苄酯和(±)-α-氨基-3-甲酯基-5-甲基异噁唑-4-丙酸,及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,至少一种nmda受体拮抗剂选自美金刚、硝基美金刚,neramexane、氯胺酮、金刚烷胺、右美沙芬、l-687,384、阿米替林、1-苄基-6’-甲氧基-6’,7’-二氢螺[哌啶-4,4’-噻吩并[3.2-c]吡喃]、艾芬地尔、依利罗地、奥芬那君、犬尿喹啉酸、非氨酯及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,至少一种nmda受体拮抗剂选自美金刚、硝基美金刚、neramexane及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
根据特定的实施方案,所述nmda受体拮抗剂选自选自美金刚、依利罗地和艾芬地尔或其药学上可接受的盐、水合物或药学上活性的对映异构体。
在某些实施方案中,所述nmda受体拮抗剂是美金刚(3,5-二甲基-1-金刚烷胺盐酸盐)或其药学上可接受的盐、水合物或药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
根据特定的实施方案,所述拮抗剂是抗体。根据特定的实施方案,所述拮抗性抗体特异性结合nmda受体的至少一个表位。根据特定的实施方案,所述抗体可以穿过bbb。
如本文所用,术语“表位”是指抗体的互补位与其结合的抗原上的任何抗原决定簇。表位决定簇通常由诸如氨基酸或碳水化合物侧链的分子的化学活性表面分组组成,并且通常具有特定的三维结构特征,以及特定的电荷特征。
如本发明中使用的术语“抗体”包括完整分子及其功能片段,例如fab、f(ab’)2、fv、scfv、dsfv或单结构域分子,例如vh和vl,其能够与抗原的表位结合。所述抗体可以是单特异性的(能够识别一个表位或蛋白)、双特异性(能够结合两个表位或蛋白)或多特异性(能够识别多个表位或蛋白)。
用于实施本发明的一些实施方案的合适的抗体片段包括免疫球蛋白轻链(本文中称为“轻链”)的互补决定区(cdr)、免疫球蛋白重链(本文中称为“重链”)的互补决定区、轻链的可变区、重链的可变区、轻链、重链、fd片段,和包含轻链和重链两者的基本上整个可变区的抗体片段,例如fv、单链fv(scfv)、二硫键稳定的fv(dsfv)、fab、fab’和f(ab’)2。
如本文所用,术语“互补决定区”或“cdr”可互换使用,是指在重链和轻链多肽的可变区内发现的抗原结合区。通常,抗体在每个vh中包含三个cdr(cdrhi或hi;cdrh2或h2;和cdrh3或h3),并且每个vl中包含三个cdr(cdrli或li;cdrl2或l2;和cdrl3或l3)。
构成可变区或cdr的特定抗体中的氨基酸残基的同一性可以使用本领域熟知的方法确定,包括诸如由kabat等人定义的序列变异性的方法(参见例如kabat等人,1992,sequencesofproteinsofimmunologicalinterest,第5版,publichealthservice,nih,washingtond.c.),由chothia等人定义的结构环区的位置(参见例如chothia等人,nature342:877-883,1989),kabat和chothia之间的折衷使用oxfordmolecular'sabm抗体建模软件(现
如本文所用,“可变区”和“cdr”可以指由本领域已知的任何方法定义的可变区和cdr,所述方法包括方法的组合。
包含轻链和重链两者的整个或基本上整个可变区的功能性抗体片段定义如下:
(i)fv,定义为由轻链(vl)的可变区和重链(vh)的可变区组成的经基因工程改造的片段,其表示为两条链;
(ii)单链fv(“scfv”),包括轻链的可变区和重链的可变区的经基因工程改造的单链分子,通过合适的多肽接头连接成为基因融合的单链分子。
(iii)二硫键稳定的fv(“dsfv”),其是经基因工程改造的抗体,包括通过经基因工程改造的二硫键连接的轻链的可变区和重链的可变区。
(iv)fab,含有抗体分子的单价抗原结合部分的抗体分子的片段,其可以通过用木瓜蛋白酶处理全抗体以产生完整的轻链和重链的fd片段获得,所述重链的fd片段由其可变结构域和ch1结构域组成;
(v)fab’,含有抗体分子的单价抗原结合部分的抗体分子的片段,其可以通过用胃蛋白酶处理全抗体,然后通过还原(每个抗体分子获得两个fab'片段)来获得;
(vi)f(ab’)2,含有抗体分子的单价抗原结合部分的抗体分子的片段,其可以通过用胃蛋白酶处理全抗体获得(即,通过两个二硫键将fab'片段的二聚体保持在一起);和
(vii)单结构域抗体或纳米抗体由对抗原表现出足够亲和力的单个vh或vl结构域组成。
所述抗体可以是单克隆或多克隆的。
生产多克隆和单克隆抗体及其片段的方法是本领域众所周知的(参见例如,harlow和lane,antibodies:alaboratorymanual,coldspringharborlaboratory,newyork,1988,通过引用并入本文)。
根据本发明的一些实施方案的抗体片段可以通过抗体的蛋白酶水解或通过在大肠杆菌或哺乳动物细胞(例如中国仓鼠卵巢细胞培养物或其它蛋白表达系统)中的编码该片段的dna表达来制备。借助常规方法可以通过胃蛋白酶或木瓜蛋白酶消化全抗体获得抗体片段。例如,可以通过用胃蛋白酶酶切抗体来产生抗体片段,以提供表示为f(ab’)2的5s片段。可以使用硫醇还原剂和任选的由二硫键断裂产生的巯基的封闭基团进一步切割该片段,以产生3.5sfab’单价片段。或者,使用胃蛋白酶的酶切直接产生两个单价fab’片段和fc片段。这些方法例如由goldenberg,美国专利号4,036,945和4,331,647以及其中包括的参考文献描述,这些专利以其全部内容通过引用并入本文。另见porter,r.r.[biochem.j.73:119-126(1959)]。也可以使用切割抗体的其它方法,例如分离重链以形成单价轻-重链片段,进一步切割片段,或其它酶学、化学或基因技术,只要该片段与被完整的抗体识别的抗原结合。
fv片段包含vh和vl链的缔合。该缔合可能是非共价的,如inbar等人[proc.nat'lacad.sci.usa69:2659-62(19720]中所述。或者,可变链可通过分子间二硫键连接或通过诸如戊二醛的化学物质进行交联。优选地,fv片段包含通过肽接头连接的vh和vl链。通过构建包含通过寡核苷酸连接的编码vh和vl结构域的dna序列的结构基因来制备这些单链抗原结合蛋白(sfv)。将该结构基因插入表达载体中,随后将所述表达载体导入宿主细胞,例如大肠杆菌。重组宿主细胞合成具有桥接两个v结构域的接头肽的单个多肽链。用于产生sfv的方法描述于例如[whitlow和filpula,methods2:97-105(1991);bird等人,science242:423-426(1988);pack等人,bio/technology11:1271-77(1993);和美国专利号4,946,778,其全部内容通过引用并入本文。
抗体片段的另一种形式是编码单个互补决定区(cdr)的肽。可以通过构建编码目标抗体的cdr的基因来获得cdr肽(“最小识别单位”)。这样的基因例如通过使用聚合酶链式反应以从产生抗体的细胞的rna合成可变区来制备。参见例如larrick和fry[methods,2:106-10(1991)]。
应当理解,对于人类治疗或诊断,优选使用人源化抗体。非人(例如,鼠)抗体的人源化形式是免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab’、f(ab’).sub.2或抗体的其它抗原结合子序列)的嵌合分子,其含有来自非人免疫球蛋白的最小序列。人源化抗体包括人免疫球蛋白(接受体抗体),其中形成接受体的互补决定区(cdr)的残基被来自具有所需的特异性、亲和力和容量的非人物种如小鼠、大鼠或兔的cdr(供体抗体)的残基替代。在一些情况下,人免疫球蛋白的fv框架残基被相应的非人残基替代。人源化抗体还可以包含既不在接受体抗体中也不在输入的cdr或框架序列中发现的残基。通常,人源化抗体将包含至少一个,且通常为两个可变结构域的基本上所有,其中所有或基本上所有的cdr区域对应于非人免疫球蛋白的那些,和所有或基本上所有的fr区域是人免疫球蛋白共有序列的那些。人源化抗体最理想地还将包含免疫球蛋白恒定区(fc)的至少一部分,通常为人免疫球蛋白的恒定区(fc)[jones等人,nature,321:522-525(1986);riechmann等人,nature,332:323-329(1988);和presta,curr.op.struct.biol.,2:593-596(1992)]。
用于人源化非人抗体的方法是本领域熟知的。通常,人源化抗体具有从非人的来源引入其中的一个或多个氨基酸残基。这些非人氨基酸残基通常被称为输入残基,其通常取自输入可变结构域。人源化可以基本上按照winter和共事者的方法进行[jones等人,nature,321:522-525(1986);riechmann等人,nature332:323-327(1988);verhoeyen等人,science,239:1534-1536(1988)],通过用啮齿类动物cdr或cdr序列取代人抗体的相应序列。因此,这样的人源化抗体是嵌合抗体(美国专利号4,816,567),其中基本上小于完整的人可变结构域已被来自非人物种的相应序列所取代。在实践中,人源化抗体通常是人抗体,其中一些cdr残基和可能的一些fr残基被来自啮齿类动物抗体中的类似位点的残基取代。
也可以使用本领域已知的各种技术来生产人抗体,包括噬菌体展示文库[hoogenboom和winter,j.mol.biol.,227:381(1991);marks等人,j.mol.biol.,222:581(1991)]。cole等人和boerner等人的技术也可用于制备人单克隆抗体(cole等人,monoclonalantibodiesandcancertherapy,alanr.liss,p.77(1985)和boerner等人,j.immunol.,147(1):86-95(1991)]。类似地,人抗体可以通过将人免疫球蛋白基因座引入转基因动物,例如其中内源性免疫球蛋白基因已部分或完全失活的小鼠来制备。在攻击时观察到人抗体产生,其在所有方面都非常类似于人中所见,包括基因重排、装配和抗体谱。这种方法描述于例如美国专利号5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;5,661,016和以下科学出版物:marks等人,bio/technology10:779-783(1992);lonberg等人,nature368:856-859(1994);morrison,nature368812-13(1994);fishwild等人,naturebiotechnology14,845-51(1996);neuberger,naturebiotechnology14:826(1996);和lonberg和huszar,intern.rev.immunol.13,65-93(1995)。
一旦得到抗体,就可以测试其活性,例如通过elisa。
可以用作本发明的一些实施方案的拮抗剂的另一种药剂是适体。如本文所用,术语“适体”是指结合特定分子靶标(例如蛋白)的双链或单链rna分子。本领域已知各种方法可用于设计蛋白特异性适体。本领域技术人员可以如stoltenburgr,reinemannc和strehlitzb(biomolecularengineering(2007)24(4):381-403)中所述地使用selex(指数富集的配体系统进化)来进行有效的选择。
在核酸水平抑制生物学功能
核酸水平的下调通常使用具有核酸主链、dna、rna、其模拟物或其组合的核酸药剂来实现。该核酸药剂可以从dna分子编码或提供给细胞本身。
因此,本发明的一些实施方案的拮抗剂可以是rna沉默剂。如本文所用,短语“rna沉默”是指一组由rna分子介导的调节机制[例如,rna干扰(rnai),转录基因沉默(tgs),转录后基因沉默(ptgs),压制,共抑制和翻译抑制],其导致相应的编码蛋白的基因表达的抑制或“沉默”。已经在许多类型的生物体包括植物、动物和真菌中观察到rna沉默。
如本文所用,术语“rna沉默剂”是指能够使靶基因表达特异性抑制或“沉默”的rna。在某些实施方案中,所述rna沉默剂能够通过转录后沉默机制来阻止mrna分子的完全加工(例如全翻译和/或表达)。rna沉默剂包括非编码rna分子,例如包含配对链的rna双链体,以及从其可产生这种小的非编码rna的前体rna。示例性的rna沉默剂包括dsrna,例如sirna、mirna和shrna。
在一个实施方案中,所述rna沉默剂能够诱导rna干扰。
在另一个实施方案中,所述rna沉默剂能够介导翻译抑制。
根据本发明的一个实施方案,所述rna沉默剂对靶rna(例如grin2b)是特异性的,并且不交叉抑制或沉默其它靶标或者剪接变体,所述剪接变体表现出与靶基因的99%或更小的总体同源性,例如与靶基因的小于98%、97%、96%、95%、94%、93%、92%、91%、90%、89%、88%、87%、86%、85%、84%、83%、82%、81%的总体同源性;如通过pcr、蛋白印迹、免疫组织化学和/或流式细胞术测定。
rna干扰是指由短干扰rna(sirna)介导的动物中序列特异性转录后基因沉默的过程。
以下是对可以根据本发明的特定实施方案使用的rna沉默剂的详细描述。
dsrna、sirna和shrna-细胞中长dsrna的存在刺激被称为切酶的核糖核酸酶iii酶的活性。切酶参与将dsrna加工成称为短干扰rna(sirna)的短小片段dsrna。衍生自切酶活性的短干扰rna通常长度为约21至约23个核苷酸并且包含约19个碱基对双链体。rnai反应还具有内切核酸酶复合物,通常称为rna诱导的沉默复合物(risc),其介导具有与sirna双链体的反义链互补的序列的单链rna的切割。靶rna的切割发生在与sirna双链体的反义链互补的区域的中间。
因此,本发明的一些实施方案预期使用dsrna从mrna下调蛋白表达。
根据一个实施方案,使用长于30bp的dsrna。各种研究表明长的dsrna可用于使基因表达沉默而不诱导应激反应或引起显著的脱靶效应-参见例如[strat等人,nucleicacidsresearch,2006,第34卷,第13期3803-3810;bhargavaa等人brainres.protoc.2004;13:115–125;diallom.,等人,oligonucleotides.2003;13:381–392;paddisonp.j.,等人,proc.natl.acad.sci.usa.2002;99:1443-1448;trann.,等人,febslett.2004;573:127-134]。
根据本发明的一些实施方案,在干扰素途径未被活化的细胞中提供dsrna,参见例如billy等人,pnas2001,第98卷,第14428-14433页。和diallo等人,oligonucleotides,2003年10月1日,13(5):381-392。doi:10.1089/154545703322617069。
根据本发明的一个实施方案,长dsrna被特异地设计为不诱导用于下调基因表达的干扰素和pkr途径。例如,shinagwa和ishii[genes&dev.17(11):1340-1345,2003]已开发了一种名为pdecap的载体,以从rna聚合酶ii(polii)启动子表达长双链rna。因为pdecap的转录物缺乏促进ds-rna输出到细胞质的5’-帽结构和3’-聚(a)尾,所以来自pdecap的长ds-rna不会诱导干扰素反应。
在哺乳动物系统中逃避干扰素和pkr途径的另一种方法是通过转染或内源表达引入小的抑制性rna(sirna)。
术语“sirna”是指诱导rna干扰(rnai)途径的小的抑制性rna双链体(通常在18-30个碱基对之间)。尽管最近已经描述了25-30个碱基长度的化学合成的rna双链体可以具有与同一位置的21聚体相比效力增加100倍之多,通常,sirna经化学合成为具有中心19bp双链体区域和在末端的对称的2-碱基3’-突出端的21聚体。观察到的使用更长的rna在触发rnai中获得的增加的效力被认为是由向切酶提供底物(27聚体)而不是产物(21聚体)产生的,并且这提高了sirna双链体进入risc的速率或效率。
已经发现3’-突出端的位置影响sirna的效力和在反义链上具有3’-突出端的不对称双链体通常比在有义链上具有3'-突出端的那些更有效(rose等人,2005)。这可以归因于不对称链加载成risc,因为当靶向反义转录物时观察到相反的功效模式。
双链干扰rna(例如sirna)的链可以连接以形成发夹或茎环结构(例如shrna)。因此,如上所述,本发明一些实施方案的rna沉默剂也可以是短发夹rna(shrna)。
如本文所用的术语“shrna”是指具有茎-环结构的rna药剂,其包含互补序列的第一和第二区域,所述区域的互补性和定向足以使得碱基配对发生在所述区域,即由环区连接的第一和第二区域之间,所述环由环区内的核苷酸(或核苷酸类似物)之间缺乏碱基配对而产生。环中的核苷酸数目为3至23,或5至15,或7至13,或4至9,或9至11之间(包括端点)的数字。环中的一些核苷酸可与环中其它核苷酸参与碱基对相互作用。可用于形成环的寡核苷酸序列的实例包括5'-caagaga-3'和5'-uuacaa-3'(国际专利申请号wo2013126963和wo2014107763)。本领域技术人员将认识到,所得单链寡核苷酸形成包含能够与rnai机构相互作用的双链区的茎环或发夹结构。
适用于本发明一些实施方案的rna沉默剂的合成可如下实现。首先,将受体或受体亚基(例如grin2b)mrna序列在aug起始密码子的下游扫描aa二核苷酸序列。每个aa和3'相邻的19个核苷酸的出现记录为潜在的sirna靶位点。优选地,sirna靶位点从开放阅读框中选择,因为非翻译区(utr)在调节蛋白结合位点中更富集。utr结合蛋白和/或翻译起始复合物可能干扰sirna内切核酸酶复合物的结合[tuschlchembiochem.2:239-245]。然而应当理解,在非翻译区引导的sirna也可以是有效的,如用于gapdh所证实的,其中定向在5'utr的sirna介导细胞gapdhmrna的约90%的降低并在蛋白水平完全消除(www.ambion.com/techlib/tn/91/912.html)。
其次,使用任何序列比对软件(例如可从ncbi服务器获得的blast软件(www.ncbi.nlm.nih.gov/blast/))将潜在靶位点与适当的基因组数据库(例如,人,小鼠,大鼠等)进行比较。与其它编码序列显示显著同源性的推定靶位点被过滤掉。
选择合格的靶序列作为sirna合成的模板。优选的序列是那些包括低g/c含量的序列,因为与g/c含量高于55%的那些相比,这些低g/c含量的序列被证明在介导基因沉默中更有效。优选沿着靶基因的长度选择几个靶位点用于评价。为了更好地评估所选择的sirna,优选结合使用阴性对照。阴性对照sirna优选包括与sirna相同的核苷酸组成,但与基因组缺乏显著的同源性。因此,优选使用sirna的加扰核苷酸序列,条件是其不显示与任何其它基因的任何显著的同源性。
例如,针对grin2b引导的合适的sirna可以从例如sigma获得。
应当理解,并且如上所述,本发明的一些实施方案的rna沉默剂不需要限于仅含有rna的那些分子,而是进一步包括经化学修饰的核苷酸和非核苷酸。
根据另一个实施方案,所述rna沉默剂可以是mirna。
术语“微小rna”、“mirna”和“mir”是同义词,是指约19-28个核苷酸长度的非编码单链rna分子的集合,其调节基因表达。发现mirna在广泛的生物体(病毒、fwdarw.人)中存在,并且已显示在发育、体内平衡和疾病病因学中起作用。
以下是mirna活性机制的简要说明。
编码mirna的基因被转录,导致产生称为pri-mirna的mirna前体。pri-mirna可以形成具有茎和环的发夹。
pri-mirna的发夹结构被drosha识别,drosha是rnaseiii内切核酸酶。drosha通常识别pri-mirna中的末端环,并以典型的rna酶iii内切核酸酶的交错切割来切割pri-mirna,产生具有5’磷酸和
双链茎或pre-mirna的茎环的基部处的5'磷酸和3'突出端然后被切酶识别,切酶也是rnaseiii内切核酸酶。然后,切酶从茎环的基部切除末端环两个螺旋转角,留下另外的5'磷酸和
尽管最初与mirna*作为双链物种存在,但mirna最终作为单链rna并入被称为rna诱导的沉默复合物(risc)的核糖核蛋白复合物,而mirna*被去除和降解。
基于mirna和mrna之间的高水平互补性,特别是mirna的核苷酸2-7,risc鉴定靶核酸。一些研究已经查看了mirna与其mrna靶标之间的碱基配对要求,以实现翻译的有效抑制(bartel综述,2004,cell116-281)。在哺乳动物细胞中,mirna的前8个核苷酸可能很重要(doench&sharp2004genesdev2004-504)。然而,微小rna的其它部分也可以参与mrna结合。此外,在3’处的充分的碱基配对可补偿5'处的不充分配对(brennecke等人,2005plos3-e85)。分析在全基因组上的mirna结合的计算研究已表明,mirna的5’处的碱基2-7在靶结合上的特定作用,但是通常被发现是“a”的第一核苷酸的作用也被认可(lewis等人,2005cell120-15)。类似地,krek等人使用核苷酸1-7或2-8来鉴定和验证靶标(2005,natgenet37-495)。
mrna中的靶位点可以在5’utr、3'utr中或编码区中。
mirna可以通过以下两种机制中的任一种来引导risc下调基因表达:mrna切割或翻译抑制。如果mrna与mirna具有一定程度的互补性,则mirna可以指定mrna的切割。当mirna指导切割时,切口通常在与mirna的残基10和11配对的核苷酸之间。或者,如果mirna不具有与mirna的必要程度的互补性,则mirna可抑制翻译。
从上文提供的描述可以理解,细胞与mirna的接触可以通过用例如成熟的双链mirna、pre-mirna或pri-mirna转染/加载细胞来实现。
pre-mirna序列可以包含45-90、60-80或60-70个核苷酸。
pri-mirna序列可以包含45-30000、50-25000、100-20000、1000-1500或80-100个核苷酸。
反义-反义是设计用于通过与其mrna特异性杂交来阻止或抑制基因表达的单链rna。可以使用能够与编码受体或受体亚基(例如grin2b)的mrna转录物特异性杂交的反义多核苷酸来实现受体的下调。
必须在考虑对反义方法重要的两个方面时实现可用于有效下调受体的反义分子的设计。第一方面是将寡核苷酸递送到适当细胞的细胞质中,而第二方面是以抑制其翻译的方式特异性结合细胞内的指定mrna的寡核苷酸的设计。
现有技术教导可用于将寡核苷酸有效地递送到多种细胞类型中的许多递送策略[参见例如
另外,基于解释靶mrna和寡核苷酸两者中的结构改变的力能学的热力学循环,用于鉴定对其靶mrna具有最高预测结合亲和力的那些序列的算法也是可用的[参见例如walton等人biotechnolbioeng65:1-9(1999)]。这些算法已成功地用于在细胞中实施反义方法。
此外,还公开了使用体外系统设计和预测特异性寡核苷酸的效率的几种方法(matveeva等人,naturebiotechnology16:1374-1375(1998)]。
因此,产生高度准确的反义设计算法和多种寡核苷酸递送系统能够使普通技术人员设计和实施适用于下调已知序列表达的反义方法,而不必诉诸于不适当的试验和错误实验。
如下文所总结,核酸药剂也可以在dna水平操作。
抑制受体的生物学功能还可以通过引入基因结构中涉及功能丧失改变的靶向突变(例如点突变、缺失和插入)而使基因(例如,grin2b)失活来实现。
如本文所用,短语“功能丧失改变”是指基因的dna序列中的任何突变,其导致表达产物,即mrna转录物和/或翻译的蛋白的表达水平和/或活性下调。这种功能丧失变化的非限制性实例包括错义突变,即,使用另一个氨基酸残基改变蛋白中的氨基酸残基并由此消除该蛋白的酶活性的突变;无义突变,即,在蛋白中引入终止密码子的突变,所述终止密码子例如早期终止密码子,其导致缺乏酶活性的较短的蛋白;移码突变,即突变,通常为,改变蛋白的阅读框架的核酸的缺失或插入,并且可能通过将终止密码子引入阅读框架来导致早期终止(例如,缺乏酶活性的截短蛋白),或在影响蛋白的二级或三级结构的较长氨基酸序列(例如,连续蛋白)中,并且导致缺乏非突变多肽的酶活性的非功能性蛋白;由于移码突变或修饰的终止密码子突变(即当终止密码子被突变成氨基酸密码子时)的连续突变,具有消除的酶活性;启动子突变,即启动子序列中的突变,通常为5’至基因的转录起始位点,其导致特异性基因产物的下调;调节突变,即在上游或下游或基因内的区域中的突变,其影响基因产物的表达;缺失突变,即缺失基因序列中的编码核酸并且可能导致移码突变或符合读框的突变(在编码序列内,一个或多个氨基酸密码子的缺失)的突变;插入突变,即,将编码或非编码核酸插入基因序列中,并且可能导致一个或多个氨基酸密码子的移码突变或符合读框的插入的突变;倒位,即导致反向编码或非编码序列的突变;剪接突变,即导致异常剪接或剪接不良的突变;以及重复突变,即导致重复的编码或非编码序列的突变,其可能是符合读框的或可能引起移码。
根据特定的实施方案,基因的功能丧失改变可以包含该基因的至少一个等位基因。
如本文所用的术语“等位基因”是指基因座的一个或多个替代形式中的任何一个,所有这些等位基因都与性状或特征有关。在二倍体细胞或生物体中,给定基因的两个等位基因占据一对同源染色体上相应的基因座。
根据其它特定的实施方案,基因的功能丧失改变包括基因的两个等位基因。
将核酸改变引入目标基因的方法在本领域是熟知的[参见例如menked.genesis(2013)51:-188;capecchi,science(1989)244:1288-1292;santiago等人procnatlacadsciusa(2008)105:5809-5814;国际专利申请号wo2014085593,wo2009071334和wo2011146121;美国专利号8,771,945、8,586,526、6,774,279和up专利申请公开号20030232410、20050026157、us20060014264;其内容通过引用整体并入],并且包括靶向同源重组(例如“命中和运行”,“双重替换”),位点特异性重组酶(例如cre重组酶和flp重组酶),pb转座酶(例如sleepingbeauty,piggybac,tol2或frogprince),通过工程改造的核酸酶的基因组编辑(例如大范围核酸酶,锌指核酸酶(zfn),转录活化剂如效应子核酸酶(talen)和crispr/cas系统)和使用重组腺伴随病毒(raav)平台的基因组编辑。用于向目标基因引入核酸改变的药剂可以从公众可获得的来源设计,或者可以从transposagen、addgene和sangamobiosciences商业获得。
用于定性功效和检测序列改变的方法是本领域熟知的,且包括但不限于dna测序、电泳、基于酶的错配检测测定和杂交测定如pcr、rt-pcr、rna酶保护、原位杂交、引物延伸、dna印迹、rna印迹和斑点印迹分析。
特定基因中的序列改变也可以使用例如色谱法、电泳方法、免疫检测测定法,如elisa和蛋白质印迹分析和免疫组织化学在蛋白水平上确定。
gd的主要表现之一是大量葡糖神经酰胺(glccer)在神经元细胞中的病理积累。因此,在某些实施方案中,β-葡糖脑苷脂酶活性缺陷表现为glccer在神经元中的升高和/或病理学积累。
gd2型和3型与gd1型区别的关键标准之一是中枢神经系统(cns)的参与和cns相关症状的出现。因此,在某些实施方案中,神经元细胞是中枢神经系统(cns)神经元。
如现在已知的是,甚至在载体中发现的gba1突变是帕金森氏病的高危因素,预期用根据本发明的nmda拮抗剂的治疗甚至对于这类易患pd的具有gba1突变的患者也是有益的。不希望受任何理论或作用机制的约束,预期这种治疗可能会延缓疾病的发病。
根据特定的实施方案,nmda受体拮抗剂特异性结合nmda受体,与其它受体没有交叉反应性。
已知许多充当nmda受体拮抗剂的化合物具有其它生物活性(如例如上文表1中所示)。因此,根据其它特定的实施方案,所述nmda受体拮抗剂可以调节其它受体的活性。
如本文所用,术语“调节”是指通过抑制(即拮抗剂)或通过活化(即激动剂)活性和/或受体表达来改变活性。
根据特定的实施方案,调节活性和/或表达是抑制活性和/或表达。
根据特定的实施方案,调节活性和/或表达是活化活性和/或表达。
因此,在某些实施方案中,nmda受体拮抗剂也具有5-羟色胺能活性。如本文所用的术语“5-羟色胺能活性”是指nmda受体拮抗剂也调节5-ht受体家族的受体的活性的能力。
如本文所用,术语“5-ht受体家族”是指用作5-羟色胺受体的一组蛋白。该组含有由在推定的跨膜区域内的它们的推断的氨基酸序列中显示彼此大于72%或更高的同源性的基因编码的蛋白亚组(由带电荷或极性氨基酸界定的疏水性氨基酸的线性连续的一段序列,足够长以形成跨越脂质双层的二级蛋白结构)。迄今已知四种人5-ht受体亚家族:5-ht1、5-ht2、5-ht3和5-ht4。
在某些实施方案中,所述nmda受体拮抗剂也是5-ht3受体拮抗剂。
在某些实施方案中,具有5-ht3受体拮抗剂活性的nmda受体拮抗剂是氯胺酮或其药学上可接受的盐、水合物或药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,所述nmda受体拮抗剂也具有胆碱能活性。如本文所用的术语“胆碱能活性”是指nmda受体拮抗剂也能调节烟碱乙酰胆碱受体(nachr)家族的受体的活性的能力。在某些实施方案中,所述nmda受体拮抗剂也是烟碱乙酰胆碱受体(nachr)拮抗剂。
如本文所用,术语“烟碱乙酰胆碱受体(nachr)家族”是指用作乙酰胆碱受体的一组蛋白,其是在配体结合时肌肉收缩的信号。在某些实施方案中,具有nachr拮抗剂活性的nmda受体拮抗剂选自金刚烷胺和右美沙芬及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,所述nmda受体拮抗剂也具有多巴胺能活性。如本文所用的术语“多巴胺能活性”是指nmda受体拮抗剂也调节多巴胺受体家族的受体的活性的能力。
如本文所用,术语“多巴胺受体家族”是指用作多巴胺受体的一组蛋白。该组含有由在推定的跨膜区域(由带电荷或极性氨基酸界定的疏水性氨基酸的线性连续的一段序列,足够长以形成跨越脂质双层的二级蛋白结构)内的它们的推断的氨基酸序列中显示出彼此大于65%的同源性的基因编码的蛋白亚组。迄今已知三种人多巴胺受体亚家族:多巴胺d1受体、多巴胺d2受体和多巴胺d3受体。
在某些实施方案中,nmda受体拮抗剂也是多巴胺d2受体激动剂。
在某些实施方案中,具有多巴胺d2受体激动剂活性的nmda受体拮抗剂是氯胺酮或其药学上可接受的盐、水合物或药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
在某些实施方案中,nmda受体拮抗剂也具有神经保护活性。如本文所用的术语“神经保护活性”是指减少或改善神经损伤以及保护或恢复已遭受神经损伤的神经元细胞的作用。如本文所用,术语“神经损伤”是指由诸如代谢、毒性、神经毒性和化学原因的各种原因导致的对神经元细胞或组织的任何损害。在某些实施方案中,nmda受体拮抗剂也是σ-1受体激动剂。
如本文所用,术语“σ-1受体”是指sigmar1基因的表达产物,所述基因编码通过ip3受体调节钙信号传导的在内质网(er)处的伴侣蛋白。
在某些实施方案中,具有σ-1受体激动剂活性的nmda受体拮抗剂选自l-687,384、阿米替林和1-苄基-6’-甲氧基-6’,7’-二氢螺[哌啶-4,4’噻吩并[3.2-c]吡喃]及其药学上可接受的盐、水合物和药学上活性的对映异构体。每个可能性代表本发明的单独实施方案。
本发明还预期包含本文所述的nmda受体拮抗剂与治疗gd的标准方法的组合疗法。治疗gd的标准方法的非限制性实例包括各种疼痛减轻疗法、输血,用于涉及骨和关节的矫形手术、骨髓移植、干细胞移植、脾切除术、基因治疗、酶替代疗法(ert)、底物减少疗法(srt)和药理学伴侣治疗剂。
根据特定的实施方案,将nmda受体拮抗剂治疗与选自酶替代治疗剂、底物减少治疗剂和药理学伴侣治疗剂的药剂组合。
如本文所用“酶替代疗法(ert)”是指外源性施用葡糖脑苷脂酶(gcd)。市场上可获得许多卫生监管机构批准的gcd形式。实例包括但不限于elelyso(taliglucerase)、cerezyme(伊米苷酶(imiglucerase))、vpriv(velaglucerase)和ceredase(阿糖脑苷酶(alglucerase))。
如本文所用,术语“底物减少治疗(srt)剂”是指抑制gcd的天然底物,葡糖神经酰胺(或gl1)的合成的药剂(例如小分子)。市场上可获得许多卫生监管机构批准的srt形式。实例包括但不限于美格鲁特(miglustat)
如本文所用,术语“药理学伴侣治疗剂”(pct)是指可以促进正确折叠并稳定突变形式的gcd的药剂(例如小分子),从而拯救突变的酶免于可能在内质网(er)或其它细胞蛋白降解/处置系统中的降解和/或阻止错折叠的蛋白在细胞中的积累。药理学伴侣可以设计用于穿过血脑屏障(bbb),使其成为治疗对ert无反应的gd神经元病性形式的候选药物。
本发明一些实施方案的nmda拮抗剂和/或药剂可以施用于生物体本身,或在药物组合物中,其中与合适的载体或赋形剂混合。
如本文所用的术语“药物组合物”是指包含至少一种药学活性成分和至少一种药学上可接受的载体的任何组合物。药物组合物的目的是促进化合物施用于生物体。在本文中,术语“活性成分”是指起生物效应作用的nmda受体拮抗剂。
在本文中,可以互换使用的术语“药学上可接受的载体”和“生理上可接受的载体”是指任何类型的无毒固体、半固体或液体填料、载体稀释剂或赋形剂,其不产生对生物体的显著刺激并且不会消除所施用化合物的生物活性和性质。这些短语包括佐剂。
本文中,术语“赋形剂”是指添加到药物组合物中以进一步促进活性成分的施用的惰性物质。赋形剂的非限制性实例包括碳酸钙、磷酸钙、各种糖类和各种类型的淀粉、纤维素衍生物、明胶、植物油和聚乙二醇。本文所用的术语“药学上活性的对映异构体”是指具有指定的生物活性或功能的指定分子的一种或多种立体异构体。举例来说,nmda受体拮抗剂可用作外消旋混合物,或作为富集或纯化(s)或(r)手性药物。每种立体异构体的相对活性可以使用本领域已知的标准技术来确定。
药物的配制和施用技术可见“remington'spharmaceuticalsciences”,mackpublishingco.,easton,pa,最新版本,其通过引用并入本文。
合适的施用途径可以例如包括口服、直肠、经粘膜,特别是经鼻、肠或胃肠外递送,包括肌肉内、皮下和髓内注射,以及鞘内、直接心室内、心内,例如进入右心室或左心室,进入总冠状动脉、静脉内、腹膜内、鼻内或眼内注射。
在某些实施方案中,将nmda受体拮抗剂和/或上述药剂配制成用于口服递送。在某些实施方案中,将nmda受体拮抗剂和/或药剂配制成用于持续释放。在某些实施方案中,将nmda受体拮抗剂和/或上述药剂配制成用于注射。
用于药物递送至中枢神经系统(cns)的常规方法包括:神经外科策略(例如脑内注射或脑室内输注);药剂的分子操作(例如,包含对内皮细胞表面分子具有亲和性的转运肽与本身不能穿过bbb的药剂组合的嵌合融合蛋白的产生),试图利用bbb的内源性转运途径之一;设计用于增加药剂的脂质溶解度的药理学策略(例如,水溶性药剂与脂质或胆固醇载体的缀合);以及通过高渗性破坏bbb的完整性的短暂破坏(由将甘露醇溶液注入颈动脉或使用生物活性剂如血管紧张素肽引起)。然而,这些策略中的每一个都具有局限性,例如与侵入性外科手术相关的固有风险,由内源性转运系统固有的限制所限定的大小限制,与全身施用嵌合分子(由可能在cns外部有活性的载体基序组成)相关的潜在的不希望的生物学副作用,以及在bbb被破坏的脑区域内的脑损伤的可能风险,这使得它不是最佳的递送方法。
或者,可以以局部而非全身方式施用药物组合物,例如通过将药物组合物直接注射到患者的组织区域中。
本发明的一些实施方案的药物组合物可以通过本领域熟知的方法制备,例如通过常规的混合、溶解、制粒、制成糖丸、研磨、乳化、包封、包埋或冻干工艺。
因此,使用包含赋形剂和助剂的一种或多种生理学上可接受的载体,根据本发明的一些实施方案使用的药物组合物可以以常规方式配制,所述载体促进将活性成分加工成药学上可使用的制剂。适当的制剂取决于所选择的施用途径。
对于注射,药物组合物的活性成分可以配制在水溶液中,优选在生理学上相容的缓冲液如hank’s溶液、‘林格氏液或生理盐缓冲液中。对于经粘膜施用,在制剂中使用适合渗透屏障的渗透剂。这种渗透剂在本领域中通常是已知的。
对于口服施用,可以通过将活性化合物与本领域熟知的药学上可接受的载体组合来容易地配制药物组合物。这样的载体使得药物组合物可以配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液等,用于患者的口服摄取。口服使用的药理学制剂可以使用固体赋形剂制备,任选地研磨所得混合物,并且如果需要,在加入合适的助剂之后,加工颗粒混合物以获得片剂或糖衣丸芯。合适的赋形剂特别是填料如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纤维素制剂,诸如,例如玉米淀粉、小麦淀粉、大米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠;和/或生理上可接受的聚合物如聚乙烯吡咯烷酮(pvp)。如果需要,可以加入崩解剂,例如交联的聚乙烯吡咯烷酮、琼脂或海藻酸或其盐如藻酸钠。
向糖衣丸芯提供合适的涂层。为此目的,可以使用浓缩糖溶液,其可以任选地含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇、二氧化钛、漆溶液和合适的有机溶剂或溶剂混合物。可将染料或颜料加入到片剂或糖衣丸包衣中用于鉴定或表征活性化合物剂量的不同组合。
可以口服使用的药物组合物包括由明胶制成的推入式胶囊以及由明胶和增塑剂如甘油或山梨糖醇制成的软的密封胶囊。推入式胶囊可以含有与填料如乳糖,粘合剂如淀粉,润滑剂如滑石或硬脂酸镁,以及任选的稳定剂混合的活性成分。在软胶囊中,所述活性成分可以溶解或悬浮在合适的液体中,例如脂肪油,液体石蜡或液体聚乙二醇。此外,可以加入稳定剂。用于口服施用的所有制剂应该是适合所选施用途径的剂量。
对于口腔施用,组合物可以采用以常规方式配制的片剂或锭剂的形式。
对于通过鼻吸入施用,根据本发明的一些实施方案使用的活性成分可以使用合适的推进剂,例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷或二氧化碳从加压包或雾化器呈递的气溶胶喷雾形式便利递送。在加压气溶胶的情况下,剂量单位可以通过提供阀来递送计量的量来确定。用于分配器中的例如明胶的胶囊和药筒可以配制成含有化合物和合适的粉末基质如乳糖或淀粉的粉末混合物。
本文所述的药物组合物可以配制用于胃肠外施用,例如通过推注或连续输注。用于注射的制剂可以以单位剂量形式存在,例如在任选添加防腐剂的安瓿或多剂量容器中。组合物可以是在油性或水性载体中的悬浮液、溶液或乳液,并且可以含有配制剂,例如悬浮剂、稳定剂和/或分散剂。
用于胃肠外施用的药物组合物包括水溶性形式的活性制剂的水溶液。此外,活性成分的悬浮液可以适当地制备为油性或水基注射悬浮液。合适的亲脂性溶剂或载体包括脂肪油如芝麻油,或合成脂肪酸酯如油酸乙酯、甘油三酯或脂质体。水性注射悬浮液可以含有增加悬浮液粘度的物质,例如羧甲基纤维素钠、山梨糖醇或葡聚糖。任选地,悬浮液还可含有合适的稳定剂或药剂,其增加活性成分的溶解度以允许制备高度浓缩的溶液。
或者,活性成分可以是粉末形式,用于在使用之前用合适的载体例如无菌、无致热原的水基溶液构成。
本发明的一些实施方案的药物组合物还可以使用例如常规栓剂基质如可可脂或其它甘油酯以直肠组合物如栓剂或保留灌肠剂配制。
适用于本发明一些实施方案的情况的药物组合物包括其中含有以有效达到预期目的的量的活性成分的组合物。更具体而言,治疗有效量是指有效预防、减轻或改善病症症状(例如gd,例如3型gd)或延长被治疗的受试者的存活的活性成分(例如nmda受体拮抗剂)的量。
治疗有效量的确定在本领域技术人员的能力范围内,特别是鉴于本文提供的详细公开内容。
对于用于本发明方法中的任何制剂,可以从体外和细胞培养测定法开始估算治疗有效量或剂量。例如,可以在动物模型中配制剂量以达到所需浓度或滴度。这些信息可用于更精确地确定人中的有用剂量。
本文所述的活性成分的毒性和治疗功效可以通过体外、细胞培养或实验动物中的标准药学方法来确定。从这些体外和细胞培养测定和动物研究中获得的数据可用于配制用于人的剂量范围。剂量可以根据使用的剂型和使用的施用途径而变化。鉴于患者的病症,个体医师可以选择确切的配方、施用途径和剂量。(参见例如,fingl等人,1975,“thepharmacologicalbasisoftherapeutics”,第1章第1页)。
可以分别调整剂量和间隔,以提供活性成分的水平足以诱导或抑制生物效应(最小有效浓度,mec)。mec将因每种制剂而异,但可以从体外数据估算。实现mec所需的剂量将取决于个体特征和施用途径。检测测定法可用于确定血浆浓度。
取决于待治疗的病症的严重性和反应性,给药可以是单次或多次施用,治疗过程持续数天至数周或直到实现治愈或达到疾病状态的减少。
当然,待施用的组合物的量将取决于被治疗的受试者、痛苦的严重程度、施用方式、处方医师的判断等。
如果需要,本发明的一些实施方案的组合物可以存在于包装或分配器装置中,例如fda批准的试剂盒中,其可以包含含有活性成分的一种或多种单位剂型。所述包装可以例如包括金属或塑料箔,例如泡罩包装。包装或分配器装置可以附有用于施用的说明书。包装或分配器也可以由管理制造、使用或销售药物的政府机构规定的形式的容器相关联的通知来容纳,该通知反映了该机构批准的组合物形式或人或兽医管理。例如,这种通知可以是美国食品和药物管理局批准的用于处方药的标签或批准的产品插页。也可以制备包含配制在相容的药物载体中的本发明的制剂的组合物,放置在适当的容器中,并标记用于治疗指定的病症,如上文进一步详述。
根据本发明的另一方面,提供了鉴定用于治疗戈谢病(gd)的神经病性形式的试剂盒,其包含包装nmda受体拮抗剂和选自酶替代治疗剂、底物减少治疗剂和药理学伴侣治疗剂的药剂的包装材料。
如以下实施例部分的实施例4进一步所示,发明人已经发现,grin2b基因的非编码序列中单核苷酸变异(snpidrs29869040)中鸟嘌呤的存在与ngd相关,而腺嘌呤在该snp中的存在与gd的相对cbe不敏感性和更缓和的表型相关;此外,grin2bmrna和蛋白表达水平与严重的ngd相关。
因此,本发明的教导也可用于通过确定grin2b基因中的序列变异或grin2b基因的表达产物的量来诊断患者的gd的神经病性形式。
因此,根据本发明的一个方面,提供了一种诊断患者中戈谢病(gd)的神经病性形式的方法,所述方法包括
在患者的生物样品中确定影响grin2b基因的表达产物的量的序列变异和/或grin2b基因的表达产物的量,且其中相对于健康患者或诊断患有gdi型的患者的生物样品,存在序列变异、表达产物的量高于预定水平和/或表达产物的增加的量指示gd的神经病性形式,从而诊断患者的gd的神经病性形式。
根据特定的实施方案,所述患者或受试者被诊断患有gd。
根据本发明的另一方面,提供了一种治疗被诊断患有戈谢病(gd)的神经病性形式的患者的方法,该方法包括:
(a)根据本发明的一些实施方案的方法诊断患者;并且其中指出,相对于健康患者或诊断患有gdi型的患者的生物样品,存在序列变异和/或表达产物的量高于预定水平的和/或增加的量的表达产物,
(b)用nmda受体拮抗剂治疗患者,
从而治疗诊断患有gd的神经病性形式的患者。
为了测定序列变异,首先从测试对象的生物样品获得dna。根据本发明的特定实施方案可以使用的生物样品包括但不限于体液,例如全血、血清、血浆、脑脊液、尿液、淋巴液和呼吸道、肠道和生殖泌尿道的各种外部分泌物,眼泪,唾液,乳汁以及白细胞,恶性组织,羊水和绒毛膜绒毛,以及细胞或组织活检(例如脑活检)。
一旦获得样品,使用本领域熟知的方法提取dna。如上所述,检测序列变异的方法是本领域熟知的,包括但不限于dna测序、电泳、基于酶的错配检测测定和杂交测定如pcr、rt-pcr、rna酶保护、原位杂交、引物延伸、dna印迹、rna印迹和斑点印迹分析。特定基因的序列变异也可以在蛋白水平上使用例如色谱法、电泳方法、免疫检测测定,如elisa和蛋白印迹分析和免疫组织化学来确定。根据特定的实施方案,使用基因组序列分析确定序列变异(例如snp)。
根据本发明的特定实施方案,通过将生物样品、细胞或其部分或其提取物与探针(例如寡核苷酸探针或引物)杂交来进行序列变异的检测,所述探针与包含该序列变异(例如snp)的多核苷酸特异性杂交。以下进一步提供可用于本发明的探针的详细描述。根据特定的实施方案,杂交在允许形成包含含有存在于细胞中的序列变异(例如snp)的dna和探针的复合物的条件下实现。
根据本发明的其它特定的实施方案,通过使生物样品、细胞或其部分或其提取物与特异性结合包含序列变异(例如snp)的多肽的抗体接触来进行序列变异的检测。根据特定的实施方案,接触在允许形成包含含有存在于细胞中的序列变异(例如snp)的多肽和抗体的复合物(即免疫复合物)的条件下实现。
核苷酸/探针复合物或免疫复合物可以在多种温度、盐浓度和ph值下形成,所述温度、盐浓度和ph值可以根据所使用的方法和生物样品而变化,并且本领域技术人员能够调节适合于形成每个复合物的条件。
根据特定的实施方案,序列变异是snp。
根据特定的实施方案,序列变异是在grin2b基因的非编码序列中。
如本文所用的短语“表达水平”和“表达量”是指生物样品中基因表达和/或基因产物活性的程度。例如,各种基因的上调或下调可以影响基因产物的水平(即rna和/或蛋白)。
应当注意,表达水平可以以任意绝对单位或以归一化单位(相对于对照参考的已知表达水平)来确定。例如,当使用dna芯片时,表达水平根据芯片的内部对照或通过使用分位数归一化如rma进行归一化。
根据特定的实施方案,使用rna和/或蛋白检测方法确定表达量。
根据特定的实施方案,所述检测方法选自pcr、寡核苷酸微阵列、免疫沉淀法、蛋白印迹分析和facs。
根据本发明的一些实施方案,从受试者的细胞中提取rna或蛋白分子。因此,根据特定的实施方案,该方法还包括在比较之前从细胞中提取rna或蛋白。
从受试者的细胞中提取rna或蛋白分子的方法是本领域熟知的。提取的rna可以进一步加工成cdna。用于将rna转化为cdna的方法和商业可得的试剂盒是本领域熟知的,包括例如使用酶逆转录酶。一旦获得,可以使用本领域已知的方法来表征rna、cdna或蛋白分子的各种rna、cdna和/或蛋白分子的表达和/或活性水平。
根据特定的实施方案,可以使用rna或dna检测方法在核酸水平确定grin2b基因的表达。
因此,根据本发明的一些实施方案,通过将生物样品、细胞或其部分或其提取物与探针(例如寡核苷酸探针或引物)杂交来进行grin2b途径的rna的表达水平的检测,所述探针与由grin2b基因(例如,包括本领域已知的任何可选剪接形式)表达的多核苷酸特异性杂交。这样的探针可以是任何大小,例如短多核苷酸(例如,15-200个碱基),100-2000个碱基的中等多核苷酸和多于2000个碱基的长多核苷酸。
本发明使用的探针可以是任何直接或间接标记的rna分子[例如,rna寡核苷酸(例如,17-50个碱基),体外转录的rna分子],dna分子(例如寡核苷酸,例如15-50个碱基,cdna分子,基因组分子)和/或其类似物[例如肽核酸(pna)],其对grin2b基因的rna转录物有特异性。根据特定的实施方案,所述探针与可检测部分结合。
根据本发明的教导设计的寡核苷酸可以根据本领域已知的任何寡核苷酸合成方法生成,例如酶促合成或固相合成。
根据特定的实施方案,杂交在允许形成包含存在于细胞中的grin2b基因的mrna或cdna和探针的复合物的条件下进行。所述复合物可以在各种温度、盐浓度和ph值下形成,所述温度、盐浓度和ph值可根据所使用的方法和生物样品而变化,并且本领域技术人员能够调节适合于形成每个核苷酸/探针复合物的条件。
因此,根据本发明的一个方面,提供了一种物质的组合物,其包含被诊断患有戈谢病(gd)的患者的多核苷酸样品,以及能够与由grin2b基因表达的多核苷酸特异性杂交的寡核苷酸,并且任选地其中所述寡核苷酸被标记。
在细胞样品中检测rna和/或cdna分子的方法的非限制性实例包括rna印迹分析、rt-pcr[例如,半定量rt-pcr,使用例如lightcyclertm(roche)的定量rt-pcr],rna原位杂交(使用例如dna或rna探针用以杂交存在于细胞或组织切片中的rna分子),原位rt-pcr(例如,如nuovogj等人,amjsurgpathol.1993,17:683-90;komminothp,等人patholrespract.1994,190:1017-25所述)和寡核苷酸微阵列(例如,通过将衍生自样品的多核苷酸序列与附着于具有可寻址的位置的固体表面[例如,玻璃晶片),例如affymetrix微阵列(
如上所述,根据特定的实施方案,可以使用蛋白检测方法在氨基酸水平确定grin2b基因的表达。
因此,根据本发明的一些实施方案,通过使生物样品、细胞或其部分或其提取物与特异性结合由grin2b基因(例如,包括本领域已知的其任何变体)表达的多肽的抗体接触来进行grin2b的蛋白的表达水平的检测。根据特定的实施方案,所述接触在允许形成包含存在于细胞中的grin2b基因涉及的多肽和抗体的复合物(即免疫复合物)的条件下实现。
所述免疫复合物可以在各种温度、盐浓度和ph值下形成,所述温度、盐浓度和ph值可以根据所使用的方法和生物样品而变化,并且本领域技术人员能够调节适合于形成每种免疫复合物的条件。
因此,根据本发明的一个方面,提供了一种物质的组合物,其包含物质的组合物,其包含被诊断患有戈谢病(gd)的患者的多肽样品,以及能够特异性结合由grin2b基因表达的多肽的抗体和任选的第二抗体。
检测细胞样品中特异性蛋白分子的水平和/或活性的方法的非限制性实例包括酶联免疫吸附测定(elisa)、蛋白印迹分析、免疫沉淀法(ip)、放射免疫测定(ria)、荧光活化细胞分选(facs)、免疫组织化学分析、原位活性测定(使用例如施加在含有活性酶的细胞上的显色底物)、体外活性测定(其中特定的酶的活性在提取自细胞的蛋白混合物中测量)和基于分子量的方法。例如,在需要检测分泌蛋白的表达水平的情况下,可以对从受试者获得的含有细胞分泌的内容物的流体样品(例如血清)进行elisa测定。
根据特定的实施方案,本发明使用的抗体可以是任何直接或间接标记的抗体。根据特定的实施方案,寡核苷酸与可检测部分结合。
本发明的一些实施方案使用的可检测部分可以是但不限于荧光化学品(荧光团),磷光化学品、化学发光化学品、放射性同位素(例如[125]碘)、酶、荧光多肽、亲和标记物,以及可通过正电子发射断层成像术(pet)或磁共振成像(mri)检测的分子(造影剂)。
如上所述,将患者生物样品中的grin2b基因的表达水平与健康患者或被诊断患有gdi型的患者的生物样品中的至少一种基因的表达水平进行比较。
如本文所用,术语“健康患者”是指不患有gd的患者。
如上所述,相对于健康患者或被诊断患有gdi型的患者的生物样品,影响grin2b基因的表达产物的量的序列变异的存在,所述表达产物的量高于预定水平和/或所述表达产物的增加的量,指示gd的神经病性形式。
如本文所用,短语“高于预定阈值的量”或“增加的量”是指相对于使用相同的定量方法的健康受试者的类似生物样品中发现的量的至少统计学显著的上调。
根据特定的实施方案,所述增加的量为相对于对照样品增加至少5%,至少10%,至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%,至少100%或更多,高于约2倍,高于约3倍,高于约4倍,高于约5倍,高于约6倍,高于约7倍,高于约8倍,高于约9倍,高于约20倍,高于约50倍,高于约100倍,高于约200倍,高于约350倍,高于约500倍,高于约1000倍或更多。
预期在从本申请成熟的专利期限内,将会开发许多相关的nmda受体拮抗剂,并且术语“nmda受体拮抗剂”的范围意在包括所有这些推理的新技术。
如本文所用,术语“约”是指±10%术语“包含”、“含有”、“包括(includes)”、“包括(including)”、“具有”和它们的结合物意味着“包括但不限于”。
术语“由...组成”是指“包括但限于”。
术语“基本上由...组成”是指组合物、方法或结构可以包括另外的成分、步骤和/或部分,但是只有当所述另外的成分、步骤和/或部分不会实质上改变所要求保护的组合物、方法或结构的基本和新特征时。
如本文所用,单数形式“一”、“一种”和“所述”包括复数指代,除非上下文另有明确规定。例如,术语“一种化合物”或“至少一种化合物”可以包括多种化合物,包括它们的混合物。
在本申请中,本发明的各种实施方案可以以范围格式呈现。应当理解,范围格式的描述仅仅是为了方便和简洁,并且不应被解释为对本发明的范围的僵化限制。因此,对范围的描述应被认为已经具体公开所有可能的子范围以及该范围内的各个数值。例如,诸如从1到6的范围的描述应被认为已经具体公开子范围诸如1至3、1至4、1至5、2至4、2至6、3到6等,以及该范围内的各个数字,例如1、2、3、4、5和6。不管范围的宽度这都适用。
本文无论何时显示数值范围,都意味着包括在指定范围内的任何引用的数字(分数或整数)。短语“范围在第一指示数值和第二指示数值之间”和“范围从第一指示数值至第二指示数值”在本文中可互换使用,并且意在包括所述第一和第二指示数值以及它们之间的所有分数和整数数字。
如本文所使用的,术语“方法”是指完成给定任务的方式、手段、技术和工序,包括但不限于已知或者以已知方式、手段、技术和工序由化学、药理学、生物学、生物化学和医学领域的从业者容易开发的那些方式、手段、技术和工序。
当提及特定的序列表时,这样的参考应被理解为也包括基本上对应于其互补序列的序列,包括由于例如测序错误、克隆错误或导致碱基置换、碱基缺失或碱基添加的其它改变而导致的较小序列变异,条件是这些变异的频率为50个核苷酸中少于1个,或者100个核苷酸中少于1个,或者200个核苷酸中少于1个,或者500个核苷酸中有少于1个,或者1000个核苷酸中少于1个,或者5000个核苷酸中少于1个,或者10000个核苷酸中少于1个。
应当理解,为了清楚起见,在单独实施方案的上下文中描述的本发明的某些特征也可以在单个实施方案中组合提供。相反,为了简洁起见,在单个实施方案的上下文中描述的本发明的各种特征也可以单独提供或以任何合适的子组合提供或合适的在本发明的任何其它描述的实施方案中提供。在各种实施方案的上下文中描述的某些特征不应被认为是那些实施方案的基本特征,除非该实施方案在没有那些元素的情况下不起作用。
如上所述和如下权利要求部分所要求保护的本发明的各种实施方案和方面在以下实施例中找到实验支持。然而,它们绝对不被解释为限制本发明的广泛范围。
实施例
现在参考以下实施例,其与上述描述一起以非限制性方式说明本发明的一些实施方案。
通常,本文使用的命名法和本发明中使用的实验室工序包括分子、生物化学、微生物学和重组dna技术。这些技术在文献中有详细解释。参见例如“molecularcloning:alaboratorymanual”sambrook等人,(1989);“currentprotocolsinmolecularbiology”第i-iii卷ausubel,r.m.,编(1994);ausubel等人,“currentprotocolsinmolecularbiology”,johnwiley和sons,baltimore,maryland(1989);perbal,“apracticalguidetomolecularcloning”,johnwiley&sons,newyork(1988);watson等人,“recombinantdna”,scientificamericanbooks,newyork;birren等人(编)“genomeanalysis:alaboratorymanualseries”,第1-4卷,coldspringharborlaboratorypress,newyork(1998);方法如美国专利号4,666,828;4,683,202;4,801,531;5,192,659和5,272,057中所述;“cellbiology:alaboratoryhandbook”,第i-iii卷cellis,j.e.,编(1994);“cultureofanimalcells-amanualofbasictechnique”,freshney,wiley-liss,n.y.(1994),第三版;“currentprotocolsinimmunology”第i-iii卷coliganj.e.,编(1994);stites等人(编),“basicandclinicalimmunology”(第8版),appleton&lange,norwalk,ct(1994);mishell和shiigi(编),“selectedmethodsincellularimmunology”,w.h.freemanandco.,newyork(1980);可用的免疫测定法在专利和科学文献中广泛描述,参见例如美国专利号3,791,932;3,839,153;3,850,752;3,850,578;3,853,987;3,867,517;3,879,262;3,901,654;3,935,074;3,984,533;3,996,345;4,034,074;4,098,876;4,879,219;5,011,771和5,281,521;“oligonucleotidesynthesis”gait,m.j.,编(1984);“nucleicacidhybridization”hames,b.d.和higginss.j.,编(1985);“transcriptionandtranslation”hames,b.d.和higginss.j.,编(1984);“animalcellculture”freshney,r.i.,编(1986);“immobilizedcellsandenzymes”irlpress,(1986);“apracticalguidetomolecularcloning”perbal,b.,(1984)和“methodsinenzymology”第1-317卷,academicpress;“pcrprotocols:aguidetomethodsandapplications”,academicpress,sandiego,ca(1990);marshak等人,“strategiesforproteinpurificationandcharacterization-alaboratorycoursemanual”cshlpress(1996);所有这些通过引用并入,如在本文中完整阐述。在本文件全文中提供其它一般性参考文献。其中的工序被认为是本领域熟知的,并为了读者的方便而提供。其中包含的所有信息通过引用并入本文。
材料和方法
小鼠-从jackson实验室(usa)、harlanuk和harlan以色列获得纯种近交小鼠品系。具体来说,btbrt+itpr3tf/jc3h/hej、dba/2j、mrl/mpj、wsb/eij、molf/ei、pwd/phj、kk/hij、bpl/1j、i/lnj、bpn/3j和lp/j获自jackson;a/j、akr/j、nzw/lacj、129s1/svimj获自英国的harlan实验室;和c57bl/6jolahsd、balb/cj和fvb/nj均获自以色列的harlan实验室。如在vitner等人naturemedicine(2014)20:204-208;和enquist,i.b.等人proc.natl.acad.sci.usa(2007)104:17483–17488中所述地产生gbaflox/flox;巢蛋白-cre小鼠,一种gd的小鼠模型。这些小鼠总结了人ngd的许多特征,尽管它们的gba1缺陷仅限于神经和大胶质谱系。小鼠在特定的无病原体条件下维持,并根据国际指南通过魏茨曼研究所动物保护委员会批准的方案处理。
cbe注射-环己烯四醇-β-环氧化物(cbe)获自calbiochemmillipore(darmstadt,德国)。从出生后第8天(p8)开始每天向小鼠腹膜内施用每天25mg或50mg/kg体重的剂量的cbe或pbs(对照)。
用nmda受体激动剂和拮抗剂处理-所有激动剂和拮抗剂从p8起每天施用。每天以200mg/kg/天的剂量施用d-环丝氨酸(sigma)。每天以0.3mg/kg/天的剂量施用mk-801(sigma)。美金刚(sigma)每天以3或30mg/kg/天的剂量施用。每天以9mg/kg/天的剂量施用艾芬地尔(sigma)。
免疫组织化学-处死小鼠,将全脑在4%多聚甲醛:pbs中在4℃下固定过夜。将组织在pbs中洗涤并用薄片切片机切片。通过所有阻断、抗体孵育和洗涤步骤,将40微米冠状切片在2%bsa、0.2%tritonx-100、pbs中自由漂浮处理。将切片在4℃下用初级抗大鼠cd68(abdserotec,oxford,uk;1:1000)孵育过夜。洗涤后,将切片用二次cy2-缀合的驴抗大鼠抗体(1:200,jackson)孵育。使用落射荧光显微镜(zeiss)分析脑皮质层v中cd68-阳性细胞的存在。
rna提取和定量pcr处理后,处死小鼠,并取出它们的脑,置于小鼠脑切片器(youngmousebrainslicermatrix)(bsmys001-1,zivicinstruments,pittsburgh,pa,usa)上,并切成1mm冠状切片。使用刮铲将大脑皮质分离并在液氮中快速冷冻并储存在-80℃下。根据制造商的说明书,使用rneasymini试剂盒(qiagengmbh,hilden,德国)分离总rna。使用perfectasybrgreenfastmix(quantabiosciences,gaithersburg,md,usa)和abiprism7300序列检测系统(appliedbiosystems,fostercity,ca,usa)进行定量聚合酶链反应(q-pcr)。引物浓度为在20μl的反应体积中的13nm,且cdna相当于2ng的总rna。每个反应都以三个生物重复和四个技术一式三份进行。热循环参数如下:步骤1,95℃10分钟;步骤2,95℃15秒,60℃30秒和68℃30秒。重复步骤2进行40个循环,和然后进行解离步骤。使用tata盒结合蛋白(tbp)进行归一化的比较循环阈值法计算mrna水平的折叠变化。使用双尾、双独立样本学生t检验计算p值。引物序列如下:
grin2b正向引物(seqidno:2):5'-cgcccagatcctcgatttca-3';
grin2b反向引物(seqidno:3):5'-ctggaagaacatggaggactca-3'。
tbp正向引物(seqidno:4):5'-tgctgttggtgattgttggt-3';和
tbp反向引物(seqidno:5):5'-ctggcttgtgtgggaaagat-3';
gba1活性测定-如前所述进行gba1活性测定(farfel-becker等人,hummolgenet.2014;23(4):843-54)。简言之,将冷冻的半脑样品在mcilvaine缓冲液(0.1m柠檬酸,ph4.2,0.2mna2hpo4,29:21,体积:体积)中超声处理。将含有50μg蛋白的组织匀浆物在37℃下用在25μl最终体积的mcilvaine缓冲液中的8μmc6-nbd-glccer(avantipolarlipids,alabaster,al,usa)孵育30分钟。提取脂质并使用氯仿:甲醇:9.8mmcacl2(60:35:8,体积:体积:体积)作为显影溶剂通过薄层色谱法分离较低相。使用typhoon9410可变模式成像仪,用真实的标准鉴定c6-nbd-神经酰胺,并通过image-quanttl(gehealthcare,chalfontstgiles,uk)量化条带。
鞘脂分析-使用如前所述的abi4000四极线性离子阱质谱仪进行lc-esi-ms/ms(farfel-becker等人,hummolgenet.2014;23(4):843-54)。鞘脂内标获自avantipolarlipids(alabaster,al,usa)。
全基因组关联研究-通过高效混合模型关联(emma),使用如前所述的单个单核苷酸多态性(snp)关联,对定量寿命表型进行gwa作图(kang等人,2008)。emma校正遗传相关性和人口结构,最大限度地减少假关联。为了确保小鼠基因组的高度作图分辨率,使用4000000个snp/品系进行关联。在严格的bonferroni校正之后,全基因组显著性的阈值为1.25×10-8。虽然以前已经证明,在杂交小鼠多样性组(hmdp)中使用emma的gwa的p<0.05全基因组等同物为p=4.1×10-6(kang等人,2008),为避免假关联,p值≤1×10-7被认为是显著的。曼哈顿图是使用r包生成的(turnersd.qqman:用于使用q-q和曼哈顿图可视化gwas结果的r包。biorxivdoi:://dx.doi.org/10.1101/005165)。
运动检测-通过吊线测试,一种lsd小鼠模型的验证测试,每周对处理的品系中的运动协调进行评估(alvarez等人,2008)。简而言之,将小鼠的前爪放在水平杆(3mm直径;35mm长)的中心处。观察动物的身体位置30秒,并如前所述进行评分(alvarez等人fasebj.2008;22(10):3617-27):0=在10秒内脱落;1,=通过两个前爪挂在杆上;2=试图爬上杆;3=通过两个前爪加一个或两个后爪挂在杆上;4=所有四只爪挂着,加上尾巴卷绕在杆上;和5=主动逃生到杆的末端。
人样品和wb-人脑样品通过知情同意书获得。按照描述(vitner等人,2014)制备匀浆物。印迹用抗nr2b(1:1000,millipore,06-600)和gapdh(1:10000,chemicon,mab374)抗体孵育。
统计分析-所有数据显示为平均值±sem。使用双尾学生t检验进行两个样品之间的比较。p<0.05被认为是统计学显著的。
实施例1.选择神经病性戈谢病(ngd)的小鼠模型
为了研究不同小鼠品系作为2/3型gd的可靠模型的潜力,选择了15种不同的近交小鼠品系。cbe已经被用于在小鼠中诱导gd多年(mumford等人,1975),并且它被用于产生gd疾病的第一动物模型。cbe是水溶性的,并穿过血脑屏障。所选择的15种小鼠品系具有不同的系统发育起源,并且它们的snp分布可以自由获得(图1a)。在出生后第8天开始和在其剩下的生命中,每天向小鼠腹腔注射25mg/kg/天的cbe(vitner等人,2014)。如下图1b和表2中总结的,15种小鼠品系的存活延续超过200天。获得的结果表明,每种小鼠品系对cbe的gd诱导反应不同。品系可分为两组:第一组小鼠的行为非常均一;它们发展了一种非常有侵袭性的疾病,寿命短。第二组品系表现出具有更广泛的表型的更长的预期寿命。在每个品系中,寿命变化性低,表明每种品系对cbe处理的反应是遗传背景的结果。
为了进一步表征cbe处理对不同品系的影响,每周使用吊线试验,从出生后第21天开始,持续2个月追踪运动行为。挂线测试评估协调和运动功能,其中高分意味着更好的协调。如图1c所示,存活短的经cbe处理的品系在非常早期的时间点也显示差的运动行为;而存活长的品系呈现较高的运动行为值。呈现长寿命的一些品系,如sv129和balb/c,在后期阶段表现出较差的运动行为,而其它品系如kk/hij在所有测试时间点都具有高的运动得分。与品系无关,经pbs处理的小鼠显示出高挂线测试得分,表明由于cbe处理而导致运动行为的差异(图1c)。值得注意的是,pwd/phj和wsb/eij品系由于其野性行为而被排除在运动行为分析中。
为了验证实施例1的结果,在两个示例性品系akr/j(在第24天的平均死亡率)和btbrt+itpr3tf/j(在第199天的100%死亡率)中分析脑的皮质层v中cd68-阳性细胞的存在。如图2所示,通过cbe处理更容易死亡的akr/j小鼠也显示明显的脑病理学,表明它们可以用作2型和/或3型gd的良好模型,而btbrt+itpr3tf/j小鼠在死亡率和脑病理学方面对cbe敏感性较低。
总之,在测试的品系中,发现a/j、akr/j、c3h/hej、dba/2j、mrl/mpj、c57bl/6j、wsb/eij和molf/eij对cbe最敏感,为2/3型gd提供良好的小鼠模型。
实施例2.不同小鼠品系的脑中的gba1活性和脂质水平与存活率差异无关
为了消除在不同小鼠品系中观察到的表型差异是由脑中不同的cbe代谢引起的可能性,测量用cbe或pbs(对照)处理10天的小鼠的gba1酶活性。如图3a所示,在所有测试的品系中cbe以相同程度显著降低了大脑gba1活性。总体而言,剩下的gba1活性为对照的5-10%(图3a)。在pbs(r2=0.126,未显示数据)和cbe条件(r2=0.0581,图3b)中,脑中的gba1活性和寿命之间无相关性。另外,根据品系进行评估时,gba1活性的抑制和寿命之间没有发现相关性(r2=0.0085,数据未显示)。
在下一步中,分析了gba1抑制、glccer积累的后果。如预期,与对照相比,cbe处理的小鼠在脑中呈现更高水平的glccer。与pbs处理的小鼠相比,cbe处理的脑中glccer水平的平均升高为3.7倍(图3c)。脑中最丰富的glccer种类c18是提高的主要glccer种类(未显示)。重要的是,在pbs(r2=0.1441,未显示数据)或cbe条件下(r2=0.0569,图3c),脑中glccer水平与寿命之间无相关性。每个品系的glccer水平的变化与寿命之间也没有相关性(r2=0.0311,数据未显示)。另外,在pbs和cbe条件下,在各种glccer亚种(c14,c16,c18:1,c18,c20,c22,c24:1,c24,c26:1和c26)和寿命之间没有发现相关性(数据未示出)。
糖基鞘氨醇(glcso)是已知在gd中升高的另一种脂质,并且已被提出作为gd生物标志物(rolfs等人,plosone.2013nov20;8(11):e79732)。与对照相比,cbe处理的脑中发现glcso水平平均升高约36倍(图3d)。探讨了glcso水平与小鼠寿命之间的潜在相关性-在pbs(r2=0.068,未显示数据)或cbe处理的脑(r2=0.0013,图3d)中没有发现相关性。与其它脂质类似,glcso水平变化与小鼠寿命之间没有相关性(r2=0.0775,数据未显示)。
另外,在处理的小鼠的脑中分析galcer和galso水平(图3e-3f)。cbe处理的小鼠显示这些脂质没有升高,且脂质水平与小鼠寿命之间没有相关性(对于galcer和galso分别为r2=0.0975和6×10-5)。
综合来看,gba1活性或脂质水平与小鼠寿命之间缺乏相关性表明,在测试品系中观察到的表型差异不是由于cbe的差异代谢或glccer或glcsph水平的差异积累,表明修饰基因的参与。
实施例3.全基因组关联研究
为了发现涉及gd进展的新基因,对上述15种近交系进行全基因组关联研究(gwas)。模型生物体中的gwas具有很大的潜力来识别与人疾病相关的复杂性状的风险因素(frazeret等人,2007;peters等人,2007)。模型生物体-关联作图可能比人关联作图更强大,因为通过在基因相同的生物体中复制表型测量可以减少环境因素的影响(peters等人,2007)。此外,在模型生物体中许多正在进行的基因分型项目中产生的信息是可自由获得的,允许在模型生物体内对复杂性状进行计算机作图。例如,基因组序列分析和snp发现的最新进展导致大量近交系小鼠的密集snp作图的可用性(kirby等人,2010)。这些小鼠snp分布是对复杂性状作图的丰富资源,已广泛用于gwas作图(liu等人2007)。
为了避免由于品系之间的遗传相关性引起的潜在的假关联,使用了基于高效混合模型关联(emma)的新型生物信息学工具。emma是模型生物体关联作图的统计检验,用于校正人口结构和遗传相关性的混杂效应(kang等人,2008)。避免由于人口结构引起的假关联的另一种方法是从不同的系统发生起源选择小鼠品系(clarke等人,2011)。
使用4000000个snp/品系来允许基因组的良好覆盖。图4a-b显示了曼哈顿图,其表明每个染色体中标记的关联几率的对数。gwas分析确定了编码nmda谷氨酸受体亚基b(nmdar2b或nr2b)的基因grin2b(p值=6.58e-08)作为gd进展的潜在修饰基因。具体来说,在grin2b基因的非编码序列(位于grin2bmrna的内含子区域)中,在染色体6(染色体位置136080931)上鉴定了单核苷酸变异(snpidrs29869040),其中鸟嘌呤与cbe-敏感性和早期gd的表型相关,而腺嘌呤与相对cbe-不敏感性和gd的更缓和的表型相关(关联p值=1.73×10-10)。
测试的15种小鼠品系的平均存活时间和grin2bsnp变异总结在下表2中。
表2.
基于上述预测研究,评估grin2b参与神经病性gd的发病机制。内含子中发现重要的关联snp。由于非编码snp可以调节定量性状基因座(qtl)的表达,所以通过qpcr确定grin2b的mrna水平。使用的样品取自大脑皮层,因为grin2b在脑中表达,且该区域显示出病理学。在pbs或cbe处理后10天,测定2个短期存活品系(a/j和c57bl6/jolahsd)和2个长期存活品系(nzw和fvb)的转录水平。发现不同的基因表达模式-在cbe处理后,grin2b表达水平仅在短期存活品系中增加,表明在应激条件下表达水平的调节(图5a)。
此外,通过蛋白印迹评估了对照、1型和2型gd患者中病原性脑区、额叶皮层的死后活组织检查中nr2b蛋白的水平。类似于在小鼠组织中获得的qpcr结果,检测到1型gd患者组织中的nr2b水平没有变化,而观察到神经病性患者中的水平升高,表明nr2b在ngd中起病理作用(图5b)。
在过去,本发明的发明人之一已经表明,glccer积累诱导功能性钙储存的变化(korkotian等人,1999,pelled等人,2005)。此外,本发明人证明用cbe处理的大鼠海马神经元对体外高浓度谷氨酸的毒性作用更敏感(pelled等人,2000),表明谷氨酸受体的高度活化。总而言之,这表明目前的gwas分析可能已揭示了可能参与gd病理级联修饰的重要候选基因;和nmda受体在长期存活品系中的激动剂应减少它们的寿命,并且nmda受体的拮抗剂应增加短期存活品系的寿命。
实施例4.nmda拮抗剂mk-801相比nmda激动剂d-环丝氨酸对ngd进展的作用
为了研究神经病性戈谢病(gd)中谷氨酸兴奋性毒性的生物相关性,采用药理学方法。首先研究了有效的nmda拮抗剂mk-801在gd发病机制中的作用。mk-801是现存的最具特异性的nmda阻断剂之一。它以非竞争性的方式在几个结构域处结合受体的离子通道,从而阻止ca2+通过通道流入。mk-801已被广泛研究用于治疗神经系统疾病的动物模型(lipton,2006)。然而,它拮抗突触和突触外nmda受体(parsons和raymond,2014)。
图6例示使用mk-801(0.3mg/kg/天)阻断nmda信号传导如何延长cbe-处理的(25mg/kg/天)c3h小鼠的存活,这表明nmda受体是抗-gd药剂的良好治疗靶标。
相反,施用于4种长期存活小鼠品系(balb/cj、fvb/nj、129s1/svimj和btbrt+itpr3tf/j)的有效nmda激动剂d-环丝氨酸减少了cbe-处理的小鼠的寿命(图7)。
实施例5.用于治疗ngd的其它nmda拮抗剂的实施例
尽管mk-801在延长gd小鼠的寿命方面有积极的作用,但由于其对受体的高亲和力和低解离动力学(off-ratekinetics),不仅阻断经突触外受体的过量钙流入的毒性作用,还阻断谷氨酸信号传导的关键正常功能(lipton,2004),它不能用于治疗患者。因此,测试美金刚(一种反竞争性的开放通道阻断剂),其比mk-801提供了更快的与受体的解离结合动力学,并优先阻断突触外nmda受体(lipton,2006,parsons和raymond,2014)。美金刚比mk-801较少特异性。它用作5-ht3受体和α-7nachr的非竞争性拮抗剂(rammes等人,2001;aracava等人,2005),并且用作多巴胺d2受体的激动剂(seeman等人,2008)。美金刚被美国fda和ema批准用于治疗中度至重度阿尔茨海默病(reisberg等人,2003)和路易体痴呆(aarsland等人,2009)。
如图1b和上文表2所示地,使用cbe发展神经病性gd的几种小鼠品系[a/j(aj)、c3h/hej(c3h)、dba/2j(dba)和c57bl6/jolahsd(c57)]用cbe(25mg/kg天)或cbe加美金刚(3mg/kg天)处理。如图8a所示,在所有测试品系中,用美金刚治疗显著延长了小鼠的寿命。
即使在更高的50mg/kg/天的cbe处理剂量的情况下,更高剂量的30mg/kg/天的美金刚治疗显著延长了aj小鼠的存活(图8b-c)。
用美金刚治疗使得神经病性gd小鼠的寿命比mk-801更大程度地增加,可能是因为美金刚优先阻断突触外nmda受体,而mk-801阻断突触和突触外nmda受体两者(parsons和raymond,2014)。
以类似的方式,如通过吊线测试评估,用美金刚治疗延迟了由cbe诱导的运动功能障碍的进展(图9a)。在出生后第49天,美金刚-治疗的小鼠呈现与cbe-处理的小鼠在p21时相同的得分,表明美金刚是治疗ngd的最具侵袭性形式的潜在药物。
重要的是,用美金刚治疗并不干扰脑中的gba1抑制,所述gba1在出生后第70天(p70),小鼠疾病的最后阶段几乎检测不到(图9b)。
由于cbe可以抑制除gba1以外的其它酶,所以在ngd的遗传小鼠模型中进一步评价美金刚的作用,其中gba1缺失发生在神经元和星形胶质细胞中。值得注意的是,如图10a-b所示,美金刚治疗显著延长了ngd小鼠的存活。
在最后阶段,在cbe-处理的小鼠模型中测试了另一种nmda受体拮抗剂艾芬地尔。根据其它mk801和美金刚,该药物在cbe-处理的小鼠的寿命中也显示增加(图11)。
总之,数据表明,nmda受体拮抗剂可以用作ngd的新型治疗靶标。
参考文献
(整个申请中引用了其它参考文献)
aarslandd.,ballardc,walkerz.,bostromf.,alvesg.,kossakowskik.,leroi,i.pozo-rodriguezf.,minthonl.,londose.,memantineinpatientswithparkinson'sdiseasedementiaordementiawithlewybodies:adouble-blind,placebo-controlled,multicentretrial(美金刚在帕金森病痴呆或路易体痴呆患者中:双盲、安慰剂对照、多中心试验).lancet,neurology,8,613-618(2009).
aracavay.,pereirae.f.,maelickea.,albuquerquee.x.memantineblocksalpha7*nicotinicacetylcholinereceptorsmorepotentlythann-methyl-d-aspartatereceptorsinrathippocampalneurons.(美金刚在大鼠海马神经元中比阻断n-甲基-d-天冬氨酸受体更有效地阻断α7*烟碱乙酰胆碱受体)j.pharmacol.exp.ther.,312,1195-1205(2005).
beavanm.s.和schapiraa.h.v.,glucocerebrosidasemutationsandthepathogenesisofparkinsondisease.(葡糖脑苷脂酶突变和帕金森病的发病机制)annalsofmedicine,45,511-521(2013).blisst.v.和collingridge,g.l.,asynapticmodelofmemory:long-termpotentiationinthehippocampus.(记忆的突触模型:海马中的长时程增强)nature,361,31-39(1993).
caudlew.m.,zhangj.,glutamate,excitotoxicity,andprogrammedcelldeathinparkinsondisease.(帕金森病中的谷氨酸、兴奋性毒性和程序性细胞死亡)exp.neurol.,220,230-233(2009).clarkeg.m.等人,basicstatisticalanalysisingeneticcase-controlstudies.(遗传病例对照研究中的基础统计分析)nat.protoc,6,121-133(2011).
cookes.f.和blisst.v.,plasticityinthehumancentralnervoussystem.(人中枢神经系统的可塑性)brain,129,1659-1673(2006).
costaj.,gomesc,decarvalhom.,diagnosis,pathogenesisandtherapeutictargetsinamyotrophiclateralsclerosis.(肌萎缩性侧索硬化症的诊断、发病机制和治疗靶标)cnsneurol.disord.drugtargets,9,764-778(2010).
coxt.m.,gaucherdisease:clinicalprofileandtherapeuticdevelopments.(戈谢病:临床特征和治疗进展)biologics,4,299-313(2010).
deeganp.b.和coxt.m.,imigluceraseinthetreatmentofgaucherdisease:ahistoryandperspective.(治疗戈谢病中的伊米苷酶:历史与认识)drugdesign,developmentandtherapy,6,81-106(2012).
essam.m.,braidyn.,vijayank.r.,subashs.,guilleming.j.excitotoxicityinthepathogenesisofautism.(自闭症发病机制中的兴奋性毒性)neurotox.res.,23,393-400(2013).
frazerk.a.等人,asequence-basedvariationmapof8.27millionsnpsininbredmousestrains.(近交小鼠品系中827万个snp的基于序列的变异图谱)nature,448,1050-1053(2007).
fullerm.,meiklep.j.和hopwoodj.j.,epidemiologyoflysosomalstoragediseases:anoverview.(溶酶体贮积病流行病学:概述)fabrydisease:perspectivesfrom5yearsoffos(2006).
gonzalezd.e等人,enzymereplacementtherapywithvelaglucerasealfaingaucherdisease:resultsfromarandomized,double-blind,multinational,phase3study.(在戈谢病中使用velagluceraseα的酶替代疗法:随机、双盲、多国、3期研究的结果)am.j.hematol.,88,166-171(2013).
hollakc.e.m.,anevidence-basedreviewofthepotentialbenefitsoftaliglucerasealfainthetreatmentofpatientswithgaucherdisease.(循证回顾talglucerasealfa在治疗戈谢病患者中的潜在益处)coreevidence,7,15-20(2012).
kangh.m.等人,efficientcontrolofpopulationstructureinmodelorganism
associationmapping.(模型生物体关联作图中人口结构的有效控制)genetics,178,1709-1723(2008).
korkotiane.,schwarza.,pelledd.,schwarzmanng.,segalm.,futermana.h.,elevationofintracellularglucosylceramidelevelsresultsinanincreaseinendoplasmicreticulumdensityandinfunctionalcalciumstoresinculturedneurons.(细胞内葡糖神经酰胺水平的升高导致培养神经元中的内质网密度和功能性钙储存增加)j.biol.chem.,274,21673-21678(1999).
kostandyb.b.,theroleofglutamateinneuronalischemicinjury:theroleofsparkinfire.(谷氨酸在神经元缺血性损伤中的作用:火花在火中的作用)neurol.sci.,33,223-37(2012).
liptons.a.,failuresandsuccessesofnmdareceptorantagonists:molecularbasisfortheuseofopen-channelblockerslikememantineinthetreatmentofacuteandchronicneurologicinsults.(nmda受体拮抗剂的失败和成功:使用美金刚等开放通道阻断剂在治疗急性和慢性神经损伤中的分子基础)neurorx.,1,101-110(2004).
liptons.a.,paradigmshiftinneuroprotectionbynmdareceptorblockade:
memantineandbeyond.(nmda受体阻断对神经保护作用的范例转换:美金刚及更多)nat.rev.drugdiscov.,5,160-70(2006).
liux.b.等人,switchingofnmdareceptor2aand2bsubunitsatthalamicandcorticalsynapsesduringearlypostnataldevelopment.(nmda受体2a和2b亚基在早期出生后发育期间的丘脑和皮层突触的切换)thejournalofneuroscience,24,40,8885-8895(2004).
machaczkam.等人,substratereductiontherapywithmiglustatfortype1gaucherdisease:aretrospectiveanalysisfromasingleinstitution.(采用美格鲁特的1型戈谢病移植物的底物减少疗法:来自单一机构的回顾性分析)upsalajournalofmedicalsciences,117,28-34(2012).mehtaa.,prabhakarm.,kumarp.,deshmukhr.,sharmap.l.,excitotoxicity:bridgetovarioustriggersinneurodegenerativedisorders.(兴奋性毒性:通往神经变性疾病中的各种触发因素的桥梁)eur.j.pharmacol.,698,6-18(2013).
mumfordr.a.等人,thegauchermouse(戈谢小鼠).biochem.biophys.res.commun.,67,1,85-90(1975).
nichollsj.g.,martina.r.,fuchsp.a.,brownd.a.,diamondm.e.,weisblatd.,(2012).fromneurontobrain(从神经元到脑)(第五版).sunderland,ma:sinauerassociates.
parsonsm.p.,raymondl.a.extrasynapticnmdareceptorinvolvementincentralnervoussystemdisorders.(突触外nmda受体参与中枢神经系统疾病)neuron,82,279-293(2014).
pelledd.,shogomorih.,futermana.h.,theincreasedsensitivityofneuronswithelevatedglucocerebrosidetoneurotoxicagentscanbereversedbyimiglucerase.(具有升高的葡糖脑苷脂的神经元对神经毒性剂的敏感性增加可被伊米苷酶逆转)j.inh.met.dis.,23,175-184(2000).
pelledd.,trajkovic-bodennecs.,lloyd-evanse.,sidranskye.,schiffmannr.,futermana.h.enhancedcalciumreleaseintheacuteneuropathicformofgaucherdisease.(在戈谢病急的性神经病性形式中的增强的钙释放)neurobiol.dis.,18,83-88(2005).
petersl.l.等人,themouseasamodelforhumanbiology:aresourceguideforcomplextraitanalysis(小鼠作为人生物学的模型:复杂性状分析的资源指南).nat.rev.genet.,8,58-69(2007).
rammesg.,rupprechtr.,ferrariu.,zieglgansbergerw.,parsonsc.g.,then-methyl-d-aspartatereceptorchannelblockersmemantine,mrz2/579andotheramino-alkyl-cyclohexanesantagonise5-ht(3)receptorcurrentsinculturedhek-293andn1e-115cellsystemsinanon-competitivemanner(n-甲基-d-天冬氨酸受体通道阻断剂美金刚、mrz2/579和其它氨基-烷基-环己烷以非竞争性方式拮抗培养的hek-293和n1e-115细胞系统中的5-ht(3)受体电流).neurosci.lett.,306,81-84(2001).
ratjenf.和doringg.,cysticfibrosis(囊性纤维化).lancet,361,681-689(2003).
reisbergb.,doodyr.,stofflera.,schmittf.,ferriss.,mobiush.j.,memantinestudygroup.memantineinmoderate-to-severealzheimer'sdisease(美金刚研究组.在中度至重度阿尔茨海默病中的美金刚).newengl.j.med.,348,1333-1341(2003).
seemanp.,carusoc,lasagam.,memantineagonistactionatdopamined2highreceptors(在多巴胺d2高受体处的美金刚激动剂作用).synapse,62,149-153(2008).
sidranskye.等人,multicenteranalysisofglucocerebrosidasemutationsin
parkinson'sdisease(帕金森病中葡糖脑苷脂酶突变的多中心分析),n.engl.j.med.361,1651-1661(2009).
trayneliss.f.,wollmuthl.p.,mcbainc.j.,mennitif.s.,vancek.m.,ogdenk.k.,hansenk.b.,yuanh.,myerss.j.和dinglediner.,glutamatereceptorionchannels:structure,regulation,andfunction(谷氨酸受体离子通道:结构、调节和功能).pharmacologicalreviews,62,405-496(2010).
vitner等人,ripk3asapotentialtherapeutictargetforgaucher'sdisease(ripk3作为戈谢病的潜在治疗靶标).nat.med.,20,2,204-208(2014).
walkerf.o.,huntington'sdisease(亨廷顿氏病).lancet,369,218-228(2007).
zhangc.k.等人,genome-wideassociationstudyofn370shomozygousgaucherdiseaserevealsthecandidacyofcln8geneasageneticmodifiercontributingtoextremephenotypicvariation(n370s纯合子戈谢病的全基因组关联研究揭示了cln8基因作为导致极端表型变异的遗传修饰物的候选资格).am.j.hematol.,87,4,377-383(2012).
- 还没有人留言评论。精彩留言会获得点赞!