RIP3抑制剂在制备抗血小板血栓药物中的用途的制作方法
本发明属于抗血栓药物领域,涉及rip3抑制剂在制备抗血小板血栓药物中的用途。
背景技术:
众所周知,血小板在止血和血栓形成过程中举足轻重。一旦血管出现损伤,血小板即可黏附至内皮下的蛋白成分,同时发生活化,从而触发血小板内致密颗粒的释放及血栓素a2(txa2)的合成。释放出的可溶性血小板激动剂(如二磷酸腺苷(adp)、凝血酶及txa2)进一步募集循环中的血小板,并通过结合至血小板表面的g蛋白偶联受体(gprotein-coupledreceptor,gpcr)使聚集反应更加稳定,从而形成不可逆的血小板血栓,达到凝血、止血的效果。
adp作为致密颗粒中的重要组分,在低浓度激动剂引起的血小板活化的信号放大效应中起主要介导作用。adp通过p2y1及p2y12受体分别激动gq及gi信号通路。p2y1受体在adp诱导的血小板活化中起着微弱却至关重要的始动作用,p2y12受体不但接续并完善由p2y1起始的血小板聚集,更重要的是,参与其他激动剂(如txa2、凝血酶等)诱导的血小板聚集。因此,当血小板受到低浓度激动剂的刺激时,adp的作用尤为重要。
txa2或凝血酶刺激血小板均可导致adp自致密颗粒中释放。虽然txa2通过血栓素a2/前列腺素h2(tp)受体激活血小板,而凝血酶通过蛋白酶活化受体(protease-activatedreceptors,pars)激活血小板,但是两者均与gq及g13通路偶联,而致密颗粒的释放恰恰需要gq及g13通路的活化。从血小板中去除gq或g13不仅显著抑制了致密颗粒的释放,亦可影响体内初级止血以及动脉血栓的形成。作为稳定的txa2类似物,u46619可以诱导adp的二相释放,而磷脂酰肌醇-3-激酶(pi3k)的激活对adp的二相释放同样发挥重要作用。去除pi3k的下游分子akt1或akt2可以减弱血小板的活化及致密颗粒的释放。另外,pi3k可经由gpcr结合到gβγ。由此可见,pi3k-akt信号通路在gpcr激动剂诱导的血小板释放过程中发挥重要的调节作用。
受体相互作用蛋白激酶(receptor-interactingproteinkinase,rip)是一类具有丝氨酸/苏氨酸激酶活性的蛋白,包含7个成员(即rip1-7),其在n末端均含有一段高度同源的激酶结构域(kinasedomain,kd),并且具有不同的c末端。其中,含有518个氨基酸的rip3蛋白是rip激酶家族中分子量最小的蛋白质,其n末端包含的kd对其激酶活性及自身磷酸化均至关重要,而c末端包含的rip同型相互作用基序(riphomotypicinteractionmotif,rhim)可介导rip3与其他坏死性凋亡(necroptosis)相关蛋白的相互作用。现有研究大多关注rip3对细胞凋亡和程序性坏死的调控作用,但其在止血和血栓形成中的地位尚属未知。
技术实现要素:
本发明首次通过实验探究了rip3在止血和血栓形成过程中的作用,发现rip3不仅在体外实验中参与血小板的调节,而且在体内的止血和血栓形成过程中也发挥重要作用,可以作为抗血栓的新靶点。通过调节adp的释放,rip3选择性地影响了血栓素a2(txa2)及凝血酶介导的血小板活化,表明rip3抑制剂可以参与血小板血栓形成过程,进而抑制血栓形成,可以开发成新型抗血栓药物,极具科研和经济价值。因此,本发明提供了rip3抑制剂在制备抗血小板血栓药物中的用途。
目前,关于rip3抑制剂的研究报道尚不多见,主要集中于以下三类:(1)无机物类抑制剂;(2)小分子有机物类抑制剂;以及(3)核酸和蛋白质类抑制剂。
无机物类抑制剂通常为金属离子的氯化物(如hg2cl2)、氟化物(如bef2)和磷酸盐(如cu3(po4)2),对常见的蛋白激酶均能够产生抑制作用。但由于其毒性较大、选择性较差,适用范围比较受限。
小分子有机物类抑制剂是rip3抑制剂中最重要的一类,包含了较为繁多的结构类型,逐渐成为国内外制药企业的关注热点。小分子有机物类抑制剂直接作用于rip3中n末端的丝氨酸/苏氨酸激酶活性结构域,起到抑制rip3的作用,其主要包括如下类型:氨基苯并噻唑类抑制剂(如gsk’872、gsk’843)、二芳基马来酰亚胺类抑制剂(如enzastaurin、sb216763等)、二芳基脲类抑制剂(如sorafenib)、苯氨基喹唑啉类抑制剂(如vandetanib、erlotinib等)、异喹啉磺胺类抑制剂(如fasudil)、吡啶并咪唑类抑制剂(如vemurafenib)和十字孢碱类抑制剂(如staurosporine)等。
在核酸和蛋白质类抑制剂中,多聚核苷酸类抑制剂通过由自身核酸序列编码的蛋白质作用于rip3中n末端的kd,发挥rip3抑制作用。除了通过核酸序列编码相应的蛋白质以外,rip3抗体同样可以直接作用于rip3中n末端的kd,从而抑制rip3的活性。因此,作为能够有效抑制rip3活性的一类物质,核酸和蛋白质类抑制剂同样可以发挥抗血小板血栓的功能。
本发明首次通过实验探究了rip3与止血和血栓形成过程之间的关系,发现rip3不仅在体外实验中参与血小板的调节,而且在体内的止血和血栓形成过程中也发挥重要作用,可以作为抗血栓的新靶点,为抗血栓药物研发提供了新方向。
附图说明
图1为wt与rip3-/-小鼠的尾出血时间示意图。
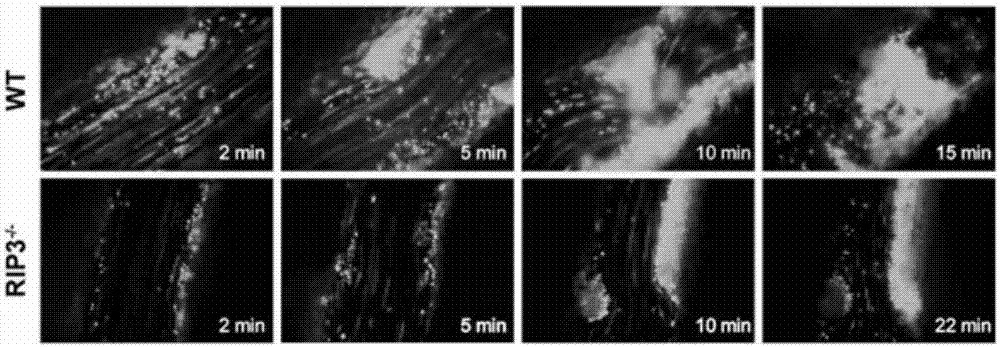
图2为通过实时显微术记录的wt与rip3-/-小鼠体内fecl3诱导的肠系膜动脉血栓形成的典型性图像,图像右下角标注了fecl3致损后的时间。
图3为通过fecl3损伤测定的wt与rip3-/-小鼠体内肠系膜动脉的阻塞时间示意图。
图4为白细胞和血小板的免疫印迹法示意图。
图5为来源于分别采用wt和rip3-/-小鼠供体骨髓衍生细胞重新填充的rip3-/-(wt→rip3-/-)和wt(rip3-/-→wt)小鼠的血小板内rip3表达的示意图。
图6为通过fecl3损伤测定的采用wt或rip3-/-小鼠供体骨髓衍生细胞重新填充的wt和rip3-/-小鼠体内肠系膜动脉的阻塞时间示意图。
图7为来源于wt(n=27)和rip3-/-小鼠(n=26)的全血中检测到的血小板计数示意图。
图8为wt和rip3-/-小鼠血小板的电子显微镜分析图。
图9为不同基因型小鼠的ag和dg的定量示意图。
图10为采用特异性抗体通过流式细胞仪检测的wt和rip3-/-小鼠血小板膜表面主要糖蛋白表达的示意图。
图11为rip3在血小板聚集中的作用示意图。
图12为响应低剂量u46619或凝血酶的rip3-/-血小板的atp分泌示意图。
图13为不足以诱导聚集的、低浓度的adp(0.25μm)翻转rip3缺失对325nmu46619或0.008u/ml凝血酶诱导的血小板聚集的抑制作用的示意图。
图14为采用指定剂量的u46619或凝血酶刺激的小鼠血小板中p-选择素暴露的流式细胞仪分析示意图。
图15为采用凝血酶(0.008u/ml)、adp(2.5mm)、胶原(0.5μg/ml)或载体(对照)刺激的wt和rip3-/-血小板中txb2生产的示意图。
图16为rip3在akt、gsk3β、erk和p38mapk磷酸化中的作用的示意图。
图17为采用抑制剂(sb216763)或载体(dmso)预处理后观察到的u46619或凝血酶刺激wt和rip3-/-血小板聚集的示意图。
图18为与采用载体(对照)或者指定剂量的u46619或凝血酶刺激的wt和rip3-/-血小板结合的pe-jon/a(ab)的流式细胞仪分析示意图。
图19为与采用凝血酶或载体刺激的wt和rip3-/-血小板结合的fitc标记的纤维蛋白原的流式细胞仪分析示意图。
图20为rip3抑制剂抑制u46619和凝血酶诱导的血小板聚集的示意图。
图21为通过实时显微术记录的注射有gsk'872或载体(dmso)的c57d小鼠体内fecl3诱导的肠系膜动脉血栓形成的典型性图像,每一个图像的右下角都标出fecl3致损后的时间。
图22为通过fecl3损伤测定的注射有gsk'872或载体的c57d小鼠体内肠系膜动脉的阻塞时间示意图。
具体实施方式
以下将结合附图和具体实施例来进一步解释和说明本发明的技术方案。
实施例一:gsk’872的抗血栓形成实验。
1、试剂与材料:
阿司匹林、a3p5p、牛血清白蛋白(bsa)、戊巴比妥钠、rgds(arg-gly-asp-ser)、sb216763购自sigma-aldrich公司;calcein-am购自同仁化学研究所;u46619购自calbiochem公司;凝血酶、胶原、adp以及chrono-lume购自chronolog公司;fitc标记的小鼠p-selectin(wug.e9)、pe标记的小鼠integrinαiibβ3(jon/a)、抗小鼠gpib抗体购自emfretanalytics公司;pe标记抗小鼠cd41购自biolegend公司;fitc标记小鼠纤维蛋白原购自abcam公司;txb2酶联免疫分析试剂盒购自enzolifesciences公司;抗小鼠rip3抗体购自prosci公司;抗磷酸化akt(thr308)、抗磷酸化akt(ser473)、抗总akt、抗磷酸化erk1/2(thr202/tyr204)、抗磷酸化gsk3β(ser9)、抗人rip3以及抗β-肌动蛋白(β-actin)抗体购自cellsignalingtechnology公司;mrs2395由复旦大学医学院丁忠仁教授惠赠;rip3抑制剂gsk’872购自德国merckmillipore公司。
2、实验用小鼠:
rip3基因敲除小鼠以c57b6为背景,由北京生命科学研究院王晓东教授提供。应用与rip3基因敲除小鼠具有相同遗传背景的野生型(wt)小鼠作为对照。全部动物实验均经苏州大学附属第一医院伦理委员会批准。
3、尾出血时间:
采用2%戊巴比妥钠将6至8周龄的小鼠麻醉,快速自鼠尾末端切去3mm,立即浸入到37℃恒温水浴的等渗pbs中,计数尾出血时间。出血终止以60s内无再次出血为标准,tbt>600s为观察终点。
4、洗涤血小板:
健康成人志愿者自肘正中静脉采血,并按照li,z.,zhang,g.,lebreton,g.c.,etal.,twowavesofplateletsecretioninducedbythromboxanea2receptorandacriticalroleforphosphoinositide3-kinase[j],j.biol.chem.,2003,278:30725-30731中报道的方法洗涤血小板,献血者均知情同意并签署协议书。实验方案经苏州大学附属第一医院伦理委员会批准,符合赫尔辛基宣言。
按照同样的方法洗涤小鼠血小板。小鼠全身麻醉后,自下腔静脉采血,1/7体积的acd抗凝。全血离心200g×11min,以获得富血小板血浆(prp)。prp中的血小板以cgs洗涤2次,每次离心600g×2min。末次离心后弃上清,以modifiedtyrode’sbuffer(mtb)重悬。室温静置2h后用于实验。
5、电镜:
洗涤血小板以2.5%戊二醛于4℃固定过夜。室温离心600g×2min以收集细胞沉淀。细胞沉淀以pbs洗涤,以1.0%锇酸室温固定1h,梯度丙酮脱水,70%丙酮-饱和醋酸铀于4℃过夜,包埋并制备超薄切片。hitachih600透射电镜观察血小板形态及颗粒内容物。wt组及rip3基因敲除组各选择20个血小板(来自5个不同视野)进行观察并拍照。
6、体内血栓成像:
按照ni,h.,papalia,j.m.,degen,j.l.,etal.,controlofthrombusembolizationandfibronectininternalizationbyintegrinalphaiibbeta3engagementofthefibrinogengammachain[j],blood,2003,102:3609-3614中报道的方法制备fecl3诱导的肠系膜微血管栓塞模型。自供体小鼠分离血小板,洗涤并以calcein-am(5μg/ml)标记。雄性受体小鼠戊巴比妥钠麻醉,按照5×106/g剂量球后注射相应基因型的calcein标记的血小板,放置于37℃预温的平板上。腹前正中切口,显露肠系膜血管床,在荧光显微镜(leica公司)下观察并选择合适的血管,在适当部位放置3mm2左右的5%fecl3浸润的滤纸片,计时,观察血流中断及血栓形成的情况。在抑制剂实验中,先将抑制剂通过眼球后静脉注射吸收后,再进行血栓形成实验。
7、全身照射及骨髓移植:
雄性wt及rip3基因敲除小鼠(10周龄)接受co60来源的8gy剂量的全身照射。收集来自雄性wt及rip3基因敲除小鼠(8周龄)股骨及胫骨的骨髓细胞,并按照1×107/只小鼠给予注射(接受照射后6h内完成),放入ivc专用动物房,给予酸化水、co60辐照饲料及垫料,每日观察生存情况;3~4周后存活小鼠测定全血细胞计数,若恢复正常即可用于下一步实验。移植是否成功通过westernblotting检测受体小鼠血小板中rip3蛋白的表达来确定。
8、血小板聚集及释放实验:
血小板的聚集及释放通过chrono-loglumi血小板聚集仪记录。洗涤血小板(3×108/ml)由不同激动剂刺激。10μl萤光素/萤光素酶在刺激前2min内加入到240μl血小板悬液中。在某些实验中,血小板悬液预先给予不同抑制剂于37℃预处理。聚集及释放曲线持续记录5至10min。
9、txa2合成的检测:
txa2的合成用其稳定的代谢物txb2来表示。血小板用如前所述的不同激动剂刺激,txb2的合成用txb2酶联免疫分析试剂盒进行检测。
10、流式细胞术:
洗涤血小板(3×108/ml)分别加入不同浓度激动剂进行刺激,并同时加入fitc标记的小鼠p-selectin(wug.e9)或pe标记的小鼠integrinαiibβ3(jon/a),室温避光放置15min;加入pbs终止反应,通过cytomicstmfc500mcl流式细胞仪(beckmancoulter公司)检测荧光阳性细胞群体比例以及平均荧光强度。
11、纤维蛋白原结合实验:
洗涤血小板分别加入不同浓度凝血酶或其溶剂以及fitc标记小鼠纤维蛋白原(135μg/ml),同时以rgds处理管(2mm,37℃,5min)作为阴性对照,以排除非特异结合。于37℃避光放置30min,每管内加入350μlpbs终止反应,上机检测结合荧光标记纤维蛋白原的细胞群体阳性率及平均荧光强度。
12、westernblotting:
洗涤血小板(转速1000rpm),以凝血酶或u46619刺激,根据聚集曲线在不同时间点加入2x细胞裂解液(含2mmpmsf、2mmnaf、2mmna3vo4以及蛋白酶抑制剂)终止反应,冰上裂解,制样。样本以免疫印迹法检测相应蛋白的表达。
13、统计学分析:
全部数据均来源于至少3次相互独立的实验,数据以均数±标准误表示,应用prismversion5.0对数据进行统计学分析,对数据进行非配对studentt检验,p<0.05作为差异性显著界值。
14、实验结果:
(1)rip3基因敲除小鼠表现出止血功能受损以及血栓形成受抑的倾向:
为了研究rip3在体内止血过程中的作用,按照estevez,b.,etal.,limkinase-1selectivelypromotesglycoproteinib-ix-mediatedtxa2synthesis,plateletactivation,andthrombosis[j],blood,2013,121:4586-4594中报道的方法,对rip3基因敲除小鼠进行尾出血时间的检测。rip3基因敲除小鼠在其生命周期中并未表现出显著的出血倾向或发生血栓栓塞事件,但是其尾出血时间的中位值(410s)较wt小鼠(223s)显著延长。使用双尾mann-whitney检验进行统计分析,表明2组动物之间具有显著性差异(***p<0.0001),结果如图1所示。此外,有44.4%的rip3基因敲除小鼠在为期10分钟的观察时间内不能停止出血。以上数据表明rip3在初期止血过程中具有重要作用。
应用fecl3损伤导致的肠系膜微动脉血栓模型来探索rip3在体内血栓形成过程中的作用。血栓形成过程在荧光显微镜下实时监测,结果如图2所示。rip3基因敲除小鼠微动脉的阻塞时间(19.9±1.1min)较wt小鼠(13.5±1.2min)延迟(**p=0.0012),结果如图3所示。以上数据说明rip3在体内参与血栓形成过程。
(2)rip3表达于血小板并参与调节小鼠血栓形成:
由于血小板在止血和血栓形成过程中起重要作用,因此首先需要检测血小板内是否有rip3的表达。采用免疫印迹法进行检测,其具体方法如下:在室温下,将洗涤后的血小板再悬浮于裂解缓冲液(包含0.15mnh4cl、10mmnahco3和1mmedta)中10min,通过600g×5min离心采用0.9%生理盐水洗涤白细胞,采用sds-page上样缓冲液裂解洗涤后的血小板和白细胞,并采用针对rip3和cd45(白细胞标记物)的抗体通过免疫印迹法探测血小板和白细胞,针对β-actin的印迹被用作泳道内参照,结果如图4所示。结果表明,人与小鼠的血小板内有rip3的表达,同时证实了在rip3基因敲除小鼠的血小板中无rip3的表达。
除了血小板以外,尚有其他因素参与体内止血和血栓形成过程,尤其是内皮细胞。为了确定究竟是内皮细胞还是血小板在rip3基因敲除小鼠的止血和血栓形成缺陷中起主要作用,对wt及rip3基因敲除小鼠分别进行骨髓移植,来源于wt和rip3-/-小鼠的血小板被用作对照物,而β-actin被用作泳道内参照。接受wt小鼠骨髓细胞移植的rip3基因敲除小鼠(wt→rip3-/-)的血小板内rip3表达水平与wt小鼠相仿,而接受rip3基因敲除小鼠骨髓细胞移植的wt小鼠(rip3-/-→wt)的血小板无rip3表达,结果如图5所示。
关于血管阻塞时间,rip3-/-→wt小鼠(18.4±1.2min)比wt→rip3-/-小鼠(12.5±0.9min)显著延长(**p=0.0047),而接受rip3基因敲除小鼠骨髓细胞移植的rip3基因敲除小鼠(rip3-/-→rip3-/-)(17.8±1.8min)也比接受wt小鼠骨髓细胞移植的wt小鼠(wt→wt)(12.6±1.2min)长(*p=0.035),结果如图6所示。此外,wt→wt及wt→rip3-/-小鼠的血管阻塞时间与wt相仿,而rip3-/-→rip3-/-及rip3-/-→wt小鼠的血管阻塞时间与rip3-/-小鼠相近。以上数据表明,血小板而非内皮细胞的rip3缺陷是rip3基因敲除小鼠血栓形成受抑的主要原因。
此外,与wt小鼠相比,rip3基因敲除小鼠在红细胞计数、白细胞计数及血红蛋白浓度等方面均无显著差异,而血小板计数甚至略有升高(*p<0.05,如图7所示)。无论细胞计数分析抑或电镜观察结果(如图8所示)均显示rip3基因敲除小鼠的血小板大小及形态与正常情况无差异。两种基因型小鼠的α-颗粒(ag)和致密颗粒(dg)的数量(如图9所示)以及血小板膜表面主要糖蛋白(gp)cd42b(gpibα)和cd41(αiib亚基)的表达(如图10所示)亦无差异。
(3)rip3缺失导致凝血酶及u46619诱导的血小板聚集反应受抑:
检测激动剂诱导的血小板聚集反应,以确定rip3在其中所发挥的作用。在持续搅拌的条件下,于37℃采用不同浓度的u46619、凝血酶(thrombin)、胶原(collagen)和adp刺激来源于wt和rip3-/-小鼠的洗涤后的血小板,使用比浊集合度计监测血小板聚集,结果如图11所示。rip3基因敲除小鼠的血小板对于低浓度的u46619(****p<0.0001)及凝血酶(*p=0.016,**p=0.0071)诱导的聚集呈现出显著的反应降低,增加激动剂的剂量则可以纠正这一缺陷,但在胶原及adp诱导的聚集反应中则未见显著差异。上述数据表明,rip3选择性地参与由低浓度u46619或凝血酶诱导的血小板聚集的信号放大过程。
(4)rip3缺失导致凝血酶及u46619诱导的血小板adp释放受抑:
如前所述,自血小板致密颗粒中释放的adp在提高血小板对低浓度激动剂的敏感性及放大血小板聚集反应中发挥非常重要的作用。rip3缺失仅在应用低浓度刺激剂时导致血小板聚集受抑,由此可以假设rip3影响了刺激剂诱导的adp释放环节。为了验证这一假设,检测刺激剂诱导的atp释放作为致密颗粒释放的指标。采用不同浓度的u46619或凝血酶刺激来源于wt和rip3-/-小鼠的洗涤后的血小板,在萤光素/萤光素酶试剂(80nm)的存在下与血小板聚集同时记录atp分泌。如图12所示,rip3基因敲除血小板中低浓度u46619诱导的二相释放反应缺失,在低浓度凝血酶诱导的atp释放中亦可观察到同样的现象。上述结果表明,rip3缺失可导致凝血酶及u46619诱导的血小板致密颗粒释放受抑。
为了进一步确定致密颗粒释放的adp在刺激剂诱导的血小板活化过程中的作用,采用特异性拮抗剂a3p5p和mrs2395分别阻断相应的adp受体p2y1和p2y12,结果如图13所示。a3p5p和mrs2395在wt及rip3-/-血小板中均可抑制u46619诱导的二相聚集与释放,亦可抑制低浓度凝血酶诱导的血小板聚集与释放。上述结果表明,在低浓度u46619和凝血酶诱导的血小板聚集中,致密颗粒释放的adp发挥非常重要的作用。
(5)adp释放受抑与rip3基因敲除血小板聚集功能降低有关:
adp诱导的rip3基因敲除血小板聚集反应并未受到抑制,表明rip3信号通路在adp诱导的整合素活化及血小板聚集中并非必需,由此假设rip3缺失对于u46619或凝血酶诱导的血小板聚集的抑制作用是其抑制adp释放的结果。为了验证这一假设,检测补充外源性adp是否可以纠正u46619及凝血酶在rip3基因敲除血小板中引起的聚集受抑。补充单独应用不足以诱导血小板发生聚集的低浓度adp后即可纠正低浓度u46619及凝血酶在rip3基因敲除血小板中引起的聚集受抑。上述结果表明,adp释放受抑与rip3基因敲除血小板聚集功能降低有关,而rip3在血小板活化中的初步功能是介导u46619或凝血酶刺激导致的adp释放。
(6)rip3基因敲除血小板α-颗粒的释放及txa2的产生:
各种刺激剂诱导的颗粒释放及txa2的产生在刺激信号的放大中起到重要作用,并可进一步使血管损伤部位血小板的活化趋于稳定。因此,进一步检测rip3基因敲除血小板α-颗粒的释放,结果如图14所示。从中可以发现,在u46619刺激的血小板中仅能检测到极为微量的α-颗粒释放,而在凝血酶刺激的wt及rip3-/-血小板中也没有观察到α-颗粒释放的显著性差异。
通过检测txa2的稳定代谢产物txb2,进一步探讨rip3是否参与介导txa2的合成,结果如图15所示。在凝血酶及胶原刺激的wt及rip3-/-血小板中,没有观察到txa2合成的显著性差异,但在adp诱导的rip3-/-血小板中,txb2的合成却显著高于wt血小板(*p<0.05)。
(7)rip3参与调节血小板akt磷酸化:
由于pi3k/akt信号通路被证实参与u46619诱导的血小板的二相释放,因此推测rip3可能通过pi3k/akt通路来调节致密颗粒的释放。在37℃和1000rpm搅拌速度下,采用100nmu46619或0.006u/ml凝血酶在指定的时间内刺激洗涤后的血小板。将血小板溶解,并通过westernblotting采用anti-phospho-akt(thr308/ser473)、anti-phospho-gsk3β(ser9)、anti-phospho-erk、anti-phospho-p38或anti-β-actin(作为泳道内参照)抗体进行探测,结果如图16所示。从中可以发现,akt作为pi3k下游分子,其活化的指标(308位苏氨酸与473位丝氨酸的磷酸化)在凝血酶及u46619刺激的rip3基因敲除血小板中显著降低。此外,pi3k抑制剂在wt及rip3基因敲除血小板中均可降低凝血酶及u46619诱导的聚集反应。gsk3β(一种丝/苏氨酸激酶)也可为akt的激酶活性所磷酸化。gsk3的磷酸化可负反馈调控依赖于pi3k/akt信号通路的致密颗粒释放。与akt的活化相一致,gsk3β的磷酸化程度在rip3基因敲除血小板中也有所降低。
为了进一步证实akt在rip3信号通路中的作用,在加入凝血酶或u46619刺激之前,向rip3基因敲除血小板中给予gsk3β拮抗剂sb216763预处理,该试剂可解救akt的功能受抑。sb216763可使u46619或凝血酶诱导的rip3基因敲除血小板聚集程度提高至与单独应用u46619或凝血酶刺激的wt血小板相若,结果如图17所示。上述结果表明,rip3在血小板中是参与介导akt活化的上游分子。
除了pi3k/akt信号通路外,erk的活化也参与调节刺激剂诱导的血小板释放。u46619或凝血酶诱导的erk磷酸化在rip3基因敲除血小板中减低,表明erk的活化亦受到rip3的调控。
(8)rip3缺失导致u46619及凝血酶诱导的整合素αiibβ3活化受抑:
由于整合素αiibβ3的活化为体外血小板聚集反应所必需,因此探讨rip3在整合素αiibβ3活化过程中的作用。u46619及凝血酶诱导的整合素αiibβ3活化的程度在rip3基因敲除血小板中减弱(如图18所示)。低浓度凝血酶诱导的纤维蛋白原结合在rip3基因敲除血小板也显著降低(如图19所示)。以上结果表明,rip3参与刺激剂诱导的整合素αiibβ3的活化。
(9)rip3抑制剂抑制血小板聚集和小鼠体内动脉血栓形成:
在37℃下,采用不同浓度的rip3抑制剂gsk'872或载体(dmso)孵育洗涤后的人血小板30min,然后采用u46619和凝血酶刺激,并用比浊集合度计监测血小板聚集。rip3抑制剂与血小板作用后,可剂量依赖地抑制u46619和凝血酶诱导的血小板聚集,结果如图20所示。
应用fecl3损伤导致的肠系膜微动脉血栓模型来探索rip3抑制剂在体内血栓形成过程中的作用,并在荧光显微镜下实时监测血栓形成过程,结果如图21所示。另外,rip3抑制剂作用的小鼠微动脉的阻塞时间较对照小鼠明显延迟(如图22所示,**p<0.01)。以上结果表明,rip3可以作为抗血栓的新靶点,并为研究抗栓治疗策略提供新思路。rip3抑制剂能够抑制血栓形成,有望成为高效、特异、副作用小的新一代抗血栓药物。
- 还没有人留言评论。精彩留言会获得点赞!