一种促进蛋白多肽药物口服吸收的酵母细胞壁微粒制剂的制作方法
本发明属药物制剂领域,具体涉及一种能促进蛋白质或多肽口服吸收的酵母细胞壁微粒制剂及其制备方法。
背景技术:
近年来,越来越多的蛋白质多肽药物进入临床实验或临床治疗阶段,其主要给药方式为注射途径,但实践显示,由于大多数蛋白质和多肽药物体内生物半衰期短,需要频繁给药,病人顺应性极差;所以开发非注射途径的蛋白质多肽制剂成为目前药剂学领域研究的热点,也是有关领域需要重点突破的课题。临床实践表明,口服给药是最方便也最为安全的临床用药途径,但是蛋白质和多肽药物存在以下几个问题,导致口服生物利用度很低,无法起到较好的治疗效果:1.胃液中不稳定,易被胃蛋白酶快速降解;2.可受肠道内的蛋白酶的降解;3.蛋白质和多肽药物亲水性强,细胞膜通透性差;4.蛋白质分子量大,是导致膜通透性差的一个原因。目前提高蛋白质多肽药物口服吸收的研究已非常广泛,主要包括以下几种方法:1.采用渗透促进和蛋白酶抑制剂可在一定程度上提高其生物利用度,但是由于其存在较为严重的毒性,其发展前景尚不可预知;2.采用转铁蛋白(tf)、细胞穿膜肽tat等修饰提高细胞的通透性;3.采用微粒给药系统提高胰岛素的口服生物利用度是目前研究最为热门的方面,微粒给药系统可以在一定程度上保护药物免受酶的降解,同时可以提高药物跨膜的能力,目前主要的有纳米粒、脂质体、微乳以及复乳等;但是目前的微粒给药系统仍然不能显著的提高其生物利用度,主要原因在于粒子无法大量跨过肠细胞膜而转运药物。
研究显示,肠道内存在一种特殊的结构-派尔氏结(peyer’spatch),派尔氏结可以吞噬较大的颗粒,并将其运送至淋巴循环,从而进入体循环而发挥药物疗效;而酵母细胞壁颗粒中富含β-葡聚糖,可特异性的靶向于m细胞,从而增加其转运效果。本申请的发明人基于上述现有技术的依据,以及酵母细胞壁价廉易 得,可直接使用面包酵母制得,且具有较好的安全性,适合作为药物给药系统的材料的优势,拟提供一种促进蛋白多肽药物口服吸收的酵母细胞壁微粒制剂,借助酵母细胞壁具有较大的空腔,和具有很高的载药量的特点,通过增加m细胞的靶向作用增加体内的生物利用度。
技术实现要素:
本发明的目的在于针对现有技术的缺陷,提供一种促进蛋白多肽药物口服吸收的酵母细胞壁微粒制剂,通过酵母细胞壁颗粒载蛋白质或多肽提高其口服生物利用度。本发明制剂生物利用度且效果可维持较长的时间,使用方便,重现性好。
基于现有技术中,由于蛋白质多肽药物在胃肠道中不稳定,易受到胃肠道中各种蛋白酶的降解作用,且跨膜能力很差,导致生物利用度极低,酵母细胞壁颗粒可直接靶向于派尔氏结的m细胞,而m细胞具有很强的转运微粒的能力,且药物包裹在酵母细胞壁颗粒中也可避开胃肠道中蛋白酶的破坏,从而可以增加其在胃肠道中的稳定性;但是如果将蛋白质或多肽药物直接包载在酵母细胞壁微粒中,在胃肠道中极易从细胞壁孔道中泄露的缺陷,本发明通过对其在酵母细胞壁微粒内部进行凝胶化作用而使蛋白质或多肽药物能保留在内部,从而通过m细胞大量转运酵母细胞壁颗粒,而增加蛋白质多肽进入体循环内的浓度,进而增加蛋白多肽药物的口服生物利用度。
本发明提供如下技术方案解决现有技术存在的问题:
本发明的一种促进蛋白质和多肽药物口服吸收的酵母细胞壁微粒制剂,其特征在于,由蛋白质或多肽药物、药物辅料和酵母细胞壁颗粒组成,所述的蛋白质或多肽药物或与辅料共同被包裹于酵母细胞壁中,在一定温度下实现内部凝胶化。
本发明中,所述的酵母细胞壁颗粒通过面包酵母制得。
本发明中,所述的辅料选自泊洛沙姆、海藻酸钠或壳聚糖。
本发明中,所述的泊洛沙姆是泊洛沙姆407或188,或二者的混合物。
本发明中,所述的泊洛沙姆407的浓度为10-50%,泊洛沙姆188的浓度为 10-50%,泊洛沙姆407与188的比例为5:1-4。
本发明中,所述的海藻酸钠与钙离子或壳聚糖配合使用,其中海藻酸钠与钙离子的比例为1:0.1-5,海藻酸钠与壳聚糖的比例为1:0.1-5。
本发明中,所述的蛋白质或多肽药物为其水溶液,ph为1.0-8.0,浓度为0.1-10mg/ml。
本发明中,所述的含蛋白质或多肽药物的酵母细胞壁微粒制剂通过两步法制备,其包括,首先制备蛋白质或多肽的水溶液,然后将酵母细胞壁粉末分散在该溶液中,所述蛋白质或多肽扩散进入酵母细胞壁内部,最后通过调节ph至蛋白质多肽的等电点附近,将其沉淀,离心,洗涤,加入辅料溶液,进行内部凝胶化。
所述的制备方法中,当辅料使用海藻酸钠时,需在除掉外相蛋白质或多肽以及辅料后,再加入钙离子或壳聚糖对内部海藻酸钠进行交联;当辅料使用泊洛沙姆时,需在低温下操作使其为溶液态,在除掉外相蛋白质或多肽以及辅料后,升高温度使其内部凝胶化。
本发明的一个实施例中,首先以胰岛素为模型药物,制备载胰岛素的内部凝胶化酵母细胞壁微粒,并进一步对其进行体内外评价。
其中,提供了一种促进胰岛素口服生物利用度的酵母细胞壁微粒,其由胰岛素、辅料和酵母细胞壁颗粒组成,其中活性成分胰岛素被包载于酵母细胞壁内部,所述辅料为可凝胶化的材料;
所述的胰岛素的浓度优选为0.1-100mg/ml;
所述的酵母细胞壁微粒由面包酵母制得,面包酵母通过酸碱处理,干燥得酵母细胞壁微粒。
所述的凝胶化材料包括泊洛沙姆188、407以及海藻酸钠中的一种或几种。
本发明中,通过下述方法制备所述的载胰岛素酵母细胞壁微粒:
称取一定量的酵母细胞壁粉末分散在胰岛素溶液中,涡旋混合均匀,用1m的盐酸调节ph至2,然后在4℃条件下200rpm磁力搅拌2h,用1m的氢氧化钠调节ph至5.6(胰岛素的等电点附近),使胰岛素大量析出沉淀,使孵育在 酵母细胞壁内腔和孔道中的胰岛素沉积在这些腔道内部;重复上述操作3次,通过反复调节ph增加在酵母细胞壁内部沉积的胰岛素的量,提高载药量;然后2000g离心10min,弃上清的胰岛素,加入特定浓度的ph7.0的凝胶化材料溶液,在室温条件下孵育4h;最后2000g离心10min收集沉淀,改变条件实现内部凝胶化,在滤纸上用热水洗去残留的辅料溶液和胰岛素。
所述的凝胶化材料选自泊洛沙姆407、188以及海藻酸钠中的一种或几种,其中优选泊洛沙姆407.
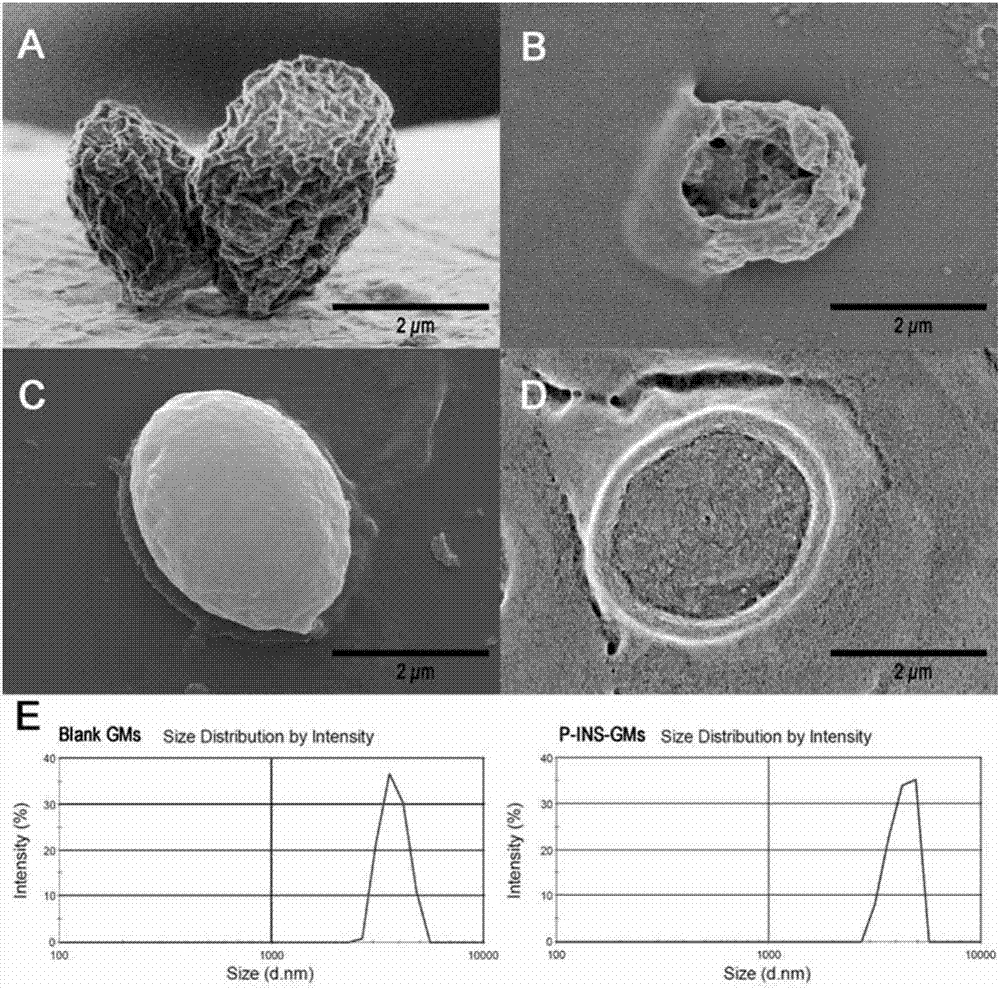
本发明制得的载胰岛素的内部凝胶化的酵母细胞壁微粒(以下简称为p-ins-gms),用马尔文测定粒径和电位,用扫描电子显微镜观察其形态如图1所示。
本发明通过体外稳定性和体内降糖实验的比较,结果表明,本发明通过酵母细胞壁微粒包载胰岛素,并对其进行内部凝胶化,提高了胰岛素在胃肠道内的稳定性,并且通过靶向m细胞增加了胰岛素的口服生物利用度。
附图说明
图1显示了:空白酵母细胞壁微粒(gms)(a)和它的横切面(b),胰岛素凝胶化酵母细胞壁微粒(p-ins-gms)(c)以及横切面(d)的扫描电镜图;空白gms和p-ins-gms粒径图(e)。
图2.为凝胶化(ins-gms)和凝胶化(p-ins-gms)酵母细胞壁微粒在不含酶的sgf(a)和sif(b)中的释放,
其中显示了胰岛素在含酶的sgf(c)和sif(d)中的降解曲线。
图3.为口服给予不同胰岛素制剂在正常大鼠(a)和糖尿病大鼠(b)体内的降血糖曲线(n=4),其中显示,正常大鼠和糖尿病大鼠降糖曲线上面积与剂量的相关性(c)。
具体实施方式
实施例1
制备酵母细胞壁颗粒粉末:取面包酵母100g,加入1lnaoh(1m)溶液,于80℃恒温水浴锅内孵育1h,50rpm慢速搅拌。然后2000g离心10min,收集沉淀,将沉淀重新分散于1l纯水中,用2m的盐酸调节ph至4.5左右,50rpm慢速搅拌下于55℃恒温水浴锅中孵育1h,再次2000g离心10min收集沉淀,依次分别用1l纯水洗一次,200ml异丙醇洗四次,200ml丙酮洗两次,最后收集沉淀,真空干燥,称量计算产率;
包载胰岛素:称取1g制备的酵母细胞颗粒发(gms)粉末分散在5ml胰岛素(ins)溶液中(10mg/ml),涡旋混合均匀,用1m的盐酸调节ph至2,然后在4℃条件下200rpm磁力搅拌2h,用1m的氢氧化钠调节ph至5.6(ins的等电点附近),ins大量析出沉淀,使孵育在gms内腔和孔道中的ins沉积在这些腔道内部;重复上述操作3次,通过反复调节ph增加在gms内部沉积的ins的量,从而提高载药量;然后2000g离心10min,弃上清的ins,加入特定浓度的ph7.0的poloxamer溶液,在室温条件下孵育4h,最后2000g离心10min收集沉淀,升温到tgel以上使gms内部的poloxamer形成凝胶态,在滤纸上用热水洗去残留的poloxamer和ins;
取制备的载胰岛素的内部凝胶化的酵母细胞壁微粒(以下简称为p-ins-gms),用马尔文测定粒径和电位,用扫描电子显微镜观察其形态如图1所示。
实施例2载胰岛素的内部凝胶化的酵母细胞壁微粒的体外释放和抗酶降解实验
体外释放实验:准备10ml不含酶的人工胃液或者人工肠液,在恒温水浴振荡器中预热到37℃,取适量冻干的胰岛素酵母细胞壁微粒(p-ins-gms),加入到不含酶的人工胃液或者人工肠液中,在第0.25、0.5、0.75、1、1.5和2h取样200μl并补充等量的预热的不含酶的人工胃液或者人工肠液,样品8000g离心后过0.25μm滤膜后进样,计算释放的ins含量,其释放曲线如见图2所示;
抗酶降解实验:准备10ml的人工胃液或者人工肠液,在恒温水浴振荡器中预热到37℃,取适量冻干的p-ins-gms,加入到人工胃液(sgf)或者人工肠液(sif)中,取样时间点为0.5、1、2h(sgf)以及0.5、1、4h(sif),其余操作同前,取出的样品8000g离心后弃上清液,用纯水洗一次并离心,取沉淀用β-葡聚糖酶消化30min,涡旋后8000g离心取上清液,稀释至合适的浓度并过0.25μm滤膜后进样,计算剩余的ins含量,其稳定性结果如图2所示。
实施例3载胰岛素的内部凝胶化的酵母细胞壁微粒的口服降血糖实验
正常大鼠以及糖尿病大鼠,分别随机分为6组,每组4只,实验前禁食12h,可自由饮水,6组制剂分别为p-ins-gms(以胰岛素计量分别为10、30和50iu/kg),未固化的酵母细胞壁微粒ins-gms(30iu/kg),空白的内部泊洛沙姆凝胶化的酵母细胞壁微粒p-gms以及ins溶液组(2iu/kg),其中,除ins溶液组为皮下注射给药外,其余制剂组均为灌胃给药;
各组制剂在给药之后特点时间点,于大鼠尾静脉取血,滴加一滴在血糖仪试纸的感应区测定即时血糖值,每个时间点测3次取平均值,测定的血糖值绘制成血糖-时间曲线;结果显示,正常大鼠及糖尿病大鼠体内血糖-时间曲线如图3所示。
- 还没有人留言评论。精彩留言会获得点赞!