一种以铁蛋白为载体的抗肿瘤药物及其制备方法与流程
本发明涉及生物制药领域,涉及一种以铁蛋白为载体的抗肿瘤药物及其制备方法。
背景技术:
常见小分子抗肿瘤药物如阿霉素、5-氟尿嘧啶、紫杉醇、顺铂等在肿瘤治疗上有良好效果,其中阿霉素的抗肿瘤活性尤为明显,但另一方面它们都不具有靶向肿瘤细胞的特性,单独给药容易在抑制肿瘤细胞的同时杀伤正常细胞,存在一定细胞毒性,副作用明显。
铁蛋白由于其自身球形结构稳定,并且可以主动靶向到肿瘤细胞表面铁蛋白受体1的特征被研究人员开始用于装载小分子抗肿瘤药物,从而实现肿瘤药物的靶向递送。使用以铁蛋白为载体的抗肿瘤药物不仅可以增强靶向性,还可以降低药物细胞毒性,减少正常细胞的杀伤,另外由于铁蛋白生物相容性强,进入人体内也没有免疫原性。
目前已有多种方法用于以铁蛋白为载体的抗肿瘤药物,以阿霉素为例,Simsek,E等人(Magic ferritin:A novel chemotherapeutic encapsulation bullet,Journal of Magnetism and Magnetic Materials,2005,293(1):509-513)最早开始利用铁蛋白在pH 2.0下会发生解离,然后在中性条件恢复球形结构的特征装载阿霉素,并且装载比例为5:1(阿霉素:铁蛋白),蛋白收率只有30%。研究人员改进调节pH的方法为梯度模式,Kilic,M等人(A novel protein-based anticancer drug encapsulating nanosphere:apoferritin-doxorubicin complex,J Biomed Nanotechnol,2012,8(3):508-514)将铁蛋白pH调至2.5后与阿霉素混合均匀,然后先将pH调至4稳定一段时间,接着继续调节pH至中性,从而实现药物的装载。这种方法虽然蛋白收率有一定的提高,达到55%,装载比例为28:1,但是操作过程繁琐,而且铁蛋白与阿霉素依然有损失。这种通过调节pH实现药物装载的过程使得蛋白回收率低而且阿霉素损失大,Kim,M等人(pH-Dependent Structures of Ferritin and Apoferritin in Solution:Disassembly and Reassembly,Biomacromolecules,2011,12(5):1629-1640)认为通过调节pH实现铁蛋白球形结构打开与恢复的过程会对铁蛋白亚基造成结构损伤,从而造成蛋白回收率低的问题。为了解决pH调节过程蛋白收率过低的问题,研究人员Minmin Liang等人(H-ferritin–nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection,PNAS,2014,111(41):14900-14905)和Lei,Y等人(Targeted tumor delivery and controlled release of neuronal drugs with ferritin nanoparticles to regulate pancreatic cancer progression,J Control Release,2016,232:131-142)进一步尝试通过8M脲变性铁蛋白,部分打开球形结构,然后通过透析复性在铁蛋白恢复球形结构的过程中实现药物的装载,最终装载比例分别能够达到33.1:1和32.5:1,铁蛋白回收率也较高,达到65%,但是整个装载药物的过程复杂繁琐,样品中存在残留脲,透析过程造成阿霉素的大量浪费,生产成本太高。由于铁蛋白球形结构打开后再恢复过程的蛋白损失过大,还有部分研究人员试图在不打开铁蛋白球形结构的基础上进行药物装载,Zhen,Z等人(RGD-Modified Apoferritin Nanoparticles for Efficient Drug Delivery to Tumors,Acs Nano,2013,7(6):4830-4837)通过铜离子介导小分子药物进入铁蛋白实现装载的方法虽然可以一定程度提升装载比例,能够达到37:1,但是蛋白仍然损失较大,只有33%的收率,而且样品中残留重金属离子存在一定的安全风险。
因此,在本领域中,需要寻找一种简便高效,既能提高铁蛋白收率,同时具有高药物装载比例的制备工艺。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种以铁蛋白为载体的抗肿瘤药物及其制备方法。
为达到此发明目的,本发明采用以下技术方案:
一方面,本发明提供一种以铁蛋白为载体的抗肿瘤药物的制备方法,所述方法包括以下步骤:
(1)制备铁蛋白;
(2)对铁蛋白和抗肿瘤药物的混合溶液在200-800MPa压力下进行高压处理6-20h;
(3)对步骤(2)处理后的产物进行分离纯化得到以铁蛋白为载体的抗肿瘤药物。
本发明利用高压处理高压作用破坏铁蛋白三轴通道中负责通道开关的Arg72-Asp122离子键以及Leu110-Leu134疏水相互作用,促使铁蛋白通道扩增,增加药物的装载比例。高压过程对铁蛋白球形结构无影响,整个过程不会造成铁蛋白的损失,从而实现以铁蛋白为载体的抗肿瘤药物的高效制备,并且通过分离纯化可以得到以铁蛋白为载体的抗肿瘤药物,提升生产效率,降低生产成本。
优选地,步骤(1)所述铁蛋白的制备方法包括热处理和Superdex 200凝胶过滤层析步骤,具体包括以下步骤:
a、将表达有铁蛋白的工程菌破碎后收集上清溶液,上清液经过热处理后进行冰浴得到粗样品;
b、将粗样品离心去除沉淀,取上清液,经层析柱纯化得到铁蛋白。
优选地,步骤a所述工程菌的构建采用PET-28a作为载体,将铁蛋白基因克隆至所述载体上构建重组质粒,而后将重组质粒转至大肠杆菌BL21进行铁蛋白原核表达。
优选地,步骤a所述热处理在温度70-80℃下进行,例如在71℃、72℃、73℃、74℃、75℃、76℃、77℃、78℃、79℃或80℃下进行。
优选地,步骤a所述热处理的时间为5-15min,例如6min、7min、8min、9min、10min、11min、12min、13min或14min。
优选地,步骤a所述冰浴的时间为10-25min,例如12min、14min、16min、18min、20min、22min或24min。
优选地,步骤b所述离心的转速为8000-15000rpm,例如9000rpm、10000rpm、11000rpm、12000rpm、13000rpm或14000rpm。
优选地,步骤b所述离心的时间为20-40min,例如22min、24min、25min、27min、29min、30min、32min、34min、36min、38min或39min。
优选地,步骤b所述离心在4℃下进行。
优选地,步骤b所述层析柱为Superdex 200凝胶过滤层析柱。
优选地,步骤(2)所述抗肿瘤药物为小分子抗肿瘤药物。
优选地,步骤(2)所述抗肿瘤药物为阿霉素(DOX)、5-氟尿嘧啶、紫杉醇或顺铂中的任意一种或至少两种的组合,优选阿霉素。
优选地,步骤(2)所述铁蛋白与抗肿瘤药物的质量比为1:1-3:1,例如1:1、1.2:1、1.5:1、1.8:1、2:1、2.2:1、2.4:1、2.6:1、2.8:1或3:1。
优选地,步骤(2)所述铁蛋白和抗肿瘤药物的混合溶液是将铁蛋白和抗肿瘤药物加入至缓冲溶液中得到的溶液。
优选地,所述缓冲溶液为醋酸缓冲溶液、磷酸盐缓冲溶液(PB)或Tris-HCl缓冲溶液中的任意一种。
优选地,所述缓冲溶液为pH值4.5-8.5的缓冲溶液;
优选地,所述缓冲溶液为pH 4.5的20mM醋酸-醋酸钠缓冲溶液、pH 5.5的20mM醋酸-醋酸钠缓冲溶液、pH 6.5的20mM磷酸盐缓冲液、pH 7.5的20mM磷酸盐缓冲液或pH 8.5的20mM Tris-HCl缓冲溶液中的任意一种,优选为pH5.5的20mM醋酸-醋酸钠缓冲溶液。
优选地,步骤(2)所述混合溶液中还包含添加剂。
优选地,所述添加剂为氯化钠、脲或精氨酸中的任意一种或至少两种的组合,优选精氨酸。
优选地,所述添加剂在混合溶液中的浓度为0.01-2mol/L,例如0.01mol/L、0.02mol/L、0.05mol/L、0.08mol/L、0.1mol/L、0.2mol/L、0.5mol/L、0.8mol/L、1mol/L、1.2mol/L、1.4mol/L、1.6mol/L或1.8mol/L。例如混合溶液中所述添加剂为0.01-1M(例如0.01M、0.02M、0.03M、0.05M、0.08M、0.1M、0.3M、0.5M、0.8M或1M,M即mol/L)氯化钠,0.01-2M(例如0.01M、0.03M、0.05M、0.08M、0.1M、0.3M、0.5M、0.8M、1M、1.2M、1.5M、1.8M或2M)脲或0.01-0.5M(例如0.01M、0.03M、0.05M、0.08M、0.1M、0.2M、0.3M、0.4M或0.5M)精氨酸,优选20mM(mM即mmol/L)精氨酸。
在反应过程中加入添加剂可以抑制铁蛋白与阿霉素混合时产生聚集沉淀,同时可以辅助压力用于铁蛋白孔道的扩增,提升装载效率。
步骤(2)所述高压处理的压力为200-800MPa,例如220MPa、240MPa、260MPa、280MPa、300MPa、320MPa、350MPa、380MPa、400MPa、450MPa、500MPa、550MPa、600MPa、650MPa、700MPa、750MPa或780MPa。
压力低于200MPa不会对铁蛋白结构产生影响,无法扩增铁蛋白通道,但是若压力过大则可能造成铁蛋白球形结构完全被破坏,蛋白发生变性,无法继续装载抗肿瘤药物。
步骤(2)所述高压处理的时间为6-20h,例如7h、8h、9h、10h、12h、14h、16h、18h或19h。高压处理时间过短,低于6h的情况下药物装载比例较低,此后随着时间的增加,装载量逐渐增加并趋于稳定,当处理时间高于19h基本可以认为装载量不会再继续增加,所以无需进一步提升作用时间。优选地,所述高压处理为在650MPa压力下作用16h。
优选地,步骤(3)所述分离纯化利用Sephedax G25脱盐层析来实现。
优选地,所述Sephedax G25脱盐的方法为:将高压处理后的产物直接上样,收集蛋白洗脱峰,采用280nm和480nm双波长检测,得到装载药物的铁蛋白和游离的抗肿瘤药物。
优选地,所述Sephedax G25脱盐过程中使用的缓冲液为pH 7.4的200mM PB缓冲液。
优选地,经Sephedax G25脱盐后得到的游离的抗肿瘤药物经过冻干、有机溶剂复溶、冷乙醚沉淀和干燥进行提纯回收。即将步骤(3)中Sephedax G25脱盐分离得到的未被装载的游离抗肿瘤药物溶液冻干处理;然后将冻干后的小分子药物粉末使用有机试剂复溶,离心去除其中的无机盐,并且优选地,选择DMF作为溶解试剂;再将复溶后的小分子药物使用冷乙醚沉淀并且离心收集,烘干储存后等待重复使用。
在本发明中,对以铁蛋白为载体的抗肿瘤药物进行载药定量分析和结构检测,所述载药定量分析包括分别根据铁蛋白与小分子药物浓度标准曲线计算步骤(3)得到的装载药物的铁蛋白的浓度以及被装载小分子药物的浓度,并且由此计算铁蛋白装载小分子药物的装载比例,公式如下:
其中,所述N表示每个铁蛋白装载小分子药物的个数;Cdrug表示被装载小分子药物的质量浓度;CHFn表示装载药物的铁蛋白的质量浓度;MHFn与Mdrug分别表示铁蛋白与小分子药物的摩尔分子量。
所述结构检测包括利用Superdex200凝胶过滤色谱、荧光光谱、圆二色光谱和透射电镜检测对产物进行结构检测。
优选地,所述Superdex 200凝胶过滤层析中使用的缓冲液为pH 7.4的200mM磷酸盐缓冲液。
通过本发明所述的分离纯化可以得到装载药物的铁蛋白,回收未被装载的抗肿瘤药物,回收的游离药物可以重复利用,提升生产效率,降低生产成本。
在本发明中所述装载药物的铁蛋白的收率是指装载了药物的铁蛋白占原料铁蛋白的百分比。
作为优选技术方案,本发明所述以铁蛋白为载体的抗肿瘤药物的制备方法包括以下步骤:
(1)制备铁蛋白:将表达有铁蛋白的工程菌破碎后收集上清液,上清液在70-80℃下进行热处理5-15min,而后进行冰浴10-25min得到粗样品,将粗样品8000-15000rpm下离心去除沉淀,取上清液,经Superdex 200凝胶过滤层析柱纯化得到铁蛋白;
(2)将质量比为1:1-3:1的铁蛋白和抗肿瘤药物加入至pH值4.5-8.5的缓冲溶液中,混合均匀,并向其中加入添加剂,得到混合溶液,将混合溶液在200-800MPa压力下进行高压处理6-20h;
(3)利用Sephedax G25脱盐层析对步骤(2)处理后的产物进行分离纯化得到以铁蛋白为载体的抗肿瘤药物。
另一方面,本发明提供了如上所述的制备方法制备得到的以铁蛋白为载体的抗肿瘤药物。
相对于现有技术,本发明具有以下有益效果:
本发明利用高压处理得到以铁蛋白为载体的抗肿瘤药物,本发明的方法既能提高药物的装载比例,使得药物装载比例可以达到10:1-22:1(药物与铁蛋白的摩尔比),不会造成蛋白损失,还能够回收游离的未被装载的抗肿瘤药物,提升生产效率,降低生产成本,适用于大规模工业生产。
附图说明
图1为本发明以铁蛋白为载体的抗肿瘤药物的制备流程示意图。
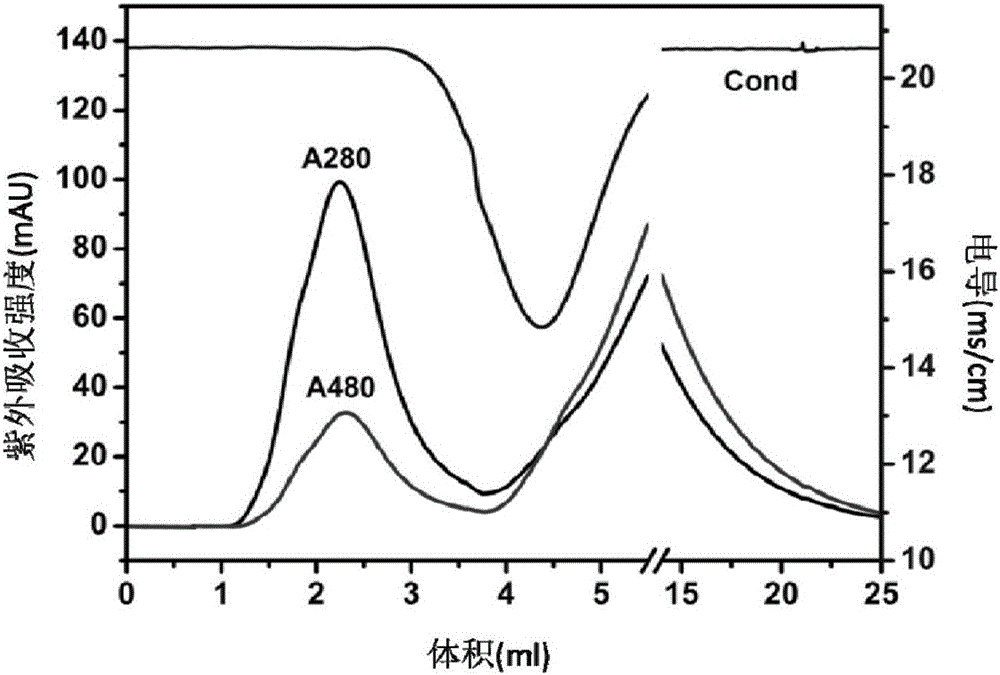
图2为本发明实施例1中进行Sephedax G25脱盐的结果图,其中Cond表示溶液电导值;
图3为本发明实施例1中制备的以铁蛋白为载体的抗肿瘤药物的Superdex200凝胶过滤层析图,其中Cond表示溶液电导值;
图4为本发明实施例1制备的以铁蛋白为载体的抗肿瘤药物的荧光光谱图;
图5为本发明实施例1制备的以铁蛋白为载体的抗肿瘤药物的圆二色光谱图;
图6A为铁蛋白原样的透射电镜图,其中标尺为100nm;
图6B为本发明实施例1制备的以铁蛋白为载体的抗肿瘤药物的透射电镜图,其中标尺为100nm;
图7为本发明实施例1在使用不同添加剂下的铁蛋白的药物装载比例和载药铁蛋白收率结果图;
图8为本发明实施例2中对铁蛋白和抗肿瘤药物混合溶液进行不同处理时铁蛋白的药物装载比例和载药铁蛋白收率结果图。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
实施例1
在本实施例中,通过以下方法制备以铁蛋白为载体的抗肿瘤药物(总体流程示意图如图1所示),具体包括以下步骤:
(1)制备铁蛋白:将表达有铁蛋白的工程菌(工程菌的构建采用PET-28a作为载体,将铁蛋白基因克隆至载体上构建重组质粒,而后将重组质粒转至大肠杆菌BL21进行铁蛋白原核表达)破碎后收集上清液,上清液在75℃下进行热处理10min,而后进行冰浴15min得到粗样品,将粗样品12000rpm下离心30min去除沉淀,取上清液,经一步Superdex 200凝胶过滤层析柱纯化得到铁蛋白;
(2)将质量比为1.5:1的铁蛋白和抗肿瘤药物DOX加入至pH值5.5的20mM醋酸-醋酸钠缓冲溶液中,混合均匀,分别向其中加入不同添加剂(20mM NaCl、30mM NaCl、300mM脲(Urea)、400mM脲、20mM精氨酸(Arg)或30mM精氨酸,所述浓度为添加剂在所得到的混合溶液中的摩尔浓度),得到混合溶液,将混合溶液在450MPa压力下进行高压处理16h;
(3)利用Sephedax G25脱盐,所用缓冲溶液为200mM PB,pH 7.4,将高压处理后的产物直接上样,收集蛋白洗脱峰,采用280nm和480nm双波长检测,收集铁蛋白洗脱峰,并且将未被装载的游离小分子药物分离收集,将脱盐处理收集的蛋白洗脱样品直接上样,缓冲溶液为200mM PB,pH 7.4,采用280nm和480nm双波长检测,得到以铁蛋白为载体的抗肿瘤药物。
图2是Sephedax G25脱盐图,其中Cond表示溶液电导值,图2表明Sephedax G25脱盐方法可以将装载药物的铁蛋白与未被装载的游离小分子药物完全分离。
分别利用Superdex200凝胶过滤色谱,荧光光谱和圆二色光谱分析装载药物后铁蛋白的结构特征,以比较铁蛋白原样以及本制备工艺获得样品的分子量大小,三级结构与二级结构。图3为本实施例制备的以铁蛋白为载体的抗肿瘤药物的Superdex凝胶过滤色谱图,其结果表明装载药物后铁蛋白的分子量与原样一致,而且药物被装载在铁蛋白内部;图4为本实施例制备的以铁蛋白为载体的抗肿瘤药物的荧光光谱图(其中HFn代表铁蛋白,HFn+DOX HP代表装载药物后铁蛋白),其结果表明装载药物后铁蛋白的三级结构与铁蛋白原样一致;图5为本实施例制备的以铁蛋白为载体的抗肿瘤药物的圆二色光谱图(其中HFn代表铁蛋白,HFn+DOX HP代表装载药物后铁蛋白),其结果表明装载药物后铁蛋白的二级结构与铁蛋白原样一致;以上两点说明本发明得到的装载药物的铁蛋白结构正确。
透射电镜分析检测装载药物后铁蛋白的球形结构,图6A为铁蛋白原样透射电镜图,图6B为装载药物的铁蛋白的透射电镜图,由图6A和图6B的比较可以得知,本发明制备得到的装载药物的铁蛋白维持完整球形结构,与铁蛋白原样一致,粒径大小在12nm,符合理论值,说明本发明得到的装载药物后的铁蛋白结构正确。
根据铁蛋白与小分子药物浓度标准曲线计算步骤(3)得到的装载药物的铁蛋白的浓度以及被装载小分子药物的浓度,并且由此计算铁蛋白装载小分子药物的装载比例,公式如下:
其中,所述N表示每个铁蛋白装载小分子药物的个数;Cdrug表示被装载小分子药物的质量浓度;CHFn表示装载药物的铁蛋白的质量浓度;MHFn与Mdrug分别表示铁蛋白与小分子药物的摩尔分子量。
在加入不同添加的情况下,装载药物的铁蛋白收率以及药物装载比例见图7,由图7可以看出,20mm Arg作为添加剂时,450MPa作用16h后获得最高装载比例,达到14.7:1,并且具有高的载药铁蛋白收率,接近100%。
实施例2
在本实施例中,通过以下方法制备以铁蛋白为载体的抗肿瘤药物(总体流程示意图如图1所示),具体包括以下步骤:
(1)制备铁蛋白:将表达有铁蛋白的工程菌(工程菌的构建同实施例1)破碎后收集上清液,上清液在75℃下进行热处理10min,而后进行冰浴15min得到粗样品,将粗样品12000rpm下离心30min去除沉淀,取上清液,经一步Superdex 200凝胶过滤层析柱纯化得到铁蛋白;
(2)将质量比为1.5:1的铁蛋白和抗肿瘤药物DOX加入至pH值5.5的20mM醋酸-醋酸钠缓冲溶液中,混合均匀,向其中加入添加剂精氨酸,得到混合溶液,精氨酸在混合溶液中的摩尔浓度为20mM,将混合溶液分别在250、350、450、500、600和650MPa压力下进行高压处理16h,以常压下常温放置铁蛋白与DOX混合溶液16h的处理方式作为对照1(以Atmo RT表示),以常压下先调节铁蛋白溶液pH到2,然后将其与DOX混合溶液调回pH7的处理方式作为对照2(以pH2-pH7表示);
(3)利用Sephedax G25脱盐层析对步骤(2)处理后的产物进行分离纯化得到以铁蛋白为载体的抗肿瘤药物(具体处理条件和方法与实施例1相同)。
根据铁蛋白与小分子药物浓度标准曲线计算步骤(3)得到的装载药物的铁蛋白的浓度以及被装载小分子药物的浓度,并且由此计算铁蛋白装载小分子药物的装载比例,公式如下:
其中,所述N表示每个铁蛋白装载小分子药物的个数;Cdrug表示被装载小分子药物的质量浓度;CHFn表示装载药物的铁蛋白的质量浓度;MHFn与Mdrug分别表示铁蛋白与小分子药物的摩尔分子量。
在不同处理条件下得到的以铁蛋白为载体的抗肿瘤药物的药物装载比例以及载药铁蛋白收率结果如图8所示。
从图8可以看出,使用压力处理的样品最后的装载药物的铁蛋白收率接近100%,远高于常规使用pH调节的方法。而且随着作用压力的增加,药物装载比例逐渐增加,当压力为500MPa,作用16h后的药物装载比例为16.7:1,稍低于常规使用pH调节方法的结果,而当压力为650MPa,作用16h后的药物装载比例与pH调节方法的结果相似,为22:1。
实施例3
在本实施例中,通过以下方法制备以铁蛋白为载体的抗肿瘤药物(总体流程示意图如图1所示),具体包括以下步骤:
(1)制备铁蛋白:将表达有铁蛋白的工程菌(工程菌的构建同实施例1)破碎后收集上清液,上清液在70℃下进行热处理15min,而后进行冰浴10min得到粗样品,将粗样品8000rpm下离心40min去除沉淀,取上清液,经一步Superdex 200凝胶过滤层析柱纯化得到铁蛋白;
(2)将质量比为1:1的铁蛋白和抗肿瘤药物DOX加入至pH 4.5的20mM醋酸-醋酸钠缓冲溶液中,混合均匀,向其中加入添加剂精氨酸,得到混合溶液,精氨酸在混合溶液中的摩尔浓度为20mM,将混合溶液在500MPa压力下进行高压处理20h;
(3)利用Sephedax G25脱盐层析对步骤(2)处理后的产物进行分离纯化得到以铁蛋白为载体的抗肿瘤药物(具体处理条件和方法与实施例1相同)。
经过Superdex200凝胶过滤色谱分析可以得出本实例制备得到以铁蛋白为载体的抗肿瘤药物分子量正确,而且药物被装载在铁蛋白内部。经过荧光光谱和圆二色光谱分析可以得出本实施例制备得到的以铁蛋白为载体的抗肿瘤药物中铁蛋白的三级结构和二级结构与铁蛋白原样的三级结构和二级结构一致,证明到的装载药物的铁蛋白结构正确。并且通过透射电镜分析得出,制备得到的装载药物的铁蛋白维持完整球形结构,与铁蛋白原样一致,粒径大小约12nm,符合理论值,说明得到的装载药物后的铁蛋白结构正确。
本实施例获得的以铁蛋白为载体的抗肿瘤药物的药物装载比例为20:1,装载药物的铁蛋白的收率接近100%。
实施例4
在本实施例中,通过以下方法制备以铁蛋白为载体的抗肿瘤药物(总体流程示意图如图1所示),具体包括以下步骤:
(1)制备铁蛋白:将表达有铁蛋白的工程菌(工程菌的构建同实施例1)破碎后收集上清液,上清液在80℃下进行热处理5min,而后进行冰浴25min得到粗样品,将粗样品15000rpm下离心20min去除沉淀,取上清液,经一步Superdex 200凝胶过滤层析柱纯化得到铁蛋白;
(2)将质量比为3:1的铁蛋白和抗肿瘤药物紫杉醇加入至pH 8.5的20mM Tris-HCl缓冲溶液中,混合均匀,向其中加入添加剂精氨酸,得到混合溶液,精氨酸在混合溶液中的摩尔浓度为20mM,将混合溶液在800MPa压力下进行高压处理10h;
(3)利用Sephedax G25脱盐层析对步骤(2)处理后的产物进行分离纯化得到以铁蛋白为载体的抗肿瘤药物(具体处理条件和方法与实施例1相同)。
经过Superdex200凝胶过滤色谱分析可以得出本实例制备得到以铁蛋白为载体的抗肿瘤药物分子量正确,而且药物被装载在铁蛋白内部。经过荧光光谱和圆二色光谱分析可以得出本实施例制备得到的以铁蛋白为载体的抗肿瘤药物中铁蛋白的三级结构和二级结构与铁蛋白原样的三级结构和二级结构一致,证明到的装载药物的铁蛋白结构正确。并且通过透射电镜分析得出,制备得到的装载药物的铁蛋白维持完整球形结构,与铁蛋白原样一致,粒径大小约12nm,符合理论值,说明得到的装载药物后的铁蛋白结构正确。
本实施例获得的以铁蛋白为载体的抗肿瘤药物的药物装载比例为16.2:1,装载药物的铁蛋白的收率接近100%。
实施例5
本实施例与实施例4不同之处仅在于,步骤(2)中不加入添加剂,其余制备方法以及条件的选择均与实施例4相同。本实施例获得的以铁蛋白为载体的抗肿瘤药物中铁蛋白的结构也能够与铁蛋白原样保持一致,其获得的以铁蛋白为载体的抗肿瘤药物的药物装载比例为10:1,装载药物的铁蛋白的收率接近100%。
对比例1
与实施例3不同之处仅在于,步骤(2)中高压处理的压力为180MPa,其余制备方法以及条件的选择均与实施例3相同。本实施例获得的以铁蛋白为载体的抗肿瘤药物中铁蛋白的结构也能够与铁蛋白原样保持一致,其获得的以铁蛋白为载体的抗肿瘤药物的药物装载比例为7:1。
对比例2
与实施例4不同之处仅在于,步骤(2)中高压处理的压力为900MPa,其余制备方法以及条件的选择均与实施例4相同。本实施例中铁蛋白的结构遭到破坏,装载药物的铁蛋白的收率仅为45%。
对比例3
与实施例3不同之处仅在于,步骤(2)中高压处理的时间为5h,其余制备方法以及条件的选择均与实施例3相同。本实施例获得的以铁蛋白为载体的抗肿瘤药物中铁蛋白的结构也能够与铁蛋白原样保持一致,其获得的以铁蛋白为载体的抗肿瘤药物的药物装载比例为8:1。
申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!