含有佐剂的合成纳米载体的剂量选择的制作方法
相关申请
本申请根据35U.S.C.§119要求2010年5月26日提交的美国临时申请61/348713、2010年5月26日提交的61/348717、2010年5月26日提交的61/348728以及2010年6月25日提交的61/358635的权益,各自的全部内容通过引用结合在此。
背景技术:
佐剂是大多数目前使用的疫苗接种方案的重要组分。它们也很可能将结合到将来的疫苗产品中。目前正在开发许多新颖的佐剂,并且已经证明许多这些佐剂在研究和临床环境中增进了疫苗的免疫应答。然而,对于免疫应答增进有益的佐剂剂量在许多重要的患者组中可能诱导副作用。事实上,佐剂的这两种能力是内在联系的,因为它本身是广泛的免疫刺激,这种免疫刺激提供了针对增进疫苗接种连同其副作用(毒性)的刺激。已知这两种过程都是通过炎性细胞因子的释放驱动的。因此,降低佐剂给予的副作用和/或确切地说增进某些免疫应答的方法将具有重大的临床价值。
因此,所需要的是有效提供一种或多种所希望的免疫应答的组合物和方法,这些组合物和方法可以降低与疫苗中的佐剂使用相关的不利事件的频率。
技术实现要素:
在一个方面,提供了一种方法,该方法包括提供一个剂量的佐剂以及一个剂量的抗原,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,并且通过将该剂量的佐剂以及该剂量的抗原给予一位受试者产生一个针对该抗原的抗体滴度,其中该剂量的佐剂少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂以及该剂量的抗原给予该受试者所产生的抗体滴度相似的抗体滴度。在一个实施方案中,该方法进一步包括将该剂量的佐剂选择为少于一个单独剂量的佐剂,该单独剂量的佐剂产生导致与通过将该剂量的佐剂以及该剂量的抗原给予该受试者所产生的抗体滴度相似的抗体滴度。优选地,同一实体进行这些方法的各步骤(即,同一实体进行提供、产生和/或选择步骤)。在另一个方面,提供了一种组合物,该组合物包含的该剂量的佐剂少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂以及该剂量的抗原给予该受试者所产生的抗体滴度相似的抗体滴度。
在另一个方面,提供了一种方法,该方法包括提供一个剂量的佐剂,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,并且通过将该剂量的佐剂给予一位受试者产生全身性细胞因子释放,其中该剂量的佐剂多于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予该受试者所产生的全身性细胞因子释放相似的全身性细胞因子释放。在一个实施方案中,该方法进一步包括将该剂量的佐剂选择为多于一个单独剂量的佐剂,该单独剂量的佐剂产生与通过将该剂量的佐剂给予该受试者所产生的全身性细胞因子释放相似的全身性细胞因子释放。优选地,同一实体进行这些方法的各步骤(即,同一实体进行提供、产生和/或选择步骤)。在另一个方面,提供了一种组合物,该组合物包含的该剂量的佐剂多于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予该受试者所产生的全身性细胞因子释放相似的全身性细胞因子释放。
在一个实施方案中,在此提供的任何方法和组合物的一种或多种佐剂包含针对Toll样受体3、4、5、7、8或9或其组合的一种激动剂。在另一个实施方案中,该佐剂包括一种针对Toll样受体3的激动剂、一种针对Toll样受体7和8的激动剂、或一种针对Toll样受体9的激动剂。在又另一个实施方案中,该佐剂包括R848、免疫刺激DNA或免疫刺激RNA。在一个进一步的实施方案中,在此提供的任何方法和组合物的该剂量的佐剂包括两种或更多种类型的佐剂。在一个实施方案中,一部分的该剂量的佐剂没有结合到合成纳米载体上。
在此提供的任何方法和组合物的另一个实施方案中,将一种以上类型的抗原给予受试者。在一个实施方案中,至少一部分的该剂量的一种或多种抗原结合到合成纳米载体上。在另一个实施方案中,至少一部分的该剂量的一种或多种抗原没有结合到合成纳米载体上。在又另一个实施方案中,至少一部分的该剂量的一种或多种抗原与合成纳米载体联合给予。在再另一个实施方案中,至少一部分的该剂量的一种或多种抗原不与这些合成纳米载体联合给予。在一个实施方案中,该一种或多种抗原包括一种B细胞抗原和/或一种T细胞抗原。在另一个实施方案中,该T细胞抗原包括一种通用T细胞抗原(universal T cell antigen)或T辅助细胞抗原。在一个实施方案中,该一种或多种抗原包括一种B细胞抗原或一种T细胞抗原以及一种通用T细胞抗原或T辅助细胞抗原。在一个实施方案中,该T辅助细胞抗原包括从卵清蛋白获得或衍生的一种肽。在另一个实施方案中,从该从卵清蛋白获得或衍生的肽包括在SEQ ID NO:1中提出的一个序列。在此提供的任何方法和组合物的再另一个实施方案中,该通用T细胞抗原或T辅助细胞抗原通过封装(encapsulation)而结合到该合成纳米载体上。在此提供的任何方法和组合物的又一个实施方案中,该B细胞抗原包括尼古丁。在一个进一步的实施方案中,这些合成纳米载体包括尼古丁以及该一种通用T细胞抗原或T辅助细胞抗原。在又另一个实施方案中,该尼古丁和/或通用T细胞抗原或T辅助细胞抗原结合到合成纳米载体上。在一个实施方案中,该通用T细胞抗原或T辅助细胞抗原通过封装进行结合。
在此提供的任何方法和组合物的另一个实施方案中,该剂量的佐剂包括R848并且该剂量的抗原包括尼古丁以及一种通用T细胞抗原或T辅助细胞抗原,其中该尼古丁和通用T细胞抗原或T辅助细胞抗原也结合到合成纳米载体上,并且其中这些合成纳米载体包括一种或多种聚合物。
在此提供的任何方法和组合物的另一个实施方案中,这些合成纳米载体包括脂质纳米颗粒、聚合物纳米颗粒、金属纳米颗粒、基于表面活性剂的乳液、树枝状聚合物、巴克球(buckyball)、纳米线(nanowire)、病毒样颗粒、肽或蛋白质颗粒、以及包含以下项的组合的纳米颗粒:球状纳米颗粒、立方形纳米颗粒、锥形纳米颗粒、长方形纳米颗粒、圆柱形纳米颗粒或环形纳米颗粒(toroidal nanoparticle)。在一个实施方案中,这些合成纳米载体可以包括一种或多种聚合物。在另一个实施方案中,该一种或多种聚合物包括一种聚酯。在又一个实施方案中,该一种或多种聚合物包括或进一步包括一种结合到亲水聚合物上的聚酯。在再另一个实施方案中,该聚酯包括一种聚(乳酸)、聚(乙醇酸)、聚(乳酸-乙醇酸)共聚物或聚己内酯。在一个实施方案中,该亲水聚合物包括一种聚醚。在另一个实施方案中,该聚醚包括聚乙二醇。
在此提供的任何方法和组合物的一个实施方案中,该至少一个剂型包括该剂量的佐剂。在另一个实施方案中,一种疫苗包括一种或多种剂型。在再另一个实施方案中,其中一个以上的剂型包括该剂量的佐剂,并且该一个以上的剂型是联合给予的。
在所提供的任何方法的一个实施方案中,通过包括以下项的一种途径给予:皮下、肌内、真皮内、口服、鼻内、经粘膜、直肠;眼、透皮(transdermal)或经皮(transcutaneous)给予或其组合。
在所提供的任何方法的另一个实施方案中,该受试者患有癌症、感染性疾病、非自身免疫性代谢性疾病、退行性疾病、成瘾、特应性疾病(atopic condition)、哮喘;慢性阻塞性肺病(COPD)或慢性感染。
在另一个方面,提供了如相对于提供的任何方法或组合物所定义的一个剂量的佐剂与一个剂量的抗原或者一个剂量的佐剂用于治疗或预防的用途。
在又另一个方面,提供了如相对于提供的任何方法或组合物所定义的一个剂量的佐剂与一个剂量的抗原或者一个剂量的佐剂用于所提供的任何方法中的用途。
在再另一个方面,提供了如相对于提供的任何方法或组合物所定义的一个剂量的佐剂与一个剂量的抗原或一个剂量的佐剂用于治疗癌症、感染性疾病、非自身免疫性代谢性疾病、退行性疾病、成瘾、特应性疾病、哮喘;慢性阻塞性肺病(COPD)或慢性感染的用途。在一个实施方案中,该方法包括通过包括以下项的一种途径给予该一个或多个剂量:皮下、肌内、真皮内、口服、鼻内、经粘膜、直肠;眼、透皮或经皮给予或其组合。
在一个另外的方面,提供了如相对于提供的任何方法或组合物所定义的一个剂量的佐剂与一个剂量的抗原或者一个剂量的佐剂用于制造用于提供的任何方法中的药剂的用途。
附图说明
图1显示了在用纳米载体(NC)接种之后小鼠中的全身性细胞因子产生。图1A、1B和1C分别显示了在实验组中TNF-α、IL-6、和IL-12的产生。对来自三只小鼠的组的血清进行汇集并且通过ELISA进行分析。
图2显示了在NC接种之后小鼠中的全身性IFN-γ产生。对来自三只小鼠的组的血清进行汇集并且通过ELISA进行分析。
图3显示了在用游离的或NC结合的TLR激动剂接种之后的全身性IL-12产生。对来自两只小鼠的组的血清进行汇集并且通过ELISA进行分析。
图4显示了通过游离的或NC结合的TLR激动剂的免疫细胞因子的局部诱导。每个点代表来自单独的小鼠的两个淋巴结(LN)的平均值。
图5显示了用游离的和NC结合的TLR7/8激动剂R848接种之后在腘淋巴结中的细胞群体动力学。将三只完整的小鼠在不同天处死并且将它们的腘LN的平均细胞计数指定为“第0天”,表示所有其他数目与之相比为“1”。来自R848-或NC接种的组的每个条代表取自独立的动物的两个淋巴结的平均值。
图6显示了用含有表面尼古丁和T辅助细胞肽OP-II的NC(有或没有R848)免疫的小鼠中的抗尼古丁抗体的滴度。
图7显示了在NC-CpG接种以及CpG接种的动物的血清中诱导的TNF-α和IL-6。
图8显示了在NC-CpG接种以及CpG接种的动物的血清中的IFN-γ和IL-12的诱导。
具体实施方式
在详细地描述本发明之前,应当理解的是,本发明不受特殊例证的材料或工艺参数的限制,因为像这样的材料和工艺参数当然可以变化。还应当理解的是,在此使用的术语仅仅是出于描述本发明的特殊实施方案的目的,而不旨在限制使用替代性术语来描述本发明。
在此引用的所有出版物、专利以及专利申请,无论上文还是下文,都出于所有目的特此通过引用以其全部内容进行结合。
除非发明内容另外明确指出,如本说明书和所附的权利要求书中所使用的单数形式“一个/一种”“(a/an)”和“该”(“the”)包括复数指示物。例如,提及“一种聚合物”包括两种或更多种这样的分子的混合物,提及“一种溶剂”包括两种或更多种这样的溶剂的混合物,提及“一种粘合剂”包括两种或更多种这样的材料的混合物,等等。
引言
诸位发明人已经出乎意料并且令人惊讶地发现上文指出的问题和限制可以通过实践在此披露的发明来克服。在此描述的发现涉及结合到纳米载体上的佐剂,并且基于这些发现,提供了针对通过选择特定剂量的结合到纳米载体上的佐剂产生所希望的免疫应答的方法和有关的组合物。在一些实施方案中,并且取决于该所希望的一种或多种免疫应答,这些剂量低于在相似情况下没有结合到纳米载体上的佐剂的剂量。在其他实施方案中,这些剂量大于没有结合到纳米载体上的佐剂的剂量。
在一个方面,诸位发明人已经出人意料地发现了有可能提供以下方法和有关的组合物,该方法包括给予一个剂量的佐剂,当结合到合成纳米载体上时,该剂量的佐剂少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予一位受试者所产生的免疫应答(例如抗体滴度)相似的免疫应答。由于将一个剂量的佐剂的至少一部分结合到一种合成纳米载体上的更强的佐剂效应,可以使用更少的佐剂。该剂量的佐剂因此可以是亚治疗的或毒性降低的剂量,其中该剂量的佐剂的至少一部分结合到合成纳米载体上。在另一个方面,本发明涉及一种组合物,该组合物包含一个剂型,该剂型包含亚治疗的或毒性降低的剂量的佐剂,以及一种药学上可接受的赋形剂,其中该剂量的佐剂的至少一部分结合到合成纳米载体上。在再另一个方面,本发明涉及一种方法,该方法包括将一个亚治疗的或毒性降低的剂量的佐剂给予一位受试者;其中该剂量的佐剂的至少一部分结合到合成纳米载体上。
当与混合佐剂比较时,观察到佐剂结合到纳米载体上将提供更强的佐剂效应并且导致实质上更高的抗体应答。另外,还观察到结合的佐剂导致更强的抗体应答,甚至是在使用显著更大量的游离佐剂(高达大于6倍)时。参见实例11。该结果与Diwan等人《当代药物传输》(Current Drug Delivery),2004,1,405-412中提供的传授内容预期的相反,其中发现了(特别是在更低剂量的佐剂时)当佐剂以溶液给予而不是用颗粒递送时抗体产生是更高的。然而,在此描述了一个相反的结果。
因此在另一个方面,诸位发明人已经出人意料地发现了有可能提供一种方法和有关的组合物,该方法包括提供一个剂量的佐剂以及一个剂量的抗原,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,并且通过将该剂量的佐剂以及该剂量的抗原给予一位受试者产生一个针对该抗原的抗体滴度,其中该剂量的佐剂少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂以及该剂量的抗原给予该受试者所产生的抗体滴度相似的抗体滴度。在多个实施方案中,该方法进一步包括将该剂量的佐剂选择为少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂以及该剂量的抗原给予该受试者(例如人)所产生的抗体滴度相似的抗体滴度。优选地,在此提供的方法的步骤通过同一实体进行。在再另一个方面,本发明涉及一种组合物,该组合物包括一个剂型,该剂型包含一个剂量的佐剂和一个剂量的抗原以及一种药学上可接受的赋形剂,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,并且其中该剂量的佐剂少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂以及该剂量的抗原给予一位受试者所产生的抗体滴度相似的抗体滴度。
还证明了佐剂结合到纳米载体上可以导致比使用游离佐剂更低的即时全身性细胞因子诱导。因此,与单独佐剂相比,佐剂结合到纳米载体上可以允许使用更高剂量的佐剂。因此在另一个方面,本发明提供了一种方法,该方法包括提供了一个剂量的佐剂,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,并且通过将该剂量的佐剂给予一位受试者产生一种免疫应答(例如全身性细胞因子释放),其中该剂量的佐剂多于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予一位受试者(例如人)所产生的免疫应答相似的免疫应答。在多个实施方案中,该方法进一步包括将该剂量的佐剂选择为多于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予该受试者所产生的免疫应答相似的一种免疫应答(例如全身性细胞因子释放。)优选地,在此提供的方法的步骤通过同一实体进行。在又另一个方面,本发明涉及一种组合物,该组合物包括一个剂型,该剂型包含一个剂量的佐剂以及一种药学上可接受的赋形剂,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,并且其中该剂量的佐剂多于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予该受试者所产生的免疫应答相似的免疫应答(例如全身性细胞因子释放)。
总体来说,使用在此提供的这些发现现在有可能选择一个佐剂剂量,取决于所希望的对于使用结合到纳米载体上的佐剂是特异性的免疫结果。该剂量可以是一个更低的剂量(在与单独佐剂相比时),该更低的剂量产生了多个抗体滴度或避免了不需要的全身性活性(同时大大增强了局部免疫刺激作用)。与单独佐剂相比较,该剂量可以是一个产生相似的全身性细胞因子释放曲线的更高的剂量。
在一个另外的方面,给予在此提供的组合物可能对于其中调节免疫应答是所希望的任何受试者都是有益的。在一些实施方案中,该受试者是其中炎症应答是所希望的受试者。在其他实施方案中,这些受试者是其中Th1免疫应答是所希望的受试者。在一些实施方案中,这些受试者患有癌症或具有患癌症的风险。在其他实施方案中,这些受试者患有感染或感染性疾病或具有患感染或感染性疾病的风险。仍然在其他实施方案中,该受试者患有特异性疾病、哮喘、慢性阻塞性肺病(COPD)或慢性感染或具有患这些疾病的风险。还提供了将这些组合物给予这样的受试者的方法。
实例1-13展示了本发明的不同实施方案,包括本发明的不同配制品或方面。在此还提供了在这些实例中描述的组合物和方法。
现在将在以下更详细地描述本发明。
定义
“佐剂”表示并不构成特异性抗原,但是提高对伴随给予的抗原的免疫应答的强度和寿命的试剂。这样的佐剂可以包括但不限于:模式识别受体(例如Toll样受体、RIG-1和NOD样受体(NLR))的刺激剂、矿物盐(例如明矾,与肠细菌(例如大肠杆菌、明尼苏达沙门菌、鼠伤寒沙门菌、或弗氏志贺菌)的单磷酰脂质(monphosphoryl lipid,MPL)A结合的明矾或分别与(AS04)、以上提到的细菌MPL A特异性结合的明矾)、皂苷(如Qs-21、Quil-A、ISCOMs、ISCOMATRIXTM)、乳液(如MF59TM、ISA 51和ISA 720)、AS02(QS21+角鲨烯+)AS15、脂质体和脂质体配制品(如AS01)、合成的或特别制备的微颗粒和微载体(如淋病奈瑟球菌(N.gonorrheae)、沙眼衣原体和其他微生物的源于细菌的外膜泡(OMV))、或壳聚糖颗粒、储存形成剂(depot-forming agent)(如嵌段共聚物)、特异性修饰或制备的肽(例如胞壁酰二肽)、氨基烷基氨基葡糖苷4-磷酸酯(如RC529)、或蛋白质(如细菌类毒素或毒素片段)。
在多个实施方案中,佐剂包括针对模式识别受体(PRR)(包括但不限于Toll样受体(TLR),特别是TLR 2、3、4、5、7、8、9和/或其组合)的激动剂。在其他实施方案中,佐剂包括针对Toll样受体3的激动剂、针对Toll样受体7和8的激动剂、或针对Toll样受体9的激动剂;优选地这些列举的佐剂包括咪唑并喹啉,如R848;腺嘌呤衍生物(如在美国专利6,329,381(Sumitomo Pharmaceutical Company(住友制药株式会社)中披露的那些);授予比戛迪克(Biggadike)等人的美国专利公开物专利申请2010/0075995或授予坎坡斯(Campos)等人的WO 2010/018132;免疫刺激DNA;或免疫刺激RNA。在特定的实施方案中,合成纳米载体作为佐剂结合这样的化合物,这些化合物是针对toll样受体(TLR)7和8的激动剂(“TLR 7/8激动剂”)。其中有用的是Tomai等人的美国专利6,696,076中披露的TLR 7/8激动剂化合物,包括但不限于咪唑并喹啉胺、咪唑并吡啶胺、6,7-稠合环烷基咪唑并吡啶胺、以及1,2-桥接咪唑并喹啉胺。优选的佐剂包括咪喹莫特和瑞喹莫德(也称为R848)。在特定的实施方案中,佐剂可以是DC表面分子CD40的激动剂。在某些实施方案中,为了刺激免疫力而不是耐受,合成纳米载体结合了促进DC成熟(对于启动初始T细胞而言是需要的)以及细胞因子(如I型干扰素,它促进抗体免疫应答)的产生的佐剂。在多个实施方案中,佐剂还可以包括免疫刺激RNA分子(如但不限于dsRNA、或聚I:聚C12U(以获得,聚I:C与聚I:聚C12U两者都称为TLR3刺激剂)、和/或在海尔(F.Heil)等人,“经由Toll样受体7和8的单链RNA的种属特异性识别(Species-Specific Recognition of Single-Stranded RNA via Toll-like Receptor 7and 8)”《科学》(Science)303(5663),1526-1529(2004);福尔默(J.Vollmer)等人,“通过化学修饰的核糖核苷和寡核糖核苷酸进行的免疫调节(Immune modulation by chemically modified ribonucleosides and oligoribonucleotides)”WO 2008033432 A2;福尔斯巴赫(A.Forsbach)等人,“含有特异性序列基序并且靶向Toll样受体8通路的免疫刺激寡核糖核苷酸(Immunostimulatory oligoribonucleotides containing specific sequence motif(s)and targeting the Toll-like receptor 8 pathway”WO 2007062107 A2;乌尔曼(E.Uhlmann)等人,“具有增强的免疫疫刺激性活性的修饰的寡核糖核苷酸类似物(Modified oligoribonucleotide analogs with enhanced immunostimulatory activity)”美国专利申请公开US 2006241076;林慕德(G.Lipford)等人,“免疫刺激性病毒性RNA寡核糖核苷酸和其用于治疗癌症和感染的用途(Immunostimulatory viral RNA oligonucleotides and use for treating cancer and infections)”WO 2005097993 A2;G.Lipford(林慕德)等人,“免疫刺激的含G,U的寡核糖核苷酸、组合物以及筛选方法(Immunostimulatory G,U-containing oligoribonucleotides,compositions,and screening methods)”WO 2003086280 A2中披露的那些。在一些实施方案中,佐剂可以是TLR-4激动剂(例如细菌脂多糖(LPS)、VSV-G、和/或HMGB-1)。在一些实施方案中,佐剂可以包括TLR-5激动剂(如鞭毛蛋白、或它的一部分或衍生物),包括但不限于在美国专利6,130,082、6,585,980、和7,192,725中披露的那些。在特定的实施方案中,合成纳米载体结合了针对Toll样受体(TLR)-9的配体,如包含CpG的免疫刺激DNA分子,它诱导I型干扰素分泌,并且刺激T细胞和B细胞活化,导致增加的抗体产生和细胞毒性T细胞应答(Krieg(克雷格)等人,细菌DNA中的CpG基序触发直接的B细胞活化(CpG motifs in bacterial DNA trigger direct B cell activation),《自然》(Nature)1995.374:546-549;朱(Chu)等人,CpG寡核苷酸充当佐剂来激活T辅助细胞1(Th1)免疫(CpG oligodeoxynucleotides act as adjuvants that switch on T helper 1(Th1)immunity),《实验医学杂志》(J.Exp.Med.)1997.186:1623-1631;林慕德(Lipford)等人,含有CpG的合成的寡核苷酸促进B和细胞毒性T细胞对蛋白抗原的应答(CpG-containing synthetic oligonucleotides promote B and cytotoxic T cell responses to protein antigen):一类新的疫苗佐剂,《欧洲免疫学杂志》(Eur.J.Immunol.)1997.27:2340-2344;罗曼(Roman)等人,免疫刺激DNA序列作为T辅助细胞1佐剂起作用(Immunostimulatory DNA sequences function as T helper-1-promoting adjuvants)《自然医学》(Nat.Med.)1997.3:849-854;戴维斯(Davis)等人,CpG DNA在用重组乙型肝炎表面抗原免疫的小鼠中是一种有效的特异性免疫增强剂(CpG DNA is a potent enhancer of specific immunity in mice immunized with recombinant hepatitis B surface antigen)《免疫学杂志》(J.Immunol.)1998.160:870-876;林慕德(Lipford)等人,作为免疫细胞激活剂的细菌DNA(Bacterial DNA as immune cell activator)《微生物学进展》(Trends Microbiol)1998.6:496-500;克雷格(Krieg)等人的美国专利6,207,646;塔克(Tuck)等人的美国专利7,223,398;凡奈斯特(Van Nest)等人的美国专利7,250,403;或克雷格(Krieg)等人的美国专利7,566,703。。
在一些实施方案中,佐剂可以是从坏死细胞释放的促炎刺激物(例如尿酸盐晶体)。在一些实施方案中,佐剂可以是活化的补体级联成分(例如CD21、CD35,等)。在一些实施方案中,佐剂可以是活化的免疫复合物成分。这些佐剂还包括补体受体激动剂(如结合CD21或CD35的分子)。在一些实施方案中,补体受体激动剂诱导了合成纳米载体的内源补体调理作用。在一些实施方案中,佐剂是细胞因子,它们是由细胞释放的小的蛋白质或生物因子(在5kD-20kD的范围内),并且对细胞-细胞相互作用、通讯以及其他细胞的行为具有特殊作用。在一些实施方案中,该细胞因子受体激动剂是小分子、抗体、融合蛋白、或适体。
在多个实施方案中,至少一部分剂量的佐剂结合到合成纳米载体上,优选地,全部剂量的佐剂结合到合成纳米载体上。在多个实施方案中,该剂量的佐剂包括两种或更多种类型的佐剂。例如,而不是限制,可以结合作用于不同受体(例如不同的TLR受体)的佐剂。作为一个实例,在一个实施方案中,TLR 7/8激动剂可以与TLR 9激动剂结合。在另一个实施方案中,TLR 7/8激动剂可以与TLR 4激动剂结合。在再另一个实施方案中,TLR 9激动剂可以与TLR 3激动剂结合。
“给予”或“给药”表示以一种药理学上有用的方式将一种物质提供给一位受试者。
“有效量”是组合物的产生一种或多种所希望的免疫应答的任何量。这个量可以是针对体外或体内目的。针对体内目的,该量可以是临床医师将认为可以对需要免疫应答的受试者具有临床益处的量。这样的受试者患有癌症、感染或感染性疾病、特应性疾病、哮喘、慢性阻塞性肺病(COPD)或慢性感染或具有患这些疾病的风险。
有效量包括那些涉及抗体滴度的产生和/或一种或多种细胞因子的全身性释放的量。在多个实施方案中,该有效量包括那些涉及产生一种全身性细胞因子释放曲线的那些。在一些实施方案中,该一种或多种细胞因子或细胞因子释放曲线包括TNF-α、IL-6和/或IL-12的全身性释放。在其他实施方案中,该一种或多种细胞因子或细胞因子释放曲线包括IFN-γ、IL-12和/或IL-18的全身性释放。这可以通过常规方法监测。有效产生一种或多种所希望的免疫应答的量还可以是在此提供的组合物产生所希望的治疗终点或所希望的治疗结果的量。
有效量当然将取决于所治疗的特定受试者;病症、疾病或失调的严重程度;个体患者参数,包括年龄、身体状况、体型以及体重;治疗持续时间;同时治疗(如果有)的性质;具体的给药途径以及健康从业者的知识和专业知识之内的类似因素。这些因素为本领域普通技术人员所熟知,并且可以仅仅用常规实验法解决。通常优选的是使用“最大剂量”,即根据合理医学判断的最高安全剂量。然而,本领域的普通技术人员应当了解的是,由于医学原因、心理原因或事实上任何其他原因,患者可以坚持较低剂量或耐受剂量。
在多个实施方案中,结合到纳米载体上的一种或多种佐剂的剂量的选择取决于与产生相似免疫应答(有或没有抗原)的一种或多种单独佐剂(即,没有结合到纳米载体上的)的剂量的比较。如在此使用的,“相似免疫应答”包括健康从业者预期的在受试者中导致可比较的治疗结果的免疫应答。相似免疫应答也包括相同类型应答的免疫应答(例如,诱导相同的特定细胞因子或细胞因子的集合,产生相同类型的抗体滴度,等等),这些免疫应答的水平被认为不是统计学上不同的。
是否产生一种相似免疫应答可以使用体内或体外技术确定。例如,是否产生一种相似免疫应答可以通过给予受试者该剂量的单独佐剂(具有或没有抗原)经测量受试者中的免疫应答(例如,抗体滴度或一种或多种细胞因子的释放)来确定。该受试者不必是以本发明的方法向其给予本发明的包含结合纳米载体的佐剂的组合物的同一受试者。该受试者例如可以是先前给予了该剂量的单独佐剂的一位临床试验受试者或者多位受试者。该受试者例如可以是先前给予了该剂量的单独佐剂的一个动物模型受试者或多个受试者。该受试者的免疫应答的测定还可以通过测量从该受试者中分离的细胞或与该剂量的单独佐剂(具有或没有抗原)接触的来自另一个或多个受试者的细胞的反应来确定。该其他的一个或多个受试者再次可以是临床试验受试者或动物模型受试者。
在多个实施方案中,该比较是基于一种免疫应答(例如,特定类型的抗体滴度,特定的细胞因子水平、细胞因子集合的水平)的测量,可以在用该剂量的单独佐剂免疫之后的第1、2、3、4、5、6、7、8、9、10、12、15、17、20、25、30、35、40小时或更多小时之内完成。在其他实施方案中,该免疫应答在免疫之后的第1、2、3、4、5、6、7、8、9、10、12、15、20、25、30、35、40天或更多天之内测量的。用于确定一种免疫应答是否是相似的测定对于本领域的普通技术人员是已知的。另外,这样的测定的实例在以下多个实例中更详细地进行说明。
是否一个剂量的单独佐剂(具有或没有抗原)产生了一种相似免疫应答还可以通过一个健康从业者预期该免疫应答(或免疫应答的水平)是基于来自现有技术的体内和/或体外测定的结果(在其他受试者中)来确定。这样的结果可以包括其中已经确定了有效剂量的临床试验的结果。因此,在比较中所使用的单独佐剂的剂量是一个健康从业者预期有效地产生该免疫应答或治疗效果的量。在另一个实施方案中,在比较中所使用的单独佐剂的剂量是一个健康从业者预期为最大耐受剂量的单独佐剂的剂量。在多个实施方案中,结合佐剂的剂量比一个单独佐剂的剂量小1倍、2倍、3倍、4倍、5倍或6倍,该单独佐剂的剂量是有效地产生在此提供的一种免疫应答或治疗结果的量。在其他实施方案中,结合佐剂的剂量比一个单独佐剂的剂量小至少1倍、2倍、3倍、4倍、5倍或6倍,该单独佐剂的剂量是最大耐受剂量。在其他实施方案中,结合佐剂的剂量大于一个单独佐剂的剂量,该单独佐剂的剂量是一个有效产生在此提供的一种免疫应答或治疗结果的量。在其他实施方案中,结合佐剂的剂量大于一个单独佐剂的剂量,该单独佐剂的剂量是最大耐受剂量。
通常,本发明的组合物的一种或多种佐剂或抗原的剂量的范围可以是从大约0.001μg/kg至大约100mg/kg。在一些实施方案中,剂量的范围可以是从大约0.01μg/kg至大约10mg/kg。仍然在其他实施方案中,剂量的范围可以是从大约0.1μg/kg至大约5mg/kg,大约1μg/kg至大约1mg/kg,大约10μg/kg至大约0.5mg/kg或大约100μg/kg至大约0.5mg/kg。在另外的实施方案中,剂量的范围可以是从大约0.1μg/kg至大约100μg/kg。仍然在另外的实施方案中,剂量的范围可以是从大约30μg/kg至大约300μg/kg。可替代地,可以基于合成纳米载体的数量而给予该剂量。例如,有用的剂量包括大于106、107、108、109或1010个合成纳米载体/剂量。其他有用的剂量的实例包括例如从大约1x106至大约1x1010,大约1x107至大约1x109或大约1x108至大约1x109的合成纳米载体/剂量。
在多个实施方案中,该剂量是一个“亚治疗剂量”,表示提供了所希望的治疗结果的一种佐剂(或多种佐剂)的一个量(例如,特定的质量单位数目),其中该亚治疗剂量是在数字上小于若单独给予时提供实质上相同的治疗结果所需要的量的一个量。在此情况下,“单独”或“单独地”表示该佐剂(或多种佐剂)没有结合到一种合成纳米载体上。在一个实施方案中,亚治疗剂量的R848包括从0.01微克/kg至100微克/kg,优选0.1微克/kg至10微克/kg的R848。在一个实施方案中,亚治疗剂量的含CpG寡核苷酸包括从0.001μg/kg至2mg/kg,优选从大约0.01μg/kg至0.1mg/kg的含CpG寡核苷酸。在再另一个实施方案中,亚治疗剂量的免疫活性核酸或其衍生物包括从0.001μg/kg至2mg/kg,优选从0.01μg/kg至0.1mg/kg。在另一个实施方案中,亚治疗剂量的包括从0.001μg/kg至0.5mg/kg。
在其他实施方案中,该剂量是一个“毒性降低的剂量”,表示提供了特定的全身性细胞因子释放(优选特定的全身性细胞因子释放曲线)的一个剂量,其中该毒性降低的剂量大于在单独地给予时提供大致相同的特定的全身性细胞因子释放(优选一个特定的全身性细胞因子释放曲线)所需要的佐剂的剂量。在这种情况下,“单独”表示该佐剂没有结合到一种合成纳米载体上。另外,“全身性细胞因子释放曲线”表示一种全身性细胞因子释放模式,其中该模式包括针对若干种不同的全身性细胞因子测量的细胞因子水平。在一个实施方案中,毒性降低的剂量的R848包括从0.01微克/kg至100微克/kg,优选0.1微克/kg至10微克/kg的R848。在一个实施方案中,毒性降低的剂量的含CpG寡核苷酸包括从0.001微克/kg至2mg/kg,优选从0.01μg/kg至0.1mg/kg的含CpG寡核苷酸。在另一个实施方案中,亚治疗剂量的包括从0.001μg/kg至0.5mg/kg。
“抗体应答”表示导致B细胞的产生或刺激和/或抗体产生的任何免疫应答。“抗体滴度”表示可测量抗体水平的产生。抗体应答或抗体滴度的产生优选地是在人类中。在一些实施方案中,抗体是某种同种型的抗体,如IgG或其亚类。用于测量抗体滴度的方法在本领域中是已知的并且包括酶联免疫吸附测定(ELISA)。用于测量抗体滴度的方法还在实例中略为详细地进行了描述。优选地,抗体应答或抗体滴度对一种抗原是特异性的。这样的抗原可以与结合佐剂的纳米载体联合给予但是也可以不联合给予。
“抗原”表示B细胞抗原或T细胞抗原。在多个实施方案中,抗原结合到合成纳米载体上。在其他实施方案中,抗原未结合到合成纳米载体上。在多个实施方案中,抗原与合成纳米载联合给予。在其他实施方案中,抗原未与合成纳米载体联合给予。“抗体类型”表示共享相同或大致相同的抗原特征的分子。在多个实施方案中,所提供的组合物的抗原与正在被治疗的疾病或病症是相关联的。例如,该抗原可以是一种变应原(用于治疗一种过敏症或过敏性病症)、一种癌相关抗原(用于治疗癌症或肿瘤)、一种传染因子抗原(用于治疗感染、感染性疾病或慢性感染性疾病),等等。
“至少一部分剂量”表示剂量的至少某部分,范围一直到包括所有剂量。
“具有风险”的受试者是健康从业者认为有可能患有在此提供的疾病或病症的受试者。
“B细胞抗原”表示被B细胞识别并且触发在B细胞中的免疫应答的任何抗原(例如被B细胞上的B细胞受体特异性识别的抗原)。在一些实施方案中,是T细胞抗原的抗原也是B细胞抗原。在其他实施方案中,T细胞抗原并不也是B细胞抗原。B细胞抗原包括但不限于:蛋白质、肽、小分子、以及碳水化合物。在一些实施方案中,B细胞抗原包括非蛋白抗原(即不是蛋白质或肽抗原)。在一些实施方案中,B细胞抗原包括与传染因子结合的碳水化合物。在一些实施方案中,B细胞抗原包括与传染因子结合的糖蛋白或糖肽。传染因子可以是细菌、病毒、真菌、原生动物或寄生虫或朊病毒。在一些实施方案中,B细胞抗原包括弱免疫原性抗原。在一些实施方案中,B细胞抗原包括滥用的物质或其一部分。在一些实施方案中,B细胞抗原包括成瘾物质或其一部分。成瘾物质包括但不限于尼古丁、麻醉药、镇咳剂、镇静剂(tranquilizer)、以及镇静药(sedative)。在一些实施方案中,B细胞抗原包括毒素,如来自化学武器或天然来源的毒素或一种污染物。B细胞抗原还可以包括有害环境因子。在其他实施方案中,B细胞抗原包括同种抗原、变应原、接触性致敏原、退行性疾病抗原、半抗原、感染性疾病抗原、癌抗原、特应性疾病抗原、自身免疫性疾病抗原、成瘾物质、异种抗原、或代谢性疾病酶或其酶产物。
“选择”表示自身直接地或间接地做出选择,例如但不限于通过依赖人的语言或行为而采取行动的无关的第三方。通常,该同一实体(例如,一起起作用的个体或个体组或组织(organization)中)提供了在此提供的一种组合物并且通过同样选择适当剂量的组合物之后给予该组合物产生了所希望的免疫应答。
“联合给予”表示将两种或更多种物质以一种在时间上相关(优选地在时间上充分相关)的方式给予一位受试者,以便提供免疫应答的调节。在多个实施方案中,可以通过给予在同一剂型中的两种或更多种物质而发生联合给予。在其他实施方案中,联合给予可以包括以不同的剂型,但是在指定的时间段之内给予两种或更多种物质,优选地在1个月之内、更优选在1周之内,仍然更优选地在一天之内,并且甚至更优选地在1小时之内。
“结合”(“Couple”)或“结合的”(“Coupled”)或“结合”(“Couples”)(等等)表示使一个实体(例如一个部分)与另一个实体在化学上结合。在一些实施方案中,结合是共价的,表示在两个实体之间的共价键存在的情况下发生结合。在非共价的实施方案中,通过非共价相互作用介导非共价结合,这些非共价相互作用包括但不限于:电荷相互作用、亲和相互作用、金属配位作用、物理吸附、主客体相互作用、疏水相互作用、TT堆积相互作用、氢键相互作用、范德华相互作用、磁相互作用、静电相互作用、偶极-偶极相互作用、和/或它们的组合。在多个实施方案中,封装是一种形式的结合。在多个实施方案中,一个剂量的一种或多种佐剂的至少一部分结合到合成纳米载体上,优选地,全部剂量的一种或多种佐剂结合到合成纳米载体上。在多个实施方案中,一个剂量的一种或多种佐剂的至少一部分没有结合到合成纳米载体上。
“剂型”表示在介质、载体、媒介物或适合于给予受试者的装置中的一种药理学和/或免疫活性材料。在多个实施方案中,至少一种本发明的剂型可以包括一个剂量的一种佐剂或多种佐剂。在多个实施方案中,一种以上的剂型包括一个剂量的佐剂,优选地在这样的实施方案中这一种以上的剂型是联合给予的。
“封装”表示用一种合成纳米载体包封,优选地用一种合成纳米载体完全包封。多数或所有封装的物质不暴露于合成纳米载体外的局部环境。封装不同于吸收,吸收是将一种物质的大部分或全部置于一种合成纳米载体的表面上,并且使该物质暴露于合成纳米载体外的局部环境。
“产生”表示引起一种作用,例如自身直接地或间接地发生针对一种抗原的抗体滴度或全身性细胞因子释放,例如但不限于通过依赖人的语言或行为而采取行动的无关的第三方。
“感染”或“感染性疾病”是由微生物、病原体或其他因子(如细菌、真菌、朊病毒或病毒)引起的任何病症或疾病。
“分离的核酸”表示一种从其天然环境分离出并且以足以允许其鉴定或使用的量存在的核酸。分离的核酸可以是(i)在体外通过例如聚合酶链式反应(PCR)扩增;(ii)通过克隆重组生产;(iii)如通过切割和凝胶分离进行纯化;或(iv)通过例如化学合成而合成的核酸。分离的核酸是通过本领域熟知的重组DNA技术容易地可操作的核酸。因此,包含在其中5′和3′限制性酶切位点是已知的载体中或者针对它的聚合酶链式反应(PCR)引物序列已经披露的核苷酸序列被认为是分离的,但是以其天然状态存在于它的天然宿主中的核酸序列不被认为是分离的。分离的核酸可以被基本上纯化,但是不必要被纯化。例如,在克隆或表达载体中分离的核酸不是纯的,因为在它所存在的细胞中,可能只包括很小百分比的物质。然而,作为在此使用的术语,这样的核酸是分离的,因为通过本领域的那些普通技术人员已知的标准技术,它是容易地可操作的。在此提供的任何核酸都可以是分离的。在一些实施方案中,在此提供的组合物中的抗原以分离的核酸的形式存在,例如编码一种抗原肽、多肽或蛋白质的分离的核酸。
“分离的肽、多肽或蛋白质”表示从其天然环境分离出的并且以足以允许其鉴定或使用的量存在的多肽(或肽或蛋白质)。这表示例如该多肽(或肽或蛋白质)可以被(i)通过表达克隆选择性地生产或(ii)如通过色谱法或电泳进行纯化。分离的多肽可以是但不必要是基本上纯的。由于在药物制剂中分离的肽、多肽或蛋白质可以与药学上可接受的载体混合,按制剂的重量计该多肽(或肽或蛋白质)可能仅包括小的百分比。虽然如此,这种多肽(或肽或蛋白质)是分离的,因为它已经从在活系统中可能与其相关的物质中分离出来,即从其他蛋白质(或肽或多肽)中分离出来。在此提供的任何肽、多肽或蛋白质都可以是分离的。在一些实施方案中,在此提供的组合物中的抗原是处于肽、多肽或蛋白质的形式。
“合成纳米载体的最大尺寸”表示沿着该合成纳米载体的任何轴测量的纳米载体的最大尺寸。“合成纳米载体的最小尺寸”表示沿这着该合成纳米载体的任何轴测量的合成纳米载体的最小尺寸。例如,对于球状(spheriodal)合成纳米载体,合成纳米载体的最大和最小尺寸将是基本相同的,并且是它的直径的大小。类似地,对于立方形合成纳米载体,合成纳米载体的最小尺寸将是它的高度、宽度或长度中最小的那个,而合成纳米载体的最大尺寸将是它的高度、宽度或长度中最大的那个。在一个实施方案中,基于样品中合成纳米载体的总数,样品中至少75%、优选至少80%、更优选至少90%的合成纳米载体的最小尺寸大于100nm。在一个实施方案中,基于样品中合成纳米载体的总数,样品中至少75%、优选至少80%、更优选至少90%的合成纳米载体的最大尺寸等于或小于5μm。优选地,基于样品中合成纳米载体的总数,样品中至少75%、优选至少80%、更优选至少90%的合成纳米载体的最小尺寸大于110nm、更优选大于120nm、更优选大于130nm、并且仍更优选大于150nm。本发明的合成纳米载体的最大尺寸与最小尺寸的纵横比可以取决于实施方案而变化。例如,合成纳米载体的最大尺寸与最小尺寸的纵横比可以从1:1到1,000,000∶1、优选从1∶1到100,000:1、更优选从1∶1到1000∶1、再优选从1∶1到100∶1、并且又更优选从1∶1到10∶1而变化。优选地,基于样品中合成纳米载体的总数,样品中至少75%、优选至少80%、更优选至少90%的合成纳米载体的最大尺寸等于或小于3μm、更优选等于或小于2μm、更优选等于或小于1μm、更优选等于或小于800nm、更优选等于或小于600nm、并且再更优选等于或小于500nm。在优选的实施方案中,基于样品中合成纳米载体的总数,样品中至少75%,优选至少80%,更优选至少90%的合成纳米载体的最大尺寸等于或大于100nm、更优选等于或大于120nm、更优选等于或大于130nm、更优选等于或大于140nm、并且仍更优选等于或大于150nm。通过将这些合成纳米载体悬浮在一种液体(通常是水性的)介质中,并且使用动态光散射(例如使用一台Brookhaven ZetaPALS仪器)获得合成纳米载体大小的测量值。
“药学上可接受的载体或赋形剂”表示与所列举的合成纳米载体一起使用来配制本发明的组合物的药理学上无活性的材料。药学上可接受的载体或赋形剂包括多种本领域已知的物质,包括但不限于:糖类(如葡萄糖、乳糖、以及类似物)、防腐剂(如抗微生物剂)、复原助剂、着色剂、盐水(如磷酸盐缓冲盐水)以及缓冲剂。在一些实施方案中,药学上可接受的载体或赋形剂包括碳酸钙、磷酸钙、不同的稀释剂、不同的糖和各种类型的淀粉、纤维素衍生物、明胶、植物油以及聚乙二醇。
“受试者”表示动物,包括温血哺乳动物,如人类和灵长类;禽类;家庭驯养动物或农场动物,如猫、狗、绵羊、山羊、牛、马以及猪;实验动物,如小鼠、大鼠以及豚鼠;鱼;爬行动物;动物园动物和野生动物;等等。
“合成纳米载体”表示未见于自然界中并且拥有至少一个小于或等于5微米大小的尺寸的离散物体。通常,白蛋白纳米颗粒被包括作为合成纳米载体,然而,在某些实施方案中,合成纳米载体不包含白蛋白纳米颗粒。在多个实施方案中,本发明的合成纳米载体不包括壳聚糖。
合成纳米载体可以是但不限于一个或多个基于脂质的纳米颗粒(例如脂质体)(在此还称为脂质纳米颗粒,即构成其结构的大多数物质是脂质的纳米颗粒)、聚合物纳米颗粒、金属纳米颗粒、基于表面活性剂的乳液、树枝状聚合物、巴克球、纳米线、病毒样颗粒(即主要由病毒结构蛋白构成但不具有感染性或具有低感染性的颗粒)、基于肽或蛋白质的颗粒(在此也称为蛋白质颗粒,即构成其结构的大多数物质是肽或蛋白质的颗粒)(如白蛋白纳米颗粒)和/或使用纳米材料的组合产生的纳米颗粒(如脂质-聚合物纳米颗粒)。合成纳米载体可以具有多种不同的形状,包括但不限于球状、立方形、锥形、长方形、圆柱形、环形等等。根据本发明的合成纳米载体包括一个或多个表面,包括但不限于内表面(大致面向该合成纳米载体的内部部分的表面)以及外表面(大致面向该合成纳米载体的外部环境的表面)。可以适合用于实践本发明的示例性的合成纳米载体包括:(1)Gref(格里夫)等人的美国专利5,543,158中披露的生物可降解纳米颗粒,(2)Saltzman(萨尔兹曼)等人的美国专利申请20060002852公开的聚合物纳米颗粒,(4)DeSimone(德西蒙)等人的美国专利申请20090028910公开的石版印刷构建的(lithographically constructed)纳米颗粒,(5)von Andrian(冯安德里安)等人的WO 2009/051837的披露,或(6)Penades(佩纳德斯)等人的公开的美国专利申请2008/0145441中披露的纳米颗粒。
根据本发明的合成纳米载体具有等于或小于大约100nm、优选地等于或小于100nm的最小尺寸,不包括具有使补体活化的羟基的表面,或者可替代地包括基本由不是使补体活化的羟基的部分组成的表面。在一个优选的实施方案中,根据本发明的合成纳米载体具有等于或小于大约100nm、优选地等于或小于100nm的最小尺寸,不包括实质上使补体活化的表面,或者可替代地包括基本由不实质上活化补体的部分组成的表面。在更优选的实施方案中,根据本发明的合成纳米载体具有等于或小于大约100nm、优选地等于或小于100nm的最小尺寸,不包括使补体活化的表面,或者可替代地包括基本由不使补体活化的部分组成的表面。在多个实施方案中,合成纳米载体可以拥有大于1∶1、1∶1.2、1∶1.5、1∶2、1∶3、1∶5、1∶7、或大于1∶10的长宽比。
“全身性细胞因子释放”表示一种或多种特定细胞因子的全身性释放。在一些实施方案中,该全身性细胞因子释放是一种特定的全身性细胞因子释放曲线。在一些实施方案中,该特定的全身性细胞因子释放,优选一个特定的全身性细胞因子释放曲线,是在人类中的。在多个实施方案中,在此提供的组合物和方法(其中一个剂量的佐剂的至少一部分结合到纳米载体上导致在受试者中的特定的全身性细胞因子释放曲线)。术语“单独”或“单独地”还用来表示没有结合到任何合成纳米载体上的佐剂。另外,“全身性细胞因子释放曲线”表示一种全身性细胞因子释放的模式,其中该模式包括针对若干不同的全身性细胞因子所测量的细胞因子水平。在一些实施方案中,该特定的全身性细胞因子释放曲线包括TNF-α、IL-6和/或IL-12的全身性释放。在其他实施方案中,该特定的全身性细胞因子释放曲线包括IFN-γ、IL12和/或IL-18的全身性释放。
“T细胞抗原”表示通过T细胞中的免疫应答来识别的并且触发T细胞中的免疫应答的任何抗原(例如,经由呈递结合到I类或II类主要组织相容性复合体分子(MHC)上的、或者结合到CD1复合物上的抗原或它的一部分而被T细胞或NKT细胞上的T细胞受体特异性地识别的抗原)。在一些实施方案中,是T细胞抗原的抗原也是B细胞抗原。在其他实施方案中,T细胞抗原并不也是B细胞抗原。T细胞抗原通常是蛋白质、多肽或肽。T细胞抗原可以是刺激CD8+T细胞应答、CD4+T细胞应答、或两者的抗原。因此,在一些实施方案中,这些纳米载体可以有效刺激这两种类型的应答。
在一些实施方案中,T细胞抗原是‘通用’T细胞抗原或T细胞记忆抗原(即受试者对其具有先存在的记忆并且可以用来加强对无关抗原(例如无关B细胞抗原)的T细胞辅助的T细胞抗原)。通用T细胞抗原包括破伤风类毒素以及一种或多种衍生自破伤风类毒素、爱泼斯坦-巴尔病毒(Epstein-Barr virus)或流感病毒的肽。通用T细胞抗原还包括流感病毒的组分,如血凝素、神经氨酸酶或核蛋白、或一种或多种从它们衍生的肽。在一些实施方案中,通用T细胞抗原不是存在于具有MHC分子的复合物中的抗原。在一些实施方案中,通用T细胞抗原不与用于呈递到T辅助细胞上的MHC分子复合。因此,在一些实施方案中,通用T细胞抗原不是T辅助细胞抗原。然而,在其他实施方案中,通用T细胞抗原是T辅助细胞抗原。
在多个实施方案中,T辅助细胞抗原可以包含一种或多种获自或衍生自以下物质的肽:破伤风类毒素、爱泼斯坦-巴尔病毒、流感病毒、呼吸道合胞病毒、麻疹病毒、腮腺炎病毒、风疹病毒、巨细胞病毒、腺病毒、白喉类毒素或PADRE肽(从赛特(Sette)等人的美国专利7,202,351的工作中所知)。在其他实施方案中,T辅助细胞抗原可以包含卵清蛋白或从它获得或衍生的肽。优选地,卵清蛋白包含如登录号AAB59956、NP_990483.1、AAA48998或CAA2371中所提出的氨基酸序列。在其他实施方案中,获自或衍生自卵清蛋白的肽包含以下氨基酸序列:H-Ile-Ser-Gln-Ala-Val-His-Ala-Ala-His-Ala-Glu-Ile-Asn-Glu-Ala-Gly-Arg-OH(SEQ ID NO:1)。在其他实施方案中,T辅助细胞抗原可以包含一种或多种脂质、或糖脂类,包括但不限于:α-半乳糖苷神经酰胺(α-GalCer)、α-连接的鞘糖脂(来自鞘氨醇单胞菌属)、半乳糖苷二酰基甘油(来自伯氏疏螺旋体)、脂磷酸聚糖(来自杜氏利什曼原虫)以及磷脂酰肌醇四甘露糖苷(PIM4)(来自麻风分枝杆菌)。对于用作T辅助细胞抗原的另外的脂质和/或糖脂,参见塞兰德罗(V.Cerundolo)等人,Harnessing invariant NKT cells in vaccination strategies,《自然免疫学评论》(Nature Rev Immun),9:28-38(2009)。
在多个实施方案中,CD4+T细胞抗原可以是获自一个来源(如天然来源)的CD4+T细胞抗原的衍生物。在这样的实施方案中,CD4+T细胞抗原序列(如结合MHC II的那些肽)可以与获自该来源的抗原具有至少70%、80%、90%或95%的一致性。在多个实施方案中,T细胞抗原、优选通用T细胞抗原或T辅助细胞抗原可以结合到合成纳米载体上或从合成纳米载体去结合。在一些实施方案中,通用T细胞抗原或T辅助细胞抗原封装在本发明的组合物的合成纳米载体中。
“疫苗”表示一种提高了对于特定的病原体或疾病的免疫应答的物质的组合物。疫苗典型地含有刺激受试者的免疫系统以识别特异性抗原为外来物质并且将它从受试者身体消除的因子。疫苗还建立免疫“记忆”因此该抗原将被迅速地被识别并且响应于是否一个人被再激发。疫苗可以是预防性的(例如防止未来被任何病原体感染)、或治疗性的(例如用于治疗癌症的针对肿瘤特异性抗原的疫苗或针对用于治疗感染或感染性疾病的衍生自传染因子的抗原的疫苗)。在多个实施方案中,一种疫苗可以包含根据本发明的剂型。优选地,在一些实施方案中,这些疫苗包括结合到一种合成纳米载体上的一种佐剂(或多种佐剂)。
在特定的实施方案中,本发明的组合物结合了多种佐剂,这些佐剂包含针对toll样受体(TLR)7和8的激动剂的激动剂(“TLR 7/8激动剂”)。其中有用的是Tomai等人的美国专利6,696,076中披露的TLR 7/8激动剂化合物,包括但不限于咪唑并喹啉胺、咪唑并吡啶胺、6,7-稠合环烷基咪唑并吡啶胺、以及1,2-桥接咪唑并喹啉胺。优选的佐剂包括咪喹莫特和R848。
在特定的实施方案中,本发明的组合物结合了多种佐剂,这些佐剂包含针对Toll样受体(TLR)-9的配体,如包含CpG的免疫刺激DNA分子,它诱导I型干扰素分泌,并且刺激T细胞和B细胞活化,导致增加的抗体产生和细胞毒性T细胞应答(Krieg(克雷格)等人,CpG motifs in bacterial DNA trigger direct B cell activation.Nature(自然).1995.374:546-549;Chu(朱)等人,CpG oligodeoxynucleotides act as adjuvants that switch on Thelper 1(Th1)immunity.J.Exp.Med.(实验医学杂志)1997.186:1623-1631;Lipford(林慕德)等人,CpG-containing synthetic oligonucleotides promote B and cytotoxic T cell responses to protein antigen:a new class of vaccine adiuvants.Eur.J.Immunol(欧洲免疫学杂志).1997.27:2340-2344;Roman(罗曼)等人,Immunostimulatory DNA sequences function as T helper-1-promoting adjuvants.Nat.Med(自然医学).1997.3:849-854;Davis(戴维斯)等人,CpG DNA is a potent enhancer of specific immunity in mice immunized with recombinant hepatitis B surface antigen.J.Immunol(免疫学期刊).1998.160:870-876;Lipford(林慕德)等人,Bacterial DNA as immune cell activator.Trends Microbiol(微生物学进展).1998.6:496-500)。在多个实施方案中,CpG可以包括旨在增强稳定性的修饰(例如硫代磷酸酯键),或其他修饰(例如修饰的碱基)。参见,例如美国专利5,663,153、6,194,388、7,262,286、或7,276,489。在某些实施方案中,为了刺激免疫力而不是耐受,在此提供的组合物结合了促进DC成熟(对于引发初始T细胞而言是需要的)以及细胞因子(例如类型I干扰素,它促进抗体应答和抗病毒免疫)的产生的佐剂。在一些实施方案中,佐剂包含TLR-4激动剂(例如细菌脂多糖(LPS)、VSV-G、和/或HMGB-1)。在一些实施方案中,佐剂包含细胞因子,是由细胞释放的小的蛋白质或生物因子(在5kD-20kD的范围内),并且对细胞-细胞相互作用、通讯以及其他细胞的行为具有特殊作用。在一些实施方案中,佐剂包含从坏死细胞释放的促炎刺激物(例如尿酸盐晶体)。在一些实施方案中,佐剂包含活化的补体级联成分(例如CD21、CD35,等等)。在一些实施方案中,佐剂包含活化的免疫复合物成分。这些佐剂还包括补体受体激动剂(如结合CD21或CD35的分子)那些。在一些实施方案中,该补体受体激动剂诱导纳米载体的内源补体调理作用。佐剂还包括含细胞因子受体激动剂(例如细胞因子)的那些。
在一些实施方案中,该细胞因子受体激动剂是小分子、抗体、融合蛋白、或适体。在多个实施方案中,佐剂还可以包括免疫刺激RNA分子(例如但不限于dsRNA或聚I:C(TLR3刺激剂)、和/或在F.Heil(海尔)等人,“Species-Specific Recognition of Single-Stranded RNA via Toll-like Receptor 7 and 8”Science 303(5663),1526-1529(2004);J.Vollmer(福尔默)等人,“Immune modulation by chemically modified ribonucleosides and oligoribonucleotides”WO 2008033432 A2;A.Forsbach(福尔斯巴赫)等人,“Immunostimulatory oligoribonucleotides containing specific sequence motif(s)and targeting the Toll-like receptor 8 pathway”WO 2007062107 A2;E.Uhlmann(乌尔曼)等人,“Modified oligoribonucleotide analogs with enhanced immunostimulatory activity”U.S.Pat.Appl.Publ.US 2006241076;G.Lipford(林慕德)等人,“Immunostimulatory viral RNA oligonucleotides and use for treating cancer and infections”WO 2005097993 A2;G.Lipford(林慕德)等人,“Immunostimulatory G,U-containing oligoribonucleotides,compositions,and screening methods”WO 2003086280 A2中披露的那些。
在一些实施方案中,佐剂包括凝胶型佐剂(例如氢氧化铝、磷酸铝、磷酸钙、等等)、微生物佐剂(例如包括CpG基序的免疫调节DNA序列;免疫刺激RNA分子;内毒素例如单磷酰脂质A;外毒素例如霍乱毒素、大肠杆菌不耐热毒素、以及百日咳毒素;胞壁酰二肽、等等);油乳液和乳化剂基佐剂(例如弗氏佐剂、MF59[Novartis]、SAF、等等);微粒佐剂(例如脂质体、生物可降解微球、皂苷等等);合成佐剂(例如非离子嵌段共聚物、胞壁酰肽类似物、聚磷腈、合成多核苷酸、等等),和/或它们的组合。
本发明的组合物
根据本发明,可以使用各种各样的合成纳米载体。在一些实施方案中,合成纳米载体是球体或球状体。在一些实施方案中,合成纳米载体是扁平的或盘状的。在一些实施方案中,合成纳米载体是立方体或立方形的。在一些实施方案中,合成纳米载体是卵形或椭圆形的。在一些实施方案中,合成纳米载体是圆柱体、椎体、或锥体。
在一些实施方案中,希望使用一群在大小、形状、和/或构成方面较一致的合成纳米载体,这样每一个合成纳米载体具有相似特性。例如,基于合成纳米载体的总数,至少80%、至少90%、或至少95%的合成纳米载体可以具有落在合成纳米载体的平均直径或平均尺寸的5%、10%或20%之内的最小尺寸或最大尺寸。在一些实施方案中,一个合成纳米载体群就大小、形状、和/或构成而论可以是不均匀的。
合成纳米载体可以是实心的或空心的,并且可以包括一个或多个层。在一些实施方案中,每一层相对于其他一层或多层具有独特的构成和独特的特性。为了给出仅仅是一个实例,合成纳米载体可以具有一个核/壳结构,其中核是一层(例如一个聚合物核)并且壳是一个第二层(例如一个脂质双层或单层)。合成纳米载体可以包括多个不同的层。
在一些实施方案中,合成纳米载体可以任选地包括一种或多种脂质。在一些实施方案中,合成纳米载体可以包括一种脂质体。在一些实施方案中,合成纳米载体可以包括一个脂质双层。在一些实施方案中,合成纳米载体可以包括一个脂质单层。在一些实施方案中,合成纳米载体可以包括一种胶束。在一些实施方案中,合成纳米载体可以包括一个核,该核包括被一个脂质层(例如脂质双层、脂质单层等)围绕的聚合物基质。在一些实施方案中,合成纳米载体可以包括被一个脂质层(例如脂质双层、脂质单层,等等)围绕的非聚合物核(例如金属颗粒、量子点、陶瓷颗粒、骨颗粒、病毒颗粒、蛋白质、核酸、碳水化合物,等等)。
在一些实施方案中,合成纳米载体可以包括一种或多种聚合物或聚合物基质。在一些实施方案中,这样一种聚合物或聚合物基质可以被涂层(例如脂质体、脂质单分子层、胶束、等等)围绕。在一些实施方案中,合成纳米载体的不同要素可以与该聚合物或聚合物基质结合。
在一些实施方案中,一个要素,例如一个免疫特征表面、靶向部分、抗原、佐剂和/或寡核苷酸可以与聚合物基质共价结合。在一些实施方案中,由一个连接物介导共价结合。在一些实施方案中,一个元件可以与聚合物基质非共价结合。例如,在一些实施方案中,一个要素可以被封装在聚合物基质之内、被聚合物基质围绕、和/或被分散遍及该聚合物基质。可替代地或另外地,一个要素可以通过疏水性相互作用、电荷相互作用、范德华力、等等与聚合物基质结合。
各种各样的聚合物以及用于由此形成聚合物基质的方法是常规已知的。通常,一种聚合物基质包括一种或多种聚合物。聚合物可以是天然的或非天然的(合成的)聚合物。聚合物可以是均聚物或包含两种或更多种单体的共聚物。就序列而言,共聚物可以是无规、嵌段的,或者包括无规序列和嵌段序列的组合。典型地,根据本发明的聚合物是有机聚合物。
适合用于本发明中的聚合物的实例包括,但不限于:聚乙烯、聚碳酸酯(例如聚(1,3-二噁烷-2酮))、聚酐(例如聚(癸二酸酐))、聚丙基延胡索酸酯(polypropylfumerate)、聚酰胺(例如聚己内酰胺)、聚缩醛、聚醚、聚酯(例如聚丙交酯、聚乙交酯、丙交酯-乙交酯共聚物、聚己内酯、多羟基酸(例如聚(β-羟基烷酸酯))、聚(原酸酯)、聚氰基丙烯酸酯、聚乙烯醇、聚氨酯、聚磷腈、聚丙烯酸酯、聚甲基丙烯酸酯、聚脲、聚苯乙烯、聚胺、聚赖氨酸、聚赖氨酸-PEG共聚物以及聚(乙烯亚胺)、聚(乙烯亚胺)-PEG共聚物。
在一些实施方案中,根据本发明的聚合物包括在21C.F.R.§177.2600下已经由美国食品与药品管理局(FDA)批准用于人的聚合物,包括但不限于聚酯(例如聚乳酸、聚(乳酸乙醇酸)共聚物、聚己内酯、聚戊内酯、聚(1,3-二噁烷-2酮));聚酐(例如聚(癸二酸酐));聚醚(例如聚乙二醇);聚氨酯;聚甲基丙烯酸酯;聚丙烯酸酯;以及聚氰基丙烯酸酯。
在一些实施方案中,聚合物可以是亲水的。例如,聚合物可以包括阴离子基团(例如磷酸基、硫酸基、羧酸基);阳离子基团(例如季胺基团);或极性基团(例如羟基、硫醇基、胺基)。在一些实施方案中,包括亲水的聚合物基质的合成纳米载体在合成纳米载体内产生亲水环境。在一些实施方案中,聚合物可以是疏水的。在一些实施方案中,包括疏水的聚合物基质的合成纳米载体在合成纳米载体内产生疏水环境。在合成纳米载体内,聚合物亲水性或疏水性的选择可以影响要合并(例如结合)材料的性质。
在一些实施方案中,聚合物可以用一个或多个部分和/或官能团修饰。根据本发明,可以使用多种部分或官能团。在一些实施方案中,可以用聚乙二醇(PEG)、用碳水化合物、和/或用衍生自多糖类的非环状聚缩醛来修饰聚合物(Papisov(巴比索夫),2001,ACS Symposium Series,786:301)。可以使用Gref(格里夫)等人的美国专利号5543158、或Von Andrian(冯安德里安)等人的WO公开WO2009/051837中的全部传授内容进行某些实施方案。
在一些实施方案中,可以用脂质或脂肪酸基团修饰聚合物。在一些实施方案中,脂肪酸基团可以是丁酸、己酸、辛酸、癸酸、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、花生酸、山嵛酸、或二十四烷酸中的一种或多种。在一些实施方案中,脂肪酸基团可以是棕榈油酸、油酸、异油酸、亚麻酸、α-亚麻酸、γ-亚麻酸、花生四烯酸、鳕油酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸或芥酸的一种或多种。
在一些实施方案中,聚合物可以是聚酯,包括共聚物,这些共聚物包括乳酸和乙醇酸单元(例如聚(乳酸乙醇酸共聚物)和聚(丙交酯乙交酯)共聚物),在此统称为“PLGA”,以及包括乙醇酸单元的均聚物,在此称为“PGA”,以及乳酸单元(例如聚-L-乳酸、聚-D-乳酸、聚-D,L-乳酸、聚-L-丙交酯、聚-D-丙交酯、以及聚-D,L-丙交酯),在此统称为“PLA”。在一些实施方案中,示例性的聚酯包括,例如多羟基酸;PEG共聚物和丙交酯与乙交酯的共聚物(例如PLA-PEG共聚物、PGA-PEG共聚物、PLGA-PEG共聚物),以及它们的衍生物)。在一些实施方案中,聚酯包括例如聚(己内酯)、聚(己内酯)-PEG共聚物、聚(L-丙交酯-L-赖氨酸)共聚物、聚(丝氨酸酯)、聚(4-羟基-L-脯氨酸酯)、聚[α-(4-氨基丁基)-L-乙醇酸]、以及它们的衍生物。
在一些实施方案中,聚合物可以是PLGA。PLGA是一种生物相容的并且生物可降解的乳酸和乙醇酸的共聚物,并且多种形式的PLGA特征在于乳酸∶乙醇酸的比率。乳酸可以是L-乳酸、D-乳酸、或D,L-乳酸。可以通过改变乳酸∶乙醇酸的比率调整PLGA的降解速率。在一些实施方案中,根据本发明,将使用的PLGA特征在于大约85∶15、大约75∶25、大约60∶40、大约50∶50、大约40∶60、大约25∶75、或者大约15∶85约的乳酸∶乙醇酸比率。
在一些实施方案中,聚合物可以是一种或多种丙烯酸聚合物。在某些实施方案中,丙烯酸聚合物包括,例如丙烯酸和甲基丙烯酸的共聚物、甲基丙烯酸甲酯共聚物、甲基丙烯酸乙氧基乙酯、甲基丙烯酸氰基乙基酯、甲基丙烯酸氨基烷基酯共聚物、聚(丙烯酸)、聚(甲基丙烯酸)、甲基丙烯酸烷基酰胺共聚物、聚(甲基丙烯酸甲酯)、聚(甲基丙烯酸酸酐)、甲基丙烯酸甲酯、聚甲基丙烯酸酯、聚(甲基丙烯酸甲酯)共聚物、聚丙烯酰胺、甲基丙烯酸氨基烷基酯共聚物、甲基丙烯酸缩水甘油酯共聚物、聚腈基丙烯酸酯、以及包括一种或多种以上聚合物的组合。该丙烯酸聚合物可以包括具有低含量的季铵基团的丙烯酸酯和甲基丙烯酸酯的完全聚合共聚物。
在一些实施方案中,聚合物可以是阳离子型聚合物。通常,阳离子型聚合物能够缩合和/或保护核酸(例如DNA、或它的衍生物)的带负电的链。含有胺的聚合物(例如聚(赖氨酸)(Zauner(泽纳)等人,1998,《先进药物递送综述》(Adv.Drug Del.Rev.),30:97;以及Kabanov(卡巴诺夫)等人,1995,《生物共轭化学》(Bioconjugate Chem.),6:7)、聚(亚乙基亚胺)(PEI;Boussif(波希夫)等人,1995,《美国科学院院报》,1995,92:7297)、以及聚(酰胺胺)树枝状聚合物(Kukowska(库科斯卡)-Latallo(拉塔罗)等人,1996,《美国科学院院报》,93:4897;Tang(唐)等人,1996,《生物共轭化学》,7:703;以及Haensler(亨斯勒)等人,1993,《生物共轭化学》,4:372)在生理pH下是带正电的,在多种细胞系中与核酸形成离子对,并且介导转染。在多个实施方案中,本发明的合成纳米载体可以不包含(或可以排除)阳离子聚合物。0}
在一些实施方案中,聚合物可以是带有阳离子侧链的可降解聚酯(Putnam(普特南)等人,1999,《大分子》,32:3658;Barrera(巴雷拉)等人,1993,《美国化学会志》,115:11010;Kwon(权)等人,1989,《大分子》,22:3250;Lim(林)等人,1999,《美国化学会志》,121:5633;以及Zhou(周)等人,1990,《大分子》,23:3399)。这些聚合物的实例包括聚(L-丙交酯L-赖氨酸)(Barrera(巴雷拉)等人,1993,《美国化学会志》,115:11010)、聚(丝氨酸酯)(Zhou(周)等人,1990,《大分子》,23:3399)、聚(4-羟基-L-脯氨酸酯)(Putnam(普特南)等人,1999,《大分子》,32:3658;以及Lim(林)等人,1999,《美国化学会志》,121:5633)、以及聚(4-羟基-L-脯氨酸酯)(Putnam(普特南)等人,1999,《大分子》,32:3658;以及Lim(林)等人,1999,《美国化学会志》,121:5633)。
这些和其他聚合物的特性以及用于制备它们的方法在本领域中是熟知的(参见,例如美国专利6,123,727;5,804,178;5,770,417;5,736,372;5,716,404;6,095,148;5,837,752;5,902,599;5,696,175;5,514,378;5,512,600;5,399,665;5,019,379;5,010,167;4,806,621;4,638,045;以及4,946,929;Wang(王)等人,2001,《美国化学会志》,123:9480;Lim(林)等人,2001,《美国化学会志》,123:2460;Langer(朗格尔),2000,《化学研究评述》,33:94;Langer(朗格尔),1999,《控释杂志》,62:7;以及Uhrich(乌利希)等人,1999,《化学评论》,99:3181)。更一般地说,在Concise Encyclopedia of Polymer Science and Polymeric Amines and Ammonium Salts,Goethals(戈萨尔斯)编辑,培格曼出版社,1980中;在Principles of Polymerization by Odian,约翰·威利父子出版公司,第四版,2004中;在Allcock(阿尔库克)等人的Contemporary Polymer Chemistry,Prentice-Hall,1981中;在Deming(德明)等人,1997,《自然》,390:386中;以及在美国专利6,506,577、6,632,922、6,686,446、以及6,818,732中说明了用于合成某些适合的聚合物的多种方法。
在一些实施方案中,聚合物可以是线性聚合物或支化聚合物。在一些实施方案中,聚合物可以是树枝状聚合物。在一些实施方案中,聚合物可以是基本上彼此交联的。在一些实施方案中,聚合物可以基本上不交联。在一些实施方案中,聚合物可以根据本发明进行使用而不经历交联步骤。进一步理解的是,本发明的合成纳米载体可以包括嵌段共聚物、接枝共聚物、共混物、混合物、和/或任何以上及其他聚合物的加合物。本领域的那些技术人员将认识到,在此列出的聚合物代表根据本发明可以使用的聚合物的示例性的、而不是全面的清单。
在一些实施方案中,这些合成纳米载体可以包括一种或多种聚合物。因此,聚合物合成纳米载体还可以包括冯安德里安(Von Andrian)等人的WO公开WO 2009/051837中描述的聚合物合成纳米载体,包括但不限于具有一种或多种亲水性组分的那些。优选地,一种或多种聚合物包含聚酯,如聚(乳酸)、聚(乙醇酸)、聚(乳酸-乙醇酸)共聚物或聚己内酯。更优选地,一种或多种聚合物包含或另外包含结合到亲水聚合物(如聚醚)上的聚酯。在多个实施方案中,该聚醚包含聚乙二醇。再更优选地,一种或多种聚合物包含聚酯和结合到亲水聚合物(如聚醚)上的聚酯。在其他实施方案中,一种或多种聚合物被结合到一种或多种抗原和/或一种或多种佐剂上。在多个实施方案中,至少一些聚合物被结合到这种或这些抗原上,和/或至少一些聚合物被结合到这种或这些佐剂上。优选地,当存在一种以上的类型的聚合物时,一种类型的聚合物被结合到这种或这些抗原上。在多个实施方案中,一种其他类型的聚合物被结合到这种或这些佐剂上。例如,在多个实施方案中,当纳米载体包含聚酯和结合到亲水聚合物(如聚醚)上的聚酯时,该聚酯被结合到该佐剂上,而该结合到亲水聚合物(如聚醚)上的聚酯被结合到这种或这些抗原上。在多个实施方案中,在纳米载体包含辅助细胞抗原时,T细胞抗原可以封装在纳米载体中。
在一些实施方案中,合成纳米载体可以不包含聚合组分。在一些实施方案中,合成纳米载体可以包含金属颗粒、量子点、陶瓷颗粒等等。在一些实施方案中,非聚合物合成纳米载体是非聚合组分的聚集物,如金属原子(例如金原子)的聚集物。
在一些实施方案中,合成纳米载体可以任选地包含一种或多种两亲实体。在一些实施方案中,两亲实体可以促进具有增加的稳定性、改进的均匀性或增加的粘性的合成纳米载体的产生。在一些实施方案中,两亲实体可以与脂质膜(例如脂质双层、脂质单层等)的内表面结合。本领域中已知的多种两亲实体适合于在制造根据本发明的合成纳米载体中使用。这样的两亲实体包括,但不限于,磷酸甘油酯;磷脂酰胆碱;二棕榈酰磷脂酰胆碱(DPPC);二油烯基磷脂酰乙醇胺(DOPE);二油烯基氧丙基三乙基铵(DOTMA);二油酰磷脂酰胆碱;胆固醇;胆固醇酯;二酰基甘油;二酰基甘油琥珀酸酯;双磷脂酰甘油(DPPG);十六醇;脂肪醇(例如聚乙二醇(PEG));聚氧乙烯-9-月桂醚;表面活性脂肪酸(例如棕榈酸或油酸);脂肪酸;脂肪酸甘油单酯;脂肪酸甘油二酯;脂肪酸酰胺;脱水山梨糖醇三油酸酯(85)甘胆酸盐;脱水山梨糖醇单月桂酸酯(20);聚山梨醇酯20(20);聚山梨醇酯60(60);聚山梨醇酯65(65);聚山梨醇酯80(80);聚山梨醇酯85(85);聚氧乙烯单硬脂酸酯;表面活性素;泊洛沙姆;脱水山梨糖醇脂肪酸酯(例如脱水山梨糖醇三油酸酯);卵磷脂;溶血卵磷脂;磷脂酰丝氨酸;磷脂酰肌醇;鞘磷脂;磷脂酰乙醇胺(脑磷脂);心磷脂;磷脂酸;脑苷脂;双十六烷基磷酸酯;二棕榈酰磷脂酰甘油;硬脂酰胺;十二胺;十六胺;乙酰基棕榈酸酯(acetyl palmitate);蓖麻油酸甘油酯;十八烷酸十六烷基酯;肉豆蔻酸异丙酯;四丁酚醛(tyloxapol);聚(乙二醇)5000磷脂酰乙醇胺;聚(乙二醇)400-单硬脂酸酯;磷脂;具有高表面活性剂特性的合成的和/或天然的洗涤剂;脱氧胆酸酯;环糊精;离液序列高的盐;离子对试剂;以及它们的组合。两亲实体组分可以是不同两亲实体的混合物。本领域普通技术人员应认识到这是具有表面活性剂活性的物质的示例性的非详尽清单。任何两亲实体都可以在根据本发明使用的合成纳米载体的产生中使用。
在一些实施方案中,合成纳米载体可以任选地包含一种或多种碳水化合物。碳水化合物可以是天然的或合成的。碳水化合物可以是衍生的天然碳水化合物。在某些实施方案中,碳水化合物包括单糖或二糖,包括但不限于:葡萄糖、果糖、半乳糖、核糖、乳糖、蔗糖、麦芽糖、海藻糖、纤维二糖(cellbiose)、甘露糖、木糖、阿拉伯糖、葡糖醛酸、半乳糖醛酸(galactoronic acid)、甘露糖醛酸、葡糖胺、半乳糖胺、以及神经氨酸。在某些实施方案中,碳水化合物是一种多糖,包括但不限于普鲁兰糖、纤维素、微晶纤维素、羟丙基甲基纤维素(HPMC)、羟基纤维素(HC)、甲基纤维素(MC)、右旋糖酐、环糊精(cyclodextran)、糖原、淀粉、羟乙基淀粉、角叉菜胶、聚糖(glycon)、直链淀粉、壳聚糖、N,O-羧甲基壳聚糖、藻胶和海藻酸、淀粉、甲壳质、肝素、菊糖、魔芋、葡萄甘露聚糖(glucommannan)、石耳素、肝素、透明质酸、凝胶多糖、以及黄原胶。在多个实施方案中,本发明的合成纳米载体不包含(或确切地说排除)碳水化合物,如多糖。在某些实施方案中,碳水化合物可以包含碳水化合物衍生物,如糖醇,包括但不限于甘露糖醇、山梨糖醇、木糖醇、赤藻糖醇、麦芽糖醇以及乳糖醇。
根据本发明的组合物包含本发明的合成纳米载体以及药物学上可接受的赋形剂,如防腐剂、缓冲剂、盐水或磷酸盐缓冲盐水。可以使用常规的药物制造和配合技术制造这些组合物,以获得有用的剂型。在一个实施方案中,本发明的合成纳米载体与防腐剂一起悬浮在的注射用无菌盐水溶液中。
在多个实施方案中,当制备合成纳米载体作为疫苗中使用的试剂(例如,抗原或佐剂)的载体时,用于将试剂结合到合成纳米载体上的方法可能是有用的。当该试剂是一种小分子时,则有利的是在组装该合成纳米载体之前将该试剂附接到一种聚合物上。在多个实施方案中,在合成纳米载体的构建中,可能还有利的是制备具有表面基团的合成纳米载体,这些载体用于通过使用这些表面基团将该试剂结合到该合成纳米载体上而不是将该试剂附接到一种聚合物上并且然后使用这种聚合物结合物。可以使用各种各样的反应用于将试剂附接到合成纳米载体上的目的。
在某些实施方案中,该结合可以是一种共价连接物。在多个实施方案中,根据本发明的肽可以通过1,2,3-三唑连接物共价地结合到该外表面上,该连接物通过该纳米载体的表面上的叠氮基与含炔基团的抗原或佐剂的1,3-偶极环化加成反应或通过该纳米载体的表面上的炔与含叠氮基团的抗原或佐剂的1,3-偶极环化加成反应而形成。这样的环化加成反应优选在铜(I)催化剂以及适合的Cu(I)-配体和将Cu(II)化合物还原成催化活性的Cu(I)化合物的还原剂的存在下进行。这种Cu(I)催化的叠氮-炔环加成(CuAAC)也可以称为点击反应(click reaction)。
另外,共价结合可以包含共价连接物,它包含酰胺连接物、二硫基连接物、硫醚连接物、腙连接物、酰肼连接物、亚胺或肟连接物、脲或硫脲连接物、脒连接物、胺连接物以及磺酰胺连接物。
一种酰胺连接物通过在一个组分(例如抗原或佐剂)上的胺与一个第二组分(例如该纳米载体)的羧酸基团之间的酰胺键而形成。可以使用任何常规的形成酰胺键的反应用适当保护的氨基酸或抗原或佐剂以及活化的羧酸(例如,N-羟基丁二酰亚胺活化的酯)产生该连接物中的酰胺键。
通过在例如R1-S-S-R2形式的两个硫原子之间形成二硫键(S-S)产生二硫键连接物。可以通过含硫醇/巯基(-SH)的抗原或佐剂与聚合物或纳米载体上的另一个活化的硫醇基或通过含硫醇/巯基的纳米载体与含活化的硫醇基团的抗原或佐剂的硫醇基交换而形成二硫键。
三唑连接物,具体地可以是具有形式的1,2,3-三唑,其中R1和R2可以是任何化学实体,通过附接在第一组分(例如纳米载体)上的叠氮化物与附接在第二组分(例如肽)上的末端炔的1,3-偶极环化加成反应而制成。使用或不使用一种催化剂进行该1,3-偶极环化加成反应,优选地使用Cu(I)-催化剂,该催化剂将这两个组分通过1,2,3-三唑官能团连接。由Sharpless(夏普莱斯)等人,在《应用化学》(Angew.Chem.Int.Ed.),41(14),2596,(2002)和Meldal等人,在《化学综述》(Chem.Rev.),2008,108(8),2952-3015中详细说明了这一化学作用,并且这通常被称为“点击”反应或CuAAC。
在多个实施方案中,制备了在该聚合物链末端含有叠氮基或炔基的一种聚合物。这个聚合物然后用于制备一种合成纳米载体,其方式为将多个炔基或叠氮基定位到该纳米载体的表面上。可替代地,该合成纳米载体可以通过另一个途径制备,并且随后使用炔基或叠氮基官能化。在炔基(如果该聚合物含有叠氮化物)或叠氮基(如果该聚合物含有炔)的存在下制备该抗原或佐剂。然后使用或不使用一种催化剂允许该抗原或佐剂通过偶极1,3-环化加成反应与纳米载体进行反应,该催化剂通过1,4-二取代的l,2,3-三唑连接物将该抗原或佐剂共价结合到该颗粒上。
通过形成例如R1-S-R2形式的硫-碳(硫醚)键形成硫醚连接物。硫醚键可以通过一个组分(例如该抗原或佐剂)上的硫醇/巯基(-SH)基团与一个第二组分(例如纳米载体)上的烷基化基团(例如叠氮化物或环氧化物)的烷化作用制造。还可以通过一种组分(例如抗原或佐剂)上的硫醇/巯基的基团到一种第二组分(例如含有马来酰亚胺基团或乙烯砜基团的聚合物)上的缺电子烯基团(作为迈克尔受体)的迈克尔加成来形成硫醚连接物。以另一种方式,可以通过一个组分(例如该抗原或佐剂)上的硫醇/巯基基团与一个第二组分(例如聚合物或纳米载体)上的烯基团的激进的硫醇-烯反应(radical thiol-ene reaction)来制备硫醚连接物。
可以通过一个组分(例如该抗原或佐剂)上的酰肼基团与一个第二组分(例如纳米载体)上的醛/酮化学基团的反应来制造腙连接物。
可以通过一个组分(例如该抗原或佐剂)上的酰肼基团与一个第二组分(例如纳米载体)上的羧酸基团的反应来形成酰肼连接物。通常使用与形成酰氨键相似的化学作用来进行这样的反应,其中羧酸用一种活化试剂活化。
可以通过一个组分(例如该抗原或佐剂)上的胺或N-烷氧基胺(或胺氧基)基团与一个第二组分(例如纳米载体)上的醛或酮基团的反应来形成亚胺或肟连接物。
可以通过一个组分(例如该抗原或佐剂)上的胺基团与一个第二组分(例如纳米载体)上的异氰酸酯或硫代异氰酸酯基团的反应来制备脲或硫脲连接物。
可以通过一个组分(例如该抗原或佐剂)上的胺基团与一个第二组分(例如纳米载体)上的亚胺酸酯基团的反应来制备脒连接物。
可以通过一个组分(例如该抗原或佐剂)上的胺基团与一个第二组分(例如纳米载体)上的烷基化基团(例如卤化物、环氧化物或磺酸酯基团)的烷化反应来制造胺连接物。可替代地,还可以用一种适当的还原剂(例如,氰基硼氢化钠或三乙酰氧基硼氢化钠)通过一个组分(例如该抗原或佐剂)上的胺基团与一个第二组分(例如纳米载体)上的醛或酮基团的还原胺化来制造胺连接物。
可以通过一个组分(例如该抗原或佐剂)上的胺基团与一个第二组分(例如纳米载体)上的磺酰卤化物(例如磺酰氯)基团的反应来制造磺酰胺连接物。
通过一种亲核体到乙烯基砜上的迈克尔加成来制造砜连接物。乙烯基砜或亲核体可以在该纳米颗粒的表面上或附接到该抗原或佐剂上。
该抗原或佐剂还可以通过非共价结合方法而结合到该纳米载体上。例如,带负电荷的抗原或佐剂可以通过静电吸附而结合到带正电荷的纳米载体上。含金属配体的抗原或佐剂还可以通过金属-配体络合物而结合到含金属络合物的纳米载体上。
在多个实施方案中,抗原或佐剂可以在组装合成纳米载体之前附接到聚合物(例如聚乳酸聚乙二醇嵌段共聚物)上,或者该合成纳米载体在它的表面上可以形成有反应性或可活化基团。在后一情况下,可以制备抗原或佐剂以使其具有与由合成纳米载体的表面呈现的连接化学(attachment chemistry)相容的基团。在其他实施方案中,可以使用适合的连接物将试剂,例如肽抗原连接到VLP或脂质体上。连接物是能够将两个分子结合在一起的化合物或试剂。在一个实施方案中,连接物可以是同双功能或异双功能试剂,如在海尔曼森(Hermanson)2008中所述。例如,可以在EDC存在下用同双功能连接物己二酸二酰肼(ADH)处理表面上包含羧基的VLP或脂质体合成纳米载体,从而形成具有ADH连接物的相应的合成纳米载体。然后使生成的ADH连接的合成纳米载体经由NC上的ADH连接物的另一端与包含酸基的试剂结合,从而产生相应的VLP或脂质体肽缀合物(liposome peptide conjugate)。
关于可供使用的结合方法的详细说明,参见Hermanson(赫曼森)G T,“Bioconjugate Techniques”,第二版,由学术出版社(Academic Press)出版,2008。除了共价连接以外,可以通过吸附将抗原或佐剂结合到预先形成的合成纳米载体上或者它可以通过在形成该合成纳米载体的过程中进行封装而结合。
制造和使用本发明的方法和有关组合物的方法
可以使用本领域已知的多种多样的方法来制备合成纳米载体。例如,合成纳米载体可以由如以下的方法形成:纳米沉淀、使用流体通道的流动聚焦、喷雾干燥、单一和双重乳液溶剂蒸发、溶剂萃取、相分离、研磨、微乳液工序、微制造、纳米制造、牺牲层、单凝聚和复凝聚、以及本领域的普通技术人员熟知的其他方法。可替代地或另外地,已经描述了单分散半导体、传导性、磁性、有机以及其他纳米材料的水性和有机溶剂合成(普莱伊亚诺(Pellegrino)等人,2005,《微小》(Small),1:48;默瑞(Murray)等人,2000,《材料科学评论年报》(Ann.Rev.Mat.Sci.),30:545;以及特林达迪(Trindade)等人,2001,《化学材料》(Chem.Mat.),13:3843)。文献中已经描述了另外的方法(参见例如达保罗(Doubrow)编,“医学和药学中的微胶囊和纳米粒子(Microcapsules and Nanoparticles in Medicine and Pharmacy),”CRC出版社,博卡拉顿(Boca Raton),1992;马西威兹(Mathiowitz)等人,1987,《控释杂志》(J.Control.Release),5:13;马西威兹等人,1987,《反应性聚合物》(Reactive Polymers),6:275;以及马西威兹等人,1988,《应用聚合物科学杂志》(J.Appl.Polymer Sci.),35:755,并且参看美国专利5578325和6007845;保利赛利等人,“可以高效结合并且递送病毒样颗粒的表面修饰的基于PLGA的纳米颗粒(Surface-modified PLGA-based Nanoparticles that can Efficiently Associate and Deliver Virus-like Particles)”《纳米医学》(Nanomedicine).5(6):843-853(2010))。
可以如所希望地使用多种方法将不同的材料封装于合成纳米载体中,这些方法包括但不限于阿斯特提(C.Astete)等人,“PLGA纳米颗粒的合成和表征(Synthesis and characterization of PLGA nanoparticles)”《生物材料杂志聚合物辑》(J.Biomater.Sci.Polymer Edn),第17卷,第3期,第247-289页(2006);阿沟司达奇斯(K.Avgoustakis)“聚乙二醇化聚(丙交酯)与聚(丙交酯乙交酯)共聚物纳米颗粒:制备、特性以及在药物递送中的可能的应用(Pegylated Poly(Lactide)and Poly(Lactide-Co-Glycolide)Nanoparticles:Preparation,Properties and Possible Applications in Drug Delivery)”《当代药物传输》(Current Drug Delivery)1:321-333(2004);瑞斯(C.Reis)等人,“纳米封装I.用于制备药物负载的聚合物纳米颗粒的方法(Nanoencapsulation I.Methods for preparation of drug-loaded polymeric nanoparticles)”《纳米医学》2:8-21(2006);保利赛利等人,“可以高效结合并且递送病毒样颗粒的表面修饰的基于PLGA的纳米颗粒”《纳米医学》.5(6):843-853(2010)。可以使用适合用于将物质(例如寡核苷酸)封装在合成纳米载体中的其他方法,包括但不限于在安格(Unger)的美国专利6,632,671(2003年10月14日)中披露的方法。
在某些实施方案中,通过纳米沉淀方法或喷雾干燥来制备合成纳米载体。可以改变在制备合成纳米载体中使用的条件来产生具有所希望的大小或特性(例如疏水性、亲水性、外部形态学、“粘性”、形状,等等)的颗粒。制备合成纳米载体的方法和使用的条件(例如溶剂、温度、浓度、空气流速等)可以取决于有待结合到合成纳米载体上的物质和/或该聚合物基质的构成。
如果通过任何以上方法制备的颗粒具有在所希望的范围以外的大小的范围,则可以例如使用一个筛来确定这些颗粒的大小。
本发明的合成纳米载体的要素,如靶向部分、聚合物基质、抗原、佐剂等等,可以例如通过一个或多个共价键结合到合成纳米载体上或可以借助一个或多个连接物结合。使合成纳米载体功能化的另外的方法可以由以下文献改编而来:萨尔茨曼(Saltzman)等人的公开的美国专利申请2006/0002852、德西蒙(DeSimone)等人的公开的美国专利申请2009/0028910、或默蒂(Murthy)等人的公开的国际专利申请案WO/2008/127532 A1。
可替代地或另外地,合成纳米载体可以直接或间接地经由非共价相互作用结合到一个要素(如免疫特征表面、靶向部分、佐剂、不同的抗原等)上。在非共价的实施方案中,通过非共价相互作用介导非共价结合,这些非共价相互作用包括但不限于:电荷相互作用、亲和相互作用、金属配位作用、物理吸附、主-客体相互作用、疏水相互作用、TT堆积相互作用、氢键相互作用、范德华相互作用、磁相互作用、静电相互作用、偶极-偶极相互作用、和/或它们的组合。这样的结合可以安排在一种本发明的合成纳米载体的一个外表面或一个内表面上。在多个实施方案中,封装和/或吸收是结合的一种形式。
在多个实施方案中,本发明的合成纳米载体可以通过混合在同一载体或递送系统中与其他佐剂组合。这样的佐剂可以包括但不限于矿物盐,如明矾,与肠道细菌(例如大肠杆菌、明尼苏达沙门菌、鼠伤寒沙门菌、或弗氏志贺菌)的单磷酰脂质(MPL)A结合的明矾或分别与(AS04)、以上提到的细菌的MPLA特异性结合的明矾)、皂苷(如QS-21、Quil-A、ISCOMs、ISCOMATRIXTM)、乳液(如MF59TM、ISA 51和ISA 720)、AS02(QS21+角鲨烯+)、脂质体和脂质体配制品(如AS01)、AS15、合成的或特别制备的微粒和微载体(如淋病奈瑟球菌(N.gonorrheae)、沙眼衣原体和其他细菌的源于细菌的外膜泡(OMV))、或壳聚糖颗粒、储存形成剂(depot-forming agent)(如嵌段共聚物)、特异性修饰或制备的肽(如胞壁酰二肽)、氨基烷基氨基葡糖苷4-磷酸酯(如RC529)、或蛋白质(如细菌类毒素或毒素片段)。另外的有用的佐剂可以在以下文献中找到:WO 2002/032450;US 7,357,936“Adiuvant Systems and Vaccines(佐剂系统和疫苗)”;US 7,147,862“Vaccine composition containing adjuvants(含佐剂的疫苗组合物)”;US 6,544,518“Vaccines”;US 5,750,110“Vaccine composition containing adjuvants(含佐剂的疫苗组合物)”。可以使用常规剂量范围研究来确定其他类似佐剂的剂量。在多个实施方案中,未结合到所列举的合成纳米载体上的佐剂(如果有的话)可以是与结合到该合成纳米载体上的佐剂相同或不同的。
在多个实施方案中,结合到本发明的合成纳米载体上的任何佐剂可以是与未结合到该合成纳米载体上的那些不同的、相似的或相同的(具有或没有抗原,使用或不使用另一种递送载体)。这些佐剂(结合的以及未结合的)可以分别在不同时间点和/或在不同身体部位和/或通过不同的免疫路径给予,或与带佐剂的合成纳米载体(具有或没有抗原)分别在不同时间点和/或在不同身体部位和/或通过不同的免疫路径给予。
可以使用传统的药物混合方法使合成纳米载体的群体结合以形成根据本发明的剂型。这些方法包括液体-液体混合,其中两种或更多种各自含有一个或多个纳米载体子集的悬浮液被直接合并或经由一个或多个含有稀释剂的容器而集合在一起。因为合成纳米载体还可以用粉末形式生产或储存,可以执行干燥的粉末-粉末混合,因为可以将两种或更多种粉末再悬浮于普通介质中。取决于纳米载体的特性和它们的相互作用势,可以存在赋予给一种或另一种混合途径的优点。
在本发明的方法中使用的包含合成纳米载体的典型的本发明的组合物可以包括无机或有机缓冲剂(例如磷酸、碳酸、乙酸、或柠檬酸的钠盐或钾盐)和pH调节剂(例如盐酸、氢氧化钠或氢氧化钾、柠檬酸或乙酸的盐、氨基酸和它们的盐)、抗氧化剂(例如抗坏血酸、α-生育酚)、表面活性剂(例如聚山梨醇酯20、聚山梨醇酯80、聚氧乙烯9-10壬基酚、去氧胆酸钠)、溶液和/或低温/冻干稳定剂(例如蔗糖、乳糖、甘露醇、海藻糖)、渗透调节剂(例如盐类或糖类)、抗细菌剂(例如苯甲酸、苯酚、庆大霉素)、消泡剂(例如聚二甲基硅酮(polydimethylsilozone))、防腐剂(例如硫柳汞、2-苯氧乙醇、EDTA)、聚合物稳定剂和粘度调节剂(例如聚乙烯吡咯酮、泊洛沙姆488、羧甲基纤维素)、以及共溶剂(例如甘油、聚乙二醇、乙醇)。
可以在根据本发明的方法中使用的组合物包含与药学上可接受的赋形剂结合的本发明的合成纳米载体。可以使用常规的药物制造和配合技术制作这些组合物,以获得有用的剂型。适合用于实践本发明的技术可以在《工业混合手册:科学和实践》(Handbook of Industrial Mixing:Science and Practice),由爱德华L.保罗(Edward L.Paul),维克多A.阿蒂莫-奥本格(Victor A.Atiemo-Obeng)以及苏珊妮M.克里斯塔(Suzanne M.Kresta)编,2004约翰威利父子公司;和《制药学:剂型设计科学》(Pharmaceutics:The Science of Dosage Form Design),第2版由奥顿(M.E.Auten)编,2001,邱吉尔利文斯通公司(Churchill Livingstone)中找到。在一个实施方案中,本发明的合成纳米载体与防腐剂一起悬浮在的注射用无菌盐水溶液中。
应当理解的是,可以用任何适合的方式制造在本发明的方法中可以使用的组合物,并且本发明决不限于可以使用在此说明的方法生产的组合物的用途。适当的方法的选择可能需要注意相结合的特定部分的特性。
在一些实施方案中,本发明的合成纳米载体是在无菌条件下制造并且最后杀菌的。这可以确保生成的组合物是无菌的并且是非感染性的,因此当与非无菌组合物相比时,提高了安全性。这提供了有价值的安全措施,特别是当接受合成纳米载体的受试者具有免疫缺陷、正在遭受感染,和/或对感染敏感时。在一些实施方案中,取决于配制策略,本发明的合成纳米载体可以冻干并且储存在悬浮液中或呈冻干粉末形式历经较长时间而无活性损失。
在本发明的方法中可以使用的这些组合物可以通过多种给药途径来给予,包括但不限于皮下、肌内、真皮内、口服、鼻内、经粘膜、舌下、直肠、眼用、透皮、经皮或通过这些途径的组合。
根据本发明,剂型的剂量含有不同量的的合成纳米载体群和/或不同量的佐剂和/或抗原。存在于本发明的剂型中的合成纳米载体和/或佐剂和/或抗原的量可以根据佐剂和/或抗原的性质、待实现的治疗益处以及其他此类参数而变化。在一些实施方案中,这些剂型的剂量是亚治疗剂量或毒性降低的剂量。在其他的实施方案中,这些剂量是有效地产生一个或多个如在此提供的免疫应答的量。在一些实施方案中,该一种或多种免疫响应是一种抗体应答或一种抗体滴度和/或全身性细胞因子释放的产生。在多个实施方案中,可以进行剂量范围研究以确立将存在于剂型中的合成纳米载体群的最佳治疗量和/或佐剂和/或抗原的量。在多个实施方案中,存在于剂型中的合成纳米载体和/或佐剂和/或抗原的量是在给予一位受试者时有效地产生如在此提供的一种免疫应答的量。在一些实施方案中,该受试者是人类。有可能使用常规剂量范围研究和技术来确定在受试者中有效产生如在此提供的免疫应答的佐剂和/或抗原的量。可以按多种频率给予本发明的剂型。在一个优选的实施方案中,至少一次给予该剂型足以产生药理学有关的应答。在更优选的实施方案中,利用剂型的至少两次给予、至少三次给予或至少四次给予来确保药理学有关的应答。
在此说明的组合物和方法可以用来诱导、增强、刺激、调节、指导或更改免疫应答。在此说明的组合物和方法可以用于诊断、预防和/或治疗多种病症,如癌症、感染性疾病、代谢性疾病、退行性疾病、自身免疫性疾病、炎性疾病、免疫性疾病、或其他失调和/或病症。在此说明的组合物和方法还可以用于预防或治疗成瘾,如尼古丁或麻醉药成瘾。在此说明的组合物和方法还可以用于预防和/或治疗由于暴露于毒素、有害物质、环境毒素、或其他有害介质而导致的病症。
在多个实施方案中,在此提供的组合物和方法可以用来全身性地诱导细胞因子,如TNF-α、IL-6和/或IL-12,或IFN-γ、IL-12和/或IL-18。在其他实施方案中,在此提供的组合物和方法可以用于诱导一种抗体应答或产生一个抗体滴度。在此提供的免疫应答对于一种抗原(如在此提供的任何一种抗原)可以是特异性的,优选地在本发明中的或根据本发明的在此提供的方法给予的一种或多种抗原。
在此提供的这些组合物和方法可以用于多种受试者中。在此提供的受试者可以患有癌症或具有患癌症的风险。癌症包括但不限于乳腺癌;胆道癌;膀胱癌;脑癌,包括胶质母细胞瘤和髓母细胞瘤;宫颈癌;绒毛膜癌;结肠癌;子宫内膜癌;食道管癌;胃癌;血液肿瘤,包括急性淋巴细胞性和髓性白血病,例如B细胞CLL;T细胞急性淋巴母细胞白血病/淋巴瘤;多毛细胞白血病;慢性髓性白血病、多发性骨髓瘤;AIDS相关白血病和成人T细胞白血病/淋巴瘤;上皮内肿瘤,包括博文病(Bowen’s disease)和佩吉特病(Paget’s disease);肝癌;肺癌;淋巴瘤,包括霍奇金病(Hodgkin’s disease)和淋巴细胞性淋巴瘤;神经母细胞瘤;口腔癌,包括鳞状细胞癌瘤;卵巢癌,包括从上皮细胞、基质细胞、生殖细胞以及间充质细胞产生的那些;胰腺癌;前列腺癌;直肠癌;肉瘤,包括平滑肌肉瘤、横纹肌肉瘤、脂肪肉瘤、纤维肉瘤以及骨肉瘤);皮肤癌,包括黑色素瘤、梅克尔细胞癌(Merkel cell carcinoma)、卡波西肉瘤(Kaposi’s sarcoma)、基底细胞癌以及鳞状细胞癌;睾丸癌,包括生殖细胞瘤,如精原细胞瘤、非精原细胞瘤(畸胎瘤、绒毛膜癌)、基质肿瘤以及生殖细胞肿瘤;甲状腺癌,包括甲状腺腺癌和髓样癌;以及肾癌,包括腺癌和肾母细胞瘤(Wilms tumor)。
在此提供的受试者可能患有感染或感染性疾病或具有患感染或感染性疾病的风险。感染或感染性疾病包括但不限于病毒性感染性疾病,如AIDS、禽痘(水痘)、普通感冒、巨细胞病毒感染、科罗拉多蜱传热、登革热、埃博拉出血热、手足口病、肝炎、单纯疱疹、带状疱疹、HPV、流形性感冒(Flu)、拉沙热、麻疹、马尔堡出血热、传染性单核细胞增多症、腮腺炎、诺如病毒(Norovirus)感染、脊髓灰质炎、进行性多灶性脑白质病、狂犬病、风疹、SARS、天花(痘症)、病毒性脑炎、病毒性胃肠炎、病毒性脑膜炎、病毒性肺炎、西尼罗病以及黄热病;细菌性感染性疾病,如炭疽、细菌性脑膜炎、肉毒中毒、布鲁菌病、弯曲菌病、猫抓病、霍乱、白喉、流行性斑疹伤寒、淋病、脓疱病、军团病、麻疯病(汉森病)、钩端螺旋体病、李斯特菌病、莱姆病、类鼻疽、风湿热、MRSA感染、诺卡菌病、百日咳(Pertussis/Whooping Cough)、瘟疫、肺炎球菌肺炎、鹦鹉热、Q热、落矶山斑疹热(RMSF)、沙门菌病、猩红热、志贺氏菌病、梅毒、破伤风、沙眼、结核病、土拉菌病、伤寒、斑疹伤寒以及尿路感染;寄生虫感染性疾病,如非洲锥虫病、阿米巴病、蛔虫病、巴贝虫病、恰加斯病、华支睾吸虫病、隐孢子虫病、囊虫病、裂头绦虫病、龙线虫病、棘球蚴病、蛲虫病、片形吸虫病、姜片虫病、丝虫病、自由生活阿米巴感染(Free-living amebic infection)、贾第虫病、颚口线虫病、膜壳绦虫病、等孢子球虫病、黑热病、利什曼病、疟疾、后殖吸虫病、蝇蛆病、盘尾丝虫病、虱病、蛲虫感染、疥疮、血吸虫病、绦虫病、弓蛔虫病、弓形体病、旋毛虫病(Trichinellosis/Trichinosis)、鞭虫病、滴虫病以及锥虫病;真菌感染性疾病,如曲霉菌病、芽生菌病、念珠菌病、球孢子菌病、隐球菌病、组织胞浆菌病、足癣(脚气)以及股癣;朊病毒感染性疾病,如阿尔珀斯病、致死性家族性失眠症、杰茨曼-斯脱司勒-史茵克综合征(Gerstmann--Scheinker syndrome)、库鲁病以及变异型克罗伊茨费尔特-雅各布病(Variant Creutzfeldt-Jakob disease)。
在此提供的受试者包括患有特应性疾病或具有患特应性疾病的风险的那些:例如但不限于过敏症、过敏性哮喘、或特应性皮炎;哮喘;慢性阻塞性肺病(COPD,例如肺气肿或慢性支气管炎);以及由于慢性传染因子引起的慢性感染(例如慢性利什曼病、念珠菌病或血吸虫病),以及由疟原虫、鼠弓形体、分枝杆菌、HIV、HBV、HCV EBV或CMV、或以上的任何一种、或以上的任何亚类引起的感染。
实例
实例1:具有共价结合的佐剂的合成纳米载体(预示的)
根据Gerster(盖斯特)等人的美国专利5,389,640的实例99中提供的合成,合成了瑞喹莫德(aka R848)。制备了PLA-R848结合物。制备了PLA-PEG-尼古丁结合物。通过使用D,L-丙交酯(MW=大约15KD-18KD)的开环聚合制备了PLA。通过NMR证实了PLA结构。从VWR科技产品公司(VWR scientific)购买聚乙烯醇(Mw=11KD-31KD,85%水解)。
这些用来制备以下溶液:
1.在二氯甲烷中的PLA-R848结合物,为100mg/mL
2.在二氯甲烷中的PLA-PEG-尼古丁,为100mg/mL
3.在二氯甲烷中的PLA,为100mg/mL
4.在水中的聚乙烯醇,为50mg/mL。
将溶液#1(0.25mL至0.75mL)、溶液#2(0.25mL)和溶液#3(0.25mL至0.5mL)合并在具有蒸馏水(0.5mL)的小的管形瓶中,并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒。向这一乳液添加溶液#4(2.0mL),并且使用一台Branson(布兰森)数字超声波仪250以35%振幅将其超声处理40秒,形成了第二乳液。将这一乳液添加至一个含有磷酸盐缓冲溶液(30mL)的烧杯中,并且在室温下搅拌这一混合物2小时以形成纳米载体。为了洗涤这些纳米载体,将一部分纳米载体分散体(7.0mL)转移至一个离心管中,并且在5,300g旋转一小时,除去上清液,并且将沉淀再悬浮在7.0mL的磷酸盐缓冲盐水中。重复该离心步骤,并且将沉淀再悬浮在2.2mL的磷酸盐缓冲盐水中,获得具有大约10mg/mL的最终纳米载体分散体。
实例2:具有非共价结合的佐剂的合成纳米载体(预示的)
如下制造带电荷的纳米载体:
1.在二氯甲烷中的PLA-PEG-OMe,为100mg/mL
2.在二氯甲烷中的PLA,为100mg/mL
3.在水中5mg/mL的十六烷基三甲基溴化铵
将溶液#1(0.25mL至0.75mL)、溶液#2(0.25mL)和蒸馏水(0.5mL)合并在小的管形瓶中,并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒。向这一乳液添加溶液#3(2.0mL),并且使用一台Branson(布兰森)数字超声波仪250以35%振幅将其超声处理40秒,形成了第二乳液。将这一乳液添加至一个含有磷酸盐缓冲溶液(30mL)的烧杯中,并且在室温下搅拌这一混合物2小时以形成纳米载体。为了洗涤这些纳米载体,将一部分纳米载体分散体(7.0mL)转移至一个离心管中,并且在5,300g旋转一小时,除去上清液,并且将沉淀再悬浮在7.0mL的磷酸盐缓冲盐水中。重复该离心步骤,并且将沉淀再悬浮在2.2mL的DI水中,以获得具有大约10mg/mL的最终纳米颗粒分散体。在这种情况下,为了将一种抗原CpG DNA吸附到纳米载体上,将1.0mL的在DI水中的带电荷的纳米载体(为10mg/mL)在冰上进行冷却。向这种冷却的悬浮液中加入10μg的CpG DNA ODN 1826,并且将该混合物在4℃下孵育4小时。然后将这些纳米载体分离出并且如以上描述的进行洗涤。
实例3:具有合成纳米载体和未结合抗原的组合物(预示的)
从JT Baker购买聚乙烯醇(Mw=11KD-31KD,87%-89%部分水解)。从Bachem Americas公司(柏市街3132号,托伦斯,加利福尼亚州,90505。产品代码4065609(3132Kashiwa Street,Torrance CA 90505.Part#4065609))获得卵清蛋白肽323-339。合成并且纯化PLGA-R848(或PLA-R848)和PLA-PEG-抗原或PLA-PEG-连接物或PLA-PEG-Ome结合物。
以上材料用来制备以下溶液:
1.在二氯甲烷中的PLA-R848或PLGA-R848,为100mg/mL
2.在二氯甲烷中的PLA-PEG-OMe,为100mg/mL
3.在二氯甲烷中的PLA或PLGA,为100mg/mL
4.在100mM的pH 8的磷酸盐缓冲液中的聚乙烯醇,为50mg/mL
将溶液#1(0.1至0.9mL)和溶液#2(0.01至0.50mL)合并,任选地包含溶液#3(0.1至0.89mL),并且将蒸馏水(0.50mL)加入到小的管形瓶中,并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒。向这一乳液添加溶液#4(2.0-3.0mL),并且使用一台Branson(布兰森)数字超声波仪250以30%振幅将其超声处理40秒,形成了第二乳液。将这一乳液添加至一个含有70mM的pH 8的磷酸盐缓冲溶液(30mL)的搅拌烧杯中,并且在室温下将这一混合物搅拌2小时以形成纳米载体。为了洗涤这些纳米载体,将一部分纳米载体分散体(25至32mL)转移至一个50mL离心管中,并且以9500rpm(13,800g)在4℃下旋转一小时,除去上清液,并且将沉淀再悬浮在25至32mL的磷酸盐缓冲盐水中。重复该离心步骤,并且将沉淀再悬浮在磷酸盐缓冲盐水中,以获得具有大约10mg/mL的最终标称纳米载体浓度。
将这些纳米载体使用必要量的无菌生理盐水合并以达到在无菌载体中的终浓度,并且然后使用常规的滑动-尖端(slip-tip)或鲁尔锁紧套口(Luer-lock)注射器经皮下或肌内注射给予受试者。
实例4:合成纳米载体和非联合给予抗原的给药(预示的)
将实例3的这些纳米载体配制到一种无菌生理盐水载体中,并且然后使用常规的滑动-尖端(slip-tip)或鲁尔锁紧套口(Luer-lock)注射器经皮下或肌内注射给予受试者。将受试者暴露于环境抗原(例如,花粉、动物抗原、等等)中,该环境抗原不与该合成纳米载体联合给予。记录下由于给予合成纳米载体引起的对于非联合给予的抗原的任何改变的免疫应答。
实例5:具有共价结合佐剂的合成纳米载体
病毒样颗粒(VLP)作为用于疫苗中的纳米载体并且用于药物递送已经受到重视。这些病毒样颗粒还可以用来递送共价连接的佐剂。可以通过多种方法制造病毒样颗粒,例如如在Biotechnology and Bioengineering《生物技术和生物工程》100(1),28,(2008)中描述的。共价连接可以如下实现:
将在PBS中的病毒样颗粒的悬浮液(1.0mL,300μg/mL)在冰上冷却。对此加入在PBS(0.5mL)中的R-848结合物(50mg,如以下描述的)。加入EDC盐酸盐(50mg)并且将该混合物在冰温下轻轻搅拌过夜。通过透析,生成的VLP结合物不合过量的R848结合物。
R848结合物如下制造。将R848(5.0gm,1.59X10-2摩尔)与二甘醇酸酐(3.7gm,3.18X10-2摩尔)在二甲基乙酰胺(10mL)中合并。将该溶液在120℃下加热2小时。轻微冷却之后,加入2-丙醇(25mL),并且将生成的溶液在冰上搅拌1小时。酰亚胺作为白色固体分离出,将其通过过滤分离,用2-丙醇洗涤并且干燥。R848酰亚胺的产量是6.45gm(98%)。
将R848酰亚胺(412mg,1.0X10-3摩尔)和6-羟基己酸(132mg,1.0X10-3摩尔)在二氯甲烷(5mL)中搅拌。向该悬浮液中添加1,5,7-三氮杂二环[4,4,0]癸-5-烯(TBD,278mg,2X10-3摩尔),之后将悬浮液在室温下搅拌过夜。将生成的澄清溶液用二氯甲烷(25mL)稀释,并且将该溶液用5%的柠檬酸溶液(2X25mL)洗涤。在用硫酸镁干燥之后,将该溶液过滤并且在真空下蒸发,以提供在VLP-抗原合成中使用的R848结合物。预期的R848结合物结构如下:
实例6:纳米载体结合到R848佐剂上取消了全身性炎性细胞因子产生
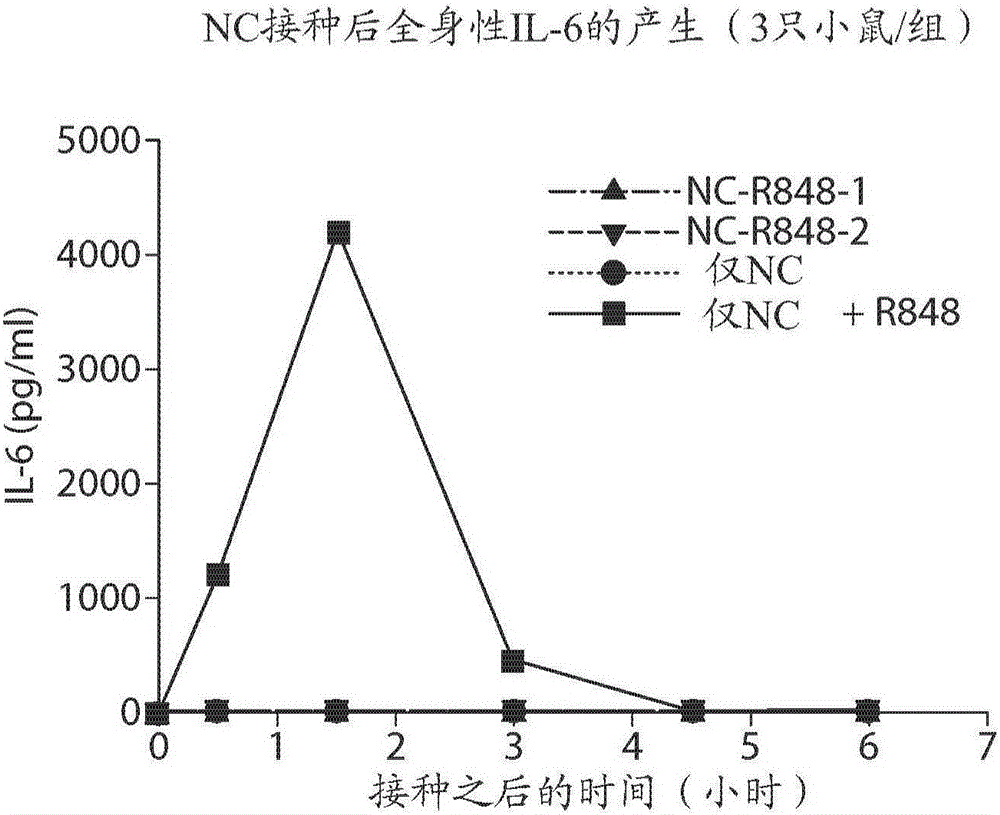
对多个组的小鼠向后肢中皮下注射100μg的与小分子核苷类似物以及已知的TLR7/8激动剂和佐剂R848结合的、非结合的或混合的纳米载体(NC)。纳米载体中的R848的量是2%-3%,导致每次注射2-3μg的结合的R848;所使用的游离R848的量是每次注射20μg。通过末端放血(terminal bleed)获取小鼠血清并且在不同的时间点通过ELISA(BD生物科学)测量了在血清中的全身性细胞因子产生。如在图1A-1C中可见,当使用混合的R848(NC+R848)时,观察到强的全身性主要促炎细胞因子TNF-α、IL-6和IL-12的产生,而当使用两个单独的结合R848的NC(NC-R848-1和NC-R848-2)制剂时,没有检测到TNF-α、IL-6和IL-12的表达。峰值细胞因子表达水平的差对于TNF-α和IL-6是大于100倍,并且对于IL-12是大于50倍。没有结合到R848上的NC(标记为仅NC)在不与R848混合使用时未诱导任何全身性细胞因子。
实例7:纳米载体结合到R848佐剂上未抑制全身性免疫细胞因子IFN-γ的产生
虽然早期促炎细胞因子与免疫过程中的副作用相关,已知其他细胞因子(例如免疫IFN-γ)的产生对于诱导有效的免疫应答是重要的。因此,与实例6相同地进行一个实验。免疫细胞因子IFN-γ的全身性产生(如通过ELISA,BD生物科学在小鼠血清中测量的)对Th1免疫应答起作用,并且被发现达到了相同的水平,无论是否使用NC-R848(含2μg的R848)或与R848混合的NC(20μg)(图2)。而且,由NP-R848产生IFN-γ在更宽的时间窗口上分布。
实例8:通过佐剂R848和CpG的全身性IL-12产生被它们结合到纳米载体上而取消。
证明了通过将TLR激动剂结合到纳米载体上对全身性细胞因子诱导的作用对于特定TLR激动剂不是特异性的。在这个实验中,对两只小鼠的组接种游离TLR激动剂R848或CpG 1826(各20μg)以及结合到纳米载体上的相同分子,NC-R848(100μg的NC制品,含有总计3μg的R848)或NC-CpG(100μg的NC制品,含有总计5μg的CpG 1826)并且在指示的不同时间测量了在汇集的小鼠血清中的血清IL-12(ELISA,BD科学)。如在图3中所见,全身性IL-12的峰值水平对于游离R848而言比NC-R848高30倍,并且对于游离CpG 1826而言比NC-CpG高20倍。
实例9:通过佐剂结合到纳米载体上大大增进了免疫细胞因子IFN-γ、IL-12和IL-1β的局部诱导,而节省了佐剂
虽然全身性促炎细胞因子诱导与疫苗接种的不利作用相关,免疫细胞因子(例如FN-γ或IL-1β)的局部诱导被视为对于特异性的并且局部的免疫应答的诱导是最有益的。在图4所示的实验中,对小鼠在后肢皮下注射游离的(20μg)的NC-结合的R848以及CpG佐剂(佐剂含量2.5-4μg),在指定的时间移除引流(腘)淋巴结(LN),在标准细胞培养基中孵育过夜并且通过如以上描述的ELISA测量细胞上清液中的细胞因子产生。当使用NC-R848时,与游离R848相比(值得注意的是,在NC-R848中存在的R848的量比游离R848的小5-10倍),观察到强得多的Thl细胞因子IFN-γ(50-100-倍,图4A)和IL-12(17-倍,图4B)以及炎性体相关IL-1β(6-倍,图4C)的局部诱导。同样地,NC-CpG是比游离CpG(已知在这一点上是极其有效的)强得多的局部免疫细胞因子诱导物。局部IFN-γ产生比峰值水平高7-15倍(图4A),IL-12的产生高4倍(图4B),并且IL-1β的产生高2倍(图4C)。存在于NC-CpG中的CpG 1826的量比游离CpG 1826低4-5倍。
实例10:通过NC-结合的R848佐剂而非游离R848的局部淋巴结(LN)刺激以及免疫细胞增殖的诱导
引流淋巴结肿胀(淋巴结病)时一种局部免疫激活的标志。它是由于被不同的细胞浸润的LN浸润引起的,这些细胞对于先天和适应性免疫应答起作用。如以上描述的对小鼠在后肢中皮下接种NC-R848、仅NC或NC-R848。在指示的时间移除腘LN(图5),并且计数总的细胞以及单独的免疫细胞群的数目。对于总的细胞数使用血细胞计数器,并且然后对于细胞群通过表面细胞标记物区别地染色并且使用FACS确定每个群的阳性百分比。DC:树突细胞,mDC:髓系DC,pDC:浆细胞样DC,Mph:巨噬细胞,Gr:粒细胞,B:B细胞,T:T细胞,NK:自然杀伤细胞。以下标记物用于染色:CD11c+(DC);CD11c+B220-(mDC);CD11c+B220+(pDC);F4/80+/Gr1-(Mph);F4/80-/Gr1+(Gr);B220+CDllc-(B细胞);CD3+(T细胞);CD3-/CD49b+(NK细胞)。在用NC-R848注射之后看到在引流LN中的总细胞数大大增加,其中DC、粒细胞、B细胞以及NK细胞显示出最显著的作用(图5)。
实例11:对于结合有佐剂的纳米载体对比混合的佐剂的更高的抗体应答
用于Nic、R848、OP-II纳米载体配制品的材料
从Bachem Americas公司(柏市街3132号,托伦斯,加利福尼亚州,90505.产品代码4064565)购买卵清蛋白肽323-339酰胺TFA盐。从勃林格殷格翰公司(B0ehringer IngeIheim)(德国殷格翰,产品代码R202H)购买具有0.19dL/g的固有粘度的PLA。通过开环过程合成具有大约2500Da的分子量以及按重量计大约13.6%的R848含量的PLA-R848结合物。合成了具有大约3,500Da的尼古丁封端的PEG嵌段以及大约15,000Da的DL-PLA嵌段的PLA-PEG-尼古丁。从JT Baker(区域编号U232-08)购买聚乙烯醇(Mw=11,000-31,000,87%-89%水解的)。
用于Nic,R848,OP-II纳米载体生产的方法
多种溶液制备如下:
溶液1:在室温下制备了在蒸馏水中的卵清蛋白肽323-339,为69mg/mL。
溶液2:通过将聚合物以100mg/mL溶解,以2∶1的比率合并PLA-R848和PLA溶液,并且然后将1份的PLA-PEG-尼古丁溶液加入到3份的PLA-R848/PLA溶液中制备了在二氯甲烷中的50mg/mL的PLA-R848、25mg/mL的PLA、和25mg/mL的PLA-PEG-尼古丁。
溶液3:在100mM去离子水中的聚乙烯醇,为50mg/mL。
溶液4:70mM磷酸盐缓冲液,pH 8。
使用溶液1和溶液2首先产生一种初级(W1/O)乳液。将溶液1(0.1mL)和溶液2(1.0mL)在小的玻璃压力管中合并并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒。然后通过向该初级乳液添加溶液3(2.0mL),并且使用一台Branson(布兰森)数字超声波仪250以35%振幅将其超声处理40秒,形成一种二级(W1/O/W2)乳液。将该二级乳液添加到在一个50ml的开放的烧杯中的含70mM磷酸盐缓冲溶液(30mL)的烧杯中并且在室温下搅拌2小时以允许二氯甲烷蒸发并且在悬浮液中形成纳米载体。对于一部分的该悬浮的纳米载体通过以下过程洗涤:将该纳米载体悬浮液转移到一个离心管中,在5,300rcf下旋转60分钟,除去上清液,并且将沉淀再悬浮在磷酸盐缓冲盐水中。重复该洗涤步骤,并且将沉淀再悬浮在磷酸盐缓冲盐水中,以获得基于聚合物具有10mg/mL的标称浓度的纳米载体悬浮液。将该悬浮液在-20℃下冷冻储存直至使用。
表1:Nic,R848,OP-II纳米载体的表征
用于Nic,,OP-II纳米载体配制品的材料
从Bachem Americas公司(柏市街3132号,托伦斯,加利福尼亚州,90505.产品代码4064565)购买卵清蛋白肽323-339酰胺TFA盐。从勃林格殷格翰公司(Boehringer Ingelheim)(德国殷格翰,产品代码R202H)购买具有0.19dL/g的固有粘度的PLA。合成了具有大约3,500Da的尼古丁封端的PEG嵌段以及大约15,000Da的DL-PLA嵌段的PLA-PEG-尼古丁。从JT Baker(区域编号U232-08)购买聚乙烯醇(MW=11,000-31,000,87%-89%水解的)。
用于Nic,,OP-II纳米载体生产的方法
多种溶液制备如下:
溶液1:在室温下制备了在0.13N盐酸中的卵清蛋白肽323-339,为69mg/mL。
溶液2:通过将聚合物PLA(为100mg/mL)溶解在二氯甲烷中以及将PLA-PEG-尼古丁(为100mg/mL)溶解在二氯甲烷中,并且然后将3份的PLA溶液合并到1份的PLA-PEG-尼古丁溶液中制备了在二氯甲烷中的75mg/mL的PLA和25mg/mL的PLA-PEG-尼古丁。
溶液3:在100mM去离子水中的聚乙烯醇,为50mg/mL。
溶液4:70mM磷酸盐缓冲液,pH 8。
使用溶液1和溶液2首先产生了初级(W1/O)乳液。将溶液1(0.1mL)和溶液2(1.0mL)在小的玻璃压力管中合并并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒。然后通过向该初级乳液添加溶液3(2.0mL),并且使用一台Branson(布兰森)数字超声波仪250以35%振幅将其超声处理40秒,形成一种二级(W1/O/W2)乳液。将该二级乳液添加到在一个50ml的开放的烧杯中的含70mM磷酸盐缓冲溶液(30mL)的烧杯中并且在室温下搅拌2小时以允许二氯甲烷蒸发并且在悬浮液中形成纳米载体。对于一部分的该悬浮的纳米载体通过以下过程洗涤:将该纳米载体悬浮液转移到一个离心管中,在5300rcf下旋转60分钟,除去上清液,并且将沉淀再悬浮在磷酸盐缓冲盐水中。重复该洗涤步骤,并且将沉淀再悬浮在磷酸盐缓冲盐水中,以获得基于聚合物具有10mg/mL的标称浓度的纳米载体悬浮液。将该悬浮液在-20℃下冷冻储存直至使用。
表2:纳米载体表征
结果
用含有表面的尼古丁和T辅助细胞肽OP-II的NC(有或没有R848)免疫的小鼠中的抗尼古丁抗体滴度(5只动物/组;皮下,100μg的NC/每次注射,以4周间隔3次)。在第一次免疫后第26和40天的滴度(针对聚赖氨酸-尼古丁的ELISA)。组1:用NP[Nic,R848,OP-II](3.1%的NC结合的R848)免疫;组2:用混合有20μg的游离R848的NP[Nic,,OP-II](没有结合到NC上的R848)免疫。
这些结果证明,R848结合到NC上比使用与不含R848的NC混合的游离R848导致更强的佐剂效应。当使用相同量的两种NC用于动物免疫时,一种含表面尼古丁、T辅助肽OP-II以及R848(NC[Nic,R848,OP-II]),并且另一种含相同的成分但是没有R848([NC[Nic,,OP-II]),与NC结合的R848的量相比,对于没有结合到NC上的R848观察到了更强的抗体应答,甚至在免疫之前实质上更高量的游离R848(>6倍)与NP[Nic,,OP-II]混合时(图6)。
实例12:具有捕集的佐剂的纳米载体导致更低的全身性促炎细胞因子诱导
用于纳米载体配制品的材料
从Bachem Americas公司(柏市街3132号,托伦斯,加利福尼亚州,90505.产品代码4065609)购买卵清蛋白肽323-339酰胺乙酸盐。从Oligos Etc(9775SW Commerce Circle C-6,Wilsonville,OR 97070.)购买具有完全硫代磷酸酯化的骨架的具有5′-TCC ATG ACG TTC CTG ACG TT-3′核苷酸序列与钠抗衡离子的PS-1826DNA寡核苷酸,从勃林格殷格翰公司(Boehringer Ingelheim)(德国殷格翰,产品代码R202H)购买具有0.19dL/g的固有粘度的PLA。合成了具有大约5,000Da的尼古丁封端的PEG嵌段以及大约17,000Da的DL-PLA嵌段的PLA-PEG-尼古丁。从JT Baker(区域编号U232-08)购买聚乙烯醇(Mw=11,000-31,000,87%-89%水解的)。
用于纳米载体生产的方法
多种溶液制备如下:
溶液1:在室温下制备在稀盐酸水溶液中的卵清蛋白肽323-339,为70mg/mL。通过在室温下将卵清蛋白肽溶解在0.13N的盐酸溶液中制备了该溶液。
溶液2:在二氯甲烷中的0.19-IV PLA(为75mg/mL)和PLA-PEG-尼古丁(为25mg/ml)。通过分别将PLA(为100mg/mL)溶解在二氯甲烷中并且将PLA-PEG-尼古丁(为100mg/mL)溶解在二氯甲烷中,然后通过对每份PLA-PEG-尼古丁溶液添加3份的PLA溶液将这些溶液混合,从而制备了该溶液。
溶液3:在净化水中的寡核苷酸(PS-1826),为200mg/ml。通过在室温下将寡核苷酸溶解在净化水中制备了该溶液。
溶液4:与溶液2相同。
溶液5:在100mM的pH 8的磷酸盐缓冲液中的聚乙烯醇,为50mg/mL。
制备了两种单独的初级油包水乳液。通过将溶液1(0.1mL)和溶液2(1.0mL)在小的玻璃压力管中合并并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒制备了W1/O2。通过将溶液3(0.1mL)和溶液4(1.0mL)在小的玻璃压力管中合并并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒制备了W3/O4。通过将0.5ml的每种初级乳液(W1/O2和W3/O4)与溶液5(3.0mL)合并并且使用一台Branson(布兰森)数字超声波仪250以30%振幅将该混合物超声处理60秒制备了具有两个内乳液相([W1/O2,W3/O4]/W5)乳液的三级乳液。
然后将该三级乳液添加至含有70mM的pH 8的磷酸盐缓冲溶液(30mL)的开放的50mL烧杯中,然后在室温下搅拌2小时,以蒸发二氯甲烷并且在水性悬浮液中形成纳米载体。纳米载体的一部分通过以下过程洗涤:将该悬浮液转移到一个离心管中,以13,800g旋转一小时,除去上清液,并且将沉淀再悬浮在磷酸盐缓冲盐水中。重复该洗涤步骤,并且将沉淀再悬浮在磷酸盐缓冲盐水中,以获得具有大约10mg/mL的最终纳米颗粒分散体。
通过HPLC分析来确定纳米载体中的寡核苷酸和肽的量。通过重量法确定每mL悬浮液的总的干纳米载体质量并且将其调节到5mg/mL。将颗粒作为冷藏悬浮液储存直至使用。
表3:纳米载体表征
结果
在NC-CpG以及游离CpG接种的动物的血清中诱导了TNF-α和IL-6。将动物组用100μg的NC-CpG(含有5%CpG-1826)或用5μg的游离CpG-1826接种(皮下)。在接种后的不同时间点通过终端放血从这些动物(3只/组)收集血清,汇集并且通过ELISA(BD)测定细胞因子的存在。
这些结果证明,佐剂捕集到NC之内比使用游离佐剂导致更低的即时全身性促炎细胞因子诱导。当相同量的CpG佐剂(NC捕集的或游离的)用于接种时,与NC捕集的CpG相比,对于游离CpG观察到在动物血清中显著更高的TNF-α和IL-6诱导(图7)。
实例13:具有捕集的佐剂的纳米载体导致相似或更高的长期的免疫细胞因子全身性诱导
用于纳米载体配制品的材料
从Bachem Americas公司(Kashiwa,Torrance CA 90505。产品代码4065609)购买卵清蛋白肽323-339酰胺乙酸盐。从Oligos Etc(9775 SW Commerce Circle C-6,Wilsonville,OR 97070.)购买具有完全硫代磷酸酯化的骨架的具有5′-TCC ATG ACG TTC CTG ACG TT-3′核苷酸序列与钠抗衡离子的PS-1826DNA寡核苷酸。从SurModics Pharmaceuticals(756 Tom Martin Drive,伯明翰(Birmingham),AL 35211。产品代码100DL 2A)购买具有0.21dL/g的固有粘度的PLA。合成了具有大约5,000Da的尼古丁封端的PEG嵌段以及大约17,000Da的DL-PLA嵌段的PLA-PEG-尼古丁。从JT Baker(区域编号U232-08)购买聚乙烯醇(MW=11,000-31,000,87%-89%水解的)。
用于纳米载体生产的方法
溶液制备如下:
溶液1:在室温下制备了在稀盐酸水溶液中的卵清蛋白肽323-339,为35mg/mL。通过在室温下将卵清蛋白肽溶解在0.13N的盐酸溶液中制备了该溶液。
溶液2:在二氯甲烷中的0.21-IV PLA(为75mg/mL)和PLA-PEG-尼古丁(为25mg/ml)。通过分别将PLA(为100mg/mL)溶解在二氯甲烷中以及PLA-PEG-尼古丁(为100mg/mL)溶解在二氯甲烷中,然后通过对每一份PLA-PEG-尼古丁溶液加入3份的PLA溶液将这些溶液混合,从而制备了该溶液。
溶液3:在净化水中的寡核苷酸(PS-1826),为200mg/ml。通过在室温下将寡核苷酸溶解在纯化水中制备了该溶液。
溶液4:与溶液#2相同。
溶液5:在100mM的pH 8的磷酸盐缓冲液中的聚乙烯醇,为50mg/mL。
制备了两种单独的初级油包水乳液。通过将溶液1(0.2mL)和溶液2(1.0mL)在小的玻璃压力管中合并并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒制备了W1/O2。通过将溶液3(0.1mL)和溶液4(1.0mL)在小的玻璃压力管中合并并且使用一台Branson(布兰森)数字超声波仪250以50%振幅将该混合物超声处理40秒制备了W3/O4。通过将0.55ml的每种初级乳液(W1/O2和W3/O4)与溶液5(3.0mL)合并并且使用一台Branson(布兰森)数字超声波仪250以30%振幅将该混合物超声处理60秒制备了具有两个内乳液相([W1/O2,W3/O4]/W5)乳液的三级乳液。
然后将该三级乳液添加至含有70mM的pH 8的磷酸盐缓冲溶液(30mL)的开放的50mL烧杯中,然后在室温下搅拌2小时,以蒸发二氯甲烷并且形成在水性悬浮液中的纳米载体。纳米载体的一部分通过以下过程洗涤:将该悬浮液转移到一个离心管中,以13,800g旋转一小时,除去上清液,并且将沉淀再悬浮在磷酸盐缓冲盐水中。重复该洗涤步骤,并且将沉淀再悬浮在磷酸盐缓冲盐水中,以获得具有大约10mg/mL的最终纳米颗粒分散体。
通过HPLC分析确定纳米载体中的寡核苷酸和肽的量。通过重量法确定每mL悬浮液的总的干纳米载体的质量并且将其调节到5mg/mL。将颗粒作为冷藏悬浮液储存直至使用。
表4:纳米载体表征
结果
在NC-CpG以及CpG接种的动物的血清中诱导了IFN-γ和IL-12。将动物组用100μg的NC-CpG(含有6%CpG-1826)或用6μg的游离CpG-1826接种(皮下)。在接种后24小时通过终端放血从这些动物(3只/组)收集血清,汇集并且通过ELISA(BD)测定细胞因子的存在。
这些结果证明,与利用游离佐剂相比,佐剂捕集到NC之内导致相似的或甚至更高的长期的免疫细胞因子的全身性诱导。当相同量的CpG佐剂(NC捕集的或游离的)用于动物接种时,在动物血清中观察到相似水平的全身性IFN-γ长期诱导和更高的IL-12诱导(图8)。
以下内容对应于本申请母案的原始权利要求书:
1.一种方法,包括:
提供一个剂量的佐剂以及一个剂量的抗原,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,
通过将该剂量的佐剂以及该剂量的抗原给予一位受试者产生一个针对该抗原的抗体滴度,并且
将该剂量的佐剂选择为少于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂以及该剂量的抗原给予该受试者所产生的抗体滴度相似的抗体滴度。
2.如项1所述的方法,其中该佐剂包含针对Toll样受体3、4、5、7、8或9或其组合的一种激动剂。
3.如项2所述的方法,其中该佐剂包括一种针对Toll样受体3的激动剂、一种针对Toll样受体7和8的激动剂、或一种针对Toll样受体9的激动剂。
4.如项3所述的方法,其中该佐剂包括R848、免疫刺激DNA或免疫刺激RNA。
5.如项1至4中任一项所述的方法,其中该剂量的佐剂包括两种或更多种类型的佐剂。
6.如项1至5中任一项所述的方法,其中该剂量的佐剂的一部分未结合到这些合成纳米载体上。
7.如项1至6中任一项所述的方法,其中给予该受试者一种以上类型的抗原。
8.如项1至7中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分结合到这些合成纳米载体上。
9.如项1至7中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分未结合到这些合成纳米载体上。
10.如项1至7中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分与这些合成纳米载体联合给予。
11.如项1至7中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分不与这些合成纳米载体联合给予。
12.如项1至11中任一项所述的方法,其中该一种或多种抗原包括一种B细胞抗原和/或一种T细胞抗原。
13.如项12所述的方法,其中该T细胞抗原包括一种T辅助细胞抗原。
14.如项1至11中任一项所述的方法,其中该一种或多种抗原包括一种B细胞抗原或一种T细胞抗原以及一种T辅助细胞抗原。
15.如项1至14中任一项所述的方法,其中该给予是通过包括以下项的一种途径给予:皮下、肌内、真皮内、口服、鼻内、经粘膜、直肠;眼、经皮或透皮给予或其组合。
16.如项1至15中任一项所述的方法,其中这些合成纳米载体包括脂质纳米颗粒、聚合物纳米颗粒、金属纳米颗粒、基于表面活性剂的乳液、树枝状聚合物、巴克球、纳米线、病毒样颗粒、肽或蛋白质颗粒、以及包含以下项的组合的纳米颗粒:球状纳米颗粒、立方形纳米颗粒、锥形纳米颗粒、长方形纳米颗粒、圆柱形纳米颗粒或环形纳米颗粒。
17.如项1至15中任一项所述的方法,其中这些合成纳米载体包括一种或多种聚合物。
18.如项17所述的方法,其中该一种或多种聚合物包括一种聚酯。
19.如项17或18所述的方法,其中该一种或多种聚合物包括或进一步包括一种结合到亲水聚合物上的聚酯。
20.如项18或19所述的方法,其中该聚酯包括一种聚(乳酸)、聚(乙醇酸)、聚(乳酸-乙醇酸)共聚物或聚己内酯。
21.如项19或20所述的方法,其中该亲水聚合物包括一种聚醚。
22.如项21所述的方法,其中该聚醚包括聚乙二醇。
23.如项1至22中任一项所述的方法,其中该至少一个剂型包括该剂量的佐剂。
24.如项23所述的方法,其中一种疫苗包括该一种或多种剂型。
25.如项23或24所述的方法,其中一个以上的剂型包括该剂量的佐剂,并且该一个以上的剂型是联合给予的。
26.如项1至25中任一项所述的方法,其中该受试者患有癌症、感染性疾病、非自身免疫性代谢性疾病、退行性疾病、成瘾、特应性疾病、哮喘;慢性阻塞性肺病(COPD)或慢性感染。
27.如项1至26中任一项所述的方法,其中该抗原包括尼古丁。
28.一种方法,包括:
提供一个剂量的佐剂,其中该剂量的佐剂的至少一部分结合到合成纳米载体上,
通过将该剂量的佐剂给予一位受试者产生一种全身性细胞因子释放,并且
将该剂量的佐剂选择为多于一个单独剂量的佐剂,该单独剂量的佐剂导致与通过将该剂量的佐剂给予该受试者所产生的全身性细胞因子释放相似的全身性细胞因子释放。
29.如项28所述的方法,其中该佐剂包含针对Toll样受体3、4、5、7、8或9或其组合的一种激动剂。
30.如项29所述的方法,其中该佐剂包括一种针对Toll样受体3的激动剂、一种针对Toll样受体7和8的激动剂、或一种针对Toll样受体9的激动剂。
31.如项30所述的方法,其中该佐剂包括R848、免疫刺激DNA或免疫刺激RNA。
32.如项28至31中任一项所述的方法,其中该剂量的佐剂包括两种或更多种类型的佐剂。
33.如项28至32中任一项所述的方法,其中该剂量的佐剂的一部分未结合到这些合成纳米载体上。
34.如项28至33中任一项所述的方法,其中给予该受试者一种以上类型的抗原。
35.如项28至34中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分结合到这些合成纳米载体上。
36.如项28至34中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分未结合到这些合成纳米载体上。
37.如项28至34中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分与这些合成纳米载体联合给予。
38.如项28至34中任一项所述的方法,其中该剂量的一种或多种抗原的至少一部分不与这些合成纳米载体联合给予。
39.如项28至38中任一项所述的方法,其中该一种或多种抗原包括一种B细胞抗原和/或一种T细胞抗原。
40.如项39所述的方法,其中该T细胞抗原包括一种T辅助细胞抗原。
41.如项28至38中任一项所述的方法,其中该一种或多种抗原包括一种B细胞抗原或一种T细胞抗原以及一种T辅助细胞抗原。
42.如项28至41中任一项所述的方法,其中该给予是通过包括以下项的一种途径给予:皮下、肌内、真皮内、口服、鼻内、经粘膜、直肠;眼、经皮或透皮给予或其组合。
43.如项28至42中任一项所述的方法,其中这些合成纳米载体包括脂质纳米颗粒、聚合物纳米颗粒、金属纳米颗粒、基于表面活性剂的乳液、树枝状聚合物、巴克球、纳米线、病毒样颗粒、肽或蛋白质颗粒、以及包含以下项的组合的纳米颗粒:球状纳米颗粒、立方形纳米颗粒、锥形纳米颗粒、长方形纳米颗粒、圆柱形纳米颗粒或环形纳米颗粒。
44.如项28至42中任一项所述的方法,其中这些合成纳米载体包括一种或多种聚合物。
45.如项44所述的方法,其中该一种或多种聚合物包括一种聚酯。
46.如项44或45所述的方法,其中该一种或多种聚合物包括或进一步包括一种结合到亲水聚合物上的聚酯。
47.如项45或46所述的方法,其中该聚酯包括一种聚(乳酸)、聚(乙醇酸)、聚(乳酸-乙醇酸)共聚物或聚己内酯。
48.如项46或47所述的方法,其中该亲水聚合物包括一种聚醚。
49.如项48所述的方法,其中该聚醚包括聚乙二醇。
50.如项28至49中任一项所述的方法,其中该至少一个剂型包括该剂量的佐剂。
51.如项50所述的方法,其中一种疫苗包括该一种或多种剂型。
52.如项50或51所述的方法,其中一个以上的剂型包括该剂量的佐剂,并且该一个以上的剂型是联合给予的。
53.如项28至52中任一项所述的方法,其中该受试者患有癌症、感染性疾病、非自身免疫性代谢性疾病、退行性疾病、成瘾、特应性疾病、哮喘;慢性阻塞性肺病(COPD)或慢性感染。
54.如项34至53中任何一项所述的方法,其中该抗原包括尼古丁。
55.如项1或34所述的方法,其中该剂量的佐剂包括R848并且该剂量的抗原包括尼古丁以及一种T辅助细胞抗原,其中该尼古丁和T辅助细胞抗原也结合到这些合成纳米载体上,并且其中这些合成纳米颗粒包括一种或多种聚合物。
56.如项55所述的方法,其中该一种或多种聚合物包括一种结合到亲水聚合物上的聚酯。
57.如项56所述的方法,其中该亲水聚合物包括一种聚醚。
58.如项56或57所述的方法,其中该聚酯包括一种聚(乳酸)、聚(乙醇酸)、聚(乳酸-乙醇酸)共聚物或聚己内酯。
59.如项57或58所述的方法,其中该聚醚包括聚乙二醇。
60.如项1至27中任一项所定义的一个剂量的佐剂和一个剂量的抗原或如项28至59中任一项所定义的一个剂量的佐剂在治疗或预防中的用途。
61.如项1至27中任一项所定义的一个剂量的佐剂和一个剂量的抗原或如项28至59中任一项所定义的一个剂量的佐剂在如项1至59中任一项所定义的方法中的用途。
62.如项1至27中任一项所定义的一个剂量的佐剂和一个剂量的抗原或如项28至59中任一项所定义的一个剂量的佐剂在治疗癌症、感染性疾病、非自身免疫性代谢性疾病、退行性疾病、成瘾、特应性疾病、哮喘;慢性阻塞性肺病(COPD)或慢性感染中的用途。
63.如项62所述的一个或多个剂量,其中该方法包括将该一个或多个剂量通过包括以下项的一种途径给予:皮下、肌内、真皮内、口服、鼻内、经粘膜、直肠;眼、经皮或透皮给予或其组合。
64.如项1至27中任一项所定义的一个剂量的佐剂和一个剂量的抗原或如项28至59中任一项所定义的一个剂量的佐剂在用于如项1至59中任一项所定义的方法中的药剂的制造的用途。
- 还没有人留言评论。精彩留言会获得点赞!