一种凝血酶缓释内镜下止血夹及其制备方法与流程
本发明涉及医疗器械及其制备领域,特别是涉及一种凝血酶缓释内镜下止血夹及相关医疗器械的制备方法。
背景技术:
目前,随着医疗技术的飞速发展与创新,各种内镜技术、微创技术等诊疗合一的医学手段逐步成为主流医疗技术不断出现,但内镜与微创器械也带来一些上消化道出血是常见的消化道疾病,同时也是内镜下治疗中常见的手术并发症。对于上消化道出血的传统内科治疗手段主要有局部喷洒或注射止血、静脉应用止血药物等,目前内镜下止血广泛应用靶向药物凝血酶局部作用于病灶表面,血液很快形成稳定的凝血块。但靶向喷洒后存在凝血酶被组织液快速稀释的问题,使药效降低。后随着内镜下器械的不断发展与改良,用于局部止血及封闭穿孔的各种吻合夹开始出现。钛夹作为内镜下治疗的重要器械之一,目前只对局部损伤承担物理封闭治疗作用。很多学者尝试在医用金属基材上靶向缓释凝血酶,目前所有的缓释研究都基于生物惰性材料表面,不但生物活性差,而且重金属离子毒性会造成凝血酶失效。羟基磷灰石(hydroxyapatite,简写为HA或HAP,分子式为Ca10(OH)2(PO4)6)是牙齿和骨骼的主要(无机)成分,在前沿医学上也作为人造骨的最佳成分。羟基磷灰石生物兼容性好,是能刺激或者诱导骨组织生长并能与骨组织形成骨性结合的天然陶瓷材料,生物兼容性及生物活性均优于磷酸三钙及其它磷钙陶瓷材料。羟基磷灰石的使用,有助于细胞的粘附、增殖及功能发挥,在直接作为骨、牙等替代或缺损修复材料的基础上,不但是优异的骨组织工程载体材料,也可作为其它医学功能材料或药物的载体材料。
技术实现要素:
本发明的目的是解决现有凝血酶缓释医疗器械领域中存在的部分问题,提供一种凝血酶缓释内镜下止血夹。
本发明的目的是通过以下技术方案实现的:
一种凝血酶缓释内镜下止血夹的制备方法,包括如下步骤:
(1)将金属基底用去离子水超声洗涤干燥后浸泡于磷化液中,取出进行二次干燥后洗涤;
(2)将步骤(1)处理后的金属基底浸泡于羟基磷灰石悬浊液中,取出干燥;
(3)将步骤(2)处理后的金属基底浸泡于凝血酶溶液中取出即得;
所述金属基底为金属基质的内镜下止血夹。
优选地,所述步骤(1)和步骤(2)中的干燥是在干燥箱中55-65℃干燥6-8分钟或25-28℃空气中干燥1.2-1.8小时。
优选地,所述步骤(1)中的浸泡温度为25-28℃,时间为1-2分钟。
优选地,所述步骤(1)中的二次干燥为干燥箱中60-65℃干燥5-8分钟或25-28℃空气中干燥1.2-1.8小时。
优选地,所述步骤(1)中的磷化液为5mol/l的羟基乙叉二膦酸溶液10-20份、0.5mol/l的焦磷酸溶液1-2份、柠檬酸或六次甲基四胺1.5-5份混合而成。
优选地,所述步骤(2)中的羟基磷灰石悬浊液浓度为25g/l,浸泡温度为28-30℃,时间为6-8分钟。
优选地,所述步骤(3)中的凝血酶溶液中凝血酶浓度为4500-4800U/l,由凝血酶冻干粉与0.9%生理盐水制备。
优选地,所述步骤(3)中的浸泡温度为20-25℃,时间为1-1.5小时。
本发明的另方面为一种凝血酶缓释内镜下止血夹,包括内镜下止血夹的金属基底,所述金属基底的金属表面上依次覆盖有化学转换膜层、磷酸盐层、羟基磷灰石层和凝血酶层。
优选地,所述金属基底的厚度为1-50毫米,磷酸盐层的厚度为0.02-2微米,化学转换膜层的厚度为0.4-100纳米,羟基磷灰石层的厚度为0.1-0.6毫米,凝血酶层的厚度为0.1-1微米。
优选地,所述金属基底为不锈钢,碳钢,螺纹钢,冷轧钢,热轧钢,锰钢,铝,铝合金,钛,钛合金,钴合金,镁铝合金的一种。
本发明的有益效果:
1.本发明实现了内镜下止血夹金属基的生物活性表面的凝血酶缓释涂层制备,可实现从单纯“裸”器械到“功能性”药物复合器械的升级。
2.本发明可实现凝血酶等仅能局部应用的药物的靶向缓释,可用于制备的“功能性”药物复合内镜下止血夹可直接放置于人体靶器官以及手术靶部位。
3.本发明可实现凝血酶等药物在金属基涂层体系上的稳定缓释,药物可实现在指定部位缓释从而可持续增加周围组织浓度,解决了局部喷洒的药物被组织液快速稀释而影响药效的问题。
附图说明
图1是本申请凝血酶缓释内镜下止血夹的产品图示;
图2是制备的稳定羟基磷灰石纳米/亚微米涂层;
图3是羟基磷灰石纳米/亚微米涂层表面的凝血酶层;
图4是羟基磷灰石层的XPS曲线;
图5是凝血酶层的XPS曲线;
图6是不同时间下凝血酶平均浓度曲线图;
图7是不同时间段凝血酶的柱图。
具体实施方式
为了更好地说明本发明,下面结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。
本发明的凝血酶缓释内镜下止血夹,如图1所示,包括内镜下止血夹的金属基底12、金属表面13、磷酸盐层14、化学转换膜层15、羟基磷灰石层16和凝血酶层17。所述金属基底12的厚度为1-50毫米,磷酸盐层15的厚度为0.02-2微米,化学转换膜层14的厚度为0.4-100纳米,羟基磷灰石层16的厚度为0.1-0.6毫米,凝血酶层17的厚度为0.1-1微米。
具体实施例1:
1.1.SU304奥氏体不锈钢样品用去离子水超声洗涤5分钟,清除表面的油污或锈蚀。待表面干净后,放置于干燥箱中60℃干燥8分钟,以表面无残留水滴为合格,所述不锈钢样品的厚度为10毫米。
2.将5mol/l的羟基乙叉二膦酸溶液15份、0.5mol/l的焦磷酸溶液1份、六次甲基四胺2份制备磷化液。将不锈钢样品浸泡于25℃上述磷化液中2分钟,在金属表面形成磷酸盐层15和化学转换膜层14,所述溶液的1份为1l,六次甲基四胺1份为1g。
3.取出后待多余溶液流下后,放置于干燥箱中60℃干燥8分钟,使制备的磷酸盐层15和化学转换膜层14干燥。所述化学转换膜层14为金属表面13上很薄的一层薄膜。
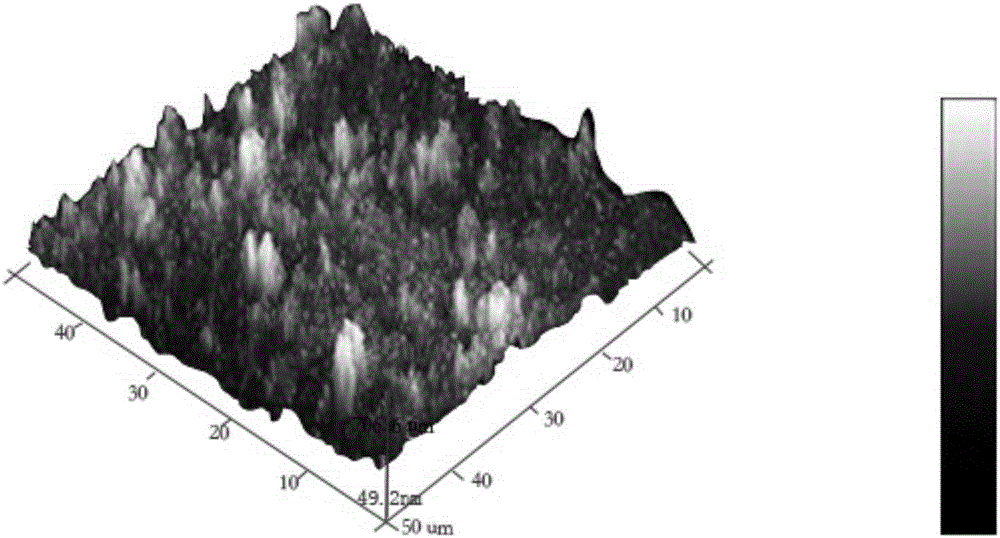
4.待样品表面无明显液体或胶体,用去离子水冲洗金属表面5分钟,冲洗掉多余的磷化结晶残留,剩下不易被冲洗掉的化学转换膜层14表面的磷酸盐层15,其厚度为10纳米,磷酸盐层15的厚度为0.1微米。放置于25g/l不断进行搅拌的羟基磷灰石(HA)悬浊液中,28℃浸泡8分钟。完成金属表面化学转换膜层14和磷酸盐层15上的羟基磷灰石层的自组装制备,所得羟基磷灰石层的厚度为0.3毫米。保留一部分样品进行羟基磷灰石层的光电子能谱与原子力显微镜表征,见附图2-5。
5.取出步骤4制备好的产品放入干燥箱中60℃干燥8分钟,待表面无残留水滴后。放入凝血酶冻干粉与0.9%生理盐水制备4800U/l凝血酶溶液中,25℃浸泡1.5小时,制备凝血酶层,其厚度为0.5微米。
6.取出在30℃空气中干燥2小时,进行光电子能谱与原子力显微镜表征,原子力显微镜表征测试结果见附图2-3,从AFM对比图可以看出,制备前后表面出现明显变化,浅色区域为凝血酶分子。光电子能谱表征测试结果见附图4-5,经过XPS对比可以看出,(1)凝血酶分子成功涂覆在羟基磷灰石表面,且有一定厚度;(2)从高分辨XPS解谱来看,没有新的化学键产生,缓释产物是凝血酶。上述结果说明凝血酶涂层前后成分与形貌产生了明显的变化,形成了稳定的涂层,涂层为凝血酶层;没有新的化学键结合产生,说明凝血酶无其它污染物产生。
7.取出步骤5样品在30℃空气中干燥2小时,每组取6块样品,利用酶标仪在450nm波长下分别测定不同浓度标准品的吸光度,根据不同标准品浓度及对应的吸光度绘制标准曲线。在此基础上不同时间下计算的出的平均凝血酶浓度如附图6所示,从附图6可知在0-60分钟内凝血酶释放迅速,从60-180分钟凝血酶释放十分缓慢但仍可维持一定的浓度。
将镀有凝血酶的金属基底(共6块)分别浸泡于盛有200ml生理盐水的烧杯中,分别于0h、1h、2h、3h、4h、5h取样本液100ul置于标记好的EP管中,每次取样后弃去原有生理盐水,利用酶标仪测定不同时间下六组溶液的吸光度并计算平均值。不同时间下弃去浸泡溶液测得的吸光度应用t检验两两组间比较P值均大于0.05,差异无统计学意义,每隔1小时弃去浸泡溶液前测得的溶液的吸光度无显著差异,我们可以认为相同时间段内药物涂层金属基底可稳定持续释放凝血酶。具体结果如附图7所示。
上述结果说明凝血酶在1小时候达到稳定缓释值,而在持续变化的溶液中可以稳定的缓释凝血酶。
上述试验研究表明“凝血酶-羟基磷灰石-无氧化物层-金属”钢板于生理盐水溶液中可持续稳定地释放凝血酶,从而保证溶液中凝血酶的浓度,具有凝血酶缓释效果,即,如此制备的凝血酶缓释金属基质内镜下止血夹也具有良好的凝血酶缓释效果。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或替换,都应该涵盖在本发明的保护范围之内。因此,本发明的保护范围应该以权利要求书的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!