一种抗IL‑17A抗体的组合物的制作方法
本发明涉及一种稳定的抗IL-17A抗体的组合物。
背景技术:
IL-17A(同IL-17)与促炎症反应的产生相关,并诱导和介导多种细胞因子,包括alpha肿瘤坏死因子(TNF-α)、IL-6、IL-8、IL-1β、GRO-α、粒细胞-集落刺激因子(G-CSF)、前列腺素E2(PGE 2)、IL-10、IL-12、IL-1R拮抗剂、白血病抑制因子等的表达。IL-17亦可诱导软骨细胞和人骨关节外一氧化氮的产生。
有证据证明,IL-17A信号通路和各种自身免疫病包括银屑病、银屑病性关节炎、风湿性关节炎、强直性脊柱炎、克罗恩氏病、多发性硬化症、动脉粥样硬化、肺相关疾病和红斑狼疮等均有一定的关联,目前临床实验中以IL-17A作为靶点的治疗在银屑病、风湿性关节炎以及强直性脊柱炎上取得了很好的结果。SHR-1314注射液是一种自主开发的人源化单克隆抗体药物,以IL-17A为靶点,特异结合IL-17A抑制GROα等细胞因子的产生,达到阻断信号传导通路的作用,主要用于银屑病的治疗,其他自身免疫疾病待临床确认。
WO2015070697公开了一类新的抗IL-17A抗体,所述的抗体具有亲和力高、半衰期长的特点,预期其对上述疾病具有更好的疗效。然而这些新的抗IL-17A抗体极不稳定,难以制成临床可用的制剂,WO2015070697对于它们如何制成制剂没有任何描述。因此,有必要对这些抗体进行深入研究,以得到稳定、方便临床使用的制剂。
技术实现要素:
本发明的目的在于提供一种稳定的抗IL-17A抗体组合物。
本发明的组合物含有抗IL-17A抗体、缓冲剂、二糖,任选的还可以含有表面活性剂。
本发明所述的组合物中,所述的抗IL-17A抗体优选具有分别为SEQ ID NO:1、SEQ ID NO:2和SEQ ID NO:3的LCDR1、LCDR2和LCDR3氨基酸序列,以及分别为SEQ ID NO:4、SEQ ID NO:5和SEQ ID NO:6的HCDR1、HCDR2和HCDR3氨基酸序列,所述氨基酸序列如下表所示:
进一步优选的抗IL-17A抗体具有SEQ ID NO:7的轻链和SEQ ID NO:8的重链氨基酸序列:
SEQ ID NO:7
EIVLTQSPDFQSVTPKEKVTITCSASSSVNYMHWFQQKPDQSPKLWIYRTSNLASGVPSRFSGSGSGTDYTLTINSLEAEDAATYYCQQRSSYPWTFGQGTKLEIKR
SEQ ID NO:8
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDYEVHWVRQAPGQGLEWMGVIDPGTGGVAYNQKFEGRVTMTADTSTSTAYMELRSLRSDDTAVYYCTRYSLFYGSSPYAMDYWGQGTLVTVSS
所述的抗IL-17A抗体的浓度可以是50-150mg/ml,优选70-100mg/ml,最优选80mg/ml。
本发明优选的缓冲剂为组氨酸-盐酸盐体系,优选组氨酸-组氨酸盐酸盐缓冲剂,其用量没有特别限制,在本发明的实施方案中,例如是1至50mM,优选5至20mM,最优选10mM。
所述的二糖可以选自蔗糖、乳酸、海藻糖、麦芽糖,优选蔗糖。所述二糖的用量无需特别限制,在本发明的实施方案中,例如是10至500mg/ml,优选50至200mg/ml,更优选50至100mg/ml,最优选76mg/ml。
所述的表面活性剂可以选自聚氧乙烯氢化蓖麻油、甘油脂肪酸酯、聚氧乙烯山梨醇酐脂肪酸酯,所述聚氧乙烯山梨醇酐脂肪酸酯可以选自聚山梨醇酯20、40、60或80。所述表面活性剂的用量无需特别限制,在本发明的实施方案中,例如是0.1至10mg/ml,优选0.2至5mg/ml,更优选0.3至0.9mg/ml,最优选0.6mg/ml。
所述的组合物是一种可注射的药物组合物。
所述组合物的pH值范围可以在5.0-7.0之间,优选5.4-6.2,最优选5.8-6.0。
在本发明的一个实施方案中,所述组合物由抗IL-17A抗体、缓冲剂、二糖,表面活性剂组成,任选包括水。
所述的可注射的药物组合物可以是注射液或者进一步制备成冻干粉形式。所述的冻干粉可以由本领域的常规方法制备。
本发明还提供了一种经冻干粉复溶后重建形成的注射液,可直接用于注射。
本发明的药物组合物可以有效抑制抗体的聚集和脱酰胺作用,从而阻止其中抗体产品的降解,得到稳定性的注射组合物,在25℃条件下可以稳定性存放6个月,2-8℃条件下可以稳定存放12个月。并且,本发明的药物组合物对于蛋白氧化降解具有保护作用,还能够与玻璃、不锈钢容器相容,在这些容器中也能够稳定存在。
附图说明
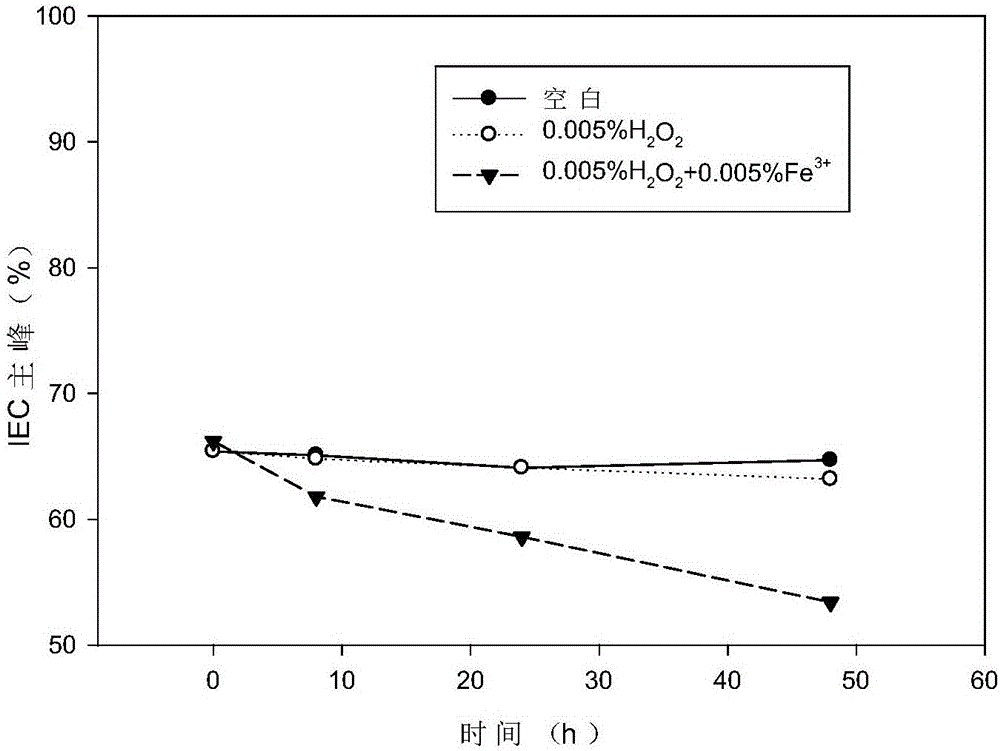
图1显示实施例5的制剂在强氧化条件下降解曲线,其中空白组和0.005%H2O2组的降解曲线重叠。
图2显示实施例5的制剂在强氧化条件下降解曲线。
具体实施方式
通过以下实施例进一步详细说明本发明。这些实施例仅用于说明性目的,而并不用于限制本发明的范围。
实施例1
将抗IL-17A抗体分别配制为pH 5.5-6.5的含10mM组氨酸盐酸盐,76mg/mL蔗糖,0.6mg/mL聚山梨醇酯80的制剂,蛋白浓度为80mg/mL。过滤每种制剂并填充入2mL中性硼硅玻璃管制注射剂瓶中,所述玻璃瓶用注射液用覆聚四氟乙烯/六氟丙烯的共聚物膜氯化丁基橡胶塞封口。将样品保存于40℃进行稳定性分析。结果显示抗IL-17A抗体在pH 5.8-6.0最稳定。
表1、pH对保存于40℃的抗IL-17A抗体的降解的效应
实施例2
在下列缓冲液中,配置蛋白浓度为80mg/mL的抗IL-17A抗体制剂:
1)15mM磷酸盐,76mg/mL蔗糖,pH 5.8
2)10mM组氨酸盐酸盐,76mg/mL蔗糖,pH 5.8
将每种制剂等分到2mL西林瓶中并保存于40℃。药品的稳定性分析显示,抗IL-17A抗体在组氨酸缓冲盐体系中的稳定性明显优于磷酸盐缓冲体系。
表2、缓冲体系对保存于40℃的抗IL-17A抗体降解的影响
实施例3
采用DSC技术设计了含有不同蔗糖浓度的处方进行处方筛选:
实验结果表明,当蔗糖浓度达到76mg/ml时SHR-1314单抗的Tm值具有较大的升高,说明该浓度下蛋白的稳定性较好
表3、不同蔗糖浓度的处方组成和处方筛选实验结果
实施例4
在含下列不同浓度表面活性剂的缓冲液中,制备蛋白浓度为80mg/mL的抗IL-17A抗体制剂:
1)10mM组氨酸盐酸盐,76mg/mL蔗糖,pH 5.8
2)10mM组氨酸盐酸盐,76mg/mL蔗糖,0.6mg/mL聚山梨醇酯20,pH 5.8
3)10mM组氨酸盐酸盐,76mg/mL蔗糖,0.3mg/mL聚山梨醇酯80,pH 5.8
4)10mM组氨酸盐酸盐,76mg/mL蔗糖,0.6mg/mL聚山梨醇酯80,pH 5.8
5)10mM组氨酸盐酸盐,76mg/mL蔗糖,0.9mg/mL聚山梨醇酯80,pH 5.8
将每种制剂填充入2mL西林瓶中,并用覆膜胶塞封口。药品置于25℃恒温摇床上,以500rpm的速度震摇。稳定性结果表明,0.6~0.9mg/mL聚山梨醇酯80和20,有效防止了抗IL-17A抗体大颗粒聚集的形成。
表4、表面活性剂对于25℃,500rpm振摇的抗IL-17A抗体聚集的影响
实施例5
抗IL-17A抗体以80mg/mL配制在10mM组氨酸盐酸盐,76mg/mL蔗糖,0.6mg/mL聚山梨醇酯80,pH 5.8中。将抗体填充入2mL西林瓶中,并用覆膜胶塞封口。样品置于-20℃~40℃低温循环3次,或4℃~40℃冻融循环3次。通过蛋白含量,纯度与活性检测评估药品稳定性,结果证明抗IL-17A抗体在该处方中是比较稳定的,经低温和冻融循环后仍能够符合质量标准。
表5、抗IL-17A抗体制剂在低温循环和冻融循环时的稳定性
实施例6
在80mg/mL蛋白质,10mM组氨酸盐酸盐,76mg/mL蔗糖,0.6mg/mL聚山梨醇酯80,pH 5.8的抗IL-17A抗体制剂中,分别加入0.005%双氧水,或0.005%双氧水+0.005%三价铁。37℃放置48h。结果表明,该制剂处方对于蛋白氧化降解的具有一定的保护作用,参见图1和图2。
实施例7
抗IL-17A抗体以80mg/mL配制在10mM组氨酸盐酸盐,76mg/mL蔗糖,0.6mg/mL聚山梨醇酯80,pH 5.8中。将制剂分别填充在玻璃瓶和316L不锈钢罐中,室温放置48小时。蛋白含量和纯度分析表明,抗IL-17A抗体在48小时内是稳定的。该制剂与316L不锈钢罐可以相容。
表6、在不锈钢罐中抗IL-17A抗体的稳定性
- 还没有人留言评论。精彩留言会获得点赞!