包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体、制备方法及应用与流程
本发明涉及抗体领域,特别地,涉及一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体。此外,本发明还涉及包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体的制备方法及应用。
背景技术:
化疗是一种治疗肿瘤的常用的方法,虽然文献报道化疗能降低了死亡率,但是,也有文献报道化疗既不能增提高疗效,也不能延长寿命,因为化疗损害免疫系统使肿瘤免疫疗效丧失。过去的几十年里,免疫治疗与靶向治疗是两个不同的有效策略,都被证明各有其利弊。基因组引导突变识别驱动的癌症,促进了靶向药物的发展,它们在多数有肿瘤靶病变的患者中有显著的反应,但其作用相对短暂。在化疗的情况下,联合基因靶向药物比单用制剂将更有效的预防癌症。通过联合用药有效地提高整体存活率是可行的。然而,由于固有的基因组不稳定性,获得性耐药的无数的机制和广泛靶标的复杂性,可能很难通过单个基因靶向策略治愈肿瘤。肿瘤免疫治疗(Tumor immunotherapy)越来越受人关注。晚期肿瘤通过多种免疫机制逃脱宿主的免疫侦查和免疫清除,诱导肿瘤耐受,所以,有效的肿瘤免疫治疗应该促进肿瘤-免疫循环,解除肿瘤免疫抑制。肿瘤免疫治疗的理论基础是免疫系统具有识别肿瘤相关抗原、调控机体攻击肿瘤细胞,即高度特异性的细胞溶解能力。
免疫治疗本质上是多价的,因为针对单个检查点可能释放对许多不同的抗原肽特异性的T细胞,这些肿瘤内的抗原肽目前包括肿瘤分化,进展,甚至由于基因组不稳定性导致新抗原的突变驱动癌症的发生。这个生物过程十分复杂,目前仍处于研究之中。众所周知,免疫疗法有三大特点:没有典型的耐药性;诱导产生持久的临床反应;诱导产生自体免疫样毒性。肿瘤免疫治疗的耐受性很好,与化疗不同(1+1<2),将多种免疫治疗联合使用可能具有更好的安全性(1+1>2)。由于增加抗肿瘤T细胞的反应,免疫治疗效果更持久,但是只在一小部分患者中有效。因此亟需一种复合抗体,以使不同靶向目标的多个不同机制的免疫治疗,有可能在更多的患者中产生更好的效果。
技术实现要素:
本发明提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体、制备方法及应用,以解决现有的免疫治疗只对小部分患者有效的技术问题。
本发明采用的技术方案如下:
本发明一方面提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体,复合抗体包括干扰素α、肿瘤抗体和氧化石墨烯,干扰素α、肿瘤抗体和氧化石墨烯通过非共价键连接,肿 瘤抗体为利妥昔单抗或曲妥珠单抗。
进一步地,干扰素α、肿瘤抗体和氧化石墨烯的比例为每200~2000单位干扰素α对应0.1~0.5mg氧化石墨烯和1~5mg肿瘤抗体。
进一步地,干扰素α、肿瘤抗体和氧化石墨烯的比例为每2000单位干扰素α对应0.1mg氧化石墨烯和1mg肿瘤抗体。
进一步地,氧化石墨烯的粒径小于22μm。
本发明另一方面提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体的制备方法,包括以下步骤:
将干扰素α和氧化石墨烯在32~42℃下混匀反应2~4小时;
加入肿瘤抗体混匀,在32~42℃反应4~8小时,得到包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体。
进一步地,干扰素α和氧化石墨的反应温度为37℃,反应时间为2小时;加入肿瘤抗体的反应温度为37℃,反应时间为2小时。
进一步地,氧化石墨烯的制备包括以下步骤:
将氧化石墨烯原材料在0~4℃的条件下,通过超声波破碎,经过孔径0.22μm的滤网过滤,得到氧化石墨烯。
进一步地,超声波破碎的操作包括以下步骤:
将氧化石墨烯原材料配置为1~2mg/ml,在超声波破碎的强度为3.5的条件下,超声2小时,超声模式为工作10s,休息5s。
本发明还提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体在治疗肿瘤药物中的应用。
本发明具有以下有益效果:上述包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体,复合抗体可以有效地直接杀伤大部分的肿瘤细胞,破坏保护肿瘤细胞的微环境,同时干扰素α刺激免疫系统,打破肿瘤耐受,促进肿瘤特异性的细胞激活或者细胞因子的释放,达到缩小清除肿瘤、防治复发和最终治愈肿瘤的目标。
除了上面所描述的目的、特征和优点之外,本发明还有其它的目的、特征和优点。下面将参照图,对本发明作进一步详细的说明。
附图说明
构成本申请的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1是本发明优选实施例的各组小鼠的生存时间示意图;
图2是本发明优选实施例的各组小鼠体内的PBMCs细胞存活数量示意图;
图3是本发明优选实施例的各组以CCK8法测定肿瘤细胞活性鉴别柱状图;
图4是本发明优选实施例的各组Raji细胞存活数量示意图;
图5是本发明优选实施例的各组的淋巴瘤细胞存活数量示意图;
图6是各组的Treg细胞分化增殖情况示意图;
图7是本发明优选实施例的各组的Treg淋巴瘤细胞存活数量示意图;
图8是本发明优选实施例的各组的Teff/Treg比例示意图。
具体实施方式
以下结合附图对本发明的实施例进行详细说明,但是本发明可以由权利要求限定和覆盖的多种不同方式实施。
参照图1,本发明的优选实施例提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体,复合抗体包括干扰素α、肿瘤抗体和氧化石墨烯,干扰素α、肿瘤抗体和氧化石墨烯通过非共价键连接,肿瘤抗体为利妥昔单抗或曲妥珠单抗。
分子靶向治疗和化疗耐药是目前癌症研究的主要问题。细胞毒性化疗药物和可选择性的特异性靶分子的靶向药物耐药的经典机制有药物靶点的改变、促生存的途径激活和诱导细胞死亡失效。通过合理的治疗药物组合和使用预测生物标志物进行临床评估。影响耐药的可能因素有:(1)药物的运输与代谢,比如耐多药最常见药物泵,以及药物的活化与失活;(2)药物靶点的改变,例如,吉非替尼和厄洛替尼治疗非小细胞肺癌对表皮生长因子受体(EGFR)抑制剂的反应率高,是因为活化的EGFR酪氨酸激酶结构域的突变(在19外显子缺失和21号外显子L858R突变);(3)DNA损伤修复,如一些DNA损伤的药物;(4)下游耐药机制,凋亡负调控,自我吞噬;(5)耐药促进适应性反应:促生存信号通路激活,肿瘤旁路和路径冗余,上皮-间充质转化;(6)肿瘤微环境,如整合素家族、细胞因子和生长因子。在实体肿瘤,微环境是由细胞外基质,癌相关成纤维细胞,免疫和炎性细胞和血管组成的。在血液恶性肿瘤的微环境是由骨髓基质细胞、骨髓内皮细胞、破骨细胞、成骨细胞、巨噬细胞和其他细胞间的细胞组成的。微环境对抗细胞毒性药物为肿瘤细胞提供避难所,从而使他们能够逃避细胞凋亡和获得性耐药导致疾病复发。在大多数实体肿瘤的致癌过程均是一个多步骤的过程,分子机制解释不了单一治疗的效果。在这种情况下,单一靶向治疗似乎理论上是一个不理想的策略,并不能期望得到最佳的结果。然而单一靶向治疗的特异性高副作用较少,从该角度来看单一靶向治疗又是理想的。因此,建立有多针对性的分子靶向药物的联合可能是一个在未来癌症治疗的目标。这可能会解决肿瘤异质性的问题,同时保持治疗的选择性。
抗肿瘤免疫的激活对于有效地消除肿瘤细胞可能是至关重要的。在这方面,小分子药物不直接作用于免疫系统,应结合免疫活性药物治疗以取得最好的治疗效果。因此,努力以不同类别的药物组合的分子靶点治疗癌症。单抗治疗和小分子抑制剂的协同效应逐步展现。同时使用不同类别的免疫活性剂得到一个特定的分子可以被认为是最有前途的战略,最大限度地抑制靶分子和克服单一治疗的限制。
干扰素α(英文简称INFα)为一种小分子抑制剂,是数十年前发现的与病毒复制相关的首个细胞因子,具有免疫调节和抗血管生成的作用,所以多年来在恶性肿瘤治疗的广泛应用。干扰素α属于I型干扰素,I型共有13种,分类依据是其同源受体特异性识别、基因位点、其主要的氨基酸序列同源性、刺激和产物的细胞类型。在最近几年,这个局面已经改变了。在分子水平,干扰素α已在多种恶性肿瘤的治疗中,表现出抗血管生成、诱导分化、增殖和凋亡的多方面影响的强效免疫调节作用。
干扰素α的直接作用是抑制细胞增殖,是通过阻滞细胞周期G1-S期在体外和体内对肿瘤细胞产生抑制作用。干扰素诱导基因的表达,如p21,p-27,2-5-a-synthetase,PKR,IRF-1和IRF-2。很长一段时间以来,认为干扰素的α对肿瘤细胞的直接抑制作用是患者抗肿瘤反应的主要机制。干扰素对肿瘤细胞的直接毒性作用的机制是诱导细胞凋亡。但是最近已经证明,干扰素α在调节先天免疫和适应性免疫系统中有重要作用:直接和间接影响的活化、迁移、分化、存活和免疫细胞包括巨噬细胞、单核细胞多树突状细胞(DC)亚群,自然杀伤DC细胞,B细胞和T细胞。最近发现的干扰素α能启动T细胞自发的抗肿瘤细胞的反应和先天免疫传感机制,促进他们的作用。
利妥昔单抗(英文简称RTX)或曲妥珠单抗(英文简称TRA)是分子靶向治疗药物,干扰素α作为小分子抑制剂用于免疫治疗。氧化石墨烯(英文简称GO),其含有sp2杂化带羟基和羧基的苯环,不仅性质稳定、生物相容性好,还可以通过π键、疏水作用、氢键和离子键与抗体、药物分子、金属离子、荧光基团或者细胞非共价结合。其次,二维结构的GO的表面比任何其他纳米材料都高出至少4个量级,它的每个原子都暴露在表面,适合于运载药物。GO是其他石墨材料的基本构建块,可以裹成0维的球体,滚成1维的碳纳米管,层叠成3维结构的石墨。良好的药物载体就有优良的表面化学性质,不仅生物相容性好,而且生物变化可控。因此,GO的结合方式目前主要分两种:共价和非共价,前者通常是通过氧化石墨烯的非饱和结构破坏而形成的原子掺杂或反应的技术;后者不改变GO的自然结构,只通过非共价键,如范德华力、π键和电荷吸引,结合更加灵活。
氧化石墨烯作为药物载体,通过非共价键与抗体、INFα联合。干扰素α/肿瘤抗体/氧化石墨烯的复合抗体可联合靶向治疗和免疫治疗,结合二者的优越性,既保留了靶向治疗对肿瘤细胞的特异性治疗,毒性低的优点;同时又具有免疫治疗的特性,通过INFα刺激免疫系统,促进肿瘤-免疫循环,解除肿瘤免疫机制,调控机体攻击肿瘤细胞,促进肿瘤特异性的细胞激活或者细胞因子的释放,达到缩小清除肿瘤、防治复发和最终治愈肿瘤的目标。
本发明具有以下有益效果:上述包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体,复合抗体可以有效地直接杀伤大部分的肿瘤细胞,破坏保护肿瘤细胞的微环境,同时INFα刺激免疫系统,打破肿瘤耐受,促进肿瘤特异性的细胞激活或者细胞因子的释放,达到缩小清除肿瘤、 防治复发和最终治愈肿瘤的目标。
可选地,干扰素α、肿瘤抗体和氧化石墨烯的比例为每200~2000单位干扰素α对应0.1~0.5mg氧化石墨烯和1~5mg肿瘤抗体。在复合抗体中,每200~2000单位干扰素α,相应的氧化石墨烯的质量为0.1~0.5mg,RTX单抗或TRA单抗的质量为1~5mg。在该比例下,三者的比例合适,对肿瘤的治愈效果好。
可选地,干扰素α、肿瘤抗体和氧化石墨烯的比例为每2000单位干扰素α对应0.1mg氧化石墨烯和1mg肿瘤抗体。在该比例下,对肿瘤的治愈效果进一步提升。
可选地,氧化石墨烯的粒径小于22μm。尽管氧化石墨烯溶于水,如生理盐水由于盐的电荷屏蔽作用使得氧化石墨烯发生聚集。颗粒较大的氧化石墨烯在生理盐溶液下容易发生聚集,生成沉淀,性质不稳定。当复合抗体用于人体内时,采用粒径小于22μm的氧化石墨烯可在人血清中稳定均匀分散。粒径小于22μm的氧化石墨烯可直接购买或通过大颗粒的氧化石墨烯经超声波破碎制取。
本发明另一方面提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体的制备方法,包括以下步骤:
将干扰素α和氧化石墨烯在32~42℃下混匀反应2~4小时。
加入肿瘤抗体混匀,在32~42℃反应4~8小时,得到包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体。
具体的,可将GO0.2mg和INFα2000单位,37℃下持续搅拌孵育2小时。制备好的1mlINFα/GO加入1mg肿瘤抗体(RTX或者TRA),在37℃下持续搅拌孵育12小时,备用。上述三种物质采用上述结合顺序,可保证三者的结合量较高,以保证治疗效果。
可选地,干扰素α和氧化石墨的反应温度为37℃,反应时间为2小时;加入肿瘤抗体的反应温度为37℃,反应时间为2小时。
反应温度选择37℃。原因有二:第一,这个温度下杀伤效果最好;第二,这个温度也是生理温度,有利于保障体外和体内实验结果的稳定,并为得到体外和体内一致的结果奠定了基础。利妥昔单抗、抗体和氧化石墨量大,结合稳定,继续增加反应时间,各步骤中相应物质的结合数量并不会明显增加。考虑到时间成本,反应时间可选优为2小时。
可选地,氧化石墨烯的制备包括以下步骤:
将氧化石墨烯原材料在0~4℃的条件下,通过超声波破碎,经过孔径0.22μm的滤网过滤,得到氧化石墨烯。
氧化石墨烯的制备很重要,严格控制大小和厚度。可从Sigma购得氧化石墨烯原材料,透析纯化去除酒精。将氧化石墨烯原材料在超声波破碎仪破碎成细小颗粒。然后将经过孔径0.22μm的滤网过滤。可采用全程在冰水混合物中进行操作以保证反应温度在0~4℃的条件,以避免超声仪探头过热影响仪器的工作效率,甚至损伤仪器。
可选地,超声波破碎的操作包括以下步骤:
将氧化石墨烯原材料配置为1~2mg/ml,在超声波破碎的强度为3.5的条件下,超声2小时,超声模式为工作10s,休息5s。
在美国Misonix超声波破碎仪Sonicator 3000,强度3.5,持续超声2小时,模式工作10秒,休息5秒。在该条件下,氧化石墨烯的粒径小于50nm,厚度为1~3nm。超声过滤处理过的GO能在人血清中稳定均匀分散,然而未经超声的一般GO(即一般的颗粒较大的氧化石墨烯,如从Sigma购得的氧化石墨烯原材料,其粒径>0.5-1μm和厚度>10nm)在4小时之内就发生沉淀。可见,处理后的GO比一般GO更薄(约8.6倍)更小,稳定性更好,生物分布更佳。
本发明还提供了一种包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体在治疗肿瘤药物中的应用。本发明的包含干扰素α/肿瘤抗体/氧化石墨烯的复合抗体具有治疗肿瘤药物的作用,尤其可治疗Burkitt淋巴瘤,因而该复合抗体可应用于治疗肿瘤药物。
本发明使用的干扰素α购自英国Merck Sharp&Dohme Limited公司。
利妥昔单抗购自美国罗氏公司。
曲妥珠单抗购自美国基因泰克公司公司。
CCK8试剂盒购自美国Sigma公司。
流式细胞仪LSR Fortessa购自美国BD Biosciences公司。
实施例1
GO 0.2mg和INFα2000单位,37℃下持续搅拌孵育2小时。制备好的1mlINFα/GO加入1mg RTX单抗,在37℃下持续搅拌孵育12小时,备用。GO为通过超声波破碎,经过孔径0.22μm的滤网过滤的氧化石墨烯。
实施例2
GO0.1mg和INFα2000单位,37℃下持续搅拌孵育2小时。制备好的1mlINFα/GO加入5mg TRA单抗,在37℃下持续搅拌孵育12小时,备用。GO为通过超声波破碎,经过孔径0.22μm的滤网过滤的氧化石墨烯。
实施例3
GO 0.4mg和INFα2000单位,37℃下持续搅拌孵育2小时。制备好的1mlINFα/GO加入3mg RTX单抗,在37℃下持续搅拌孵育12小时,备用。GO为通过超声波破碎,经过孔径0.22μm的滤网过滤的氧化石墨烯。
实施例4
GO 0.5mg和INFα2000单位,37℃下持续搅拌孵育2小时。制备好的1mlINFα/GO加入5mg RTX单抗,在37℃下持续搅拌孵育12小时,备用。GO为通过超声波破碎,经过孔径0.22μm的滤网过滤的氧化石墨烯。
实施例5
RTX/GO的制备
将0.2mg GO和1mg RTX在1ml 10%PBS(0.09%NaCl)中混合反应,在37℃下持续搅拌孵育8小时,制备获得RTX/GO。
TRA/GO的制备
将0.2mg TRA和1mg RTX在1ml 10%PBS(0.09%NaCl)中混合反应,在37℃下持续搅拌孵育8小时,制备获得RTX/GO。
实验数据
以下测试数据使用的INFα/RTX/GO为实施例1制备得到,RTX/GO和TRA/GO由实施例5制得。
外周血单核细胞的获取
外周血单核细胞(Peripheral blood mononuclear cell,PBMC),其主要细胞类型为血液中具有单个核的细胞,主要有淋巴细胞(T/B)、树突状细胞、单核细胞和吞噬细胞,其中淋巴细胞为主。分离PBMC的主要目的是为了去除多核细胞和红细胞,从而能够更方便地在体外模拟血液免疫环境。
Ficoll是蔗糖的中性多聚体,分子量约为400,000,当密度为1.2g/ml但仍未超出正常生理性渗透压,也不会穿过生物膜。粒细胞,红细胞比重比较大,离心后沉在管底。单核细胞和淋巴细胞的比重比较小,小于或等于分层液比重,离心后漂浮于分层液中或者液面,其中以液面为主。吸取分层液液面的细胞,洗涤纯化,就从外周血中分离得到单核细胞了。
具体外周血单核细胞的分离过程可为:血库需过滤去除PBMCs细胞以制备成分浓缩红细胞,因此可利用血库采用的血液过滤器初步分离红细胞和PBMCs细胞。血液过滤器全程置于冰中。准备50ml注射器,抽吸30ml冷PBS以及20ml空气,剪开过滤器的两端软管,逆向冲洗,直至过滤器中的血液全部冲洗下来,过滤器发白为止,全部转入50ml试管中。在4摄氏度,以2000/min的速度离心10分钟。离心后,血清在上层,红细胞在下层,取两层交界处的液体5ml。转入15ml插入冰中的试管中。加入5ml冷PBS后摇匀,然后用装好5ml移液玻璃管无菌电动移液枪取Ficoll 4ml从试管底部缓慢加入,始终保持分层清晰。在常温下配平后离心,速度RCF400g,时间20分钟,减速刹车初始设置为0,当RCF降至60后,由0升到1。去除上清液,取分层的交界处液体3ml,转移至另外干净的试管中,取样计数PBMCs浓度。结合注射的最佳体积为0.5-1ml,离心PBS洗涤,重悬于适当的体积。上述方法为从血液中提取分离PBMCs方法中的一种,当然本领域的技术人员也可采用其它方法提取。
动物实验1
NODragkoγko(NRG)雌性裸鼠35只,周龄6~8周(美国犹他大学实验动物学部提供), 分笼饲养,予以标准饲料及饮水让其自由摄食。环境温度22~24℃,相对湿度60-80%。小鼠随机分成7组,每组5只。在第1天,其中5组小鼠注射Raji 4×106,另外2组小鼠注射4RH4×106(对RTX耐药性最好的淋巴瘤细胞株)。第8天在7组小鼠体内注射提取的人类PBMC细胞5×106。第10、12天分别对7组小鼠进行治疗,每组注射量为100ul~200ul,根据小鼠体重加以调整。根据治疗方案和初始注射的淋巴瘤细胞株的区别,将7组小鼠分别命名为:(1)Raji PBS组;(2)Raji RTX组;(3)Raji RTX/GO组;(4)Raji RTX+O组;(5)Raji INFα/RTX/GO组;(6)4RH RTX/GO组;(7)4RH RTX+O组。其中O代表奥沙利铂。2次治疗后不再进行任何治疗,每天随访观察记录生存与否。
参照图1,最先出现死亡的一批是:4RH RTX+O、Raji RTX+O、Raji PBS和Raji RTX治疗组,该批小鼠均在治疗后半个月之内发病,其中PBS治疗组在这半个月内全部死亡,4RH RTX+O也出人意料的死亡80%。在60之内,所有接受4RH RTX+O,Raji RTX+O,Raji PBS,Raji RTX治疗的小鼠全部死亡。而对于接受Raji RTX/GO和4RH RTX/GO治疗的小鼠抑制健康的存活到第80天才开始发病死亡,这两组与前面的4组在生存曲线上差异有统计学意义(P<0.01)。在随后的30天以内,Raji RTX/GO和4RH RTX/GO治疗组的小鼠先后死亡,但是接受Raji INFα/RTX/GO治疗的小鼠仍然健康的存活着。
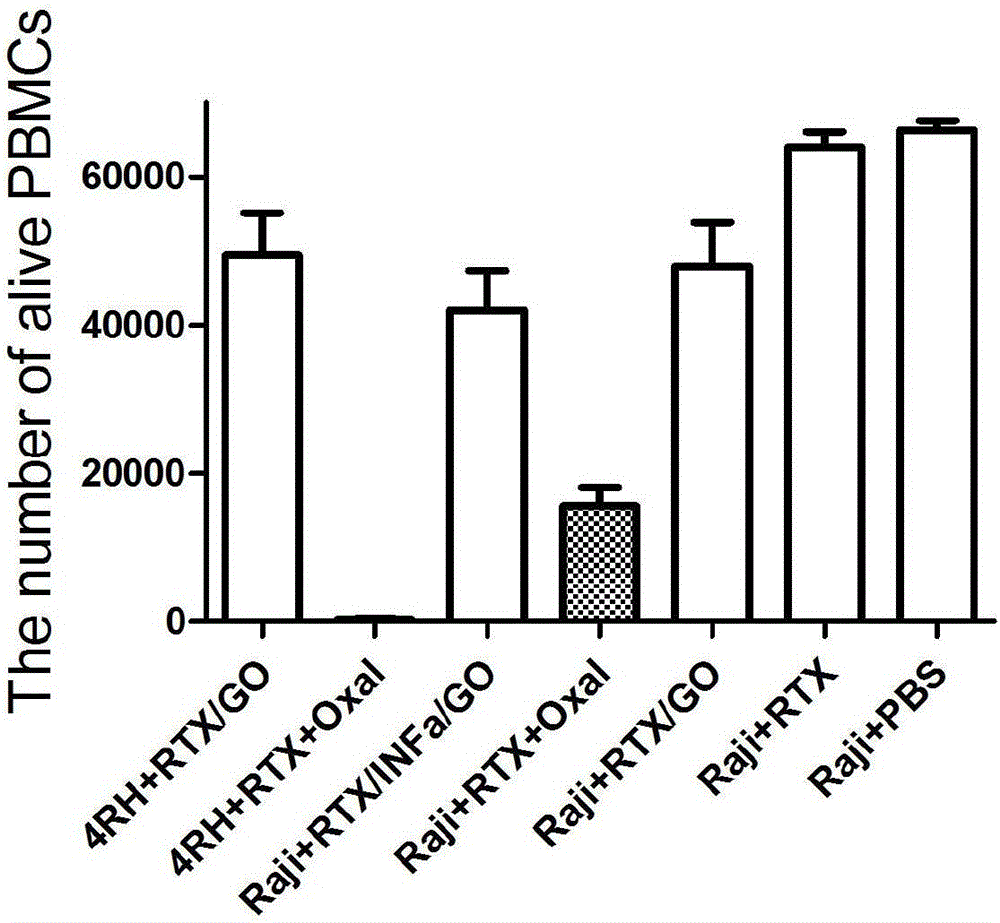
在上述动物实验的过程中,第15天,即PBMCs输注后的第7天,对所有NODragkoγko(NRG)雌性裸鼠行脸颊取血,经染色,孵育,红细胞裂解,洗涤,固定,流式细胞仪收集数据,结果整理分析,比较不同治疗组的模型体内PBMCs的数目差异。参照图2,结果显示,在含有化疗药物奥沙利铂的治疗组中,4RH RTX+O和Raji RTX+O,PBMCs组的PBMCs数目明显少于其他治疗组(P<0.01)。在Raji PBS组和Raji RTX组中,PBMCs的数目最多,且彼此之间差异没有统计学意义。有趣的是,INFα/RTX/GO增强了RTX/GO杀伤肿瘤细胞的能力,而且没有增强RTX/GO对PBMCs的作用,彼此之间差异没有统计学意义(P>0.05)。结果提示INFα/RTX/GO和RTX/GO可能轻度影响了PBMCs得总数,对但是没有影响它的功能,反而从整体而言更好的发挥了抗肿瘤的优势。
体外实验1
采用CCK8法进行细胞增殖-毒性检测,检测INFα、TRA、GO、TRA+INFα、PBS、TRA/GO和INFα/肿瘤抗体/GO对MG63的治疗效果,以反映上述物质对肿瘤细胞的作用。
实验结果体现,参照图3~4,INFα(2000U/ml),TRA(37.5μg/ml),GO(7.5μg/ml),甚至TRA+INFα,10%PBS在450nm处的吸光度都在1.0附近,彼此差异没有统计学意义,然而TRA/GO(37.5/7.5μg/ml)组在450nm处的吸光度低于0.40,与前三者相比差异有统计学意义(P<0.05)。在INFα/TRA/GO组吸光度约为0.15,与前面的对照组差异有统计学意义(P<0.01)。数据以相对于PBS的相对吸光度值的形式呈现。显而易见,INFα在该浓度下只有轻微的直接抑制肿瘤细胞生长的作用,但是INFα/TRA/GO与TRA/GO差异有统计学意义(P<0.05),提示结合在GO上的INFα可以增强INFα/TRA/GO杀伤MG63的能力。如图3可知,游离的干扰素对肿瘤细胞无杀伤。INFa/TRA/GO比TRA/GO在体外杀伤肿瘤细胞的能力更强。在INFα/RTX/GO治疗Raji的体外实验也可见类似结果,如表1所示。
表1不同处理组的相对吸光度值
体外实验2
首先对PBMCs和Raji细胞进行培养,所用培养基为完全培养基MEM,完全培养基的配制以及细胞培养的方法可按照现有技术的方法完成。同时,需要加入PBMCs的刺激剂30ng/ml的OKT3(即CD3单克隆抗体)和50IU/ml的IL-2(即白细胞介素-2),还需要加入事先培养好的DCs(即树突状细胞),培养5天。PBMCs分为多组,分别予以不同药物处理:(1)10%PBS、(2)GO、(3)RTX、(4)RTX+INFα、(5)INFα、(6)RTX/GO和(7)INFα/RTX/GO。然后经流式细胞仪对各组分析收集数据。
检测发现,参照图5,存活淋巴瘤细胞最多的3组分别是(1)10%PBS、(2)GO和(3)RTX治疗组,细胞数在17000-19000之间,彼此之间差异没有统计学意义P>0.05,而与这三组相比,(6)RTX/GO治疗组的存活淋巴瘤细胞数要少很多,结果差异有统计学意义P<0.01。有趣的是,INFα在PBMCs存在的情况能有效的抑制Raji细胞的增殖,正如在(4)RTX+INFα、(5)INFα治疗组中,存活的淋巴瘤细胞数降至约10000。更重要的是,在PBMCs存在的情况下,INFα/RTX/GO组(存活的淋巴瘤细胞数约5000)比RTX/GO(存活的淋巴瘤细胞数约3000)的显示出更好的治疗效果。为了探索可能的原因,样本经FOXP3染色,经过流式细胞仪分析收集数据。
调节性T细胞(Regulatory T cells,简称Tregs)是控制体内自身免疫反应性的一类T细胞亚群Tregs与自身免疫性疾病的发生密切相关,其异常表达可诱发自身免疫性疾病。FOXP3是控制Treg细胞发育和功能的关键转录因子之一,也是控制免疫抑制分子表达的关键因素。因此,阐明FOXP3的分子靶点是透彻理解Treg免疫抑制作用的必要条件之一。
各组的样本的检验过程如下:
1、对完成细胞表面免疫荧光染色。
2、样本加入1X BioLegend’s FOXP3Fix/Perm缓冲液200μl,震动摇匀,在室温避光孵育20分钟,离心去除上清液,收集细胞。BioLegend’s FOXP3Fix/Perm缓冲液为现有的试剂盒。
3、用细胞染色溶液(Cat.No.420201)洗涤一次,在250g转速下离心5分钟去除上清液。
4、用1X BioLegend’s FOXP3破膜缓冲液洗涤一次。
5、重悬细胞于1ml 1X BioLegend’s FOXP3破膜缓冲液,室温下闭光孵育15分钟,离心去除上清液收集细胞,然后重悬细胞与100μl的1X BioLegend’s FOXP3破膜缓冲液。
6、加入适量的抗FOXP3的荧光抗体,在室温避光孵育30分钟。
7、用细胞染色缓冲液洗涤2次,细胞重悬于200μl的染色缓冲液,在流式细胞仪下分析收集数据。
实验结果如图6~8所示,发现INFα抑制了FOXP3阳性细胞的增殖,改变了Teff/Treg的比例,这些可能与INFα/RTX/GO的杀伤肿瘤细胞作用机制相关。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种以氧化石墨烯接枝天然橡胶增容剂改性的ABS基竹塑橱柜板材及其制备方法与流程
- 一种以氧化石墨烯接枝氯化聚乙烯增容改性的聚乙烯基竹塑橱柜板材及其制备方法与流程
- 一种氧化石墨烯改性的高性能超滤复合膜及其制备方法与流程
- 一种还原氧化石墨烯/卟啉/铂纳米复合材料及其制备和应用的制作方法与工艺
- 一种从废水中回收氧化石墨烯的生物絮凝剂及其制备方法与流程
- 氧化石墨烯交联聚酰亚胺半互穿网络型复合膜及其制备的制造方法与工艺
- 一种氧化石墨烯改性的高性能正渗透复合膜及制备方法与流程
- 一种含改性氧化石墨烯的新型聚醚酰亚胺纳滤膜的制备方法与流程
- 一种硫化锡‑氧化石墨烯复合光催化剂及制备方法、应用与制造工艺
- 一种用于速生木材的添加氧化石墨烯改性乳液的复合改性剂的制造方法与工艺