使用单剂量奥利万星的治疗方法与流程
本申请为申请日为2009年8月29日,申请号为CN200980143947.5的中国申请的分案申请。
发明背景
奥利万星二磷酸盐(奥利万星)为天然存在糖肽的半合成脂糖肽类衍生物。其结构赋予针对革兰氏阳性菌的有效抗菌活性,所述革兰氏阳性菌包括万古霉素耐药性肠球菌(VRE)、甲氧西林耐药性葡萄球菌和万古霉素耐药性葡萄球菌以及青霉素耐药性链球菌。其针对指数生长的金黄色葡萄球菌(S.aureus)的杀菌活性的速度(使MSSA、MRSA和VRSA在15分钟至2小时之内减少≥3-log)为将其与原型糖肽类万古霉素区分开的特征之一(McKay等,J Antimicrob Chemother.63(6):1191-9(2009),Epub 2009年4月15日)。
奥利万星通过与诸如万古霉素等糖肽类共有的机理抑制肽聚糖(细菌细胞壁的主要结构组分)的合成(Allen等,Antimicrob Agents Chemother 41(1):66–71(1997);Cegelski等,J Mol Biol 357:1253-1262(2006);Arhin等,Poster C1-1471:Mechanisms of action of oritavancin in Staphylococcus aureus(奥利万星在金黄色葡萄球菌中的作用机理)[poster].47th Intersci Conf Antimicro Agents Chemo,2007年9月17-20日;Chicago,IL)。如同万古霉素,奥利万星与肽聚糖前体(脂结合的N-乙酰基-葡糖胺-N-乙酰基-胞壁酸-五肽)的酰基-D-丙氨酰-D-丙氨酸末端结合(Reynolds,Eur J Clin Microbiol Infect Dis 8(11):943–950(1989);Nicas和Allen,Resistance and mechanism of action(耐药性和作用机理).载于:Nagarajan R,编辑.Glycopeptide antibiotics.New York:Marcel Dekker 195–215(1994);Allen等,Antimicrob Agents Chemother 40(10):2356–2362(1996);Allen和Nicas,FEMS Microbiology Reviews 26:511–532(2003);Kim等,Biochemistry 45:5235-5250(2006))。然而,甚至在底物为VRE和万古霉素耐药性金黄色葡萄球菌(VRSA)中存在的已改变的肽聚糖前体时,奥利万星也抑制细胞壁生物合成。因此,奥利万星的抗菌活性谱超出万古霉素的,延伸至包括糖肽耐药性肠球菌和葡萄球菌(Ward等,Expert Opin Investig Drugs 15:417-429(2006);Scheinfeld,J Drugs Dermatol 6:97-103(2007))。奥利万星可通过直接与细胞壁生物合成的转糖基作用步骤中的细菌蛋白相互作用,来抑制耐药性细菌(Goldman和Gange,Curr Med Chem 7(8):801–820(2000);Halliday等,Biochem Pharmacol 71(7):957-967(2006);Wang等,Poster C1-1474:Probing the mechanism of inhibition of bacterial peptidoglycan glycotransferases by glycopeptide analogs(探索糖肽类似物对细菌肽聚糖糖基转移酶的抑制机理).47th Intersci Conf Antimicro Agents Chemo,2007年9月17-20日)。奥利万星还在革兰氏阳性菌中瓦解跨膜电势,导致迅速杀伤(McKay等,Poster C1-682:Oritavancin disrupts transmembrane potential and membrane integrity concomitantly with cell killing in Staphylococcus aureus and vancomycin-resistant Enterococci(奥利万星在金黄色葡萄球菌和万古霉素耐药性肠球菌中伴随着细胞杀伤破坏跨膜电势和膜完整性).46th Intersci Conf Antimicro Agents Chemo,San Francisco,CA,2006年9月27-30日)。上述多种作用促成奥利万星的快速杀菌活性。
奥利万星处于针对严重革兰氏阳性感染的临床开发中,其中该药物的给予是通过静脉输注,使用连续数天内给予的数个剂量。开发该药物的备选给药方案可扩展医师可用的治疗选择。本发明涉及新的给药方案。
发明简述
如本文所公开,已发现糖肽类抗生素奥利万星(也熟知为NDISACC-(4-(4-氯苯基)苄基)A82846B和LY333328)在疗程内以一剂给予受试者时,显示针对细菌感染的临床上显著的治疗活性。本发明涉及使用一剂奥利万星(或其药学上可接受的盐、水合物或溶剂化物或者它们的混合物)治疗、预防和/或防止受试者例如人的细菌感染的方法。
在第一个实施方案中,本发明涉及通过在疗程内将一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物)给予受试者来治疗受试者的细菌感染的方法。
在该实施方案的第一个方面,本发明涉及治疗受试者的细菌感染的方法,其包括在疗程内将一剂治疗有效量的药物组合物给予细菌感染的受试者,从而治疗受试者的细菌感染,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在一个优选的方面,所述药物组合物包含至少约400mg奥利万星或其药学上可接受的盐。在另一个优选的方面,所述药物组合物包含约400mg-约1800mg奥利万星或其药学上可接受的盐。在特定方面,所述药物组合物包含约800mg、900mg、1000mg、1100mg或1200mg奥利万星或其药学上可接受的盐。
在该第一个方面的变型中,可将单个后续剂量的奥利万星给予受试者。因此,第一个方面的方法还可包括在疗程内给予第二剂治疗有效量的药物组合物,其包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。优选的是,第二剂包含少于或等于第一剂的奥利万星的量。还优选的是,第二剂在第一剂之后约4天以上给予。
在该实施方案的第二个方面,本发明涉及治疗受试者的细菌感染的方法,其包括在疗程内以足以达到不低于约20μg/mL的奥利万星最大血浆浓度(Cmax)的量,将一剂药物组合物给予细菌感染的受试者,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在优选的方面中,奥利万星的Cmax不低于约40μg/mL、60μg/mL或80μg/mL。
在该第二个方面的变型中,可将单个后续剂量的奥利万星给予受试者。因此,第二个方面的方法还可包括在疗程内给予第二剂治疗有效量的药物组合物,其包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。优选的是,第二剂包含少于或等于第一剂的奥利万星的量。还优选的是,第二剂在第一剂之后约4天以上给予。
在该实施方案的第三个方面,本发明涉及治疗受试者的细菌感染的方法,其包括在疗程内以足以达到至少约20mg*h/Lμg/mL的奥利万星浓度曲线下面积(AUC 0-24小时)的量,将一剂药物组合物给予细菌感染的受试者,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在优选的方面,奥利万星的AUC 0-24小时为至少约40mg*h/Lμg/mL、80mg*h/Lμg/mL或120mg*h/Lμg/mL。
在该第三个方面的变型中,可将单个后续剂量的奥利万星给予受试者。因此,第三个方面的方法还可包括在疗程内给予第二剂治疗有效量的药物组合物,其包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。优选的是,第二剂包含少于或等于第一剂的奥利万星的量。还优选的是,第二剂在第一剂之后约4天以上给予。
在第二个实施方案中,本发明涉及通过在疗程内将一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物)给予受试者来对受试者的细菌感染提供预防的方法。
在该实施方案的一个方面,本发明涉及对受试者的细菌感染提供预防的方法,其包括在预防过程中,将一剂治疗有效量的药物组合物给予处于发展细菌感染的风险中的受试者,从而对受试者提供针对细菌感染的预防,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在一个优选的方面,所述药物组合物包含至少约200mg奥利万星或其药学上可接受的盐。在另一个优选的方面,所述药物组合物包含约200mg-约1800mg奥利万星或其药学上可接受的盐。在特定方面,所述药物组合物包含约300mg、400mg、500mg、600mg、700mg或800mg奥利万星或其药学上可接受的盐。在优选的方面中,预防维持至少约4、8或12小时。在一个备选的方面,在手术过程、牙科过程或侵入性医学过程的持续时间内保持预防。
在该方面的变型中,可将单个后续剂量的奥利万星给予受试者。因此,该实施方案的方法还可包括在疗程内给予第二剂治疗有效量的药物组合物,其包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。优选的是,第二剂包含少于或等于第一剂的奥利万星的量。
在第三个实施方案中,本发明涉及通过在疗程内将一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物)给予受试者来防止受试者的细菌感染的方法。
在该实施方案的一个方面,本发明涉及防止受试者的细菌感染的方法,其包括在防止过程中将一剂治疗有效量的药物组合物给予处于暴露至感染菌的风险中的受试者,从而防止受试者的细菌感染,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在一个优选的方面,所述药物组合物包含至少约400mg奥利万星或其药学上可接受的盐。在另一个优选的方面,所述药物组合物包含约400mg-约1800mg奥利万星或其药学上可接受的盐。在特定方面,所述药物组合物包含约700mg、800mg、900mg、1000mg、1100mg或1200mg奥利万星或其药学上可接受的盐。在优选的方面,所述防止维持至少约24、72或114小时。
在该方面的变型中,可将单个后续剂量的奥利万星给予受试者。因此,该实施方案的方法还可包括在疗程内给予第二剂治疗有效量的药物组合物,其包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。优选的是,第二剂包含少于或等于第一剂奥利万星的量。
优选实施其中通过静脉给药或口服给予药物组合物的本发明各种方法。
本发明的方法包括其中细菌感染为复杂性皮肤和皮肤组织感染(Complicated Skin and Skin Structure Infection,cSSSI)的方法。本发明的方法还包括其中感染菌和引起细菌感染的细菌选自以下细菌的方法:革兰氏阳性菌、金黄色葡萄球菌(Staphylococcus aureus)、甲氧西林耐药性金黄色葡萄球菌、万古霉素耐药性金黄色葡萄球菌、万古霉素中度耐药(vancomycin-intermediate)金黄色葡萄球菌、异质性万古霉素中度耐药(vancomycin hetero-intermediate)金黄色葡萄球菌、酿脓链球菌(Streptococcus pyogenes)、无乳链球菌(Streptococcus agalactiae)、咽峡炎链球菌(Streptococcus anginosus)、中间链球菌(Streptococcus intermedius)、星座链球菌(Streptococcus constellatus)、停乳链球菌(Streptococcus dysgalactiae)、停乳链球菌似马亚种(Streptococcus dysgalactiae subsp.equisimilis)、肺炎链球菌(Streptococcus pneumoniae)、A组链球菌、B组链球菌、C组链球菌、D组链球菌、肠球菌(Enterococci species)、粪肠球菌(Enterococcus faecalis)、万古霉素耐药性粪肠球菌、屎肠球菌(Enterococcus faecium)、万古霉素耐药性屎肠球菌、表皮葡萄球菌(Staphylococcus epidermidis)、甲氧西林耐药性表皮葡萄球菌、溶血性葡萄球菌(Staphylococcus haemolyticus)、炭疽芽孢杆菌(Bacillus anthracis)和艰难梭菌(Clostridium difficile)。
附图简述
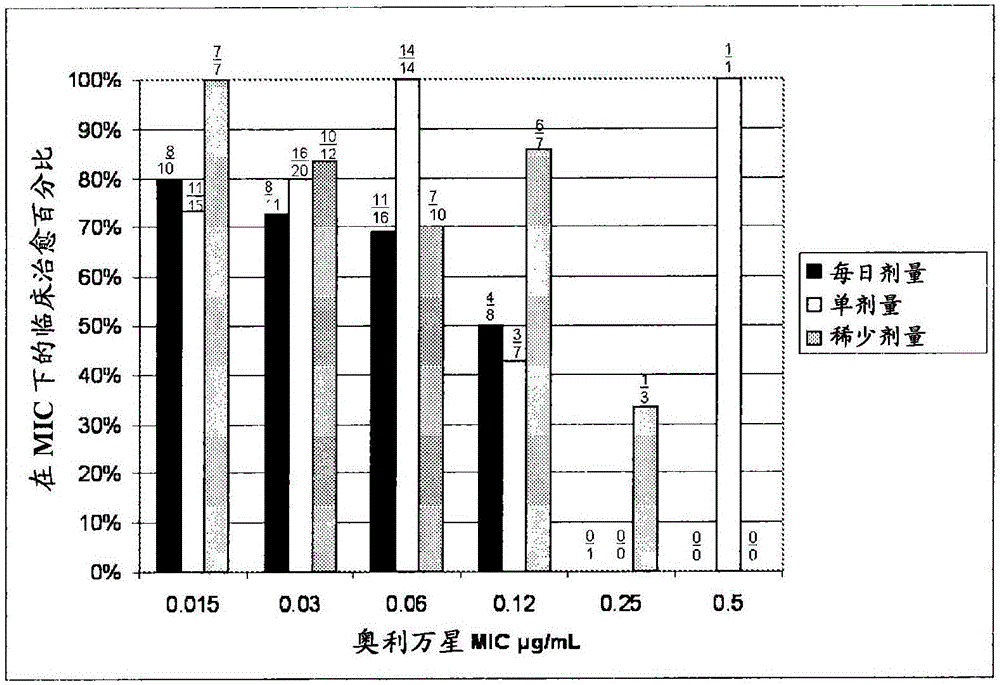
图1在治疗试验的微生物学可评价群体中,奥利万星MIC对金黄色葡萄球菌的临床治愈率。
图2在治疗试验的微生物学可评价群体中,奥利万星MIC对甲氧西林耐药性金黄色葡萄球菌的临床治愈率。
图3在中性粒细胞减少症的小鼠大腿感染模型中,奥利万星针对MSSA和MRSA的单剂量反应比较研究。由金黄色葡萄球菌ATCC13709(MSSA)和NRS123(MRSA)引起的感染。相似的ED50:对ATCC13709和NRS123分别为5.8(3.3-10)和2.4(0.8-7.3)mg/kg。
图4在中性粒细胞减少症的小鼠大腿感染模型中,奥利万星的HEQ剂量有效性(平均值±SEM)。由金黄色葡萄球菌ATCC13709引起的感染。对于200、400和1200mg在72小时时观测到≥2-Log杀伤的剂量-反应关系。
图5在中性粒细胞减少症的小鼠大腿感染模型中,在感染后72小时时,奥利万星针对MSSA或MRSA菌株的有效性(具有95%CI的平均值)。与200mg HEQ剂量相比,*p值≤0.05。体内有效性不受苯唑西林耐药性表型的影响。奥利万星对所有测试的菌株具有活性,与它们的MIC无关。
图6所给予奥利万星剂量的直方图。
图7奥利万星输注持续时间的直方图。
图8奥利万星输注速率的直方图。
图9在单剂量奥利万星之后从最后输注(按剂量范围分级(stratify))开始,奥利万星浓度对时间的半对数散点图。
发明详述
本发明基于发明人的以下发现:奥利万星显示延长的血浆半寿期。该发现使得单剂量的所述化合物在治疗、预防或防止受试者的细菌感染中有效。因此,在第一个实施方案中,本发明涉及治疗受试者的细菌感染的方法,其包括在疗程内将一剂治疗有效量的奥利万星或其药学上可接受的盐给予细菌感染的受试者。在发明简述中提供了该实施方案的特定方面。
在第二个实施方案中,本发明涉及对受试者的细菌感染提供预防的方法,其包括在疗程内将一剂治疗有效量的奥利万星或其药学上可接受的盐给予需要预防的受试者。在发明简述中提供了该实施方案的特定方面。
在第三个实施方案中,本发明涉及防止受试者的细菌感染的方法,其包括在疗程内将一剂治疗有效量的奥利万星或其药学上可接受的盐给予需要所述防止的受试者。在发明简述中提供了该实施方案的特定方面。
在各个实施方案中,可将第二剂治疗有效量的奥利万星或其药学上可接受的盐给予受试者。
优选的是,在本发明各个实施方案中,奥利万星以包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂的药物组合物形式给予。
奥利万星(也称为N-(4-(4-氯苯基)苄基)A82846B和LY333328)具有以下化学结构:
奥利万星本身就可用于本发明的方法,或者可以药学上可接受的盐、水合物、溶剂化物或其混合物的形式用于本发明的方法。术语“药学上可接受的盐”是指衍生自无机酸和有机酸的无毒的酸加成盐。尽管本文提及“奥利万星”和“其药学上可接受的盐”两者,但是除非由上下文另外指出,术语“奥利万星”应理解为包括所述化合物本身以及药学上可接受的盐,这是因为为了简洁起见,可仅使用术语“奥利万星”。
通常用于生成酸加成盐的酸为无机酸例如盐酸、氢溴酸、氢碘酸、硫酸、磷酸等,和有机酸例如对甲苯磺酸、甲磺酸、草酸、对溴苯磺酸、碳酸、琥珀酸、柠檬酸、苯甲酸、乙酸等。碱加成盐包括以下盐:其衍生自无机碱例如铵或碱金属或碱土金属的氢氧化物、碳酸盐、碳酸氢盐等。因此,可用于制备本发明盐的这类碱包括氢氧化钠、氢氧化钾、氢氧化铵、碳酸钾、碳酸钠、碳酸氢钠、碳酸氢钾、氢氧化钙、碳酸钙等。尤其优选钾盐形式和钠盐形式。
应认识的是,构成本发明任何盐一部分的具体反荷离子并不是关键的性质,只要作为整体的盐为药理学上可接受的,并且反荷离子并不赋予作为整体的盐不合乎需要的性质即可。
用于制备包括奥利万星及其类似物在内的糖肽类抗生素的方法可见于例如美国专利号5,840,684,其通过引用以其整体结合于本文中。
药物组合物
在本发明的各种方法中,奥利万星可以药物组合物的形式给予受试者。本发明的药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或赋形剂。
药学上可接受的载体和赋形剂为以下化合物、溶液、物质或材料:其可用于制备适于给予受试者例如人的奥利万星制剂。具体而言,本发明的载体和赋形剂为可用于制备以下药物组合物的载体和赋形剂:所述药物组合物通常安全、无毒且既不是生物学上不合乎需要的也不是其它方面不合乎需要的,其可能呈现药理学上有利的特征,并包含为兽医用途和人类药物用途所接受的载体和赋形剂。合适的药学上可接受的载体和赋形剂为本领域所熟知,并可由本领域技术人员根据临床情况来确定。技术人员会理解的是,稀释剂包括在术语载体和赋形剂的范围之内。合适的载体和赋形剂的实例包括葡萄糖、水、甘油、乙醇、丙二醇、聚山梨酯80(Tween-80TM)、聚乙二醇300和400(PEG 300和400)、聚乙二醇化蓖麻油(例如Cremophor EL)、泊洛沙姆407和188、环糊精或环糊精衍生物(包括HPCD((2-羟基丙基)-环糊精)和(2-羟基乙基)-环糊精;参见例如美国专利申请公开20060194717)、亲水载体和疏水载体,以及其组合。疏水载体包括例如脂肪乳剂、脂质、聚乙二醇化磷脂(PEGylated phospholid)、聚合物基质、生物相容的聚合物、脂质球(liposphere)、小囊泡、颗粒和脂质体。该术语明确排除细胞培养基。更具体地:(1)5%(w/v)葡萄糖或(2)水可用作药学上可接受的载体。
制剂中包含的赋形剂具有不同的目的,这取决于例如药物性质和给药模式。通常使用的赋形剂的实例包括而不限于:稳定剂、增溶剂和表面活性剂、缓冲剂、抗氧化剂和防腐剂、张度剂、填充剂(bulking agent)、润滑剂、乳化剂、助悬剂或粘度剂(viscosity agent)、惰性稀释剂、填料(filler)、崩解剂、粘合剂、湿润剂、润滑剂、抗菌剂、螯合剂、甜味剂、芳香剂、矫味剂、着色剂、给药助剂(administration aid)及其组合。
所述组合物可包含常用载体和赋形剂,例如玉米淀粉或明胶、乳糖、蔗糖、微晶纤维素、高岭土、甘露醇、磷酸二钙、氯化钠、海藻酸、交联羧甲基纤维素钠和淀粉羟乙酸钠。
所用的具体载体、稀释剂或赋形剂将取决于活性成分所用于的方法和目的。
药学上可接受的赋形剂还包括使组合物与血液相容的张度剂。在注射用制剂中尤其需要张度剂。
用于制备依据本发明的药物组合物的可接受方法为本领域技术人员所已知。例如,可按照药剂师的常规技术制备药物组合物,以得到用于各种给药途径的所需制品,所述技术适当地包括以下步骤:例如混合、粒化和压缩(当需要片剂形式时),或混合、填充和溶解成分。
治疗、预防和防止的方法
本发明的方法包括使细菌与有效量的奥利万星或其药学上可接受的盐接触。例如,可通过使革兰氏阳性菌与奥利万星接触来抑制这类细菌的细胞壁生物合成。所述接触可在体外(在生物化学测定和/或细胞测定中)、非人类动物体内、哺乳动物(包括人类)体内和/或离体(例如用于灭菌目的)进行。本文所用术语“接触”广义上意指使细菌细胞和奥利万星分子足够接近,使得奥利万星可对细菌细胞施加作用。奥利万星可被转运至细菌细胞的位置,或者奥利万星可位于细菌细胞途经的位置或使细菌细胞与之接触的位置。技术人员会理解的是,术语“接触”包括奥利万星与细菌细胞之间的物理相互作用以及无需物理相互作用的相互作用。
本文所用“受试者”意指动物,例如哺乳动物包括人类和其它高等灵长类、低等灵长类和有兽医重要性的动物例如狗、猫、马、绵羊、山羊和牛等,优选人。受试者可具有细菌感染,可处于发展细菌感染的风险中或可处于比一般群体暴露至感染菌的风险更高的风险中。
本文所用“细菌感染”是指本文所公开的单剂量给药方法适用的由细菌的种或菌株所引起的感染。例如,治疗方法可用于治疗具有细菌性皮肤感染的受试者,所述感染为例如复杂性皮肤和皮肤组织感染(cSSSI)以及复杂性和非复杂性皮肤和软组织感染(SSTI),包括脓肿、溃疡、烧伤和蜂窝织炎。治疗方法还包括治疗深部细菌感染例如大脓肿(major abscess)、感染性溃疡、重度烧伤或深部广泛性蜂窝织炎。可使用本发明方法治疗的其它细菌感染包括血流感染(BSI)、与导管有关的血流感染(CRBSI)、骨髓炎、假关节感染、肺炎(社区获得性和医院内)、关节腔感染和装置感染(device infection)(例如与起搏器和内部心脏除颤器相关的感染)。治疗方法还可伴随外科手术施用于细菌感染。
感染菌和引起细菌感染的细菌包括美国专利号5,840,684中所述的细菌、革兰氏阳性菌和尤其是金黄色葡萄球菌(甲氧西林敏感性菌株和甲氧西林耐药性菌株;万古霉素敏感性菌株、万古霉素中度耐药菌株、异质性万古霉素中度耐药菌株和万古霉素耐药性菌株)、酿脓链球菌、无乳链球菌、咽峡炎链球菌组(包括咽峡炎链球菌、中间链球菌和星座链球菌(S.constellatus))、停乳链球菌(包括停乳链球菌似马亚种)、肺炎链球菌、链球菌(包括A组链球菌、B组链球菌、C组链球菌和D组链球菌)、肠球菌、粪肠球菌(万古霉素敏感性菌株和万古霉素耐药性菌株)、屎肠球菌(万古霉素敏感性菌株和万古霉素耐药性菌株)、表皮葡萄球菌(甲氧西林敏感性菌株和甲氧西林耐药性菌株)、溶血性葡萄球菌、炭疽芽孢杆菌和艰难梭菌(营养体型和孢子两者)。
治疗方法
如上文发明概述中所论述,在第一个实施方案中,本发明涉及通过在疗程内将一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物)给予受试者,来治疗受试者的细菌感染的方法。因此,本发明包括治疗受试者的细菌感染的方法,其包括在疗程内将一剂治疗有效量的药物组合物给予细菌感染的受试者,从而治疗受试者的细菌感染,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在该实施方案的一个方面,可将第二剂药物组合物给予受试者。
本发明的治疗方法还可基于在受试者中获得奥利万星的特定药代动力学概况(Bhavnani等,Antimicrobial Agents Chemother.50(3):994-1000(2006))。例如,本发明包括治疗受试者的细菌感染的方法,其包括给予足以达到以下目标中的一个或多个的一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物):(1)不低于选定水平的奥利万星最大血浆浓度(Cmax),或(2)至少选定水平的最小浓度曲线下面积(AUC 0-24小时)。
因此,本发明还包括治疗受试者的细菌感染的方法,其包括在疗程内以足以达到不低于选定值的奥利万星最大血浆浓度(Cmax)的量,将一剂药物组合物给予细菌感染的受试者,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在该实施方案的一个方面,可将第二剂药物组合物给予受试者。
应当理解的是,奥利万星的治疗有效的最小Cmax将根据以下因素变化:给予受试者的制剂中奥利万星的浓度、给药方法、给药持续时间、治疗的细菌感染类型和感染中细菌的特性以及其它因素例如受试者的体格特征。然而,大多数情况下,应在受试者内达到不少于约1μg/mL的最小Cmax。因此,本发明包括在受试者内达到不小于约1、5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95或100μg/mL的最小Cmax。在优选的方面中,奥利万星的Cmax不小于约20μg/mL。在其它优选的方面中,奥利万星的Cmax不小于约40μg/mL、60μg/mL或80μg/mL。
本发明还包括治疗受试者的细菌感染的方法,其包括在疗程内以足以达到至少选定值的奥利万星浓度曲线下面积(AUC 0-24小时)的量,将一剂药物组合物给予细菌感染的受试者,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在该实施方案的一个方面,也可将第二剂药物组合物给予受试者。
应当理解的是,奥利万星的治疗有效的最小AUC 0-24小时将根据以下因素而变化:给予受试者的制剂中奥利万星的浓度、给药方法、给药持续时间、治疗的细菌感染类型和感染中细菌的特性以及其它因素例如受试者的体格特征。然而,在大多数情况下,应在受试者内达到至少约20mg*h/Lμg/mL的最小AUC 0-24小时。因此,本发明包括在受试者内达到不小于约20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120、125、130、135、140、145或150mg*h/Lμg/mL的最小AUC。在优选的方面中,奥利万星的AUC 0-24小时为至少约20mg*h/Lμg/mL。在其它优选的方面中,奥利万星的AUC 0-24小时为至少约40mg*h/Lμg/mL、80mg*h/Lμg/mL或120mg*h/Lμg/mL。
术语“治疗(treating和treatment)”意指至少减轻与受试者的细菌感染相关的疾病病状或症状,这通过在受试者体表或体内的细菌生长、复制和/或增殖的减少或者细菌的死亡或破坏来实现。术语“治疗”包括完全或部分治愈、痊愈、抑制、解除、改善和/或减轻疾病病状。与未给予奥利万星的受试者相比,受试者的疾病病状或症状的减轻可为约100%、99%、98%、97%、96%、95%、90%、80%、70%、60%、50%、40%、30%、20%、10%、5%或1%。在一个方面,治疗意指将引起受试者感染的细菌种群减少至检不出的水平,其中检测为通过任何常规方法检测,例如在实验室中培养样品。在另一个方面,治疗意指完全治愈感染,表现为没有感染相关临床症状。在本发明另一个方面,治疗意指将受试者的疾病病状或症状减轻至少约90%。在另一个方面,治疗意指将受试者的疾病病状或症状减轻至少约95%。
每一剂中奥利万星的治疗有效量和足以达到本文所公开治疗方法的规定目标的量将视以下因素而变化:例如受试者的体格特征、受试者症状的严重性、感染形式、细菌特性、用于给予药物的制剂和方法以及实施的方法。给定受试者的具体剂量通常由主治医师判断设定。然而,每一剂中奥利万星的治疗有效量典型地为至少约200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000mg奥利万星。在特定方面,每一剂中奥利万星的治疗有效量为约100mg-3000mg奥利万星,优选约200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000mg奥利万星。
在一个优选的方面,剂量包含至少约400mg奥利万星。在另一个优选的方面,剂量包含约400mg-约1800mg奥利万星。在特定方面,剂量包含约800、900、1000、1100或1200mg奥利万星。
根据给药方式,剂量可一次性全部给予(例如用胶囊中的口服制剂),或者可在一段时间内缓慢给予(例如静脉给药)。对于较慢的给药方式,给药持续时间可以分钟计,例如约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120或更多分钟,或者是以小时计的时间,例如约0.5、1、1.5、2、2.5、3、3.5、4、4.5、5或更多小时。可中断剂量的给予,例如其中通过静脉输注给予剂量并且将剂量分成两袋或更多袋输注袋。在这类情况下,当更换输注袋时,可中断剂量的给予。
预防方法
在第二个实施方案中,本发明涉及通过在疗程内将一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物)给予受试者,来对受试者的细菌感染提供预防的方法。因此,本发明包括对受试者的细菌感染提供预防的方法,其包括在预防过程中,将一剂治疗有效量的药物组合物给予处于发展细菌感染的风险中的受试者,从而对受试者的细菌感染提供预防,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在该实施方案的一个方面,可将第二剂药物组合物给予受试者。
许多医师认为:在手术过程、牙科过程或侵入性医学过程之前,应当为人类考虑抗生素预防,以减少因所述过程期间无效的无菌度导致感染的可能。深部感染为有时需要后续医学介入的严重并发症,并且伴随显著的发病率和死亡率。因此,奥利万星可用作该情形中预防抗生素的替代或附加的预防抗生素。例如,在侵入性医学治疗例如手术或植入留置装置(例如关节替换(髋、膝、肩等))前不久,可将本发明的奥利万星和/或药物组合物给予受试者,以达到针对相关细菌的全身性作用和/或局部作用。在侵入性医学治疗之后例如术后或装置在体内期间,可重复治疗。
术语“预防”意指细菌感染相关疾病病状在受试者优选人中形成的可能性的减少。具体而言,该术语涉及将奥利万星给予受试者以减少细菌感染发生的可能性,所述细菌感染例如在手术、牙科过程或侵入性医学过程期间或之后可能发生的细菌感染。例如,可在暴露至细菌之前通过给予奥利万星减少受试者的细菌感染的可能性。与未给予奥利万星的受试者相比,预防可为在受试者中约减少至少约100%、99%、98%、97%、96%、95%、90%、80%、70%、60%、50%、40%、30%、20%、10%、5%或1%。在给予奥利万星之后,预防可在受试者中持续至少约0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、22、23或24小时,或者2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、30或更多天。在一个备选的方面,在手术过程、牙科过程或侵入性医学过程的持续时间内维持预防。
在优选的方面,维持预防(即细菌感染相关疾病病状在受试者中形成的可能性减少)至少约4、8或12小时。在一个具体的方面,细菌感染相关疾病病状在受试者中形成的可能性减少为减少至少约90%、持续至少约4小时。在另一个具体的方面,细菌感染相关疾病病状在受试者中形成的可能性的减少为减少至少约95%、持续至少约4小时。
在受试者潜在暴露至细菌之前(例如手术或牙科过程之前)的10、9、8、7、6、5、4、3、2或1天内或者24、22、20、18、16、14、12、10、9、8、7、6、5、4、3、2、1或0.5小时内,可给予奥利万星或包含所述化合物的药物组合物,从而允许奥利万星合理地全身性存在或局部存在,优选存在于在手术过程期间潜在暴露至细菌污染的区域。
用于预防的每一剂中奥利万星的治疗有效量视以下因素而变化:例如受试者的体格特征、受试者将经历的过程、潜在可引起感染的细菌特性、用于给予药物的制剂和方法。对于给定受试者的具体剂量通常由主治医师判断设定。然而,每一剂中奥利万星的治疗有效量典型地为至少约200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000mg奥利万星。在特定方面,每一剂中奥利万星的治疗有效量为约100mg-3000mg奥利万星,优选约200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000mg奥利万星。
在一个优选的方面,剂量包含至少约200mg奥利万星。在另一个优选的方面,剂量包含约200mg-约1800mg奥利万星。在特定方面,剂量包含约300、400、500、600、700或800mg奥利万星。
根据给药方式,剂量可一次性全部给予(例如用胶囊中的口服制剂),或者可在一段时间内缓慢给予(例如静脉给药)。对于较慢的给药方式,给药持续时间可以分钟计,例如约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120或更多分钟,或者是以小时计的时间,例如约0.5、1、1.5、2、2.5、3、3.5、4、4.5、5或更多小时。可中断剂量的给予,例如在通过静脉输注给予剂量并且将剂量分成两袋或更多袋输注袋时。在这类情况下,当更换输注袋时,可中断剂量的给予。
防止方法
在第三个实施方案中,本发明涉及通过在疗程内将一剂奥利万星或其药学上可接受的盐(优选配制成药物组合物)给予受试者,来防止受试者的细菌感染的方法。因此,本发明包括防止受试者的细菌感染的方法,其包括在防止过程中将一剂治疗有效量的药物组合物给予处于暴露至感染菌的风险中的受试者,从而防止受试者的细菌感染,所述药物组合物包含奥利万星或其药学上可接受的盐和药学上可接受的载体或稀释剂。在该实施方案的一个方面,可将第二剂药物组合物给予受试者。
术语“防止(prevent和prevention)”意指阻断或阻止细菌感染相关疾病病状在受试者优选人中形成。例如可对比一般群体具有更高细菌感染风险的受试者实施这类方法,所述受试者包括正在接受针对细菌感染的治疗从而正常肠道菌群被抗微生物治疗抑制的患者、免疫功能受损(例如免疫球蛋白缺陷、脾功能障碍、脾切除术、HIV感染、白细胞功能受损、血红蛋白病)的患者、老龄人(Loo等,2005.NEJM353:2442)、具有某些恶性肿瘤(例如多发性骨髓瘤、慢性淋巴细胞性白血病、淋巴瘤)的人、处于职业性风险增加的人(例如公共服务工作者,例如消防、供水、卫生、警察、医疗和实验室工作者、医院工作者)、处于封闭群体(如监狱、军队、疗养院)的人和具有可增加其细菌感染敏感性的免疫缺陷的其他人。在给予奥利万星之后,防止可在受试者中持续至少约0.5、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、35、40、45、50或更多天。
在本发明的一个方面,防止在受试者中持续至少约24小时。在另一个方面,防止在受试者中持续至少约72小时。在又一个方面,防止在受试者中持续至少约144小时。
在受试者潜在暴露至细菌之前(例如军人与疑有特定细菌的物质接触之前)的10、9、8、7、6、5、4、3、2或1天之内或者24、22、20、18、16、14、12、10、9、8、7、6、5、4、3、2、1或0.5小时之内,可给予奥利万星或包含所述化合物的药物组合物。
用于防止的每一剂中奥利万星的治疗有效量视以下因素而变化:例如受试者的体格特征、受试者可能暴露至其下的细菌特性、用于给药的制剂和方式。对于给定受试者的具体剂量通常由主治医师判断设定。然而,每一剂中奥利万星的治疗有效量典型地为至少约200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000mg奥利万星。在特定方面,每一剂中奥利万星的治疗有效量为约100mg-3000mg奥利万星,优选约200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1050、1100、1150、1200、1250、1300、1350、1400、1450、1500、1550、1600、1650、1700、1750、1800、1850、1900、1950或2000mg奥利万星。
在一个优选的方面,剂量包含至少约400mg奥利万星。在另一个优选的方面,剂量包含约400mg-约1800mg奥利万星。在特定方面,剂量包含约700、800、900、1000、1100或1200mg奥利万星。
根据给药方式,剂量可一次性全部给予(例如用胶囊中的口服制剂),或者可在一段时间内缓慢给予(例如静脉给药)。对于较慢的给药方式,给药持续时间可以分钟计,例如约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、105、110、115、120或更多分钟,或者为以小时计的时间,例如约0.5、1、1.5、2、2.5、3、3.5、4、4.5、5或更多小时。可中断剂量的给予,例如在通过静脉输注给予剂量并且将剂量分成两袋或更多袋输注袋时。在这类情况下,当更换输注袋时,可中断剂量的给予。
第二剂
在某些情况下,可能需要给予第二剂奥利万星以达到给定方法的目标。例如,主治医师可能确定一剂奥利万星并不足以实现完全治疗患者的特定细菌感染。
当在疗程内将第二剂给予受试者时,优选第二剂中奥利万星的量等于或少于在第一剂中给予患者的量。在特定施方案中,第二剂中奥利万星的量为第一剂中奥利万星的量的100%或更少、90%或更少、80%或更少、70%或更少、60%或更少、50%或更少、40%或更少、30%或更少、20%或更少、或者10%或更少。
当在疗程内给予第二剂时,剂量之间的间隔将根据本文关于剂量中所含奥利万星的量方面所论述的相同考虑事项而变化。间隔可由主治医师确定。然而,一般而言,当所实施的方法为治疗方法时,剂量之间的间隔可为约0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10天,优选约4天。当所实施的方法为预防方法时,剂量之间的间隔可为约0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10小时。当所实施的方法为防止方法时,剂量之间的间隔可为约1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9、9.5或10天。
当在疗程内给予两个或更多剂量奥利万星时,各个剂量可以相同方式和/或制剂给予,或者以不同方式和/或制剂给予。
本文所用术语“剂量(dose)”、“单位剂量”、“用药量(dosage)”“有效剂量”和相关术语是指物理上的离散单位,其包含经计算以产生所需疗效的预定量活性成分。因此,单剂量为给予受试者的预定量奥利万星。优选的是,如本发明方法中所公开,将奥利万星配制成用于给予受试者的药物组合物。
本文所用术语“疗程”取决于本发明的特定方法,然而,所述术语通常意指以下时期:在该时期内或在整个时期内达到选定目标。就治疗方法而言,疗程为实现治疗受试者的细菌感染所需的时期。就预防方法而言,疗程为在整个时期内实现对细菌感染的预防的时期。就防止方法而言,疗程为在整个时期内实现防止细菌感染的时期。
尽管本发明优选涉及细菌感染的治疗、防止和/或预防,但本发明包括针对由细菌感染引起的其它疾病或涉及细菌感染的其它疾病的治疗和预防方法,所述疾病包括但不限于耳炎、结膜炎、肺炎、菌血症、窦炎、胸膜脓胸和心内膜炎、血管内感染或内皮感染、骨髓炎和脑膜炎。在这类方法中,将一剂奥利万星以足以提供疗效的量给予受试者,从而防止或治疗受试者的感染。
本发明的药物组合物和化合物可配制例如用于口服、肠内、舌下、鼻内、眼内、直肠、阴道内、经皮、粘膜、局部或胃肠外给药。胃肠外给药方式包括而不限于皮内、皮下(s.c.、s.q.、sub-Q、Hypo)、肌内(i.m.)、静脉内(i.v.)、腹膜内(i.p.)、动脉内、髓内、心脏内、关节内(关节)、滑膜内(关节液区)、颅内、脊柱内和鞘内(脊髓液)。可用于胃肠外注射或输注药物制剂的任何已知装置都可用于实现这类给药。
对于局部应用,本发明的药物组合物可制备成合适的形式以施加至皮肤或鼻和喉咙的粘膜、阴道或直肠,并可采用乳膏剂、软膏剂、栓剂、滴鼻剂、液体喷雾剂或吸入剂、锭剂或涂咽剂的形式。这类局部制剂还可包含诸如二甲亚砜(DMSO)等化合物以促进活性成分的表面渗透。对于施加至眼或耳而言,药物组合物可以在疏水基或亲水基中配制的液体或半液体形式存在,如软膏剂、乳膏剂、洗剂、涂剂或散剂。对于直肠给药而言,药物组合物可以与常规载体例如可可脂、蜡或其它甘油酯混合的栓剂形式给予。
用于胃肠外给药的制剂可呈等渗无菌水或非水溶液剂、混悬剂或脂肪乳剂形式。单位剂量的这些溶液剂或混悬剂可呈浓缩的液体、粉末或颗粒形式,用于在递送时在合适的药学上可接受的载体例如无菌水中临时复溶。除上述赋形剂之外,散剂形式任选包含填充剂(例如甘露醇、甘氨酸、乳糖、蔗糖、海藻糖、葡聚糖、羟乙基淀粉、聚蔗糖和明胶)和冷冻保护剂或冻干保护剂。在备选的实施方案中,本发明的药物组合物和化合物的胃肠外单位剂型可为所述药物组合物和化合物在无菌密封安瓿或无菌预装载注射器中的合适载体中的即用溶液。合适的载体任选包括任何上述赋形剂。用于注射的胃肠外形式必须为存在容易注射性(syringability)程度的流体。
用于胃肠外制剂中的赋形剂还可包括而不限于:稳定剂(例如碳水化合物、氨基酸和聚山梨酯,例如5%葡萄糖)、增溶剂(例如溴化十六烷基三甲铵、多库酯钠、单油酸甘油酯、聚乙烯吡咯烷酮(PVP)和聚乙二醇(PEG))、表面活性剂(例如聚山梨酯、PEG琥珀酸生育酚(tocopherol PEG succinate)、泊洛沙姆和CremophorTM)、缓冲剂(例如醋酸盐、柠檬酸盐、磷酸盐、酒石酸盐、乳酸盐、琥珀酸盐、氨基酸等)、抗氧化剂和防腐剂(例如BHA、BHT、龙胆酸、维生素E、抗坏血酸、抗坏血酸钠和含硫剂例如亚硫酸盐、亚硫酸氢盐、偏亚硫酸氢盐、硫代甘油、硫基乙醇酸盐等)、张度剂(用于调节生理相容性)、助悬剂或粘度剂、抗菌剂(如硫柳汞(thimersol)、苄索氯铵、苯扎氯铵、苯酚、甲酚和三氯叔丁醇)、螯合剂和给药助剂(如局部麻醉剂、抗炎剂、抗凝剂、用于延长的血管收缩剂及增加组织渗透性的药剂)以及其组合。
使用疏水载体的胃肠外制剂包括:例如脂肪乳剂和含脂质制剂、脂质球、小囊泡、颗粒和脂质体。脂肪乳剂不但包括上述赋形剂,还包括脂质相和水相以及添加剂例如乳化剂(例如磷脂、泊洛沙姆、聚山梨酯和聚氧乙烯蓖麻油)和渗透剂(例如氯化钠、甘油、山梨醇、木糖醇和葡萄糖)。脂质体包括天然或衍生的磷脂,并任选地包括诸如胆固醇等稳定剂。
在静脉内(IV)应用中,本发明药物组合物的无菌制剂和任选的一种或多种添加剂(包括增溶剂或表面活性剂)可溶解于或悬浮于任何常用静脉注射液并通过输注给予。静脉注射液包括含5%葡萄糖的水。
在肌内制剂中,本发明药物组合物的无菌制剂可在药物稀释剂例如注射用水(WFI)或含5%葡萄糖的水中溶解并给予。药物组合物合适的不溶形式可制备成水基或药学上可接受的油基(例如长链脂肪酸的酯,例如油酸乙酯)中的混悬剂,并给予。
对于口服应用,口服药物组合物可制成含治疗有效量的药物组合物的单位剂量形式。固体制剂例如片剂和胶囊剂特别有用。还可设计缓释或肠溶包衣制剂。对于儿科和老年医学应用,混悬剂、糖浆和咀嚼片特别适合。对于口服给药,药物组合物呈例如片剂、胶囊剂、混悬剂或液体糖浆或酏剂、糯米纸囊剂等形式。对于一般口服给药,赋形剂或添加剂包括但不限于惰性稀释剂、填料、崩解剂、粘合剂、湿润剂、润滑剂、甜味剂、调味剂、着色剂和防腐剂。
片剂和胶囊剂除包含糖肽类抗生素之外,还可含常规载体如:惰性稀释剂(例如碳酸钠和碳酸钙、磷酸钠和磷酸钙及乳糖)、粘合剂(例如阿拉伯胶、淀粉、明胶、蔗糖、聚乙烯吡咯烷酮(聚维酮)、山梨醇、甲基纤维素黄蓍胶、羧甲基纤维素钠、羟丙基甲基纤维素和乙基纤维素)、填料(例如磷酸钙、甘氨酸、乳糖、玉米淀粉、山梨醇或蔗糖)、湿润剂、润滑剂(例如金属硬脂酸盐、硬脂酸、聚乙二醇、蜡类、油类、硅石和硅胶(colloical silica)、硅油(silicon fluid)或滑石)、崩解剂(例如马铃薯淀粉、玉米淀粉和海藻酸)、调味剂(例如薄荷、冬青油、水果调味剂、樱桃、葡萄、泡泡糖等)和着色剂。载体还可包括诸如单硬脂酸甘油酯或二硬脂酸甘油酯等包衣赋形剂,以延迟胃肠道吸收。
口服液体制剂(通常呈水溶液剂或油溶液剂、混悬剂、乳剂或酏剂形式)可包含常规添加剂例如助悬剂、乳化剂、非水剂、防腐剂、着色剂和调味剂。用于液体制剂的添加剂的实例包括阿拉伯胶、杏仁油、乙醇、分馏椰子油、明胶、葡萄糖糖浆、甘油、氢化食用脂肪、卵磷脂、甲基纤维素、微晶纤维素、对羟基苯甲酸甲酯或对羟基苯甲酸丙酯、丙二醇、山梨醇或山梨酸。在一个实施方案中,化合物可配制于10%羟丙基β-环糊精中。在另一个实施方案中,化合物可配制于含85%的聚乙二醇400(PEG400)的无菌水中。口服制剂可呈待受试者饮下的液体形式,呈含所述制剂的胶囊剂形式,或技术人员已知用于给予口服制剂的其它方式。
尽管可通过上述方式以全身性方式给予治疗,但也可以局部方式给予治疗。例如,可直接通过例如局部组合物给予治疗,或直接给予至皮下或其它形式的伤口。
本发明的各种方法也可通过将第二治疗剂给予受试者来实施。这类第二治疗剂可包含在含含奥利万星的药物制剂中,或者它们可分开给予。许多第二治疗剂例如抗生素可与本发明的化合物、组合物和方法联用。用作第二治疗剂的抗生素可通过干扰细胞壁合成、质膜完整性、核酸合成、核糖体功能、叶酸合成等起作用。可用抗生素的非限制性列表包括:夫西地酸、甲氧苄啶、磺胺嘧啶、磺胺甲唑、青霉素、单环内酰胺、青霉烷、青霉烯、克拉维烷(clavam)、克拉维烯(clavem)、碳青霉烷(carbopenam)、碳青霉烯(carbopenem)、头孢烷(cepham)、头孢烯(cephem)、氧头孢烷(oxacepham)、氧头孢烯、碳头孢烷(carbocepham)、碳头孢烯(carbocephem)、头孢菌素、四环素、四环素衍生抗菌剂、甘氨酰环素、甘氨酰环素衍生抗菌剂、米诺环素、米诺环素衍生抗菌剂、山环素、山环素衍生抗菌剂、美他环素、美他环素衍生抗菌剂、唑烷酮类抗菌剂、氨基糖苷类抗菌剂、其它糖肽类或脂糖肽类、喹诺酮类抗菌剂、达托霉素、达托霉素衍生抗菌剂、利福霉素、利福霉素衍生抗菌剂、利福平、利福平衍生抗菌剂、利福拉齐、利福拉齐衍生抗菌剂、利福布汀、利福布汀衍生抗菌剂、利福喷汀(rifapentin)、利福喷汀衍生抗菌剂、利福昔明和利福昔明衍生抗菌剂。
第二治疗剂可在将本发明的药物制剂给予受试者之前、并行或之后给予。
本发明还包括试剂盒,其在合适的容器中包含一个或两个剂量的含有奥利万星的药物组合物和关于其在治疗、预防和/或防止细菌感染中的书面使用说明书。
实施例
实施例1
奥利万星(Ori)为半合成的脂糖肽,当以多剂量(MD)形式每天IV给予200mg持续3-7天(D)时,具有针对革兰氏阳性cSSSI(包括MRSA)的明确功效。动物和2期和3期PK数据表明单剂量(SD)或稀少剂量(infrequent doses,ID)的Ori作为对cSSSI潜在有效的潜能。
使用持续给予3-7天的每日剂量(200mg)、单剂量(1200mg)和稀少剂量(800mg剂量和任选的第5天额外的400mg),进行2期、多中心、随机化、双盲、平行、活性药物对照(active-comparator)研究,其中探索了作为对因革兰氏阳性病原体引起的cSSSI的治疗的三种奥利万星给药方案。
研究设计和治疗 通过交互式语音应答系统按1:1:1比例将患者随机化,以接受1)奥利万星药物对照每日剂量:每日IV 200mg,持续3-7天(由研究者根据临床标准确定);2)奥利万星单剂量:在第1天IV 1200mg奥利万星;或3)奥利万星稀少剂量:在第1天IV 800mg,和任选的第5天IV 400mg(由研究者根据临床标准确定)。在随机化期间,将患者根据伤口感染、大脓肿和蜂窝织炎的疾病类别分级。IV给予安慰剂(含5%葡萄糖的水)以保持盲的。
包括和排除标准 如果患者具有符合疾病诊断标准(列于下面并按疾病状态分类)的cSSSI(假定或已证明由革兰氏阳性病原体引起)、年龄≥18且体重指数≥17kg/m2和≤40kg/m2,则将其纳入研究。
对于分类为复杂性的皮肤和皮肤组织感染,必须符合以下的一个或多个标准:1)在纳入之前或之后48小时内需要重大外科手术的感染;2)怀疑或确认感染过程涉及较深层软组织,而非筋膜或肌肉层,或者;3)存在使对治疗的反应复杂化的重大基础疾病,包括但不限于糖尿病、菌血症、皮质类固醇治疗或任何水平的中性粒细胞减少症。
三种类别的感染(伤口感染、大脓肿和蜂窝织炎)中的每一种都必须符合额外的标准。伤口感染必须已从伤口或溃疡而未从创伤的器官/腔结构(space component)中进行脓引流,并具有一个或多个以下病状:带有发烧(>38℃)或白细胞增多(WBC>10,000/mm3或分类计数显示>10%带形)的感染的全身性表现;局部疼痛或触痛;红斑;或局部肿胀。大脓肿必须在纳入前7天之内已有急性发作、脓引流或脓吸出、带有发烧或白细胞增多的感染的全身性表现;红斑或硬结(直径≥2cm)或者触痛;和通过物理检查、盲法抽吸(blind aspiration)或者超声发现需要在纳入48小时之内介入(例如抽吸、切口和引流、切除)的小腔积液的迹象。蜂窝织炎必须有在纳入前7天之内的急性发作;疼痛或触痛;皮肤红斑;进展性水肿或硬结;和在纳入前3天内曾有发烧。
如果患者在纳入前3天内接受具有革兰氏阳性覆盖范围的任何全身性抗微生物剂持续超过24小时(除非该革兰氏阳性病原体在体外对该抗微生物剂有耐药性,或者患者在先前疗法中为临床上失败的)、对糖肽类和它们的任何赋形剂有严重过敏反应史(并不排除对糖肽类万古霉素有组胺样输注反应的患者)、或者预期需要超过10天常规抗生素治疗,则从研究中排除所述患者。怀孕女性或哺乳中女性也从研究中排除。
分析群体 对四种患者群体进行分析:意向治疗(ITT)、修正的意向治疗(MITT)、临床上可评价的(CE)和微生物学上可评价的(ME)。ITT群体包括被随机化治疗和接受任何量的研究药物的患者。将潜在非盲的两个患者从用于所有功效分析的ITT群体中排除。MITT群体包括具有在基线时分离的革兰氏阳性病原体的所有ITT患者。CE群体包括功效ITT患者,其符合纳入标准,在根据对治疗组的分配的预期时间范围内接受≥80%的预期研究药物剂量,在治疗结束或首次随访评价时并不具有不确定的临床反应,具有治愈、失败或改善的首次随访评价,或者在治疗结束时具有失败的临床反应。ME群体中的患者为具有在基线时分离的革兰氏阳性病原体的CE患者。
临床评价和微生物学评价 主要功效终点为在TOC时CE群体的临床反应,TOC在第1天纳入研究之后20-28天出现。临床反应作为治疗结束、TOC和晚期随访过程的一部分由研究者通过评价体征和症状来确定,所述体征和症状包括发烧、疼痛、触痛、红斑、硬结、水肿、脓引流、焦痂和失活组织。由研究者根据临床体征和症状在治疗结束和TOC时确定治愈、改善、失败或不确定的临床反应。在晚期随访时,研究者除治愈、改善或不确定之外还可确定复发的临床反应。只对在TOC时临床反应为治愈或改善的患者评价在晚期随访时的临床反应。
治愈定义为脓引流、疼痛、水肿、发烧、红斑、触痛和硬结的消退。可存在浆液引流或吸出和/或肉芽组织。改善定义为脓引流的消退和在蜂窝织炎情形下发烧和疼痛的停止。如可存在浆液引流、肉芽组织、焦痂和/或失活组织一样,可存在残余红斑、水肿、疼痛(在伤口或脓肿的情况下)、触痛和/或硬结。失败包括任何以下情形:存在脓引流(或吸出)和/或发烧;在开始研究治疗之后>48小时,意料之外地需要脓肿引流术或移除缝线(用于治疗感染);或者在开始研究药物治疗之后24小时以上,用对初次感染位置具有抗革兰氏阳性病原体活性的非研究全身性抗生素治疗或在初次感染位置使用局部抗生素。
在纳入三天内获得血液和感染位置培养物(通常在纳入时进行)。如果临床上需要,则从感染位置获得治疗结束、TOC和晚期随访(或早期复发时)培养物。如果证实患者在基线时具有菌血症,则至少在治疗结束或TOC时进行随访血液培养。将样本培养并在各个研究地点的认证实验室(certified laboratory)鉴定病原体。将在基线/随机和直至TOC时间点(包括TOC时间点)从感染位置得到的所有分离革兰氏阳性病原体,进行传代培养并送至中心实验室(Covance Clinical Laboratories,Indianapolis,IN),用于证实性鉴定和敏感性测试。在本地实验室和中心实验室之间矛盾的情况下,使用中心实验室的结果。
统计分析 原假设为:奥利万星单剂量或稀少剂量并不劣于奥利万星每日剂量。主要功效终点为CE群体中在TOC时的临床反应(治愈或改善对比失败)。主要功效分析为将每日剂量组中具有治愈临床反应(定义为治愈或改善的研究者评价)的CE患者的比例与1)单剂量组和2)稀少剂量组中的比例进行比较。使用按疾病类别分级的Mantel-Haenszel方法构建对反应率中的差异和相应置信区间(CI)的修正估值。
所设计的研究使用以下样本大小:其假定对85%的反应率差异有双侧90%的置信区间和在80%的检验效能(power)下有15%的非劣效性界限(non-inferiority margin)来计算。使用这些假定,需要总共210个临床上可评价患者(70/分支(arm))。假定可评价率为70%,则需要纳入总共300个患者(100/分支)以得到210个CE患者。
结果
患者 将总共302个患者随机化并接受研究药物治疗(每日剂量组中100个,单剂量组中99个,和稀少剂量组中103个),这些患者中228个(75.5%)为临床上可评价的(表1)。在完成研究之前,在ITT群体中的两个患者为潜在非盲的。这两个患者并没有包括在任何功效群体中,但包括在所有安全性分析中。在ITT群体中,单剂量组的88.9%患者、稀少剂量组的86.4%患者和每日剂量组的89.0%患者完成了IV治疗。在ITT群体中,有96个患者有伤口感染(19个手术上的、47个创伤、1个感染性烧伤和29个皮肤溃疡)、114个有大脓肿和92个有蜂窝织炎。在3种给药方案之间的人口统计学特征和基线特征相当(表2)。
表1
a在完成研究之前,在意向治疗群体中的两个患者为非盲的。这两个患者并没有包括在任何功效群体中,但包括在所有安全性分析中。
表2
注释:除非另外指出,数据为n(%)个患者
a其它包括混合种族出身,美洲印第安人,阿拉斯加土著,夏威夷土著或其它太平洋岛民
b使用Cockcroft-Gault公式和基线血清肌酐计算估计的肌酐清除率
基线病原体和敏感性 在ITT群体的209个患者(69.2%)中,从在基线时的感染位置分离到至少一种革兰氏阳性生物体。最常见分离到的病原体为金黄色葡萄球菌,其从87.6%(183/209)的MITT患者中分离到。MRSA在49%(103/209)的MITT患者中分离到。在MITT群体中鉴定的其它三种最常见的病原体为酿脓链球菌(5.7%,12/209)、无乳链球菌(3.8%,8/209)和粪肠球菌(3.8%,8/209)。如用含0.002%聚山梨酯-80的肉汤微稀释物所评价的,在MITT群体中,奥利万星对金黄色葡萄球菌的最小抑制浓度(MIC)范围为0.008-0.5μg/mL。奥利万星对所有金黄色葡萄球菌和对MSSA和MRSA亚类的MIC90为0.12μg/mL。
临床功效 每日剂量组、单剂量组和稀少剂量组在CE群体中于TOC时的临床治愈率分别为72.4%(55/76)、81.5%(66/81)和77.5%(55/71)(表3),表明奥利万星单剂量和稀少剂量不劣于奥利万星每日剂量。单剂量组和每日剂量组之间的治愈率和90%CI的估计差异为8.6%(-2.5,18.2),而稀少剂量组和每日剂量组之间为5.2%(-6.8,15.4),这表明单剂量方案和稀少剂量方案非劣效。在稀少剂量组中,仅在第1天接受800mg的临床上可评价患者(23/71)和在第1天接受800mg加上在第5天接受任选的400mg剂量的临床上可评价患者(48/71),分别具有78.3%(18/23)和77.1%(37/48)的治愈率,这与总体治愈率相当。按照疾病类别的治愈率在伤口感染和大脓肿的所有治疗组别之间相当,在稀少剂量的蜂窝织炎患者和每日剂量的蜂窝织炎患者之间相当(表3)。与每日剂量组(58.3%)相比,在单剂量组(87.5%)的蜂窝织炎患者中观察到统计学上较高的治愈率(90%CI;9.2,49.1)。与单剂量组(0/9)或稀少剂量组(1/14,7%)相比,更多在每日剂量组中失败的蜂窝织炎患者具有计划外的手术过程或外科手术(4/14,29%)。
表3
注释:治愈包括治愈和改善结果
a在完成研究之前,在意图治疗群体中的两个患者为非盲的。因此这两个患者并没有包括在任何功效分析(ITTN=98)中,但包括在所有安全性分析(ITT,N=100)中。
b通过按疾病分级的Mantel-Haenszel方法估计患者之间反应率的差异
c在完成数据分析之后,发现一个随机化至单剂量组的患者实际上接受了6天200mg/天的治疗。通过将该患者从单剂量组转至每日剂量组进行灵敏度分析,而在蜂窝织炎疾病类别中的统计学显著性维持不变。
在每日剂量组、单剂量组和稀少剂量组中,在TOC时对在基线时有金黄色葡萄球菌的患者的治愈率分别为67.4%、78.9%和79.5%,以及对基线MRSA患者的治愈率分别为78.3%,73.0%和87.0%(表4)。在ME群体中,奥利万星MIC和患者(包括在基线时有金黄色葡萄球菌和MRSA的患者)在TOC时的治愈率之间没有明显关系,并且极少分离群具有高于0.12的MIC(图1和2)。
表4
注释:治愈包括治愈和改善结果
在CE患者中的复发率低,其中在每日剂量组中没有患者经历复发,在单剂量组中1/61个(1.6%)患者经历复发和在稀少剂量组中2/54个(3.7%)患者经历复发。在ITT群体中,在每日剂量组、单剂量组和稀少剂量组中的研究药物治疗(奥利万星或安慰剂)的平均持续时间类似(分别为5.4、5.1和5.2天)。
安全性和耐受性 总体在三个治疗组之间的安全性实验结果相当。研究药物治疗的早期中止的最常见理由是缺乏功效(3.3%,10/302)。最常见不良事件为恶心、静脉炎、腹泻、头痛、输注位置外渗、呕吐和便秘。与每日剂量组和稀少剂量组相比,单剂量组中血液肌酸磷酸激酶(CPK)增加的发生率更高。这些病例的复查表明CPK增加的患者具有自正常水平温和地、无症状地上升或者在基线时就已经轻微上升。在最后的就诊时大多数已正常化。在一个受试者中,仅在第35天时观察到上升。
多数不良事件被研究者认为是强度上温和的或适度的(在每日剂量组、单剂量组和稀少剂量组中分别为85.7%、94.5%和95.2%),其中在各个治疗组中超过一半为温和的(51.8%、58.2%和60.3%)。多数不良事件与研究药物治疗无关。在研究者记录为与研究药物治疗相关的不良事件中,静脉炎、腹泻和恶心最为常见。在每日剂量组、单剂量组和稀少剂量组中,被研究者评价为与研究药物治疗相关的静脉炎患者的百分比分别为3.0%(3/100)、4.0%(4/99)和8.7%(9/103),并且无一静脉炎事件为严重的。在稀少剂量组中,有相关静脉炎的患者百分比在仅接受800mg的患者中为11.8%(4/34),而在接受800mg加上400mg剂量的患者中为7.2%(5/69)。
总共25个患者(8.3%)有严重不良事件。与单剂量组(7.1%,7/99)和稀少剂量组(6.8%,7/103)相比,严重不良事件的发生率在每日剂量组(11%,11/100)中较高。在单剂量组的两个患者有被研究者评价为与研究药物治疗相关的严重不良事件。一个患者经受呼吸困难而另一个患者经受过敏反应。在研究期间5个患者死亡(在每日剂量组中为3/100、在单剂量组中为0/99和在稀少剂量组中为2/103)。导致死亡的不良事件为心脏停搏、心肺衰竭、感染性休克、心肌梗死和肺栓塞。无一死亡被研究者评价为与研究药物治疗相关并且无一患者在治疗期间死亡。总共7个患者由于不良事件而终止研究药物治疗(在每日剂量组、单剂量组和稀少剂量组中分别为3.0%[3/100]、3.0%[3/99]和1.0%[1/103])。导致研究药物治疗早期中止的不良事件为脓肿、坏疽、导尿管位置疼痛、肾损害、眼睛瘙痒和过敏反应(2个患者)。
针对复杂性皮肤和皮肤组织感染治疗的患者的生命征象数据为寻常和典型的。在这些参数方面没有临床上显著的治疗组别差异,也不存在意想不到的治疗的不良全身性作用的任何征候。
由该研究提供的证据表明:在复杂性皮肤和皮肤组织感染患者的治疗中,作为1200mg的单剂量或800mg和可选的第5天400mg的稀少剂量给予的奥利万星不劣于持续3-7天的200mg每日剂量。该研究提供了单剂量或稀少剂量奥利万星在治疗cSSSI中的有效性的证据。单剂量和稀少剂量奥利万星与每日剂量一样对由革兰氏阳性病原体(包括MRSA)引起的复杂性皮肤和皮肤组织感染有效。安全性和耐受性在剂量给药组之间类似。
实施例2–在中性粒细胞减少症的小鼠大腿感染模型中,奥利万星(ORI)对甲氧西林敏感性金黄色葡萄球菌菌株和甲氧西林耐药性金黄色葡萄球菌菌株的功效比较
奥利万星(ORI)为新型脂糖肽,具有针对多数革兰氏阳性菌(包括青霉素耐药性肺炎链球菌、甲氧西林耐药性金黄色葡萄球菌(MRSA)和万古霉素(VAN)耐药性肠球菌(VRE))的高效体外活性(Allen,N.E.和T.I.Nicas,FEMS Microbiol Rev 26(5):511-32(2003);Arhin等,Antimicrob Agents Chemother 52(5):1597-603(2008))。
在本研究中,将单次推注和人当量(HEQ)剂量的奥利万星(ORI)用于在鼠大腿感染模型中比较其针对MSSA和MRSA临床分离群的活性。
方法:用5×105菌落形成单位(CFU)的细胞,在中性粒细胞减少症的CD-1小鼠(n=3/组)中对14个临床SA分离群(3个MSSA和11个MRSA;MIC 0.0015-2μg/mL)建立大腿感染。针对一种MSSA菌株和一种MRSA菌株测试单个静脉剂量ORI(0.5-40mg/kg)。还针对MSSA和MRSA菌株评价每天100或200或400mg×3天的模拟人暴露的ORI剂量(HEQ剂量,即24h AUC-匹配的)和单个1200mg HEQ剂量的功效。在治疗24h(单剂量)或72h(HEQ剂量)之后,采集双大腿并评价CFU计数。
菌株:将14个临床金黄色葡萄球菌分离群(3个MSSA和11个MRSA;MIC 0.0015-2μg/mL)用于本研究中。如先前所述,按照CLSI准则通过肉汤微稀释测定法和包含的聚山梨酯-80(最终检验浓度0.002%)来针对奥利万星测定MIC(Arhin等,Antimicrob Agents Chemother 52(5):1597-603(2008))。
体内研究:按照动物关怀和使用委员会(Institutional Animal Care and Use Committee)批准的方案进行所有研究。在双大腿中用5×105菌落形成单位(CFU)的细胞,在中性粒细胞减少症的CD-1小鼠(19-21g,n=3/组)中对14个临床金黄色葡萄球菌分离群建立大腿感染。在单剂量-反应研究中,感染后(PI)24h监测细菌/大腿的数量。在人当量(HEQ)剂量范围研究中,在PI 2、4、8、12、24、48和72h测定小鼠大腿中的细菌效价。将大腿连续稀释并铺板至Baird-Parker琼脂板上以测定细菌效价。检测限为1.69Log10CFU/大腿。对ORI的各个HEQ给药方案在PI 72h时计算大腿中的细菌效价减少量(与起始接种物相比)。
抗生素疗法:1)在单剂量反应研究中,在PI 1h时,将小鼠用0.4-40mg/kg剂量范围的ORI静脉内(IV)治疗。2)在HEQ剂量范围研究中,在PI 1h时开始,使小鼠接受多种IV给药方案以模拟人药物浓度分布。模拟以下HEQ剂量:持续72h的100、400、800mg的每日剂量(QD)或单次1200mg剂量(Lehoux等"Efficacy of Oritavancin(ORI)in the Mouse Bacteremia Model.(奥利万星(ORI)在小鼠菌血症模型中的功效)"48th Interscience Conference on Antimicrobial Agents and Chemotherapy;2008年9月25-28日;Washington(DC)Poster B-1009)。
数据分析:通过使用GraphPad Prism软件,将抑制性S形Emax模型用于计算奥利万星的ED50(导致50%的最大细菌杀伤的剂量)±95%置信区间。通过使用StatsDirect软件,按照Mann-Whitney U检验进行统计学计算以比较来自各个实验组的细菌效价。认为低于0.05的p-值为显著的。
结果:ORI的单剂量剂量-反应研究得到类似的ED50(导致50%的最大杀伤的剂量):对于MSSA为5.8mg/kg(95%CI:3.3-10)和对于MRSA为2.4mg/kg(95%CI:0.8-7.3)(图3)。此外,ORI的功效为HEQ剂量依赖性的(图4)。ORI对MSSA和MRSA菌株的功效为类似的(图5)。与每日200mg剂量相比,单次1200mg剂量的细菌载量减少显著地更多(p≤0.0005)(表5)。
表5
n=测试菌株数
结论:ORI在体内对MSSA和MRSA为等价有效的。单剂量-反应研究(1200mg)显示ORI在大腿模型中对MSSA和MRSA为等价有效的(类似的ED50)。
实施例3
从复杂性皮肤和皮肤组织感染(cSSSI)或菌血症的患者中进行奥利万星的药代动力学(PK)分析。分析群体由来自12个研究(包括9个1期研究、2个2期研究和1个2/3期研究)的奥利万星治疗的受试者和患者组成。以100-800mg的固定剂量范围或基于体重的0.02-10mg/kg的剂量范围,将奥利万星作为单剂量和多剂量静脉(IV)输注液两者给予。
结果:最终分析群体包括来自总共560个受试者的数据:200个来自1期研究,86个来自2期菌血症研究,29个来自2期cSSSI研究,和245个来自2/3期cSSSI研究。最终药代动力学分析数据集包括采集自所述560个受试者的总共6,336个奥利万星血浆浓度,其中6,290个奥利万星浓度包含在结果中。多数受试者(>90%)为群体药代动力学分析提供至少6个样本。
在群体PK分析所包括的研究中给予了大范围的奥利万星剂量,其中42%(560个中的236个)的受试者接受≥400mg,而25%(560个中的142个)接受800mg或更多。所给予奥利万星剂量的直方图示于图6,其中各个剂量范围的中点值示于各个条的上方。在所有研究中,奥利万星输注的持续时间在0.13-6.5小时之间变化;然而,对于多数受试者而言,将奥利万星在1小时之内给予。实际输注持续时间和速率的直方图分别示于图7和8中,其中各个输注持续时间或速率的中点值示于各个条的上方。
该剂量范围允许稳健评价奥利万星PK的剂量-比例性(也称为线性)。尽管未进行剂量-比例性的正式统计学评价,但将最终群体PK模型的拟合优度用于检测任何明显的剂量-比例性不足。
在该分析中奥利万星的最终结构PK模型为三室模型(一个中央室,两个外周室),具有零级静脉输注速率和一级线性消除。所述模型良好地拟合数据(数据未显示),与观察到的浓度或所给予剂量无关。如果需要非线性模型,则在最低和/或最高浓度和/或剂量下加权残差会有显著偏倚。未发现CL随着剂量增加而减少的趋势。在表6中提供了关键PK参数估计值的概括统计量(按剂量分级)。
表6
自单剂量奥利万星之后最后输注(按剂量范围分级)开始,奥利万星浓度对时间的半对数散点图示于图9。表7中提供了关于健康受试者的关键PK参数估计值的概括统计量。
表7
aAUC0-24、Cmax和Cmin已标准化至200mg的剂量以容易进行组间比较。
b在4(2–14)天的中位数(最小值–最大值)之后得到的暴露参数
****
应理解的是,本文所述的实施例和实施方案仅用于阐述性目的,并且将根据其的各种修改或变化都向本领域技术人员提出,并包括在本申请的精神和范围以及所附权利要求的范围之内。
本文所引用的所有文献都通过引用以其整体明确结合于本文中,所述文献包括但不限于出版物、专利、专利申请、书籍、手册、文章、论文、摘要和海报以及其它材料。
- 还没有人留言评论。精彩留言会获得点赞!