一种氟化石墨烯纳米药物载体及其制备方法和应用与流程
本发明属于材料和生物医药技术领域,具体涉及一种氟化石墨烯纳米药物载体及其制备方法和应用。
背景技术:
药物载体不但能够负载药物并改变药物进入体内的方式和分布,而且能实现药物的靶向输送与可控释放,受到越来越多研究者的关注。特别是随着纳米技术的发展,利用纳米材料可以自由进入细胞并在病变组织中富集的特性,对其靶向修饰后与药物联合使用,既能减少药物的使用剂量,又能提高其靶向性,从而降低药物的毒副作用、提高治疗效果(参见Wang B,Hu L,Siahaan T,Drug Delivery: Principles and Applications,Second Edition,Wiley Series in Drug Discovery and Development)。
碳材料由于具有低的细胞毒性、广泛的原料来源以及多种存在形态,被广泛应用于药物载体领域(参见Feng T,Ai X Z,An G H,et al.,ACS Nano,2016,10,4410-4420;Steiger C,Uchiyama K,Takagi T,et al,Journal of Controlled Release,2016,239,128-136.),特别是最近在石墨烯领域发现的新型衍生物-氟化石墨烯(Fluorinated graphene),不但继承了石墨烯比表面积大、光热转换性能高、细胞毒性小等优点,更为重要的是氟化石墨烯还具有其他碳材料所不具有的显著优势:(1)稳定的顺磁性:氟化石墨烯即使在液氮及2 K低温下仍然具有稳定的顺磁性(参见Feng Q,Tang N,Liu F,et al.,ACS Nano,2013,7,6729-6734;Nair R R,Sepioni M,Lehtinen T,Keinonen J,et al.,Nature Physics,2012,8,199-202.),因此可作为磁共振成像的造影剂。(2)优异稳定的光热性能:根据我们前期的实验研究与文献报道,氟化石墨烯比氧化石墨烯、石墨烯具有更高的光热转换性能(参见Romero-Aburto R,Narayanan T,Hasumura T,et al.,Advanced Materials,2013,25, 5632-5637.);并且通过控制其结构,在相同条件下与金纳米颗粒具有可比拟的光热治疗效果;但与昂贵的金纳米材料相比,碳材料价格更低廉、在激光照射下更稳定,因此基于碳材料的光热试剂有望大幅度降低肿瘤光热治疗的成本(参见Romero-Aburto R,Narayanan T,Hasumura T,et al.,Advanced Materials,2013,25,5632-5637.)。(3)氟元素在生物医药中的特殊作用:已有研究指出氟化石墨烯具有良好的生物相容性并能促进干细胞的增殖和分化;此外,C-F键强的极性能够诱导产生生物响应,并且氟元素在生物方面的应用已经扩展到实际应用的医药、临床以及治疗当中(参见Müller K, Faeh C, Diederich F,Science,2007,28,1881-1886;Wang Y,Lee W C,Manga K K,et al.,Advanced Materials,2012,24,4285-4290.)。因此,发展一种有效且简单的方法来构建基于氟化石墨烯的靶向给药与光热治疗纳米载药材料,进一步提高碳材料光热-化疗联合治疗的效果,无论是对于科学研究还是实际应用都尤为迫切。
但是由于氟化石墨烯表面能低、疏水性强,而且C-F键的化学性质稳定、难以连接修饰其他官能团,目前尚无氟化石墨烯靶向修饰和生物改性的公开报道。
技术实现要素:
针对现有技术存在的问题,本发明提供一种氟化石墨烯纳米药物载体,该载体提供的药物控释方式和途径,可显著提高药物的生物利用度,降低药物的毒副作用,提高药物的治疗效果。
本发明还提供该纳米药物载体的制备方法。
本发明也提供了该纳米药物载体在制备抗癌药物中的应用。
本发明为了实现上述目的所采用的技术方案为:
一种氟化石墨烯纳米药物载体,将氟化氧化石墨烯羧基化处理,连接肿瘤靶向分子,利用聚乙烯吡咯烷酮修饰改性后,制成氟化石墨烯纳米药物载体,通过吸附作用负载药物。
上述纳米药物载体的制备方法,包括以下步骤:
(1)氟化氧化石墨烯的制备:将氟化石墨与氢氧化钠混合,每100 mg氟化石墨中加入氢氧化钠为100~600 mg,在氩气保护下加热反应,温度为320~400℃,反应时间为1~3小时,加水溶解,洗涤干燥后得到活化氟化石墨,与浓硫酸混合后搅拌加热反应,反应的温度为60~90℃,反应时间为4~6小时,再加入浓硝酸反应6-10小时,冷却后加水溶解,超声,抽滤、洗涤、冷冻干燥后得到氟化氧化石墨烯。此时氟化氧化石墨烯中氟含量为1~60 at%,氧含量为5~50 at%。
(2)氟化氧化石墨烯的羧基化:氟化氧化石墨烯在氢氧化钠和氯乙酸钠的作用下,制成羧基化的氟化氧化石墨烯。
(3)氟化氧化石墨烯连接靶向分子:取步骤(2)制成的羧基化的氟化氧化石墨烯在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)和 N-羟基琥珀酰亚胺(NHS)作用下,与靶向分子溶液避光反应,得到连接靶向分子的氟化氧化石墨烯。
(4)氟化氧化石墨烯的PVP改性:取步骤(3)制成的连接靶向分子的氟化氧化石墨烯制成分散液,加入PVP,超声,加热反应得到氟化石墨烯纳米药物载体。
优选地,上述制备方法中,步骤(2)中氟化氧化石墨与氢氧化钠和氯乙酸钠的质量比:1 :10~75:10~75。
优选地,上述制备方法中,所述步骤(3)中羧基化的氟化氧化石墨烯与EDC、NHS和靶向分子的质量比:1:0.8~1.5:0.6~1.2:0.5~1.5。
优选地,上述制备方法中,所述步骤(4)中连接靶向分子的氟化氧化石墨烯与PVP的质量比为4:1~8。
优选地,上述制备方法中,所述步骤(4)中超声的功率为200~500W,时间为30~90min,加热反应的温度为50℃,时间为12~20小时。
本发明制成的载体中,氟化氧化石墨烯为20~3000nm的单层或者多层,PVP相对分子量为10000~360000。
上述方法制备的纳米药物载体在制备抗癌药物中的应用。
所述的药物包括抗癌剂、抗生素、激素、激素拮抗剂、白细胞介素、干扰素、生长因子、肿瘤坏死因子、内毒素、淋巴毒素、尿激酶、链激酶、组织纤溶酶原激活剂、蛋白酶抑制剂、烷基磷酸胆碱、放射性同位素标记成分、反义 DNA、小 RNA、抗体、光动力治疗药物、心血管系统药物、胃肠道系统药物、神经系统药物中一种或多种的混合物。
所述的抗癌剂包括紫杉醇、喜树碱、酞菁、表柔比星、多西他赛、吉西他滨、顺铂、卡铂、泰素、丙卡巴肼、环磷酰胺、放线菌素 D、柔红霉素、依托泊苷、他莫昔芬、阿霉素、丝裂霉素、博来霉素、普卡霉素、反铂、长春碱、甲氨蝶呤和蟾毒灵中一种或多种的混合物。
本发明的药物载体可用于疾病的治疗。应用本发明药物载体的疾病包括胃癌、肺癌、乳癌、肾癌、睾丸癌、脑瘤、卵巢癌、肝癌、支气管癌、鼻咽癌、喉癌、胰腺癌、膀胱癌、结肠癌和宫颈癌。本发明的药物载体中所包含的药物活性成分的种类可根据所期望的应用而变化。也就是说,本发明的药物载体可用于多种医疗应用中。
本发明还涉及包含所述药物载体和至少一种可药用载体的药物组合物。对于负载于本发明药物组合物中的药物活性成分的种类和本发明药物组合物所应用的疾病的种类没有特别限制,例如,它们与本发明药物载体中的那些相同。对于可用于所述药物组合物中的载体的种类没有特别限制。医学应用中可用的一般载体和赋形剂均可用于本发明中,它们的具体实例包括但不限于,离子交换树脂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白、缓冲物质、水、盐和电解质、胶体二氧化硅、三硅酸镁、聚乙烯比咯烷酮、基于纤维素的基质、聚乙二醇、羧甲基纤维素钠、聚丙烯酸类、蜡和羊毛脂。本发明的药物组合物还可包含选自,但不限于,润滑剂、润湿剂、乳化剂、助悬剂和防腐剂的至少一种添加剂。本发明的药物载体或药物组合物可制备成各种剂型,例如包括,但不限于,胃肠外施用的水溶性溶液、无菌注射制剂。
本发明的有益成果:
(1)以商业化的氟化石墨为原料来制备氟化石墨烯,解决了以石墨烯为原料制备过程中步骤复杂的问题,并且避免了剧毒气体(如F2、XeF2等)的氟化过程;同时氟化石墨活化、氧化的步骤简单方便,有望实现较大规模生产。
(2)利用氟化氧化石墨烯,解决了氟化石墨烯难以靶向修饰的技术问题,可以实现氟化石墨烯药物载体的主动靶向。与抗肿瘤药物相结合,可以通过与血管内皮细胞和肿瘤细胞表面的特异性受体结合而实现主动靶向,同时可降低抗肿瘤药物的毒副作用。
(3)利用PVP吸附到氟化石墨烯上完成生物相容性改性,不涉及化学反应,操作简便,且制备的载体毒性小,具有很好的生物学安全性。
(4)可以实现药物的无损装载和可控释放。抗癌药物通过π-π键结合到氟化石墨烯上,避免了共价键对药物分子的损伤,而且这种吸附方式负载的药物可以缓慢释放,有利于长时间保持药效。
附图说明
图1为氟化石墨烯(FG)和氟化氧化石墨烯(FGO)的红外谱图;
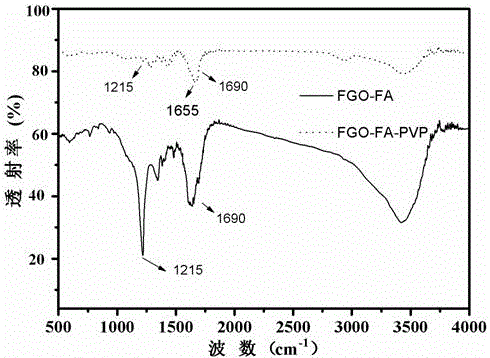
图2为叶酸修饰的氟化氧化石墨烯(FGO-FA)和PVP修饰后的氟化石墨烯(FGO-FA-PVP)的红外谱图;
图3为叶酸(FA)、阿霉素(DOX)、FGO-FA、PVP修饰后氟化石墨烯(FGO-FA-PVP)及其载药(FGO-FA-PVP-DOX)后的紫外吸收谱图;
图4中1、2、3、4依次为FG、FGO、FGO-FA和FGO-FA-PVP在PBS中的分散性图片;
图5为不同FGO-FA-PVP浓度时Hela细胞的存活率;
图6为不同浓度DOX、FGO-FA-PVP-DOX、FGO-FA-PVP-DOX+808 nm laser以及氧化石墨烯修饰载药后 (GO-FA-PVP-DOX+808 nm laser)近红外照射下Hela细胞的存活率。
具体实施方式
为了更好地理解本发明的实质,下面通过具体实施例对本发明的技术方案进行进一步的阐述。
实施例1
(1)将100mg氟化石墨和100mg氢氧化钠的混合物,在氩气保护下加热到320℃反应2小时后,加水溶解,洗涤干燥后得到活化的氟化石墨。取100 mg活化氟化石墨加入98wt%浓硫酸15mL,混合后搅拌加热到80℃,反应4小时,然后再加入65wt%浓硝酸20mL,反应8小时,冷却后加水溶解、超声,抽滤、洗涤、冷冻干燥后得到氟化氧化石墨烯。制成的氟化氧化石墨烯中氟含量为23.4 at%,氧含量为17.6 at%。
(2)将步骤(1)得到的氟化氧化石墨烯分散到水中制得2mg/mL的分散液,取10mL分散液,向其中加入1.0g的氢氧化钠和1.0g的氯乙酸钠,在300W功率下超声3小时,抽滤洗涤后透析,去除其他杂质离子得到羧基化的氟化石墨烯。
(3)叶酸修饰氟化氧化石墨烯得到FGO-FA
称取0.5g叶酸溶于100mL的去离子水中,量取20mL叶酸溶液,用饱和的碳酸氢钠溶液调pH=8.0。称取0.1g步骤(2)中得到的羧基化氟化石墨烯溶于100mL去离子水里,超声分散,依次缓慢加入100mgEDC,80mg NHS,300W功率下超声2小时,缓慢加入上述叶酸溶液后,避光搅拌24小时,抽滤,干燥,制得FGO-FA。如图2红外谱图和图3紫外吸收谱图所示,靶向分子叶酸成功修饰到了氟化石墨烯载体之上。
(4)PVP生物改性FGO-FA得到氟化石墨烯纳米药物载体(FGO-FA-PVP)
聚乙烯吡咯烷酮相对分子量为260000,将10mg PVP加入到10mL 1mg/mL步骤(3)中得到的FGO-FA分散液中,在300W超声下处理30分钟,然后在50 ℃下搅拌15小时,得到FGO-FA-PVP。如图2红外谱图和图3紫外吸收谱图所示,PVP成功修饰到氟化石墨烯上,而且制备的载体在PBS中具有良好的分散稳定性,见附图4。实施例2
(1)将100mg氟化石墨和600mg氢氧化钠的混合物,在氩气保护下加热到400℃反应3小时后,加水溶解,洗涤干燥后得到活化的氟化石墨。取100 mg活化氟化石墨加入98wt%浓硫酸40ml,混合后搅拌加热到90℃,反应6小时,然后再加入68wt%浓硝酸30ml反应10小时,冷却后加水溶解、超声,抽滤、洗涤、冷冻干燥后得到氟化氧化石墨烯。制成的氟化氧化石墨烯中氟含量为7.5 at%,氧含量为37.1 at%。
(2)将步骤(1)得到的氟化氧化石墨烯分散到水中制得1mg/mL的分散液,取10mL分散液,向其中加入0.1g的氢氧化钠和0.1g的氯乙酸钠,在300W功率下超声3小时,抽滤洗涤后透析,去除其他杂质离子得到羧基化的氟化石墨烯。
(3)叶酸修饰氟化氧化石墨烯得到FGO-FA
称取0.75g叶酸溶于100mL的去离子水中,量取20mL叶酸溶液,用饱和的碳酸氢钠溶液调pH=8.0。称取0.1g步骤(2)中得到的羧基化氟化石墨烯溶于100mL去离子水里,超声分散,依次缓慢加入150mgEDC,120mg NHS,300W功率下超声2小时,缓慢加入上述叶酸溶液后,避光搅拌24h,抽滤,洗涤,干燥,制得FGO-FA。
(4)PVP生物改性FGO-FA得到氟化石墨烯纳米药物载体(FGO-FA-PVP)
PVP的相对分子量为360000,将20mg PVP加入到10mL 1mg/mL步骤(3)中得到的FGO-FA分散液中,在500W超声下处理50分钟,然后在50 ℃下搅拌20小时,得到FGO-FA-PVP。
实施例3
(1)将100mg氟化石墨和200mg氢氧化钠的混合物,在氩气保护下加热到350℃反应2小时后,加水溶解,洗涤干燥后得到活化的氟化石墨。取100 mg活化氟化石墨加入98wt%浓硫酸20ml混合后搅拌加热到80℃,反应5小时,然后再加入68wt%浓硝酸20ml反应7小时,冷却后加水溶解、超声,抽滤、洗涤、干燥后得到氟化氧化石墨烯。制成的氟化氧化石墨烯中氟含量为15.2 at%,氧含量为19.3 at%。
(2)将步骤(1)得到的氟化氧化石墨烯分散到水中制得5mg/mL的分散液,取4mL分散液,向其中加入1.5g的氢氧化钠和1.5g的氯乙酸钠,在300W功率下超声3h,抽滤洗涤后透析,去除其他杂质离子得到羧基化的氟化石墨烯。
(3)叶酸修饰氟化氧化石墨烯得到FGO-FA
称取0.25g叶酸溶于100mL的去离子水中,量取20mL叶酸溶液,用饱和的碳酸氢钠溶液调pH=8.0。称取0.1g步骤(2)中得到的羧基化氟化石墨烯溶于100mL去离子水里,超声分散,依次缓慢加入80mg EDC,60mg NHS,300W功率下超声2h,缓慢加入上述叶酸溶液后,避光搅拌24h,抽滤,干燥,制得FGO-FA。
(4)PVP生物改性FGO-FA烯得到氟化石墨烯纳米药物载体(FGO-FA-PVP)
将10mg PVP加入到40mL 1mg/mL步骤(3)中得到的FGO-FA分散液中,在200W超声下处理90分钟,然后在50 ℃下搅拌12小时,得到FGO-FA-PVP。PVP的相对分子量为100000。
实施例4
(1)将100mg氟化石墨和100mg氢氧化钠的混合物,在氩气保护下加热到380℃反应1小时后,加水溶解,洗涤干燥后得到活化的氟化石墨。取100 mg活化氟化石墨加入98wt%浓硫酸15ml,混合后搅拌加热到60℃,反应4小时,然后再加入65wt%浓硝酸10ml,反应6小时,冷却后加水溶解、超声,抽滤、洗涤、干燥后得到氟化氧化石墨烯。制成的氟化氧化石墨烯中氟含量为25.1 at%,氧含量为12.2 at%。
(2)将步骤(1)得到的氟化氧化石墨烯分散到水中制得2mg/mL的分散液,取10mL分散液,向其中加入0.4g的氢氧化钠和0.4g的氯乙酸钠,在300W功率下超声3h,抽滤洗涤后透析,去除其他杂质离子得到羧基化的氟化石墨烯。
(3)叶酸修饰氟化氧化石墨烯得到FGO-FA
称取0.5g叶酸溶于100mL的去离子水中,量取20mL叶酸溶液,用饱和的碳酸氢钠溶液调pH=8.0。称取0.1g步骤(2)中得到的羧基化氟化石墨烯溶于100mL去离子水里,超声分散,依次缓慢加入120mg EDC,100mg NHS,300W功率下超声2h,缓慢加入上述叶酸溶液后,避光搅拌24小时,抽滤,洗涤,干燥,制得FGO-FA。
(4)PVP生物改性FGO-FA得到氟化石墨烯纳米药物载体(FGO-FA-PVP)
将10mg PVP加入到20mL 1mg/mL步骤(3)中得到的FGO-FA分散液中,在300W超声下处理30分钟,然后在50 ℃下搅拌15小时,得到FGO-FA-PVP。
对比例1
(1)氧化石墨烯分散到水中制得2mg/mL的分散液,取10mL分散液,向其中加入0.4g的氢氧化钠和0.4g的氯乙酸钠,在300W功率下超声3h,抽滤洗涤后透析,去除其他杂质离子得到羧基化的氧化石墨烯。
(2)叶酸修饰氧化石墨烯(GO-FA)的制备
称取0.5g叶酸溶于100mL的去离子水中,量取20mL叶酸溶液,用饱和的碳酸氢钠溶液调pH=8.0。称取0.1g步骤(2)中得到的羧基化氧化石墨烯溶于100mL去离子水里,超声分散,依次缓慢加入100mg EDC,80mg NHS,300W功率下超声2小时,缓慢加入上述叶酸溶液后,避光搅拌24h,抽滤,干燥,制得GO-FA。
(3)PVP生物改性的氧化石墨烯(GO-FA-PVP)的制备
将10mg PVP加入到20mL 1mg/mL步骤(2)中得到的GO-FA分散液中,在300W超声下处理30分钟,然后在50 ℃下搅拌15小时,得到GO-FA-PVP。
1.毒理实验:
图5为不同FGO-FA-PVP浓度时Hela细胞的存活率。实验表明,即使在高的浓度下,FGO-FA-PVP对细胞基本上也没有显著毒性。
2.FGO-FA-PVP-DOX+808nm laser与GO-FA-PVP-DOX+808nm laser的制备以及细胞毒性
将实施例1及对比例中得到的载体与不同比例的DOX混合,完成药物负载得到FGO-FA-PVP-DOX及GO-FA-PVP-DOX,然后用超滤去掉未结合的DOX,沉淀用PBS重新溶解均匀,放于4℃冰箱中保存备用。
将Hela细胞分别接种于96孔板中,24小时后将FGO-FA-PVP-DOX与GO-FA-PVP-DOX分别加入并形成浓度梯度,加入培养基后进行培养。
相同条件下,分别以纯DOX和负载相同浓度DOX的FGO-FA-PVP-DOX,与FGO-FA-PVP-DOX+808nm,GO-FA-PVP-DOX+808nm laser做平行对照,24小时后进行细胞存活率检测。结果如图6所示,可以看出,可以看出药物负载到FGO-FA-PVP具有很好的缓释效果;总体上FGO-FA-PVP 比单纯 DOX 杀灭癌细胞的效果都好。在808nm近红外光照射下,功率密度为1. 3 W/cm2 ,FGO-FA-PVP-DOX比GO-FA-PVP-DOX表现出更好的肿瘤细胞杀灭效果。因此氟化石墨烯纳米药物载体的光热效果好于氧化石墨烯药物载体。
- 还没有人留言评论。精彩留言会获得点赞!
- 过渡金属与石墨烯的复合纳米线及其制备方法与流程
- 一种氧化石墨烯表面原位生长二氧化硅的纳米杂化填料及其制备方法与流程
- GO增强CNT覆膜砂的智能混凝土无线传感器的制造方法与工艺
- 一种基于纳米纤维素晶须MoS2/石墨烯复合对电极材料及其制备方法和应用与流程
- 聚醚砜树脂/石墨烯纳米片多孔纳米复合材料、制备方法及其用途与流程
- 一种改性石墨烯与纳米纤维素复合温敏材料的制备方法与制造工艺
- 石墨烯掺杂改性纳米钙钛矿型La1‑xSrxMnO3复合材料及其制备方法和应用与制造工艺
- 一种在二氧化锰电极表面对苯胺进行原位氧化的方法与制造工艺
- 一种氧化石墨烯/银纳米颗粒/金字塔形硅三维拉曼增强基底及制备方法和应用与制造工艺
- 纳米羧基化石墨烯复合涤纶导电织物的制备方法与制造工艺