用于成像和光热治疗的磁性纳米材料和制备方法及应用与流程
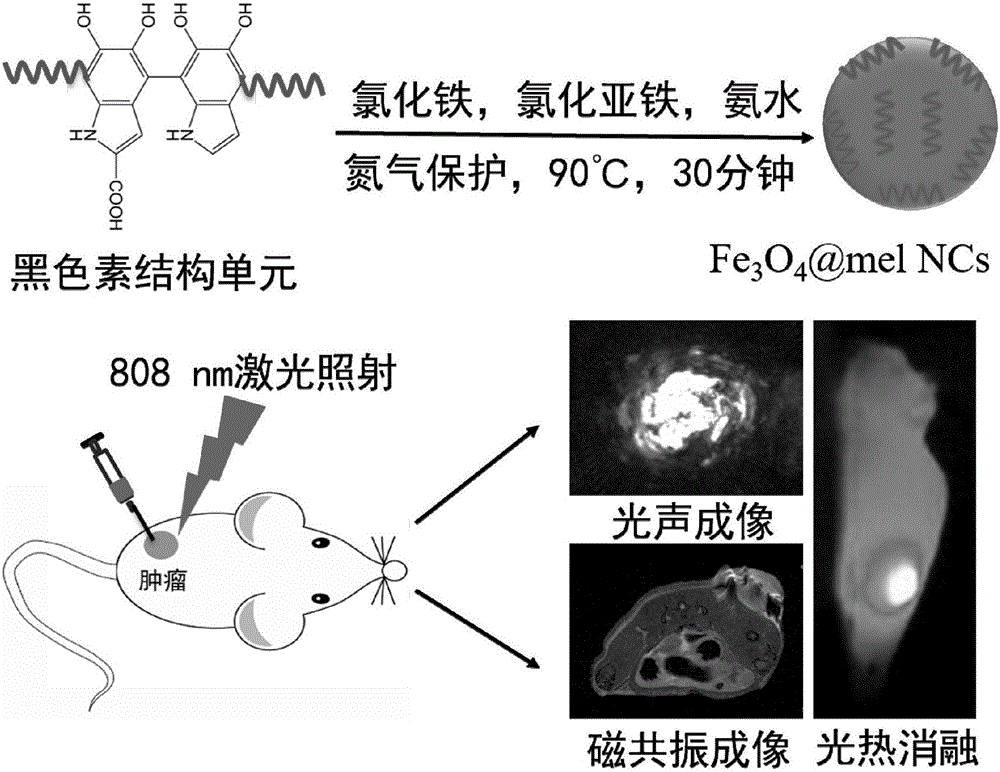
本发明涉及医药技术领域,特别涉及一种用于成像和光热治疗的磁性纳米材料和制备方法及应用。
背景技术:
随着生物技术和纳米科学的快速发展,近红外激光介导的光热治疗已逐渐作为一种具有广阔前景的替代疗法用于肿瘤治疗。光热治疗是一种侵袭性较小的局部治疗方式。当肿瘤区域暴露于近红外激光辐照范围时,富集在肿瘤区域的光热转换试剂能够将光能转换为热能,有效杀伤肿瘤细胞。与传统疗法(如手术切除,化疗,放疗等)相比,光热治疗具有非侵袭性、高选择性、高治疗效率,对周围健康组织损伤小等优势。目前研究较多的光热转换试剂主要有贵金属纳米材料,碳纳米材料,铜硫属化合物,有机聚合物等。尽管取得了一定进展,绝大多数光热转换试剂具有难以代谢、非降解性,可能引起潜在的长期毒性(如氧化应激、肺炎等)。而且,它们缺乏临床诊断和实时动态监测深部组织的能力,临床应用受到限制。
磁共振成像作为一种具有高空间分辨力的多方位多参数成像模态,在临床肿瘤诊断方面具有极大的价值。凭借优异的磁学性能,氧化铁纳米颗粒已被广泛应用于磁共振对比增强,药物递送,磁热疗等研究。目前,有多篇文献报道了基于氧化铁纳米颗粒的杂合纳米材料用于磁共振成像引导下的光热治疗,如将金、硫化铜、二硫化钼、石墨烯、二硫化钨等光热模块包被在氧化铁纳米颗粒表面。然而,这些材料均需要繁琐的合成步骤将不同功能组分整合至同一纳米平台,因此合成繁琐,成本高。
最近发现单组分的磁性材料也具有一定的光热转换能力,如四氧化三铁纳米颗粒,四氧化三铁纳米团簇等。也有文献将具有近红外区吸收的聚合物包被在四氧化三铁纳米材料表面以提高其光热转换效率,如聚吡咯、聚多巴胺等。然而,这些纳米颗粒多采用溶剂热法或热沉积法合成,需要较长的反应时间、严苛的反应条件、繁琐的配体交换、复杂的化学修饰。
黑色素是一种广泛存在于生物体各组织内的天然聚合物。它具有良好的生物相容性,生物可降解性及较强的近红外区吸收,是一种理想的光热转换试剂。有文献利用黑色素优异的金属离子螯合能力,在已合成的黑色素纳米颗粒表面吸附铁离子,锰离子,铜64离子等,进行多模态成像指导下的光热治疗,取得了较好的效果。然而,由于金属离子是通过螯合作用吸附在纳米颗粒表面,具有脱落的风险。
因此,迫切需要开发出一种简单温和的方法来制备具有良好生物相容性和良好光热转换能力的新型磁性纳米颗粒。
技术实现要素:
本发明的目的是提供一种用于成像和光热治疗的磁性纳米材料,该材料具有非毒性和良好生物相容性,并且具有成像能力。
本发明的技术方案是:
用于成像和光热治疗的磁性纳米材料,该材料是黑色素包被的氧化铁纳米颗粒。
该材料为水溶性的黑色素包被的氧化铁纳米颗粒。
每0.26mg黑色素包被1mg铁。
本发明的第二个目的是提供一种用于成像和光热治疗的磁性纳米材料的制备方法,该方法采用共沉淀法一步法合成水溶性的Fe3O4@mel NCs,具有温和、简单的优点。
本发明所述用于成像和光热治疗的磁性纳米材料的制备方法,有以下步骤:
1)将FeCl2·4H2O和FeCl3·6H2O溶于5mL 1M HCl溶液中,充氮气条件下加热至90℃;
2)剧烈搅拌条件下,快速加入0.5mL浓度为28vol.%的NH4OH溶液,反应20秒。随后,在1分钟内加入5mL黑色素溶液,90℃下搅拌30分钟;
3)溶液冷却至室温,磁分离直至溶液pH值为中性。收集沉淀,将得到的黑色素包被的氧化铁纳米颗粒分散在水中。其制备方法如下所示:
所述FeCl2·4H2O:FeCl3·6H2O重量比为1:2.72。
步骤2)所述黑色素溶液的浓度为1mg/mL,pH=9.0。
本发明第三个目的是提供用于成像和光热治疗的磁性纳米材料在制备用于磁共振成像制剂中的应用;
以及,用于成像和光热治疗的磁性纳米材料在制备用于光声成像制剂中的应用。
以及,用于成像和光热治疗的磁性纳米材料在制备治疗肿瘤光热消融制剂中的应用。
所述肿瘤为皮下瘤。
申请人采用本发明所述的Fe3O4@mel NCs,进行磁共振、光声双模态成像和肿瘤光热治疗。实验结果表明:紫外-可见光吸收光谱显示合成的Fe3O4@mel NCs在808nm处的光吸收值与浓度存在良好的线性关系;对Fe3O4@mel NCs的磁共振、光声成像及光热转换性能进行表征,光热治疗仪热成像图结果显示在808nm激光照射下,Fe3O4@mel NCs溶液温度升高呈浓度和激光功率依赖性;与多种商业化的氧化铁纳米颗粒相比,本发明所述的Fe3O4@mel NCs近红外区吸收最高,光热性能最好,在700nm激光激发下光声信号强度最高,并且R2弛豫率更高;细胞毒性实验结果表明合成的Fe3O4@mel NCs细胞毒性很低;Fe3O4@mel NCs注入荷瘤鼠肿瘤部位后,肿瘤部位光声信号和磁共振信号立刻发生变化,并在1小时左右比较弥散;接受Fe3O4@mel NCs+激光辐照组的荷瘤鼠肿瘤明显缩小,生长减慢;各主要脏器细胞形态学无明显差异。
本发明合成的Fe3O4@mel NCs,是一种新型的多功能用于肿瘤诊疗一体化的纳米材料,该材料将为开发和构建多功能纳米诊疗平台提供新思路,在生物医学领域具有一定的应用前景。
附图说明
图1为一步法合成Fe3O4@mel NCs及其诊疗应用的示意图;
图2为Fe3O4@mel NCs的合成及表征;其中,图2a为未加入黑色素的原始四氧化三铁纳米颗粒(左)及Fe3O4@mel NCs水溶液(右);图2b为Fe3O4@mel NCs的透射电镜图像;图2c为磁化曲线;图2d为傅立叶变换红外光谱;
图3为黑色素溶液及铁含量标准吸收曲线;其中,图3a,3b表示黑色素溶液在500nm处的标准吸收曲线;图3c,3d表示邻二氮菲法在510nm处检测铁含量;
图4为Fe3O4@mel NCs的吸收光谱及水合尺寸;其中,图4a表示不同浓度Fe3O4@mel NCs的紫外-可见光吸收光谱;图4b表示Fe3O4@mel NCs水溶液在808nm处的吸收值-铁浓度曲线;图4c表示Fe3O4@mel NCs的水合尺寸;图4d为表面电势。
图5为Fe3O4@mel NCs的磁、光、热性能表征;其中,图5a表示Fe3O4@mel NCs的R2弛豫率;图5b表示不同浓度Fe3O4@mel NCs的光声信号强度;图5c表示不同浓度Fe3O4@mel NCs在2W/cm2激光辐照下的热成像图;图5d表示Fe3O4@mel NCs(铁浓度为10mM)在不同功率激光辐照下的热成像图;
图6为Fe3O4@mel NCs的光热转换性能图;其中,图6a、图6b为不同激光功率下Fe3O4@mel NCs的温度变化;图6c、图6d为不同浓度Fe3O4@mel NCs在同一激光功率下的温度变化。
图7为Fe3O4@mel NCs与多种商业化的氧化铁纳米颗粒在同等浓度下(铁浓度为10mM)的性能比较;其中,图7a为紫外-可见光吸收光谱;图7b为光热转换性能;图7c为700nm激光激发下光声信号强度;图7d为R2弛豫率;
图8为Fe3O4@mel NCs对U87MG细胞活性的影响;其中,图8a为U87MG细胞经Fe3O4@mel NCs处理24小时后的细胞活性;图8b为不同处理加激光辐照后细胞行钙黄绿素和碘化丙啶共染的荧光图像;图8c为不同处理加激光辐照后细胞活性检测结果;
图9为Fe3O4@mel NCs被细胞有效摄取的情况;其中,图9a为U87MG细胞和Fe3O4@mel NCs共孵育6小时后的细胞磁共振成像;图9b为细胞光声成像;图9c为细胞普鲁士蓝染色;
图10为体内光声、磁共振双模态成像;其中,图10a为瘤内注射Fe3O4@mel NCs(25μL,2mg Fe/mL)前后不同时间点肿瘤部位光声图像;图10b为瘤内注射Fe3O4@mel NCs(25μL,2mg Fe/mL)前后不同时间点肿瘤部位磁共振图像;图10c为肿瘤区域的光声成像信号强度变化;图10d为肿瘤区域的磁共振信号强度变化;
图11为Fe3O4@mel NCs治疗小鼠肿瘤的情况;其中,图11a为U87MG荷瘤鼠经瘤内注射25μL Fe3O4@mel NCs 1小时后行光热治疗的热成像图;图11b为不同分组小鼠在治疗前后不同时间的肿瘤体积;图11c为不同分组小鼠在治疗前后不同时间的小鼠体重;图11d为不同分组小鼠在治疗前及治疗后第15天图片;
图12为不同分组小鼠治疗后第15天行苏木精-伊红染色图片。
具体实施方式
本发明采用的试剂:
黑色素购自西格玛奥德里奇公司;
商业化的氧化铁纳米颗粒分别购自美国大洋纳米科技有限公司、法国加柏公司和中国万德高科技有限公司;
其余试剂均购自国药集团化学试剂有限公司。
实施例1共沉淀法合成Fe3O4@mel NCs
将100umol,19.881mg的FeCl2·4H2O与200umol,54.058mg的FeCl3·6H2O溶于5mL 1M HCl溶液中,在充氮气条件下加热至90℃,剧烈搅拌条件下快速加入0.5mL的28vol.%NH4OH溶液,反应20秒。随后,在1分钟内加入5mL黑色素溶液(1mg/mL,pH=9.0),90℃下搅拌30分钟,冷却至室温,磁分离直至溶液pH值达到中性。收集沉淀,将获得的Fe3O4@mel NCs分散于水中,参见图1。
实施例2Fe3O4@mel NCs的合成及表征
透射电镜观察形貌:移取50uL Fe3O4@mel NCs溶液滴加在表面碳涂层铜网上,用滤纸吸走多余的溶液,室温条件下自然风干。采用透射电子显微镜在200kV电压条件下观察纳米颗粒的形貌、粒径和分散情况。
振动样品磁强计检测磁学性能:称量干燥后的粉末样品约10mg,置于测试专用微量试管内,用脱脂棉塞紧压实。采用振动样品磁强计进行常温性能测试:电源工作频率86Hz,输入功率5W,在电脑上X轴记录磁场变化,Y轴记录磁化强度变化。
傅里叶变换红外光谱仪检测化学基团:将真空干燥的溴化钾粉末用玛瑙研钵研磨,移取适量冷冻干燥后的待测样品,将样品和溴化钾按照约1:100的质量比在研钵中再次混匀、研磨。在红外烤灯照射下压片制样,将样品放置在傅里叶红外光谱仪上进行检测。
透射电镜结果表明成功制备尺寸均一的纳米颗粒,其结果见图2。图2a显示未加入黑色素的反应液在室温静置过夜后会发生聚沉,加入黑色素后,能够显著改善纳米颗粒的水分散性。磁性测量数据表明Fe3O4@mel NCs的饱和磁化率为47.8emu/g,并且具有优异的磁响应性能。傅里叶变换红外光谱表明黑色素成功包被在纳米颗粒表面。
实施例3检测Fe3O4@mel NCs中黑色素及铁含量
配制不同浓度的黑色素溶液,采用全波长酶标仪测量其光学吸收情况。取500nm处光吸收值,作吸光度值-黑色素溶液浓度曲线,测量合成的Fe3O4@mel NCs中的黑色素含量。用(NH4)2Fe(SO4)2·6H2O配制铁标准浴液,采用标准邻二氮菲法在510nm处作铁浓度标准吸收曲线,测量合成的Fe3O4@mel NCs中的铁含量。计算Fe3O4@mel NCs中黑色素和铁的含量比例。
采用全波长酶标仪及邻二氮菲法分别在500nm处及510nm处作吸收标准曲线,检测产物中黑色素及铁含量。测得每1mg Fe对应0.26mg黑色素,参见图3。
实施例4紫外-可见光吸收光谱及水合尺寸检测
配制不同浓度的Fe3O4@mel NCs,采用全波长酶标仪测量其光学吸收情况。取808nm处光吸收值,作吸光度值-Fe3O4@mel NCs溶液浓度曲线。
动态光散射仪检测水合尺寸及表面电势:取1mL Fe3O4@mel NCs溶液至样品池中,置于粒度分析仪检测腔体内。数据采集条件为衍射角173°,测试温度25℃。
紫外-可见光吸收光谱显示Fe3O4@mel NCs在808nm处的光吸收值与浓度存在良好的线性关系,动态光散射仪测得Fe3O4@mel NCs的水合尺寸约为91nm,表面电势约-26.1mV,参见图4。
实施例5Fe3O4@mel NCs的磁共振、光声成像及光热转换性能表征
磁共振成像:配制不同铁摩尔浓度的Fe3O4@mel NCs溶液。在室温条件下,将样品置于德国布鲁克7.0T小动物磁共振成像仪进行实验。测试参数设定:TR=4000ms,TE=45ms,视野为25×25mm。
光声成像:配制不同铁摩尔浓度的Fe3O4@mel NCs溶液。在室温条件下,将样品置于Endra128小动物光声成像仪进行实验。成像参数:能量,2.8毫焦;波长,700nm;角度,60°。
光热转换性能检测:(1)配制铁摩尔浓度为10mM的Fe3O4@mel NCs溶液,将溶液移至酶标仪孔板中,分别采用不同功率的808nm激光器对溶液进行照射5分钟,用红外温度监测仪记录激光照射时溶液的温度变化情况。绘制成温度-时间曲线,分析Fe3O4@mel NCs溶液温度变化与激光功率的关系。(2)配制不同铁摩尔浓度的Fe3O4@mel NCs溶液,将溶液移至酶标仪孔板中,采用功率为2W/cm2的808nm激光器对溶液进行照射5分钟,同时用红外温度监测仪记录材料进行激光照射时的温度变化情况。绘制成温度-时间曲线,分析Fe3O4@mel NCs溶液温度变化与溶液浓度的关系。
对Fe3O4@mel NCs的磁共振、光声成像及光热转换性能进行表征。7.0T小动物磁共振仪测得Fe3O4@mel NCs的T2信号强度随着溶液浓度的升高而逐渐降低,其R2弛豫率约为246mM-1S-1,Endra128光声成像结果显示Fe3O4@mel NCs的光声信号强度具有浓度依赖性;光热治疗仪热成像图结果显示在808nm激光照射下,Fe3O4@mel NCs溶液温度升高呈浓度和激光功率依赖性。参见图5,图6。
实施例6Fe3O4@mel NCs与商业化氧化铁纳米颗粒性能的比较
将合成的Fe3O4@mel NCs与三种商业化的氧化铁纳米颗粒进行性能比较:配制铁摩尔浓度为10mM的四种纳米颗粒溶液,分别采用全波长酶标仪测量其吸收光谱;采用功率为2W/cm2的808nm激光器对溶液进行照射5分钟;采用Endra128小动物光声成像仪进行检测溶液在700nm波长处的光声信号;采用布鲁克7.0T小动物磁共振成像仪测量溶液的R2弛豫率。
由于有黑色素的包裹,在同等浓度下,本发明所述的Fe3O4@mel NCs在近红外区吸收最高,因此光热性能最好,并且在700nm激光激发下光声信号强度最高。同时发现本发明所述的Fe3O4@mel NCs R2弛豫率明显高于商业化的氧化铁纳米颗粒。参见图7。
实施例7细胞毒性实验及细胞光热治疗
细胞毒性实验:将5000个U87MG细胞接种在96孔细胞培养板中,待细胞贴壁后,加入不同浓度梯度的Fe3O4@mel NCs,与细胞共孵育24小时。MTT实验检测Fe3O4@mel NCs对细胞活性的影响。细胞光热治疗:将5000个U87MG细胞接种在96孔培养板中,待细胞贴壁后,加入不同浓度梯度的Fe3O4@mel NCs,与细胞共孵育6小时。用磷酸盐缓冲液清洗三次,加入100微升无血培养基,采用808nm激光器以1W/cm2的功率照射细胞5分钟。对照组包括未处理组、仅NCs组和仅激光组。照射完成后,细胞继续孵育4小时,MTT实验检测光热治疗对细胞活性的影响。
细胞毒性实验结果表明合成的Fe3O4@mel NCs细胞毒性很低。人胶质瘤细胞U87MG与Fe3O4@mel NCs共孵育6小时后,进行光热治疗,发现Fe3O4@mel NCs加激光辐照组的细胞活性明显低于其它对照组。表明Fe3O4@mel NCs可通过光热效果有效杀伤肿瘤细胞。参见图8。
实施例8细胞摄取实验
细胞成像实验:将U87MG细胞接种于10cm细胞培养皿,待细胞融合至80%左右时,加入不同浓度的Fe3O4@mel NCs,与细胞共孵育6小时。未进行处理的细胞作为对照。消化、离心、收集细胞。将细胞用1%的琼脂糖分散,分别比较不同分组细胞的磁共振T2信号或在700nm波长处光声信号。细胞普鲁士蓝染色实验:将U87MG细胞接种于12孔细胞培养板,待细胞融合至80%左右时,加入不同浓度的Fe3O4@mel NCs,与细胞共孵育6小时。未进行处理的细胞作为对照。行普鲁士蓝染色,倒置显微镜进行观察、拍照。
与Fe3O4@mel NCs共孵育6小时后,细胞磁共振T2信号显著降低,光声信号明显增强。普鲁士蓝染色结果表明Fe3O4@mel NCs能够被细胞有效摄取。参见图9。
实施例9肿瘤光声和磁共振双模态成像
将Fe3O4@mel NCs(25μL,2mg Fe/mL)采用梅花注射法注入荷瘤鼠肿瘤部位后,分别在注射前、注射后5分钟和注射后1小时对小鼠肿瘤部位行光声成像和磁共振成像。比较不同时间点信号变化情况。
将Fe3O4@mel NCs(25μL,2mg Fe/mL)注入荷瘤鼠肿瘤部位后,肿瘤部位光声信号和磁共振信号立刻发生变化,并在1小时左右比较弥散。参见图10。
实施例10肿瘤光热治疗及疗效监测
将Fe3O4@mel NCs(25μL,2mg Fe/mL)注入荷瘤鼠肿瘤部位后,在注射1小时后行光热治疗。对照组分为未处理组、仅NCs组和仅激光组。以2W/cm2的激光功率照射肿瘤部位8分钟,采用红外温度监测仪动态记录肿瘤部位温度变化。疗效监测:在不同分组小鼠治疗前后不同时间点,每隔一天称量一次小鼠体重,并用游标卡尺测量肿瘤体积。并分别在治疗前和治疗后第15天对小鼠进行大体拍照。
在注射1小时后行光热治疗,Fe3O4@mel NCs组肿瘤部位温度可升高至51.3℃,而未注射组仅为39.4℃。动态监测不同分组小鼠在治疗前后不同时间点的肿瘤体积和小鼠体重,与对照组相比,接受Fe3O4@mel NCs+激光辐照组的荷瘤鼠肿瘤明显缩小,生长减慢。各组小鼠体重变化无明显差异。参见图11。
实施例11组织切片伊红-苏木精染色
在治疗后第15天,10%水合氯醛麻醉小鼠。先用50mL生理盐水经心脏冲洗血液后,再用50mL 4%多聚甲醛灌注。迅速分离并获取心、肝、脾、肺、肾等主要脏器,浸泡于10%福尔马林中。24小时后进行石蜡包埋。以5微米的层厚进行切片,脱蜡。组织切片浸入苏木精染液中10分钟,伊红染色5分钟,倒置显微镜观察、拍照。
各主要脏器细胞形态学无明显差异,表明纳米颗粒具有较好的生物相容性。其结果参见图12。
- 还没有人留言评论。精彩留言会获得点赞!