毛蕊花苷在制备治疗口腔鳞癌药物中的用途的制作方法
本发明涉及医药领域,尤其涉及毛蕊花苷在制备治疗口腔鳞癌药物中的用途。
背景技术:
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC),简称口腔鳞癌,是口腔颌面部最常见恶性肿瘤之一,其发病率高,有早期广泛淋巴结转移的倾向。目前,在临床上,手术、放射治疗和化学药物治疗仍是治疗口腔鳞癌的重要手段,但这些方法均存在缺陷。比如:外科手术因其局部治疗的不彻底性及术后高复发率而限制其应用;放疗和化疗虽可有效杀伤癌细胞,但同时又会造成正常细胞受损而导致患者出现多种并发症,给患者身体带来极大损伤。
毛蕊花苷(Verbascoside,VB),属于苯丙素苷类化合物,可从车前科、马鞭草科、玄参科等多种植物体内提取获得。毛蕊花苷具有抗癌(如:肝癌、胃癌)、抗炎、抗菌、抗氧化、免疫调节等广泛的药理活性,但到目前为止未见其治疗口腔鳞癌的报道。
技术实现要素:
因此,本发明的目的之一在于提供毛蕊花苷的诱导人鳞癌细胞HN4凋亡的用途,能够用于制备治疗口腔鳞癌的药物和/或保健品。
为达上述目的,本发明采用的技术方案为:
毛蕊花苷在制备治疗口腔鳞癌药物中的用途。
毛蕊花苷在制备诱导人鳞癌细胞HN4凋亡的药物中的用途。
毛蕊花苷在制备抑制人鳞癌恶性肿瘤生长,诱导鳞癌肿瘤组织中肿瘤细胞凋亡的药物中的用途。
该药物为注射给药剂型。
该药物为静脉注射给药剂型或腹腔注射给药剂型。
本发明还提供一种治疗口腔鳞癌的药物,该药物含有毛蕊花苷。
本发明经过实验研究,通过运用体内外口腔鳞癌模型,观察毛蕊花苷通过抑制癌细胞增殖、促使癌细胞凋亡,进而提高荷瘤裸鼠存活率的作用,发现毛蕊花苷对人口腔鳞癌细胞具有明显的抑生长、促凋亡作用,同时对BALB/c裸鼠口腔鳞癌的生长具有显著抑制作用,从而揭示了毛蕊花苷在制备治疗口腔鳞癌的药物中的用途,具有良好的研究和应用前景。
同时,发明人还发现毛蕊花苷治疗口腔鳞癌基本不会对正常组织造成不利影响,基本没有毒副作用,与以前的文献(中国专利03114454.3、102119934A)报道毛蕊花苷治疗其他癌症的结论相一致。
以下通过实施例和附图对本发明做进一步详细说明。
附图说明
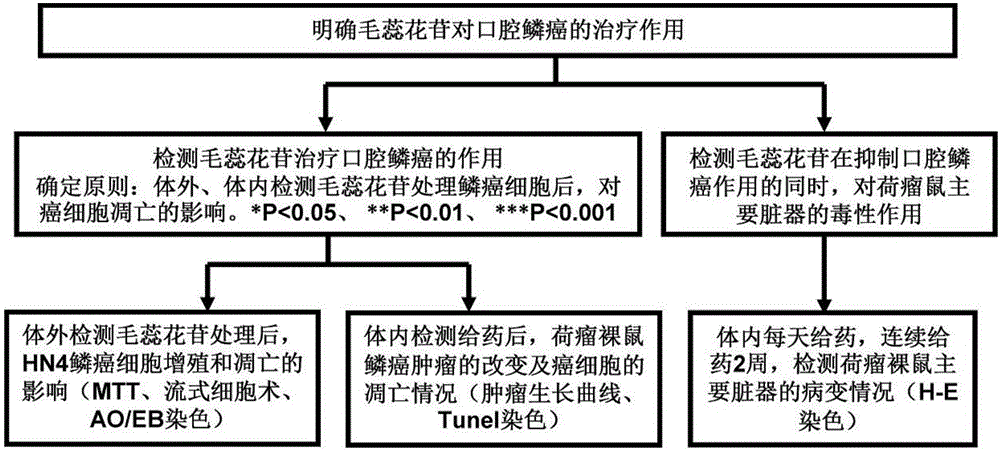
图1所示为本发明毛蕊花苷作为治疗口腔鳞癌药物的用途的主要流程示意图。
图2所示为MTT法检测HN4细胞在含不同浓度毛蕊花苷(VB)培养基培养48小时后的增殖曲线示意图。
图3所示为流式细胞术检测经不同浓度毛蕊花苷刺激HN4细胞48小时后,对细胞凋亡的影响的示意图。
图4所示为对图3细胞凋亡的统计分析的示意图。
图5所示为AO/EB染色检测经不同浓度毛蕊花苷刺激HN4细胞48小时后,对细胞凋亡的影响的照片。
图6所示为用PBS或毛蕊花苷隔天腹腔注射荷瘤裸鼠2周期间,检测荷瘤裸鼠肿瘤的生长曲线的示意图。
图7所示为用PBS或毛蕊花苷隔天腹腔注射荷瘤裸鼠2周后,检测荷瘤裸鼠肿瘤的大小的示意图。
图8所示为用PBS或毛蕊花苷隔天腹腔注射荷瘤裸鼠2周后,检测荷瘤裸鼠肿瘤组织中肿瘤细胞的凋亡的示意图。
图9所示为用PBS或毛蕊花苷每天腹腔注射荷瘤裸鼠2周后,检测荷瘤裸鼠主要脏器(心脏、肝脏、肾脏)的病变情况的示意图。
具体实施方式
本发明提供一种毛蕊花苷在制备治疗口腔鳞癌药物中的用途。
其中,毛蕊花苷可在市场上购得,其纯度达99.88%,也可自制(高效液相法)。提取方法在现有技术中有多篇报道,例如:中国专利申请99123015.9,WO2004069218,JP2000302797,JP2191291,FR2302745。其各项物性参数以及红外、核磁、质谱等光谱数据在中国专利03114454.3中有详细报道。
本发明采用的毛蕊花苷为市场采购获得,购自中科院西北高原生物研究所,毛蕊花苷分子式为C29H36O15,分子量624.59,CAS登记号(CAS RegistryNumber):61276-17-3,结构式如下所示:
为更好的说明本发明的目的、技术方案和优点,以下通过实施例对本发明作进一步的阐述。
如图1所示,本发明通过检测毛蕊花苷治疗口腔鳞癌的作用以及检测毛蕊花苷在抑制口腔鳞癌作用的同时对荷瘤鼠主要器脏的毒性作用来明确毛蕊花苷对口腔鳞癌的治疗作用。其中,检测毛蕊花苷治疗口腔鳞癌的作用的确定原则为:体内、体外检测毛蕊花苷处理鳞癌细胞后,对癌细胞凋亡的影响。其中,体外检测毛蕊花苷处理后,HN4细胞增殖和凋亡的影响,主要采用的方法有:MTT,流式细胞术以及AO/EB染色;体内检测给药毛蕊花苷后,荷瘤裸鼠鳞癌肿瘤的改变及癌细胞的凋亡情况,主要采用的体现方法有:肿瘤生长曲线,TUNEL染色。具体参见以下实施例。
实施例1毛蕊花苷对HN4细胞增殖和凋亡的影响。
实验目的:观察毛蕊花苷对HN4细胞增殖和凋亡的影响。
实验细胞:HN4口腔鳞癌细胞,购买于上海生命科学院细胞所。
实验药品:毛蕊花苷购自中科院西北高原生物研究所,用无菌PBS(磷酸缓冲盐溶液,phosphate buffer saline)溶解,阴性对照为PBS。
实验方法:运用MTT比色法和AO/EB染色技术表明毛蕊花苷可有效抑制HN4细胞的增殖,诱使HN4细胞发生凋亡。具体步骤如下:
1、MTT比色法检测细胞增殖
1)接种细胞:用含10%胎牛血清(FBS)的高糖DMEM/F-12培养液将HN4细胞配制成单个细胞悬液,调整细胞密度,以每孔5×103~5×104个细胞接种到96孔板,每孔体积100μl,培养板的边缘孔用无菌PBS,水或者培养液填充。设置空白对照孔(不含有细胞)。
2)37℃,5%CO2,培养24h待细胞贴壁,将不同浓度(0μM、12.5μM、25μM、50μM、100μM、200μM)的毛蕊花苷溶液分别加入细胞培液中,继续培养48h。
3)每孔加入10μl MTT工作液(5mg/ml),加样时尽量勤换枪头,控制加量误差。
4)水平摇床上低速混匀1min后,放入37℃培养箱孵育2~4h。
5)直接吸掉旧的培养液,避免枪尖刮破单细胞层。
6)加入100μl/孔甲臜溶解液,用枪充分混匀后放入37℃培养箱孵育4h。
7)孵育结束,放置在酶标仪上摇匀后,选择OD490nm或OD570nm,测定吸光度。记录结果,比色以空白调零。根据公式细胞增殖率%=(处理细胞OD/对照细胞OD)×100,计算得到细胞增殖率,以浓度或时间为横坐标绘制曲线如图2所示。
2、PI/Annexin V-FITC(流式细胞术)检测细胞凋亡
1)用去离子水将10×Binding Buffer稀释成1×Binding Buffer。
2)细胞收集:根据MTT法所述,用不同浓度毛蕊花苷处理HN4细胞48h,随后用不含EDTA(乙二胺四乙酸)的0.25%胰酶消化细胞收集后(注:胰酶消化时间不宜过长,否则会影响细胞膜上磷脂酰丝氨酸与Annexin V-FITC的结合),于室温1000rpm的转速下离心5~10分钟,收集细胞。
3)细胞洗涤:用预冷1×PBS(4℃)重悬细胞一次,1000rpm转速离心5~10分钟,洗涤细胞。
4)加入300μl的1×Binding Buffer悬浮细胞。
5)Annexin V-FITC标记:加入5μl的Annexin V-FITC混匀后,避光,室温孵育15分钟。
6)PI(碘化丙啶)标记:上机前5分钟再加入5μl的PI染色。
7)上机前,补加200μl的1×Binding Buffer。
3、AO/EB染色检测细胞凋亡
1)调整HN4细胞密度为106/ml,将细胞种至6孔板,每孔2ml细胞。
2)根据MTT法所述,用不同浓度毛蕊花苷处理HN4细胞48h,随后用0.25%胰酶消化细胞收集,于室温1000rpm离心5~10分钟,收集细胞,PBS洗涤1次。
3)PBS重悬细胞,使细胞浓度106/ml左右。
4)取100μl的HN4细胞悬液,各加2μl AO(吖啶橙)和EB(溴化乙锭)(AO/EB染料配制:AO、EB各1mg,分别溶于10ml pH7.2PBS中,使之配成100μg/ml的储备液,4℃保存,用前等量混合)。
5)取上述染色液一滴,滴在洁净玻片,加盖玻片后立即置荧光显微镜下观察,计取5个视野,共100个细胞中凋亡细胞百分数。
统计学分析:本实验所有数据均采用均值±标准差(±s)表示,组间差异性分析采用t检验,以P<0.05作为统计学差异参考标准。
实验结果:
1)如图2所示,随着VB浓度的增高,HN4鳞癌细胞增值率逐渐降低。
2)如图3所示,随着VB浓度的增加,HN4鳞癌细胞凋亡明显。如图4所示,图4是对图3细胞凋亡的统计分析的示意图,当VB浓度达到50μM以后,随着VB浓度的增加,HN4鳞癌细胞凋亡率明显增加。
3)如图5所示,图5是AO/EB染色检测经不同浓度毛蕊花苷刺激HN4细胞48小时后,对细胞凋亡的影响的示意图,同样也可以看出,随着VB浓度的增加,HN4鳞癌细胞凋亡明显。
以上差别均有统计学意义(*P<0.05;**P<0.01;***P<0.001)。
从以上实验结果可以看出,本发明毛蕊花苷可浓度依赖性的抑制HN4鳞癌细胞的增殖,诱导癌细胞发生凋亡。
实施例2毛蕊花苷对荷瘤裸鼠肿瘤生长的影响。
运用皮下植瘤的裸鼠模型检测毛蕊花苷对HN4鳞癌肿瘤生长的影响,具体步骤为:
1、动物实验
从南京大学模式动物所购买健康的3~4周雌性BALB/c裸鼠,饲养3d后将无不良反应,饮食、饮水、活动正常者纳入实验。用无血清的高糖DMEM/F-12重悬收集的HN4细胞并进行细胞计数(约1×107个/ml)。取100μl(约106个细胞)注射于小鼠前右腋皮下,待7~10天后,将肿瘤大小均一(体积约为300mm3)的植瘤小鼠随机分2组,每组10只。分别经腹腔注射生理盐水(PBS)和毛蕊花苷于小鼠体内,每两天注射一次,共7次,在此期间用游标卡尺对两组裸鼠肿瘤的大小进行测定。随后,处死小鼠,取出肿瘤组织于10%福尔马林中浸泡备用。
实验结果请参见图6,从图中可以发现,同PBS对照组相比,毛蕊花苷处理组可显著抑制荷瘤裸鼠肿瘤的生长。而且,从图7可以发现,同PBS处理组相比,经毛蕊花苷处理后,荷瘤裸鼠肿瘤明显减小。(*P<0.05)
2、Tunel组织染色
1)石蜡包埋肿瘤组织切片。
2)脱蜡:用二甲苯浸洗5min,共浸洗2次。
3)水化:采用梯度乙醇水化(100%,5min;100%,3min;95%,3min;
85%,3min;70%,3min;50%,3min)。
4)浸洗:先采用0.85%NaCl浸洗5min,接着再采用PBS洗5min。
5)固定:浸入4%多聚甲醛15min。
6)浸洗:采用PBS浸洗5min,共浸洗2次。
7)细胞通透:用每片100μl 20μg/ml蛋白酶K(Proteinase K)处理组织10~30min RT,较佳为15min;
8)浸洗:采用PBS洗5min。
9)固定:浸入4%多聚甲醛5min。
10)浸洗:采用PBS浸洗5min,共浸洗2次。
11)平衡:加100μl平衡液,湿盒平衡5~10min,较佳为10min。
12)制备TUNEL反应混合液:处理组用1μl rTdT+1μl生物素标记的dUTP
+98μl平衡液混匀;而阴性对照组不加rTdT,改为三蒸水;阳性对照组先加入100μl DNase(脱氧核糖核酸酶)1缓冲液孵育5min,甩掉液体后再加100μl DNase 1(10U/ml)酶切10min,用去离子水冲洗4次,再用PBS浸洗5min,后面步骤从第10步开始。
13)标记反应:加100μl TUNEL反应混合液于标本上,加盖玻片或封口膜在暗湿盒中反应,于37℃下反应1h。
14)终止反应:浸入2×SSC(saline sodium citrate)溶液中15min。
15)浸洗:采用PBS浸洗5min,共浸洗3次。
16)封闭POD(内源性过氧化物酶):浸入0.3%H2O2溶液中15min。
17)浸洗:采用PBS浸洗5min,共浸洗3次。
18)酶标反应:加100μl streptavidin(链霉亲和素)标记HRP(按1:500PBS稀释),孵育30min。
19)浸洗:采用PBS浸洗5min,共浸洗3次。
20)DAB显色(避光):加100μl DAB混合液(50μl DAB+50μl DAB底物缓冲液+50μl H2O2(20×)+950μl三蒸水)10min左右,镜下出现浅棕色背景。
21)用去离子水冲洗几次。
22)用苏木素复染,3s左右后立即用自来水冲洗。依次采用梯度酒精脱水(50%、70%、85%、95%、100%、100%的浓度各1min);二甲苯透明1min×2次;中性树胶封片。
结果请参见图8,从图中可以发现,同PBS对照组相比,毛蕊花苷处理组可显著增加荷瘤裸鼠肿瘤组织肿瘤细胞的凋亡。
实施例3毛蕊花苷对荷瘤裸鼠主要脏器的影响。
运用实施例2皮下植瘤的裸鼠模型检测毛蕊花苷对荷瘤裸鼠主要脏器的影响,具体步骤为:
1、给药实验
根据实施例2动物实验的方法准备荷瘤裸鼠,将肿瘤大小均一(体积约为300mm3)的植瘤小鼠随机分2组,每组10只。每天分别经腹腔注射生理盐水(PBS)和毛蕊花苷于荷瘤小鼠体内,共2周,在此期间监测荷瘤小鼠的存活情况,若有死亡应立即解剖寻找死亡的原因。给药2周后,处死小鼠,取出各组小鼠的心脏、肝脏和肾脏组织于10%福尔马林中浸泡待做切片,进行H-E染色。
2、H-E染色
1)取材组织块,经固定后,常规石蜡包埋,4μm切片。
2)切片常规用二甲苯脱蜡,经各级乙醇至水洗:二甲苯(I)5min→二甲苯(Ⅱ)5min→100%乙醇2min→95%乙醇1min→80%乙醇1min→75%乙醇1min→蒸馏水洗2min。上述各两次,然后把水吸干。
3)苏木素染色5min,自来水冲洗,并吸干水。
4)盐酸乙醇分化30s,过程中提插数次。
5)自来水浸泡15min或温水(约50℃)浸泡5min,并吸干水。
6)置伊红液中30s-2min。
7)常规脱水,透明,封片:依次如下,95%乙醇(I)1min→95%乙醇(Ⅱ)1min→100%乙醇(I)1min→100%乙醇(Ⅱ)1min→二甲苯石碳酸(3:1)1min(可省略)→二甲苯(I)1min→二甲苯(Ⅱ)1min→中性树脂封固。
结果发现,给药2周后,各组荷瘤裸鼠都未见有死亡。同时,对裸鼠主要脏器的切片观察,发现同PBS对照组相比,毛蕊花苷处理组的荷瘤裸鼠主要脏器并未有显著的病理改变,结果见图9。因此,可初步推测毛蕊花苷基本无毒。
综上,本发明通过运用体内外口腔鳞癌模型,观察毛蕊花苷通过抑制癌细胞增殖、促使癌细胞凋亡,进而提高荷瘤裸鼠存活率的作用,发现毛蕊花苷对人口腔鳞癌细胞具有明显的抑生长、促凋亡作用,同时对BALB/c裸鼠口腔鳞癌的生长具有显著抑制作用,从而揭示了毛蕊花苷在制备治疗口腔鳞癌的药物中的用途,具有良好的研究和应用前景。同时,本发明实验还发现毛蕊花苷治疗口腔鳞癌基本不会对正常组织造成不利影响,基本没有毒副作用。
藉由以上较佳具体实施例的详述,是希望能更加清楚描述本发明的特征与精神,而并非以上述所揭露的较佳具体实施例来对本发明的保护范围加以限制。相反地,其目的是希望能涵盖各种改变及具相等性的安排于本发明所欲申请的权利要求的保护范围内。因此,本发明所申请的权利要求的保护范围应该根据上述的说明作最宽广的解释,以致使其涵盖所有可能的改变以及具相等性的安排。
- 还没有人留言评论。精彩留言会获得点赞!