原人参二醇皂苷在制备防治炎症疾病的药物中的应用的制作方法
本发明属于生物医药技术领域,涉及一种化合物的新用途,尤其涉及原人参二醇皂苷在制备防治炎症疾病的药物中的应用。
背景技术:
雾霾是雾和霾的组合词,常见于城市,为灾害性天气现象进行预警预报,统称为“雾霾天气”。雾霾是特定气候条件与人类活动相互作用的结果,高密度人口的经济及社会活动必然会排放大量细颗粒物(PM 2.5),一旦排放超过大气循环能力和承载度,细颗粒物浓度将持续积聚,此时如果受静稳天气等影响,极易出现大范围的雾霾。雾霾的来源有汽车尾气、烧煤产的废气、工业废气、扬尘和可生长颗粒等,雾霾对人体的危害有对呼吸系统的影响、对心脑血管的影响、传染病增多、不利于儿童的生长、影响心里健康和影响生殖能力等。雾霾可以通过支气管和肺泡进入血液,干扰肺部交换,引发呼吸道感染、哮喘、支气管炎等疾病。
原人参二醇皂苷是一种固醇类化合物,三萜皂苷,主要存在于人参属药材中,对高脂血症、记忆障碍、急性心肌梗死、心肌缺氧、糖尿病、肾病和肿瘤等有一定的预防和治疗作用,但是现有技术中并未有关于原人参二醇皂苷能够预防雾霾引起的肺部炎症疾病的报道。
技术实现要素:
有鉴于此,本发明的目的在于针对现有技术的不足,而提供原人参二醇皂苷在制备预防炎症疾病的药物中的应用,使原人参二醇皂苷能够有效防治炎症疾病。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了原人参二醇皂苷在制备预防炎症疾病的药物中的应用。
优选的,所述炎症疾病包括肺部炎症疾病。
优选的,所述炎症疾病包括由雾霾中PM2.5引起的肺部炎症疾病。
优选的,所述原人参二醇皂苷降低肺部炎症中炎症因子的含量。
优选的,所述炎症因子包括IL-1β、TNF-α、IL-6和HMGB1中的一种或几种。
优选的,所述防治炎症疾病的药物的剂型包括液体制剂、颗粒剂、缓释剂、冲剂、片剂或胶丸。
优选的,所述防治炎症疾病的药物含有原人参二醇皂苷在药学上可接受的辅料。
优选的,所述防治炎症疾病的药物中原人参二醇皂苷的有效含量为95%以上。
本发明提供了原人参二醇皂苷在制备防治炎症疾病的药物中的应用,原人参二醇皂苷能够有效防治炎症疾病。在本发明中,所述原人参二醇皂苷防治炎症疾病的原理为抑制炎症部位巨噬细胞的激活,从而降低促炎因子的释放。
附图说明
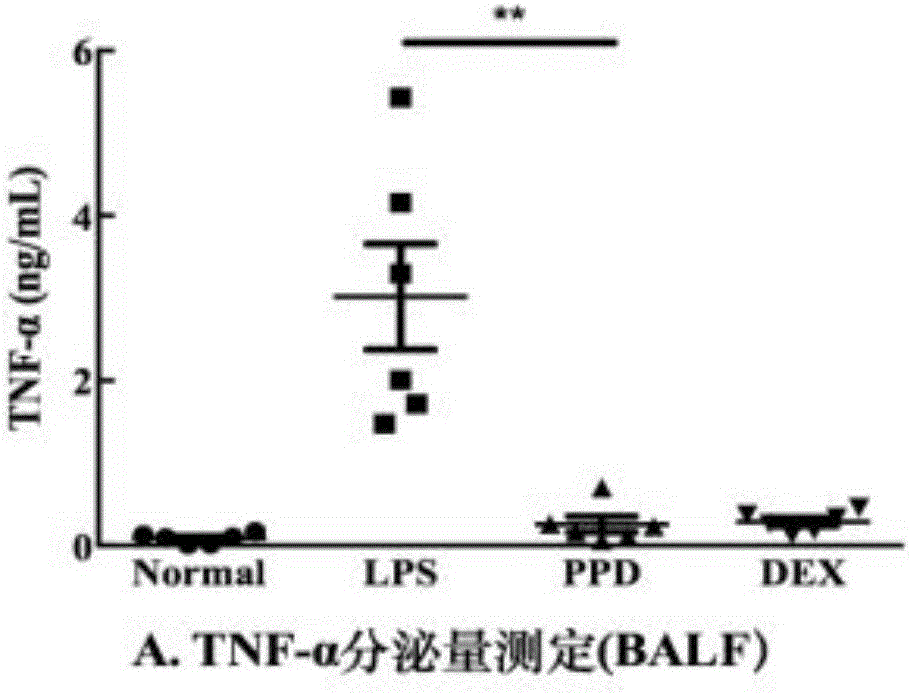
图1为肺泡灌洗液中TNF-α分泌量测定;
图2为肺泡灌洗液中IL-6分泌量测定;
图3为肺泡灌洗液中IL-1β分泌量测定;
图4为血清中IL-6分泌量测定;
图5为细胞上清液中TNF-α分泌量测定;
图6为细胞上清液中IL-6分泌量测定;
图7为细胞上清液中IL-1β分泌量测定。
具体实施方式
本发明提供了原人参二醇皂苷在制备防治炎症疾病的药物中的应用。具体的,在本发明中,所述炎症疾病优选包括肺部炎症疾病,更优选为由雾霾中PM2.5引起的肺部炎症疾病。所述由雾霾中PM2.5引起的肺部炎症疾病的临床表现为急慢性支气管炎、急性鼻炎、支气管哮喘、肺癌等。
在本发明中,所述原人参二醇皂苷优选通过降低肺部炎症疾病中炎症因子的含量,来防治肺部炎症疾病。在本发明中,所述炎症因子优选包括IL-1β、TNF-α、IL-6和HMGB1中的一种或几种,更优选为四种。在本发明中,为了能够表征原人参二醇皂苷降低炎症因子含量的效果,在服用药物前后通过检测肺泡灌洗液,来确定炎症因子的含量。
本发明对所述肺泡灌洗液的制备方法优选为80~120μg/kg LPS(脂多糖)经滴鼻一次性给予BALB/C小鼠LPS,24h后收集肺泡灌洗液。
本发明对所述原人参二醇皂苷的来源没有特殊限定,采用市售产品即可,如南京广润生物制品有限公司的30636-90-9。在本发明中,所述原人参二醇皂苷在药物中的有效含量优选为95~100%,更优选为96~99%,最优选为97~98.9%;所述原人参二醇皂苷的服用剂量优选为5~40mg/kg,更优选为10~30mg/kg,最优选为20mg/kg。
本发明对所述药物的剂型没有特殊的限定,采用本领域技术人员熟知的剂型即可,在本发明中,所述原人参二醇皂苷的剂型可以为液体剂、颗粒剂、缓释剂、冲剂、片剂或胶丸。本发明对上述剂型的辅料没有特殊限定,采用本领域技术人员在药学上可接受的辅料即可。本发明对上述剂型的制备方法没有特殊限定,采用本领域技术人员常规制备上述剂型的方法即可。
在本发明中,为了能够表征原人参二醇皂苷降低炎症因子含量的效果,在服用药物前后对炎症因子进行检测。本发明对所述肺泡灌洗液中的炎症因子的检测方法没有特殊限定,具体的优选采用酶联免疫分析方法,具体为:
将IL-1β、TNF-α、IL-6和HMGB1的抗体包被于缓冲稀释液中,得到预处理液;
将所述预处理液加入聚苯乙烯板的反应孔中,0~6℃过夜后弃去反应孔中的溶液,用洗涤缓冲液洗涤;
向所述洗涤后的反应孔中加入待测样品,20~42℃反应30~90min,反应完毕后用洗涤缓冲液再次洗涤;
向所述再次洗涤后的反应孔中加入酶标抗体,20~42℃反应30~90min后用洗涤缓冲液进行第三阶段洗涤;
向所述第三阶段洗涤后的反应孔中加入底物显色液TMB,20~42℃孵育5~30min,用0.05~0.3ml的1~3N H2SO4终止反应,在450nm处检测每孔的OD值。根据标样制作标准曲线,通过标准曲线计算各种炎症因子含量。
在本发明中,所述缓冲稀释液的组分为11.8g Na2HPO4和16.1g NaH2PO4溶于1L去离子水中,pH值为6.5,或所述缓冲稀释液的组分为7.13g NaHCO3和1.59g Na2CO3,pH值为9.5;所述缓冲稀释液的体积用量为1:250。在本发明中,所述酶标抗体为BD biosciences ELISA试剂盒中的酶标抗体,用量优选为1:250比例与1×PBS加1%脱脂奶稀释。本发明对所述酶标抗体的来源没有特殊限制,采用市售商品即可,如Cell Signaling Technology,R&D Systems等公司的ELISA试剂盒。在本发明中,所述待测样品加入后的反应条件优选为20~42℃反应30~90min,更优选为22~30℃反应35~75min,最优选为25℃反应60min。
在本发明中,所述洗涤缓冲液的组分为1×PBS和体积含量为0.05%Tween 20,pH值为7.0;所述洗涤缓冲液洗涤的倍数为4倍。在本发明中,所述用洗涤缓冲液洗涤、再次洗涤与第三阶段洗涤的条件相同。
在本发明中,在本发明中,所述加入底物显色液后孵育的条件优选为20~42℃反应1-40min,更优选为22~30℃反应5~30min,更优选为25℃反应10~20min。
在本发明中,为了验证原人参二醇皂苷的药物活性,建立了不同组别的动物模型,即将雌性6~8龄的BALB/C小鼠饲养5~10d后,随机分为正常组、LPS疾病模型组、原人参二醇皂苷低剂量组、原人参二醇皂苷中剂量组、原人身二醇皂苷高剂量组和阳性对照组,每组10只。在本发明中,所述不同组别的动物模型的待测样品的制备方法优选为:不同组别的动物模型通过灌胃方式给药7d,正常组和LPS疾病模型组给予等量的蒸馏水,给药7d后,按照80~120μg/kg的剂量经滴鼻一次性给予小鼠LPS,20~28h后处死小鼠,取肺泡灌洗液或血液。将所述肺泡灌洗液或血液离心后的上清液,即为不同组别的动物模型的待测样品。
在本发明中,构建所述由LPS引起的肺部炎症疾病的疾病模型的目的在于研究原人参二醇皂苷对其的治疗作用,为原人参二醇皂苷成为应对雾霾、微生物等引起的肺炎治疗药物奠定一定的理论基础。在本发明中,所述由LPS引起的肺部炎症疾病的疾病模型构建方法具体为:按照5mg/kg的剂量经滴鼻一次性给予小鼠LPS,20~28h后处死小鼠,取肺泡灌洗液或血液。
本发明为了得到LPS疾病模型,采用所述LPS对小鼠进行一次性滴鼻处理,本发明对所述LPS的种类和来源没有特殊限定,具体的可优选为Sigma公司的大肠杆菌026:B6来源的LPS(Sigma L8274)。
本发明对所述处死小鼠的方法没有特殊限定,采用本领域技术人员常规采用的方法即可,具体的可优选为采用二氧化碳方法处死小鼠。
在本发明中,所述肺泡灌洗液或血液离心的条件优选为:离心的转速3000~8000rpm/min,离心的时间2~8min,更优选为:离心的转速4000~7000rpm/min,离心的时间4~6min,最优选为离心的转速5000rpm/min,离心的时间5min。
在本发明中,所述阳性对照组给予的药优选为地塞米松,根据小鼠的体重,每天用量5mg/kg。所述低剂量组每天用量优选为5mg/kg;所述中剂量组用量优选为10mg/kg;所述高剂量组用量优选为20mg/kg。
在本发明中,所述原人参二醇皂苷能够抑制巨噬细胞产生炎症因子,所述炎症因子优选包括IL-1β、TNF-α、IL-6和HMGB1中的一种或几种,更优选为IL-1β、TNF-α和IL-6。
在本发明中,所述原人参二醇皂苷能够抑制巨噬细胞产生炎症因子的检测方法采用酶联免疫方法,具体为:
将IL-1β、TNF-α和IL-6的抗体包被于缓冲稀释液中,得到预处理液;
将所述预处理液加入聚苯乙烯板的反应孔中,0~6℃过夜后弃去反应孔中的溶液,用洗涤缓冲液洗涤;
向所述洗涤后的反应孔中加入上清液,20~42℃反应30~90min,反应完毕后用洗涤缓冲液再次洗涤;
向所述再次洗涤后的反应孔中加入酶标抗体,20~42℃反应30~90min后用洗涤缓冲液进行第三阶段洗涤;
向所述第三阶段洗涤后的反应孔中加入底物显色液TMB,20~42℃孵育5~30min,用0.05~0.3ml的1~3N H2SO4终止反应,在450nm处检测每孔的OD值。
在本发明中,所述缓冲稀释液的组分为11.8g Na2HPO4和16.1g NaH2PO4溶于1L去离子水中,pH值为6.5,或所述缓冲稀释液的组分为7.13g NaHCO3和1.59g Na2CO3溶于1L去离子水中,pH值为9.5;所述缓冲稀释液的体积用量为1:250。在本发明中,所述酶标抗体为BD biosciences ELISA试剂盒中酶标抗体,用量优选为1:250比例与1×PBS加1%脱脂奶稀释。本发明对所述酶标抗体的来源没有特殊限制,采用市售商品即可,如Cell Signaling Technology,R&D Systems等公司的ELISA试剂盒。
在本发明中,所述洗涤缓冲液的组分为1×PBS和体积含量为0.05%Tween 20,pH值为7.0;所述洗涤缓冲液洗涤的倍数为4倍。在本发明中,所述用洗涤缓冲液洗涤、再次洗涤与第三阶段洗涤的条件相同。
在本发明中,所述上清液加入后的反应条件优选为20~42℃反应30~90min,更优选为22~30℃反应35~75min,最优选为25℃反应60min。
在本发明中,所述酶标抗体的种类优选为BD biosciences ELISA试剂盒,用量优选为1:250比例稀释。本发明对上述酶标抗体的来源没有特殊限制,采用市售商品即可。在本发明中,所述加入酶标抗体后反应的条件优选为20~42℃反应30~90min,更优选为22~30℃反应35~75min,最优选为25℃反应60min。
在本发明中,在本发明中,所述加入底物显色液后孵育的条件优选为20~42℃反应1-40min,更优选为22~30℃反应5~30min,更优选为25℃反应10~20min。
在本发明中,所述原人参二醇皂苷能够抑制巨噬细胞产生炎症因子的检测方法中所述的上清液的制备方法优选为:将6~8龄的C57BL/6小鼠饲喂5~8天后,腹腔内注射巯基醋酸盐培养液,4d后处死小鼠,收集腹腔渗出细胞,用DMEM培养基重悬腹腔渗出细胞,得到混合液,将混合液接种于细胞培养皿中过夜培养,培养后在细胞培养皿中的贴壁细胞即为巨噬细胞,将巨噬细胞收集于DEME培养基中培养。培养完毕后取巨噬细胞接种于48孔板中,10~12h后,更换Opti-MEM培养基100μl,加入原人参二醇皂苷,加入完毕后用silica刺激细胞,孵育后取上清液。
在本发明中,所述巯基醋酸盐培养液的组分为巯基醋酸盐;所述巯基醋酸盐培养液的注射量优选为0.5~4ml,更优选为1~3ml,最优选为2ml;所述巯基醋酸盐培养液中的巯基醋酸盐的质量百分含量优选为1~8%,更优选为2~6%,最优选为4%。
本发明对所述处死小鼠的方法没有特殊限定,采用本领域技术人员常规采用的方法即可。本发明对所述收集腹腔渗出细胞的方法没有特殊限定,采用常规收集方法即可。
在本发明中,所述DEME培养基为赛默飞世尔科技公司Gibco品牌的DMEM(产品号为11995),pH值为7.2。
在本发明中,所述混合液中细胞稀释至2×106cells/mL。所述混合液培养过夜的培养的温度优选为25~45℃,更优选为30~42℃,最优选为37℃。
在本发明中,所述巨噬细胞收集于DEME培养基中培养的温度优选为25~45℃,更优选为30~42℃,最优选为37℃;所述培养的时间优选为8-14h,更优选为10-12h,最优选为12h。所述培养优选在体积含量为5%的CO2和95%的空气条件下进行培养,所述空气为洁净无菌的空气。
在本发明中,所述巨噬细胞培养完毕后,接种于48孔板中,接种量优选为1.5~3×105cell/孔,更优选为1.8~2.5×105cell/孔,最优选为2×105cell/孔。
在本发明中,所述Opti-MEM培养基为赛默飞世尔科技公司Gibco品牌的Opti-MEM(产品号为31985),pH值为7.0。
在本发明中,所述加入原人参二醇的目的是,使原人参二醇皂苷的摩尔浓度为12.5μM、25μM和50μM。
在本发明中,所述二氧化硅(InvioGen tlrl-sio)的质量浓度优选为120~160μg/ml,更优选为140~155μg/ml,最优选为150μg/ml。所述silica加入的体积优选为2~8μl,更优选为2.5~5μl,最优选为3μl。所述加入silica后孵育的时间优选为2~6h,更优选为2.5~5h,最优选为3h;所述加入silica后孵育的温度优选为25~45℃,更优选为30~42℃,最优选为37℃。
下面结合实施例对本发明提供的原人参二醇皂苷在制备防治炎症疾病的药物中的应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
将雌性8龄BALB/C小鼠饲喂一周后,随机分为正常组、LPS疾病模型组、原人参二醇皂苷低剂量组(5mg/kg/d)、原人参二醇皂苷中剂量组(10mg/kg/d)、原人参二醇皂苷高剂量组(20mg/kg/d)和阳性对照组(地塞米松5mg/kg/d),每组10只,通过灌胃方式给药,正常组和PM2.5疾病模型组给予等量的蒸馏水,第7天给药后按100μg/kg的剂量经滴鼻方式一次性给予小鼠LPS,24h后处死小鼠,取肺泡灌洗液或血液,将肺泡灌洗液或血液在5000rpm/min离心5min,离心后的上清液,为待测样品。
将IL-1β、TNF-α、IL-6的抗体包被于缓冲稀释液中,得到预处理液,将0.5ml的预处理液加入聚苯乙烯板的反应孔中,4℃过夜,过夜后弃去孔中的溶液,用4倍体积的洗涤缓冲液洗涤5次,加入50μl待测样品,室温反应1h,用4倍体积的洗涤缓冲液洗涤5次,按1:250等比例稀释IL-1β、TNF-α、IL-6酶标抗体,25℃反应1h,用4体积的洗涤缓冲液洗涤5次,洗涤后每孔加入50μl的2N H2SO4终止反应,在450nm处检测每孔的OD值,结果如下:
在体内实验中,通过对肺泡灌洗液和血液中的炎症因子IL-1β、TNF-α、IL-6进行ELISA测定,结果显示:原人参二醇皂苷处理组中的炎症因子IL-1β、TNF-α、IL-6的分泌较模型组均受到了显著抑制,其效果接近地塞米松阳性对照组,说明使用原人参二醇皂苷在体内模型中,对LPS引起的肺组织损伤具有很好的保护作用。实验结果见图1、图2、图3和图4。其中,血液中TNF-α及IL-6含量低于可检测最低浓度,实验数据未采用。
实施例2
将6龄的C57BL/6小鼠饲喂5天后,腹腔内注射2ml 4%的巯基醋酸盐培养液,4d后处死小鼠,收集腹腔渗出细胞,用5mLDMEM培养基重悬腹腔渗出细胞,得到混合液,混合液中,腹腔渗出细胞的浓度为6×106cells/mL,将混合液细胞稀释至2×106cells/mL后,接种于细胞培养皿中过夜培养,培养后在细胞培养皿中的贴壁细胞即为巨噬细胞,将巨噬细胞收集于DEME培养基中培养,培养的条件为体积百分含量为5%的CO2、95%的空气,37℃培养12h。培养完毕后取2.0×105cell/孔巨噬细胞接种于48孔板中,10~12h后,更换100μl Opti-MEM培养基,加入原人参二醇皂苷进行处理,使原人参二醇皂苷的摩尔浓度分别为12.5μM、25μM和50μM,处理完毕后150μg/mL silica刺激细胞,37℃孵育3h后取上清液。
将IL-1β、TNF-α、IL-6的抗体包被于缓冲稀释液中,得到预处理液,50μl的预处理液加入聚苯乙烯板的反应孔中,4℃过夜,过夜后弃去孔中的溶液,用4倍体积的洗涤缓冲液洗涤5次,加入50μl待测样品,室温反应1h,用4倍体积的洗涤缓冲液洗涤5次,以1:250的比例加入酶标抗体,25℃反应1h,用4体积的洗涤缓冲液洗涤5次,洗涤后每孔加入50μl的2N H2SO4终止反应,在450nm处检测每孔的OD值,结果如下:
通过测定细胞上清液中炎症因子对原人参二醇皂苷的抗炎能力进行评价。实验结果表明:原人参二醇皂苷高剂量处理组中,细胞上清液中炎症因子TNF-α、IL-6、IL-1β的分泌受到了显著的抑制并具有一定的浓度依赖性,其中高剂量组中TNF-α、IL-6、IL-1β的分泌分别仅为正常组的1/3、1/2、1/4。实验结果见图5、图6和图7。
由以上实施例可知,本发明提供了原人参二醇皂苷在制备防治炎症疾病的药物中的应用,原人参二醇皂苷能够有效防治炎症疾病。在本发明中,所述原人参二醇皂苷防治炎症疾病的原理为抑制炎症部位巨噬细胞的激活,从而降低促炎因子的释放。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!