基于光纤束的医用光学相干层析成像二维前向扫描探头的制作方法
本发明涉及医用光学内窥成像装置的技术领域,具体涉及一种基于光纤束的医用光学相干层析成像二维前向扫描探头。
背景技术:
光学相干层析成像技术(OCT)是一种非接触,无损伤的医用光学成像技术。通过对样品内部散射光的检测,OCT可以对生物样品的结构进行高分辨的成像,分辨率在微米量级。
为了对人体内部的病变组织进行检测,人们将OCT技术与内窥探头相结合,发展了基于管状光纤探针的OCT内窥成像方法,被广泛应用于心血管以及泌尿系统的临床研究, 其中旋转式微型侧向扫描OCT探头已被成功应用于冠状动脉的临床检查。和X射线以及超声技术相比,OCT具有更高的分辨率,它可以检测出易破裂的动脉粥样硬化斑块。
然而,在对一些人体器官, 例如口腔、肠胃、呼吸道以及腔体的检查和手术过程中,需要一种可进入人体的微型前向或侧向成像探头, 来对人体组织的结构进行观测。现有的前向扫描装置主要是在OCT探头光纤的前端安装光束扫描机构,例如使用微机械镜片(Y. Pan, H. Xie, G. K. Fedder, “Endoscopic optical coherence tomography based on a microelectromechanical mirror, “ Opt. Lett., 26, 1966-1968, 2001)、压电驱动的悬臂(S. A. Boppart, B. E. Bouma, C. Pitris, G. J. Tearney, and J. G. Fujimoto, “Forward-imaging instruments for optical coherence tomography,” Opt. Lett., 22, 1618-1620, 1997)、转动的棱镜对(J. Wu, M. Conry, C. Gu, F. Wang, Z. Yaqoob, and C. Yang, “Paried-angle-rotation scanning optical coherence tomography forward-imaging probe.” Opt. Lett., 31, 1265-1267, 2006)、或者使用振镜或齿轮拖动探测光纤整体来回移动(B. E. Bouma and G. J. Tearney, “Power-efficient nonreciprocal interferometer and linear-scanning fiber-optic catheter for optical coherence tomography,” Opt. Lett., 24, 531-533, 1999), 从而可以对生物或人体内部组织的微观结构进行三维立体成像。但是这些前向(或侧向)扫描OCT探头结构复杂,体积也相对较大,很难制成微型的二维前向扫描成像装置,从而限制了OCT技术在人体内部疾病检测中的应用。
近年来,出现了基于光纤束的前向OCT成像装置(Jae-Ho H., J. Lee, and J. U. Kang, “Pixelation effect removal from fiber bundle probe based optical coherence tomography imaging,” Opt. Express, 18, 7427-7439, 2010),在这种装置中,扫描机构被放置于光纤束的入射端,在光纤束的出射端由物镜直接进行成像。因为扫描机构不需要进入人体,从而避免了扫描探头的复杂性。但是,在现有的光纤束OCT成像技术中,人们采用的是共路型干涉装置,由于原理限制,其工作距离很短,无法对样品进行大范围成像,所以并不实用。
技术实现要素:
本发明的目的在于:克服现有技术的不足,提供一种基于光纤束的医用光学相干层析成像二维前向扫描探头,与现有技术相比具备如下有益效果:可以在长的工作距离上对待测人体组织的结构进行大范围成像,工作距离不受限制;因为扫描机构被置于光纤束的入射端,不需要进入人体,从而减小了成像探头前端结构的复杂性,有利于制成微型内窥成像装置,应用于人体和其他生物体的结构检测,为疾病的早期诊断提供帮助。
本发明所采取的技术方案是:
基于光纤束的医用光学相干层析成像二维前向扫描探头,包括光源,所述光源通过光学干涉仪与光束扫描单元连接,所述光束扫描单元通过光纤束与探头连接,还包括控制和数据采集部分,所述控制和数据采集部分分别与光源、光学干涉仪和光束扫描单元连接,所述光学干涉仪内包括光学环形器、分束器A、准直透镜、光学衰减器、全反射镜、分束器B和光电探测器;光束扫描单元所收集到的样品光通过光学环形器的c端从分束器A的其中一路进入,从分束器A输出的一路光E1经由准直透镜B进行准直,并通过光学衰减器入射到全反射镜,所述准直透镜B、光学衰减器和全反射镜构成光学干涉仪的参考臂;从分束器A输出的另一路光E2与由参考臂反射回的光E3通过分束器B进行干涉,所述分束器B输出的干涉光信号由光电探测器进行接收,转换为电信号后由控制和数据采集部分内的数据采集卡采集。
本发明进一步改进方案是,所述E3和E2的光程差Δl与光纤束的出射端面到待测生物组织的距离d的关系满足0<(Δl-2d)≤2.0mm。
本发明更进一步改进方案是,所述数据采集卡采集到的光谱干涉信号经过付里叶变换,共得到四个干涉峰,样品内部的结构信息包含在最靠近零频率处或等光程面的干涉峰中。
本发明更进一步改进方案是,所述从分束器A输出的另一路光E2经过偏振控制器的偏振作用之后与由参考臂反射回的光E3通过分束器B进行干涉。
本发明更进一步改进方案是,所述光源为一扫频激光器、或其它波长可连续调节的光源。
本发明更进一步改进方案是,所述由光纤束输出端面出射的光被柱状梯度折射率透镜进行准直。
本发明更进一步改进方案是,被柱状梯度折射率透镜准直的光由一个会聚透镜聚焦在待测生物组织上。
本发明更进一步改进方案是,经由柱状梯度折射率透镜准直偏转的光通过会聚透镜的中心。
本发明更进一步改进方案是,所述光学干涉仪内设有光学隔离器、可变光衰减器和光学环形器,所述光源输出的探测光依次经过光学隔离器和可变光衰减器之后进入光学环形器的a端,并从光学环形器的b端输出至扫描单元之后、探头收集到的光再由扫描单元光学环形器的b端进入光学环形器的b端,最后从光学环形器的c端输出至分束器A进行分光。
本发明更进一步改进方案是,从光学环形器的b端口输出的探测光进入光束扫描单元之后,经由准直透镜A准直以后入射到一个二维扫描振镜,使光束扫描单元形成二维光束扫描机构,由二维扫描振镜反射的光,经由透镜A、透镜B、透镜C,会聚到光纤束的入射端面,从而实现所述二维光束扫描机构控探测光对光纤束的入射端面进行扫描;探测光由光纤束的出射端面输出进入成像探头,对待测生物组织进行扫描,所述准直透镜A、二维扫描振镜、透镜A、透镜B、透镜C和光纤束的入射端面均设于光束扫描单元内。
本发明更进一步改进方案是,所述控制和数据采集部分还扫描驱动卡和计算机,所述计算机的输入端与数据采集卡连接,所述计算机的输出端与扫描驱动卡连接,所述扫描驱动卡与光束扫描单元连接,所述数据采集卡还与光源的同步信号连接;所述扫描驱动卡输出的信号控制光束扫描单元进行扫描,数据采集卡采集到的数字信号由计算机接收处理。
本发明更进一步改进方案是,所述扫描驱动卡输出的信号控制光束扫描单元的二维扫描振镜进行扫描。
发明的有益效果在于:
第一、本发明的基于光纤束的医用光学相干层析成像二维前向扫描探头,与现有技术相比具备如下有益效果:可以在长的工作距离上对待测人体组织的结构进行大范围成像,工作距离不受限制。
第二、本发明的基于光纤束的医用光学相干层析成像二维前向扫描探头,因为扫描机构被置于光纤束的入射端,不需要进入人体,从而减小了成像探头前端结构的复杂性,有利于制成微型内窥成像装置,应用于人体和其他生物体的结构检测,为疾病的早期诊断提供帮助。
附图说明:
图1为本发明的基于光纤束的医用OCT内窥成像装置示意图。
图2为本发明的内窥成像装置的光学干涉仪结构示意图。
图3为本发明的光束扫描单元结构示意图。
图4为本发明的探头结构示意图。
图5为本发明实施例的干涉光谱的数值模拟图。
图6为本发明实施例的干涉光谱的付里叶变换图。
具体实施方式:
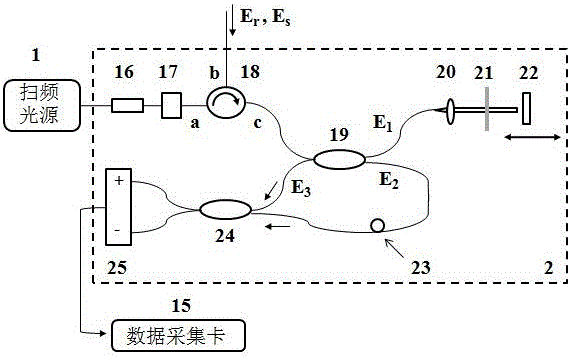
结合图1、图2、图3和图4所示,本发明包括光源1,所述光源1通过光学干涉仪2与光束扫描单元3连接,所述光束扫描单元3通过光纤束11与探头4连接,还包括控制和数据采集部分5,所述控制和数据采集部分5分别与光源1、光学干涉仪2和光束扫描单元3连接,所述光学干涉仪2内包括光学环形器18、分束器A19、准直透镜20、光学衰减器21、全反射镜22、分束器B24和光电探测器25;光束扫描单元3所收集到的样品光通过光学环形器18的c端从分束器A19的其中一路进入,从分束器A19输出的一路光E1经由准直透镜B20进行准直,并通过光学衰减器21入射到全反射镜22,所述准直透镜B20、光学衰减器21和全反射镜22构成光学干涉仪2的参考臂;从分束器A19输出的另一路光E2与由参考臂反射回的光E3通过分束器B24进行干涉,所述分束器B24输出的干涉光信号由光电探测器25进行接收,转换为电信号后由控制和数据采集部分5内的数据采集卡15采集。
所述E3和E2的光程差Δl与光纤束11的出射端面到待测生物组织12的距离d的关系满足0<(Δl-2d)≤2.0mm。
所述数据采集卡15采集到的光谱干涉信号经过付里叶变换,共得到四个干涉峰,样品内部的结构信息包含在最靠近零频率处或等光程面的干涉峰中。
所述从分束器A19输出的另一路光E2经过偏振控制器23的偏振作用之后与由参考臂反射回的光E3通过分束器B24进行干涉。
所述光源1为一扫频激光器、或其它波长可连续调节的光源。
所述由光纤束11输出端面出射的光被柱状梯度折射率透镜26进行准直。
被柱状梯度折射率透镜26准直的光由一个会聚透镜27聚焦在待测生物组织12上。
经由柱状梯度折射率透镜26准直偏转的光通过会聚透镜27的中心。
所述光学干涉仪2内设有光学隔离器16、可变光衰减器17和光学环形器18,所述光源1输出的探测光依次经过光学隔离器16和可变光衰减器17之后进入光学环形器18的a端,并从光学环形器18的b端输出至扫描单元3之后、探头4收集到的光再由扫描单元3光学环形器18的b端进入光学环形器18的b端,最后从光学环形器18的c端输出至分束器A19进行分光。
从光学环形器18的b端口输出的探测光进入光束扫描单元3之后,经由准直透镜A6准直以后入射到一个二维扫描振镜7,使光束扫描单元3形成二维光束扫描机构,由二维扫描振镜7反射的光,经由透镜A8、透镜B9、透镜C10,会聚到光纤束11的入射端面,从而实现所述二维光束扫描机构控探测光对光纤束11的入射端面进行扫描;探测光由光纤束11的出射端面输出进入成像探头4,对待测生物组织12进行扫描,所述准直透镜A6、二维扫描振镜7、透镜A8、透镜B9、透镜C10和光纤束11的入射端面均设于光束扫描单元3内。
所述控制和数据采集部分5还包括扫描驱动卡14和计算机13,所述计算机13与数据采集卡15和扫描驱动卡14连接,所述扫描驱动卡14与光束扫描单元3连接,所述数据采集卡15还与光源1的同步信号连接;所述扫描驱动卡14输出的信号控制光束扫描单元3进行扫描,数据采集卡15采集到的数字信号由计算机13接收处理。
所述扫描驱动卡14输出的信号控制光束扫描单元3的二维扫描振镜7进行扫描。
假定入射到光纤束11出射端面FB的光场为E0,则由端面FB反射的光场为Er=rfE0,其中rf为光纤束11端面的反射率。从样品中散射的光场为Es=rsE0(2d),其中d为出射端面FB到待测生物组织12表面的光程差,rs为样品的散射系数。
如图2所示,Er和Es按光场入射方向原光路返回光学干涉仪2,进入光学环形器18的b端,然后由c端输出进入2x2结构的分束器A19,被分为两路光E1(E1=r1(Er+Es))和E2(E2=r2(Er+Es)),其中r1和r2为分束器A19的分光比。光场E1经由全反射镜22反射回分束器A19,输出后变为光场E3=r3E1(其中r3=r1或r3=r2),则输入到分束器B24的两路光场E2和E3为:
其中Δl为由干涉仪引起的光场E2和E3之间的光程差,其长度可以通过前后调节全反射镜22的位置来控制。光场E2和E3的表达式各包含两项,这四项光场E21、E22、E31和E32具有不同的光程延迟,它们会彼此之间产生干涉,所以从光纤耦合器24输出的干涉光场包含有六项,它们分别为=<E21,E22>、=<E21,E31>、=<E21,E32>、=<E22,E31>、=<E22,E32>和=<E31,E32>,在OCT图像上,这六项分别对应不同的成像深度,其中是光纤束11端面FB的反射光和待测生物组织12的反射光形成的共路型干涉信号,它产生在深度-2d处;是光纤束11端面FB自身反射光的干涉信号,它产生在深度Δl处;是待测生物组织12和光纤束11端面反射光的干涉信号,它产生在深度Δl-2d处;是待测生物组织12和光纤束11端面反射光的另外一个干涉信号,它产生在深度Δl+2d处;是待测生物组织12表面自身散射光的干涉信号,它产生在深度Δl处;是光纤束11端面FB的反射光和待测生物组织12的反射光形成的另一个共路型干涉信号,它产生在深度-2d处。在这六项光场干涉信号中, 、、和是和待测生物组织12的结构信息相关的。假定从光纤束11端面到待测生物组织12表面的距离为d=15毫米,设定Δl=31毫米,则六个干涉信号将分别产生在深度-30毫米(和)、31毫米(和)、1毫米()、以及61毫米()处,因为频率域OCT的信号会随着成像深度衰减,在这六个干涉信号中,只有在深度Δl-2d=1毫米处的干涉信号会被有效探测到,而正好包含有待测生物组织12的结构信息。从以上讨论可以看出,当我们设定好探头的工作距离d以后,通过移动平面反射镜22来选择合适的干涉仪两臂之间的光程差Δl,就可以得到待测生物组织12的结构信息,并同时消除其它干涉项对成像的不利影响。所以,这种新型成像装置的工作距离将不受限制,可以对人体内部的组织结构在大尺度范围内进行成像检测。
实施例:
本实施例利用计算机对本发明所述成像装置进行了数值模拟。
如图5所示,图5显示了由分束器B24输出到光电探测器25上的干涉光谱模拟计算结果,其中水平坐标轴为光场的波数,竖直坐标轴为干涉光场的强度。在图5的计算中,设定输入光源1的中心波长为1300纳米,线型为高斯型,光谱半高宽为50纳米,光纤束出射端面到待测生物组织12表面距离为7毫米, 干涉仪光程差选为Δl=16毫米。对图5中的光干涉信号进行付里叶变换,则可以得到待测生物组织12的空间位置信息,如图6所示,其中水平坐标轴的起点代表光学干涉仪2等光程面G的位置。
如图6所示,在图6中,我们可以看到四个干涉峰,其中干涉峰P1和干涉仪等光程面G的间距为2毫米,它对应前面所述的干涉信号,代表了待测生物组织12的位置信息;干涉峰P2和干涉仪等光程面G的间距为14毫米,它对应前述的干涉信号和;干涉峰P3和干涉仪等光程面G的间距为16毫米,它对应前述的干涉信号和;干涉峰P4和干涉仪等光程面G的间距为30毫米,它对应干涉信号;在实际应用中,由于光谱采样密度的限制,只有靠近等光程面G的干涉信号P1才能被有效探测并成像,而其他三个信号,P2、P3和P4由于距离等光程面G太远,无法被有效探测,所以在P1位置,我们可以成功的得到待测生物组织12的结构图像。
对本发明应当理解的是,本发明的保护范围应该以权利要求所界定的保护范围为准,凡是在本发明的精神原则之内,所作出的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!