血液处理装置及用于操作该装置的控制系统的制作方法
本申请涉及医疗器械领域,尤其是涉及一种具有串并联结构的血液处理装置。
背景技术:
肝衰竭患者进行外周血干细胞移植,需进行干细胞采集,然而,此类患者病情重,往往需要进行人工肝(包括血浆置换、胆红素吸附、生物人工肝等方式)支持治疗。人工肝支持系统的治疗机制是基于肝细胞的强大再生能力,通过体外机械、理化和生物装置,清除各种有害物质,补充必需物质,改善内环境,暂时替代衰竭肝脏的部分功能,为肝细胞再生及肝功能恢复创造条件或等待机会进行肝移植。常规做法是(以血浆置换为例),患者接受单独的血浆置换治疗,先建立体外循环通路,将患者连接血浆治疗机器,进行血浆置换治疗,时间约2-4小时;自体外周血干细胞采集则采用单独的血细胞分离机进行采集,需重新建立体外循环通路,耗时约需2-3小时。
人工肝支持系统、干细胞采集本是临床单独使用的技术,针对肝衰竭患者需要进行干细胞采集时,需要采用两种治疗方式,分别进行的缺点在于患者需反复建立体外循环通路,多次添加抗凝剂,并且体外抗凝风险加大,同时治疗耗时加长,造成了患者的不适与临床风险。
技术实现要素:
本实用新型的目的在于针对需要进行干细胞采集和人工肝支持系统的肝衰竭患者的治疗,提供一种具有串并联结构的血液处理装置,操作该装置的方法和治疗方法,将人工肝处理装置和血细胞分离器连接,同时进行人工肝支持系统、干细胞采集两项治疗,从而提高治疗效率,降低患者治疗风险。
本实用新型包含以下内容:
实施方式1.一种血液处理装置,其特征在于,包括:
血细胞分离器;
人工肝处理装置;
与人工肝处理装置连接的第一上游血液导管和第一下游血液导管;和
与血细胞分离器连接的第二上游血液导管和第二下游血液导管;其中
所述第二上游血液导管和第二下游血液导管与所述第一上游血液导管分别在第二入口点和第二出口点连接,并且所述第二出口点比第二入口点更接近于所述人工肝处理装置。
实施方式2.根据实施方式1所述的血液处理装置,其特征在于,还包括:与所述第一上游血液导管连接的抗凝剂注入导管。
实施方式3.根据实施方式1所述的血液处理装置,其特征在于,所述人工肝处理装置包括血浆分离器,所述血液处理装置还包括:与所述第一下游血液导管连接的血浆注入导管或置换液注入导管。
实施方式4.根据实施方式1-3中任一项所述的血液处理装置,其特征在于,其中所述血细胞分离器配置为能够分离来自第二上游血液导管的血液得到第二分离血液和干细胞,并使第二分离血液进入第二下游血液导管。
实施方式5.根据实施方式3所述的血液处理装置,其特征在于,其中所述血浆分离器配置为能够分离来自第一上游血液导管的血液得到第一分离血液和血浆,并使第一分离血液进入第一下游血液导管。
实施方式6.根据实施方式1-3中任一项所述的血液处理装置,其特征在于,还包括:与所述第二上游血液导管连接的第二流量调节计。
实施方式7.根据实施方式1或2所述的血液处理装置,其特征在于,还包括:与所述第一上游血液导管连接的第一流量调节计,所述第一流量调节计位于所述第二出口点的下游。
实施方式8.根据实施方式2所述的血液处理装置,其特征在于,还包括与所述抗凝剂注入导管连接的抗凝剂注入器,其配置为用于注射抗凝剂。
实施方式9.根据实施方式3所述的血液处理装置,其特征在于,还包括与所述血浆注入导管连接的血浆注入器,其配置为用于注射新鲜血浆;或者还包括与所述置换液注入导管连接的置换液注入器,其配置为用于注射置换液。
实施方式10.根据实施方式1所述的血液处理装置,其特征在于,所述人工肝处理装置包括选自以下的至少一种:血浆置换装置、胆红素吸附装置、和生物人工肝装置。
实施方式11.根据实施方式1所述的血液处理装置,其特征在于,所述血液处理装置中的血液容量低于500ml。
实施方式12.一种用于操作实施方式1-11中任一项所述的血液处理装置的控制系统,其特征在于,所述控制系统包括软件和硬件,所述控制系统配置为能够如下操作所述血液处理装置:使待处理的血液的第一部分流经第一上游血液导管进入人工肝处理装置,并且待处理的血液的第二部分从第一上游血液导管在第二入口点进入第二上游血液导管并进入血细胞分离器;
血细胞分离器将待处理的血液的第二部分进行分离处理得到经分离的第二分离血液,将第二分离血液经第二下游血液导管在第二出口点与待处理的血液的第一部分合并得到合并的血液,合并的血液进入人工肝处理装置,
人工肝处理装置将合并的血液进行分离处理得到第一分离血液。
本实用新型也包含这样的实施方式:
一种血液处理装置,其特征在于,包括:
血细胞分离器;
人工肝处理装置;
与人工肝处理装置连接的第一上游血液导管和第一下游血液导管;和
与血细胞分离器连接的第二上游血液导管和第二下游血液导管;其中
所述第二上游血液导管和第二下游血液导管与所述第一下游血液导管分别在第二入口点和第二出口点连接,并且所述第二入口点比第二出口点更接近于所述人工肝处理装置。
借助于本实用新型的技术方案,针对需要进行干细胞移植和人工肝支持系统的肝衰竭患者的治疗,只需要建立一次体外血液循环,同时进行人工肝支持系统和干细胞采集两项治疗,从而缩短了治疗时间,提高治疗效率,降低患者治疗风险。
附图说明
为了更清楚地说明本公开实施例的技术方案,下面将对实施例的附图作简单地介绍,显而易见地,下面描述中的附图仅仅涉及本公开的一些实施例,而非对本公开的限制。
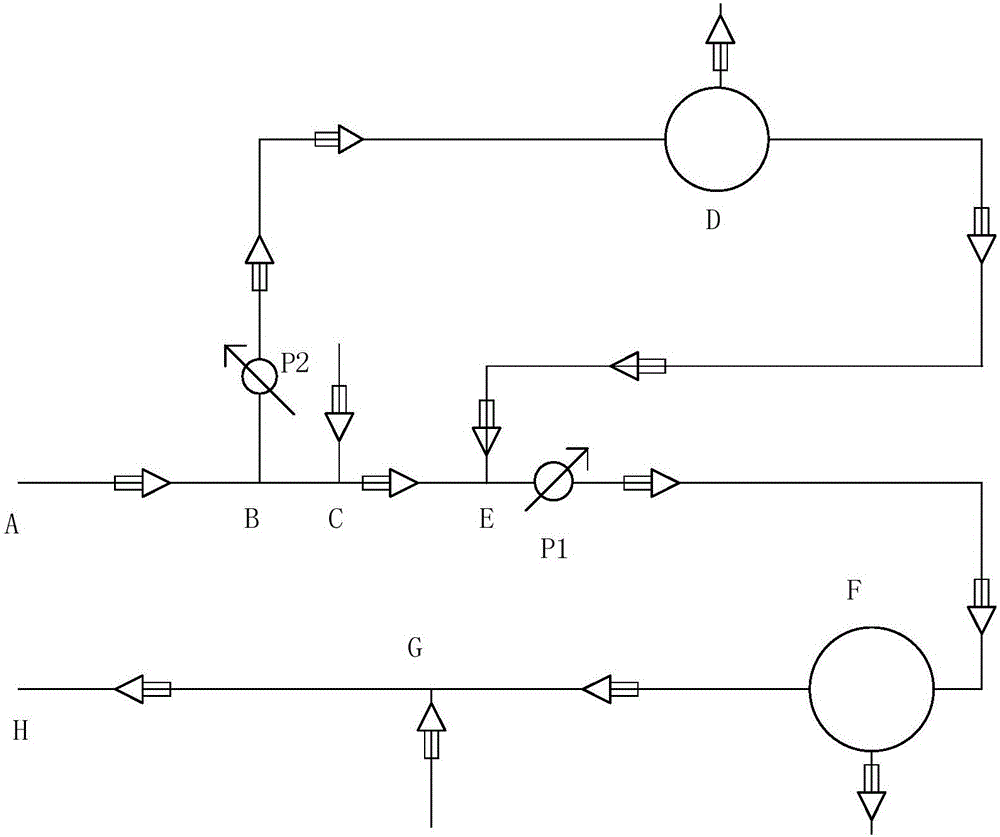
图1是本申请一种实施方式的示意图。
图2是一种用于操作血液处理装置的控制系统的示意图。
图中,附图标记具有以下含义:
D:血细胞分离器;F:人工肝处理装置;
ABEF:第一上游血液导管;B:第二入口点;E:第二出口点;
FGH:第一下游血液导管;
BD:第二上游血液导管;
DE:第二下游血液导管;
P1:第一流量调节计;
P2:第二流量调节计;
C:抗凝剂注入导管接入点;
G:血浆注入导管或置换液注入导管接入点;
11:控制系统。
具体实施方式
为使本公开实施例的目的、技术方案和优点更加清楚,下面将结合本公开实施例的附图,对本公开实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本公开的一部分实施例,而不是全部的实施例。基于所描述的本公开的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其他实施例,都属于本公开保护的范围。
肝衰竭患者进行外周血干细胞移植,需进行干细胞采集,然而,此类患者病情重,往往需要通过人工肝支持系统来进行支持治疗。
人工肝支持系统简称为人工肝脏或人工肝,是利用体外设备装置,清除因肝衰竭而产生或增加的各种有害物质,补充需肝脏合成或代谢的蛋白质等必需物质,改善患者水、电解质及酸碱平衡等内环境,临时替代肝脏的一些功能,从而辅助治疗肝衰竭等疾病的治疗手段。人工肝一般分为非生物型、生物型及混合型3种。非生物型人工肝包括血浆置换、血浆胆红素吸附、血液透析滤过等治疗肝衰竭的方法;生物型人工肝是指通过在体外培养的肝细胞的基础上建立体外生物装置代替衰竭的肝功能;混合型人工肝是联合非生物型人工肝的解毒功能与生物型人工肝的合成和转化等功能,代表了人工肝的发展趋势。
以血浆置换为例,患者接受单独的血浆置换治疗,先建立体外循环通路,进行血浆置换治疗,时间约2-4小时。血浆置换主要是先分离出血浆,将患 者的血液引出体外,经过膜式血浆分离方法将患者的血浆从全血中分离出来弃去,然后补充等量的新鲜冷冻血浆或人血白蛋白等置换液。血浆置换时,分离血浆可以使用血浆分离器。冷冻血浆的补充往往在血浆分离器的下游完成。
外周血干细胞(PBSC)的采集方法可以使用血细胞分离器分离采集外周血的单个核细胞组分。多采用分离淋巴细胞的程序分离。一般情况下行大静脉穿刺即可,建立体外循环进行采集。采集成人时的血流速度为50—60ml/min,每次分离4—6循环(约2—3h),分离血液的总容积9L,依据情况连续或隔日采集。
人工肝支持系统、干细胞采集单独进行均具有较好的安全性和效果。例如,血浆置换可以清除患者体内的各种代谢毒素和致病因子,从而达到治疗目的。由于血浆置换法不仅可以清除体内中、小分子的代谢毒素,还清除了蛋白、免疫复合物等大分子物质,同时又补充了体内所缺乏的白蛋白、凝血因子等必需物质,较好的替代了肝脏某些功能。外周血干细胞(PBSC)的采集方法目前属于成熟的临床应用技术,能够根据需求较好的采集到目标需求量的细胞数量。
人工肝支持系统、干细胞采集本是临床单独使用的技术,针对肝衰竭患者需要进行干细胞移植时,需要采用两种治疗方式,分别进行的缺点在于患者需反复建立体外循环通路,体外抗凝风险加大,治疗耗时加成,造成了患者的不适与临床风险。
本实用新型的目的在于针对需要进行干细胞移植和人工肝支持系统的肝衰竭患者的治疗,提供一种具有串并联结构的血液处理装置,操作该装置的方法和治疗方法,将人工肝处理装置和血细胞分离器连接,同时进行人工肝支持系统、干细胞采集两项治疗,从而提高治疗效率,降低患者治疗风险。
图1示出了一种血液处理装置,其包括:
血细胞分离器D;
人工肝处理装置F;
与人工肝处理装置连接的第一上游血液导管(ABEF)和第一下游血液导管(FGH);和
与血细胞分离器连接的第二上游血液导管(BD)和第二下游血液导管(DE);其中
所述第二上游血液导管和第二下游血液导管与所述第一上游血液导管分别在第二入口点(B)和第二出口点(E)连接,并且所述第二出口点(E)比第二入口点(B)更接近于所述人工肝处理装置。
在图1中,导管使用实线表示,其中实线上的箭头表示导管中物质的流动方向。
该血液处理装置通过将用于血细胞分离的第二血液循环以并联方式连接于用于人工肝支持系统的第一血液循环的上游,从而使得,只需要建立一次体外血液循环即可同时进行血细胞分离和人工肝支持系统治疗,并且由于血细胞分离循环的时间较短,借助于这种装置,可以随时开闭血细胞分离循环,而不影响人工肝支持系统循环,结果是无需单独建立血细胞分离循环,并且节约了血细胞分离循环的时间,提高了治疗效率,降低了患者治疗风险。
在本申请中,与人工肝处理装置连接的循环称为第一循环或者第一血液循环。在本申请中,与血细胞分离器连接的循环称为第二循环或者第二血液循环。
在一些示例中,所述血液处理装置,还包括:与所述第一上游血液导管连接的抗凝剂注入导管。在本申请的实施例中,仅需在第一上游血液导管处设置抗凝剂注入导管,从该导管添加抗凝剂,就可以使得整个人体的血液被肝素化(抗凝化处理),从而整个血液流通管路能够满足抗凝的要求。
当然也可以在所述第二上游血液导管上连接抗凝剂注入导管。在一些示例中,所述第二上游血液导管上不连接抗凝剂注入导管。
在一些示例中,所述人工肝处理装置包括血浆分离器,所述血液处理装置还包括:与所述第一下游血液导管连接的血浆注入导管或置换液注入导管。在血浆置换中,在分离了血液中原有的血浆之后,需要补充等量的新鲜冷冻血浆或人血白蛋白等置换液,因此,该血浆注入导管也可以称为是置换液注入导管。
在一些示例中,在所述血液处理装置中,所述血细胞分离器配置为能够分离来自第二上游血液导管的血液中的干细胞得到第二分离血液,并使第二分离血液进入第二下游导管。
在一些示例中,在所述血液处理装置中,所述血浆分离器配置为能够分离来自第一上游血液导管的血液中的血浆,得到第一分离血液,并使第一分离血液进入第一下游导管。
在一些示例中,所述血液处理装置还包括:与所述第二上游血液导管连接的第二流量调节计P2。
在一些示例中,所述血液处理装置,还包括:与所述第一上游血液导管连接的第一流量调节计P1,所述第一流量调节计P1位于所述第二出口点(E)的下游。
在一些示例中,所述血液处理装置中的血液容量低于500ml,优选低于400ml,更优选低于300ml。使整个血液处理装置中的血液容量较低是出于对患者的可承受能力而言的,对于正常的人而言,可能当血液缺失(体外循环)500ml以上时会出现不适,然而,对于肝病患者,可能血液在体外循环达到500ml之前就会出现不适症状,因此,所述血液处理装置中的血液容量越低越好,优选低于400ml。
本申请的实施例还提供操作以上所述的血液处理装置的方法,包括:
使待处理的血液的第一部分流经第一上游血液导管进入人工肝处理装置F,并且待处理的血液的第二部分从第一上游血液导管在第二入口点(B)进入第二上游血液导管并进入血细胞分离器D;
血细胞分离器D将待处理的血液的第二部分进行分离处理得到经分离的第二分离血液,将第二分离血液经第二下游血液导管在第二出口点与待处理的血液的第一部分合并得到合并的血液,合并的血液进入人工肝处理装置F,
人工肝处理装置F将合并的血液进行分离处理得到第一分离血液。
在一些示例中,所述方法还包括:通过所述抗凝剂注入导管向第二上游血液导管中的待处理的血液的第二部分中添加抗凝剂。
在一些示例中,所述方法还包括:通过所述血浆注入导管向第一下游血液导管中的第一分离血液中添加血浆。
在一些示例中,在所述方法中,所述血细胞分离器配置为能够分离来自第二上游血液导管的血液(待处理的血液的第二部分)中的干细胞得到第二分离血液,并使第二分离血液进入第二下游血液导管。
在一些示例中,所述血浆分离器配置为能够分离来自第一上游血液导管的血液中的血浆,得到第一分离血液,并使第一分离血液进入第一下游血液导管。
在一些示例中,所述方法还包括:调节所述第二流量调节计P2和第一 流量调节计P1中的至少一个,从而使得第二血液循环中的流量和第一血液循环中的流量满足外循环血液流速的要求。
在一些示例中,所述方法还包括预先对所述装置(包括整个管道)采用肝素盐水进行管路预冲洗。在所述装置的运行过程中,仅在第一上游血液导管添加抗凝剂就可以实现整体循环的肝素化,整体肝素化的过程是通过人体循环达到的,在第二循环中不添加抗凝剂,从而可以减少抗凝剂(肝素)的用量。在本申请中,肝素化和抗凝化具有相同的含义,都是指向血液中添加抗凝剂如肝素从而达到使血液在体外处理的过程中不凝固的效果。
在一些示例中,所述方法还包括:通过所述血浆注入导管向第一下游血液导管中的第一分离血液中添加以下物质中的至少一种:新鲜血浆或置换液。因此,所述血浆注入导管也可以成为置换液注入导管。所述的置换液可以包括人血白蛋白。
在所述方法的一些示例中,所述血细胞分离器配置为能够分离来自第二上游血液导管的血液(待处理的血液的第二部分)中的干细胞得到第二分离血液,并使第二分离血液进入第二下游血液导管。
在所述方法的一些示例中,所述血浆分离器配置为能够分离来自第一上游血液导管的血液中的血浆,得到第一分离血液,并使第一分离血液进入第一下游血液导管。
在一些示例中,所述方法还包括:调节所述第二流量调节计P2和第一流量调节计P1中的至少一个,从而使得整个循环中流量和压力达到平衡。
在一些示例中,所述方法还包括:启动所述装置的步骤:首先使第二循环处于关闭状态(其可以通过例如关闭所述第二流量调节计P2,或者夹闭所述第二循环的管路与第一循环的管路连接处的出入口完成),然后启动第一循环,开始进行人工肝支持系统治疗,待血流动力学稳定后(例如P1保持在80ml/min以上时),启动第二循环(其可以通过例如开启所述第二流量调节计P2,或者取下所述第二循环的管路与第一循环的管路连接处的出入口处的夹子来完成),实现干细胞采集。
在一些示例中,所述方法还包括:停止所述装置的步骤:首先结束第二循环,夹闭第二循环入口,进入返回红细胞程序,待第二循环管路中红细胞返回后,夹闭第二循环出口,血细胞分离器关机,在此过程中第一循环继续进行;然后结束第一循环。
如图2所示,本申请还提供一种用于操作所述的血液处理装置的控制系统11,其特征在于,所述控制系统包括软件和硬件,所述控制系统配置为能够实现如上所述的方法。图2是示意图,并没有示出控制系统的具体部件。然而,本领域技术人员应该理解,根据本申请目前已经提供的信息,形成所述控制系统是本领域技术人员的常规技术手段。因此,任何能够实现所述方法的控制系统都在本申请的保护范围内。
本申请还提供一种用于操作所述的血液处理装置的控制系统,其特征在于,所述控制系统包括软件和硬件,所述控制系统配置为能够如下操作该血液处理装置:使待处理的血液的第一部分流经第一上游血液导管进入人工肝处理装置,并且待处理的血液的第二部分从第一上游血液导管在第二入口点进入第二上游血液导管并进入血细胞分离器;
血细胞分离器将待处理的血液的第二部分进行分离处理得到经分离的第二分离血液,将第二分离血液经第二下游血液导管在第二出口点与待处理的血液的第一部分合并得到合并的血液,合并的血液进入人工肝处理装置,
人工肝处理装置将合并的血液进行分离处理得到第一分离血液。
实施例
采用图1所示的装置,对10名患者进行了治疗。结果如下表所示。
上表中,
“采集单个核细胞数(/L)”是指外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)即外周血中具有单个核的细胞的浓度,包括淋巴细胞、单核细胞和以CD34+分子标记为特征的外周血造血干细胞。
“CD34+细胞数(/L)”是指CD34是造血干细胞表面的标志物,CD34+细胞数指造血干细胞的浓度.
“理论所需治疗时间(h)”是指:传统治疗分别进行人工肝和干细胞采集所需治疗时间的总和。
“实际治疗花费时间(h)”是指:采用本实例进行人工肝和干细胞采集一共需要的实际时间。
经过对患者的生化指标的测量表明,采用本公开的血液处理装置对患者进行治疗与采用传统的两步分别进行治疗的方法相比,治疗效果没有明显差异,然而却缩短了治疗时间,减轻了患者的痛苦。
以上所述仅是本公开的示范性实施方式,而非用于限制本公开的保护范围,本公开的保护范围由所附的权利要求确定。
- 还没有人留言评论。精彩留言会获得点赞!