组织内假体及其生产方法与流程
本发明涉及一种组织内假体以及生产该内假体的方法。
背景技术:
本发明所涉及的组织内假体可例如为血管内假体或心脏瓣膜假体,尤其是主动脉瓣假体、二尖瓣假体或三尖瓣假体。
从文献wo03/007781(pct/us02/20037)中已知了一种血管组织内假体,该血管组织内假体包括可膨胀的中空支撑结构以及生物组织的内部组织结构,其中,该中空支撑结构具有包括开口的表面,所述内部组织结构覆盖所述支撑结构的内表面。
所述可膨胀的中空支撑结构通常被称为支架,具有形状记忆,以便于其能够以折叠的状态植入血管中,并且一旦处于所述血管的恰当位置便呈现其径向膨胀形状,并且由于其表面通常由诸如镍钛诺、钛等材料的网格状物(grillageàmailles)组成,所以该表面提供有开口。就内部组织结构而言,其例如由动物的腹膜、胸膜或心包的膜组成,其被卷起以在支撑结构处于其径向膨胀形式时,能够适用于该支撑结构的内表面的形状。因此,生物组织的内部结构必须具有至少一条接合线,使所述膜的两个相对边沿该接合线相连。
在该已知的血管内假体中,如此相连的两个相对边通过缝合彼此稳固,这一方面容易导致内假体中血液流动的紊乱并且从而形成凝块,且另一方面不能确保沿所述接合线的严格紧密性。在弥补这些不足的尝试中,该在先的文献中已经提出用生物胶层覆盖缝合的线。然而,单纯提供化学粘附的这些生物胶对内假体来说是外来物,其使生物组织变性,并且易于分解。结果是从覆盖缝合线的生物胶层脱落的生物胶颗粒可形成血液凝块,导致患者的栓塞。
此外,在该已知的内假体中,内部组织结构优选通过缝合而固定至所述支撑结构。不言而喻的是,如上文针对内部结构的缝合所进行的解释,这些额外的缝合同样可能导致血液凝块。因此,在该文献中另外提出,通过生物胶来将所述内部组织结构胶粘至支撑结构。然而,由于使用了这种生物胶,再一次发现了上述提及的栓塞的风险。
要注意的是,此外进行缝合的操作是复杂且冗长的,从而这些内假体的生产并不是非常有效的,而是具有许多的限制的。
此外,一旦内假体的支撑结构已经放置在血管中的膨胀位置,其立即于所述血管接触,径向向外压血管。这导致摩擦,从而容易损害所述血管的表面,并且可能导致所述处于膨胀状态的血管内假体在所述血管中的移位。
此外,从文献us5411552和ep0850607a1已知一种心脏瓣膜假体,该心脏瓣膜假体包括可膨胀的外部支撑结构以及内部组织结构,该可膨胀的外部支撑结构具有包括开口的表面,所述内部组织结构至少部分地覆盖所述支撑结构的内表面。在这些已知的瓣膜假体中,与上文所述的类似,内部组织结构通过胶合或通过产生缝线来固定至外部支撑结构。因此,它们具有上文提及的所有缺点。
技术实现要素:
本发明的目的是通过发现完全紧密且强化的组织内假体来解决所有这些缺点,所述组织内假体在植入后不易损害患者的组织细胞并且不包括任何的缝合或生物胶。
为此,根据本发明,所述组织内假体包括:
可膨胀的中空支撑结构(支架),所述可膨胀的中空支撑结构具有包括开口的表面;以及
内部组织结构,所述内部组织结构至少部分地覆盖所述支撑结构的内表面;
不同寻常的是,所述组织内假体包括外覆层,所述外覆层由血液相容性的柔性合成材料组成,并且机械地锚定至所述内部组织结构,所述支撑结构至少部分地被保持在所述外覆层与所述内部组织结构之间。
优选地,这种机械地锚定归因于所述外覆层的血液相容性的柔性合成材料至少部分地浸渍所述内部组织结构这一事实。
因此,在根据本发明的组织内假体中,所述外覆层发挥了多种功能,其中该外覆层由纯的或负载的(夹杂物(inclusion)、活性物质等)柔性合成材料制成,有利地由弹性体,优选聚氨酯弹性体或硅酮弹性体制成,而由于其柔性不会阻碍所述可膨胀的支撑结构(支架)从其折叠植入位置膨胀至其膨胀植入位置。事实上,所述外覆层:
通过所述支撑结构的表面中的开口能到达所述内部组织结构,由于外覆层的柔性合成材料浸渍内部结构来通过机械地固定与内部结构结合,所述结合保持所述支撑结构并将其稳固到外覆层和内部结构,从而与产生单纯化学粘附的生物胶相比,能够获得非常好的机械粘附;
通过粘附至面向接合线的边缘,覆盖由膜的内覆层成型导致的接合线并且因此保证了接合线的紧密性;以及
形成柔性外部加强件,对于根据本发明的内假体,该柔性外部加强件在植入之后保护患者的天然壁免受导致磨损的摩擦。
有利地,所述外覆层的厚度为至少0.1mm且可达5mm。可选地,厚度可为不均匀的并且可在所述外覆层的一个位置至另一位置间变动。
所述内部组织结构可由动物源的生物组织(例如心包)组成,或者由合成材料(例如聚四氟乙烯)组成。
根据本发明,所述组织内假体有利地通过进行以下方法来生产,所述方法非比寻常的在于:
将所述内部组织结构引入到所述支撑结构,从而在无折叠或不过厚的情况下,以连续且均匀的方式覆盖所述支撑结构的内表面的至少一部分;
通过将血液相容性的柔性合成材料分散在溶剂中,覆盖所述内部组织结构的外表面的多个部分和所述支撑结构的表面,以形成所述血液相容性的柔性合成材料的外覆层,通过所述支撑结构的表面中的开口能到达所述外表面的多个部分,所述外覆层机械地锚定至所述内部组织结构;以及
从所述外覆层中取出所述溶剂。
在由化学固定的生物组织所形成所述内部组织结构的情况下,使内部组织结构在化学固定之后且在引入至所述支撑结构之前,经受部分脱水;以及随后在从所述外覆层取出所述溶剂期间或之后,经受再水化。
有利地,所述合成材料在分散液中的浓度为10wt%至30wt%,优选20wt%至22wt%。所述分散液的粘度有利地为500cp至1000cp。
附图说明
所附附图中的图示对如何进行本发明进行了解释。在图中,相同的附图标记表示相似的元件。
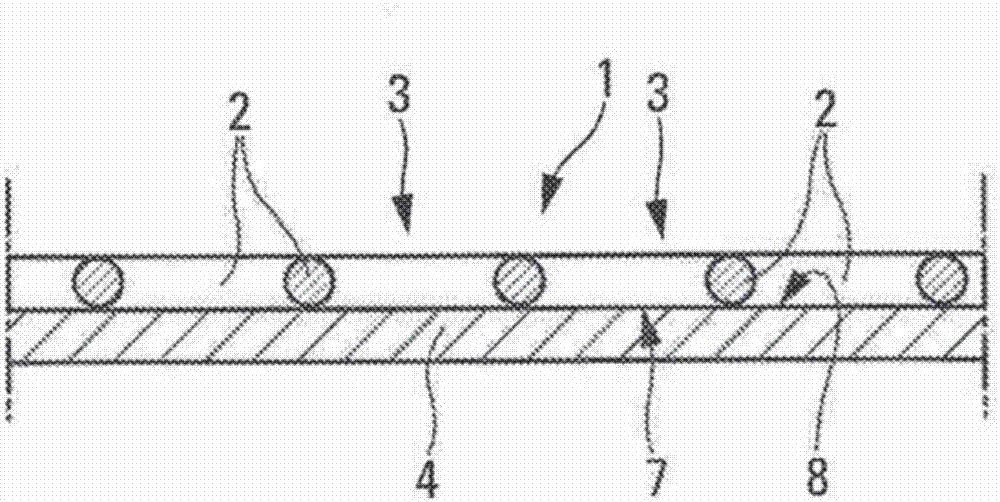
图1示意性且部分地示出了在内部组织结构装配至可膨胀的支撑结构期间,内假体的一部分。
图2为在支撑结构/内部组织结构组件组装后,这些元件的壁沿图1的线ii-ii的部分纵向截面。
图3对应于图2,并且示出了根据本发明在所述支撑结构/内部组织结构组件上产生的外覆层。
具体实施方式
图1示出了在展开位置处,诸如血管内假体或心脏瓣膜内假体的组织内假体的一部分,所述组织内假体包括:
支撑结构1(支架),所述支撑结构由具有形状记忆的合金(钢、镍钛诺、金属、聚合物等)的丝的网状物2组成,该网状物的网格3形成所述支撑结构表面中的开口,其可能在结构上沿纵向轴线或横向轴线是对称的或者是不对称的;以及
内部组织结构4,例如,切割自生物组织的膜(未示出)并且使相对边缘5a和5b沿接合线6相交地卷起,可能的是,生物组织为动物来源(猪、马、牛等)或通过人类细胞的组织培养来产生。利用动物心包已经获得了良好的结果。然而,内部组织结构4可由合成材料(诸如膨体聚四氟乙烯)组成。
在图1中,示意性地示出了将展开状态的内部结构4根据箭头f轴向引入到处于膨胀状态的可膨胀的支撑结构(支架)1中。如图2中示意性示出的,当内部结构4处于支撑结构1的恰当位置时,其至少部分地覆盖所述支撑结构1的内表面7,也就是说,通过所述支撑结构1的网格3所形成开口仍然能从外面到达由所述线2、所述内部结构4的外表面8所形成的表面。
根据本发明的组织内假体的生产包括多个步骤:
1.例如通过卷绕在芯轴上,使所述内部结构4首先成型为在支撑结构1自身膨胀时(图1)所必须具有的膨胀形式;
2.在所述内部组织结构由生物组织(优选动物心包)形成的情况下,该生物组织以已知的方式通过任何合适的产品(诸如醛)来化学固定。在由醛进行固定的情况下,优选使用戊二醛(例如使用浓度为0.625%的戊二醛)。这种化学固定确保了生物组织具有降低的抗原性,化学、生物和物理稳定性,并且特别是耐温度波动性和机械应力波动性。
3a.随后,冷冻干燥所述内部结构4的生物组织。该处理的目的一方面是为了使组织脱水,这是为了粘附所必须的,而且还为了在脱水后保留所述生物组织的三维结构。当生物组织在常规条件下脱水时,组成其的胶原纤维彼此接触并且形成不可逆的化学键,从而导致不能进行生物组织的后续再水化。为了避免该缺点,冷冻干燥使得能够通过冷冻来固定生物组织的结构,并且随后在极低压下通过升华去除水,因此不会导致纤维的移动以及由此纤维重排。对于控制冷冻干燥至关重要的两个参数是动力学和脱水:
动力学必须非常慢—例如2℃/小时至8℃/小时—以避免任何过冷的风险(导致局部再水化的水的融化);
脱水率必须至少75%,优选约78%至80%。脱水率过低将引起生物组织的一定程度的再水化,并且因此引起纤维的一定程度的移动,从而将导致在储存阶段后(甚至短时间内)柔性的丧失和糟糕的再水化。反过来,过度脱水将使生物材料变性并且导致相当大的皱缩。生物材料事实上包括结合水(在心包的情况下,10%的干物质和10%结合水),该结合水是其必要组成部分,并且必须不能去除。
为了甚至进一步在冷冻干燥期间改善组织结构的保守性,首先用二醇(有利地聚乙二醇)处理生物组织数天,然后再进行冷冻干燥。聚乙二醇与各种胶原纤维将产生低能量键,并因此其自身将置于纤维之间,如梯子的梯级。在冷冻干燥期间,各种纤维因此不能彼此相互作用。然而,因为这些键是低能量键,聚乙二醇尽管是完全生物相容的(根据欧洲药典,对于某些分子量),在再水化过程中仍然很容易冲洗掉;
3b.在变型中,冷冻干燥能够由将所述内覆层4浸没在聚乙二醇的醇溶液(例如具有至少80%聚乙二醇和10%乙醇的浓度)中以缓慢地进行化学脱水来代替。然后在低压和稳定的温度(例如40℃)下进行至少12小时的脱水。
4.因此,通过步骤3a或步骤3b的脱水,获得干的生物组织的内部组织结构4,其可完全再水化而不改变所述生物组织并且几乎没有表面皱缩。如图1所示意性示出的,随后例如通过使该内部组织结构卷绕在所述芯轴(未示出)上,使该内部组织结构4引入到支撑结构1中。然后针对所述支撑结构1,使其平坦化(通过任何已知的方式,诸如可膨胀的气球,可膨胀的芯轴等,未示出),以在无折叠或不过厚的情况下形成连续且均匀的覆盖,其中边缘5a和5b恰好相互接触而形成连续且均匀的接合线6,而不会重叠或间隙。如图2所示,在这种情况下,随后使展开状态的内部组织结构4的外表面8完美地施加到同样处于膨胀状态的支撑结构1的内表面7,仍然能从外部通过网格3来到达外表面8。
5.然后在步骤4中得到的支撑结构1/内部组织结构4组件的上方形成外覆层10,该外覆层支持该支撑结构1,使该支撑结构稳固到内部组织结构4(由于通过所述支撑结构1的网格3覆盖内部组织结构4的外表面8)并且此外密封接合线6。该外覆层10通过在其上沉积由柔性且生物相容性的合成材料分散在溶剂中所形成的粘合剂来形成。该柔性合成材料可为可植入的生物相容性聚氨酯弹性体,而溶剂可为二甲基乙酰胺。
在变型中,分散液的柔性合成材料可为硅酮弹性体,例如可植入的生物相容性聚二甲基硅氧烷,而溶剂则可为二甲苯。
合成材料在所述分散液中的重量浓度有利地为10%至30%,优选为20%至22%。根据内部结构4的生物组织的性质并根据沉积模式,将分散液的粘度调节为500cp至1000cp。
通过任何已知的方法,例如涂布、浸没、浇注或雾化,由所述分散液开始,根据所需的表面条件和分散液的粘度可形成外覆层10。
优选地,外覆层10通过叠加多个连续的层直到获得所需的厚度e,例如在0.1mm至5mm的厚度来生产。
外覆层10的外表面11是连续的,并且优选地具有能够引起轻微纤维化的微孔,以强化与植入有内假体的患者的天然壁的机械结合。该外部微孔可通过使含水溶性夹杂物的低粘度分散液雾化来获得。必须控制夹杂物的粒径以便控制微孔的孔径。
外覆层10的外表面11可以可选地包括能够改善植入的内假体的机械支持的一个或多个外部凸起。然而,在这种情况下,必须确保凸起不会诱导患者天然壁的细胞侵蚀。
6.在形成外覆层10之后,例如通过升高的温度下的干燥、升高的温度下的真空干燥和/或在生理盐水中(dusérumphysiologique)进行升高温度下的取出来去除该分散液的溶剂。优选地,通过在升高的温度(例如在约40℃的温度下)缓慢取出来去除溶剂,然后在真空下进行取出,并且通过在生理盐水中进行取出而完成。
最后,在取出溶剂阶段期间或之后,用生理盐水使内覆层4再水化。
外覆层10的外表面11可以可选地用促进细胞粘附的肽、蛋白或分子,以及血清蛋白进行化学接枝。该外表面可额外地涂覆有润湿剂或与生物相容性润滑剂,从而有利于内假体在装载植入导管期间的滑动或用于定位内假体的移位。
尽管附图中未示出,但是可将至少一种能由医学成像定位的标记物设置在根据本发明的内假体中,以便于其植入。
如上所提及的,根据本发明的内假体可以构成所有类型的假体,包括心脏瓣膜假体,主要是主动脉假体、二尖瓣假体和三尖瓣假体。
已知的经导管瓣膜的缺点是可能的植入后瓣周渗漏,其不利于医学预后。特别对于主动脉瓣,由于主动脉环经常发生不均匀的钙化,所以瓣膜和环之间可能留有空间。为了弥补该缺点,根据本发明的瓣膜的外覆层10可具有优化的厚度和柔性,以便自发地适应天然组织或外周钙化的轮廓。
此外,根据本发明的瓣膜的周长上的不同厚度或其纵向轴线上的不同厚度可以允许将人工瓣膜更好地调整到每个患者或患者子组的解剖结构。
根据本发明的人工瓣膜的外覆层10的厚度e和组成可以是不均匀的,并且在所述人工瓣膜的不同位置处变化。
- 还没有人留言评论。精彩留言会获得点赞!