MU类鸦片受体拮抗剂与类鸦片药剂的组合剂型的制作方法
本发明涉及一种外周mu类鸦片受体拮抗剂的固体组合物及所述mu类鸦片受体拮抗剂组合物与类鸦片镇痛剂的组合。具体来说,本发明涉及一种单位剂型,其中所述mu类鸦片受体拮抗剂呈实时释放形式,且所述类鸦片镇痛剂可呈缓释释放、持续释放、调节释放、或控制释放形式,以及涉及制备此单位剂型的方法。
背景技术:
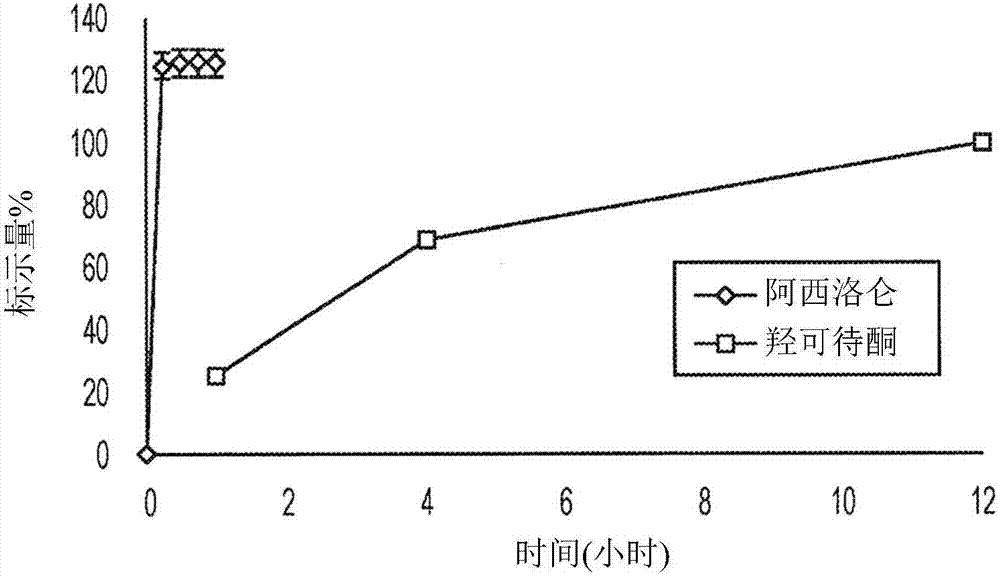
:作为类鸦片受体的促效剂起效的化合物(其中常见实例为羟可待酮(oxycodone)、氢可酮、吗啡、及羟吗啡酮(oxymorphone))是用于治疗中度到重度疼痛的镇痛疗法的支柱。应明白,类鸦片镇痛剂主要通过激发大脑和中枢神经系统中的mu类鸦片受体来发挥其有利效果。然而,类鸦片受体全身表现,既在中枢神经系统中也在包含胃肠(gi)道的外周区域中。不幸地,使用类鸦片镇痛剂可由激发这些外周受体引起有害副作用。具体来说,接受类鸦片镇痛剂用于短期或长期疼痛管理的患者经常经历一系列有害胃肠症状,具体来说类鸦片诱导便秘(oic)。包括便秘、胃排空延迟、腹部不适、及恶心在内,oic可使人极度衰弱且难以忍受。胃肠症状可严重到足以严重损及某些患者的疼痛管理。无法轻易穿过血脑屏障的外周作用类鸦片拮抗剂化合物已显示利于抵消类鸦片诱导便秘。具体来说,阿西洛仑(axelopran)3-((1r,3r,5s)-8-(2-((环己基甲基)((2s)-2,3-二羟基丙酰基)胺基)乙基)-8-氮杂双环[3.2.1]辛烷-3-基)苯甲酰胺,(美国专利第7,622,508和7,943,772号)已在临床上证实可减轻处于稳定类鸦片疗法的非癌症疼痛患者的oic症状而未损及镇痛作用。(维克瑞(vickery)等人<疼痛周报(painweek)>2012,拉斯维加斯,nv(p-87)。服用类鸦片镇痛剂来进行疼痛管理的患者可发现也可服用外周类鸦片拮抗剂来控制其疼痛药剂的有害副作用。这些可能遭受多种严重症状的患者也常常开有额外的药并因此为管理复杂的医药疗法所累。因此,期望合并多种药于组合剂型中以便易于投药及改善治疗依从性。具体来说,使用外周类鸦片拮抗剂(例如阿西洛仑)及类鸦片促效剂的组合可在发展oic之前解决oic问题。根据临床需要,类鸦片镇痛剂可口服、经皮及肠胃外途径投药来实现慢性或急性用途,其中一般优选为口服。虽然实时释放类鸦片提供有效疼痛管理(尤其对于急性以及突破性疼痛),但控制释放或缓释释放类鸦片已证实显著临床价值。然而,外周类鸦片拮抗剂的预防效果一般通过拮抗剂的实时释放实现。将期望提供结合实时释放型外周类鸦片与可为实时释放或调节释放(控制释放或缓释释放或持续释放)剂型的类鸦片镇痛剂的剂型。然而,当组合外周类鸦片与类鸦片镇痛剂时,可产生若干技术问题。第一,外周类鸦片拮抗剂在剂型存储期间必须足够稳定。例如,已知阿西洛仑因其非晶型的氧化而降解。另外,外周类鸦片拮抗剂应不会显著影响外周镇痛剂的释放曲线或其他性质。技术实现要素:本发明提供一种包括实时释放型外周mu类鸦片受体(例如阿西洛仑)及以实时释放型或调节释放型存在的固体剂型类鸦片镇痛剂的组合剂型。一方面,本发明涉及一种包括呈实时释放调配物形式的阿西洛仑的药物外包衣调配物以及一种制备此药物外包衣类鸦片组合产品的方法。已知呈结晶型硫酸盐形式的阿西洛仑具有稳定性,而已知非晶型阿西洛仑不够稳定而无法用于药品。通过发现在最初可形成非晶型阿西洛仑的任何药品制备工艺期间或之后将非晶型阿西洛仑转化成结晶型阿西洛仑的关键要求而使本发明的创作成为可能。具体来说,通过正确选择赋形剂以及赋形剂与阿西洛仑的相对比例以及任选地进一步通过控制工艺条件,可以制备具有所需物理性质的包括呈结晶型阿西洛仑硫酸盐的固体组合物。一方面,因此,本发明提供包括阿西洛仑硫酸盐和膜形成聚合物的固体组合物。一方面,所述膜形成聚合物为聚乙烯醇。一方面,所述固体组合物进一步包括增塑剂和任选地抗氧化剂。一方面,所述增塑剂为聚乙二醇3350以及所述抗氧化剂为抗坏血酸。一方面,所述固体组合物包括:(a)介于约50重量%与约95重量%之间的阿西洛仑硫酸盐,(b)介于约5重量%与约50重量%之间的聚乙烯醇,(c)介于约0%与约45%之间的聚乙二醇3350,及(d)介于约0%与约10%之间的抗坏血酸。一方面,本发明的固体组合物包括呈结晶型阿西洛仑硫酸盐。一方面,所述包括结晶型阿西洛仑硫酸盐的固体组合物在加速条件下存储时可稳定约3个月。所述固体组合物可以形成固体微球或者可以作为膜或包衣用于惰性固体片剂上或固体剂型上。提供可将非晶型阿西洛仑控制地转化成稳定结晶型的调配物的能力对于开发稳定组合产品具有广泛的实用性。为提供调节释放(以及遏制滥用)特性的大量研究工作得到商业类鸦片产品以及处于发展中的彼等。本方法允许将阿西洛仑与当前市面上或处于开发中的广泛类鸦片产品组合而不显著影响类鸦片镇痛剂的释放曲线或遏制滥用性质。一方面,所述组合剂型在类鸦片镇痛剂剂型上包括阿西洛仑或其医药可接受的盐作为活性包衣层(等同于称为药物外包衣层)。一方面,所述活性包衣层包括本发明的固体组合物。因此,一方面,所述活性包衣层包括阿西洛仑硫酸盐及膜形成聚合物。另一方面,所述活性包衣层包括阿西洛仑硫酸盐、膜形成聚合物、增塑剂、及任选抗氧化剂。另一方面,所述活性包衣层包括结晶型阿西洛仑硫酸盐。任选地,所述组合剂型在所述活性包衣层与所述类鸦片剂型之间进一步包括底衣层。一方面,本发明剂型提供组合产品的优点,其能够实时释放外周mu类鸦片受体拮抗剂,而不影响来自调节(控制或缓释或持续)释放剂型的类鸦片镇痛剂的药剂释放特性,且另外不影响各药剂组分的药物动力学特性。阿西洛仑已显示出以低剂量有效缓解类鸦片诱导便秘的症状。一方面,本发明提供包括介于约2mg与约30mg之间的实时释放调配物形式的阿西洛仑及呈调节释放形式的类鸦片镇痛剂的组合剂型。一方面,所述类鸦片镇痛剂型包括羟可待酮盐酸盐或羟吗啡酮盐酸盐。一方面,本发明提供一种治疗哺乳动物疼痛的方法,所述方法包括给予哺乳动物包括外涂布在类鸦片镇痛剂上的外周mu类鸦片受体拮抗剂的组合剂型。一方面,组合剂型中的外周mu类鸦片受体拮抗剂为阿西洛仑或其医药可接受的盐。另一方面,组合剂型中的外周mu类鸦片受体拮抗剂为阿西洛仑硫酸盐。一方面,本发明提供一种缓解类鸦片疗法的胃肠副作用的方法,所述方法包括给予阿西洛仑或其医药可接受的盐与类鸦片镇痛剂的组合剂型。另一方面,本发明提供一种形成本发明的组合剂型的方法,所述方法包括提供呈固体剂型的类鸦片镇痛剂及用包括阿西洛仑或其医药可接受的盐的包衣层涂布所述固体剂型。附图说明图1a和图1b分别显示阿西洛仑药物外包衣调配物a及阿西洛仑药物外包衣调配物b的溶解药剂(阿西洛仑及羟可待酮盐酸盐)占阿西洛仑(10mg标示量)及羟可待酮盐酸盐控制释放片剂(20mg标示量)的组合剂型的百分比的时间函数。图2a和图2b分别显示阿西洛仑药物外包衣调配物a及阿西洛仑药物外包衣调配物b的溶解药剂(阿西洛仑及羟吗啡酮盐酸盐)占阿西洛仑(10mg标示量)及羟吗啡酮盐酸盐缓释释放片剂(10mg标示量)的组合剂型的百分比的时间函数。图3a和图3b分别显示来自小猎犬的单次剂量药物动力学研究的羟可待酮盐酸盐及阿西洛仑平均血浆浓度±标准偏差(ng/ml)的时间函数,所述小猎犬被投药阿西洛仑及羟可待酮盐酸盐的组合剂型、共投药作为单独片剂的两种组分、及单独投药所述组分。图4a和图4b分别显示来自小猎犬的单次剂量药物动力学研究的羟吗啡酮盐酸盐及阿西洛仑平均血浆浓度±标准偏差(ng/ml)的时间函数,所述小猎犬被投药阿西洛仑及羟吗啡酮盐酸盐的组合剂型、共投药作为单独片剂的两种组分、及单独投药所述组分。图5显示来自健康人类个体的单次剂量药物动力学研究的平均羟可待酮血浆浓度±标准偏差(ng/ml)的时间函数,所述健康人类个体被投药阿西洛仑及羟可待酮盐酸盐的组合剂型、共投药作为单独片剂的两种组分及单独投药所述组分。图6显示来自健康人类个体的单次剂量药物动力学研究的平均阿西洛仑血浆浓度±标准偏差(ng/ml)的时间函数,所述健康人类个体被投药阿西洛仑及羟可待酮盐酸盐的组合剂型、共-给药作为单一片剂的两种组分及单独投药所述组分。图7显示阿西洛仑硫酸盐(10mg标示量)及羟可待酮盐酸盐控制释放片剂(20mg标示量)调配物a组合剂型的粉末x射线衍射图案,其使用brukerd8-高级x射线衍射仪用带有45kv的输出电压及40ma电流的cu-kα放射获得。图8显示阿西洛仑硫酸盐及聚乙烯醇的4:1重量/重量比的喷涂膜在经历25℃的70%相对湿度的重量变化。具体实施方式定义如本文中所用,术语‘固体剂型’意为呈固体形式的用于经口给予给患者的医药调配物。所述术语包括丸剂、片剂、微球、微球胶囊、微粒、及胶囊。具体来说,如本文中所用的术语微球包括微球胶囊、微粒等。如本文中所用,术语‘调节释放’形式意为改变活性原料药的释放时间和/或释放速率的药品的调配物。术语‘调节释放’形式包括多样地描述为控制释放、持续释放、缓释释放、及长效的形式。如本文中所用,术语‘实时释放’形式意为经设计在口服后立刻释放活性药剂的调配物。在实时释放调配物中,未尝试改变药剂释放速率。根据本发明,提供一种组合剂型,其包含外周mu类鸦片受体拮抗剂(例如阿西洛仑或其医药可接受的盐)及类鸦片镇痛剂。所述类鸦片镇痛剂可以调节释放医药调配物的形式存在,其经设计以影响在投药给患者后所述药剂的释放速率,如本文所定义。所述类鸦片镇痛剂型也可包含滥用遏制性。适合含于本发明内的类鸦片镇痛剂包含羟可待酮、氢可酮、吗啡、羟吗啡酮、及氢吗啡酮。这些药剂的多种控制释放或缓释释放调配物可作为商业产品获得或处于早期或晚期发展中。此类药剂的实例包含(但不限于):羟可待酮:(羟可待酮盐酸盐,控制释放,普渡制药公司(purduepharma))、oxycodonedeterxtm(羟可待酮,缓释释放,collegiumpharma)、egalet-002(羟可待酮,缓释释放,尹格莱特公司(egaletcorporation)),氢可酮:hysinglatmer(氢可酮酒石酸氢盐,缓释释放,普渡制药公司)、zohydrotmer(氢可酮酒石酸氢盐,缓释释放,zogenix,inc.)、vantrelatm(氢可酮酒石酸氢盐,缓释释放,梯瓦制药工业有限公司(tevapharmaceuticalindustries,ltd))吗啡:egalet-001(尹格莱特公司)、er吗啡(inspiriondeliverytechnologies)、ms(普渡制药公司)羟吗啡酮:er(羟吗啡酮盐酸盐,缓释释放,远藤制药公司(endopharmaceuticals))、col-172(collegiumpharma)氢吗啡酮:(氢吗啡酮盐酸盐,缓释释放,马林克罗制药公司(mallinckrodtpharmaceuticals))额外实例包含还合并非类鸦片镇痛剂的产品,具体来说为乙酰胺酚。此类组合的实例包含(但不限于):xartemistmxr(羟可待酮盐酸盐及乙酰胺酚(acetaminophen),缓释释放,马林克罗制药公司)mnk-155(氢可酮酒石酸氢盐及乙酰胺酚,控制释放,马林克罗制药公司)如美国专利第7,943,772号中所述,阿西洛仑硫酸盐形成稳定结晶型,而非晶型阿西洛仑对于用于药品而言不够稳定。如其中所描述,通过具有两个或多个在选自以下的2θ值的衍射峰的粉末x射线粉末衍射(pxrd)图案表征结晶型:6.58±0.20、7.52±0.20、9.35±0.20、14.69±0.20、16.01±0.20、17.45±0.20、17.99±0.20、18.62±0.20、19.76±0.20、21.11±0.20、22.07±0.20、23.18±0.20、23.74±0.20、24.56±0.20、25.63±0.20、26.45±0.20、27.86±0.20、28.31±0.20、29.54±0.20、30.59±0.20、31.58±0.20、33.89±0.20及36.02±0.20。具体来说,已经证实阿西洛仑硫酸盐结晶型在加速条件下的稳定性。因此,希望任何药品包括结晶型阿西洛仑。包含阿西洛仑的稳定组合药剂的提供可以通过本发明人对非晶型阿西洛仑在最初可形成非晶型阿西洛仑的任何工艺期间或之后转化成结晶型阿西洛仑的关键要求的发现来实现。发现包衣溶液中赋形剂的选择为一种因素。如下文实例10中所示,常规包衣聚合物不形成在加速条件下测试时足够稳定的膜。所述实例还显示阿西洛仑与赋形剂的比例是另一关键因素。本发明人已经进一步证实高水分含量促进结晶,如实例11和图8中所显示。使阿西洛仑硫酸盐及聚乙烯醇的4:1重量/重量比的喷涂膜在25℃下经历70%相对湿度48小时。在前两个小时内的重量增加可以归因于非晶型阿西洛仑硫酸盐对水分的吸收。在后续时间内的重量损失可以归因于阿西洛仑硫酸盐的结晶,其释放非晶型所吸收的水分。已鉴定氧化为非晶型阿西洛仑的主要降解途径。因此,在自化合物为非晶型的溶液制备包括结晶型阿西洛仑的层的任何工艺中,在结晶发生前控制氧化为有用的。虽然发现高水分含量促进结晶,但同时,高水分含量促进氧化。因而,一种可行的选择为在喷涂工艺期间使用惰性气体(例如氮气或氩气)作为雾化气体以减少或消除氧化。另一选择为在调配物中使用抗氧化剂以在喷涂期间控制氧化。基于这些发现,促进阿西洛仑结晶的固体组合物包括阿西洛仑硫酸盐和膜形成聚合物。另一方面,所述固体组合物包括阿西洛仑硫酸盐、增塑剂及任选抗氧化剂。所述固体组合物可以从水溶液或水与具有低碳数醇的组合(例如多达约40%甲醇或乙醇的水溶液)来制备,但优选从以水性为主的溶液来制备。所属
技术领域:
中已知的膜形成聚合物的实例包含但不限于聚乙烯醇、羟丙基甲基纤维素、乙基纤维素、羟丙基纤维素、羟乙基纤维素、共聚维酮、及其组合。然而,如下所举例,已证实并非所有膜形成聚合物均与促进阿西洛仑结晶和/或化学稳定性同等相容。在一具体方面,所述膜形成聚合物为聚乙烯醇。所属
技术领域:
中已知的亲水性增塑剂包含(但不限于)聚乙二醇、甘油、聚乙二醇单甲基醚、丙二醇、醋酸甘油、及山梨醇脱水山梨糖醇溶液。已进一步证实,选择增塑剂也是重要的。聚乙二醇3350在本调配物中尤其有用。聚乙二醇为具有3350平均分子量的乙二醇聚合物。抗氧化剂包含(但不限于)抗坏血酸、没食子酸丙酯、亚硫酸钠、偏亚硫酸氢钠、亚硫酸氢钠、硫甘油、巯基乙酸、丁基化羟基甲苯、丁基羟基苯甲醚、及其组合。优选的抗氧化剂为抗坏血酸。在促进结晶的固体组合物中,阿西洛仑以介于约50重量%到约95重量%,包含约50重量%到约85重量%及约50重量%到约70重量%之间的量存在。所述膜形成聚合物(例如聚乙烯醇)以约5重量%与约50重量%之间,包含约10重量%与约50重量%之间及约10重量%与约35重量%之间及约12重量%与约25重量%之间的量存在。所述增塑剂(例如聚乙二醇3350)以约0重量%与约45重量%之间,包含约5重量%与约30重量%之间及约12重量%与约25重量%之间的量存在。所述任选抗氧化剂(例如抗坏血酸)以约0重量%与约10重量%之间,包含约0.5重量%与约10重量%之间及约2重量%与约6重量%之间的量存在。因此,一方面,本发明提供固体组合物,其包括:(a)介于约50重量%与约95重量%之间的阿西洛仑硫酸盐,(b)介于约5重量%与约50重量%之间的聚乙烯醇,(c)介于约0%与约45%之间的聚乙二醇3350,及(d)介于约0%与约10%之间的抗坏血酸。另一方面,本发明提供固体组合物,其包括:(a)介于约50重量%与约70重量%之间的阿西洛仑硫酸盐,(b)介于约10重量%与约50重量%之间的聚乙烯醇,(c)介于约5%与约30%之间的聚乙二醇3350,及(d)介于约0.5%与约10%之间的抗坏血酸。又另一方面,所述固体组合物包括:(a)介于约50重量%与约70重量%之间的阿西洛仑硫酸盐,(b)介于约12重量%与约25重量%之间的聚乙烯醇,(c)介于约12%与约25%之间的聚乙二醇3350,及(d)介于约2%与约6%之间的抗坏血酸。如上所述,本发明固体组合物可以从水溶液或悬浮液(具体来说包括阿西洛仑硫酸盐、聚乙烯醇、任选聚乙二醇3350及任选抗坏血酸的溶液或悬浮液)加以制备。通常,所述固体组合物是从水溶液加以制备。在水溶液中,阿西洛仑、聚乙烯醇、任选聚乙二醇3350及任选抗坏血酸通常以与在所述固体组合物中相同的比例存在。所述固体组合物的组分(也就是说所述溶液的非水性组分,统称为‘固体含量’)可以包括介于水溶液的约1%与约50%之间,通常介于约5%与约15%之间,例如约10%,剩余部分通常为纯水。另一方面,因此,本发明提供一种包括介于约5%与约15%固体含量之间的水溶液,其中所述固体含量包括呈上述固体组合物的比例的阿西洛仑硫酸盐、聚乙烯醇、任选聚乙二醇3350及任选抗坏血酸。所述固体组合物可以构成组合剂型的一层(也就是说活性包衣层)或可以在惰性固体片剂上形成包衣以提供阿西洛仑作为单药疗法。或者,所述固体组合物可以制备成固体微球胶囊,其例如可以与不同药剂的微球胶囊组合于组合剂型中。一方面,本发明提供一种组合剂型,其在类鸦片镇痛剂型上包括本发明固体组合物作为活性包衣层(同样称为药物外包衣层)。一方面,所述组合剂型包括结晶阿西洛仑硫酸盐。一方面,包括结晶阿西洛仑硫酸盐的药物外包衣层进一步包括膜形成聚合物和增塑剂。包括阿西洛仑的活性包衣层经设计以呈实时释放模式释放药剂。另一方面,本发明提供一种组合剂型,其包括类鸦片镇痛固体剂型和药物外包衣层,其包括:(a)介于约50重量%与约70重量%之间的阿西洛仑硫酸盐,(b)介于约10重量%与约50重量%之间的聚乙烯醇,(c)介于约5%与约30%之间的聚乙二醇3350,及(d)介于约0.5%与约10%之间的抗坏血酸。又另一方面,所述药物外包衣层包括:(a)介于约50重量%与约70重量%之间的阿西洛仑硫酸盐,(b)介于约12重量%与约25重量%之间的聚乙烯醇,(c)介于约12%与约25%之间的聚乙二醇3350,及(d)介于约2%与约6%之间的抗坏血酸。如以下实例所述,尤其有用的活性药剂包衣层包括约68重量%阿西洛仑硫酸盐、约14重量%聚乙烯醇、约14重量%聚乙二醇3350、及约4重量%抗坏血酸,其相当于阿西洛仑游离碱当量:聚乙烯醇:聚乙二醇3350:抗坏血酸的比为12:3:3:1。任选地,所述组合剂型另外在所述活性包衣层与所述类鸦片剂型之间包括底衣层。宜在底衣层中使用与所述活性包衣中相同的膜形成聚合物及增塑剂。一特定方面,本发明组合剂型包含包括聚乙烯醇及聚乙二醇3350的任选底衣层(例如聚乙烯醇比聚乙二醇3350的比率约为1:2)。所述活性包衣可以从上述如针对制备本发明固体组合物的水溶液的水性包衣溶液加以制备。用于施加任选底衣的包衣溶液包括介于约5%与约15%的底衣组分,也就是说聚乙烯醇及聚乙二醇3350,剩余部分为纯水。本发明组合剂型可通过涂覆本文所述的水性包衣溶液到任选有底衣的类鸦片片剂、丸剂、微球、微球胶囊、或胶囊来制备。制备活性包衣层及任选底衣层的工艺可利用盘式涂布机或流化床或沃斯特(wurster)涂布管柱。例如,如所附实例中所述,可使用盘式涂布机向类鸦片片剂上先后喷涂底衣包衣溶液及水性活性层包衣溶液。所述工艺通常以约40℃的排气温度进行。也已证实用流化床喷涂具有约500μm特征直径的微球。因此,一方面,本发明提供一种制备组合剂型的方法,所述方法包括(a)提供呈固体剂型的类鸦片镇痛剂,及(b)用包括阿西洛仑硫酸盐和聚乙烯醇的药物外包衣层涂布所述固体剂型。另一方面,制备组合剂型的方法包括:(a)提供呈固体剂型的类鸦片镇痛剂,及(b)涂覆包括阿西洛仑硫酸盐、聚乙烯醇、聚乙二醇3350、及任选抗坏血酸的水性包衣溶液。又另一方面,所述方法进一步包括在涂覆所述活性层包衣溶液之前涂覆包括聚乙烯醇及聚乙二醇3350的水性底衣包衣溶液到所述类鸦片固体剂型。已发现,使包括呈非晶型或呈结晶不完全形式的阿西洛仑硫酸盐的层经历高相对湿度(例如约70%与约86%之间的相对湿度,约20℃与45℃之间的温度)导致非晶型阿西洛仑硫酸盐转化为结晶型。具体来说,已经发现,使阿西洛仑后涂覆结晶的能力通过特别调配文中所揭示的固体层来增强。下文实例2、3和7所述的喷涂方法参数(其中于40℃或45℃喷涂水溶液)提供有利于形成结晶阿西洛仑硫酸盐的条件,如通过图7中所示的由示例喷涂工艺制备的组合剂型的粉末x射线衍射图案所证实。此外,由例如所述实例中所述的工艺制得的组合剂型已显示存储时的稳定性。在处于40℃及75%相对湿度的加速条件三个月后,在阿西洛仑硫酸盐及羟可待酮盐酸盐的组合剂型中未观察到阿西洛仑含量及杂质概况、以及溶解曲线的显著变化,表明所述组合剂型具有良好稳定性,此进一步认为是结晶性的证据。阿西洛仑已显示出以低剂量有效缓解类鸦片诱导便秘的症状。通过适当调节加工条件,所制备含有介于约2mg与约30mg之间阿西洛仑/单位剂量的组合剂型可具有成良好含量一致性。例如,本发明人已证实约10mg阿西洛仑涂布到20mg羟可待酮盐酸盐控制释放片剂及涂布到10mg羟吗啡酮盐酸盐缓释释放片剂的组合剂型的阿西洛仑含量具有小于约5%的相对标准偏差。包括阿西洛仑活性包衣层及调节释放类鸦片的本发明组合剂型显示阿西洛仑的实时释放及所述类鸦片的缓释释放。例如,控制释放羟可待酮片剂(图1a和图1b)上的约10mg阿西洛仑外包衣涂层的体外药剂溶解曲线显示实质上所有阿西洛仑在最初四分之一小时内释放而羟可待酮历经12小时逐步释放。此外,已在40℃及75%相对湿度下存储的经10mg阿西洛仑涂布的羟可待酮盐酸盐片剂的体外药剂溶解曲线自时间-零点片剂的溶解曲线开始未改变。类似地,经阿西洛仑涂布的羟吗啡酮盐酸盐缓释释放片剂的体外溶解证实实际上所有阿西洛仑系在最初四分之一小时内释放而所述羟吗啡酮历经12小时逐步释放(图2a和图2b)。此外,所述组合剂型在体内已显示可提供与呈单独剂型存在的两种组分的共同投药中所观察到的暴露度一致的两种组分的全身暴露度。实例8描述经阿西洛仑涂布的羟可待酮盐酸盐片剂及经阿西洛仑涂布的羟吗啡酮盐酸盐片剂在狗中的药物动力学研究。图3a中,当与阿西洛仑作为组合剂型投药时,相较阿西洛仑与羟可待酮以单独剂型投药、及单独给予羟可待酮的暴露度,羟可待酮的全身暴露度有微小差异。图3b中,来自与羟可待酮作为组合剂型的阿西洛仑的全身暴露度显示与来自以单独剂型给药及单独给予阿西洛仑的暴露度一致。如图4a和图4b中所示,也在阿西洛仑及羟吗啡酮的组合剂型中观察到一致暴露度。也在健康人类个体中研究阿西洛仑及羟可待酮的本发明组合剂型。取个别片剂的共同给药作为参考产品,10mg阿西洛仑及20mg羟可待酮盐酸盐的组合剂型证实,对于健康人类个体内,阿西洛仑的总暴露度在所述参考值的16%内,且羟可待酮的总暴露度在所述参考值的5%内。此外,与所述参考产品比较时,所述羟可待酮暴露度满足美国食品及药物管理局(fda)针对生物等效性的指南。同样,来自所述组合的羟可待酮的总暴露度与当单独给予羟可待酮时所经历的暴露度相等。如图5中所示,阿西洛仑及羟可待酮的组合剂型未改变羟可待酮的全身暴露度。用途类鸦片治疗剂(例如羟可待酮、氢可酮、吗啡、及羟吗啡酮)广泛用于治疗疼痛,包含重度疼痛、慢性疼痛、及非癌疼痛(例如肌肉骨骼疼痛及术后疼痛)。正如期望阿西洛仑及类鸦片镇痛剂的组合剂型在口服后提供相等类鸦片暴露度,期望本发明组合剂型可用于治疗疼痛。因此,一方面,本发明提供治疗哺乳动物(具体来说为人类患者)疼痛的方法,所述方法包括给予所述哺乳动物包括阿西洛仑及类鸦片镇痛剂的组合剂型。一方面,本发明提供治疗疼痛的方法,其包括给予包括呈实时释放调配物形式的阿西洛仑及呈调节释放调配物形式的类鸦片镇痛剂的组合剂型。已显示mu类鸦片受体拮抗剂阿西洛仑缓解处于稳定类鸦片疗法中的患者类鸦片诱导便秘的症状,即减少类鸦片疗法的一种痛苦副作用。正如还期望与单独给予阿西洛仑比较阿西洛仑及类鸦片镇痛剂的组合剂型提供相等阿西洛仑暴露度,期望本发明组合可用于缓解类鸦片诱导的胃肠副作用。因此,另一方面,本发明提供缓解哺乳动物(具体来说为人类患者)的类鸦片疗法的胃肠副作用的方法,所述方法包括给予所述哺乳动物包括阿西洛仑及类鸦片镇痛剂的组合剂型。实例为阐释本发明而提出以下实例,且不应以任何方式视其为限制本发明的范围。对于所有以下实例,阿西洛仑硫酸盐是根据美国专利第7,943,772号中所述的工艺合成。阿西洛仑的临床片剂调配物用作体内研究的试验物品。羟可待酮提供为商业购得(羟可待酮盐酸盐控制释放,20mg)片剂。根据包装插页,所述片剂含有呈盐酸盐形式的20mg羟可待酮/片剂及以下非活性成分:丁基化羟基甲苯、羟丙甲纤维素、聚乙二醇400、聚环氧乙烷、硬脂酸镁、二氧化钛、聚山梨醇酯80、及红色氧化铁。羟吗啡酮提供为商业购得er(羟吗啡酮盐酸盐缓释释放,10mg)片剂。根据包装插页,所述羟吗啡酮片剂含有10mg羟吗啡酮盐酸盐/片剂以及以下非活性成分:羟丙甲纤维素、聚环氧乙烷、聚乙二醇、α-生育酚、柠檬酸、聚乙烯醇、二氧化钛、大粒凝胶、滑石粉、及fd&c黄色6号(日落黄)。实例1:喷涂工艺使用托马斯compu-lab19英寸盘式涂布机制备实例2及3的组合剂型。在表1中总结针对涂布性能及效率优化的处理参数。表1.处理参数设定i设定ii排气温度(℃)40a40a溶液喷雾速率(g/ml)1513雾化空气压力(psi)35b35b盘速度(rpm)1515空气流速(scfm)170170入口温度(℃)6565枪距床距离(英寸)77a范围:35到50b范围:25到45实例2:制备阿西洛仑(10mg)及羟可待酮盐酸盐(20mg)的组合剂型制造安慰剂核心来匹配片剂且用作用于包衣的基质的主要负载。(a)制备底衣为制备包衣溶液,向加热纯水usp添加聚乙烯醇(40g)。搅拌所述混合物并加热到溶解并且随后添加聚乙二醇3350(80g),并搅拌所述混合物到溶解。添加纯水usp并搅拌来提供具有大约10%固体含量(也就是说,非水性含量;固体含量不呈固体形式)的溶液。根据表i设定i的处理参数用底衣溶液喷涂总计大约4kg的安慰剂核心及少量片剂来实现表2中所列的底衣组合物的约3%增重。表2.底衣调配物组成(b)制备活性包衣层在表3中列出生成用于两种调配物的活性包衣溶液的组分数量。为制备各活性包衣溶液,向加热纯水usp添加聚乙烯醇。搅拌所述混合物并加热到溶解并且随后添加聚乙二醇,搅拌所述混合物到溶解,并添加抗坏血酸同时搅拌,随后添加阿西洛仑硫酸盐。添加纯水usp并搅拌来提供具有大约10%固体含量(也就是说,非水性含量;固体含量不呈固体形式)的包衣溶液。表3.阿西洛仑药剂活性包衣层调配物组成a阿西洛仑游离碱当量完成底层包衣之后,将经底包衣的安慰剂核心及类鸦片片剂保留在盘式涂布机内并根据表1设定i的处理参数进一步用活性包衣溶液喷涂来实现目标增重。完成包衣后,通过颜色差异自包衣安慰剂核心分离包衣类鸦片片剂。实例3:制备阿西洛仑(10mg)及羟吗啡酮盐酸盐(20mg)的组合剂型制造安慰剂核心来匹配er片剂且用作用于包衣基质的主要负载。(a)制备底衣如同实例2(a)制得底衣包衣溶液。根据表i设定ii的处理参数用底衣溶液喷涂总计大约4kg安慰剂核心及少量er片剂导致表2中所列的底衣组合物的约3%增重。(b)制备活性包衣层如实例2(a)中所述制备用于表3的两种调配物的包衣溶液。完成底层包衣之后,将经底包衣的安慰剂核心及类鸦片片剂保留在盘式涂布机内并根据表1设定i的处理参数进一步用活性包衣溶液喷涂来实现目标增重。完成包衣后,通过颜色差异自包衣安慰剂核心分离包衣类鸦片片剂。实例4:分析药剂含量一致性通过具有uv检测的高压液体色谱法(hplc)分析阿西洛仑药剂外包衣类鸦片片剂(n=10片剂/调配物)的药剂含量效力及一致性。表4中记录实例2及3中所制备的组合剂型的结果。表4:阿西洛仑药剂含量效力及一致性a标示量=10mg阿西洛仑实例5:药剂溶解曲线根据usp专论711及内部发展方法测试实例2及3的阿西洛仑包衣类鸦片片剂(n=6片剂/调配物)的单一组分的药剂溶解速率。在13、30、45、60分钟及在4及12小时溶解时间点收集样品等分试样,并通过具有uv检测的反相hplc分析。在表5及图1a和1b中显示来自阿西洛仑包衣羟可待酮片剂及阿西洛仑包衣羟吗啡酮片剂的单一组分的溶解速率结果,而在表6及图2a和2b中显示阿西洛仑包衣羟可待酮片剂的镇痛剂溶解速率结果。在所有情况下,实质上观察到所有阿西洛仑在0.25小时的第一时间点就已溶解,而控制释放类鸦片历经12小时逐步溶解。表5:阿西洛仑/羟可待酮组合剂型的体外溶解a%标示量,相对于阿西洛仑10mgb相对标准偏差表6:阿西洛仑/羟吗啡酮组合剂型的体外溶解a%标示量,相对于阿西洛仑10mgb相对标准偏差实例6:稳定性研究通过hplc分析存储于40℃及75%相对湿度(rh)的加速条件下的具有实例2调配物a的活性包衣层调配物的阿西洛仑/羟可待酮盐酸盐组合剂型的样品的阿西洛仑含量及杂质概况(如表7中所示)及溶解速率(如表8中所示)。表7:阿西洛仑分析及杂质(n=3)表8:阿西洛仑/羟可待酮组合剂型的体外溶解(n=6)a%标示量,相对于阿西洛仑10mgb相对标准偏差实例7:制备阿西洛仑包衣微球已通过涂布特征直径为500μm的糖球证实在由微球构成的固体剂型上制备组合剂型的可行性。在表9中列出制备标称10mg阿西洛仑包衣/450mg微球的组成表9.阿西洛仑包衣微球批次组成进行三次包衣操作:a.有底衣的批次量200g根据实例2中所述的方法制备底衣包衣溶液及阿西洛仑活性包衣层溶液。装载糖微球到格拉特(glatt)小型流化床的碗中并加热到约45℃。以0.6g/分钟的喷涂速率将底衣包衣溶液喷涂到所述微球上直到获得10%增重。完成底衣包衣之后,以0.6g/分钟的喷涂速率将所述活性包衣层溶液喷涂到底包衣糖微球上。在有0.8到1.0bar的雾化空气压力的流化床中使产物温度维持在约45℃。完成沉积活性包衣层后,在卸料前在45℃下使所述微球干燥10分钟。b.无底衣的批次量200g将相当于表8中所述的组成的活性包衣层直接喷涂到如上述的糖微球上。c.有底衣的批次量2kg表示为c-1及c-2的两批阿西洛仑包衣微球使用格拉特gpcg-3流化床由具有10倍于表8中所列数量的批量的组成制备。典型处理参数列示于表10中。表10.流化床处理参数(2kg批次)管柱高度(mm)35入口温度(℃)52出口温度(℃)45产物温度(℃)45溶液喷雾速率(g/min)4.0雾化空气压力(psi)30出口空气控制风门(%)40测试所得微球的含量一致性及主要降解产物。表11.含量一致性及纯度a基于10mg剂量的标示量实例8:在犬类中的药物动力学及相对生物利用率对禁食小猎犬(6只雄性犬/组)进行单次剂量、四个阶段、交叉药物动力学研究,以在口服所述组合剂型、共同给予单独组分、及各组分的单独剂型之后评估阿西洛仑及类鸦片(羟可待酮或羟吗啡酮)的药物动力学特性及相对生物利用率。将实例2调配物a(每锭含11.85mg阿西洛仑,19.42mg羟可待酮)的组合剂型及单独片剂阿西洛仑(10.21mg)、羟可待酮(19.42mg)用于阿西洛仑/羟可待酮研究。将实例3调配物a(9.26mg阿西洛仑,10.39mg羟吗啡酮)及单独片剂阿西洛仑(10.21mg)、羟吗啡酮(10.39mg)用于阿西洛仑/羟吗啡酮研究。各阶段之间观察到清除期为至少5天。犬接受经肌内给予五肽胃泌素(6μg/kg)前处理来降低胃部ph。图3a及3b(羟可待酮)及图4a及4b(羟吗啡酮)中分别显示来自药物动力学研究的阿西洛仑及类鸦片的血浆曲线。实例9:在健康人类个体中的药物动力学及相对生物可用率在健康人类个体中进行随机化、单次剂量、开放标记、四个治疗阶段、四个顺序交叉研究,在口服本发明组合剂型之后、在共同给予单独组分之后、及在给予各组分的单独剂型之后,研究阿西洛仑及羟可待酮的相对生物利用率。在各处理的投药前15及3小时及投药后9及21小时给予纳曲酮(naltrexone)来阻断类鸦片的副作用。在各阶段之间观察到七天清除期。完成至少一个阶段的个体数为28,其中26个个体完成全部四个研究阶段。根据实例2的方法制备外包衣组合片剂(每锭含9.66mg阿西洛仑,19.42mg羟可待酮),表3的调配物a中的阿西洛仑层。将单独片剂阿西洛仑(10.21mg)、羟可待酮(19.42mg)用于此研究。通过使用winnonlin版本6.2.1(pharsight,st.lous,mo)的非模室数据分析测定药物动力学(pk)参数。记录以下pk参数:c最大:血浆中最大浓度auc0-最后:在给药时间开始到最后可测浓度的浓度-时间曲线下面积auc0-∞:外推到无穷大的浓度-时间曲线下面积在表12及14中分别出示组合剂型的羟可待酮及阿西洛仑与单独组分的共同给药相比较的相对生物利用率。在表13中出示组合剂型的羟可待酮与单独的羟可待酮相比较的相对生物利用率。在图5及图6中分别显示羟可待酮及阿西洛仑的血浆暴露度。所述研究证实,阿西洛仑及羟可待酮的组合剂型相对于单独片剂的共同给药临床上提供与羟可待酮及阿西洛仑相当的暴露度。羟可待酮药物动力学参数c最大、auc0-最后、及auc0-∞几何平均比及相关联的信赖区间处于所述参考产品的80%到125%内。来自组合剂型的阿西洛仑参照共同给予单独片剂的c最大、auc0-最后、及auc0-∞几何平均比为大约85%。表12:组合剂型的羟可待酮相较于共同给予单独组分的相对生物利用率a来自线性混合效应分析的几何最小平方平均值b所述比率的90%信赖区间c对于c最大及auc0-最后而言n=27,对于auc0-∞而言n=26d对于c最大、auc0-最后、auc0-∞而言n=27表13:组合剂型的羟可待酮相较于只有羟可待酮的相对生物利用率aa来自线性混合效应分析的几何最小平方平均值b所述比率的90%信赖区间d对于c最大、auc0-最后、及auc0-∞而言n=26d对于c最大、auc0-最后、及auc0-∞而言n=27表14:组合剂型的阿西洛仑相较于共同给予单独组分的相对生物利用率aa来自线性混合效应分析的几何最小平方平均值b所述比率的90%信赖区间c对于c最大、auc0-最后、及auc0-∞而言n=27实例10:赋形剂相容性研究根据包衣材料与阿西洛仑的比研究阿西洛仑与商业包衣材料的四种组成的相容性。阿西洛仑硫酸盐与表15的材料的混合物在称量舟中在40℃下干燥来形成膜。通过hplc分析所述膜存储在40℃及88%相对湿度的加速条件下达2周的化学稳定性。表15:包衣材料a聚乙二醇b羟丙基甲基纤维素表16:阿西洛仑分析a相对于阿西洛仑游离碱当量实例11:阿西洛仑膜的水分吸收分析在60℃下将阿西洛仑硫酸盐和聚乙烯醇的4:1重量/重量比的2.5%固体负载的水溶液喷涂到带夹套玻璃表面上。将一小片膜放置于水分吸收分析仪(sga-100,vti公司,海厄利亚,佛罗里达州)。湿度设定在约0%相对湿度(rh)达10分钟且随后上升到70%rh达48小时。温度设定在25℃。如图8中所示,膜在前两个小时增加重量且在初始增加后开始损失重量。前两个小时内的重量增加可归因于非晶型阿西洛仑硫酸盐对水分的吸收。后续时间内的重量损失可归因于阿西洛仑硫酸盐的结晶,其释放非晶型所吸收的水分。膜重量的净增重可以归因于聚乙烯醇的水分吸收。虽然本发明已参考其特定实施例作出说明,但所属领域的技术人员将了解,在不脱离本发明的真正精神及范围下可作出各种改变且可取代等效项。此外,可作出多种修改来使特定状况、材料、物质组成、方法、方法步骤适应本发明的目标、精神及范围。希望所有这些修改属于此处随附权利要求书的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1