心脏损伤装置的制作方法
相关申请的交叉引用
本申请要求于2015年6月30日提交的第62/186,472号美国临时专利申请的权益,该申请整体并入本文作为参考。
本公开涉及心脏伤口管理。更具体地,本公开涉及用于心脏中伤口的临时管理的装置和方法。
背景技术:
第2013/0018302(a1)号美国专利公开(nour等人)意图公开一次性装置,旨在用于外科手术(其中每次发现套管插入或导管插入的血管方法是必须的),特别用于心脏外科手术或介入性心脏病学。这种装置本质上包括主体、由两个可膨胀的盘组成的密封系统、用于对该盘膨胀和紧缩的控制连接器、管单元和柔性导板。
第8,506,525(b2)号美国专利(bosarge)意图公开伤口密封流体递送设备和包括表面密封的方法。提供了具有第一端和第二端的导管,以使导管穿过表面密封。输注端口与导管的第一端连接,并且可膨胀的内密封与导管的第二端连接。
发明概述
以下概述旨在向读者介绍申请人教导的各方面,但不是限定任何发明。
根据一些方面,用于临时管理伤口(例如心脏中的伤口)的装置包括具有第一端部分、第二端部分和在其间的杆轴的杆。血流阻断膜位于所述第一端部分以阻断通过伤口的血流。所述血流阻断膜具有面向所述第二端部分的第一面、背向所述第二端部分的相反的第二面、邻近所述杆的中心部分,和外周部分。所述血流阻断膜是弹性柔韧的(flexible)并且在至少第一塌缩状态与展开状态之间是可移动的,在所述第一塌缩状态中,所述膜被弯曲以使外周部分轴向地移动向第二端部分且径向向内地移动向轴杆以使血流阻断膜通过伤口插入,在所述展开状态中,相对于第一塌缩状态,所述外周部分移动远离所述第二端部分并径向向外地移动以阻断通过伤口的血流。所述装置还包括支座构件,其安装于所述杆并且沿着所述杆轴向地可移动向血流阻断膜和轴向地可移动远离血流阻断膜以支托伤口并维持血流阻断膜邻近伤口。
在一些实例中,所述血流阻断膜可以倾向于展开状态。
在一些实例中,所述血流阻断膜可以由硅酮制成。
在一些实例中,所述血流阻断膜可以包括单片硅酮盘。
在一些实例中,所述血流阻断膜可以在固定位置固定于所述杆。
在一些实例中,所述血流阻断膜可以进一步移动向第二塌缩状态和从第二塌缩状态移动出,在所述第二塌缩状态中,相对于展开状态,所述膜被弯曲以使外周部分轴向地移动远离第二端部分并径向向内地移动向所述杆轴以使血流阻断膜从伤口移除。
在一些实例中,所述血流阻断膜可以具有膜刚度,并且所述支座构件可以具有比膜刚度更大的支座构件刚度。
在一些实例中,所述支座构件可以是弹性柔韧的。
在一些实例中,所述支座构件可以具有面向第一端部分的凹面侧。
在一些实例中,所述支座构件可以具有轴向穿过其延伸的中心孔,所述杆可以被容纳在所述孔中,并且所述支座构件可以沿着所述杆轴向滑动。
在一些实例中,所述杆可以从膜的第二表面垂直地延伸。
在一些实例中,所述杆可以具有在第一端部分的第一端,并且所述膜可以固定于所述第一端。在一些实例中,所述膜的中心部分可以固定于所述第一端。
在一些实例中,所述膜可以具有约0.25mm至约1.5mm的壁厚度。
在一些实例中,所述杆可以具有约10cm至约20cm的杆长度。在一些实例中,所述杆可以具有15cm的杆长度。
在一些实例中,所述血流阻断膜可以具有展开表面积,并且所述展开表面积可以小于80cm2。
在一些实例中,所述血流阻断膜可以具有展开体积,并且所述展开体积可以小于6cm3。
根据一些方面,所述装置可以用于临时管理心脏中的伤口。
根据一些方面,用于临时管理伤口(例如心脏中的伤口)的方法包括a)将血流阻断膜通过所述伤口插入。所述血流阻断膜在所述血流阻断膜穿过所述伤口时弯曲至第一塌缩状态,并且在其已经穿过所述伤口时恢复至展开状态。所述方法还包括b)将所述血流阻断膜倚靠伤口放置,例如倚靠所述心脏壁放置,从而覆盖所述伤口并且阻断通过所述伤口的血流。所述方法进一步包括c)保持所述血流阻断膜倚靠所述伤口。
在一些实例中,所述血流阻断膜当处于展开状态时可以占据不超过所述心脏体积的约1%。
在一些实例中,将所述血流阻断膜插入的步骤可以包括将杆的第一端部分插入所述伤口,其中所述血流阻断膜处于所述杆的第一端部分。
在一些实例中,将所述血流阻断膜插入的步骤可以包括使所述杆缩回以将所述血流阻断膜倚靠所述伤口放置,例如倚靠心脏壁放置。
在一些实例中,保持所述血流阻断膜倚靠所述伤口的步骤可以包括沿着所述杆轴向地将支座构件移动向所述伤口,例如移动向所述心脏,从而接触所述心脏。
在一些实例中,在将所述血流阻断膜通过所述伤口插入的步骤中,可以使得所述血流阻断膜弯曲至塌缩状态。
在一些实例中,在将所述血流阻断膜插入的步骤中,所述血流阻断膜可以在穿过所述伤口之后自动地恢复至展开状态。
在一些实例中,所述方法可以进一步包括在所述血流阻断膜处于心脏中时,例如当其在心脏中处于展开状态时,向所述伤口应用缝线。
在一些实例中,所述方法可以进一步包括将所述血流阻断膜从所述伤口缩回。在所述血流阻断膜穿过所述伤口时,所述血流阻断膜可以弯曲至第二塌缩状态。
附图简述
本文包括的附图用于例示本说明书的物件、方法和设备的各种实例,并且不旨在以任何方式限制所教导的内容的范围。在附图中:
图1a是用于使用展开状态的血流阻断膜临时管理伤口的实例装置的透视图。
图1b是使用展开状态的血流阻断膜的图1的实例装置的俯视图。
图1c是使用第一塌缩状态的血流阻断膜的图1的实例装置的俯视图。
图2a是具有伤口的心脏的实例。
图2b示出使用第一塌缩状态的血流阻断膜的被插入图2a的伤口中的图1的实例装置。
图2c示出使用展开状态的血流阻断膜的在穿过图2a的伤口之后的图1的实例装置。
图3示出血流阻断膜被放置以覆盖图2a的伤口的图1的实例装置。
图4示出使用第二塌缩状态的血流阻断膜的从图2a的伤口移除的图1的实例装置。
图5示出在用于比较使用图1的实例装置实现的伤口管理结果与弗利导管的的伤口管理结果的研究中使用的实验方法的时间轴。
图6a示出与使用弗利导管比较的当图1的实例装置用于临时伤口管理时来自右心室伤口的血液损失体积的图表。
图6b示出与使用弗利导管比较的当图1的实例装置用于临时伤口管理时来自左心室伤口的血液损失体积的图表。
图6c示出与使用弗利导管比较的当图1的实例装置用于临时伤口管理时最终伤口尺寸的图表。
具体实施方式
下文将描述各种设备或方法以提供所请求保护的主题的实施方案的实例。下文描述的实施方案未限制任一权利要求,并且任一权利要求可以覆盖与下文描述的那些不同的方法或设备。权利要求不限于具有下文描述的任一设备或方法的所有特征的设备或方法,或不限于下文描述的多个或所有设备的共有的特征。可能地,下文描述的设备或方法不是通过发布本专利申请而授予的任何专利权的实施方案。下文描述的以及通过发布本专利申请而未授予任何专利权的任何主题可以是另一保护工具(例如继续专利申请)的主题,以及申请人、发明人或所有人不旨在放弃、否认或向公众捐赠在文件中公开的任何这样的主题。
本文描述了用于临时管理伤口、例如心脏中的伤口的装置和方法及其用途。如本文所用,术语“心脏中的伤口”是指在心脏中的任何类型的伤口,包括但不限于,可能在患者的心脏中出现的撕裂伤、切口和/或穿孔。术语“心脏中的伤口”可以用于指由医生或外科医生创建的有意的伤口或撕裂伤或切口或穿孔,例如用于将导管引入心脏的切口。术语“心脏中的伤口”还可以用于指在患者心脏中不管如何而产生无意的伤口或撕裂伤或切口或穿孔。此类伤口可以包括刺穿伤口或枪击伤口。穿透心脏伤口带有高死亡率。迅速的出血控制可以对存活是关键的。在其他实例中,本文描述的装置和方法可以用于在其他身体部分中的伤口的临时管理,例如血管伤口,而不管是有意的、无意的或自然存在的(例如在动脉瘤的情况下)。
本文描述的装置和方法可以用于其中从伤口(例如心脏中的伤口)的出血需要被临时控制的各种情形。例如,心脏外科医生可以在患者的心脏中创建切口以引入导管。典型地,外科医生将必须临时缝合切口,直至完成正在执行的操作。本文描述的装置和方法可以提供用于临时控制伤口并且在执行操作时阻断从伤口的出血的替代方案。一旦完成操作,则可以移除装置并且可以缝合伤口。
在本文描述的一些实例中,装置可以被定制尺寸以允许在从伤口(例如从心脏)移除装置之前向伤口应用一些初始缝合。这可以降低伤口的尺寸,由此降低在医学专业人员完成缝合以使伤口闭合时发生的出血。
本文描述的装置和方法可以与多种其他操作(其中在心脏中产生伤口或切口)一起使用。例如,经皮主动脉瓣置换(也称为经导管主动脉瓣移植或经导管主动脉瓣置换)可以涉及在心脏中的切口。本文描述的装置和方法可以用于这样的操作,以临时阻止在心脏中为了置换主动脉瓣而创建的伤口时可能发生的出血。
本文描述的装置和方法还可以应用于心脏中的外伤性或无意的伤口。例如,如果患者患有穿入心脏的外伤性伤口,则本文描述的装置和方法可以用于迅速且临时地阻止或阻断或停止从心脏中的伤口的出血。例如,急诊室人员可以使用该装置以使得在将患者转移至手术室之前的血液损失最小化。此外,本文描述的装置和方法可以用于制止在手术期间从患者的心脏中无意/意外地产生的伤口的出血。
如上所提及的,本文所述的装置和方法还可以应用于血管伤口,包括动脉瘤在内。
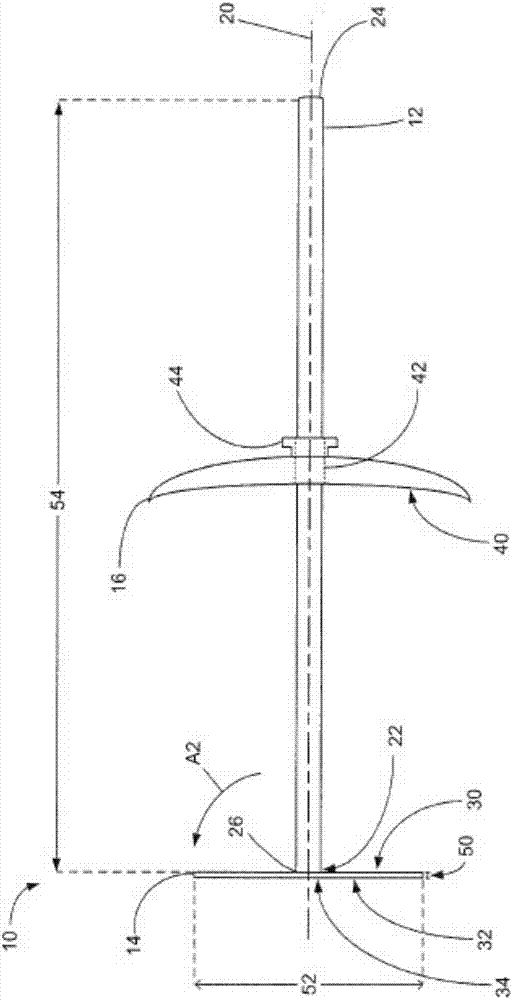
参考图1a至1c,其中示出用于临时管理伤口(例如心脏中的伤口)的装置10的实例。装置10可以用于覆盖伤口并且阻断或停止通过伤口的血液的流动。所例示的实例装置10包括杆12、血流阻断膜14和支座构件16。
通常,在一些实例中,膜14可以被放置在心脏内以倚靠心脏壁,从而覆盖伤口并阻断通过伤口的血流。支座构件16可以通过接触心脏壁外部并防止装置10被拉入心脏而保持膜14倚靠伤口。
杆12具有第一端部分22、第二端部分24和在其间延伸的杆轴20。杆12具有在第一端部分22的第一端26。杆12支持膜14和支座构件16。当装置10用于阻断来自心脏中的伤口的血流时,杆12的第二端部分24可以被医生或其他医学专业人员握住,以操纵装置10进入期望的位置。
在一些实例中,杆12可以具有约10cm至约20cm的杆长度54。例如,杆12可以具有15cm的杆长度54。这可以为杆12提供合适的长度,从而当装置10被插入患者心脏的伤口时,从患者身体延伸出。
在一些实例中,杆12可以包括或限定管路(例如,杆12可以是中空的),从而允许流体直接输注入心脏中。在其他实例中,杆12可以是固体或部分地是固体。
血流阻断膜14(也称为膜14)可以用于阻断通过患者心脏中的伤口的血流。膜14可以倚靠心脏壁放置以从心室内部覆盖伤口并且阻断通过该伤口的血流。
膜14被放置在杆12的第一端部分22。膜14具有面向杆12的第二端部分24的第一面30和背向第二端部分24的相反的第二面32。在图1的实例中,杆12大致垂直地从膜的第二面32延伸。膜14具有邻近杆12的中心部分34和外周部分36。
在图1a示出的实例中,膜14被固定于杆12的第一端26。特别地,膜14的中心部分34被固定于第一端26。具有固定在杆12的第一端26处的膜14可以当膜被放置倚靠心脏壁并覆盖伤口时使杆12的穿入深度最小化。这可以使在使用时装置10占据的心脏体积最小化。在一些实例中,所述血流阻断膜可以在固定位置固定于所述杆。
在所示的实例中,螺丝形式的膜连接件38用于将膜14固定于杆12。在其他实例中,供替代的膜连接件(例如粘合剂)可以用于将膜14固定于杆12。在其他实例中,膜14和杆12可以整体地形成。在其中使用螺丝膜连接件38的实例中,硅酮覆盖物可以放置在膜连接件38上。
膜14是弹性柔韧的。膜14可以在至少第一塌缩状态(如图1c所示)与图1a和1b中示出的展开状态之间移动。在第一塌缩状态中,膜14被弯曲以将外周部分36轴向地移动向第二端部分24并且径向向内地移动向杆轴20,如图1c中的箭头a1所指示的。膜14可以弯曲向第一塌缩状态,以将血流阻断膜14通过伤口插入。
参考图1a和1b,在展开状态中,相对于第一塌缩状态,外周部分36移动远离第二端部分24并且径向向外地移动,如图1b中的箭头a2所指示的。当处于展开状态时,膜14可以用于阻断通过伤口的血流。当膜14被放置在心脏中时,展开状态允许膜14从心脏内部覆盖伤口。
在一些实例中,膜14倾向于展开状态。在此类实例中,膜14可以在膜穿过伤口(例如,在心脏中)时弯曲至第一塌缩状态,然后当其穿过伤口时自动地恢复至展开状态。这允许膜14容易且迅速地放置,从而覆盖在心室内部上的伤口,以阻断通过伤口的血液的流动。在所示的实例中,在膜14插入心脏之后,不需要调节或膨胀或以其他方式展开膜14,因为其自动地恢复至展开状态。这允许可以迅速地操纵膜14进入位置以阻断通过伤口的血液的流动。
在一些实例中,膜14可以进一步移动至第二塌缩状态并从第二塌缩状态移动出(如图4所示)。在第二塌缩状态中,相对于展开状态,膜14被弯曲以将外周部分36轴向地从第二端部分24移开并且径向向内地移动向杆轴20。膜14可以弯曲至第二塌缩状态以将膜从伤口移开。
在装置10的各种实例中,可以使用膜14的不同尺寸。可以根据患者的解刨学(例如,心脏的尺寸)和/或伤口的尺寸使用不同尺寸的膜。例如,如果伤口是小的,可以使用更小的膜。更小的膜使当插入心脏时膜14占据的心脏体积最小化。在其他实例中,可以使用较大的膜来阻断通过较大伤口的血流。
例如,参考图1b,膜14可以具有约2cm至约7cm的直径52。在一些实例中,膜14可以具有约3.5cm的直径52。
在一些实例中,膜14可以具有约6cm2至约80cm2的展开表面积(即,第一面30、第二面32和圆柱侧表面的面积)。在一些实例中,膜14可以具有小于约80cm2的展开表面积。在一些实例中,膜14可以具有约20cm2的展开表面积。
在一些实例中,膜14可以具有约0.25mm至约1.5mm的壁厚度50。在一些实例中,膜14可以具有约1mm的壁厚度50。
在一些实例中,膜14可以具有约0.08cm3至约6cm3的展开体积。在一些实例中,膜14可以具有小于约6cm3的展开体积。在一些实例中,膜14可以具有约1cm3的展开体积。
膜14的使用允许装置10占据小的体积,例如在心脏中的小的体积。在一些实例中,血流阻断膜14当处于展开状态时占据不超过心脏体积的2%。在一些实例中,血流阻断膜14当处于展开状态时占据不超过心脏体积的1%。因此,膜14能够阻断通过伤口的血流,而不显著地降低在心室中用于循环血液的体积。因此,装置10能够阻断来自心脏中的伤口的血液的流动,而不显著地干扰心脏功能,例如心瓣功能。
在各种实例中,不同的材料可以用于制造膜14和/或支座构件16。例如,可以使用用于制造假体(prosthetics)以替代受损动脉的材料。合适的材料的实例包括各种聚合物,例如硅酮;膨体聚四氟乙烯(eptfe);聚对苯二甲酸乙二酯(“dacron”);聚醚型聚氨酯;和聚碳酸酯聚氨酯脲。在进一步的实例中,还可以使用牛心包组织或猪心包组织,例如由vascutekltd.和neovascinc.制造的那些。在一些实例中,重组人弹性蛋白原可以用作涂层,从而降低凝血活性。还可以使用前述材料的组合。
在图1所示的实例中,膜14由硅酮制造。特别地,膜14是单片硅酮盘。这可以有利于膜14的制造,并且提供占据小的体积(例如在患者心脏中的小的体积)的膜14。因此,装置10能够阻断来自心脏中的伤口的血液的流动,而不显著地干扰心脏功能,例如心瓣功能。
将支座构件16安装于杆12。支座构件16沿着杆12轴向地移动向血流阻断膜14和移动远离血流阻断膜14。当放置膜14以覆盖伤口(例如,心脏内的伤口)时,支座构件16位于心脏外部并且可以沿着杆轴向地移动以接触心脏的外表面。支座构件16可以用于支托心脏并且维持或保持血流阻断膜14邻近伤口,以使装置10不被进一步拉入心脏。
在图1所示的实例中,支座构件16具有穿过其延伸的中心孔42。杆12被容纳在孔中并且支座构件16沿着杆12轴向地滑动。在一些实例中,支座构件16可以包括握柄44。握柄44可以用于抓握支座构件16并且将支座构件16移动向杆12的期望的轴向位置。
在供替代的实例中,杆12可以有螺纹,并且可以通过转动支座构件16而将支座构件沿着杆移动。
在一些实例中,支座构件16可以包括支座固定构件。支座固定构件可以用于可释放地将支座构件16固定在杆12上的期望的轴向位置。例如,当支座构件16被放置以支托心脏时,支座固定构件(例如夹子或扣件)可以用于将支座构件16固定在适当位置。例如,夹子可以用于将支座构件16固定在沿着杆12的适当的位置。
在一些实例中,支座构件16可以是弹性柔韧的。这可以允许支座构件16符合患者解剖学的轮廓,例如当支托心脏时的心脏。支托构件16可以具有比膜14的膜刚度更大的支座构件刚度。这可以降低支座构件16当移动以支托伤口(例如心脏中的伤口)时意外地通过伤口插入的可能性。
在图1所处的实例装置10中,支座构件16具有面向第一端部分22的凹面侧40。支座构件16的凹面侧40可以提供抽吸作用(类似于吸盘)以将支座构件16固定在适当的位置,例如当移动以支托心脏时固定于心脏。这可以进一步有利于将膜14保持在适当的位置以覆盖心脏,以及提供额外的阻断以防止通过心脏中的伤口的血液的流动。
通常,装置10的各种不同的实例可以用于临时管理伤口,例如心脏中的伤口。在一些实例中,装置10可以是用于临时管理心脏中的伤口的一次性装置。在此类实例中,装置10可以在从患者的心脏移除之后被丢弃。
通常,装置10可以是可灭菌的,并且可以在使用之前经灭菌以降低伤口的感染或污染的可能性。装置10可以使用各种已知的灭菌技术(例如采用
现将参考图2a至2c、3和4。图2b、3和4示出用于临时管理心脏中的伤口的装置在装置通过伤口插入(图2b)、穿过伤口和恢复至展开状态(图2c)、放置在心脏内以覆盖伤口(图3)和从伤口缩回(图4)时使用的实例。图2a是具有穿孔或伤口62(例如刺穿伤口)的心脏60的实例。心脏60包括室64和壁66。
现参考图2b。图2b示出具有插入伤口62的装置10的血流阻断膜14(和第一端部分22)的心脏60。当装置10的第一端部分22通过伤口62而推入(以方向a)时,膜14自动地弯曲至第一塌缩状态。
在第一塌缩状态中,膜14的外周部分36已经轴向地移动向第二端部分24并且径向向内地移动向杆轴20。与心脏60接触可以使得膜14弯曲至塌缩状态。这允许膜14相对容易地穿过伤口62,并且可以使对插入膜14的伤口的恶化作用最小化。
当血流阻断膜14已经穿过伤口62时,其可以恢复至展开状态(如图2c所示)。如前所提及的,在一些实例中,膜14可以倾向于展开状态。在此类实例中,膜14在穿过伤口62之后自动地恢复至展开状态。
现参考图2c,其中例示了具有放置在心脏60的内部的血流阻断膜14的装置10的实例。膜14已经穿过伤口62并且现在在心脏60的室64内部处于展开状态。
参考图3,一旦在心脏60的内部,膜14可以被倚靠心脏60的壁66放置以覆盖伤口62并且阻断通过伤口62的血流。在一些实例中,杆12可以缩回以将血流阻断膜14倚靠心脏60的壁66放置。外科医生和手术助手可以抓握杆轴20并且缩回杆,直至膜14被倚靠心脏60的内壁66放置。在一些实例中,杆12可以包括在第一端部分22上或附近的标记物以大致指示杆12何时已经足够地缩回。
一旦膜14被倚靠壁66放置之后,膜14可以被保持倚靠伤口62以阻断通过伤口62的血液的流动。这可以将通过伤口62的血液的流动阻断延长的时间段,例如,在外科医生在患者的心脏中进行操作的时候,或在患者被从急诊室运送至手术室的时候。尽管在一些实例中,膜14可以手动地保持倚靠伤口62,即,由外科医生或手术助手辅助维持装置10在适当的位置,但是可以期望地在无需外科医生或其他医学专业人员将装置10维持在适当的位置的情况下将膜14保持在适当的位置。这可以减少在伤口62附近的堵塞并且使医学专业人员得以释放,从而进行其他任务。
支座构件16可用于保持膜14倚靠伤口62。在膜14已经被倚靠壁66放置之后,支座构件14可以沿着杆轴向地移动向心脏60以支托心脏。如上所提及的,支座构件16可以是柔韧的。这可以允许支座构件16当支托心脏60时符合心脏60的轮廓。此外,支座构件16可以具有面向膜14的凹面侧40。凹面侧40可以发挥吸盘的作用,从而当支座构件16已经被移动以支托心脏60时固定支座构件16倚靠心脏60的壁66。这可以进一步确保膜14保持在适当的位置以倚靠壁66,覆盖伤口62。
如上所提及的,支座构件16可以包括支座固定构件。当支座构件16支托心脏时,支座固定构件可以被固定或禁锢以将支座构件16保持在杆12上的期望的轴向位置。当支座构件16需要被重新放置时或当装置10被缩回时,支座固定构件可以随后被松开或释放。
在一些实例中,在血流阻断膜14处于心脏60中时,可以将缝线应用于伤口62。因为膜14的直径通常远大于杆12的直径,因此膜14可以用于阻断通过大于杆12的尺寸的伤口的血液的流动。可以应用缝线以在从伤口62缩回血流阻断膜14之前减小伤口62的尺寸。由于膜14的柔韧性质,当缩回装置10时,膜14可以从伤口62移除,即使伤口62的尺寸已经由于缝合而减小。由此,装置10可以用于迅速地阻断来自伤口62的出血,并且允许医学专业人员在提出装置10之前减小伤口的尺寸。
现参考图4,其中例示了具有从伤口62缩回的膜14的装置10的实例。一旦装置10不在需要控制通过伤口62的血液的流动,血流阻断膜14可以从伤口62缩回。在图4中,当膜14穿过伤口(在方向b上移动)时,血流阻断膜14弯曲至第二塌缩状态。
如图4所示,在第二塌缩状态中,相对于图1和3的展开状态,膜14弯曲以将外周部分36轴向地移动远离第二端部分24并且径向向内地移动向轴杆20以从伤口移除血流阻断膜14。第二塌缩状态允许装置10从患者的心脏移除,同时使对伤口62的进一步损伤最小化。第二塌缩状态还有助于在已经向伤口62应用缝线之后从心脏60移除膜14。
实施例
测试图1a至1c所示的装置(下文称为“所述装置”)并且与尿囊导管(弗利导管)比较对在实验穿透心脏伤口中的出血的控制。目前,获得对在穿透心脏损伤中的出血的临时控制的常用方法是通过伤口插入弗利导管,然后通过牵引以紧密地放置该囊倚靠损伤。实际上,这种技术可以导致对出血的次优控制并且可以导致初始损伤的扩大。而且,该囊必然占据心室内的空间,由此干扰心脏功能。
方法
六(n=6)个成年雄性约克夏猪(35-37kg)在操作之前禁食过夜,并保持在25℃和12小时明/暗循环下。
将动物经由肌内氯胺酮(20mg/kg)、甲苯噻嗪(2mg/kg)和硫酸阿品托(1mg/25kg,1-2ml)麻醉。一旦麻醉,对动物插管并且保持在使用吸入性异氟烷2-5%的呼吸机(10ml/kg)上以在整个操作保持麻醉。
连续监测脉搏血氧测量、心电图(ecg)和心率。使用14g(gauge)血管导管对每只猪的右股动脉插管,并且连续监测平均动脉血压(map)(biopacsystemsinc.,goleta,ca)。以类似的方式对右颈静脉插管以用于流体输注。动物接收静脉乳酸格林溶液以将map在整个操作保持为基线水平±5mmhg。
每只猪随机选择具有放置在右心室(rv)中和左心室(lv)中的标准化(1.5cm)心脏伤口中的所述装置或弗利导管。在每只动物中创建总计4个伤口,每个心室中两个伤口。在创建每个伤口之后,将所述装置或弗利导管用于临时管理出血。
将两个手术刀在手术刀柄上连接在一起以创建长度为1.5cm的一致伤口。抽吸导管用于血流吸引。执行正中胸骨切开术并且将围心腔打开以暴露心脏。在创建伤口之前,执行术中超声波心动图。
对于每只猪,随机选择为了控制第一伤口中的出血而选择的方法。然后沿着右心室的纵向轴创建全厚1.5cm的伤口。使伤口出血5秒钟,然后企图临时出血控制并且将所述装置或弗利导管引入伤口(根据随机选择)。
当使用本文描述的装置时,经由通过心脏伤口插入血流阻断膜而展开所述装置。将血流阻断膜放置倚靠心室壁的底面。将支座构件沿着装置的杆轴向地移动向伤口。然后将血流阻断膜保持倚靠心室壁的底面。然后经由将支座构件从伤口滑动开并且将所述装置通过心脏伤口从心室拉出,从而将所述装置从伤口缩回。
当使用弗利导管时,将弗利导管通过伤口引入心室并且用10ml生理盐水使囊膨胀。经由使囊紧缩并且将导管通过伤口从心室拉出,从而移除弗利导管。
所有的出血被吸入并且确定体积。
在完成对出血的控制之后,执行另一次超声波心动图。使用3-0聚丙烯缝线来缝合伤口。
格林乳酸溶液以推注(boluses)形式输注以将map维持在基线水平±5mmhg。一旦达到压力并且动物稳定5分钟,则执行另一次超声波心动图。此后,以前述方式在左心室中创建新的伤口。出血控制和所有其他操作与对右心室伤口所描述的那些相同。使用实例装置和弗利导管交替地在每一动物中重复前述方法两次。图5示出所用的方法的时间轴。
在完成所有四次伤口介入之后,经由注射t-61安乐死溶液(merckanimalhealthintervetcanadacorp.kirkland,qc)对动物实施安乐死。随后移除缝线并且测量每一伤口的尺寸。
在基线和在实验结束时获得动脉血样品以测量动脉血气(abg)、完整血细胞计数(cbc)、凝结曲线、肌钙蛋白、纤维蛋白原和血清乳酸盐。在插入之前和在实例装置或弗利导管处于适当的位置的时候执行术中超声波心动图。
使用学生t检验来分析两种方法之间的比较,并且p<0.05认为是统计学显著的。血液动力学数据和实验室数据以平均值±sd形式示出。超声心动图数据以从基线值变化的百分比形式示出。
结果
动物的平均体重为36.1±0.3kg。与基线相比,最终cbc值有显著的降低(p<0.05)。从心脏伤口的出血导致显著(p<0.05)降低的血红细胞计数rbc:5.3±0.3对3.9±0.3x1012/l,血红蛋白水平hgb:91±4.8对66.5±4.5g/dl,和血细胞比容hct:0.3±0.01对0.2±0.02l/l。
血小板计数和纤维蛋白原水平分别显著地降低,plt:271.5±30.9对223.2±16.1x109/l,p<0.05以及纤维蛋白原1.6±0.2对1.1±0.1g/dl,p<0.05。血凝素时间和活化血凝素时间与基线相比分别增加,pt:14.6±0.4对15.9±0.3秒,p<0.05以及aptt:10.6±0.4对12.18±0.2秒,p<0.05。
出血还导致休克,如与基线相比血清乳酸盐水平显著增加所证实的,2.6±0.3对4.8±0.9mmol/l,p<0.05。来自心脏伤口的出血与基线相比分别显著增加血清乳酸盐水平,2.6±0.3对4.8±0.9mmol/l,p<0.05。在基线与最终样品之间不存在abg值的统计学显著差异。肌钙蛋白水平与基线相比在伤口之后分别增加,0.2±0.005对0.9±0.07ng/ml,p<0.05。
图6a示出当使用所述装置时和当使用弗利导管时来自rv伤口的血液损失体积的图表。图6a表明与弗利导管(147.7±30.9ml)相比,当使用所述装置时来自rv伤口的出血(58.7±11.3ml)显著更少(p<0.05)。
图6b示出当使用所述装置时和当使用弗利导管时来自lv伤口的血液损失体积的图表。图6b表明与弗利导管(187.5±40.3ml)相比,使用实例装置(81.7±11.9ml)的来自lv伤口的出血显著更小(p<0.05)。
图6c示出当使用所述装置时和当使用弗利导管时心脏伤口的最终长度的图表。图6c表明与所述装置(1.53±0.02cm)相比,当使用弗利导管(1.8±0.1cm)控制出血时,心脏伤口的最终长度显著更长(p<0.05)。
对第一组和第二组伤口分别评价超声心动图数据。分析以下数据:
三尖瓣返流(tr)
二尖瓣返流(mr)
右心室面积分数变化(rvfac)
心博量(sv)
左心室射血分数(lvef)
术中超声波心动图数据还表明基于与基线比较的变化百分比,在5个测量值中的4个中,所述装置优于弗利导管。
mr的与基线相比的变化百分比是使用实例装置时100%增加对比使用弗利导管时51.5%增加。与插入弗利导管相比,通过插入实例装置,上文列出的其他超声波心动图参数的变化百分比的评价一致性地更低:tr(使用装置时66.6%增加对比使用弗利导管时400%增加);rvfac(使用实例装置时6.62%降低对比使用弗利导管时21.76%降低);sv(使用实例装置时2.09%降低对比使用弗利导管时12.48%降低);以及lvef(使用所述装置时0.46%降低对比使用弗利导管时5.45%降低)。
类似地,当所述装置或弗利导管用于先前修复的心脏伤口的环境中时,tr的与基线相比的变化百分比在插入所述装置时为203%增加,对比在插入弗利导管时为83%增加。在先前伤口的环境中,与插入弗利导管相比,通过插入实例装置,其他参数的变化百分比一致性地更低。即,mr(使用实例装置时无变化对比使用弗利导管时16%增加),rvfac(使用实例装置时3.9%增加对比使用弗利导管时7.8%增加),sv(使用实例装置时5.25%降低对比使用弗利导管时13.53%降低),和lvef(使用实例装置时5.78%降低对比使用弗利导管时8.03%降低)。
研究结果表明所述装置可以有效地控制出血并且可以在多个方面优于弗利导管。在研究中,通过损伤插入实例装置与插入弗利导管相比导致显著更少的出血。
所述装置还不需要牵引或囊膨胀来控制出血。与之相反,膨胀的囊不可避免地占据了原本应由血填充的心室内空间。这还可以导致血流堵塞。这可以干扰心脏功能,其对于呈现有穿透心脏损伤的患者而言是特别不期望的。研究结果还表明,与弗利导管相比,使用实例装置时超声波心动图参数的更小的变化,在心博量和左心室射血分数方面尤其显著。
通过由支座构件在心脏外表面上的下压力的组合与由血流阻断膜产生的心室内表面上的上压力之间保持平衡,实例装置堵塞心脏伤口。与之相反,仅由向上牵引获得使用弗利导管的伤口堵塞,由此产生针对心室内表面的压力。如果在导管上应用过度的牵引来控制出血,则针对心室内表面的由囊发挥的压力可以潜在地扩大伤口。这可以解释在此次研究中使用弗利导管之后伤口尺寸显著增加。
所述装置的血流阻断膜在其从心室移除时还保持对出血的连续控制。这有利于在明确的修复期间适当地布置缝线。另一方面,在移除弗利导管期间使囊紧缩经常导致从伤口的出血。此外,在不使囊紧缩的情况下尝试缝合来修复伤口,经常导致对囊的损伤和出血。
新的装置提供了在心室的穿刺心脏损伤中对出血的有效临时控制。此外,所述装置在出血控制和干扰心脏功能方面均优于弗利导管。
尽管上文描述提供了一个或多个方法或设备的实例,但是应认识到其他方法或设备可以在所附的权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!