竹节参皂苷Ⅳa在制备治疗高脂饮食致小鼠小肠干细胞的疾病上的应用的制作方法
本发明提供一种竹节参皂苷Ⅳa在制备治疗高脂饮食致小鼠小肠干细胞的疾病上的应用。
背景技术:
竹节参属五加科人参植物竹节干燥呈竹鞭状根茎,参具有补虚养阴、活络祛痰、活血止血、散瘀止痛等功效。现代药理研究表明,竹节参具有抗炎、抗氧化、免疫调节、保护心肌缺血、抗衰老等多种药理作用。皂苷类成分是其主要药效成分和研究最多的成分,研究表明竹节参总皂苷具有一定的降血脂作用,同时,其能够通过诱导细胞分化和周期组织抑制人白血病细胞HL-60的增殖。竹节参皂苷以齐墩果烷型皂苷为主,包括竹节参皂苷Ⅰa、Ⅰb、Ⅱ、Ⅲ、Ⅳ、Ⅳa、Ⅴ、pjs1、pjs2、pjs4等。
高脂饮食是肥胖症的重要诱因之一,而肥胖症作为一种慢性代谢性疾病,会导致许多慢性疾病而倍受关注。越来越多的实验和研究证明高脂饮食是许多类型肿瘤的致病因素,也有研究表明高脂饮食与肠道疾病密切相关,肥胖人群发展成为结直肠癌的风险更高。小肠是营养物质消化吸收的主要场所,黏膜柱状上皮细胞承担小肠主要的消化吸收功能,而小肠干细胞(Intestinal stem cells,ISCs)是小肠黏膜上皮细胞不断更新的源泉。小肠干细胞的增殖分化和维持自身平衡由干细胞微环境通过启动相关信号而调控,小肠干细胞所处的微环境由小肠干细胞及其周围细胞分泌的生长因子、细胞因子和细胞外基质等构成。Wnt/β-catenin信号是调节小肠干细胞微环境的主要信号,在小肠干细胞数量控制中起决定性作用。β-catenin作为Wnt/β-catenin信号的核心成分,其在细胞内水平的高低决定Wnt/β-catenin信号的传导,Wnt/β-catenin信号通过磷酸化的Disheveled蛋白将信号传至细胞内,抑制GSK-3β功能,促进β-catenin释放,进入细胞核进而启动一系列与干细胞增殖相关的基因表达。小肠干细胞具有旺盛的增殖分化功能,在异常刺激下可过度增殖分化。最新研究表明高脂饮食使得小肠干细胞的数量增加,也能够生成一群类似于干细胞的细胞,致其无限制的增殖并分化为其他类型的细胞,进而导致肠道肿瘤。
技术实现要素:
竹节参皂苷Ⅳa(Chikusetsu SaponinⅣa,CSⅣa)对小肠干细胞是否有调节作用尚不清楚,本发明应用高脂饲料建立高脂饮食小鼠模型,探讨高脂饮食小鼠小肠干细胞数量及增殖分化功能的变化,并进一步研究了其微环境Wnt/β-catenin信号通路的变化及竹节参皂苷Ⅳa对上述改变的调节作用。
材料与仪器
实验动物 雌雄各半C57BL小鼠40只,购于三峡大学医学院实验动物中心,生产许可证号:SCXK(鄂)2015-0018,分笼饲养,自由饮水和摄食。
药物与试剂 竹节参皂苷Ⅳa购自成都植标化纯生物技术有限公司;一抗Bmi1,Abcam公司;PCNA,苏州睿灜生物技术有限公司;β-catenin、GSK-3β,美国Cell Signaling technology公司;羊抗兔、兔抗鼠二抗,武汉科瑞生物技术有限公司;DAB试剂盒,迈新生物。
主要仪器 LEICA TP1020自动脱水机,LEICA EG1150H石蜡包埋机,LEICA EG1150C超薄切片机,德国Leica公司;CS-V1摊片烤片机,湖北孝感宏业医用仪器有限公司;CX41光学倒置显微镜,日本Olympus公司;JA2003电子分析天平,上海天平仪器厂。
方法
动物分组、造模及给药取雌雄各半C57BL小鼠40只,4-6周龄,随机分成4组,每组10只,即正常对照组,高脂饮食模型对照组,竹节参皂苷Ⅳa低(10mg/kg)、高(20mg/kg)剂量组。除正常对照组给予普通饲料外,其余各组均给予高脂饲料造模,同时竹节参皂苷Ⅳa低、高剂量组分别给予10mg/kg、20mg/kg的竹节参皂苷Ⅳa灌胃,每日一次,持续12w。
HE染色 小鼠腹腔注射给予350mg/kg水合氯醛麻醉后行心脏灌注,快速分离肠道组织截取3~5cm中段空肠,置于4%多聚甲醛固定24h,常规脱水,石蜡包埋,制备厚4μm连续横断切片,隔5张取1张。切片常规脱蜡至水,苏木精染色,盐酸乙醇分化,伊红染色,乙醇脱水,二甲苯透明,中性树脂封片。每组随机选取5只小鼠,每只小鼠小肠各取5张不连续切片,每张切片选取5根最长且柱状细胞排列整齐的肠绒毛,光学显微镜下观察不同组别小肠形态学变化,测量绒毛长度,隐窝深度,并计算绒毛/隐窝值(V/C值)。
PAS染色 石蜡切片常规脱蜡至水,1%高碘酸染色10min,schiff试剂避光反应15min,苏木精复染,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片。每组随机选取5只小鼠,每只小鼠小肠各取5张不连续切片,每张切片中选取5根最长且柱状细胞排列整齐的肠绒毛,光学显微镜下计数不同组每100个肠黏膜柱状上皮细胞间的杯状细胞的数量。
免疫组织化学染色 从各组中分别选取三只小鼠进行免疫组化研究,快速分离肠道组织截取3~5cm中段空肠,4%多聚甲醛灌注固定后常规脱水,石蜡包埋,制备厚4μm连续横断切片,防脱载玻片贴片,二甲苯脱蜡,梯度酒精脱水。柠檬酸盐缓冲液水浴修复30min,自然冷却至室温,PBS冲洗3次,每次5min,3%H2O2室温孵育10min,PBS冲洗3次,每次5min,血清封闭1h,加一抗4℃冰箱孵育过夜,复温20min,PBS冲洗3次,每次5min,加二抗室温孵育1h,PBS冲洗3次,每次5min,DAB反应显色,自来水冲洗,苏木精复染,盐酸乙醇分化,常规脱水,二甲苯透明,中性树胶封片。显微镜下观察结果、拍照并用图像分析系统进行分析。
统计学处理 实验数据采用SPSS 18.0软件分析,IHC数据采用Image-Pro Plus6.0软件分析,数据以x±s表示,组间采用单因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。
附图说明
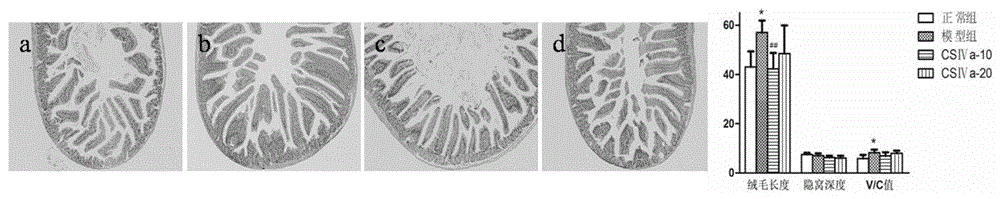
图1为竹节参皂苷Ⅳa对小肠形态学的影响(×100),a:正常组b:模型组c:竹节参皂苷Ⅳa低剂量组(10mg/kg)d:竹节参皂苷Ⅳa高剂量组(20mg/kg)与正常组比较,*P﹤0.05;与模型组比较,##P﹤0.01。
图2为竹节参皂苷Ⅳa对小肠干细胞增殖的影响(×400),a:正常组b:模型组c:竹节参皂苷Ⅳa低剂量组(10mg/kg)d:竹节参皂苷Ⅳa高剂量组(20mg/kg),与正常组比较,**P﹤0.01;与模型组比较,##P﹤0.01。
图3为竹节参皂苷Ⅳa对小肠杯状细胞数量的影响(×200.),a:正常组b:模型组c:竹节参皂苷Ⅳa低剂量组(10mg/kg)d:竹节参皂苷Ⅳa高剂量组(20mg/kg),与正常组比较,**P﹤0.01;与模型组比较,#P﹤0.05,##P﹤0.01。
图4为竹节参皂苷Ⅳa对小肠干细胞数量的影响(×400),a:正常组b:模型组c:竹节参皂苷Ⅳa低剂量组(10mg/kg)d:竹节参皂苷Ⅳa高剂量组(20mg/kg),与正常组比较,**P﹤0.01;与模型组比较,##P﹤0.01。
图5为竹节参皂苷Ⅳa对β-catenin表达量的影响(×400),a:正常组b:模型组c:竹节参皂苷Ⅳa低剂量组(10mg/kg)d:竹节参皂苷Ⅳa高剂量组(20mg/kg),与正常组比较,**P﹤0.01;与模型组比较,##P﹤0.01。
图6.竹节参皂苷Ⅳa对GSK-3β表达量的的影响(×400),注:a:正常组b:模型组c:竹节参皂苷Ⅳa低剂量组(10mg/kg)d:竹节参皂苷Ⅳa高剂量组(20mg/kg)与正常组比较,**P﹤0.01;与模型组比较,##P﹤0.01。
具体实施方式
竹节参皂苷Ⅳa对高脂饮食小鼠小肠形态学的影响
结果如图1所示,正常对照组小鼠小肠绒毛呈细指状,排列较宽松,高脂模型组小鼠小肠绒毛明显变长变粗,排列紧密且不规则。给予竹节参皂苷Ⅳa保护后,与高脂模型组比较,小鼠绒毛长度及排布情况都有所改善。利用Image-Pro Plus 6.0软件测量小肠绒毛长度、隐窝深度、计算V/C值。结果表明,高脂模型组与正常对照组比较,小肠绒毛长度和V/C值均增高,有统计学意义(P﹤0.05),但隐窝深度无明显变化。给予竹节参皂苷Ⅳa后,与高脂模型组比较,高剂量组和低剂量组绒毛长度均有所降低,但仅中剂量有统计学意义(P<0.01),V/C值有所降低,但隐窝深度无明显变化。
竹节参皂苷Ⅳa对高脂饮食小鼠小肠增殖能力的调节作用
结果如图2所示,与正常对照组比较,高脂模型组小肠隐窝处PCNA阳性细胞数量显著增高(P<0.01),给予竹节参皂苷Ⅳa保护后,与高脂模型组比较,高剂量组和低剂量组阳性细胞数量均显著降低(P<0.01)。
竹节参皂苷Ⅳa对高脂饮食小鼠小肠杯状细胞数量的调节作用
结果如图3所示,与正常对照组比较,高脂模型组杯状细胞数量显著上升(P<0.01)。给予竹节参皂苷Ⅳa保护后,与高脂模型组比较,高剂量组杯状细胞数量显著降低(P<0.01),低剂量组杯状细胞数量有所降低且具有统计学意义(P<0.05)。
竹节参皂苷Ⅳa对高脂饮食小鼠小肠干细胞数量的影响
Bmi1是ISCs特异性的标记物。结果如图2所示,与正常对照组比较,高脂模型组小肠隐窝处Bmi1阳性细胞数量显著增多(P<0.01),给予竹节参皂苷Ⅳa保护后,与高脂模型组比较,高剂量组和低剂量组的Bmi1阳性细胞数量均显著降低(P<0.01)。
竹节参皂苷Ⅳa对Wnt/β-catenin信号的调节
β-catenin免疫组化染色结果如图5所示,与正常对照组比较,高脂饮食模型组β-catenin的表达量显著增高(P<0.01),给予竹节参皂苷Ⅳa保护后,与高脂模型组比较,高剂量组和低剂量组的表达量均显著降低(P<0.01)。GSK-3β免疫组化染色结果如图6所示,与正常对照组比较,高脂饮食模型组GSK-3β的表达量显著降低(P<0.01)给予竹节参皂苷Ⅳa保护后,与高脂模型组比较,高剂量组和低剂量组的表达量均显著增高(P<0.01)。
- 还没有人留言评论。精彩留言会获得点赞!