一种欧前胡素柔性脂质体及其制备方法和应用与流程
本发明涉及柔性脂质体领域,特别涉及一种欧前胡素柔性脂质体;本发明还涉及上述脂质体的制备方法以及该脂质体的应用。
背景技术:
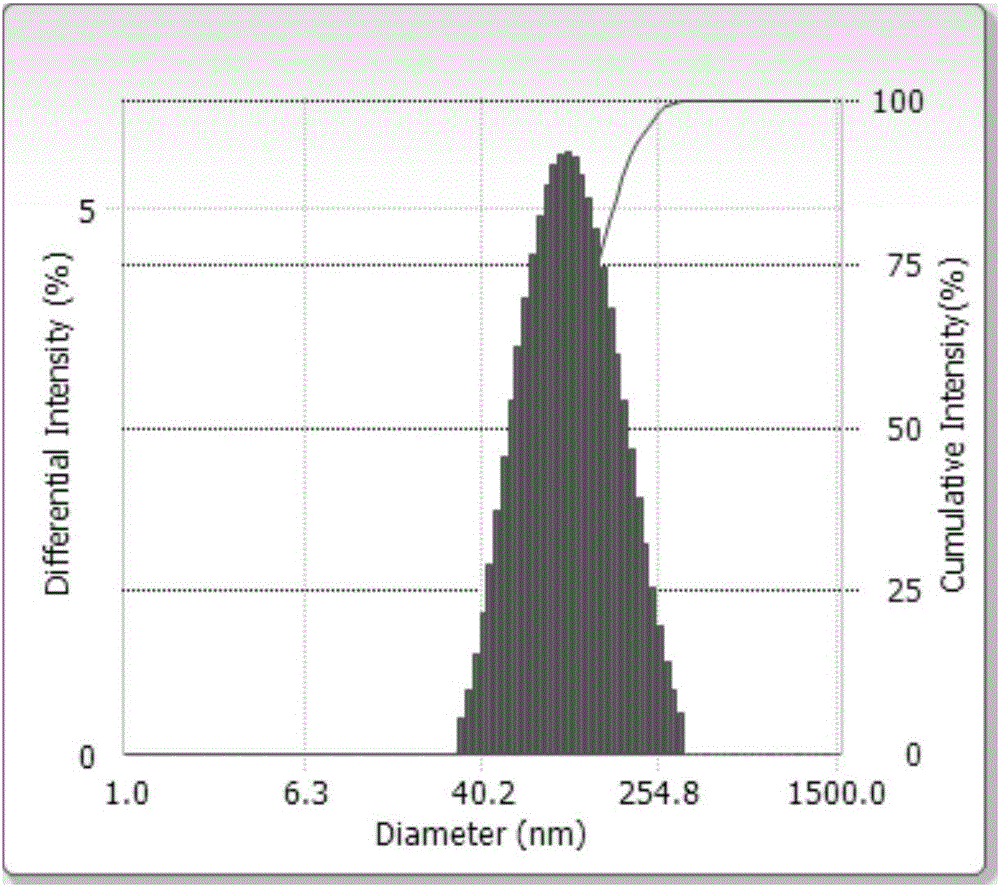
:柔性脂质体是由普通脂质体经处方改进而来,即在脂质体的磷脂成分中不加或者少加胆固醇,同时加入了表面活性剂如胆酸钠、聚氧乙烯脱水山梨醇单油酸酯(吐温)等作为膜软化剂,使脂质体的类脂膜具有高度的变形能力,通过皮肤层内外渗透压差的驱动,柔性脂质体能高效穿透比其自身小数倍的角质细胞间的孔道,再经过多次变形,到达皮肤深处后其组成不变。柔性脂质体从皮肤表层开始渗透逐渐到达真皮,随后是更深的组织,当周边地区饱和后,再经由淋巴系统进入血液。柔性脂质体能够显著增加药物的经皮渗透,增强药物的作用疗效,降低刺激和减少不良反应,提高生物利用度,因此柔性脂质体越来越广泛地成为各种大分子,脂溶性药物及水溶性药物的载体。常用的具有解热、镇痛、抗炎作用的伞形科植物如白芷、前胡、羌活等均含有香豆素类(TCP)物质,如欧前胡素(Imperatorin)、异欧前胡素(Isoimperatorin)、羌活醇(Notopterol)、补骨脂素(Psoralen)等,其中的欧前胡素是主要的药理效应成分之一。据研究表明,欧前胡素的主要药理作用有:(1)抗炎作用:通过体内外试验研究对卵白蛋白诱导变应性鼻炎小鼠模型的作用发现,欧前胡素能调节caspase-1的活性从而产生抗炎作用;选用角叉菜胶致大鼠急性胸膜炎模型进行抗炎实验,发现欧前胡素能抑制花生四烯酸代谢产物的产生、抑制促炎细胞因子释放,从而减少小鼠炎性渗出液的体积,降低白细胞计数,降低渗出液中PEG2、IL-1β、TNF-α含量,降低肺组织中MDA的含量;(2)镇痛作用:对小鼠采用热板法、醋酸扭体法等研究白芷中欧前胡素主要线型呋喃香豆素的成分的镇痛活性,发现欧前胡素能显著减少醋酸所致的小鼠的扭体次数,还能明显延迟小鼠扭体的出现;而且欧前胡素具有显著的镇痛作用,能明显抑制热板法所致的小鼠疼痛,在具有镇痛活性的成分中欧前胡素的镇痛作用最强;(3)抗菌、抗病毒作用:对大肠杆菌、弗氏痢疾杆菌、变形杆菌、伤寒杆菌具有不同程度的抑制作用,对革兰阳性菌和革兰阴性菌均有较强的抑制活性(最小抑菌浓度32~128m/ml),还能够抑制水泡性口腔炎病毒假型或糖蛋白gpl60包膜的人类免疫缺陷病毒I型(HIV-1)对T细胞和Hela细胞的感染;(4)解痉作用:通过家兔离体回肠法观察欧前胡素的解痉活性,发现欧前胡素能明显缓解BaCl2所致兔肠平滑肌痉挛,欧前胡素能缓解不同物质导致的平滑肌强直性收缩及痉挛,解痉作用与罂粟碱的作用相当,毒性较低使用安全;(5)其它作用:具有舒张血管活性的作用,欧前胡素通过作用于NO通路,能抑制血管壁增厚,并具有抑制心肌肥大、肥厚的作用,从而对高血压、动脉粥样硬化和肥厚型心肌病等有治疗作用。因此,欧前胡素可以开发成为一种抗炎镇痛的新产品。欧前胡素难溶于水,皮肤渗透性差,不易透过皮肤产生吸收,制备成传统脂质体其透皮效率低,倾向于停留在皮肤角质层表层,无法到达到皮肤深处,因而制备成柔性脂质体有利于提高经皮渗透吸收。目前国内外在欧前胡素脂质体剂型研究暂时处于空白,将其制备成柔性脂质体的方法具有极大的潜在价值。技术实现要素:本发明要解决的技术问题是针对现有技术的上述不足,提供一种包封率高,粒径小,体外累计渗透量高,稳定性好的欧前胡素柔性脂质体。本发明要解决的另一个技术问题是提供一种上述脂质体的制备方法,以保证脂质体的分布均匀性。本发明还提供一种上述脂质体在制备皮肤外用抗炎镇痛药品中的应用。为解决上述技术问题,本发明的前一技术方案是这样的:一种欧前胡素柔性脂质体,所述的柔性脂质体包括以下组分:欧前胡素、大豆卵磷脂、胆固醇、吐温80及泊洛沙姆P188。需要说明的是,欧前胡素与大豆卵磷脂、胆固醇的质量比例为1:25:1.5~1:35:1.5。需要说明的是,大豆卵磷脂与吐温80、泊洛沙姆P188质量比例为5.6:0.5:1.8~5.6:3:1.9。需要说明的是,所述的脂质体粒径为100~300nm。本发明的后一技术方案这这样的:一种欧前胡素柔性脂质体的制备方法,包括以下步骤:步骤1:按比例称取欧前胡素、大豆卵磷脂、胆固醇,加入吐温80乙醇溶液加热振荡至溶解;步骤2:在水浴条件下使用真空旋转蒸发器,除去有机溶剂,形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠及泊洛沙姆P188水溶液,旋转水化至洗脱,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声即分散完毕,放置冰箱4℃保存。需要说明的是,步骤1所述的吐温80乙醇溶液的浓度为5~20mg/ml。需要说明的是,步骤2所述的水浴温度为40~60℃。需要说明的是,步骤3所述的旋转水化时间为0.5~2h。需要说明的是,步骤4所述的探头超声时间为10~20min。本发明还公开了上述的欧前胡素柔性脂质体在制备皮肤外用抗炎镇痛药品中的应用。本发明与传统方法相比,具有以下优势:1、本发明所制备的欧前胡素柔性脂质体把欧前胡素包裹在双磷脂层中,保证了包裹的活性成分具有良好的稳定性,同时修饰了脂质体磷脂层的流动性,具备柔性性质,产生弹性和形变更好地渗透入皮肤深层,极大增加透皮吸收效果,使用泊洛沙姆P188作为水化溶液可使脂质体表面稳定,使得脂质体间相互排斥避免絮集,增加了稳定性,提高欧前胡素的经皮渗透吸收,延长药物的皮肤渗透作用时间,提高在皮肤内的滞留时间,生物利用度得到有效增长;2、本发明所制备的欧前胡素柔性脂质体的包封率达60~80%,粒径范围处于50~200nm中,表面电位为-(30~50)mv,体外累积渗透量达40~60%,稳定性好;3、本发明所述的制备方法简单方便,易于工业化,同时反应条件温和,整个工艺过程机械化程度高,使产品质量和工艺具由良好的重现性和稳定性。附图说明图1为实施例4所制得的欧前胡素柔性脂质体的粒径分布图;图2为实施例4所制得的欧前胡素柔性脂质体的Zeta电位图;图3为实施例1-4所制得的欧前胡素脂质体与饱和溶液的经皮渗透吸收曲线图。具体实施方式下面结合具体实施方式,对本发明的权利要求做进一步的详细说明,但不构成对本发明的任何限制,任何在本发明权利要求范围内所做的有限次的修改,仍在本发明的权利要求保护范围内。实施例1:步骤1:分别称取欧前胡素30mg、大豆卵磷脂900mg、胆固醇45mg置于1L圆底烧瓶中,加入无水乙醇20ml在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠及30ml去离子水,旋转30min将薄膜从瓶壁水化至从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素普通脂质体粒径大小为(118.20±3.00)nm,Zeta电位大小为(-40.87±1.14)mv,透析袋方法测得包封率为(70.70±0.28)%,呈现白色混悬液,静置底部有絮状物,摇动可变均匀乳白色。实施例2:步骤1:分别称取欧前胡素30mg、大豆卵磷脂900mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液16ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠及1%泊洛沙姆P188溶液30ml,旋转30min将薄膜从瓶壁水化至从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素柔性脂质体粒径大小为(116.47±2.39)nm,Zeta电位大小为(-42.87±1.22)mv,透析袋方法测得包封率为(71.26±2.00)%,呈现白色混悬液,摇动可变均匀乳白色。实施例3:步骤1:分别称取欧前胡素30mg、大豆卵磷脂900mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液16ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠,加入1%十二烷基硫酸钠溶液30ml,继续旋转水化40min,至薄膜层从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素阴离子柔性脂质体粒径大小为(77.47±0.80)nm,Zeta电位大小为(-63.99±1.45)mv,透析袋方法测得包封率为(69.60±1.05)%,呈现澄清透明溶液液,静置无变化。实施例4:步骤1:分别称取欧前胡素30mg、大豆卵磷脂900mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液16ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠,加入1%十六烷基三甲基溴化铵溶液30ml,继续旋转水化40min,至薄膜层从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。如图1所示,所得的欧前胡素柔性阳离子脂质体粒径大小为(102.40±1.15)nm,如图2所示,Zeta电位大小为(62.68±1.68)mv。透析袋方法测得包封率为(75.22±0.89)%,呈现澄清透明溶液液,静置无变化。实施例5步骤1:分别称取欧前胡素30mg、大豆卵磷脂750mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液13.2ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠,加入0.6%泊洛沙姆P188溶液30ml,继续旋转水化40min,至薄膜层从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素柔性脂质体粒径大小为(124.26±0.83)nm,Zeta电位大小为(-41.34±1.62)mv,透析袋方法测得包封率为(42.51±1.56)%,呈现澄清透明溶液,静置过夜后出现混悬状态,摇晃可澄清。实施例6步骤1:分别称取欧前胡素30mg、大豆卵磷脂1050mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液18.5ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠,加入0.8%泊洛沙姆P188溶液30ml,继续旋转水化40min,至薄膜层从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素柔性脂质体粒径大小为(148.71±1.42)nm,Zeta电位大小为(-43.73±1.12)mv,透析袋方法测得包封率为(67.34±2.01)%,呈现澄清透明溶液液,静置无变化。实施例7步骤1:分别称取欧前胡素30mg、大豆卵磷脂900mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液8ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠,加入0.8%泊洛沙姆P188溶液30ml,继续旋转水化40min,至薄膜层从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素柔性脂质体粒径大小为(137.71±0.83)nm,Zeta电位大小为(-36.81±0.73)mv,透析袋方法测得包封率为(63.81±1.21)%,呈现澄清透明溶液液,静置无变化。实施例8步骤1:分别称取欧前胡素30mg、大豆卵磷脂900mg、胆固醇45mg置于1L圆底烧瓶中,加入吐温浓度为10mg/ml的乙醇溶液24ml,在45℃水浴恒温下加热溶解;步骤2:在水浴温度45℃恒温水浴条件下使用真空旋转蒸发器,减压蒸发40min除去有机溶剂使类脂溶液在瓶壁形成一层均匀的薄膜;步骤3:向薄膜层中加入适量的小玻璃珠,加入0.8%泊洛沙姆P188溶液30ml,继续旋转水化40min,至薄膜层从瓶壁被洗脱下来,即得欧前胡素脂质体混悬液;步骤4:在冰浴条件下将脂质体用探头超声15min,每3s间歇一次,功率为150W,超声分散完毕即得,放置冰箱4℃保存。本实施例所得的欧前胡素柔性脂质体粒径大小为(104.28±1.42)nm,Zeta电位大小为(-45.62±0.33)mv,透析袋方法测得包封率为(68.32±0.62)%,呈现澄清透明溶液液,静置无变化。实施例9:对脂质体稳定性进行测定:取实施例2所制得的欧前胡素柔性脂质体于冰箱4℃条件下保存,分别于0天、15天及30天测定其包封率,粒径、Zeta电位,并观察外观,以确定其稳定性,其结果如表1所示:表1欧前胡素柔性脂质体稳定性结果从表1可以看出,欧前胡素柔性脂质体在4℃条件下稳定性良好,0天、15天及30天各项结果没有显著性差异(p>0.05),可预测欧前胡素柔性脂质体的稳定性良好。实施例10对柔性脂质体的体外透皮吸收性能进行测试:取健康体重合格的SD大鼠,颈椎脱臼处死,用8%的硫化钠溶液把腹部皮肤进行脱毛处理,然后将腹部皮肤剥离,剔除该皮肤皮下脂肪组织及筋膜,用生理盐水冲洗干净保存使用;使用改良的Franz扩散池进行透皮吸收实验,将皮肤夹于双室扩散池中间,角质层面向供给池,真皮层面面向接收池;供给池分别注入1ml的欧前胡素饱和水溶液、欧前胡素普通脂质体、欧前胡素柔性脂质体、欧前胡素阴离子柔性脂质体及欧前胡素阳离子柔性脂质体,接收池分别注入3%吐温水溶液17ml,在0.5、1、2、4、6、8、12、24h时间取2ml接受液并补充相应的释放介质,采用HPLC方法测定欧前胡素含量,计算累计透皮渗透量,每个样品平行实验三次取SD值。图3为实施例1-4所制得的欧前胡素脂质体与饱和溶液的经皮渗透吸收曲线图,可以看出所有脂质体均有很好的透皮渗透能力,欧前胡素普通脂质体、欧前胡素柔性脂质体、欧前胡素阴离子柔性脂质体及欧前胡素阳离子柔性脂质体的透皮累积渗透量分别是饱和水溶液的18.07倍、21.88倍、17.40倍、14.66倍。表2为实施例1-实施例4所制得的不同欧前胡素样品在大鼠鼠皮的累积渗透量,可以看出柔性脂质体透皮渗透量最高,原因为柔性脂质体增强了脂质体对皮肤表层的渗透性,脂质体本身柔性特质的发挥,使得脂质体的透皮能力大大增强,将载入药物带入皮肤深层次结构层,比普通脂质体效果更好,相比阴离子柔性脂质体和阳离子柔性脂质体,可以看出脂质体表面带高浓度离子对透皮渗透有阻碍作用,透皮效果甚至低于普通脂质体,没有得到有效的提高,综合对比发现,表明带柔性脂质体具有相当良好的皮肤透过性能,有利于活性成分的作用的充分发挥。表2不同欧前胡素样品在大鼠鼠皮的累积渗透量样品24h平均累积渗透量(%)SD饱和水溶液2.530.08普通脂质体(实施例1)45.722.21柔性脂质体(实施例2)55.382.57阴离子柔性脂质体(实施例3)44.031.25阳离子柔性脂质体(实施例4)37.091.52以上所述的仅为本发明的较佳实施例,凡在本发明的精神和原则范围内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1