一种低温等离子体诱导热声成像方法与流程
本发明涉及一种低温等离子体诱导热声成像方法,特别涉及一种适用于生物医学应用的脉冲低温等离子体诱导的高分辨率功能性成像方法。
背景技术:
医学影像技术,尤其是功能性医学影像技术,在健康工程和疾病的早期诊断中占有重要的地位和作用。目前临床用于疾病诊断的成像方法如X光、CT、超声、MRI,只能发现一定尺寸的肿块,导致多数病人错过了肿瘤早期发现、早期治疗的最佳时机,因此研究开发早期筛查和早期诊断的方法、技术一直是国内外关注并重点研究的领域。
生物组织的“电磁(光)热声成像”对生物组织介电谱敏感,具有电磁(或光学)成像的高对比度和超声成像的高分辨率的特点,成为研究热点。其中的热声成像技术具备无损和功能成像的技术特点,是继形态、结构成像之后的新一代医学成像方法。该技术在1981年首次由T.Bowen提出并完成了生物组织热声成像的可行性实验,根据热源激励方法不同可分为微波热声、光声以及最近几年发展起来的磁热声成像。
微波热声由于受脉宽的限制,分辨率一直处于mm量级。2010年德国慕尼黑理工大学亥姆霍兹中心Ntziachristos研究小组利用10ns脉宽,100MHz的传输线系统实现170μm分辨率的微波热声成像;2012年华南师范大学邢达教授利用超短脉宽微波源实现100μm分辨率的热声成像,进一步推动了热声成像技术向临床的应用发展。
为提高光声成像分辨率,研究者从激光激励聚焦和超声检测聚焦两个方面考虑,提出了声学分辨率的光声显微成像(ARPAM)和光学分辨率的光声显微成像(ORPAM)。2012年美国佛罗里达大学Xi利用ARPAM实现了老鼠耳朵血管成像,成像分辨率4.8μm,随后利用ORPAM实现了0.22μm的分辨率,可完成组织细胞核、黑色素体的成像。
磁热声成像是由新加坡南洋理工大学在2013年首次提出的。该技术与微波热声成像相比,激励频率低、探测深度深、非接触辐射低,是一种具有广泛应用前景的功能性成像技术。新方法一经提出就受到国内外学者的广泛关注,法国的里昂大学、天津生物医学工程研究所、南京师范大学、中国科学院电工研究所、中国石油大学、青岛大学等从不同角度对磁热声成像进行研究,2016年中科院电工研究所利用注入式磁声方式获得离体猪肉组织的电磁热吸收图像。
另一方面,随着科学技术的不断发展,低温等离子体作为一种生物医学技术,自从1968年第一次报道用氩离子体杀菌后,低温等离子体在医疗器械杀菌、凝血、龋齿治疗、治疗肿瘤等多个领域得到应用。
在脉冲低温等离子体射流中,局部电离的惰性气体离子在单脉冲的作用下形成“单发等离子体子弹”,在空间上产生局部电荷分离、激发空间电场。空间电场在射流中向前传播,通过等离子体能够耦合到被测组织表面的一个微小区域中,实现电磁聚焦。
结合热声成像的特点和低温等离子体射流的优势,本发明提出一种基于纳秒脉冲低温等离子体诱导超声的功能性微成像技术。该技术利用纳秒脉冲低温等离子体微射流技术与高频聚焦超声阵列相结合,通过电磁聚焦和超声聚焦有望实现微米量级的高分辨率生物组织成像,新的成像方法具有高对比度、高穿透性、高分辨率的优势,在国际上首次提出将脉冲低温等离子射流作为一种与组织直接接触的等离子态激励方式,能够使脉冲电磁能量有效地耦合到微小的局部组织中,避免了常规固态电极振动噪声的干扰,是一种创新性的热声信号激励方式。由于生物电阻抗的变化通常出现在组织细胞癌变初期,先于密度和弹性的变化,因此基于电阻抗的热声成像方法具备癌症早期诊断的独特优势;同时该方法将电阻抗功能性成像与超声高分辨率成像的优势相结合,大大提高了电阻抗成像的精确度,是当前生物医学成像研究的热点。低温等离子体作用于生物组织时能量高,斑束小,剂量可控,操作方便,不会产生热损伤和辐射损伤;由其诱导的热声成像方法还能在常规低温等离子体射流应用(如:抑制肿瘤细胞、杀菌消毒、止血等)的基础上实现高分辨率的电阻抗微成像,对常规等离子体治疗效果进行实时评估,具备辅助治疗和动态监测的独特优势,所形成的仪器设备将在癌症、心脏疾病等重大疾病的早期诊断研究上有突破性的应用,为我国人口与健康领域提供全新而可靠的研究和临床诊断手段。
技术实现要素:
本发明专利将纳秒脉冲激励的“低温等离子体射流”作用于生物组织,使生物组织吸收等离子体射流能量产生热效应,引起瞬态的热膨胀,激发热弹性的高频超声信号。根据正常组织与病变组织的电阻抗和对等离子体射流光谱吸收系数不同,进而对等离子体射流能量的吸收也不同,使该热声信号携带了组织内部的电阻抗和对射流光谱吸收强度的信息;利用声源重建算法,能在微米尺度上获得与电阻抗和光谱吸收系数相关的热声源图像,为疾病的早期诊断提供高分辨率和高对比度的生物组织医学影像。
低温等离子体诱导热声成像方法,其特征在于利用高压脉冲激励低温等离子体射流,并作用于待测物质表面,在射流作用点附近引起瞬态的热效应,激发热弹性的超声信号。
由低温等离子体射流诱导的超声信号是与下述两个物理量有关:被测对象对射流发射光谱的吸收强度和生物组织的电阻抗。因此,激发的超声信号携带了生物组织对射流光谱的吸收系数和电阻抗信息,适用于针对光吸收系数与电阻抗特性的多参数融合成像。
通过环绕在待测物体周围的超声换能器阵列测量超声信号,采用时间反转法或滤波反投影算法处理阵列超声数据,可实现分布热声源的图像重建;该分布热声源图像在低温等离子体射流激励模式下,能够获得电阻抗和射流光谱吸收系数相结合的多种参数融合图像。
为了产生生物安全的低温等离子体射流,降低作用于生物组织时的热损伤和电磁辐射,低温等离子体射流装置采用双石英管(电介质)阻挡放电形式,以氦气或氩气为工作气体,并采用纳秒级高压脉冲,以较低的重复频率循环激励;在超声信号测量中,测量过程需要在低温等离子体射流激励脉冲的同步下进行,每次脉冲激励过后,延迟一定的超声传输时间,等超声信号到达超声探头时记录数据,然后再开启下一次脉冲激励和检测过程,以此循环测量。
为了获取组织成像区域的所有超声信号,采用激励和检测的双聚焦扫描模式:脉冲激励的低温等离子体射流在生物组织表面形成一个直径为微米量级的接触斑束,实现热激励的点集中模式;超声检测方面,通过超声相控阵实现分布超声源的聚焦检测;通过扫描移动射流斑束的位置改变激励点,通过改变阵列超声探头的聚焦点,跟踪射流激励点,获取所有扫描点附近激发的超声信号。
附图说明
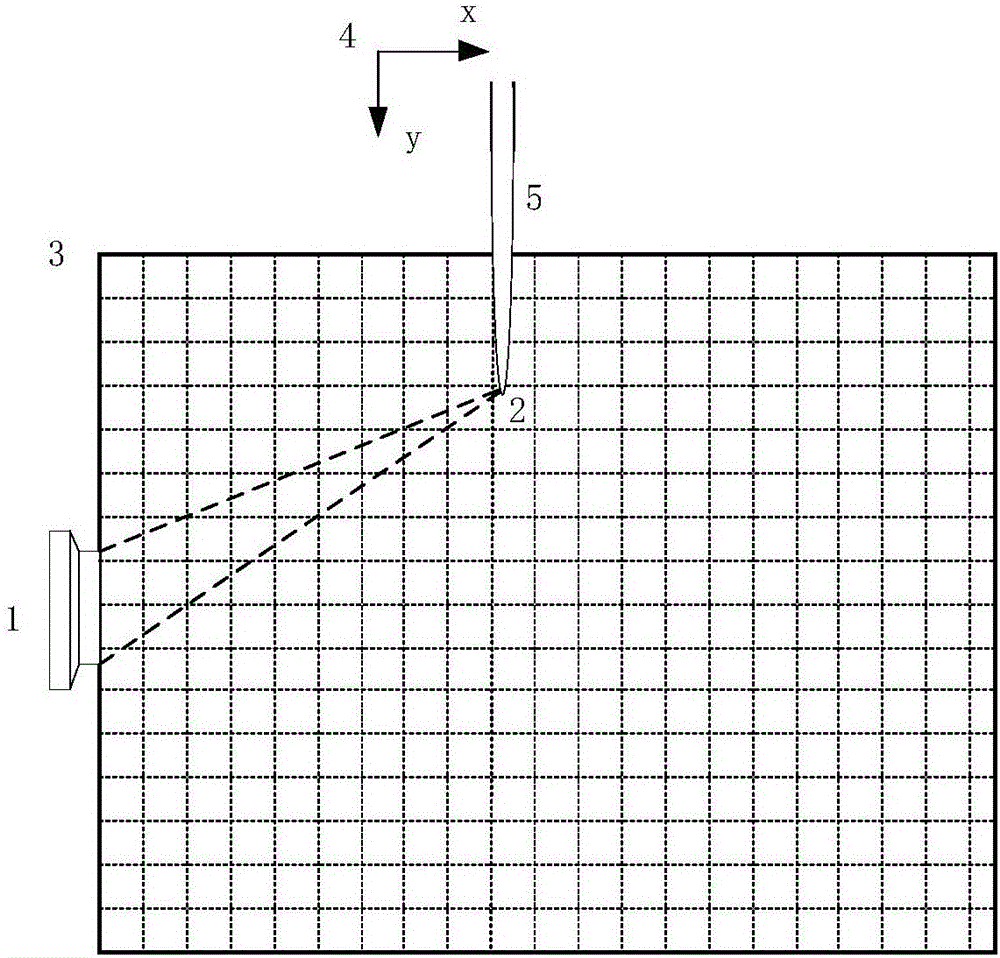
图1纳秒脉冲激励低温等离子体诱导热声成像原理示意图。
图中:1高压纳秒脉冲发生器,2相控阵超声成像设备,3同步脉冲传输光纤,4内部高压脉冲电极,5外部接地电极,6内、外石英玻璃管,7氦气(氩气)源,8低温等离子体射流发生装置,9气体和气路,10介质阻挡放电腔,11低温等离子体射流,12射流激励点,13成像目标体,14超声换能器,15超声聚焦点,16探头与成像设备连接线,17病变区域。
图2低温等离子体激励扫描与相控阵聚焦原理示意图。
图中:1超声阵列探头,2等离子体扫描点和相控阵聚焦点,3成像区域,4运动扫描坐标,5低温等离子体射流。
图3激励和检测同步时序图。
图中:1纳秒高压脉冲同步信号,2 1#阵元采集脉冲序列,2 2#阵元采集脉冲序列,128#阵元采集脉冲序列,5超声渡越时间,6有效采集数据区,7第一个扫描点时序,8超声数据采集脉冲,9数据预处理、滤波、存储时间,10第j个扫描点时序。
具体实施方式
下面结合附图和具体实施方式对本发明做进一步说明。
在脉冲低温等离子体射流中,局部电离的惰性气体离子在单脉冲的作用下形成“单发等离子体子弹”,在空间上产生局部电荷分离、激发空间电场。空间电场在射流中向前传播,通过等离子体通道耦合到被测介质表面的一个微小区域中,将电磁能量诱导至目标体内部,引发电-热-声效应。
另一方面,由于低温等离子体射流的气体击穿过程主要以光电离为主,射流内部产生较强的光子,光波频率由工作气体和环境气体决定,主要处于紫外波段。这部分光子射入目标体内部,同样引发光声效应。
不论是光声效应还是电-热-声效应都可在目标体内部产生瞬态的热激励,引发瞬态热膨胀,激发超声信号。其中涉及了多种物理场的耦合过程:电磁场与热力学场的耦合、光波与热力学场的耦合、热力学场与超声波的耦合等。由于等离子射流本身的声阻抗(类似于气体声阻抗)与被测目标体的声阻抗相差很大,所以等离子体射流内部的声场很难传入目标体中,声阻抗的差异对等离子体中的噪声起到了屏蔽作用。
根据上述原理,本发明在“脉冲低温等离子体射流”激励作用下,利用目标体的电特性与瞬态热膨胀、光吸收与瞬态热膨胀之间的双重耦合效应激发超声信号,是本发明的核心内容之一。利用超声相控阵探头探测这个超声信号,可以实现对目标体电阻抗与光吸收系数的混合探测与成像。
如附图1所示,该方法涉及的成像装置由1高压纳秒脉冲发生器、2相控阵超声成像设备和8低温等离子体射流发生装置三部分组成。
高压纳秒脉冲发生装置能够产生脉宽在200纳秒,电压在30KV以内可调,重复频率在10KHz以内可调的高压脉冲,并通过高压传输线加载到放电机构的两个电极上。
低温等离子体射流发生装置由放电机构和7氦气(或氩气)源两部分组成。整个放电机构由直径不等的内、外两个6石英玻璃管嵌套而成,内石英玻璃管直径小、最下端封口,内部放置一个4高压电极。10外部石英玻璃管直径大,包裹在内石英玻璃管外,上、下两端均开口,在上端开口处的内、外两个石英玻璃管中间通入9工作气体,通过下端小直径开口的喷嘴产生11低温等离子体射流。在外石英玻璃管的喷嘴附近安放5外部接地电极,内外电极之间形成两层石英玻璃管和工作气体构成的三层电解质。其中工作气体处于两个石英玻璃管中间,在加入高压脉冲后产生介质阻挡放电。由于两个玻璃管的阻挡作用,在高压放电的基础上又限制了放电电流,通过调节合理的尺寸参数和电源参数,可产生能与人体安全接触的低温等离子体射流,其温度和电流密度均不会对人体造成伤害。
高压纳秒脉冲激励低温等离子体射流,作用于13成像目标体产生超声信号。这个超声信号也需要在同一个3同步脉冲的同步下进行采集。为了获得不同射流激励点处产生的超声信号,本发明采用14阵列超声探头,根据扫描点的位置编程配置相控阵的聚焦点,实现12等离子体激励点和15相控阵聚焦点的位置与时序的严格同步。
激励扫描与相控阵聚焦原理示意图如附图2所示,1相控阵超声阵列探头与5低温等离子体射流聚焦于同一个2聚焦点。这个聚焦点在成像区域内沿着4扫描运动坐标同步移动扫描,对每个扫描点2都获取一组阵列超声数据,得到2点的声源强度。最终从相控阵超声成像设备获得的测量数据中提取聚焦点处的声场强度,采用被动式相控阵声源重建算法构建声源强度的分布图像,也就是热声源图像。这个热声源图像融合了目标体中每一点对低温等离子体吸收强度信息和电阻抗信息,能够区分生物组织的早期病变区域,并且具有微米量级分辨率。
激励和检测同步时序图如附图3所示。在纳秒高压脉冲同步信号的同步下,经历固定的超声渡越时间,启动阵列探头的数据采集。多路阵列探头同步采集超声信号,当距离激励点最远的超声探头阵元数据采集完成后,结束第一个激励点的数据采集,进行简单的数据预处理后,存储待用。以同样的步骤扫描采集成像区域内每个点的超声数据,获取所有扫描点的阵列超声信号。
本发明中采用的被动式相控阵成像算法,就是对于每个扫描点j的阵列超声数据,首先计算出单个超声探头阵元i距离扫描点的距离,利用目标体中的声速,获得每个振源到激励点之间的超声传输时间ti,j。将各个超声探头阵元采集的数据中与这个超声传输时间相对应的检测值叠加,获得该激励点的声源强度。
- 还没有人留言评论。精彩留言会获得点赞!