脂肪来源间充质干细胞外泌体在制备治疗脂肪组织炎症药物中的应用的制作方法
本发明涉及生物医药技术领域,具体涉及脂肪来源间充质干细胞外泌体在制备治疗脂肪组织炎症药物中的应用。
背景技术:
脂肪组织局部内皮细胞、脂肪细胞以及原驻的巨噬细胞三者相互作用,影响脂肪组织的稳态和功能。肥胖可以诱发脂肪细胞肥大,使其产生并释放大量促炎细胞因子如tnf-α、il-6、mcp-1等。这些促炎细胞因子的产生会上调内皮细胞的粘附分子、增加血管通透性,进而募集并活化大量巨噬细胞,扩大炎症反应,最终发展成为慢性脂肪组织炎症。脂肪组织中的巨噬细胞在脂肪组织炎症中起重要作用,脂肪组织中巨噬细胞的浸润活化以及大量促炎细胞因子tnf-α、il-6和il-12的释放是脂肪组织炎症的主要表现。慢性脂肪组织炎症是胰岛素抵抗以及ⅱ型糖尿病的重要始发因素。因此控制脂肪组织炎症是防治糖尿病和心血管等疾病发生发展的关键环节。
脂肪来源间充质干细胞(adsc)存在于脂肪组织的血管基质成分(svf)中,具有自我更新和多向分化潜能。adsc在体外可被诱导分化为脂肪细胞、骨细胞、软骨细胞和内皮细胞等不同的组织细胞,是目前组织修复和再生领域的研究重点和热点。脂肪来源间充质干细胞外泌体可以携带具有生物学活性的蛋白质和rna等物质,将有效成分及信息高效传递至受体细胞,在细胞间的信息交流中起重要作用。
目前对于脂肪来源间充质干细胞的研究主要涉及在肾脏、眼底疾病中的用途(cn102048756a)、在治疗勃起功能障碍的用途(cn105902568a)、在制备肝纤维化治疗制剂的用途(cn103436555a)、在制备治疗骨性关节炎制剂的用途(cn105748519a)、在制备肝癌化疗增敏制剂中的用途(cn103451152a)等,但迄今还未有关于脂肪来源间充质干细胞及其外泌体在治疗脂肪组织炎症反应的报道。
技术实现要素:
针对上述现有技术,本发明的目的提供脂肪来源间充质干细胞外泌体在制备治疗脂肪组织炎症药物中的应用。
本发明研究发现,脂肪来源间充质干细胞外泌体能够抑制腹内脂肪组织巨噬细胞的浸润活化,并抑制促炎细胞因子的产生和释放,对脂肪组织炎症具有很好的抑制效果,由此提出了下述的发明内容:
本发明的第一方面,提供脂肪来源间充质干细胞外泌体在制备治疗脂肪组织炎症药物中的应用。
本发明中,所述脂肪来源间充质干细胞外泌体由如下方法制备而成:
(1)将剥离的脂肪组织分散于消化液中,以产生细胞悬浮液;
(2)离心细胞悬浮液,以形成细胞沉淀,分离沉淀,洗涤,得到含有脂肪来源间充质干细胞(adsc)的血管基质成分(svf);
(3)在体外培养体系中对adsc进行扩增培养,收集扩增培养后的上清液,浓缩,向浓缩后的上清液中加入外泌体提取试剂,即提取得到脂肪来源间充质干细胞外泌体。
优选的,步骤(1)中,所述消化液是由krb缓冲液和ⅰ型胶原酶组成;更优选的,krb缓冲液和ⅰ型胶原酶的组成比例为1ml:2mg。
优选的,步骤(2)中,离心转速为2000rpm,离心时间为5分钟。
优选的,步骤(3)中,扩增培养的条件为:用不含外泌体的10%胎牛血清的dmem培养基(含有bfgf)培养adsc。
优选的,步骤(3)中,所述外泌体提取试剂为exoquick-tctm外泌体提取试剂。
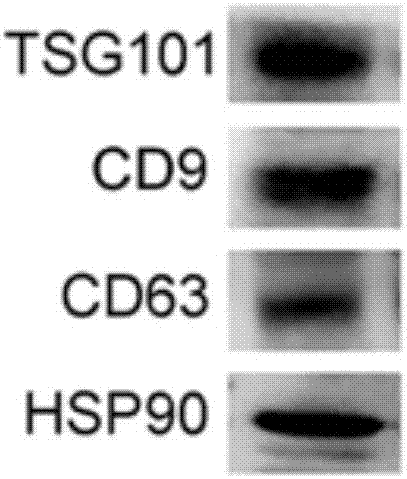
本发明中,所述脂肪来源间充质干细胞外泌体具有tsg101、cd9、cd63和hsp90标志。
优选的,本发明中,所述脂肪来源间充质干细胞外泌体来源于小鼠附睾处脂肪组织。
优选的,本发明中,所述脂肪组织炎症为饮食诱导肥胖所致的慢性脂肪组织炎症。
本发明的第二方面,提供包含上述脂肪来源间充质干细胞外泌体的组合物在制备治疗脂肪组织炎症药物中的应用。
本发明的第三方面,提供脂肪来源间充质干细胞外泌体在制备治疗由巨噬细胞炎症药物中的应用。
本发明的有益效果:
本发明首次提出了脂肪来源间充质干细胞外泌体在制备治疗脂肪组织炎症药物中的新用途,以及在制备治疗巨噬细胞炎症药物中的新用途。本发明研究发现,脂肪来源间充质干细胞外泌体能够抑制腹内脂肪组织巨噬细胞的浸润活化,并抑制促炎细胞因子的产生和释放,对脂肪组织炎症具有很好的抑制效果。此外,本发明还提供了上述脂肪来源间充质干细胞外泌体的制备方法,操作简单可行。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
图1:脂肪来源间充质干细胞外泌体的透射电镜图;图中白色标尺为150nm。
图2:外泌体标志western-blot的鉴定结果。
图3:adsc来源外泌体干预治疗后,f4/80+巨噬细胞比例检测结果。
图4:adsc来源外泌体干预治疗后,附睾处脂肪组织分泌的tnf-α水平。
图5:adsc来源外泌体干预治疗后,附睾处脂肪组织分泌的il-10水平。
图6:adsc来源外泌体干预治疗后,附睾处脂肪组织svf中tnf-αmrna水平。
图7:adsc来源外泌体干预治疗后,附睾处脂肪组织svf中il-12mrna水平。
图8:adsc来源外泌体干预治疗后,附睾处脂肪组织svf中il-6mrna水平。
图9:adsc来源外泌体抑制巨噬细胞炎症反应。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
术语说明:
脂肪组织炎症:正常脂肪组织中除脂肪细胞以外,还含有多种免疫细胞,参与维持组织稳态。由于脂肪细胞功能紊乱或其他相关因素的影响,会诱发脂肪组织炎症,表现为大量炎性免疫细胞如巨噬细胞在脂肪组织中的浸润与活化,以及大量促炎因子如tnf-α等的释放。
adsc(adipose-derivedmesenchymalstemcell):脂肪来源间充质干细胞,存在于脂肪组织血管基质成分中,是脂肪组织中的脂肪细胞前体,具有自我更新和多向分化潜能。
外泌体(exosome):是细胞分泌外排的一类囊泡结构,直径约为30-120nm,内含多种蛋白和rna物质,可通过旁分泌或者内分泌方式作用于相应的组织或细胞,是介导细胞间信息传递的一个重要介质。
正如背景技术所介绍的,现有技术中还未有关于脂肪来源间充质干细胞及其外泌体在治疗脂肪组织炎症反应的报道。基于此,本发明提出了一种脂肪来源间充质干细胞外泌体在制备治疗脂肪组织炎症药物中的应用。
在本申请的一种实施方案中,通过体内检测adsc来源外泌体对脂肪组织中巨噬细胞以及脂肪组织炎症的影响,结果发现:高脂饮食诱导肥胖小鼠的脂肪组织svf中f4/80+巨噬细胞的比例升高,而外泌体干预后,f4/80+巨噬细胞比例明显下调。脂肪组织培养上清中促炎细胞因子tnf-α的含量明显减少,而抗炎细胞因子il-10的表达量增加。结果表明外泌体干预治疗可以减轻饮食诱导肥胖所致的慢性脂肪组织炎症。
在本申请的另一种实施方案中,通过adsc来源外泌体作用于巨噬细胞的实验发现:外泌体与lps+ifn-γ共刺激组的巨噬细胞中tnf-α的mrna水平有明显下降。这说明adsc来源外泌体可以抑制巨噬细胞的炎症应答。
综上,通过上述研究发现:adsc来源外泌体能够抑制腹内脂肪组织巨噬细胞的浸润活化,并抑制促炎细胞因子的产生和释放,对脂肪组织炎症具有很好的抑制效果。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
实施例1:adsc的提取与分离
⑴脂肪组织的分离:选取10~12周龄c57bl/6雄性小鼠,麻醉并处死小鼠后,打开腹腔,剥离其附睾处脂肪,尽量去除血管,称取脂肪重量后,浸于pbs中冰上放置。
⑵配制消化液:根据脂肪重量,按照每克脂肪需3mlkrb缓冲液,6mgⅰ型胶原酶的比例配制使用。
⑶脂肪组织消化:将剥离好的脂肪组织机械剪碎后,加入配制好的消化液中,混匀后置于37℃摇床中消化45分钟,2000rpm,离心5分钟,小心取出底部的细胞置于不加酶的krb中,冰上放置。
⑷过滤:用100μm孔径铜网过滤细胞悬液,滤过后的混悬液2000rpm,5分钟离心后弃上清。
⑸洗涤:沉淀物加入双倍体积的无酶krb缓冲液,混匀后2000rpm,5分钟离心,弃上清,沉淀物即为含有adsc的血管基质成分(svf)。
⑹种板:按照一只小鼠所提细胞接种六孔板中一个孔的原则进行种板。加入含有bfgf的dmem条件培养基重悬。每孔加入2ml培养基,37℃,5%co2条件下培养,24-30小时后换液。
⑺传代:细胞融合度达90%时可进行传代。用pbs清洗细胞表面,加入适当胰酶消化细胞,按照每孔细胞传至一个10cm平皿中的原则进行传代培养。第四代的细胞进行后续实验。
实施例2:adsc来源的外泌体的提取与鉴定
用不含外泌体的10%胎牛血清的dmem培养基(含有bfgf)培养adsc。取第四代adsc细胞培养上清,0.22μm无菌过滤器过滤后,5000g,100k浓缩离心管4℃离心30分钟,取上室浓缩液于新的无菌15ml离心管中,加入exoquick-tctm外泌体提取试剂,置于4℃过夜后,5000g,4℃离心30分钟,弃上清,用无菌pbs重悬沉淀并分装,冻于-80℃保存。
将提取到的外泌体用透射电镜的方法对其直接大小以及形态进行检测,结果如图1所示;用western-blot的方法检测外泌体标志tsg101,cd9,cd63,hsp90,进一步对其进行鉴定,结果如图2所示。
实施例3:体内检测adsc来源外泌体对脂肪组织中巨噬细胞以及脂肪组织炎症的影响
⑴建立高脂饮食诱导脂肪组织炎症模型与外泌体干预
7周龄c57bl/6雄性小鼠用于建立脂肪组织炎症模型。在一周的预高脂饮食适应后,给予高脂饮食(hfd)(含有60%cal)喂养,以普通饮食(ncd)喂养作为对照组。高脂12-20周后,腹腔注射外泌体(30μg/mouse,每3天注射一次,连续注射6-8周),即为hfd-exosome组;腹腔注射生理盐水组为对照组,即hfd-ns。普通饮食喂养小鼠腹腔注射生理盐水组为ncd-ns。
⑵检测附睾处脂肪组织中f4/80+巨噬细胞比例
外泌体干预结束后,取小鼠附睾处脂肪组织,流式细胞术检测脂肪组织svf中f4/80+巨噬细胞的百分比。由图3可以看出,高脂饮食喂养的肥胖小鼠脂肪组织svf中f4/80+巨噬细胞的比例升高,而外泌体干预后,f4/80+巨噬细胞比例明显下调。
⑶检测附睾处脂肪组织培养上清中tnf-α以及il-10的变化
外泌体干预结束后,取小鼠附睾处脂肪组织,用elisa的方法检测脂肪组织培养上清中tnf-α以及il-10的含量。图4以及图5结果所示,hfd-exosome组小鼠的脂肪组织培养上清中tnf-α的含量明显减少,而il-10的表达量增加。这说明,外泌体干预治疗可以减轻饮食诱导肥胖所致的脂肪组织炎症。
⑷检测小鼠附睾处脂肪组织svf中炎性因子的变化
外泌体干预结束后,取小鼠附睾处脂肪组织的svf,real-timepcr的方法检测其中tnf-α、il-12、il-6的表达水平。由图6,图7以及图8可以看出,hfd-exosome组小鼠的tnf-α、il-12、il-6的表达水平均明显下调。这说明,外泌体干预治疗可抑制肥胖小鼠的脂肪组织炎症。
实施例4:外泌体作用于巨噬细胞
⑴腹腔巨噬细胞提取
取6-8周龄的c57bl/6雄性小鼠2-3只,腹腔注射1ml6%淀粉(生理盐水配制)。3日后处死小鼠,无菌条件下暴露腹腔,用无血清的dmem灌洗腹腔,收集腹腔灌洗液,过200目铜网以去除组织及毛发。滤过之后1000rpm离心5分钟,弃上清。加入含有血清的dmem培养基重悬巨噬细胞,接种于6孔板或者12孔板中。种板后置于37℃,5%co2培养4-6小时后换液,过夜培养后可用于后续实验。
⑵adsc来源外泌体作用于巨噬细胞,减轻巨噬细胞炎症反应
取腹腔巨噬细胞接种于细胞培养板中,过夜培养后,将巨噬细胞分为三组,即对照组,lps+ifn-γ组,以及外泌体(20μg/ml)与lps+ifn-γ共刺激组。外泌体刺激30小时,lps+ifn-γ刺激2小时后,收取细胞rna。图9所示,与lps+ifn-γ组相比,外泌体与lps+ifn-γ共刺激组中巨噬细胞tnf-α的mrna水平有明显下降。这说明adsc来源外泌体可以抑制巨噬细胞炎症应答。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!