使用抗坏血酸稳定化放射性药物组合物的制作方法
本申请是申请日为2010年4月15日,申请号为201080026254.0,发明名称为“使用抗坏血酸稳定化放射性药物组合物”的发明专利申请的分案申请。本发明涉及放射性药物组合物的稳定化,和保护其免于辐射分解性的和传播性的基团分解。具体地,本发明涉及抗氧化剂物质通过缓冲该组合物在放射性药物制剂中的应用。此外,本发明涉及抗氧化剂抗坏血酸在缓冲的条件下在特定ph范围内的下述应用:用于稳定化可用于医学成像的放射性药物组合物,并从而增加该组合物的储存期,同时维持该组合物适合施用给人类和其它哺乳动物受试者。
背景技术:
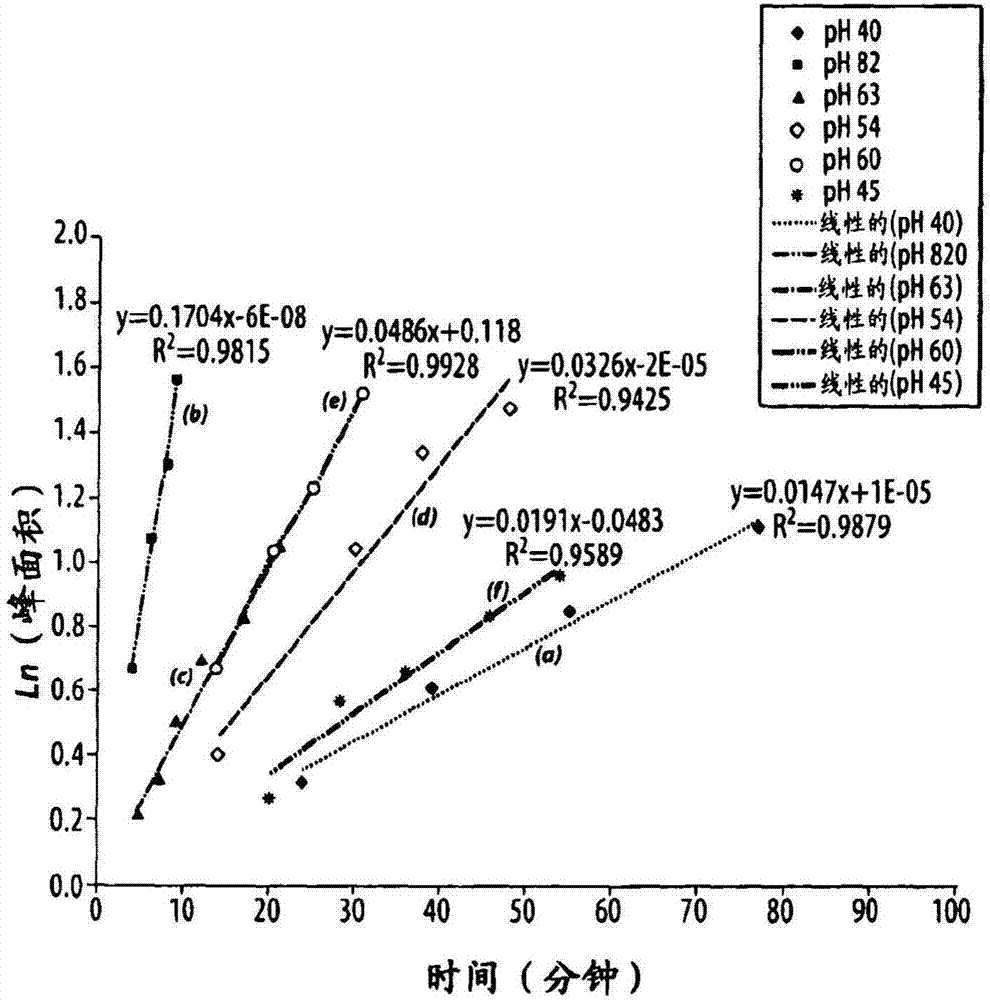
:放射性药物是含有放射性核素的药物。放射性药物常规地用于核医学中,以用于诊断或治疗各种疾病。它们通常是具有确定组成的小的有机或无机化合物。它们也可以是大分子,诸如未用放射性核素化学计量地标记的抗体或抗体片段。放射性药物形成诊断和治疗各种疾病的化学基础。通过静脉内注射放射性药物,并使用γ照相机或pet照相机测定它的生物分布,可以得到体内诊断信息。放射性药物的生物分布通常取决于放射性标记的化合物的物理性质和化学性质,且可以用于得到关于疾病的存在、进展和状态的信息。放射性药物通常可以分成2大类:其生物分布仅由它们的化学性质和物理性质决定的那些,和其最终的分布由它们的受体结合或其它生物学相互作用决定的那些。后一类经常被描述为靶物-特异性的。最近,已经将许多工作耗费在发现和开发用于诊断性成像的放射性药物上,所述放射性药物含有发射正电子的同位素。发射正电子的同位素包括82rb、124i、11c、13n和18f以及其它。这些同位素通过从原子核发射正电子而衰变。正电子是具有电子的等效质量、但是具有对应的正电荷的颗粒。在从原子核发射出以后,正电子移动,直到它遇到电子,且二者的反应导致质量的物理湮没。以511kev的值,在相对方向释放出能量,且由于所述湮没不具有角动量,从湮没点间隔大约180度发射出光子,这允许精确地确定发生所述分解所沿的线。该性质导致敏锐的灵敏度和分辨率,并允许极好的图像重构和质量。碳、氮和氟同位素的一个优点是,它们可以掺入小的有机分子中,所述有机分子例如已知的或研究中的可以用于测定药剂的生物分布以及诊断疾病的存在、不存在或范围的药物。通过具有本领域普通技术的有机化学家和放射化学家已知的多种方法,可以使它们方便地插入这些分子中。在调查研究中广泛地使用11c-碘代甲烷(11ch3i)、甲基化醇或胺,以生成对应的醚或烷基胺。然后将这些化合物适当地灭菌,配制,并注射进受试者中。广泛使用的许多pet放射性药物的主要缺点是,与许多同位素有关的相对短的半衰期。铷-82、碳-11和氮-13分别具有1.27、20.3和9.97分钟的半衰期。铷作为来自82sr-82rb发生器的氯化物盐施用,且未经合成地修饰或处理。氮-13通常作为在回旋加速器中产生的氨(13nh3)施用,所述回旋加速器邻近成像中心,适当地接近照相机。基于11c和13n二者的试剂已经用于显像剂的放射性标记中。鉴于短的半衰期和在配制和施用药物之前完成要求的反应和纯化所需的时间,需要克服大量工程和逻辑挑战,以允许使用化合物作为放射性药物。相应地更长寿命的发射正电子的同位素可以掺入新的成像用的放射性示踪剂中。这些包括前述的131i和18f,它们分别具有4.2天和107.9分钟的半衰期。近来最普遍地使用18f,因为衰变完全是通过发射正电子,且具有有利的半衰期。近2小时允许合成地掺入分子中、纯化并随后从位于中央的放射性药物进行分布,避免了对现场(on-site)回旋加速器或每月购买82sr-82rb发生器的需要/投资。在生产、配制、销售和递送药剂的过程中,同位素通常以由每种具体同位素的物理学决定的零级速率衰变。但是,该衰变也可以通过辐射分解触发药剂的化学衰变。这可以通过自由基反应进行传播,并严重降低组合物的质量。放射性药物组合物在施用之前或在施用过程中的分解,可以急剧地降低靶向潜力,并增加治疗性的放射性药物组合物的毒性。因而,在某些情况下,重要的是,确保放射性核素连接在靶向部分上,并进一步确保靶向剂的特异性得到保持。辐射分解的原因是自由基(诸如羟基和超氧化物自由基)的形成(garrison,w.m.chem.rev.1987,87,381-398)。自由基对于有机分子是非常反应性的。这些自由基对有机分子的反应性,可以影响放射性药物组合物的溶液稳定性。放射性药物组合物的稳定化,是靶物-特异性的放射性药物的开发中的一个重现挑战,且经常采用自由基清除剂作为稳定剂,以使放射性标记的分子的辐射分解最小化。有些稳定剂是“清除自由基的抗氧化剂”,其可以容易地与羟基和超氧化物自由基反应。放射性药物组合物的稳定剂可以有利地具有下述特征:当它用于人类施用时低毒性或基本上没有毒性,对放射性标记的化合物向靶细胞或组织的递送或受体结合具有低干扰或基本上没有干扰,和/或使放射性药物稳定合理的时间段(例如,在制备、销售、储存和运输放射性药物的过程中)的能力。诸如抗坏血酸等自由基清除剂已经用于稳定化99mtc(derosch等人,wo95/33757)和186/188re(anticancerres.1997,17,1783-1796)放射性药物。美国专利5,393,512公开了抗坏血酸作为186re和131i-标记的抗体或抗体片段的稳定剂的应用。美国专利5,093,105和5,306,482公开了抗坏血酸作为99mtc放射性药物的抗氧化剂的应用。为了在发生显著的损害之前使用诸如抗坏血酸等抗氧化剂来终止衰变途径,已经开发了几种策略。抗坏血酸已经用于不同的药物和放射性药物组合物中。不同于其它的缓冲剂诸如琥珀酸和氨基羧化物,抗坏血酸不含有氨基或羧基。pct/us94/06276公开了稳定剂诸如抗坏血酸和抗坏血酸的水溶性的盐和酯。美国专利no.6,066,309公开了抗坏血酸及其衍生物在稳定化放射性标记的蛋白和肽中的应用,以对抗放射性标记的氧化损失和自辐射分解。在某些情况下,在放射性标记(包括任何需要的温育时间段)以后,但是在患者施用之前,加入抗坏血酸。另外,将抗坏血酸的衍生物定义为抗坏血酸的盐、抗坏血酸的酯或它们的混合物。尽管已经公开了抗坏血酸/抗坏血酸盐作为多种诊断性的和治疗性的放射性药物组合物的稳定剂的应用(参见,例如,deausch,e.a.等人/美国专利no.5,384,113/1995;vanderheyden,j.-l.,等人/美国专利no.5,393,512/1995;flanagan,r.j.和tartaglia,d./美国专利no.5,093,105/1992;tartaglia,d.和flanagan,r.j./美国专利no.5,306,482/1994;shochat,d.等人/美国专利no.5,961,955/1999;和zamora,p.o.和merek,m.j./美国专利no.6,066,309/2000),关于在特定ph范围内使用抗坏血酸盐来增强用于临床应用的化合物的抗氧化作用,几乎没有公开或没有公开。尽管已经在文献中例证了诸如抗坏血酸等抗氧化剂的重要应用,几乎没有注意被放在抗氧化剂的状态上,例如,当将它加入缓冲溶液中进行稳定性研究(在低ph,或对于适合注射的物质而言在更高的ph)时。可以选择适合人类注射的物质,以具有高于4.0的ph,从而减少在注射部位处与强酸性溶液有关的局部化刺激和疼痛的风险。通常,注射用溶液已经用在6-8的ph范围内的磷酸盐(磷酸盐缓冲盐水(pbs))缓冲。但是,在处于典型的生物学ph范围(6-8)的缓冲溶液中采用抗坏血酸/抗坏血酸盐,经常会表现出更低的稳定化放射性药物溶液的能力。相反,尽管以前的工作可能证实使用在低ph值(2-3)的抗坏血酸时放射性药物制剂的稳定性,这样的制剂通常不适用于动物模型或人类,这是由于上面指出的局部化反应。另外,以前的工作可能阐述了抗坏血酸在广阔的酸性ph范围是有用的,或根本没有指定具体范围。迄今为止,据信,当使用抗坏血酸用于放射性药物的临床应用时,几乎不存在关于技术人员选择ph的指导。因此,需要改进的组合物和方法。技术实现要素:本发明提供了抗坏血酸作为在一定ph范围内的稳定剂的应用。在含水乙醇或水性缓冲液中配制药剂和稳定剂,使得溶液优选地在约3.5-5.5的酸性ph范围内,更优选地在约4-5范围内,最优选地在约4-4.5范围内。因而,在有些实施方案中,本发明提供了一种组合物,其包含一种或多种放射性药物化合物以及包括抗坏血酸的稳定剂,其中所述组合物的ph是在约3.5-5.5范围内。作为本发明组合物的一部分的放射性药物化合物可以选自:鱼藤酮、哒螨灵、喹螨醚、霸螨灵、吡螨胺、粉蝶霉素和2-取代的色酮类和它们的类似物。在有些实施方案中,所述放射性药物化合物是至少一种选自下述的成员:哒螨灵和其类似物。在有些实施方案中,所述放射性药物化合物是至少一种选自下述的成员:含有具有在5位取代的亲脂侧链的2-烷基-4-氯-2h-哒嗪-3-酮的化合物。在有些实施方案中,所述放射性药物化合物是2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮。在有些实施方案中,所述放射性药物化合物被放射性同位素标记,诸如选自11c、13n、18f、86br、124i、125i和131i的放射性同位素。在有些实施方案中,所述放射性同位素选自11c、13n和18f。在有些实施方案中,所述放射性同位素是18f。在前述实施方案中的任一个中,所述放射性药物组合物包含约5至100mg/ml抗坏血酸,更优选约25至500mg/ml,更优选约50至200mg/ml。在有些实施方案中,存在大于约5mg、大于约10mg、大于约20mg、大于约30mg、大于约40mg、大于约50mg、大于约100mg或大于约200mg抗坏血酸/毫升。本发明也提供了一种用于制备在前述实施方案中的任一个中所述的组合物的方法,所述方法包括:将含有放射性药物化合物的第一溶液加入在约3.5-5.5的ph范围内、更优选在约4-5范围内、甚至更优选在约4-4.5范围内的含有抗坏血酸的第二溶液中,以形成包含放射性药物化合物和抗坏血酸的第三溶液。在有些实施方案中,在将第一溶液加入第二溶液中之前,通过色谱法纯化放射性药物化合物。在有些实施方案中,在将第一溶液加入第二溶液中之前,没有通过色谱法纯化放射性药物化合物。在有些实施方案中,所述方法另外包括下述步骤:在将第一溶液加入第二溶液中以后,并在将所述组合物用于患者之前,调节第三溶液的ph至约6-8。此外,作为本发明的一部分,存在这样的方法,所述方法包括:给患者施用含有抗坏血酸的放射性药物组合物,使得所述组合物具有在约3.5-5.5范围内、更优选在约4-5范围内、甚至更优选在约4-4.5范围内的ph。本发明涉及这些以及在下文中描述的其它重要的目标。附图说明图1显示了本发明的不同组合物的放射化学纯度随时间而变化的图。图2显示了本发明的不同组合物在(a)4.0、(b)8.2、(c)6.3、(d)5.4、(e)6.0和(f)4.5的ph时放射化学杂质形成速率的图。图3显示了包含在(a)20mg/ml(|p|>0.001)、(b)50mg/ml、(c)100mg/ml和(d)200mg/ml浓度的抗坏血酸的系列溶液的放射化学纯度的图。具体实施方式使用抗坏血酸作为缓冲剂,存在几个优点。抗坏血酸已经被批准用于药物和放射性药物用途。抗坏血酸具有4.2的pka,且在ph3.0-5.0具有缓冲容量。在更高的浓度(>50mg/ml或0.25m),它也可以在5.5-6.0或更高的ph范围具有足够的缓冲容量。通常,它也被用作主要缓冲剂。本发明一般地涉及新颖的组合物(例如,放射性药物组合物),和放射性药物组合物中的抗氧化剂抗坏血酸在特定ph范围的抗氧化能力和稳定化作用的意外的且急剧的增加。在该ph,大部分抗氧化剂被质子化,然而溶液的酸性不会大至造成受试者的严重反应。它特别适用于:在本文所述的条件下进行生产和储存规程,并在施用给受试者的5、10或15分钟内,调节至更高的ph。在有些实施方案中,提供了放射性示踪剂(例如,18f-标记的放射性示踪剂),其使用抗坏血酸作为稳定剂和/或作为临床的pet显像剂。本发明有利地提供了在特定ph范围内的放射性药物制剂,其利用抗坏血酸作为稳定剂。所述ph范围会增加该组合物的稳定性和贮存期,同时使注射后的严重的局部化的部位反应最小化。另外,有些实施方案利用抗坏血酸作为放射性药物组合物中的稳定剂,用于制备标记的分子、尤其是18f-标记的分子。在某些情况下,在制备、销售和运输放射性药物组合物的过程中,抗坏血酸和它的类似物在特定ph范围内可以用作稳定剂,尤其是对于用诸如18f等放射性同位素标记的那些化合物。选择的放射性药物组合物的ph位于抗氧化剂的主要pka或(在二碱性离子的情况下)次要pka处或附近。对于具有4.17的pk的抗坏血酸,可以选择ph在约3.5-5.5、约4-5或4-4.5的范围内。抗坏血酸通常用作本发明的放射性药物组合物的稳定化组分。抗坏血酸被称作维生素c,且已经被用作抗氧化剂来防止某些放射性药物(wo95/33757;anticancerres.1997,17,1783-1796;美国专利5,093,105,和美国专利5,306,482)或放射性标记的肽(美国专利5,393,512;美国专利5,384,113和美国专利5,961,955)的辐射分解。本文使用的术语“抗坏血酸”包括抗坏血酸本身以及本领域普通技术人员已知的该酸的类似物和盐。抗坏血酸是可容易地得到的gras(公认为安全的)物质,且可以以最终制剂的高达200mg/ml水平用于药物组合物和用于生物学目的的其它制剂中。在基本上所有的加工步骤过程中以及施用给受试者时,以前的包含抗坏血酸的组合物通常处于在生物学ph范围(例如,6-8)内的ph值,以减少与酸性溶液有关的刺激和疼痛的风险。但是,在生物学ph范围内,抗坏血酸/抗坏血酸盐在缓冲溶液中稳定化放射性药物溶液的能力令人惊讶地降低。在本发明所公开的放射性药物组合物中使用抗坏血酸或它的类似物的一些优点包括:(1)以高产率(>90%)制备放射性药物组合物的能力,和(2)在维持放射性药物的放射化学纯度或rcp(>90%)的同时,储存放射性药物组合物几小时或甚至几天的能力。在某些情况下,可以将抗坏血酸盐加入制剂中。在某些情况下,抗坏血酸可以以不带电荷的形式使用,或者用于组合物中,其中在适当的ph,将更高百分比的抗坏血酸质子化。不受任何特定理论的约束,抗氧化剂的效能在某些情况下可能与抗氧化剂中的氢-氧键的非离子性质直接相关,在酸性水平(其中大部分抗氧化剂是质子化形式)具有增强的稳定性。在有些实施方案中,在没有其它稳定剂化合物存在下,放射性药物组合物可以包含抗坏血酸作为稳定剂。本发明预见到这样的放射性药物制剂:其含有一种或多种在下文中描述的心肌灌注显像剂或放射性药物化合物以及抗坏血酸,其在上文所述的ph范围内。最近,已经公开了几组新颖的心肌灌注显像剂(casebier等人,美国2007036716a1;purohit&casebier,美国2006083681a1;radeke等人,美国2005244332a1;casebier等人,wo2005/079391a2),它们对于潜在的临床诊断用途而言具有非常合乎需要的性质。这些药剂经常被制备为放射性示踪剂,且经常用放射性同位素(诸如放射性同位素18f)进行标记。在本发明中有用的一些放射性药物化合物可以是线粒体复合物1(mc-1)的有效抑制剂,且具有潜在的临床效用。这些化合物可以用放射性示踪剂(在下文中描述的,诸如18f,作为实例)进行放射性标记,且因此,以防止辐射分解性的开始衰变的方式稳定化溶液可能是所需要的。几类化合物可以用作在本发明的上下文中的放射性药物化合物,如下面更完整地描述的。例如,天然产物鱼藤酮是一种已知的商业杀虫剂,且被广泛地用于商业。主要的活性模式是通过mc-1的抑制。该化合物对于农作物应用而言是方便的,这是由于它的功效以及它在环境中快速分解为无危险产物。已知鱼藤酮的几种类似物会抑制mc-1,且一些已经被用于心肌灌注成像的非人模型中,诸如二氢氟代鱼藤酮(dihydrofluorotenone,dhfr)。可以用于心肌灌注成像且其溶液可以用抗坏血酸稳定化的另一类化合物是下面显示的一类色酮衍生物。这些化合物是在灵长类动物的心肌灌注中已经表现出良好效用的合成化合物,特别地,具体化合物如下所示。可以用于心肌灌注成像且其溶液可以用抗坏血酸稳定化的另一类化合物是称作喹螨醚的喹唑啉衍生物。喹螨醚自身是mc-1的强抑制剂,且在商业上被用作杀虫剂。喹螨醚和它的类似物的放射性标记的衍生物已经在灵长类动物和其它哺乳动物的心肌灌注成像中表现出良好效用。下面显示了喹螨醚和它的类似物,以及对于心肌灌注成像而言特别优选的具体化合物。类似地,其它商业上有用的mc-1抑制剂的类似物可用于本发明中,诸如下面显示的吡螨胺和其类似物。这些化合物的母体结构在商业上被用作杀虫剂,但是它们的类似物可以被放射性地标记,以用作心肌灌注显像剂。类似地,其它商业上有用的mc-1抑制剂的类似物可用于本发明中,诸如下面显示的霸螨灵类似物。这些化合物的母体结构在商业上被用作杀虫剂,但是它们的类似物可以被放射性地标记,以用作心肌灌注显像剂。此外,下面显示的天然产物粉蝶霉素的类似物可用作本发明一部分的化合物。粉蝶霉素是一类在取代(substation)和侧链方面具有差异性的化合物,但是通常可以表征为2-烷基-4-羟基吡啶。通常,在粉蝶霉素中,3、5和6位也被烷基或烷氧基官能团取代。这些化合物和类似物的衍生物可以被放射性地标记,以用作心肌灌注显像剂。另一类适用于本发明中的化合物是基于商业化合物哒螨灵。在某些情况下,所述化合物包含经由亲脂侧链连接至放射性同位素(诸如18f-氟化物)上的哒嗪酮杂环。这些化合物可以包含一系列有效的线粒体复合物1抑制剂。通过用基团x和y取代硫属元素,保留了该能力,且侧链(基团m、n和y)的容许量是广阔的,具有最多10个链原子的支链和直链基团仍然会提供有效的活性。在有些实施方案中,所述化合物是2-烷基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮。例如,所述化合物可以是2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮。通过有机放射化学领域的技术人员和熟知用于生产诸如氟脱氧葡萄糖(18f-fdg)等放射性药物(例如,目前唯一被批准用于人成像的18-f放射性示踪剂)的技术的人员已知的方法,可以制备本文所述的化合物。在使用之前,可以纯化化合物,并在这样的用途中例证这样的方法。其它方法是技术人员可容易地得到的。在某些情况下,放射性药物化合物可以包括不对称中心,即不对称地取代的原子。可以以旋光的或外消旋的形式分离含有不对称地取代的原子的化合物。本领域众所周知如何制备旋光形式,包括诸如拆分外消旋形式或从旋光原料合成等方法。烯烃、c=n双键等的许多几何异构体也可以存在于本文所述的化合物中,且预见到将所有这样的稳定的异构体用于本发明中。描述了本发明化合物的顺式和反式几何异构体,且可以分离为异构体的混合物,或分离的异构形式。是指结构的所有手性形式、非对映体形式、外消旋形式和所有几何异构形式,除非特别指出具体的立体化学或异构形式。认为用于制备本发明化合物的所有方法和在其中制备的中间体可用于本发明中。如指出的,本文所述的放射性药物化合物可以含有烷基取代基。如在本文中使用的,可以在本文中单独使用或用作另一个基团的一部分的术语“烷基”和“烷”包括在正常链中含有1-20个碳、优选1-10个碳、更优选1-8个碳的直链和支链烃,诸如甲基、乙基、丙基、异丙基、丁基、叔丁基、异丁基、戊基、己基、异己基、庚基、4,4-二甲基戊基、辛基、2,2,4-三甲基戊基、壬基、癸基、十一基、月桂基、它们的各种支链异构体等,以及诸如包括1-4个取代基的基团,所述取代基例如卤素(例如f、br、cl或i)或cf3、烷基、烷氧基、芳基、芳氧基、芳基(芳基)或二芳基、芳基烷基、芳基烷氧基、烯基、炔基、环烷基、环烯基、环烷基烷基、环烷基烷氧基、羟基、羟基烷基、酰基、烷酰基、杂芳基、杂芳氧基、环杂烷基、芳基杂芳基、芳基烷氧基羰基、杂芳基烷基、杂芳基烷氧基、芳氧基烷基、芳氧基芳基、烷基酰氨基、烷酰基氨基、芳基羰基氨基、硝基、氰基、硫醇、卤代烷基、三卤代烷基和/或烷硫基。如以前指出的,本文使用的放射性药物化合物也包括其“类似物”。术语“类似物”意在包括与参照的结构或化合物在结构或原子连接性方面基本上类似的任意化合物。这些包括这样的化合物:其中一个或多个单独的原子已经被替换为不同的原子或不同的官能团。术语类似物暗示高度的同源性,但是也可以包括从这样的结构智力地衍生出的化合物。因而,作为实例,哒螨灵的类似物可以作为含有具有在5位取代的亲脂侧链的2-烷基-4-氯-2h-哒嗪-3-酮的任意化合物。作为本发明一部分的放射性药物化合物意在包括在本发明的化合物中出现的原子的所有同位素。同位素包括具有相同原子数、但是不同质量数的那些原子。作为一般的实例,但不限于此,氢的同位素包括氚和氘。碳的同位素包括c-13和c-14。当取代基的键显示为连接环中的2个原子的交叉键时,则这样的取代基可以键合到环上的任意原子上。当列出取代基、但是没有指出这样的取代基用于键合到给出通式的化合物的剩余部分上的原子时,则这样的取代基可以经由该取代基中的任意原子进行键合。取代基和/或变量的组合是容许的,只要这样的组合会产生稳定的化合物。上文所述的放射性药物化合物被认为是药学上可接受的。短语“药学上可接受的”在本文中用于表示这样的化合物、材料、组合物和/或剂型:其在合理的医学判断范围内,适用于接触人类和动物的组织,且没有过度的毒性、刺激、变应性应答或其它问题或并发症,与合理的收益/风险比相称。上文所述的放射性药物化合物也包括药学上可接受的盐。本文使用的“药学上可接受的盐”表示公开的化合物的衍生物,其中通过制备它们的酸或碱盐而修饰母体化合物。药学上可接受的盐的实例包括、但不限于:诸如胺等碱性残基的无机酸盐或有机酸盐;和诸如羧酸等酸性残基的碱盐或有机盐。药学上可接受的盐包括常规的无毒的盐,或从例如无毒的无机酸或有机酸形成的母体化合物的季铵盐。例如,这样的常规的无毒的盐包括:从无机酸衍生出的盐,所述无机酸诸如盐酸、氢溴酸、硫酸、氨基磺酸、磷酸和硝酸;和从有机酸制备的盐,所述有机酸诸如醋酸、丙酸、琥珀酸、羟乙酸、硬脂酸、乳酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、双羟萘酸、马来酸、羟基马来酸、苯乙酸、谷氨酸、苯甲酸、水杨酸、对氨基苯磺酸、2-乙酰氧基苯甲酸、富马酸、甲苯磺酸、甲磺酸、乙二磺酸、草酸和羟乙磺酸。通过常规化学方法,可以从含有碱性或酸性部分的母体放射性药物合成出可用于本发明中的药学上可接受的盐。通常,这样的盐可以如下制备:在水或有机溶剂或二者的混合物中,使这些化合物的游离酸或碱形式与化学计量量的适当的碱或酸反应;通常,非水性介质如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈是优选的。合适的盐的列表可以参见:remington′spharmaceuticalsciences,第17版,mackpublishingcompany,easton,pa,1985,第1418页,其公开内容通过引用并入本文。如以前所述,本文使用的放射性药物化合物优选地是mc-1抑制剂。术语“mc-1抑制剂”表示具有抑制mc-1的能力的特定已知化合物和那些化合物的类似物。具体地,可以用合适的放射性同位素放射性地标记化合物,使得可以如下得到心肌组织的图像:给患者施用所述化合物,随后在合适的照相机中扫描患者,所述合适的照相机可以是pet、spect或平面的。这样的抑制剂可以包括、但不限于:哒螨灵和它的类似物、喹螨醚和它的类似物、鱼藤酮和它的类似物、鱼藤素和它的类似物、和取代的色酮衍生物和它们的类似物,包括上面例证的那些。本发明的放射性药物化合物优选地用合适的放射性同位素进行标记。术语“合适的放射性同位素”表示这样的同位素:其可以共价地掺入分子中,而不会不利地影响生物学能力,且具有衰变参数诸如足够长的半衰期和合适的颗粒/发射能量,使得可以得到良好的图像。这样的放射性同位素可以包括、但不限于:11c、13n、18f、86br、124i、125i和131i。在它们中,18f特别优选地用于本发明中。使用本领域技术人员可得到的材料和技术,实现放射性标记。例如,通过亲电子氟化,在适当的条件下使用[18f-f]氟气体,可以实现用氟进行的放射性标记,但是最优选地,通过[18f]-氟化物离子对适当离去基团的亲核置换来实现。通过添加氪酸盐(kryptate)来隔离钾抗衡离子,使[18f]-氟化物离子具有更高的反应性。从本领域普通技术人员已知的那些中,可以选择优选的离去基团,但是优选地是卤素,包括碘化物、溴化物、氯化物和氟化物。最优选地,所述离去基团是烷基或芳基磺酸化的酯,特别是甲苯磺酸酯。在一组实施方案中,所述放射性药物组合物包含2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮以及包括抗坏血酸在内的稳定剂,其中所述组合物的ph是在约4-4.5的范围内,且所述放射性药物组合物包含大于约50mg抗坏血酸/毫升。可以如下制备本发明的稳定化的放射性药物制剂:将包含粗的(例如,未纯化的)或纯化的放射性药物化合物的第一溶液(例如,水溶液或乙醇溶液)加入包含抗坏血酸的第二制备溶液中,以形成包含放射性药物化合物和抗坏血酸的第三溶液。所述第一溶液可以是水溶液或醇溶液,诸如乙醇溶液。在某些情况下,在接触第一溶液之前,通过加入酸性溶液(例如,盐酸溶液)或碱性溶液(例如,氢氧化钠水溶液),将所述第二溶液调节至希望的ph(例如,在3.5-5.5范围内的ph)。本发明的方法可以包括额外的处理步骤。例如,在将第一溶液加入第二溶液中以后,可以将第三溶液调节至不同的ph,诸如在生物学范围内的ph,即约6-8。在有些实施方案中,所述放射性药物组合物包含大于约50mg抗坏血酸/毫升,且所述方法另外包括下述步骤:在将第一溶液加入第二溶液中以后,调节第三溶液的ph至约小于6。在一组实施方案中,所述方法包括:将包含2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮或其19f类似物的第一溶液加入包含抗坏血酸的第二溶液中,其中所述第二溶液具有在约4-4.5范围内的ph,且包含大于约50mg抗坏血酸/毫升,以形成包含2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮和抗坏血酸的第三溶液。在有些实施方案中,所述方法可以包括一个或多个纯化步骤,诸如通过色谱法纯化。例如,所述方法可以包括通过色谱法纯化放射性药物化合物,即,在加入包含抗坏血酸的溶液之前。所述色谱法可以是反相色谱法、正相色谱法(regularphasechromatography)和/或离子交换色谱法。在有些实施方案中,所述正相色谱法可以包括使用氧化铝或硅胶柱。在某些情况下,本发明的方法可以包括使用反相hplc柱。关于反相色谱法,使用包含水、乙腈、缓冲液(例如,醋酸铵缓冲液)、醇(例如,甲醇、乙醇)、酸(例如,甲酸)或其混合物的流动相,可以洗脱hplc柱。在某些情况下,所述hplc柱是反相柱,并使用包含醋酸铵缓冲液、乙腈、乙醇、甲酸或其混合物的流动相来洗脱柱。本发明的典型的放射性药物组合物包含:含有不超过约0-10体积%乙醇的水溶液,和大于约5mg抗坏血酸/毫升。在某些情况下,所述水溶液含有大于约10mg、大于约20mg、大于约30mg、大于约40mg、大于约50mg、大于约100mg、或在某些情况下大于约200mg的抗坏血酸/毫升剂型。在有些实施方案中,所述水溶液还包括不超过约20mci的放射性药物化合物(例如,约10-20mci)和不超过约5μg的冷的放射性示踪剂的19f-类似物(例如,约1-5μg)/毫升剂型。通常,通过向溶液中加入na18f,开始辐射分解。本发明的有些方面涉及下述发现,即在开发根据本发明的放射性药物组合物(用于广泛的生产、分布和使用)的过程中,抗坏血酸表现出增强的稳定化在特定ph值的放射性药物制剂的能力。经发现,在本文所述的ph值,放射性药物制剂表现出明显更高的对抗分解的稳定性。在更高的ph值,这些溶液的稳定性明显不太有效。与含有抗坏血酸的溶液的ph的对比、经6小时时间段的稳定性和抗坏血酸的pka揭示,最有效的稳定作用是在稳定剂的氧化中心被质子化的范围内。在某些情况下,抗坏血酸或它的类似物在本文所述的放射性药物组合物中的应用,可以稳定化放射性药物,使得在放射性药物的基本上整个使用期限内可以维持高放射化学纯度(例如,>90%、>95%、>97%)。例如,在高放射化学纯度,可以维持包含18f的放射性药物1小时或更久、2小时或更久、或在某些情况下,5小时或更久。本发明也包括将放射性药物组合物施用给受试者的方法。在某些情况下,所述放射性药物组合物含有抗坏血酸,且具有在约3.5-5.5范围内的ph。在某些情况下,放射性药物组合物含有大于约50mg抗坏血酸/毫升的量的抗坏血酸,且具有小于约6的ph。在一组实施方案中,本发明提供了给患者施用放射性药物组合物的方法,所述放射性药物组合物包含:2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮、大于约50mg抗坏血酸/毫升的量的抗坏血酸,其中所述放射性药物组合物具有小于约6的ph。本文所述的本发明组合物可以以下述方式施用,作为实例:将导管或肝素固定线(heparinlockline)插入受试者的静脉中,并用适当的盐水和或肝素溶液冲洗。经由路厄粗头旋口,将药物施用进导管或肝素固定线中。患者原位在pet照相机中并可以立即开始成像,或者允许患者休息一段时间然后进入pet照相机中。或者,使用与本领域已知的那些类似的方法,在踏车或药理学应激下,经由导管或肝素固定,以类似的方式施用给患者。下面的实施例采用本发明的不同实施方案,但是不应当解释为限制其范围:实施例使用itlc或更优选地hplc,通过放射性标记的化合物的放射化学纯度(rcp),测量放射性药物的完整性。使用hplc的优点是,在特定色谱条件下,可以将由辐射分解造成的放射性杂质与放射性药物分离开。通过测定在代表性的时间点采取的样品中的放射性标记的化合物的rcp的变化,可以证实本发明的放射性药物组合物提高的时间稳定性。本发明的放射性药物组合物可以有效地维持样品的稳定性最多10小时。放射性药物的最初rcp在很大程度上取决于放射性标记条件,诸如ph、加热温度和时间。在以高产率制备放射性药物以后,通过放射性药物在特定时间段内的rcp变化,测量放射性药物组合物的稳定性。醋酸(超纯的)、氢氧化铵(超纯的)和龙胆酸购自aldrich或sigmachemicalco.,并以接收时的状态使用。使用购自fisher的盐酸和购自vwr的氢氧化钠(1n溶液)进行ph调节。抗坏血酸(500mg/ml,美国药典注射用溶液)购自myodermmedical,并根据需要用无菌注射用水(swfi)稀释。[f-18]氟化钠(na18f)购自siemensbiomarkersolutions,为储存在聚合的柱支持物上的盐。使用碳酸钾(k2co3)和kryptofix[222]的溶液,将氟化物从柱洗脱进反应烧瓶或瓶中。可以使用下述的hplc分析方法。hplc方法1使用hp-1100hplc系统,该系统具有紫外/可见光检测器(λ=220nm)、in-us放射-检测器和zorbaxc18柱(4.6mmx250mm,孔径)。流速是1ml/min,流动相从92%溶剂a(0.025m醋酸铵缓冲液,ph6.8)和8%溶剂b(乙腈)开始,在18min时达到90%溶剂a和8%溶剂b,然后在19至25min用40%溶剂a和60%溶剂b进行等度洗脱(isocraticwash)。hplc方法2使用hp-1100hplc系统,其具有紫外/可见光检测器(λ=220nm)、in-us放射-检测器和zorbaxc18柱(4.6mmx250mm,孔径)。流速是1ml/min,流动相从92%溶剂a(0.025m醋酸铵缓冲液,ph6.8)和8%溶剂b(乙腈)开始,在18min时达到80%溶剂a和20%溶剂b,然后在19至25min用40%溶剂a和60%溶剂b进行等度洗脱。hplc方法3使用hp-1100hplc系统,其具有紫外/可见光检测器(λ=220nm)、in-us放射-检测器和zorbaxc18柱(4.6mmx250mm,孔径)。流速是1ml/min,在25min内使用92%溶剂a(0.025m醋酸铵缓冲液,ph6.8)和8%溶剂b(乙腈)的等度流动相,随后在26-30min使用40%溶剂a和60%溶剂b进行等度洗脱。hplc方法4使用hp-1100hplc系统,其具有eg&gbertholdradioflow检测器和zorbaxc18柱(4.6mmx50mm,1.8μm粒度)。流速是1ml/min,在12min的运行时间内,使用50%乙腈/50%的0.1%甲酸水溶液的流动相。下面的实施例描述了18f-标记的心肌灌注成像放射性示踪剂的制备和纯化。使用下面的一般方法,以良好产率制备了哒螨灵、喹螨醚和色酮类似物,并配制成稳定的放射性药物组合物。实施例1:制备用于ph稳定化研究的18f心肌灌注成像放射性示踪剂的合成方法。将碳酸钾(k2co3,美国药典级,10mg)溶解于蒸馏水/去离子水(h2o,1ml)中,并在搅拌下加入4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8.8.8]二十六烷(称作kryptofixtm,k222)在无水乙腈(ch3cn,4ml)中的溶液中,使用得到的溶液的等分试样(1ml)洗脱携带18f的树脂柱。测定柱洗脱液的放射性内容物,并将洗脱液转移至explorarn化学模块(chemistrymodule)的反应器。该系统由使用gina-star软件的计算机控制。将洗脱的复杂溶液浓缩至干燥(70-95℃),氩放出(argonbleed);部分真空(250-12毫巴)。这产生相对干燥的、高度活化的[18f]氟化物形式。然后将希望的放射性示踪剂的对应甲苯磺酸酯溶解在100%乙腈中的溶液加入反应器中。将混合物在90℃加热10分钟。实施例2:18f心肌灌注成像放射性示踪剂的纯化和用于ph稳定化研究的药剂的制备反应结束后,蒸发乙腈(55℃,氩放出;部分真空(250-15毫巴)),并将反应混合物悬浮于流动相(60%乙腈/40%50mm醋酸铵水溶液,1.3ml)中。将该混合物吸入样品环中,注射上hplc柱(phenomenexsynergi4μhydro-rpc18,250x10mm)。通过在等度条件下的色谱法(60%乙腈/40%的50mm醋酸铵水溶液,5ml/min,36min运行时间),纯化混合物。放射合成模块(explorarn化学模块)配有紫外(254nm)和geiger-mueller(gm)检测器。将含有标记的放射性-示踪剂的级分收集在瓶中。加入含有50mg/ml浓度的抗坏血酸的抗坏血酸溶液(10-15ml),使溶液穿过药筒(预先用10ml乙醇、随后用10ml抗坏血酸溶液调节)。18f放射性标记的示踪剂吸附在柱上,抛弃水性洗脱液。用抗坏血酸溶液的另一份等分试样(10ml)洗脱以去除任何额外的副产物和残余的乙腈。然后用乙醇(≤0.5ml)洗脱放射性-示踪剂,并加入装有9.5ml抗坏血酸溶液的瓶中。实施例3:测定ph值对放射性示踪剂制剂溶液的稳定化的影响配制了一系列在不同ph值的抗坏血酸溶液,每种溶液含有5μg/ml冷的放射性药物化合物的19f-类似物2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮(例如,bms-747158-01(api))、乙醇/水(5/95)和50mg/ml抗坏血酸。通过根据需要加入盐酸或氢氧化钠的储备水溶液,调节每种溶液的ph。溶液的列表如表1所示。通过将na18f加入含有冷的放射性药物化合物的19f-类似物的溶液中,开始辐射分解,并通过放射化学纯度的hplc分析方法,在(最少)6小时时间段内监测该溶液。使用具有梯度流动相的c18rp-hplc柱分析该溶液,并使用紫外和放射化学检测器监测洗脱图(elutionprofile)。结果如图1所示。表1.在实施例3中使用的抗坏血酸溶液溶液批号pha0703274.0b0703285.8c0703304.0d0704034.0e0704044.5f0704184.6g0704244.6h0704254.6i0705016.5j0705022.4从图1中的图可以看出,得到的溶液在储存以后的纯度直接取决于最初缓冲的药剂的ph。与具有相对更为酸性的值的溶液相比,在更高的ph值(更接近7-7.5的生理ph)的溶液具有明显更低的储存稳定性。这具体地通过分别具有5.8(溶液b)和6.5(溶液i)的溶液ph值的图来例证。在图1所示的图上,分别存在这2个最低的图。监测放射化学杂质的形成(随着在4.0至8.2范围内的溶液ph而变化)的其它研究如图2所示。对于每种溶液,通过hplc监测放射化学纯度的形成,并将与放射化学杂质相对应的色谱峰的面积绘制为时间的函数。与具有6.0或更大的ph的溶液相比,具有在3.5.-5.5的ph范围的溶液表现出更大的稳定性,这证实了远远更慢的放射化学杂质形成速率。在图2中显示的结果进一步证实了在关键的酸性条件下提高的制剂稳定性的作用。在测试的ph范围内,观察到的放射化学杂质形成的第一阶反应速率减小了超过10倍。实施例4:测定抗坏血酸浓度对放射性示踪剂制剂溶液的稳定化的影响该实施例描述了抗坏血酸浓度对放射化学纯度的影响。在该实施例中,监测在ph5.8的、具有200mg/ml(饱和水平)至20mg/ml的抗坏血酸浓度范围的溶液中18f-标记的药物产品(2-叔丁基-4-氯-5-[4-(2-[18f]氟-乙氧基甲基)-苄氧基]-2h-哒嗪-3-酮)的放射化学纯度(rcp)。显示在图3中的结果表明,在200至50mg/ml范围内,rcp水平没有显著变化,但是在20mg/ml样品中,观察到杂质的增加(即,较低的rcp水平)。这些实施例意图例证本发明的应用,绝不是限制在下面的权利要求书中阐述的本发明的目的、应用和效用。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1