一种注射用卡巴他赛脂质体剂型及其制备方法与流程
本发明涉及一种卡巴他赛液体制剂及其制备方法,具体涉及一种卡巴他赛脂质体注射剂及其制备方法。
背景技术:
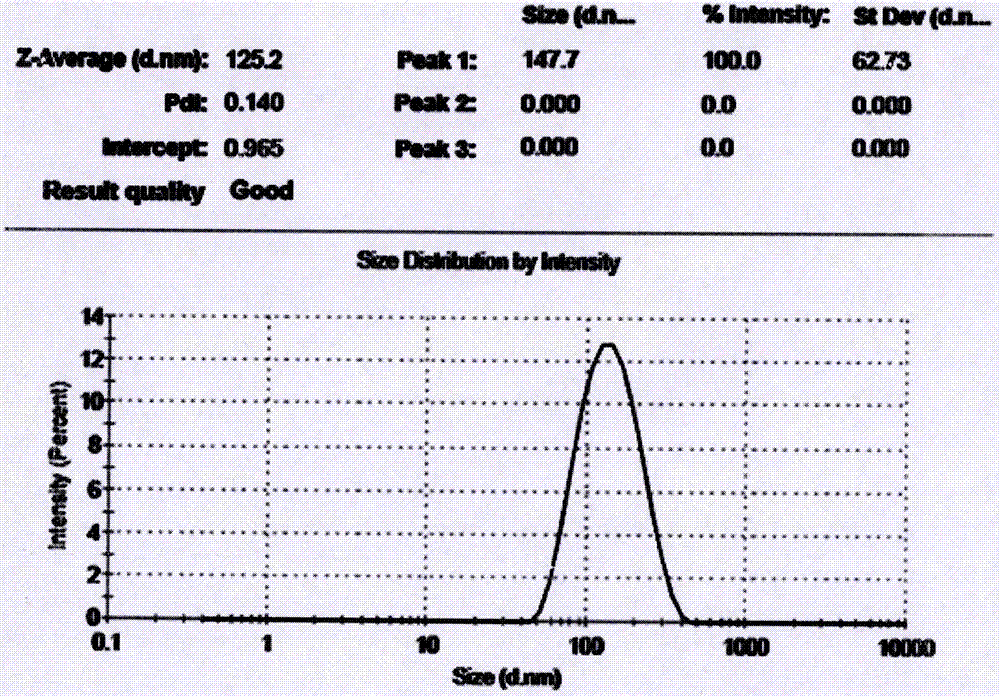
:卡巴他赛(cabazitaxol)属于紫杉烷类抗肿瘤药物,是由紫杉的针叶中提取的化合物半合成的紫杉醇衍生物,由sanofi-aventis公司开发并上市。其作用机理与其它紫杉烷类药物相似,通过促进微管双聚体装配成微管,同时防止去多聚化过程而使微管稳定,阻滞细胞于g2和m期,抑制细胞进一步分裂,从而抑制癌细胞的有丝分裂和增殖。卡巴他赛与多药耐药蛋白atp依赖的药物外排泵p-糖蛋白(p-gp)的亲和力较差,因此可以克服由于p-gp的表达而造成的肿瘤细胞的耐药。2010年6月,美国fda批准卡巴他赛与泼尼松联合用于治疗经多西他赛治疗过的激素难治性转移性前列腺癌。卡巴他赛抗瘤谱广、抗肿瘤作用强,对难治性的乳腺癌、非小细胞肺癌、转移性胃癌等的疗效均较突出,临床应用潜力深厚。sanofi-aventis公司开发的卡巴他赛注射液,存在以下缺陷:(1)溶媒的毒性和致敏性:卡巴他赛水溶性太差,现有注射剂是采用100%的吐温-80作溶剂。研究发现,吐温-80诱导的短暂适中的超敏反应与吐温-80可能造成的体液滞留有关。因此,在使用前须使用抗组胺类药物和非甾体抗炎药物进行预处理,即使处理后,患者仍有可能出现不同程度的过敏反应,需随时进行观察。此外,吐温-80还具有轻微的溶血性。(2)稳定性比较差:上市的卡巴他赛制剂仅有法国赛诺菲公司研制的卡巴他赛注射液(商品名为jevtan)。该注射液先将药物溶解于吐温-80中,临床使用前,用13%乙醇稀释至10mg/ml,而在给药前,进一步用5%葡萄糖或生理盐水稀释至临床使用浓度,稀释后注射液需在4小时内使用,否则将会产生沉淀。另外,卡巴他赛吐温-80溶液在低温15℃以下易析出。本品临床使用前需进行两步稀释,即先用13%乙醇稀释,再用葡萄糖稀释,且需过滤,临床使用步骤繁琐,易析出,存在用药方面的安全隐患。(3)临床剂量准确性较差:本品临床使用前需进行两步稀释,且装量比较小,存在不同护士在配药时剂量有差异,存在影响疗效和安全性。专利cn201210394958.4公开了一种卡巴他赛脂质体注射剂及其制备方法,该脂质体包括卡巴他赛、磷脂、胆固醇、甘露醇或葡萄糖,该技术方案解决了原研普通注射液配方中含有吐温-80的过敏风险,并提高了药物在动物体内的暴露量。但是该组成制备的脂质体成品质量可控性较差,稳定性不佳。本发明针对上述缺陷,提供了一种注射用卡巴他赛脂质体,解决了原研注射液存在的问题:降低溶媒引发的过敏风险;增强药物在体内的靶向性,提高体内生物利用度;改善临床顺应性和药物的稳定性。同时,进一步提高了卡巴他赛脂质体成品质量可控性和稳定性。技术实现要素:本发明提供了一种注射用卡巴他赛脂质体剂型的制备方法,包括卡巴他赛、磷脂、胆固醇、冻干支撑剂、水性介质、稳定剂,六者的重量比为1∶20~80∶0.2~4∶12~32∶200~1000∶0.5~10;优选上述六者的重量比为1∶30~60∶0.25~2.5∶16~28∶300~600∶1.0~6;更优选上述六者的重量比为1∶40~50∶0.35~0.8∶18~24∶400~500∶1.5~3.0。所述的磷脂可以选自大豆磷脂、蛋黄卵磷脂、氢化大豆磷脂、聚乙二醇磷脂、磷脂酰甘油等中的一种或几种。所述的冻干支撑剂可以选自甘露醇、葡萄糖、蔗糖、乳糖、氨基酸、海藻糖等中的一种或几种所述的水性介质包括不同ph值的缓冲液,可以选自磷酸盐缓冲液、枸橼酸盐缓冲液、碳酸盐缓冲液、硫酸铵缓冲盐、两性离子有机化学缓冲液等,ph值可介于4.5~9.0之间。所述的稳定剂可以选自edta-2na、油酸、聚氧乙烯氢化蓖麻油、羟丙基倍他环糊精等。本发明所述卡巴他赛纯度要求在95%~105%之间。本发明注射用卡巴他赛脂质体制备工艺可用真空薄膜浓缩法、旋转蒸发法、高速剪切法、高压均质法等。本发明制备过程中所用有机溶剂可以选自乙醇、二氯甲烷、氯仿、甲醇、乙醚、异丙醇、丙酮等中的一种或几种。本发明提供了一种制备注射用卡巴他赛脂质体的方法:称取处方量的磷脂、胆固醇、卡巴他赛,溶于有机溶剂后蒸干,使混合物成膜。加入水性介质,在30~70℃下水化,取出脂质体冷却后,于细胞破碎仪的探头下超声分散或高速分散机中搅拌,加入冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装,冷冻干燥。本发明制备的注射用卡巴他赛脂质体粒径控制范围为50nm~100nm;包封率大于90%;配伍稳定性考察8h无沉淀析出;24h内体外释放度小于15%;比格犬体内暴露量增加约0.85倍;长期放置6个月稳定性良好。本发明的注射用卡巴他赛脂质体为细胞毒类抗肿瘤药物,可用于转移性激素难治性前列腺癌、脑癌、乳腺癌、非小细胞肺癌等疾病。本发明提供的注射用卡巴他赛脂质体,加入了水性介质和稳定剂,改善了脂质体双分子层的表面张力,降低了脂质体膜的流动性,不仅提高动物体内暴露量、降低溶媒引起的过敏风险、改善临床顺应性,而且提高了脂质体的质量可控性和稳定性。同时,脂质体中的药物持续释放,延长了在血液中的循环时间,提高了药物有效成分的利用率。因此,本品开发成注射用卡巴他赛脂质体新剂型意义重大。附图说明图1为卡巴他赛脂质体粒径图;图2为不含水性介质和稳定剂的卡巴他赛脂质体粒径图;图3为卡巴他赛脂质体zeta电位图;图4为不含水性介质和稳定剂的卡巴他赛脂质体zeta电位图;图5为卡巴他赛标准曲线图;图6为卡巴他赛药物含量检测图谱;图7为卡巴他赛脂质体体外释放曲线对比图;图8为卡巴他赛药时曲线对比图。具体实施方式实施例1制备:称取处方量的蛋黄卵磷脂1000mg、胆固醇10mg、卡巴他赛25mg,用无水乙醇500ml于55~60℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的乙醇液在壁上成膜。55~60℃减压除去无水乙醇后加入同温度水性介质0.01mol/l的pbs溶液(ph值5.7)100ml,60℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至40℃后,于细胞破碎仪的探头下超声分散5min(450w×5min,工作3s,间歇1s),加入5%乳糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为79.16nm,含量为标示量的97.39%,包封率为94.31%。实施例2制备:称取处方量的大豆磷脂1000mg、胆固醇50mg、卡巴他赛28mg,用二氯甲烷550ml于30℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的二氯甲烷溶液在壁上成膜。30℃减压除去二氯甲烷后加入同温度水性介质0.1mol/l的柠檬酸盐(ph值6.6)溶液100ml,30℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于高速分散机中10000rpm分散5min,加入4%葡萄糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为77.54nm,含量为标示量的99.01%,包封率为93.55%。实施例3制备:称取处方量的蛋黄卵磷脂800mg、dspe-mpeg2000200mg,胆固醇20mg、卡巴他赛30mg,用无水乙醇400ml和二氯甲烷1ooml混合溶液于45~50℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的混合溶液在壁上成膜。45~50℃减压除去混合溶剂后加入同温度水性介质0.02mol/l的pbs溶液(ph值7.4,含1.o%油酸)100ml,50℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至40℃后,于细胞破碎仪的探头下超声分散5min(450w×5min,工作3s,间歇1s),加入6%甘露醇冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为79.41nm,含量为标示量的98.63%,包封率为93.60%。实施例4制备:称取处方量的大豆卵磷脂700mg、dspe-mpeg2000300mg,胆固醇40mg、卡巴他赛25mg,用甲醇350ml和二氯甲烷150ml混合溶液于40~45℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的混合溶液在壁上成膜。40~45℃减压除去混合溶剂后加入同温度水性介质0.025mol/l的pbs溶液(ph值8.0,含0.5%rh-40)100ml,45℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于高速分散机中10000rpm分散5min,加入2%甘露醇和2%葡萄糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为80.78nm,含量为标示量的97.99%,包封率为94.05%。实施例5制备:称取处方量的氢化大豆卵磷脂600mg、蛋黄卵磷脂300mg、dspe-mpeg20001oomg,胆固醇25mg、卡巴他赛25mg,用甲醇500ml溶液于45~50℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的甲醇溶液在壁上成膜。45~50℃减压除去甲醇溶剂后加入同温度水性介质0.5%的nahco3溶液100ml,50℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于高速分散机中10000rpm分散5min,加入4%甘露醇和2%乳糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为72.61nm,含量为标示量的97.58%,包封率为94.53%。实施例6制备:称取处方量的氢化大豆卵磷脂200mg、蛋黄卵磷脂900mg,胆固醇20mg、卡巴他赛30mg,用甲醇200ml和无水乙醇350ml混合溶液于50~55℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的混合溶液在壁上成膜。50~55℃减压除去混合溶剂后加入同温度水性介质0.5%的nahco3+0.1mol/l的羟丙基倍他环糊精的混合水溶液1ooml,55℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于细胞破碎仪的探头下超声分散5min(450w×5min,工作3s,间歇1s),加入4.5%乳糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为78.16nm,含量为标示量的98.37%,包封率为93.84%。实施例7制备:称取处方量的氢化大豆卵磷脂800mg、dspe-mpeg2000300mg,胆固醇50mg、卡巴他赛35mg,用无水乙醇500ml和二氯甲烷50ml混合溶液于45~50℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的混合溶液在壁上成膜。45~50℃减压除去混合溶剂后加入同温度水性介质0.2mol/l硫酸铵溶液(ph值7.4)100ml,50℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于细胞破碎仪的探头下超声分散5min(450w×5min,工作3s,间歇1s),加入7%甘露醇冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为79.41nm,含量为标示量的98.11%,包封率为93.26%。实施例8制备:称取处方量的大豆卵磷脂100mg、蛋黄卵磷脂900mg、dspe-mpeg200050mg,胆固醇10mg、卡巴他赛25mg,用无水乙醇400ml和甲醇100ml以及二氯甲烷50ml混合溶液于45~50℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的混合溶液在壁上成膜。45~50℃减压除去混合溶剂后加入同温度水性介质0.1mol/lpbs溶液(ph值5.0,含0.2%油酸)100ml,50℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于高速分散机中10000rpm分散5min,加入2%甘露醇和3%蔗糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为77.70nm,含量为标示量的97.57%,包封率为93.08%。实施例9制备:称取处方量的氢化大豆卵磷脂125mg、dspe-mpeg200050mg、dspg-na50mg,胆固醇10mg、卡巴他赛25mg,用无水乙醇400ml混合溶液于55~60℃水浴搅拌下使溶解,后旋转蒸发,使磷脂的混合溶液在壁上成膜。55~60℃减压除去混合溶剂后加入同温度水性介质0.01mol/lpbs溶液(ph值7.4,含hepes100mg)100ml,50℃水浴中水化(水化时可加入适当玻璃珠搅拌,水化均匀为止,注意水化时搅拌不可过于剧烈),取出脂质体放入烧杯中。冷却至室温后,于高速分散机中10000rpm分散5min,加入4%蔗糖冻干支撑剂,依次经0.45μm、0.22μm滤膜过滤,分装于西林瓶中,冷冻干燥,即得。质控:外观为白色疏松块状,粒径为84.33nm,含量为标示量的98.70%,包封率为93.28%。试验例1:注射用卡巴他赛脂质体质量控制1.试验药物注射用卡巴他赛脂质体(按照实施例3制备)不含水性介质和稳定剂的卡巴他赛脂质体(自制,参照实施例3),将配方中水性介质和稳定剂删除,制备即得。2.质量控制(1)外观本品为白色疏松块状物。(2)粒径仪器:zetasize动态光散射粒度仪,型号:nanozs型,厂家:malvern。样品制备:取注射用卡巴他赛脂质体适量,加pbs缓冲液稀释至2.5ml,经0.22μm微孔滤膜过滤,吸取其1ml于样品池中,用粒度分析仪进行测定,结果如表1,附图1和图2所示。表1卡巴他赛脂质体粒径检测结果样品注射用卡巴他赛脂质体卡巴他赛脂质体(不含水性介质和稳定剂)平均粒径79.41nm125.2nm注:脂质体平均粒径越小,靶向性越强,膜的稳定性越好。(3)zeta电位仪器:zetasize动态光散射粒度仪,型号:nanozs型,厂家:malvern。样品制备:取注射用卡巴他赛脂质体适量,加pbs缓冲液稀释至2.5ml,经0.22μm微孔滤膜过滤,吸取其1ml于样品池中,用电位分析仪进行测定,结果如表2,附图3和图4所示。表2卡巴他赛脂质体zeta电位检测结果样品注射用卡巴他赛脂质体卡巴他赛脂质体(不含水性介质和稳定剂)zetapotential-43.5mv-12.5mv注:脂质体电荷能够减少相互间的聚集和融合,增加稳定性,zeta电位绝对值在30-60mv时,荷电位子比较稳定。(4)含量仪器:高效液相色谱仪,型号:agilent1260。色谱柱:zorbaxeclipseplusc18,150*4.6mm,5um样品制备:取注射用卡巴他赛脂质体适量,加注射用水使其溶解,精密量取样品溶液0.2ml,置10ml量瓶中,用甲醇稀释至刻度,摇匀,经0.22μm微孔滤膜过滤,进样,hplc测定,如附图5和图6所示。结果:本品含量为标示量的98.63%。(5)包封率透析法:精密量取卡巴他赛脂质体2ml,置透析袋中,将透析袋置于烧杯中,加入水合介质200ml,放入搅拌子,密封好,将烧杯置于磁力搅拌器上,启动搅拌,分别于0.5、1、2、4、6、8、10、12、24h取透析外液2ml,并同时补充水合介质2ml。透析外液经0.22μm滤过,取续滤液按上述色谱条件进样。计算各时间点累计含量,并对时间作图,寻找透析平衡点。结果:本品包封率为93.60%。(6)体外释放度装置:模范体内环境进行无菌操作,将样品置透析袋中,再置37℃水浴中,取透析外液进行测定。释放介质:用牛血清白蛋白模仿体内蛋白环境,用磷酸盐缓冲液(pbs,ph=7.4)维持细胞渗透压,调节培养液酸碱平衡,故选用含5%小牛血清的pbs作为体外释放介质。测定方法:取注射用卡巴他赛脂质体适量,置透析袋中,将透析袋置50ml含5%牛血清白蛋白的pbs中,再将上述溶液置37℃水浴中,磁力搅拌,分别于0.5h、1.0h、2.0h、4.0h、6.0h、8.0h、10.0h、12.0h、24.0h时取1ml渗出液,同时补充1ml原液。按hplc法测定,计算释放度,结果如表3、表4和附图7所示。表3注射用卡巴他赛脂质体体外释放度数据时间(h)0.51.02.04.06.08.010.012.024.0释放度(%)0.001.131.512.503.664.575.626.4012.89表4卡巴他赛脂质体(不含水性介质和稳定性)体外释放度数据时间(h)0.51.02.04.06.08.010.012.024.0释放度(%)0.002.563.785.046.858.7210.2111.9322.63结果表明:脂质体中药物的释放有明显的缓释效果,且本发明脂质体缓释效果更好。(7)配伍稳定性取注射用卡巴他赛脂质体适量,加5%葡萄糖或0.9%氯化钠注射液稀释至含卡巴他赛0.12mg/ml,考察放置8小时的稳定性,结果如表5所示。表5注射用卡巴他赛脂质体配伍稳定性数据时间(h)外观粒径(nm)含量(%)包封率(%)0无色至乳白色澄明液体,无沉淀析出82.3297.8594.381无色至乳白色澄明液体,无沉淀析出81.5697.9694.263无色至乳白色澄明液体,无沉淀析出83.4198.7293.606无色至乳白色澄明液体,无沉淀析出83.8998.2692.968无色至乳白色澄明液体,无沉淀析出83.5397.6491.13结果表明:本品配伍稳定性良好。试验例2:注射用卡巴他赛脂质体与卡巴他赛注射液药动学参数比较1.试验药物注射用卡巴他赛脂质体(按照实施例3制备)卡巴他赛注射液(自制,参考jevtana说明书)制备方法:处方量吐温-80与卡巴他赛超声加热溶解后,用13%乙醇水溶液稀释定容,再用5%葡萄糖水溶液稀释至给药浓度,经0.22μm微孔滤膜过滤,即得。2.试验动物spf级beagle犬,雄雌各半,购于:北京玛斯生物技术有限公司,北京市昌平区流村镇瓦窑村,许可证号:scxk(京)2011-0003,发证机关:北京市科学技术委员会。3.试验方法将注射用卡巴他赛脂质体与卡巴他赛注射液通过比格犬采用前肢外侧静脉给药(n=2),给药剂量1.0mg/kg,分布于给药前后0min,2min,5min,15min,30min,1h,2h,4h,6h,8h,10h,24h,48h。比格犬后肢外侧小隐静脉取血0.5ml至1.5mlep管中,肝素抗凝。4℃,条件下10000rpm离心分离血浆。上述含药血浆经处理后,用hplc/ms/ms测定血浆药物浓度,绘制血药浓度-时间曲线。药动学数据经das软件包进行分析,两制剂的药动学参数结果如表6和附图8所示。表6注射用卡巴他赛脂质体与卡巴他赛注射液药动学参数比较结果表明:脂质体与注射液相比比格犬体内半衰期延长约1倍,暴露量增加约0.85倍。试验例3:注射用卡巴他赛脂质体稳定性试验数据比较按本发明专利(实施例3)制得成品分别置于4℃和25℃条件下放置6个月,考察注射用卡巴他赛脂质体稳定性,结果如表7所示。表7注射用卡巴他赛脂质体稳定性试验数据结果表明:本品放置6个月稳定性良好。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1