一种光敏剂复合物及其制备方法和应用与流程
本发明属于光动力治疗技术领域,尤其涉及一种光敏剂复合物及其制备方法和应用。
背景技术:
光动力学治疗(pdt)的原理是,光敏剂吸收特定波长的光后,能将吸收光子所产生的能力转移给周围的氧原子,使之氧化成活性氧,活性氧再氧化脂质、蛋白质、核酸类生物分子,可以对细胞产生杀伤作用。氧气、光敏剂、一定波长的光是pdt治疗的3大要素。
现有的将壳聚糖作为载体制备得到的光敏剂复合物是光动力学治疗所用的光敏剂。虽然此类光敏剂可以显著延长光敏剂在体内的循环时间,减少光敏剂自身的用量,提高光敏剂真正聚集在靶细胞中的比例,但现有的此类光敏剂,在特定的激发光作用下,无论是否被细胞摄取,都能产生光动力学杀伤效果,因此,只适合于光照区域限定在一个范围的实体瘤治疗。由于淋巴瘤细胞是弥散分布在血液中的,pdt治疗血液瘤,需要对血液进行照射,而失去了光照区域选择性,这使得上述以壳聚糖为载体的光敏剂,即便具有靶向性和良好的控释性,也不适合应用于血液瘤的治疗。
技术实现要素:
本发明的目的在于提供一种光敏剂复合物及其制备方法和应用。本发明提供的光敏剂复合物靶向性好、安全性高,能够使光动力学治疗的选择性不依赖于光照区域,使光动力学治疗具备细胞选择性,能很好的应用于血液瘤的治疗。
本发明提供了一种光敏剂复合物,所述光敏剂复合物为壳核结构,以壳聚糖为亲水骨架,壳聚糖亲水骨架内部通过酰胺键偶联疏水化合物,所述疏水化合物与光敏剂偶联,形成核结构;壳聚糖亲水骨架外部与极性水分子作用,所述壳聚糖亲水骨架外部还经特异性抗体修饰,形成壳结构。
优选的是,所述疏水化合物为多烯类疏水化合物,具有两个相邻的羧基。
优选的是,所述多烯类疏水化合物含有共轭双键。
优选的是,所述多烯类疏水化合物为类胡萝卜素类化合物。
优选的是,所述多烯类疏水化合物为2-羧基类胡萝卜素。
优选的是,所述光敏剂为ce6。
优选的是,所述特异性抗体为抗cd19单链抗体,编码抗cd19单链抗体的基因核苷酸序列如seqidno:3所示。
本发明还提供了上述技术方案所述光敏剂复合物的制备方法,包括以下步骤:
1)将壳聚糖与疏水化合物按照质量比为(20~30):4混合进行酯化反应,得到接枝聚合物,通过透析去除残留的疏水化合物;
2)将步骤1)所述接枝聚合物溶于极性溶液得到浓度为0.5~1.5mg/ml的接枝聚合物溶液,将光敏剂以20~40μl/min的速度滴加入接枝聚合物溶液中,得到负载光敏剂的胶束;
3)将步骤2)所述负载光敏剂的胶束与特异性抗体进行酯化反应,得到光敏剂复合物。
本发明还提供了上述技术方案所述光敏剂复合物或上述技术方案所述制备方法得到的光敏剂复合物在制备预防和/或治疗急性b淋巴细胞白血病药物中的应用。
本发明提供了一种光敏剂复合物。本发明的光敏剂复合物为壳核结构,以壳聚糖为亲水骨架,壳聚糖亲水骨架内部通过酰胺键偶联疏水化合物,所述疏水化合物与光敏剂偶联,形成核结构;壳聚糖亲水骨架外部与极性水分子作用,形成壳结构;所述壳聚糖亲水骨架外部经特异性抗体修饰。本发明的光敏剂复合物通过壳核结构的设置,增强了光敏剂的稳定性;特异性抗体在壳聚糖亲水骨架外部的修饰提升了光敏剂的靶向性。在ph呈中性的整个血液循环中,所述光敏剂复合物始终保持稳定的结构,构成内部核结构的疏水化合物和光敏剂接触,通过单线态氧淬灭来抑制光敏剂作用的发挥;当进入细胞内部时,疏水基团在溶酶体的酸性环境下(ph5~6),会从壳聚糖中解离出来,解除了对光敏剂的抑制作用。试验结果表明,本发明的光敏剂复合物能够在血液中长时间循环,具有细胞依赖性,即血液在体外于特定波长激发下,只有进入细胞内部的光敏剂复合物,才能产生单线态氧,对该细胞造成毒性,而血液中未被摄取、残存的光敏剂复合物不会对血液系统造成损伤,安全性高。
本发明提供的光敏剂复合物不需依赖于光照区域,通过其具备的细胞依赖性,只有被细胞摄取的光敏剂才能够产生光致毒性,本发明提供的光敏剂复合物能够实现对急性b淋巴细胞白血病的预防和/或治疗。
附图说明
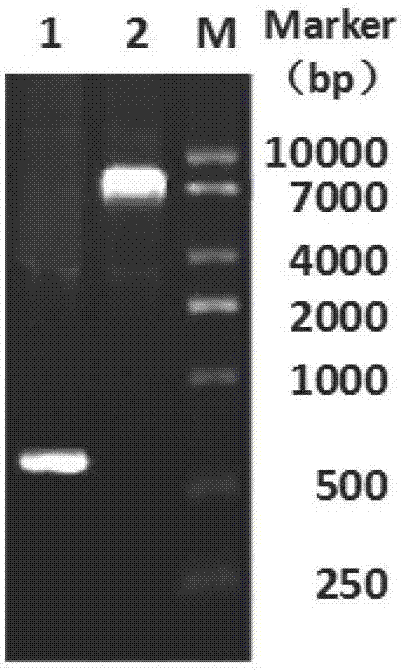
图1为本发明实施例1提供的重组载体构建表达的核酸电泳图;其中lane1是单链抗体(medi-551-scfv);lane2是重组表达载体(pet-sumo-medi-551-scfv);
图2为本发明实施例2提供的wb检测酶切前后所带标签的切除情况图;2a为用抗his的抗体检测产物中的his标签;2b为用抗sumo的抗体检测产物中的sumo标签;lane1:酶切后,产物经ni柱纯化的流出液;lane2:酶切前的ni柱纯化产物;
图3为本发明实施例2提供的酶切前后的sds-page电泳结果图;m:marker;lane1:酶切前的ni柱纯化产物;lane2:酶切后,产物经ni柱纯化的流出液;
图4为本发明实施例5提供的偶联单链抗体的反应产物经sephadexg200葡聚糖凝胶的洗脱曲线;
图5为本发明实施例5提供的光敏剂复合物(anticd19-car-cs-ce6)的制备过程以及ph稳定性示意图:5a为光敏剂复合物(anticd19-car-cs-ce6)的制备路线;5b为光敏剂复合物(anticd19-car-cs-ce6)的在酸性条件下水解,释放游离的ce6示意图;5c为接枝共聚物的结构示意图;
图6为本发明实施例6提供的光敏剂复合物(anticd19-car-cs-ce6)的uv-vis吸收光谱曲线图;
图7为本发明实施例7提供的光敏剂复合物(anticd19-car-cs-ce6)的透射电镜观察结果图;
图8为本发明实施例8提供的ce6浓度-荧光强度标准曲线;
图9为本发明实施例10提供的临界胶束浓度(cmc)测定曲线;
图10为本发明实施例11提供的光敏剂复合物(anticd19-car-cs-ce6)的ce6释放量随ph的变化;
图11为本发明实施例12提供的ce6、car-cs-ce6、anticd19-car-cs-ce6的单线态氧释放量检测;
图12为本发明实施例13提供的raji细胞和pbmc对car-cs-ce6、anticd19-car-cs-ce6的细胞摄取量随时间的变化;
图13为本发明实施例14提供的mtt检测car-cs-ce6、anticd19-car-cs-ce6的raji细胞和pbmc的细胞毒性;
图14为本发明实施例14提供的一种体外自血治疗的装置,a为装置的主体;b为氧气注入口;c为输血器连接口;e和d为led光源的发光面。
具体实施方式
本发明提供了一种光敏剂复合物,所述光敏剂复合物为壳核结构,以壳聚糖为亲水骨架,壳聚糖亲水骨架内部通过酰胺键偶联疏水化合物,所述疏水化合物与光敏剂偶联,形成核结构;壳聚糖亲水骨架外部与极性水分子作用,所述壳聚糖亲水骨架外部还经特异性抗体修饰,形成壳结构。
在本发明中,所述光敏剂复合物能够形成以接枝聚合物为主体形成的胶束,所述胶束包裹光敏剂;疏水化合物与壳聚糖进行酯化反应,通过酰胺键接枝,得到接枝聚合物,所述接枝聚合物通过疏水化合物的疏水键将光敏剂包裹在其内部,形成负载光敏剂的胶束。
在本发明中,所述胶束能够提升光敏剂复合物在水溶液中的分散性。当胶束形态完整时,对于光敏剂特定的激发波长,具有单线态氧淬灭效应;当胶束结构破坏时,对于光敏剂特定的激发波长,恢复相应的光动力学效应。即只有该胶束进入细胞内部时,由于需要经过一个溶酶体结构,溶酶体的酸性环境可以使胶束结构破坏,对于光敏剂特定的激发波长,才能产生单线态氧,产生的单线态氧可以氧化破坏细胞内部结果;当该胶束游离分散在血液中时,由于所处环境为中性,胶束结构保持完整,对于光敏剂特定的激发波长,不会产生单线态氧。
本发明提供的光敏剂复合物以壳聚糖作为亲水骨架,壳聚糖外部的亲水部分,是参与细胞识别和信号传导的重要分子;壳聚糖内部的疏水化合物类似于卵磷脂的长链烃基,类似于细胞膜的组成特点,可以通过胞吞的形式进入细胞。
在本发明中,所述壳聚糖亲水骨架内部通过酰胺键偶联疏水化合物,形成接枝聚合物;所述酰胺键是壳聚糖亲水骨架内部的氨基与疏水化合物通过酯化反应形成的;本发明对键合到所属壳聚糖亲水骨架内部疏水化合物的数量没有特殊的限定。
在本发明中,所述疏水化合物和光敏剂通过疏水键相互作用,形成偶联,得到核结构。
在本发明中,所述疏水化合物优选为多烯类化合物,具有至少两个相邻的羧基。在本发明中,所述多烯类疏水化合物结构中含有共轭双键。在本发明中,所述多烯类疏水化合物优选为类胡萝卜素类化合物,更优选为番茄红素、β-胡萝卜素、叶黄素或斑蝥黄素。在本发明中,所述类胡萝卜素类化合物的作用为当和光敏剂通过疏水键结合时,可以吸收光敏剂被特定波长的光激发后产生的能量,阻止这种能量传递给氧原子,从而出现单线态氧淬灭效应。
在本发明中,所述多烯类疏水化合物还可以为2-羧基类胡萝卜素。本发明对所述2-羧基类胡萝卜素的来源没有特殊的限定,采用本领域技术人员熟知的2-羧基类胡萝卜素的市售产品即可。在本发明中,疏水化合物的两个相邻的羧基中,一个羧基用于与亲水骨架的壳聚糖形成酰胺键相连,另一个羧基在形成的酰胺键的邻位,这种结构在中性条件下稳定,在酸性条件下会发生水解。
在本发明中,所述光敏剂优选为ce6。所述ce6为疏水性光敏剂,能够被疏水化合物包裹在接枝聚合物形成的胶束的内部形成核结构。
在本发明中,所述壳聚糖亲水骨架外部与极性水分子作用,形成壳结构。在本发明中,所述壳聚糖亲水骨架与极性水分子优选通过氢键相互作用。在本发明中,所述壳结构类似于水化膜的作用,能够保护内部的疏水性核结构,增强核结构的水溶性。
在本发明中,所述壳聚糖亲水骨架外部经特异性抗体修饰。所述特异性抗体为抗cd19单链抗体,编码抗cd19单链抗体的基因核苷酸序列如seqidno:3所示。在本发明中,所述抗cd19单链抗体能够使得该光敏剂复合物被表达cd19的细胞靶向性摄取。
在本发明中,所述抗cd19单链抗体编码序列的获得是:通过drugbank获得抗cd19抗体(medi-551)的vh序列(如seqidno:1所示)和vl序列(如seqidno:2所示),再通过一段柔性肽(g4s)3将vl的c端和vh的n端相连,获得抗cd19的单链抗体(medi-551-scfv)的序列(如seqidno:3所示)。seqidno:3所示序列具体为:
本发明对所述抗cd19单链抗体的获得方式没有特殊的限定,采用本领域技术人员熟知的蛋白表达方式即可。在本发明中,所述抗cd19单链抗体通过构建入表达载体,在宿主菌中表达获得。所述表达载体优选为抗pet-sumo中,本发明对所述表达载体的构建方法没有特殊的限定,采用本领域技术人员熟知的表达载体构建方法即可,如酶切连接方法;具体地,所述双酶切方法优选选用bamhi和hinderiii酶切位点进行表达载体的构建。本发明对所述宿主菌的选择没有特殊的限定,采用本领域技术人员熟知的常规蛋白表达菌株即可,本申请优选采用大肠杆菌菌株origami2(de3)。
在本发明中,所述抗cd19单链抗体采用发酵获得,本发明对所述发酵的方法没有特殊的限定,采用本领域技术人员熟知的大肠杆菌发酵蛋白的常规方法即可。本发明优选对发酵得到的蛋白进行纯化,得到抗cd19单链抗体,本发明对所述蛋白的纯化方法也没有特殊的限定,采用本领域技术人员熟知的蛋白纯化方法即可,如镍柱纯化方法。
本发明还提供了上述技术方案所述光敏剂复合物的制备方法,包括以下步骤:
1)将壳聚糖与疏水化合物按照质量比为(20~30):4混合进行酯化反应,得到接枝聚合物,通过透析去除残留的疏水化合物;
2)将步骤1)所述接枝聚合物溶于极性溶液得到浓度为0.5~1.5mg/ml的接枝聚合物溶液,将光敏剂以20~40μl/min的速度滴加入接枝聚合物溶液中,得到负载光敏剂的胶束;
3)将步骤2)所述负载光敏剂的胶束与特异性抗体进行酯化反应,得到光敏剂复合物。
本发明将壳聚糖与疏水化合物按照质量比为(20~30):4混合进行酯化反应,得到接枝聚合物,通过透析去除残留的疏水化合物。在本发明中,所述壳聚糖与疏水化合物的质量比优选为25:4。在本发明中,所述酯化反应中疏水化合物的其中一个羧基与壳聚糖的2-氨基通过酰胺键进行连接。本发明对所述透析的方法没有特殊的限定,采用本领域技术人员熟知的常规透析方法即可。
得到接枝聚合物后,本发明将接枝聚合物溶于极性溶液得到浓度为0.5~1.5mg/ml的接枝聚合物溶液,将光敏剂以20~40μl/min的速度滴加入接枝聚合物溶液中,得到负载光敏剂的胶束;在本发明中,所述极性溶液优选为pbs,本发明对所述pbs没有特殊的限定,采用本领域技术人员熟知的常规pbs即可。在本发明中,所述接枝聚合物在极性溶液中的浓度优选为1mg/ml,所述光敏剂的滴加速率优选为30μl/min。
得到负载光敏剂的胶束后,本发明将所述负载光敏剂的胶束与特异性抗体进行酯化反应,得到光敏剂复合物。在本发明中,特异性抗体优选与胶束中未参与反应的壳聚糖中的2-氨基通过酰胺键进行连接。
具体地,当所述光敏剂复合物中光敏剂为ce6,编码抗cd19单链抗体的基因核苷酸序列如seqidno:3所示,多烯类疏水化合物为2-羧基类胡萝卜素时,对应的光敏剂复合物的制备方法包括以下步骤:
1)构建表达载体(pet-sumo-medi-551-scfv)以及表达菌(origami2(de3)/pet-sumo-medi-551-scfv);
2)利用ni柱纯化-酶切-ni柱再纯化的方式,获得相应的抗cd19单链抗体蛋白(medi-551-scfv),利用westernblotting联合sds-page证明该蛋白得以正确表达;
3)将2-羧基类胡萝卜素与壳聚糖进行酯化反应形成酰胺键,得到接枝聚合物:2-羧基类胡萝卜素-壳聚糖(car-cs);
4)将所述接枝聚合物与光敏剂进行包埋反应形成内部为2-羧基类胡萝卜素和光敏剂作用的核结构,外部为亲水性壳聚糖的壳结构,得到负载光敏剂的胶束:2-羧基类胡萝卜素-壳聚糖-ce6胶束(car-cs-ce6);
5)将单链抗体(medi-551-scfv)与步骤4)得到的负载光敏剂胶束进行酯化反应形成酰胺键,获得最终产物:抗cd19的单链抗体修饰的2-羧基类胡萝卜素-壳聚糖-ce6胶束(anticd19-car-cs-ce6)。
本发明构建表达载体(pet-sumo-medi-551-scfv)以及表达菌(origami2(de3)/pet-sumo-medi-551-scfv)。在本发明中,构建表达载体前,优选对抗体的序列进行设计,本发明所述编码抗体的序列如seqidno:3所示,所述seqidno:3所示序列的设计方法为:通过drugbank获得抗cd19抗体(medi-551)的vh序列(如seqidno:1所示)和vl序列(如seqidno:2所示),再利用overlappcr的方法,通过一段柔性肽(g4s)3将vl的c端和vh的n端相连得到seqidno:3所示序列。本发明对所述overlappcr的条件没有特殊的限定,采用本领域技术人员熟知的overlappcr反应条件即可。
得到表达菌后,本发明利用ni柱纯化-酶切-ni柱再纯化的方式,获得相应的抗cd19单链抗体蛋白(medi-551-scfv),利用westernblotting联合sds-page证明该蛋白得以正确表达。本发明对利用表达菌进行抗体蛋白表达的方法没有特殊的限定,采用本领域技术人员熟知的常规大肠杆菌培养方法以及蛋白诱导表达方法即可。本发明对所述ni柱纯化的方法没有特殊的限定,采用本领域技术人员熟知的ni柱纯化方法即可。本发明对所述酶切方法没有特殊的限定,采用本领域技术人员熟知的蛋白酶切方法即可,具体的,本申请表达得到的蛋白his标签与蛋白之间有sumo酶切位点,本发明选用sumo酶进行酶切,本发明对所述酶切条件没有特殊的限定,采用本领域技术人员熟知的sumo酶常规酶切条件即可。
本发明将2-羧基类胡萝卜素与壳聚糖进行酯化反应形成酰胺键,得到接枝聚合物:2-羧基类胡萝卜素-壳聚糖(car-cs)。本发明对所述2-羧基类胡萝卜素与壳聚糖的来源没有特殊的限定,采用本领域技术人员熟知的2-羧基类胡萝卜素与壳聚糖的常规市售产品即可。在本发明中,所述壳聚糖与2-羧基类胡萝卜素的质量比优选为(20~30):4,更优选为25:4。本发明对所述酯化反应的条件没有特殊的限定,采用本领域技术人员熟知的酯化反应条件即可。
得到2-羧基类胡萝卜素-壳聚糖(car-cs)后,本发明将所述接枝聚合物与光敏剂进行包埋反应形成内部为2-羧基类胡萝卜素和光敏剂作用的核结构,外部为亲水性壳聚糖的壳结构,得到负载光敏剂胶束:2-羧基类胡萝卜素-壳聚糖-ce6胶束(car-cs-ce6)。在本发明中,所述2-羧基类胡萝卜素-壳聚糖与光敏剂的质量比优选为(10~20):1,更优选为15:1。在本发明中,所述光敏剂优选为ce6。本发明对所述包埋反应条件没有特殊的限定,采用本领域技术人员熟知的包埋反应的常规方法即可。
得到切除标签表达正确纯化后的目的单链抗体和负载光敏剂胶束后,本发明将单链抗体(medi-551-scfv)与负载光敏剂胶束进行酯化反应形成酰胺键,获得最终产物:抗cd19的单链抗体修饰的2-羧基类胡萝卜素-壳聚糖-ce6胶束(anticd19-car-cs-ce6)。本发明对所述酯化反应的条件没有特殊的限定,采用本领域技术人员熟知的酯化反应条件即可。
在本发明中,所述光敏剂复合物在ph为中性条件下稳定,ph6.5时发生约30%的解离,ph低于6.0时,解离度逐渐增高,约为80%。
具体的,当本发明的光敏剂复合物为anticd19-car-cs-ce6时,所述光敏复合物具有ph敏感性,形成胶束的疏水化合物为2-羧基类胡萝卜素类似物,其参与反应的一端具有2个羧基,通过其中一个羧基形成酰胺键共价结合在主链壳聚糖上的,而另一个羧基保持游离状态,由于邻位具有羧基的酰胺键在酸性条件下(ph6.0)容易发生水解,使得该胶束类光敏剂复合物在ph低于6.0时,因疏水化合物的解离丧失原有的壳核结构,包裹在其中的光敏剂被释放出来。
光敏剂复合物anticd19-car-cs-ce6结构稳定时,会产生活性氧淬灭效应。由于其疏水化合物2-羧基类胡萝卜素类似物为共轭多烯类疏水化合物,当与ce6紧密接触时,共轭双键能很好的与ce6中的吡咯环发生重叠,通过fret效应,转移ce6吸收特定波长而产生的能量,从而淬灭ce6的活性氧产量。
本发明还提供了上述技术方案所述光敏剂复合物或上述技术方案所述制备方法得到的光敏剂复合物在制备预防和/或治疗急性b淋巴细胞白血病药物中的应用。
本发明对所述药物的剂型没有特殊的限定,采用本领域技术人员熟知的常规药物剂型即可。在本发明中,所述药物的剂型优选为冻干粉末,优选采用生理盐水在避光条件下溶解,所述药物的浓度优选为5~10mg/ml。
所述光敏剂复合物进入细胞的过程为:通过表面修饰的抗cd19单链抗体,靶向性地定位于表达cd19的细胞表面,随后经历内吞作用进入细胞,依次被包裹在内吞体(ph6.0),溶酶体(ph5.0)2个细胞器内,在这2个细胞器的酸性环境中,该光敏剂复合物被分解,释放游离的光敏剂ce6。所述光敏剂复合物anticd19-car-cs-ce6在血液中,其稳定性具有细胞依赖性的特点,只有进入细胞内部,才能释放出游离的光敏剂ce6,相对应的单线态氧产量也具有细胞依赖性特点,即只有被细胞摄取的光敏剂复合物(anticd19-car-cs-ce6),在特定激发波长下,才能产生单线态氧。
具体地,为了验证该光敏剂复合物的治疗过程和效果,本发明实施具体给予患者服用5~10mg/ml的该光敏剂复合物(anticd19-car-cs-ce6),24h后抽取患者一部分血液,于体外进行671nm波长的照射,只有进入表达cd19靶细胞的光敏剂复合物才能产生单线态氧,而在血液中未被摄取的光敏剂复合物(anticd19-car-cs-ce6)不会产生单线态氧,因此对靶细胞破坏的同时,不会对血液中的正常细胞(正常的白细胞,红细胞等)和其他非细胞成分(血小板,血浆白蛋白等)造成损伤。因此,具有安全性。由于所述光敏剂复合物(anticd19-car-cs-ce6)能在血液中长时间循环,所以一次体外自血治疗后,残留的光敏剂复合物(anticd19-car-cs-ce6)可以在其后的血液循环中继续被靶细胞摄取,达到一次给药,多次治疗的效果。
下面结合具体实施例对本发明提供的一种抗cd33单链抗体及光敏剂复合物及其制备方法做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
实施例1
medi-551-scfv表达载体的构建:
通过drugbank获得抗cd19抗体(medi-551)的vh序列(如seqidno:1所示)和vl序列(如seqidno:2所示),再利用overlappcr的方法,通过一段柔性肽(g4s)3将vl的c端和vh的n端相连,获得了抗cd19的单链抗体(medi-551-scfv)的序列(如seqidno:3所示),在序列的2端添加上bamhi和hinderiii酶切位点,以酶切酶连的方式插入表达载体pet-sumo中,经过菌落pcr验证和测序,筛选出正确的重组表达载体:pet-sumo-medi-551-scfv电泳结果如图1所示,其中lane1是单链抗体(medi-551-scfv);lane2是重组表达载体(pet-sumo-medi-551-scfv)。
将重组表达载体转化入origami2(de3),利用50ug/ml的卡那霉素筛选出正确的表达菌株:origami2(de3)/pet-sumo-medi-551-scfv。
实施例2
medi-551-scfv蛋白的获得:
将表达菌株(origami2(de3)/pet-sumo-medi-551-scfv)进行2l的大规模发酵,提取其胞质蛋白,由于该表达载体得到的目的蛋白其5’端带有his标签,且其后含有一段sumo酶切位点,因此采用ni柱纯化-酶切-ni柱再纯化的方式,获得了相应的单链抗体(medi-551-scfv)蛋白。
具体步骤如下:
1)收集培养的大肠杆菌,4℃,8000rpm离心30min,获得细菌沉淀。
2)将沉淀重悬于20ml含有0.1mg/ml溶菌酶的细胞裂解液(50mmtris-hcl,0.5mnacl,1%tritonx-100,ph8.0)中,超声处理10min。
3)将上述混合物于4℃,磁力搅拌30min后,14000rpm离心30min,收集上清液,并用0.22um滤膜过滤。
4)将滤过的上清液上样预先用pbs平衡的ni柱,上样结束后,用5个柱体积的pbs洗涤。
5)用咪唑浓度依次为10mm、20mm、50mm、100mm、200mm、500mm的洗脱液进行梯度洗脱,每种洗脱浓度收集10管,1ml/管。
6)各管洗脱产物,经过sds-page验证后,确定含有目的蛋白的洗脱组分,并将这些组分合并,获得5端带有his标签以及随后的sumo酶切位点目的蛋白的融合形式。
7)装于透析带中,用500mlpbs透析3次,每次12h。
8)得到的透析产物中按100iu/ml加入sumo蛋白酶(该酶同样含有his标签),于37℃反应10h,反应产物再次经ni柱吸附,收集流出液,流出液利用超滤管(mwco:50kda),超滤得到浓缩液,得到浓缩的产物经wb验证(结果见图2:2a为用抗his的抗体检测产物中的his标签;2b为用抗sumo的抗体检测产物中的sumo标签;lane1:酶切后,产物经ni柱纯化的流出液;lane2:酶切前的ni柱纯化产物),sds-page验证(结果见图3:m:marker;lane1:酶切后,产物经ni柱纯化的流出液;lane2:酶切前的ni柱纯化产物)。证明正确表达的目的蛋白的纯化标签被有效切除,获得蛋白质的最终序列如seqidno:4所示。
实施例3
2-羧基类胡萝卜素-壳聚糖(car-cs)的合成
1)称取壳聚糖50mg,溶于20ml的ddh2o中,称取2-羧基类胡萝卜素酸酐8mg,溶于20ml的45℃乙醇中。
2)将以上2种溶液于80℃下混合,用磁力搅拌器250rpm下搅拌过夜。
3)在反应混合液中加入250ml冷乙醚产生沉淀,过滤,得到的沉淀再用100ml冷乙醚洗涤数次。
4)用50mlddh2o复溶沉淀,反应混合物在冰水浴中,用20%naoh调节ph至10,抽滤。
5)滤液装于透析袋(mwco为10000)中,透析液为10%的乙醇溶液,透析3次,去除反应中的杂质。
6)随后将透析液更换为ddh2o,再透析2次,去除残留乙醇。
7)将透析产物冻干。得到深黄色产物2-羧基类胡萝卜素-壳聚糖(car-cs)。
实施例4
2-羧基类胡萝卜素-壳聚糖-ce6胶束(car-cs-ce6)的合成:
1)称取2-羧基类胡萝卜素-壳聚糖15mg,溶于15mlpbs溶液中,于37℃,磁力搅拌过夜,使其完全溶解;称取ce61mg,溶于600μlthf溶液中,得到ce6溶液。
2)将ce6溶液缓慢滴加到2-羧基类胡萝卜素-壳聚糖溶液中,控制滴加速率,30μl/min,滴加过程中,全程用磁力搅拌器搅拌混合。
3)滴加完毕后,于37℃继续搅拌24h,得到2-羧基类胡萝卜素-壳聚糖-ce6胶束(car-cs-ce6)。
实施例5
抗cd19的单链抗体修饰的2-羧基类胡萝卜素-壳聚糖-ce6胶束(anticd19-car-cs-ce6)的合成:
1)于上述制备的胶束溶液中,加入edc溶液(50mg/ml)和nhs溶液(50mg/ml)各0.15ml,室温孵育20min后,再加入medi-551-scfv溶液(0.16mg/ml)0.15ml,室温轻轻搅拌1h,
2)反应产物通过sephadexg200葡聚糖凝胶柱,用0.01m的pbs(ph7.4)作为洗脱相,以2ml/管收集洗脱液。
3)检测每管洗脱液中280nm出的吸收值,绘制洗脱曲线,结果如图4所示,
4)可以看出,图中的前后2个洗脱峰,分别对应偶联抗cd19的单链抗体(medi-551-scfv)的胶束,以及未参与反应的游离的medi-551-scfv。收集混合并第一个洗脱峰所对应管中的洗脱液。
5)合并相经过超滤浓缩,得到表面有medi-551-scfv修饰的2-羧基类胡萝卜素-壳聚糖-ce6胶束。
整个的制备过程以及ph稳定性如图5所示。
实施例6
uv-vis光谱分析:
将anticd19-car-cs-ce6的pbs溶液(浓度为0.01mg/ml),置于石英皿中,测量其在250-700nm波长范围内的吸光度,绘制uv-vis曲线,结果如图6所示。
可以看出,有5个吸收峰,其中,280nm处为蛋白质,也就是medi-551-scfv特有的吸收峰;414和664nm两处为ce6特有的吸收峰;472和501nm两处为类胡萝卜素特有的吸收峰;260-320nm范围内,有一个宽泛的吸收带,和280处的蛋白质吸收峰有些重叠,这是壳聚糖衍生物的吸收谱带。
实施例7
tem检测
将样品溶于ddh2o,与3%磷钨酸按体积比50:1混合染色后,取3μl混合液滴加于覆盖碳膜的铜网上,待其自然干燥;用透射电镜观察其形态和大小。结果如图7所示。
可以看出,制得的胶粒,表面比较光滑,呈现类球形。
实施例8
载药量和包封率的测定
将用pbs稀释的以下浓度ce6稀释液:0.8、1、2、4、5μg/ml,用667nm波长激发,检测其715nm处的荧光发射强度,以组为横坐标,检测到的相应荧光发射强度为纵坐标,绘制ce6浓度-荧光强度标准曲线(结果见图8),得到ce6浓度-荧光强度的回归方程为:i=0.464c3+1.736(r2=0.9988)
将500μl纳米粒混悬液于millipore超滤离心管(mwco为10kda),8000rpm离心40min,将滤出液收集后,用pbs稀释10倍,用671nm波长激发,检测其715nm处的荧光发射强度,再换算为ce6含量,作为ce6游离药量。
包封率=(ce6总投药量-ce6游离药量)/ce6总投药量×100;载药量=(ce6总投药量-ce6游离药量)/纳米粒质量×100。
结果表明,包封率为:(64.2±1.6)%;载药量为:(6.5±1.6)%。
实施例9
平均粒径和zeta电位的测定
将合成的anticd19-car-cs-ce6溶解于pbs,得到浓度为1mg/ml的溶液。应用动态光散射仪(dls),测得化合物平均水化粒径。
结果显示,平均粒径为(35.4±2.4)nm,平均zeta电位为(23.5±1.7)mv。
实施例10
临界胶束浓度(cmc)测定
采用芘荧光法。将30μmol/l芘的丙酮溶液加入到一系列15ml离心管中,100μl/管,37℃使丙酮完全挥发,加入5ml不同质量浓度(0.01、0.02、0.04、0.06、0.08、0.1、0.2、0.4、0.6、0.8、1mg/ml)的anticd19-car-cs-ce6溶液,室温超声40min,然后65℃水浴恒温3h,室温冷却,静置12h后,利用波长为334nm激发,检测以上溶液在373nm和384nm处的荧光强度比值,以该比值作为纵坐标,以相应的各溶液中的胶束质量浓度的对数为横坐标,绘制曲线,结果如图9所示,确定载体的cmc的值为2.4μg/l。
实施例11
ce6释放量随ph的变化:
1)取6.0ml的anticd19-car-cs-ce6(含1.5mg的ce6)放入6个透析袋中,分别置于6个150ml不同ph的透析液中,透析介质为pbs缓冲液中,ph依次为;5.0、5.5、6.0、6.5、7.0、7.5。
2)分别于l、2、3、4、5h取出1.5ml透析液,同时补回相同体积对应ph的透析液。
3)将不同时间点取出的透析液,利用激发波长为671nm的光激发后,检测在715nm出的发射强度。再根据ce6浓度-荧光强度标准曲线,计算出对应的ce6含量。
4)将测得的ce6含量与总ce6的比值,作为释放量,以不同的时间点为横坐标,对应的ce6释放量为纵坐标,绘制不同ph环境下anticd19-car-cs-ce6的释放量,结果如图10所示。
可以看出,ph为7.0和7.5时,释放量很低,基本不超过10%,且随时间变化不明显;而在为6.5时,释放量随时间延长而增加,但最终不超过30%;在ph6.0以后,药物的释放量就显著增加,在ph为5.5时,1h后的释放量达到60%,而在ph为5.0时,1h后的释放量即达到80%。
实施例12
单线态氧释放量检测
利用rno脱色反应检测单线态氧的释放量,具体步骤如下:
1)将rno溶于重水(d2o),配成终浓度为250μm的溶液a。
2)将组氨酸溶于重水(d2o),配成终浓度为0.03m的溶液b。
3)将溶液a和溶液b按体积比1:3混合,得到溶液c。
4)6.67μm游离的ce6、car-cs-ce6和anticd19-car-cs-ce6,分别溶解在700μl含有1%dmso的重水中,随后在相应的测试组中,加入400μl溶液c,将混合溶液置于石英皿中,立刻检测440nm处的发光强度,记为初始发光强度。
5)用波长为671nm、强度为6j/cm2的光源照射上述石英皿中的溶液30min。并且在此期间,每隔2min检测440nm的发光强度。每个时间点的单线态氧产量的比例为:(初始发光强度-该时间点的发光强度)/初始发光强度×100%。
6)以时间为横坐标,以该时间点的单线态氧产量比例为纵坐标,得到单线态氧产量曲线。结果如图11所示。
可以看出,单纯的光敏剂ce6的单线态氧的释放量随时间呈显著性增加,30min的释放量达到85%左右。
car-cs-ce6的单线态氧释放量很低,最高不超过20%;anticd19-car-cs-ce6的单线态氧释放量更低,最高不超过15%,且没有时间依赖性,
可能是由于car-cs-ce6胶体中类胡萝卜素对包裹的ce6有很好的光漂白作用,使ce6吸收相应波长所产生的能量,大部分通过fret效应传递给中类胡萝卜素,而不是周围的氧原子,因此单线态氧的产量大大降低。而在anticd19-car-cs-ce6胶体中,由于外表面有亲水性的anticd19修饰,使得胶束的结构更加致密,类胡萝卜素对ce6的光漂白作用更强,单线态氧的产量更低。
实施例13
细胞摄取量测定
由于raji细胞是已经报道的表面高表达cd19分子的b-all细胞,而pbmc表面很少有cd19分子的表达。
1)收集pbs洗涤后的5×107个对数生长期的raji细胞,3000rpm离心5min,得到细胞沉淀,加入1ml细胞裂解液(0.1mnaoh,1%sds),得到细胞裂解产物。
2)将10μl不同剂量的car-cs-ce6和anticd19-car-cs-ce6,加入100μl上述细胞裂解产物中,依次得到car-cs-ce6终浓度为0.8、1、2、4、5μg/ml的裂解液混合物,
3)混合物于超声振荡40min,然后12000rpm离心30min,取上清。
4)将上清于671nm的激发波长下,检测715nm处相应浓度的吸光度数值,得到裂解液中,胶束浓度与吸光值的关系。
5)将处于对数生长期的raji细胞铺于6孔板的6个孔中,1×106细胞/孔。
6)24h后,更换新鲜培养基,加入用pbs稀释的car-cs-ce6和,再孵育0h、1h、2h、4h、8h、16h、24h。
7)到取样时间点时,将对应孔中的细胞悬液移至一干净ep管,3000rpm离心5min,得到细胞沉淀,经pbs洗涤2次后,再根据步骤1)、3)、4),得到相应的胶束含量。
8)以不同的时间点为横坐标,对应的胶束含量为纵坐标,得到2种胶束的raji细胞摄取量随时间的变化曲线。
9)采用同样的方法,得到2种胶束的健康人pbmc摄取量随时间的变化曲线。结果如图12所示。
可以看出,白血病raji细胞对anticd19-car-cs-ce6的摄取量很高,4h即能达到40%左右,且有很强的时间依赖性,24h的摄取量约为82%;相比之下,对car-cs-ce6的摄取量很低,摄取量随时间的增加较为平缓,24h的摄取量仅为30%左右;而正常细胞对这2种胶束的摄取量都不高,随时间推移仅有少量变化。
说明,经过特异性抗体修饰后,anticd19-car-cs-ce6胶束有很好的白血病细胞靶向功能,同时,降低在正常细胞中的聚集。
实施例14
细胞毒性测定
检测car-cs-ce6和anticd19-car-cs-ce6对于raji细胞和健康人pbmc的细胞毒性,
1)将对数生长期的raji细胞铺96孔板,5000细胞/孔,培养24h,
2)3000rpm离心5min,吸弃上清,然后,换成无血清的1640培养基,每个细胞分为3组,每组3复孔,分别加入pbs、等摩尔量的car-cs-ce6和anticd19-car-cs-ce6。使得ce6终浓度为5ug/ml、
3)于培养箱中避光温育1h后,换成新鲜的1640+10%fbs培养基,100μl/孔,于培养箱中避光培养24h。
4)进行671nm波长光照射,光照时间为5min,光照能量为9j/cm2。此后,再培养箱中避光培养2h。
5)每孔加入11μlmtt溶液(5mg/ml),孵育4h,3000rpm离心5min,弃上清,每孔加入dmso200μl溶解甲臜,于酶标仪570nm处检测吸光度。细胞抑制率(%)=1-实验组吸光度值/对照组吸光度值×100%。
6)用同样的方法,检测以上2种胶束对健康人pbmc的细胞毒性,
结果如图13所示。可以看出,anticd19-car-cs-ce6对raji细胞有很强的毒性,抑制率高达90%。而car-cs-ce6对raji细胞的抑制率相对较低,为50%左右;这2种胶束对于pbmc均显示出较低的毒性,抑制率为10%左右。由于正常人血中也含有极少量的表达cd19的前b细胞,所以anticd19-car-cs-ce6对该部分细胞也有一定的细胞毒性,但由于不影响正常造血干细胞和成熟的b细胞,所以对于人血中正常成分的影响微乎其微。
这2种胶束表现出的细胞毒性与细胞摄取率结果一致。说明,抗体修饰后的胶体具有靶向性,从而显示出,更高效、更有特异性的杀伤力。
实施例15
体外循环光动力学治疗:
通过一种治疗装置,如图14所示,可以容纳400ml血液,基本材质是聚二甲基硅氧烷,具有良好的光学透明性能。
装置的主体a,其内部尺寸为40cm×40cm×0.25cm的扁平结构,即长和宽均为40cm,厚度为0.25cm。上下2个面为照射面,其侧面有2个端口(b和c),分别用于注射氧气,和连接输血器。
治疗装置的光源为具有相同照射面积(40cm×40cm)的led发光阵列,光源密度为:每cm2有16个led微型发光二极管,其发射波长为671nm。使用时,将2个光源的发光面(d和e)紧贴着治疗主体a的上下2个照射面。
具体治疗过程如下:
1)对已经检测出cd19表达的b-all患者静脉输入10mg/kg经0.22μm过滤后的anticd19-car-cs-ce6,给药后,患者需避光24h。
2)抽取患者350ml血液,从c端灌于上述含有50ml抗凝剂的治疗装置中。
3)在b端注射经0.22μm过滤后的纯氧气1ml,按顺时针3-4次充分混匀。
4)将治疗装置于暗室中,用其光源照射3次,每次照射3min,两次间隔1min。随后将照射后的自体血液输回患者体内,作为一次治疗。
患者每次给药后,需要接受一个疗程,包括5次治疗,两次治疗间隔30min。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
sequencelisting
<110>李斯文
<120>一种光敏剂复合物及其制备方法和应用
<130>2017
<160>4
<170>patentinversion3.3
<210>1
<211>363
<212>dna
<213>人工序列
<400>1
gaagtgcagctggtggaaagcggcggcggcctggtgcagccgggcggcagcctgcgcctg60
agctgcgcggcgagcggctttacctttagcagcagctggatgaactgggtgcgccaggcg120
ccgggcaaaggcctggaatgggtgggccgcatttatccgggcgatggcgataccaactat180
aacgtgaaatttaaaggccgctttaccattagccgcgatgatagcaaaaacagcctgtat240
ctgcagatgaacagcctgaaaaccgaagataccgcggtgtattattgcgcgcgcagcggc300
tttattaccaccgtgcgcgattttgattattggggccagggcaccctggtgaccgtgagc360
agc363
<210>2
<211>333
<212>dna
<213>人工序列
<400>2
gaaattgtgctgacccagagcccggattttcagagcgtgaccccgaaagaaaaagtgacc60
attacctgccgcgcgagcgaaagcgtggatacctttggcattagctttatgaactggttt120
cagcagaaaccggatcagagcccgaaactgctgattcatgaagcgagcaaccagggcagc180
ggcgtgccgagccgctttagcggcagcggcagcggcaccgattttaccctgaccattaac240
agcctggaagcggaagatgcggcgacctattattgccagcagagcaaagaagtgccgttt300
acctttggcggcggcaccaaagtggaaattaaa333
<210>3
<211>757
<212>dna
<213>人工序列
<400>3
ggatccatggaaattgtgctgacccagagcccggattttcagagcgtgaccccgaaagaa60
aaagtgaccattacctgccgcgcgagcgaaagcgtggatacctttggcattagctttatg120
aactggtttcagcagaaaccggatcagagcccgaaactgctgattcatgaagcgagcaac180
cagggcagcggcgtgccgagccgctttagcggcagcggcagcggcaccgattttaccctg240
accattaacagcctggaagcggaagatgcggcgacctattattgccagcagagcaaagaa300
gtgccgtttacctttggcggcggcaccaaagtggaaattaaaggcggcggcggcagcggc360
ggcggcggcagcggcggcggcggcagcgaagtgcagctggtggaaagcggcggcggcctg420
gtgcagccgggcggcagcctgcgcctgagctgcgcggcgagcggctttacctttagcagc480
agctggatgaactgggtgcgccaggcgccgggcaaaggcctggaatgggtgggccgcatt540
tatccgggcgatggcgataccaactataacgtgaaatttaaaggccgctttaccattagc600
cgcgatgatagcaaaaacagcctgtatctgcagatgaacagcctgaaaaccgaagatacc660
gcggtgtattattgcgcgcgcagcggctttattaccaccgtgcgcgattttgattattgg720
ggccagggcaccctggtgaccgtgagcagctaagctt757
<210>4
<211>247
<212>prt
<213>人工序列
<400>4
gluilevalleuthrglnserproasppheglnservalthrprolys
151015
glulysvalthrilethrcysargalasergluservalaspthrphe
202530
glyileserphemetasntrppheglnglnlysproaspglnserpro
354045
lysleuleuilehisglualaserasnglnglyserglyvalproser
505560
argpheserglyserglyserglythraspphethrleuthrileasn
65707580
serleuglualagluaspalaalathrtyrtyrcysglnglnserlys
859095
gluvalprophethrpheglyglyglythrlysvalgluilelysgly
100105110
glyglyglyserglyglyglyglyserglyglyglyglysergluval
115120125
glnleuvalgluserglyglyglyleuvalglnproglyglyserleu
130135140
argleusercysalaalaserglyphethrphesersersertrpmet
145150155160
asntrpvalargglnalaproglylysglyleuglutrpvalglyarg
165170175
iletyrproglyaspglyaspthrasntyrasnvallysphelysgly
180185190
argphethrileserargaspaspserlysasnserleutyrleugln
195200205
metasnserleulysthrgluaspthralavaltyrtyrcysalaarg
210215220
serglypheilethrthrvalargasppheasptyrtrpglyglngly
225230235240
thrleuvalthrvalserser
245
- 还没有人留言评论。精彩留言会获得点赞!