自组装的纳米氧化锌载药胶囊及其制备方法和应用与流程
本发明属纳米材料技术和医药技术领域,具体涉及一种自组装的纳米氧化锌载药胶囊及其制备方法和应用。
背景技术:
癌症已经成为21世纪多发病和常见病,找到癌症的治疗方法是人类近些年来的共同目标。近年来,纳米材料由于其面向固体肿瘤的好的渗透性和在肿瘤处良好的留存性,被赋予了很多关注。尽管以纳米材料为平台的载药系统受到了广泛的关注,但是其实际应用遇到四个方面的阻碍。第一,大多数纳米材料难以生物降解,甚至对于生物体系具有很大的毒性;第二,载药释放系统需要在水中高度分散并且长期保持稳定,而大多数纳米材料会在短期内团聚甚至沉淀;第三,载体越稳定就越难分解,而药物释放率高则要求载体快速完全分解,两者之间的平衡不容易把握;第四,关于药物载体响应的机制,依赖于光照、磁场、超声等条件响应分解的结构十分复杂,需要复杂的合成过程,最终导致药物载体纳米粒子的组成结构不均一,而且很难被生物完全降解。
氧化锌作为一种安全无毒的材料,是美国食品和药物管理局(foodanddrugadministration)认证的安全物质(fda代码21cfr182.8991),已经在化妆品、皮肤药膏、食品包装等领域生产应用。粒径1~5纳米的氧化锌量子点具有丰富的表面缺陷,很容易被水分子破坏,因此通过表面修饰的方法制备水溶性的氧化锌量子点是把它应用到生物医药领域的关键。氧化锌量子点对ph敏感的性质特别适合于细胞内液呈弱酸性的癌细胞,氧化锌量子点在癌细胞内可以很快溶解而在正常细胞内保持稳定,用来负载抗癌药物分子就能够区分癌细胞和正常细胞,实现靶向给药。经过精巧的设计,由氧化锌量子点构建的ph响应药物运载与控制释放系统能够完美的解决上述纳米载药体常见的四个问题。
很多抗癌药物自身的疏水性限制了其应用,异维a酸就是其中之一。异维a酸是传统的抗皮肤癌药物,但是其疏水性阻碍了它的实际应用。以前的研究人员曾经采用脂质体来包裹和运载异维a酸,然而脂质体的特性使其药物负载率和释放率都很低。本发明通过构筑氧化锌纳米载药平台,不仅成功解决水溶性问题,而且异维a酸负载率达到34.6%。此载药体系在生理条件中保持稳定,接触到肿瘤或者炎症组织的酸性环境就会分解,完全释放出包裹的药物。
技术实现要素:
本发明的目的是提供一种由氧化锌纳米粒子自组装形成的载药胶囊及其制备方法和在癌症治疗方面的应用。
本发明提出的自组装的纳米氧化锌载药物胶囊,由氧化锌纳米晶内核、聚合物外壳、药物分子三个部分构成。
本发明提供的纳米氧化锌载药物胶囊的制备方法,具体步骤为:
(1)合成“氧化锌-高分子”复合纳米粒子,将有机锌盐放在乙醇中水解生成氧化锌纳米粒子,锌盐的浓度是0.09m-0.11m。此过程中,利用自由基引发氧化锌纳米粒子表面功能团与溶剂中的高分子单体共聚,在65℃-75℃经过两步聚合反应形成“疏水-亲水”共聚物壳层。其中,第一步是具有不饱和双键的功能团与溶剂中的高分子单体共聚,第二步是共聚的高分子交联到zno纳米粒子表面。然后,通过透析除去杂质和溶剂,获得“氧化锌-高分子”复合纳米粒子;该纳米粒子溶于水溶液、ph7缓冲溶液或细胞培养液中,得到“氧化锌-高分子”复合纳米粒子溶液;能长期保持稳定;
(2)将上述“氧化锌-高分子”复合纳米粒子溶液与疏水药物溶液混合,利用药物分子与纳米粒子之间的相互作用,自组装形成“氧化锌-药物”复合纳米胶囊;经过反复透析和浓缩冻干,最终获得粉末状产物。
其中,氧化锌-高分子”复合纳米粒子和疏水药物的质量比通常为1:(0.1-0.5),
所述疏水药物的溶液,一般为异维a酸的二甲亚砜溶液(异维a酸本身不溶于水,而二甲亚砜可以和水混溶),还可以为地塞米松的二甲亚砜溶液等。
本发明制备得到的“氧化锌-药物”复合纳米胶囊,直径为50~150纳米(根据实验条件可调节),药物负载量超过30%(总质量比),在室温下水溶液中保持稳定超过1年。
本发明制备得到的“氧化锌-药物”复合纳米胶囊,具有高负载率(异维a酸负载率达到34.6%)、水溶性强、结构稳定、对ph值敏感等优点,能够大量负载疏水性药物,同时根据ph响应完全释放药物,可以用于高效杀死癌细胞。
所以本发明的“氧化锌-药物”复合纳米胶囊可以用于制备癌症治疗药物。
本发明提出的“氧化锌-药物”复合纳米胶囊,可以对各种癌细胞进行体外杀伤,其抗癌毒性比疏水的药物本身普遍提高2-3倍。例如,负载了异维a酸后,对肺癌细胞a549的毒性甚至超过了已经市场化的抗肺癌药物尼达尼布和克唑替尼。
所述的“氧化锌-药物”复合纳米胶囊,具有ph响应的功能,将其溶解到不同ph值的缓冲溶液中,可利用氧化锌纳米粒子在弱酸性条件下分解的特征释放药物。当ph值在7.0以上,该纳米粒子非常稳定;当ph值在6.0~7.0范围,氧化锌纳米粒子缓慢分解;当ph在5.0~6.0范围,氧化锌纳米粒子在24小时内就能完全分解释放药物,药物释放率超过95%。由于癌细胞中,ph值通常在6.0以下,而正常细胞的ph值在7.4左右,因此这种“氧化锌-药物”复合纳米胶囊能够选择性杀死癌细胞。
本发明的原理是,先通过溶胶凝胶法和两步共聚反应在氧化锌纳米粒子表面包覆共聚高分子,该高分子由疏水基团和亲水链段构建,具有表面活性剂的特征。这种设计一方面保护了氧化锌内核不被水溶液破坏,同时具有良好的水溶性;另一方面“氧化锌-高分子”纳米粒子能够包覆到疏水的药物分子聚集体上,形成自组装的胶囊型纳米球载药平台。该载药平台在ph7以上结构长期保持稳定,但是在ph6以下氧化锌完全分解同时导致整个胶囊分解释放药物,实现了在肿瘤弱酸性环境下靶向给药的目标。虽然氧化锌和高分子本身几乎无毒,但是癌细胞毒性测试证明用该载药平台释放药物的毒性显著超过药物本身,甚至超过某些市场化的同类抗癌药物。
附图说明
图1是实施例5产品的高分辨透射电子显微镜照片。其中,a为“氧化锌-高分子”纳米粒子的透射电镜照片,b为“氧化锌-高分子”纳米粒子的高分辨透射电镜照片,c为负载了异维a酸的纳米胶囊的透射电镜照片,d为负载了异维a酸的纳米胶囊的场发射扫描电镜照片,其中插图是其高分辨照片。从a和b图可以看出实施例5的产品其氧化锌纳米粒子的直径为3纳米,晶格间距为0.25nm;从c和d图可以看出合成的纳米胶囊为100nm,为氧化锌包裹的异维a酸的核壳结构。
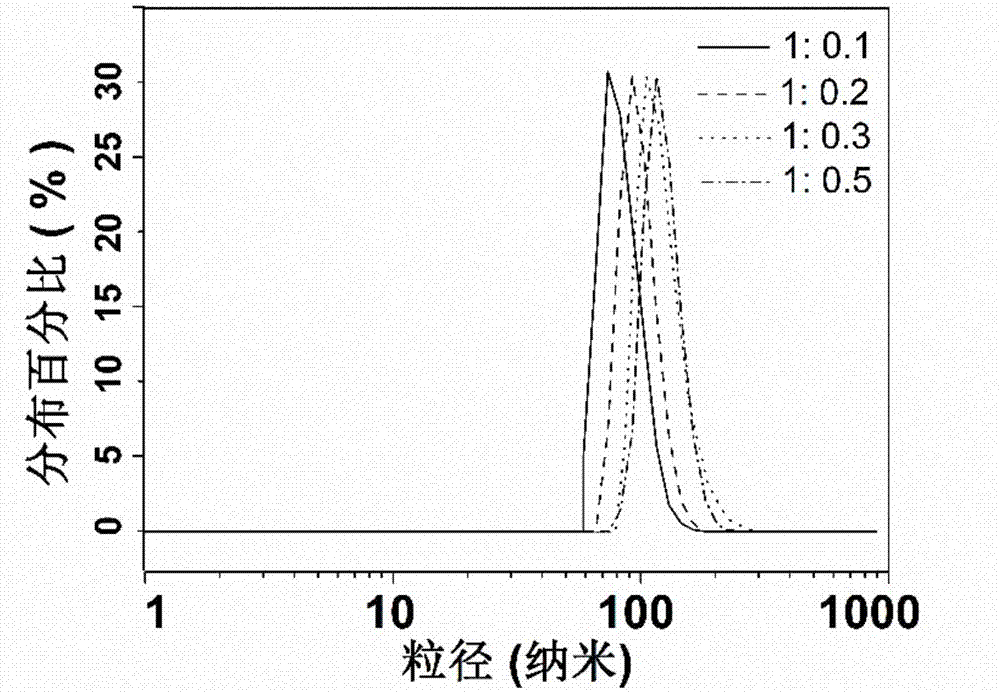
图2是氧化锌与异维a酸在合成过程中的配比从1:0.1变化到1:0.5时,所得到的纳米胶囊平均直径从70纳米变化到110纳米。随着氧化锌与异维a酸质量比的增加,合成的微乳球的直径也逐步增加。
图3是氧化锌药物复合物载体平台对于癌细胞的治疗效果的比较。图中abcd为氧化锌、异维a酸和氧化锌-异维a酸复合纳米载体分别对于前列腺癌细胞du145、宫颈癌细胞hela、乳腺癌细胞mcf-7和肺癌细胞a549四种癌细胞的mtt细胞毒性测试对比图。可以看出复合后的氧化锌异维a酸复合物的毒性远大于氧化锌和异维a酸单体,证明了复合物的毒性增强。其中对于肺癌细胞a549,其毒性的提升最明显,所以我们将之与已经上市的抗肺癌药物尼达尼布和克唑替尼进行了对比试验,实验结果显示,纯的异维a酸比起上市药物并不优越,但是对于复合物,发现其对于a549的杀死作用远大于克唑替尼和尼达尼布,改良的药物载体平台大大增强了异维a酸的抗癌效果。
图4为“氧化锌-高分子”纳米粒子在水中自组装形成纳米胶囊,负载药物后在癌细胞弱酸性条件下分解释放药物的过程。
图5是将氧化锌异维a酸药物载体系统于不同癌细胞分别作用12小时,24小时和48小时之后得到的细胞存活率对比图。从结果来看,作用时间超过24小时后,数据几乎无改变,表明24小时是药物作用于癌细胞的最佳时间。
具体实施方式
实施例1
(1)氧化锌量子点的合成
称取0.47克的甲基丙烯酸锌粉末置于三口烧瓶中,加入25毫升的无水乙醇,加热至72℃至其完全溶解。待其冷却至室温后,加入0.06克的偶氮异丁腈(aibn)和3.75毫升的聚乙二醇单甲醚甲基丙烯酸酯(pegmema),在磁力搅拌的作用下加热至72℃;10min后,加入25毫升的氢氧化锂溶液(0.14摩尔/升)和0.06克的偶氮异丁腈(aibn)。于72℃下磁力搅拌1小时。待其冷却至室温后,放入透析袋中,于去离子水中透析3天,得到聚合物修饰的氧化锌纳米材料;
(2)氧化锌-异维a酸纳米粒子的合成
取20毫升的氧化锌(1毫克/毫升)纳米粒子的水溶液,加入0.025克的异维a酸溶于25毫升的二甲亚砜溶液2毫升,在黑暗中搅拌,之后用去离子水透析三天除去未反应的药物和二甲亚砜溶液;
(3)将复合药物中药物浓度配制为为10微克/毫升,作用于肺癌细胞a54924h,之后测细胞存活率。主要是应用酶标仪来检测细胞的存活率。通过酶标仪的检测可以得出细胞的生存状态。主要的原理是酶联免疫吸附剂测定原理,抗原或抗体结合到一些固相载体表面,同时保持其免疫活性,此时抗原或抗体与特定的酶连接成酶标抗原或抗体,能保留载体的免疫活性,也能保留酶的活性。洗涤把固相载体上的抗原抗体复合物和其他物质分开,载体上的酶含量和标本中受检物质含量形成特定的比例。将酶反应的底物加入后,底物被酶催化成有色的产物,产物的含量和标本中受检物质的含量相关,因此可根据颜色的深浅进行定性或者定量分析。鉴于酶的催化频率高,极大地放大了反应结果,使测定方法达到很高的敏感度。存活率=(测定样品吸光度-空白样品吸光度)/(对照细胞吸光度-空白细胞吸光度)。
实施例2
制备方法和实施例1相同,但是步骤(2)中使用的异维a酸(1毫克/毫升)为4毫升,其他条件不变。研究不同的投料比对于纳米药物系统负载率的影响,以及mtt测试得到的细胞存活率。
实施例3
制备方法和实施例1相同,但是步骤(2)中使用的异维a酸(1毫克/毫升)为6毫升,其他条件不变。研究不同的投料比对于纳米药物系统负载率的影响,以及mtt测试得到的细胞存活率。
实施例4
制备方法和实施例1相同,但是步骤(2)中使用的异维a酸(1毫克/毫升)为10毫升,其他条件不变。研究不同的投料比对于纳米药物系统负载率的影响,以及mtt测试得到的细胞存活率。
实施例5
制备方法和实施例1相同,但是步骤(3)中使用的细胞换成前列腺癌细胞du145其他条件不变。研究纳米药物载体对于不同的癌细胞的作用,以及mtt测试得到的细胞存活率。
实施例6
制备方法和实施例1相同,但是步骤(3)中使用的细胞换为宫颈癌细胞hela其他条件不变。研究纳米药物载体对于不同的癌细胞的作用,以及mtt测试得到的细胞存活率。
实施例7
制备方法和实施例1相同,但是步骤(3)中使用的细胞换为乳腺癌细胞mcf-7,其他条件不变。研究纳米药物载体对于不同的癌细胞的作用,以及mtt测试得到的细胞存活率。
实施例8
制备方法和实施例1相同,但是步骤(3)中使用的细胞换为乳人结直肠腺上皮细胞dld-1,其他条件不变。研究纳米药物载体对于不同的癌细胞的作用,以及mtt测试得到的细胞存活率。
实施例9
制备方法和实施例1相同,但是步骤(3)中使用的细胞换为肝癌细胞hepg-2,其他条件不变。研究纳米药物载体对于不同的癌细胞的作用,以及mtt测试得到的细胞存活率。
实施例10
制备方法和实施例1相同,但是步骤(1)中使用的异维a酸换为维a酸,其他条件不变。研究不同疏水性药物的负载性质,以及mtt测试得到的细胞存活率。
实施例11
制备方法和实施例5相同,但是步骤(2)中将异维a酸替换成视黄醇,其他条件不变。研究不同疏水性药物的负载性质,以及mtt测试得到的细胞存活率。
实施例12
制备方法和实施例5相同,但是步骤(2)中将异维a酸替换成阿利维a酸,其他条件不变。研究不同疏水性药物的负载性质,以及mtt测试得到的细胞存活率。
本发明将不同的疏水性药物异维a酸、维甲酸、视黄醇、阿利维a酸与氧化锌纳米材料的复合,并对于异维a酸的不同比例进行探索,“氧化锌-高分子”纳米粒子与异维a酸的质量比为1:0.5左右时为最佳,并将之应用于肺癌细胞a549、前列腺癌细胞du145、宫颈癌细胞hela、乳腺癌细胞mcf-7的癌细胞、人结直肠腺上皮细胞dld-1、肝癌细胞hepg2的检测之中。见下表3所示。
表3
- 还没有人留言评论。精彩留言会获得点赞!