CD44‑shRNA/PEG‑MZF‑NPs/DDP纳米脂质体及其制备方法与流程
本发明属于医学及基因工程技术领域,具体涉及一种cd44-shrna/peg-mzf-nps/ddp纳米脂质体及其制备方法和应用。
背景技术:
卵巢癌是女性生殖系统中最常见的肿瘤之一,恶性程度很高,死亡率占妇科肿瘤的首位。由于卵巢癌在早期症状往往不明显,不易早期发现,超过70%的患者就诊时已为中晚期,5年生存率仅为25%。目前对卵巢癌的早期诊断尚缺乏特异有效的方法或手段。卵巢癌的治疗目前主要以手术治疗后辅以化疗,但是常规化疗副作用较大,且手术后复发率和转移率较高。因此,探索卵巢癌新型高效的早期诊断手段和治疗方法意义重大。将多种手段有机结合对卵巢癌进行联合靶向诊疗已成为重要的研究方向。基因治疗已成为继肿瘤传统手术、放疗、化疗后又一种新的治疗手段,在肿瘤治疗领域显示了较好的应用前景。肿瘤热疗是通过热能杀死肿瘤细胞,不仅可以独立应用,还可以增强放化疗的敏感性。随着纳米技术的发展,将纳米技术应用于肿瘤的治疗也日益受到关注。若能以磁性纳米材料为载体,将基因治疗、化疗、热疗有机结合,互补协同,有可能形成一种新的肿瘤联合治疗方法。
粘附分子cd44是细胞膜表面的一种跨膜糖蛋白,作为一种重要的透明质酸受体(ha),与细胞粘附、增殖、分化和迁移有关。cd44的异常表达在肿瘤的发生、发展、转移以及预后的评估中扮演着重要角色,尤其是卵巢癌组织,cd44表达率高达96.92%。研究表明:cd44表达高的卵巢癌患者,其临床表现较重,且tnm分期亦较高,高水平的cd44表达与卵巢癌患者的预后不良有关,cd44可作为卵巢癌患者病理诊断和预后预测的有效指标。因此,cd44有可能成为治疗卵巢癌的新靶点。
基因治疗是将外源性基因或者基因片段转运至靶细胞中,对靶基因进行干预的治疗方法。目前基因治疗方法被相继运用于多种肿瘤治疗研究中,其中rnai(rnainterferencerna干扰)技术在肿瘤治疗领域显示了较好的应用前景,该技术是利用双链rna在细胞内dicer内切酶的识别、结合、酶切下产生有活性的长度为21-23bp的小干扰rna(sirna)高效特异性地降解细胞内同源mrna,阻断目标基因,从而产生基因沉默效应,抑制目标基因活性。采用rnai进行卵巢癌靶向治疗,获得了较好的治疗效果。
高效、稳定地进行基因转移是进行基因治疗的关键。伴随着纳米技术的发展,以纳米颗粒为基因转移载体得到广泛研究。纳米颗粒较易被修饰,具有良好的生物相容性和较少的免疫应答,很容易进入组织与细胞表面特异性受体结合,或者被靶细胞吞噬进入细胞内,实现基因的转运,并在细胞内释放,具有较高的基因转移效率。因此,纳米载体成为极具应用前景的新型载体系统。
磁性纳米颗粒作为纳米材料的一种,除了具有一般纳米载体的功能外,由于其具有特殊的磁学性质,在外加磁场的作用下产生和周围组织不同的磁场敏感性,使t1和t2磁共振成像的弛豫时间发生变化,可被应用于磁共振成像。磁性纳米颗粒在交变磁场的作用下能够产生热效应,热能不仅能增加化疗药物的功能,还可以对肿瘤细胞进行靶向热疗。其中金属氧化物颗粒fe3o4是应用较多的磁性纳米粒子。在纳米氧化铁结构中加入锰、锌等金属元素可以制备成各种铁氧体,其中mn0.6zn0.4fe2o4不仅具有载体、热疗的功能,还具有自动控温和恒温的特征。
化疗是临床上最常用的肿瘤治疗手段,但是绝大多数的化疗药物都会产生严重的毒副作用,而且化疗主要对增殖期细胞有效,单一化疗很难将肿瘤彻底治愈。顺铂(ddp)已成为临床最常用的化疗药物之一,可抑制癌细胞的dna复制,并损伤其细胞膜上结构,有较强的广谱抗癌作用,尤其是在卵巢癌的治疗中显示了较好的疗效。但目前临床上所用的顺铂是静脉注射,静脉给药后,由于血浆ddp浓度很快升高并迅速弥散至周围组织,可使病人出现食欲减退、恶心、呕吐、腹泻等消化道症状和骨髓抑制、肾脏毒性、神经毒性、过敏反应等毒副作用。因此,改变化疗药物的给药方式及剂型具有重要的临床意义。对肿瘤进行靶向给药,不仅能有效杀死肿瘤细胞,而且能大大降低化疗药物的用药量,减轻其毒副作用。
基于卵巢癌cd44基因高表达的特性,以及磁性纳米粒靶向基因治疗、单纯磁流体热疗、顺铂化疗在肿瘤治疗研究方面都显示了良好的效果,前景广泛,但作用仍显单一,在肿瘤联合治疗原则的指导下,本研究设想:以mn0.6zn0.4fe2o4纳米粒作为基因和药物载体,利用其优良的磁响应性和有效升温控温的效果,将cd44-shrna基因治疗、ddp化疗、磁流体热疗有机结合,优势互补,有可能形成一种联合靶向诊疗卵巢癌的新方法。
技术实现要素:
为了解决现有基因治疗、化疗中存在的问题,本发明提供一种以peg修饰的mn0.6zn0.4fe2o4纳米粒(peg-mzf-nps)为载体的携载cd44-shrna抗肿瘤基因和ddp化疗药物的纳米脂质体及其制备方法,该纳米脂质体在外加磁场作用下,可以将cd44-shrna基因治疗、ddp化疗与磁流体热疗有机结合,优势互补,对肿瘤进行靶向治疗,有效解决了现有技术的问题。
本发明还公开了所述cd44-shrna/peg-mzf-nps/ddp纳米脂质体的制备方法,包括以下步骤:
采用薄膜-超声法加高速搅拌制备cd44-shrna/peg-mzf-nps/ddp纳米脂质体:①制备peg-mzf-nps/ddp复合物:取一定量的peg-mzf-nps磁流体与适量的ddp溶液混合,加入蒸馏水,超声分散15min,使其充分反应,过滤,滤液即为peg-mzf-nps/ddp复合物,将其置于4℃冰箱中避光保存备用;②取明胶和pbs缓冲液60℃水浴待明胶溶解后加入cd44-shrna质粒,混匀;③将①液和②液混合,常温、2000r/min搅拌,直至瓶壁薄膜完全脱落水合。超声、离心,弃上清及瓶底未包封的纳米材料,取中层褐性水性悬液即为cd44-shrna/peg-mzf-nps/ddp纳米脂质体。
进一步地,步骤①中peg-mzf-nps与ddp质量比为40:1-80:1,加蒸馏水后peg-mzf-nps终浓度为60μg/ml;步骤②中按peg-mzf-nps和cd44-shrna质量比为40:1加入cd44-shrna。
本发明中为探讨能否用peg-mzf-nps为载体,将cd44-shrna转染至肿瘤细胞,检测了peg-mzf-nps与cd44-shrna结合的生物学特性。琼脂糖凝胶电泳图谱显示:当纳米磁粒(peg-mzf-nps)与cd44-shrna质粒的质量比为40:1时,peg-mzf-nps可以结合体系中的所有质粒,该比例为最佳结合比,为后面的基因转染时载体与质粒量的配比提供了依据。
细胞外的核酸酶和细胞内溶酶能够降解外源性dna。安全、高效、可控的基因转移方法是进行基因治疗的关键。本实验采用dnase-i消化实验来观察磁性纳米基因复合体的稳定性。结果显示:时间在1-60min内的peg-mzf-nps与cd44-shrna质粒复合物,其电泳图谱中的条带亮度没有明显改变,保持稳定,裸露的cd44-shrna质粒加入dnase-i消化后,约1min后几乎完全消化,表明复合物稳定性较好,peg-mzf-nps可以保护cd44-shrna免受核酸酶的消化。
基因治疗中,基因转移载体的选择至关重要,作为基因载体,不仅要具有较好的组织相容性,在运输过程中能够保护基因片段不被降解,到达靶细胞后还能够有效地释放。在本次纳米磁粒(peg-mzf-nps)与cd44-shrna质粒复合物的体外释放实验中显示,在1h、4h、8h、12h、24h、2d内,dna释放量增多,第3、第4天无明显区别,表明peg-mzf-nps不仅能够保护质粒免于降解,在适当的条件下还能有效地释放dna。
以peg-mzf-nps为载体将cd44-shrna质粒转染至卵巢癌细胞后,cd44基因表达明显下降,其转染效率为55.46±4.50%,提示peg-mzf-nps可以作为基因转移载体应用于基因治疗。
本次实验用不同方法对卵巢癌ho8910细胞进行干预,实验分为七组,分别为:阴性对照组;ddp组;ddp/cd44-shrna组;mfh组;cd44-shrna/mfh组;ddp/mfh组;ddp/cd44-shrna/mfh组,分别计算各组细胞增殖抑制率和细胞凋亡率。结果显示ddp/cd44-shrna/mfh组的细胞增殖抑制率和凋亡率均明显高于其余各组。磁热疗、ddp化疗、cd44-shrna基因治疗三者联合能够有效地抑制细胞增殖,并诱导其调亡,效果明显优于任何单一治疗。westernblot方法检测显示peg-mzf-nps/ddp/cd44-shrna/mfh组中的survivin、vegf、bcl-2蛋白的表达水平明显下降,提示其治疗机理可能与抑制细胞增殖、诱导细胞凋亡、抑制血管增生或直接导致细胞死亡等有关。
本次peg-mzf-nps(mn0.6zn0.4fe2o4)磁性纳米材料体外磁感应升温实验中,在外加235khz、4kw、35a的高频交变磁场条件下,不同浓度的peg-mzf-nps均能迅速升温,0~20min升温急剧,20min后升温平缓,并保持一定的恒温,说明该材料有良好的升温恒温能力。其中浓度为60μg/ml的peg-mzf-nps在20min内达到42℃~43℃,并保持稳定,该温度为肿瘤热疗的理想温度。
本发明采用的peg-mzf-nps,具有良好的分散性、磁响应性和生物相容性;成功制备了peg-mzf-nps/ddp复合物,该复合物和peg-mzf-nps同样具有良好的磁热效应,可用于肿瘤的热化疗研究;体外磁共振扫描显示其具有作为磁共振t2弛豫造影剂的应用潜能,有可能实现靶向诊断与治疗一体化的目标。
2、peg-mzf-nps与cd44-shrna结合,具有良好的生物学特性,peg-mzf-nps可以保护dna免受核酸酶的消化,并能在恰当的条件下有效地释放dna。细胞转染实验证实,peg-mzf-nps将cd44-shrna成功转染至卵巢癌细胞,并有效地抑制了cd44基因的表达,显示了peg-mzf-nps可作为基因转移载体的可行性。
3、在外加交变磁场作用下,peg-mzf-nps/shrna/ddp纳米脂质体对卵巢癌细胞有较好的增殖抑制和凋亡诱导作用,效果明显优于任何单一的治疗,其机制可能是通过下调cd44、survivin、vegf、bcl-2蛋白表达,从而抑制细胞增殖、诱导细胞凋亡、抑制血管增生或直接导致细胞死亡。
附图说明
图1为peg-mzf-nps/ddp复合物的透射电镜图(tem)。
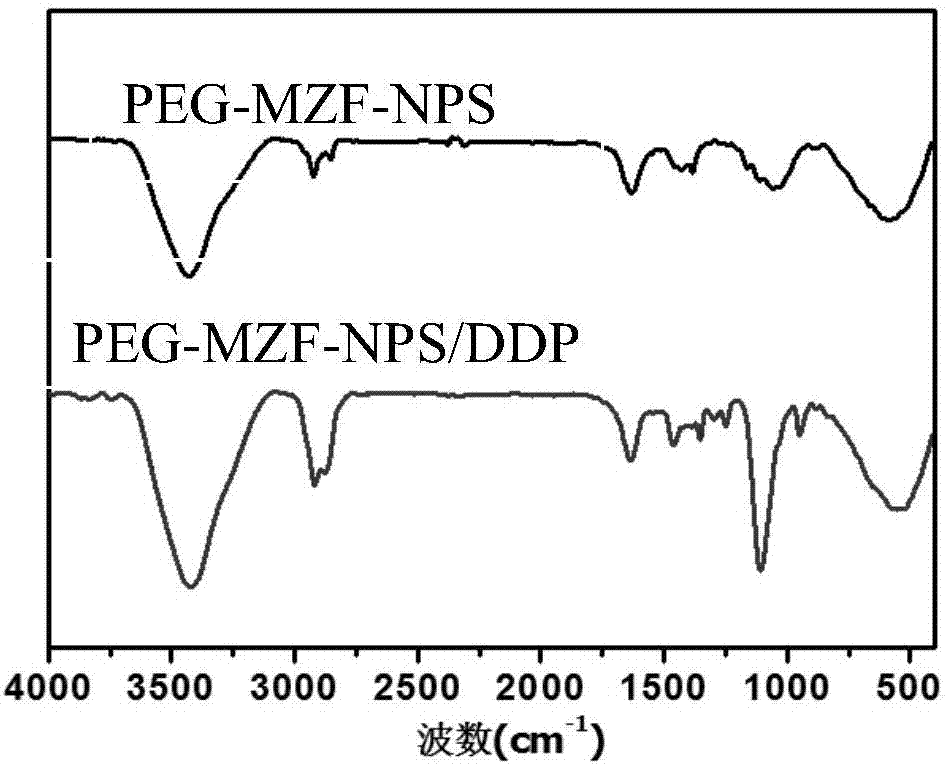
图2为peg-mzf-nps和peg-mzf-nps/ddp复合物的红外光谱图。
图3为peg-mzf-nps在交变磁场中升温曲线图。
图4为peg-mzf-nps/ddp复合物在交变磁场中升温曲线图。
图5peg-mzf-nps的体外mri成像。
图6不同浓度的peg-mzf-nps的t2横向弛豫时间r2。
图7peg-mzf-nps/ddp复合物的体外mri成像。
图8为不同质量比的peg-mzf-nps与cd44-shrna质粒结合后的电泳图谱;
泳道1:0:1(即100ng质粒dna,未加peg-mzf-nps);泳道2:5:1;泳道3:10:1;泳道4:20:1;泳道5:40:1;泳道6:80:1;marker:(takara,dl5000,从上至下标准带依次为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp)。
图9为peg-mzf-nps与cd44-shrna质粒复合物的消化保护实验电泳图谱
泳道1:100ng原始质粒dnalane;泳道2:1小时;泳道3:4小时;泳道4:8小时;泳道5:12小时;泳道6:24小时;泳道7:48小时;泳道8:72小时;泳道8:96小时mark:dnamarker(takara,dl5000,从上至下标准带依次为5000bp、3000bp、2000bp、1500bp、1000bp、750bp、500bp、250bp、100bp)。
图10为peg-mzf-nps磁性纳米材料与cd44-shrna质粒复合物的释放实验电泳图谱
lane1:100ng原始质粒dna、lane2:复合物1分钟、lane3:复合物10分钟、lane4:
复合物30分钟、lane5:复合物45分钟、lane6:复合物1小时。
图11卵巢癌ho8910细胞转染cd44-shrna质粒后cd44基因mrna的表达情况。
图12卵巢癌ho8910细胞转染cd44-shrna质粒后cd44蛋白的表达情况
图13cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热处理后卵巢癌ho8910细胞中survivin、vegf、bcl-2蛋白表达情况。
具体实施方式
为了理好地理解本发明,下面结合附图、具体材料对本发明进一步说明,不应理解为对本发明的具体限定。本发明中所采用的材料如下:
实施例:
1.peg-mzf-nps/ddp复合物的制备及表征
1.1peg-mzf-nps/ddp复合物的制备
取一定量的peg-mzf-nps磁流体与适量的ddp溶液混合(peg-mzf-nps与ddp质量比40:1-80:1),加入蒸馏水(peg-mzf-nps终浓度为60μg/ml),超声分散15min,使其充分反应,过滤,滤液即为peg-mzf-nps/ddp复合物,将其置于4℃冰箱中避光保存备用。
1.2peg-mzf-nps/ddp复合物的稳定性检测
peg-mzf-nps/ddp复合物放在4℃冰箱储存,一周后管底可见少量褐色沉淀物,经超声分散1min后即可重悬,说明该复合物具有较好的悬浮稳定性。
1.3peg-mzf-nps/ddp复合物透射电镜观察
取少量peg-mzf-nps/ddp复合物,加无水乙醇超声分散15分钟,滴有膜铜网,自然晾干后,在透射电镜(tem)下观察其形貌。电镜图见图1,制备的peg-mzf-nps/ddp复合物平均粒径为10nm左右,大小较一致。
1.4peg-mzf-nps/ddp复合物的傅立叶红外光谱(ftir)分析
用傅立叶红外光谱(ftir)分析peg-mzf-nps和peg-mzf-nps/ddp特征峰的变化。红外光谱图见图2,在peg-mzf-nps/ddp复合物的红外光谱中,在530cm-1附近出现了一个新峰,为顺铂的pt-n特征吸收峰,表明peg-mzf-nps已将ddp成功地包裹。
1.5peg-mzf-nps和peg-mzf-nps/ddp复合物在交变磁场中的升温实验
配制浓度为20μg/ml、40μg/ml、60μg/ml、80μg/ml的peg-mzf-nps磁流体,分别取500μl置于平底试管中,将温度计直接插入试管中(避免接触到试管壁),启动交变磁场,参数设置为235khz、4kw、35a,磁感应线圈直径为3cm,试管底部距磁感应线圈约0.5cm,每隔5min记录一次温度,以时间为横坐标,温度为纵坐标,绘制peg-mzf-nps磁性纳米材料的升温曲线。
取peg-mzf-nps/ddp复合物1ml加入平底试管中,交变磁场参数设置为:235khz、4kw,输出电流分别为15a、25a、35a、45a下进行升温实验,检测方法同peg-mzf-nps升温实验,以时间为横坐标,温度为纵坐标绘制该复合物升温曲线。
peg-mzf-nps和peg-mzf-nps/ddp复合物在交变磁场中的升温特性见图3、图4,二者均能升温至43℃左右,并保持稳定,可用于肿瘤的热疗。
1.6peg-mzf-nps和peg-mzf-nps/ddp复合物的体外磁共振成像(mri)研究
将浓度为0.04μg/ml、0.08μg/ml、0.16μg/ml、0.32μg/ml、0.64μg/ml、1.28μg/ml的peg-mzf-nps置于含1%琼脂糖的ependoff管中,对照组为加入去离子水的琼脂糖。另取peg-mzf-nps/ddp复合物100μl置于ependoff管中。采用7.0tmicro-mr扫描仪,内径3.0cm的体线圈,set2w1序列,参数设置如下:重复时间tr2500ms,回波时间te36ms,层厚1.0mm,fov4cmx3.5cm,矩阵256×256。读取各样本相应的t2值,之后在origin下作r2曲线(r2=1/t2),由此得出各浓度样品的r2弛豫率。
从磁共振成像(图5)上可以观察到,随着peg-mzf-nps浓度增加,其t2w1信号明显降低,测量出各浓度材料的t2值,由此得出peg-mzf-nps材料的弛豫率r2=6.06(μg/ml-1s-1),见图6,提示peg-mzf-nps具有作为磁共振t2弛豫造影剂的应用潜能。图7为peg-mzf-nps/ddp复合物的加权图像,其信号明显低于对照组,表明peg-mzf-nps与ddp结合后同样可以作为造影剂使用。
1.7peg-mzf-nps与cd44-shrna质粒结合实验
将peg-mzf-nps与cd44-shrna质粒按照质量比0:1、5:1、10:1、20:1、40:1、80:1进行混合(质粒dna的终浓度为20ng/μl,用超纯水补足总体积20μl),室温放置30分钟,以充分反应形成复合物。分别取5μl复合物进行琼脂糖凝胶电泳(即100ng/泳道),查看结合情况,并筛选出纳米磁粒与质粒dna的最佳结合比例。
纳米磁粒(peg-mzf-nps)与cd44-shrna质粒结合实验的琼脂糖凝胶电泳图谱显示,按0:1、5:1、10:1、20:1、40:1加入质粒,泳道可见清晰的条带;从电泳图可见,当纳米磁粒与cd44-shrna的质量比为40:1时,基本可以结合体系中所有的质粒,提示质量比40:1为peg-mzf-nps与cd44-shrna结合最佳比例,见图8。
1.8peg-mzf-nps对cd44-shrna质粒的dnase-i消化保护实验
将peg-mzf-nps与质粒cd44-shrna按照质量比40:1混合形成复合物,加入tangobuffer(thermo)及dnase-i酶,37℃水浴,分别消化1分钟、10分钟、30分钟、45分钟、1小时,迅速用等体积的100mmol/l的edta溶液终止反应。用sds将复合物中的质粒洗脱下来,苯酚、氯仿抽提、无水乙醇沉淀、75%的乙醇洗涤干燥后,溶于适量的超纯水中,取等体积的产物进行琼脂糖凝胶电泳检测。裸露的质粒dna同样方法处理,作为对照。
经dnase-i酶消化1-60min的peg-mzf-nps与cd44-shrna复合物,其电泳图谱中的条带亮度没有明显改变,保持稳定;裸露的cd44-shrna质粒加入dnase-i酶消化后,约1min后几乎完全消化,泳道上已经看不到条带,提示peg-mzf-nps可以有效保护该质粒免受dnase-i酶的消化,见图9。
1.9peg-mzf-nps/cd44-shrna的dna释放实验
将磁性纳米材料peg-mzf-nps与cd44-shrna质粒按照质量比40:1混合形成复合物,质粒的量(10μg)用te溶液混至500ul,至37℃恒温摇床200rpm振荡。分别于1小时、4小时、8小时、12小时、24小时、48小时、72小时、96小时取样8μl,最终各5μl/孔进行琼脂糖凝胶电泳。
结果显示,在1h、4h、8h、12h、24h、2d内,dna释放量增多,第3天、第4天无明显区别,peg-mzf-nps能够保护质粒免于降解,在适当的条件下合理的释放dna,见图10。
2.0cd44-shrna质粒经peg-mzf-nps转染卵巢癌ho8910细胞后cd44基因表达的检测
2.0.1peg-mzf-nps转染法将cd44-shrna-egfp质粒转染至ho8910细胞。
peg-mzf-nps转染:转染前一天,将细胞用含10%fbs无抗生素的培养液,按照1-4×105/孔密度接种于孔板中,以保证转染时细胞密度达80%左右;转染时,将同样量的表达质粒(cd44-shrna-egfp)和空载psilencer3.1-h1neo质粒稀释于100μl无抗生素无血清的培养液中;将peg-mzf-nps稀释于100μl无抗生素无血清的培养液中,室温静置20min;将稀释后的dna和peg-mzf-nps混合(peg-mzf-nps和dna质量比为40:1),室温静置30min,使之形成复合物。其间,将待转染的细胞培养液换成新鲜的含10%fbs无抗生素培养液,400μl/孔;每孔加入dna和peg-mzf-nps复合物200μl;充分混匀后,置于细胞培养箱中继续培养6h之后,弃上清,用pbs洗细胞1次,加入新鲜含10%fbs的培养液继续培养。
流式细胞仪检测peg-mzf-nps转染法将cd44-shrna-egfp质粒转染至细胞的转染效率为(55.46±4.50)%,证实了peg-mzf-nps作为基因转移载体的可行性。
2.0.2cd44-shrna干预ho8910细胞后cd44基因表达检测
卵巢癌ho8910细胞中经peg-mzf-nps转染空载质粒和cd44-shrna质粒24h后,real-timepcr方法检测显示转染cd44-shrna质粒后,能有效抑制ho8910细胞中cd44的mrna的表达水平(图11)。westernblot方法检测显示cd44-shrna干预治疗后,ho8910细胞中cd44的蛋白表达水平显著降低(图12),进一步证实了peg-mzf-nps能将cd44-shrna转移到卵巢癌细胞,并抑制cd44基因的表达。
2.1peg-mzf-nps/ddp/cd44-shrna纳米脂质体的制备
采用薄膜-超声法加高速搅拌制备cd44-shrna/peg-mzf-nps/ddp纳米脂质体:取一定量的peg-mzf-nps磁流体与适量的ddp溶液混合(peg-mzf-nps与ddp质量比40:1-80:1),加入蒸馏水(peg-mzf-nps终浓度为60μg/ml),超声分散15min,使其充分反应,过滤,滤液即为peg-mzf-nps/ddp复合物,将其置于4℃冰箱中避光保存备用;②取明胶和pbs缓冲液60℃水浴待明胶溶解后加入cd44-shrna质粒(按peg-mzf-nps和cd44-shrna质量比为40:1加入cd44-shrna),混匀;③将①液和②液混合,常温、2000r/min搅拌,直至瓶壁薄膜完全脱落水合。超声、离心,弃上清及瓶底未包封的纳米材料,取中层褐性水性悬液即为cd44-shrna/peg-mzf-nps/ddp纳米脂质体。
2.2cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热对ho8910细胞的增殖抑制和凋亡诱导作用
将ho8910细胞接种于含10%胎牛血清的imem培养液中,置于37℃、饱和湿度、5%co2的培养箱中培养,每2~3天传代一次,取对数生长期细胞实验。实验分组:a组为阴性对照组;b组为ddp组;c组为ddp/cd44-shrna组;d组为mfh组;e组为cd44-shrna/mfh组;f组为ddp/mfh组;g组为cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热组(ddp/cd44-shrna/mfh组)。b、c组分别加入ddp,c组细胞转染cd44-shrna质粒,转染方法同前;d组加入peg-mzf-nps磁流体;e组加入peg-mzf-nps/cd44-shrna(质量比40:1)复合物;f组加入peg-mzf-nps/ddp复合物;g组加入peg-mzf-nps/ddp/cd44-shrna纳米脂质体;mfh组(d、e、f、g组)细胞放入spg-10a-ii高频磁感应加热仪平板线圈上加热1h,非mfh组(a、b、c组)室温放置1h,然后将各组细胞在培养箱中继续培养48h,mtt方法检测各组细胞增殖的抑制率,细胞增殖抑制率=(1-实验组od值/对照组od值)×100。流式细胞仪分析细胞凋亡情况。
结果显示,cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热组细胞增殖抑制率和凋亡率均明显高于其他各组(见表1和表2),显示了cd44-shrna、ddp、磁热三者联合治疗的明显优势。
表1cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热对卵巢癌细胞ho8910增殖抑制作用
ap<0.001与阴性对照组对比;bp<0.001与ddp组对比;cp<0.001与cd44-shrna组对比;dp<0.001与peg-mzf-nps/mfh组对比;ep<0.001与cd44-shrna/mfh组对比;fp<0.001与ddp/mfh组对比;gp<0.001与ddp/cd44shrna/mfh组对比,hp<0.05与ddp/mfh组对比;ip<0.05与ddp/cd44shrna/mfh组对比
表2cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热对卵巢癌细胞ho8910的凋亡诱导作用
2.3cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热卵巢癌ho8910细胞后相关蛋白表达的检测
实验分组:a组为阴性对照组(对照组);b组为cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热组(ddp/cd44-shrna/mfh组)。a组加入生理盐水,置培养箱中常规培养48h;b组加入peg-mzf-nps/ddp/cd44-shrna纳米脂质体,于spg-10a-ii高频磁感应加热仪平板线圈上加热1h,置培养箱中常规培养48h。westernblot方法检测两组细胞中survivin、vegf、bcl-2蛋白的表达水平。图13为cd44-shrna/peg-mzf-nps/ddp纳米脂质体磁感应加热处理后ho8910细胞中survivin、vegf、bcl-2蛋白的检测结果,gadph为内参,与阴性对照组比较,ddp/cd44-shrna/mfh组的蛋白表达水平明显下降。
- 还没有人留言评论。精彩留言会获得点赞!